食品掺假是指在未注明标签的情况下,添加或减少某些改变食品成分、影响营养价值甚至不被社会接受的物质[1]。目前,肉制品是提供人体氨基酸和蛋白质等必需营养物质的重要来源之一,随着国内外生活水平的不断提升,其消耗量逐年递增,一些制造商为追逐更高利润,用廉价肉代替或掺入优质肉类但并未注明标签进行销售,如在牛肉产品中掺加马肉和猪肉[2]、羊肉产品中掺加鼠肉[3]等。故肉类掺假不仅使消费者利益受损,且威胁健康,特别是鼠肉,因鼠类对生存环境要求较低,常携带大量病毒,且可能食用毒鼠药物中毒[4]。因此,不真实的肉制品标签可能避开检验检疫,使人畜共患的病毒传入人体,造成严重的公共卫生风险[5]。虽然我国的食品安全监管部门对于肉类掺假方面严格筛查,但相应的检测标准仍有待完善[6],尤其是鼠肉这种特殊成分的鉴定。此外,现有的检测方法难以满足肉类快速消费下大批量产品的检测需求。因此,亟需建立快速、有效、准确和高通量的检测技术,以防止掺假肉制品的非法销售。
脱氧核糖核酸(deoxyribonucleic acid,DNA)是大多数生物体的遗传物质,相比于蛋白质具有更高的稳定性和特异性,因此基于DNA的聚合酶链式反应(polymerase chain reaction,PCR)技术在现有的肉类掺假检测方法中应用最为广泛[7],如传统PCR、实时荧光定量PCR(real-time fluorescence quantitative PCR,realtime PCR)和数字PCR(digital PCR,dPCR)等[8-9]。传统PCR技术具有操作简单、成本低廉的优点,但其检测时间长且不能定量分析。虽然real-time PCR和dPCR实现了实时定量或定性检测,但其设备昂贵,对人员专业程度要求较高[10-11]。近年来,随着等温扩增技术的发展,如环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术已被应用于加工肉制品中肉的种类鉴定[12],该技术在恒温条件下可扩增目标DNA,但需4~6 条扩增引物,易出现假阳性,且扩增时间长(1 h以上)[13]。
实时荧光重组酶辅助扩增(real-time recombinaseaided amplification,Rt-RAA)作为近年来新兴的扩增技术,克服了传统PCR等PCR技术检测时间长且需依赖变温仪器的缺点,在恒温条件下即可实时快速扩增目的DNA[14]。此外,相比于LAMP,Rt-RAA仅需1 对引物和1 条中间修饰的探针,避免了因引物二聚体导致的假阳性。因其具有恒温、快速、准确及操作简便的优点,在本研究中基于Rt-RAA检测技术建立同步鉴定大鼠、小鼠源性成分的检测方法,并评估其特异性、灵敏度和稳定性,实现这2 种成分在肉制品中的快速检测,旨在为肉类掺假提供更有效的检测方法。
1 材料与方法
1.1 材料与试剂
大鼠、小鼠活体购自广东省医学实验动物中心。鸭肉、牛肉、马肉、羊肉、猪肉、鸡肉、鹅肉购自当地(重庆)超市,除马肉外其他通过外观确认。马肉与购自京东和淘宝的骆驼肉、马鹿肉、梅花鹿肉、驴肉的真实性通过相关检测标准进行鉴定。
RAA荧光核酸扩增试剂盒 杭州众测生物科技有限公司;通用型核酸提取试剂盒 成都TaKaRa公司。
1.2 仪器与设备
JXFSTPRP-32组织研磨仪 上海净信实业发展有限公司;CFX96 Touch荧光定量PCR仪 美国Bio-Rad公司;Nanodrop ONEc超微量分光光度计 美国Thermo Scientific公司;ME403千分之一电子天平 瑞士Mettler Toledo公司;GR85DA高压灭菌锅 致微(厦门)仪器有限公司。
1.3 方法
1.3.1 样品处理
羊肉、猪肉、牛肉作为日常食用的肉类,并且为红肉,与鼠肉相似,故本研究将此3 种鲜肉充分粉碎混合作为后续实验样本基底肉(以下称基底肉)。将基底肉与大鼠和小鼠肉按照不同的质量比进行混合,以确定混合肉制品中大鼠和小鼠源性成分检出限。
实际的深加工或熟肉制品(如肉串、火腿肠等)中,通常存在多种肉混合的情况。为了模拟检测市售深加工或熟肉制品,将新鲜的羊肉、猪肉、牛肉与大鼠和小鼠肉按照不同的质量比进行混合,并通过高压灭菌锅121 ℃、20 min进行高压蒸熟处理。
1.3.2 样本DNA提取
参考试剂盒使用说明书进行提取,取25~100 mg组织样本置于含钢珠的离心管中,将裂解液加入其中进行充分研磨,随后加入相应的蛋白酶和RNA酶于56 ℃水浴锅中至样品组织完全溶解,后续通过吸附、离心、洗涤和洗脱得到总基因组DNA。采用超微量分光光度计在260 nm和280 nm波长处测定DNA浓度和纯度,将纯度(A260 nm/A280 nm)为1.7~1.9的样本基因组DNA稀释至约150 ng/mL,并于-20 ℃保存,备用。
1.3.3 双重Rt-RAA引物、探针设计与合成
基于小鼠1 6 S r R N A 基因序列(序列号:G U 3 3 2 5 8 9.2)和大鼠细胞色素c 氧化酶亚基I I I(cytochrome c coxidase subunit III,COX3)基因(基因ID:26204),根据Rt-RAA引物和探针设计原则,使用Snap Gene软件设计大鼠、小鼠特异性引物各1 对,从引物区间扩增子序列区域设计RAA探针各1 条(表1)。引物和探针均由北京擎科生物科技有限公司合成。
表1 用于检测大鼠和小鼠源性成分的Rt-RAA引物和探针序列
Table 1 Rt-RAA primers and probe sequences for detection of rats- and mice-derived ingredients

目标物种 引物和探针名称引物和探针序列(5’→3’)大鼠COX3-FATCATCCGTGAAGGAACATACCAAGGCCACC COX3-RTAATTCCTGTTGGGGGTCAGCAACCGCCTA COX3-PTACGGAATAATCCTGTTTATTGTCTCCGAAG-ROX-A-THF-BHQ2-CTTCTTTGCCGGATT小鼠16S rRNA-FTTAACAAAACAGCTTTTAACCATTGTAGGCC 16S rRNA-RTATTGCCTATAGTCTGATTAACTAACAATGG 16S rRNA-PAACTTCCTAAACTTAAAATTGGGTTAATCTA-FAM-A-THF-C-BHQ1-TTATAGATGCAACAC
1.3.4 大鼠和小鼠双重Rt-RAA检测条件
首先对双重Rt-RAA方法的引物和探针浓度、反应温度等检测条件进行测试与优化。通过Rt-RAA核酸扩增试剂(荧光型)说明书运行程序,测试双重Rt-RAA反应体系中不同的引物和探针浓度,最终优化得到最佳反应体系包括400 nmol/L COX3-F、-R引物,200 nmol/L COX3-P探针,200 nmol/L 16S rRNA-F、-R引物,60 nmol/L 16S rRNA-P探针,25 μL水化缓冲液,2.5 mL MgAc缓冲溶液(280 mmol/L),DNA模板各1 μL,用双蒸水补齐至50 μL。在此体系下,设置31~41 ℃的温度梯度进行反应,最终确立39 ℃为最佳反应温度。每组实验设置3 个平行。
双重Rt-RAA检测条件反应程序为:30 s/循环,40 个循环。
1.3.5 双重Rt-RAA特异性实验
按照1.3.4节确立的最终双重Rt-RAA检测条件,对建立的方法进行特异性验证实验,以提取的鸭肉、牛肉、马肉、羊肉、猪肉、鸡肉、鹅肉、骆驼肉、马鹿肉、梅花鹿肉及驴肉DNA为特异性实验验证的非目标扩增序列,以大鼠肉和小鼠肉的DNA为阳性对照,并用双蒸水作为空白对照,以确定所建立方法的特异性。
1.3.6 双重Rt-RAA灵敏度实验
将大鼠肉和小鼠肉分别与基底肉混合,制成大鼠肉和小鼠肉质量分数均分别为20%、10%、5%、2%、1%、0.5%、0.2%、0%的2 组混合模拟样品,按照1.3.2节提取DNA,按照1.3.4节最佳反应条件及反应程序进行恒温扩增,以确定所建立的方法分别对大鼠肉、小鼠肉的检测灵敏度和同步检测大鼠肉、小鼠肉的灵敏度,并与BJS 201904《食品中多种动物源性成分检测实时荧光PCR法》中real-time PCR方法检测灵敏度进行对比。
1.3.7 双重Rt-RAA稳定性实验
以1.3.6节确定的大鼠肉、小鼠肉的检出限进行6 次平行实验,按照1.3.4节最佳反应条件及反应程序进行双重Rt-RAA扩增,以确定该检测方法的稳定性。
1.3.8 模拟市售样品实验
按照1.3.1节方法制备1.3.6节质量比模拟样品,制得同时含有大鼠肉和小鼠肉且各自所占质量分数分别为10%、5%、2%、1%、0.5%、0.2%、0%的7 种混合模拟市售熟肉制品,按照1.3.2节提取DNA,按照1.3.4节最佳反应条件及反应程序进行扩增,以确定该方法对实际样品中大鼠肉、小鼠肉同步检检测的可靠性。
1.3.9 市售样品和模拟样品实验
在烧烤店和烧烤摆位购买25 份样品,按照1.3.1节方法制作模拟样品,大鼠、小鼠肉质量分数均为0.5%。按照1.3.2节提取DNA,利用本研究建立的双重Rt-RAA方法和real-time PCR方法进行鼠源性成分检测,对比分析并评价实验结果。
1.4 数据处理
采用PowerPoint软件作图。采用Excel软件进行数据处理,实验结果以±s表示。
2 结果与分析
2.1 双重Rt-RAA检测条件的建立与优化
本研究主要对引物和探针浓度进行优化,最大限度地提高双重Rt-RAA检测方法扩增效率。如表2所示,在双重反应体系中大鼠和小鼠的引物(400 nnmol/L)和探针(120 nmol/L)浓度相同的条件下,小鼠的荧光扩增曲线对大鼠的荧光扩增曲线表现出一定的抑制。因此,通过降低小鼠的引物和探针浓度,并增加大鼠的引物和探针浓度,对双重扩增体系进行优化。最终确定小鼠的引物和探针浓度分别为200 nmol/L和60 nmol/L,大鼠的引物和探针浓度分别为400 nmol/L和200 nmol/L,并得到双重Rt-RAA最佳检测循环阈(cycle threshold,Ct)值。
表2 双重Rt-RAA方法检测不同引物和探针浓度下大鼠和小鼠源性成分的Ct值
Table 2 Cycle threshold (Ct) values of duplex Rt-RAA for rats- and mice-derived ingredients at different primer and probe concentrations
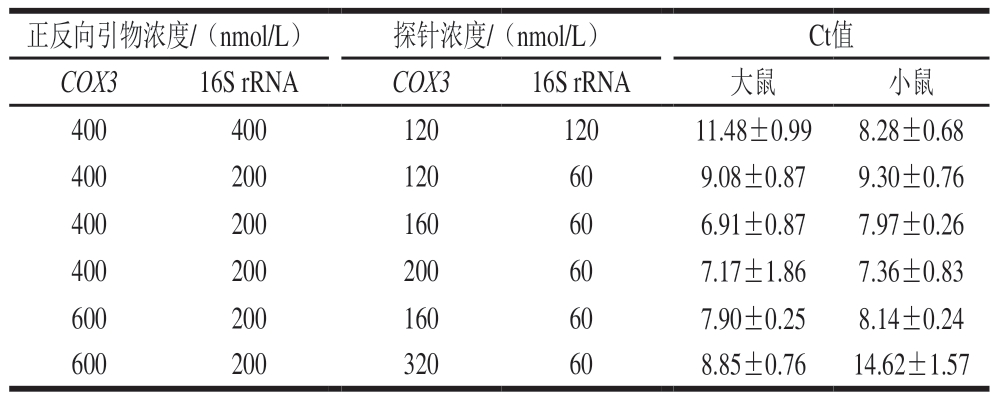
正反向引物浓度/(nmol/L)探针浓度/(nmol/L)Ct值COX316S rRNACOX316S rRNA大鼠小鼠40040012012011.48±0.998.28±0.68 400200120609.08±0.879.30±0.76 400200160606.91±0.877.97±0.26 400200200607.17±1.867.36±0.83 600200160607.90±0.258.14±0.24 600200320608.85±0.7614.62±1.57
为了优化双重R t-R A A 检测方法反应温度,在3 1 ~4 1 ℃进行温度梯度实验。如表3 所示,在31~39 ℃,随着温度的升高,检测大鼠和小鼠的Ct值逐渐降低。在41 ℃时,荧光扩增曲线则呈现出延迟,其中大鼠延迟幅度最大。因此,为了使双重Rt-RAA方法实现快速检测,将39 ℃作为最佳反应温度。
表3 双重Rt-RAA方法检测不同反应温度下大鼠和小鼠源性成分的Ct值
Table 3 Ct values of duplex Rt-RAA for rats- and mice-derived ingredients at different reaction temperatures

反应温度/℃Ct值大鼠小鼠3114.31±1.1811.29±0.25 3310.94±1.3110.60±1.70 359.02±4.029.66±0.59 377.78±4.099.54±4.59 395.97±0.535.73±1.38 4134.75±0.889.80±0.37
2.2 双重Rt-RAA的检测特异性
按照优化的检测条件对双重Rt-RAA方法进行特异性验证。如图1所示,提取的鸭肉、牛肉、马肉、羊肉、猪肉、鸡肉、鹅肉、骆驼肉、马鹿肉、梅花鹿肉及驴肉等非目标DNA和空白对照均未出现扩增,只有大鼠和小鼠样品DNA出现了扩增曲线,表明双重Rt-RAA检测方法具有良好的特异性。
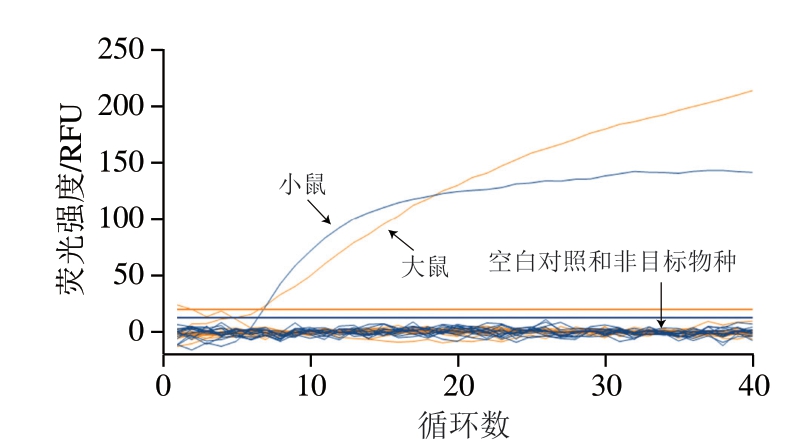
图1 双重Rt-RAA方法检测大鼠和小鼠源性成分特异性验证
Fig. 1 Specificity verification of duplex Rt-RAA for rats- and mice-derived ingredients
2.3 双重Rt-RAA的检测灵敏度
如图2所示,大鼠和小鼠源性成分的检测灵敏度分别为0.5%和0.2%。
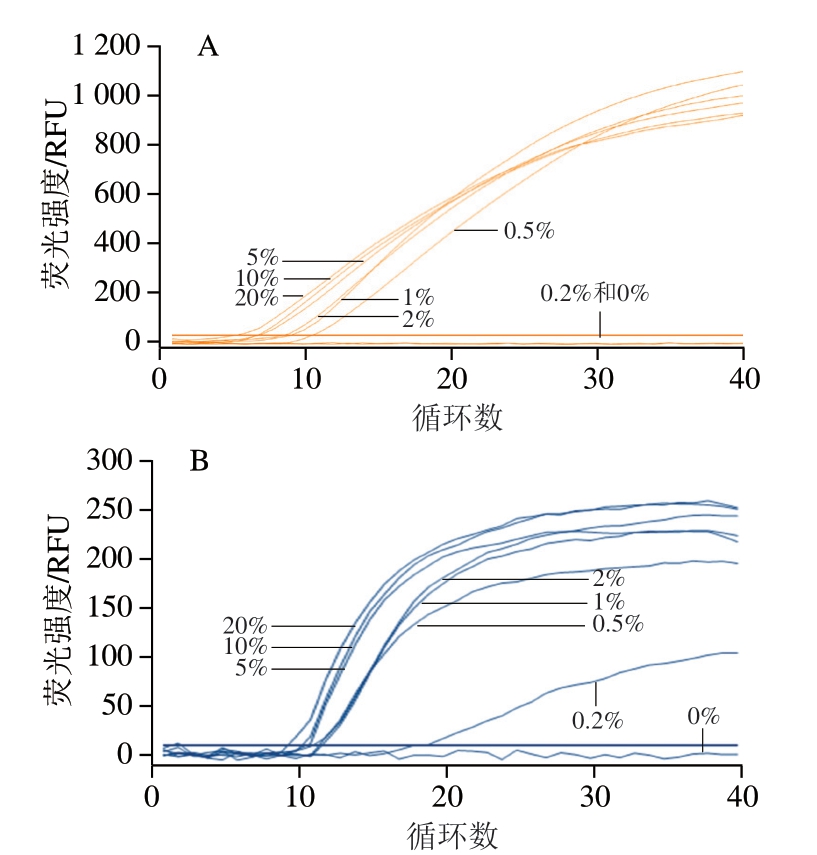
图2 双重Rt-RAA方法检测大鼠和小鼠源性成分灵敏度
Fig. 2 Sensitivity of duplex Rt-RAA for detecting rats- and mice-derived components
A.检测大鼠源性成分灵敏度;B.检测小鼠源性成分灵敏度。
根据其检测灵敏度,仍以羊肉、猪肉、牛肉粉碎混合作为基底肉,制备同时含有大鼠肉和小鼠肉,其质量分数均分别为5%、2%、1%、0.5%、0.2%、0%的6 种混合样品,结果表明,利用双重Rt-RAA方法同步检测大鼠和小鼠源性成分的灵敏度仍低至0.5%(图3A),realtime PCR方法检测灵敏度则为2%(图3B)。表明本研究建立的鼠源性双重Rt-RAA检测方法灵敏度较传统的realtime PCR检测方法得到进一步的提升,为检测更低质量比鼠源性成分提供了新的方法。
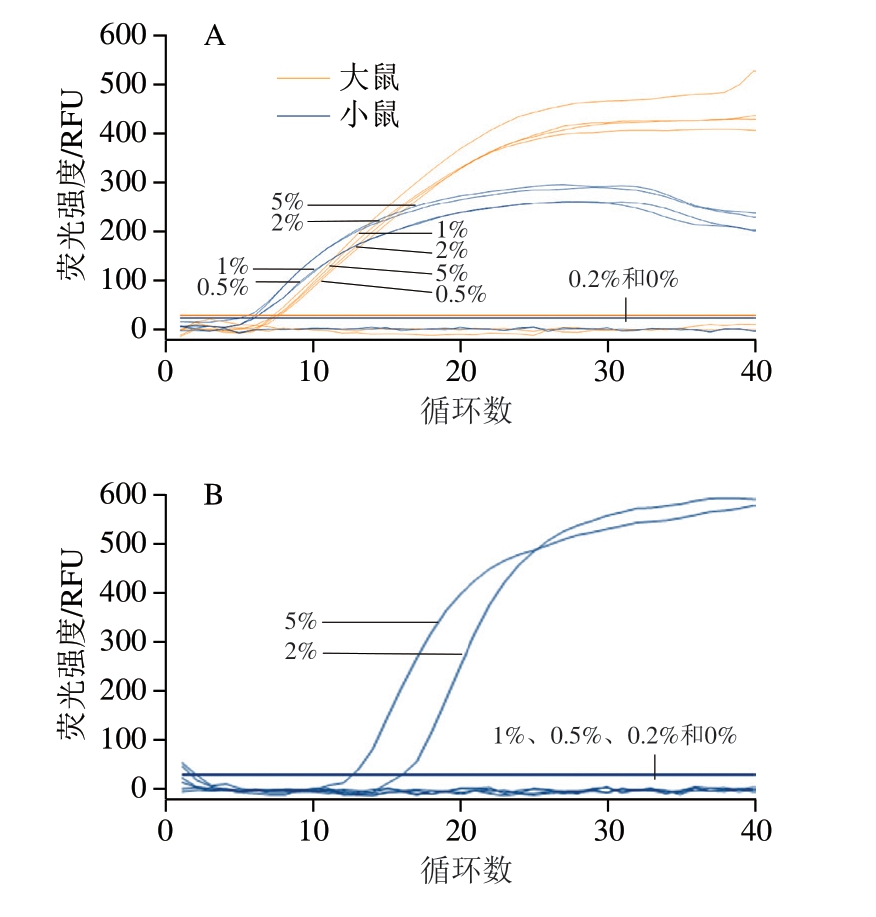
图3 大鼠和小鼠源性成分同步检测灵敏度
Fig. 3 Sensitivity of duplex Rt-RAA and real-time PCR for synchronous detection of rats- and mice-derived components
A.双重Rt-RAA方法;B. real-time PCR方法。
2.4 双重Rt-RAA的检测稳定性
为了确定双重Rt-RAA方法同步检测大鼠和小鼠源性成分的稳定性,本研究对同时含有大鼠肉与小鼠肉且各自所占质量分数均为0.5%的模拟样品进行同步检测。如图4所示,对设置的6 个平行,均能同步扩增出大鼠和小鼠DNA,表明所建立的双重Rt-RAA方法具有良好的稳定性。
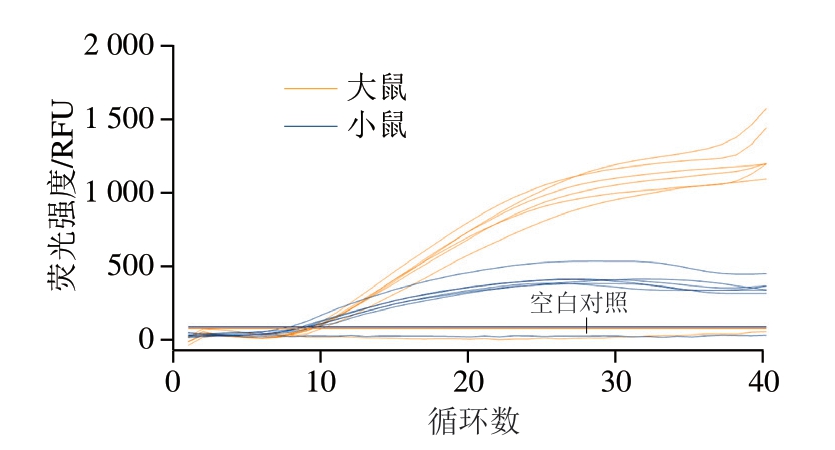
图4 双重Rt-RAA方法同步检测大鼠和小鼠源性成分稳定性
Fig. 4 Stability of duplex Rt-RAA for simultaneous detection of rats- and mice-derived components
2.5 模拟市售样品测定结果
如图5所示,本方法对于大鼠肉和小鼠肉质量分数为0.5%的混合模拟市售熟肉制品仍能检出大鼠和小鼠源性成分。因此,表明本研究所建立的双重Rt-RAA方法可用于实际检测。
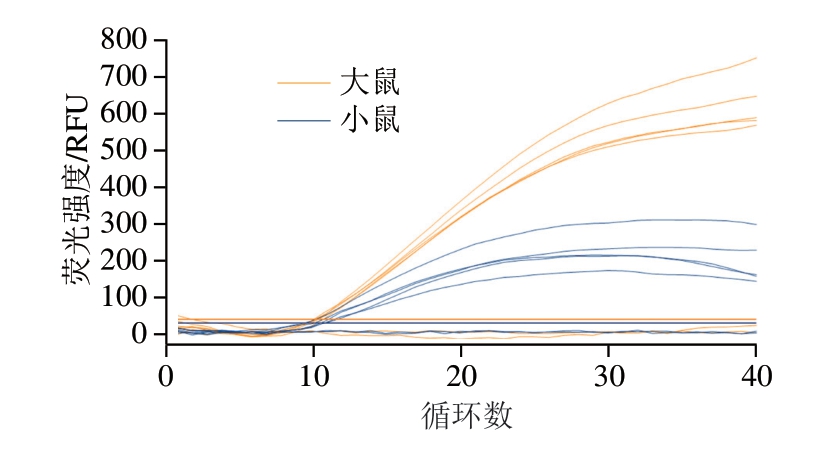
图5 双重Rt-RAA方法同步检测模拟样本中大鼠和小鼠源性成分灵敏度
Fig. 5 Sensitivity of duplex Rt-RAA for simultaneous detection of ratsand mice-derived components in simulated samples
2.6 市售样品和模拟样品测定结果
为进一步验证本研究所建立的检测方法的适用性,用双重Rt-RAA方法和BJS 201904中real-time PCR方法对25 份市售样品进行检测,结果高度一致,如表4所示。由于检出阳性样本数较少,在实验中增加了模拟样品进行对比检测,2 种方法检测结果符合率为100%。
表4 大鼠和小鼠源性成分的双重Rt-RAA和real-time PCR方法检测结果
Table 4 Results of detection of rats- and mice-derived components by duplex Rt-RAA and real-time PCR
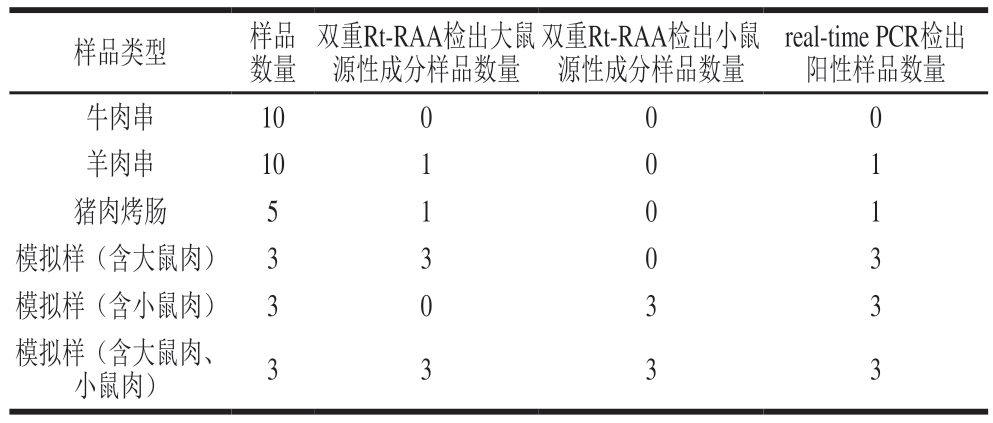
real-time PCR检出阳性样品数量牛肉串10000羊肉串10101猪肉烤肠5101模拟样(含大鼠肉)3303模拟样(含小鼠肉)3033模拟样(含大鼠肉、小鼠肉)3333样品类型样品数量双重Rt-RAA检出大鼠源性成分样品数量双重Rt-RAA检出小鼠源性成分样品数量
3 讨论与结论
在经济利益的驱使下,肉制品掺假屡禁不绝,不仅给消费者带来经济损失,且可能会对身体造成危害和引发疫病传染风险[15]。从欧洲的“马肉风波”至近年来被曝光的亚洲“鼠肉丑闻”事件,肉制品的掺假问题已经成为社会公众关注的焦点。随着科学技术不断发展,其掺假检测技术也在不断趋于完善。DNA作为绝大多数生物体遗传物质,具有高稳定性和保守性的特点,基于此建立的PCR检测技术[16]、real-time PCR检测技术[17]及等温扩增技术[18]等逐渐成为动物源性成分检测的国家标准或行业标准。目前,Ahamad等[19]建立多重PCR以区分兔肉、大鼠肉和松鼠肉。Suryawan等[20]基于细胞色素b(Cytb)基因开发了单重PCR方法,特异性检出印尼牛肉丸中的大鼠源性成分。王学政等[21]同样通过Cytb基因序列,设计针对鼠源性成分的荧光PCR法特异性引物。Duan Siqi等[4]建立并验证一种基于物种特异性PCR技术快速鉴别肉制品中鼠肉真伪的试剂盒。陈珍金等[22]分别开发了大鼠和小鼠源性成分的LAMP检测技术,用于羊肉制品中鼠源性成分的检测。然而,基于双重Rt-RAA技术同步检测大鼠和小鼠源性成分的技术鲜见报道。
鼠类是一种啮齿类哺乳动物,繁殖速度快、数量多,对生存环境要求低,生命力强。常携带流感病毒、冠状病毒及尼帕病毒等[23],严重威胁消费者健康。鼠肉为红肉,掺入可食用的肉及肉制品中难以通过外观判断。此外,复杂的样品基质相互干扰,对于检测的准确度和特异性同样产生严重的影响。随着人们对于肉制品的需求不断增加,已报道的鼠源性成分检测方法难以满足大批量的检测。
Rt-RAA是一种基于重组酶、DNA聚合酶及单链DNA结合蛋白3 种关键因子,在恒温条件下通过核酸外切酶(exonuclease,exo)探针实时监测特定DNA扩增过程的检测技术[24-25],exo探针含有与四氢呋喃(tetrahydrofuran,THF)残基紧密相连的内部荧光基团和猝灭基团[26]。当exo探针与目标序列相结合时,连接荧光基团与猝灭基团THF被切断,进而产生荧光,该荧光可以被常规的荧光定量仪器所检测,降低了Rt-RAA检测技术对仪器的要求。Rt-RAA检测技术具有简单、快速、特异性强和灵敏度高的优点[27]。相对于实时荧光重组酶聚合酶扩增(realtime recombinase polymerase amplification,Rt-RPA)检测技术,Rt-RAA重组酶从细菌或真菌中获得,来源范围广、成本低,且是我国自主研发的新型核酸扩增技术,而Rt-RPA重组酶则来自于T4噬菌体,来源范围窄、获取成本高[28-29]。因此,本研究基于大鼠的COX3基因和小鼠的16S rRNA基因序列建立双重Rt-RAA反应检测体系。实验结果表明,所建立的双重Rt-RAA特异性强、稳定性好,双重体系分别检测大鼠和小鼠源性成分的检出限分别为0.5%和0.2%,同步检测2 种源性成分检出限低至0.5%,并在模拟熟肉制品中同步检出限仍为0.5%,明显优于real-time PCR方法检测灵敏度。双重Rt-RAA方法与real-time PCR方法对市售样品和模拟样品检测结果具有高度一致性,符合率为100%。
与陈珍金等[22]建立的LAMP检测方法实验结果相比,Rt-RAA方法可在39 ℃恒温条件下30 min内完成检测,而LAMP方法则需要63 ℃恒温条件、45 min才能完成检测。同时,Rt-RAA检出限与LAMP检测大鼠和小鼠的检出限基本相当。此外,Rt-RPA检测方法并未出现交叉反应,通过6 次平行实验验证,本研究建立的检测方法具有很好的稳定性。因此,本研究建立的双重Rt-RAA检测方法适用于肉制品中大鼠和小鼠源性成分的快速检测,为现场快速检测肉制品掺假提供了另一条快捷、实用的检测方法。
[1] HAJI A, DESALEGN K, HASSEN H. Selected food items adulteration, their impacts on public health, and detection methods:a review[J]. Food Science & Nutrition, 2023, 11(12): 7534-7545.DOI:10.1002/fsn3.3732.
[2] WALKER M, BURNS M, BURNS D. Horse meat in beef productsspecies substitution 2013[J]. Journal of the Association of Public Analysts, 2013, 41: 67-106.
[3] AMARAL J S, SANTOS G, OLIVEIRA M B P P, et al. Quantitative detection of pork meat by EvaGreen real-time PCR to assess the authenticity of processed meat products[J]. Food Control, 2017, 72:53-61. DOI:10.1016/j.foodcont.2016.07.029.
[4] DUAN S Q, AI J X, SUN L Y, et al. Development and validation of a rapid kit for authenticity of murine meat in meat products with a species-specific PCR assay[J]. Food Additives & Contaminants Part A: Chemistry, Analysis, Control, Exposure & Risk Assessment, 2020,37(4): 552-560. DOI:10.1080/19440049.2020.1718218.
[5] NAAUM A M, SHEHATA H R, CHEN S, et al. Complementary molecular methods detect undeclared species in sausage products at retail markets in Canada[J]. Food Control, 2018, 84: 339-344.DOI:10.1016/j.foodcont.2017.07.040.
[6] 李欣南. 基于核酸分子检测的肉类源性成分快速鉴别技术的开发与应用[D]. 沈阳: 中国医科大学, 2018.
[7] CHEN A L, WEI C B, CHEN G, et al. Duplex PCR approach for the detection and quantification of donkey, horse and mule in raw and heatprocessed meat products[J]. International Journal of Food Science &Technology, 2015, 50(3): 834-839. DOI:10.1111/ijfs.12720.
[8] 梁子英, 刘芳. 实时荧光定量PCR技术及其应用研究进展[J]. 现代农业科技, 2020, 6(1): 1-3; 8.
[9] QUAN P L, SAUZADE M, BROUZES E. dPCR: a technology review[J]. Sensors, 2018, 18(4): 1271. DOI:10.3390/s18041271.
[10] HARSHITHA R, ARUNRAJ D R. Real-time quantitative PCR: a tool for absolute and relative quantification[J]. Biochemistry and Molecular Biology Education, 2021, 49(5): 800-812. DOI:10.1002/bmb.21552.
[11] BALTRUŠIS P, HÖGLUND J. Digital PCR: modern solution to parasite diagnostics and population trait genetics[J]. Parasites &Vectors, 2023, 16(1): 143. DOI:10.1186/s13071-023-05756-7.
[12] CHO A R, DONG H J, CHO S. Meat species identification using loopmediated isothermal amplification assay targeting species-specific mitochondrial DNA[J]. Korean Journal for Food Science of Animal Resources, 2014, 34(6): 799-807. DOI:10.5851/kosfa.2014.34.6.799.
[13] KIM S H, LEE S Y, KIM U, et al. Diverse methods of reducing and confirming false-positive results of loop-mediated isothermal amplification assays: a review[J]. Analytica Chimica Acta, 2023, 1280:341693. DOI:10.1016/j.aca.2023.341693.
[14] CUI H, TU F, ZHANG C, et al. Real-time reverse transcription recombinase-aided amplification assay for rapid amplification of the N gene of SARS-CoV-2[J]. International Journal of Molecular Sciences,2022, 23(23): 15269. DOI:10.3390/ijms232315269.
[15] MOTALIB HOSSAIN M A, ALI M E, HAMID S B A, et al. Targeting double genes in multiplex PCR for discriminating bovine, buffalo and porcine materials in food chain[J]. Food Control, 2017, 73: 175-184.DOI:10.1016/j.foodcont.2016.08.008.
[16] AI J, SUN L, GAO L, et al. Development of a PCR-based assay for detection of Chinese mink tissue in meat products based on the mitochondrial DNA cytochrome-b gene[J]. Mitochondrial DNA Part B:Resources, 2019, 4(2): 2748-2750. DOI:10.1080/23802359.2018.1532828.
[17] CHEN X Y, LU L X, XIONG X H, et al. Development of a real-time PCR assay for the identification and quantification of bovine ingredient in processed meat products[J]. Scientific Reports, 2020, 10(1): 2052.DOI:10.1038/s41598-020-59010-6.
[18] 郭燕华, 陈遂, 王德莲, 等. 基于重组酶等温扩增技术快速检测生鲜肉中猪源性成分[J]. 食品安全质量检测学报, 2017, 8(6): 2012-2016.
[19] AHAMAD M N U, ALI M E, MOTALIB HOSSAIN M A, et al.Multiplex PCR assay discriminates rabbit, rat and squirrel meat in food chain[J]. Food Additives & Contaminants Part A: Chemistry, Analysis,Control, Exposure & Risk Assessment, 2017, 34(12): 2043-2057. DOI:10.1080/19440049.2017.1359752.
[20] SURYAWAN G Y, SUARDANA I W, WANDIA I N. Sensitivity of polymerase chain reaction in the detection of rat meat adulteration of beef meatballs in Indonesia[J]. Veterinary World, 2020, 13(5): 905-908. DOI:10.14202/vetworld.2020.905-908.
[21] 王学政, 季福玲, 刘志胜, 等. 一种用于实时荧光PCR法检测肉制品中鼠源性成分特异性引物的研发[J]. 中国生物制品学杂志, 2018,31(7): 775-777; 781. DOI:10.13200/j.cnki.cjb.002239.
[22] 陈珍金, 张璜, 石磊, 等. 利用LAMP技术快速检测羊肉制品中的鼠源性成分[J]. 食品科学, 2021, 42(12): 322-327. DOI:10.7506/spkx1002-6630-20201016-146.
[23] KINGSLEY D H. Emerging foodborne and agriculture-related viruses[J]. Microbiology Spectrum, 2016, 4(4). DOI:10.1128/microbiolspec.pfs-0007-2014.
[24] CHEN W X, FAN J D, LI Z Y, et al. Development of recombinase aided amplification combined with disposable nucleic acid test strip for rapid detection of porcine circovirus type 2[J]. Frontiers in Veterinary Science, 2021, 8: 676294. DOI:10.3389/fvets.2021.676294.
[25] WANG Z H, LI P, LIN X, et al. Application of portable real-time recombinase-aided amplification (Rt-RAA) assay in the clinical diagnosis of ASFV and prospective DIVA diagnosis[J]. Applied Microbiology and Biotechnology, 2021, 105(8): 3249-3264.DOI:10.1007/s00253-021-11196-z.
[26] DONG Y C, ZHOU D D, ZHANG B Z, et al. Development of a realtime recombinase-aided amplification assay for rapid and sensitive detection of Edwardsiella piscicida[J]. Frontiers in Cellular and Infection Microbiology, 2024, 14: 1355056. DOI:10.3389/fcimb.2024.1355056.
[27] FAN X X, LI L, ZHAO Y G, et al. Clinical validation of two recombinase-based isothermal amplification assays (RPA/RAA)for the rapid detection of African swine fever virus[J]. Frontiers in Microbiology, 2020, 11: 1696. DOI:10.3389/fmicb.2020.01696.
[28] 孙晓红, 后来旺, 李达容, 等. 重组酶等温扩增技术在分析检测中的应用研究进展[J]. 食品与发酵工业, 2020, 46(24): 265-270.DOI:10.13995/j.cnki.11-1802/ts.024735.
[29] WANG R P, XU S, WEI E J, et al. Recombinase-aided amplification coupled with lateral flow dipstick for efficient and accurate detection of Bombyx mori nucleopolyhedrovirus[J]. Folia Microbiologica, 2024,69(3): 667-676. DOI:10.1007/s12223-023-01102-7.