氨基糖苷类(aminoglycosides,AGs)抗生素是一类细菌蛋白质合成抑制剂,其抗菌谱较广、抗菌活性强,对需氧革兰氏阴性杆菌如大肠杆菌、沙门氏菌、巴氏杆菌变形杆菌属、肠杆菌属、志贺菌属等有强大的杀菌作用,常用于防治畜禽呼吸道、肠道、泌尿道感染及败血症、禽霍乱等疫病,是防治需氧革兰氏阴性杆菌感染的首选药物[1-2]。AGs兽药具有严重的肾毒性、耳毒性及造血系统毒性,可造成神经肌肉阻滞、过敏等不良反应[3],长期食用AGs兽药残留超标的动物源性食品会导致药物在人体内蓄积,同时引发相应的毒副作用或出现耐药性,损害人体健康。为此,监控畜禽肉中AGs兽药残留对于保障畜禽肉质量安全,以及消费者饮食安全和身体健康具有重要意义。
AGs兽药是由氨基糖苷与氨基环醇形成的苷,结构中含有氨基等碱性基团和多个羟基,故此类药物呈碱性,水溶性较强,且紫外吸收弱,进行食品中残留检测分析时存在提取难、保留弱、灵敏度低等难点问题。国内外在解决其保留弱、灵敏度低等难题方面的报道较多。例如,为解决AGs兽药在反相色谱柱上保留弱甚至无保留问题,可在样品进样溶液或流动相中加入离子对试剂[4-7],或采用亲水性色谱柱[8-12];若检测灵敏度低,可采用适宜的样品前处理净化技术,如液-液萃取法[13-15]、固相萃取法[16-21]、基质固相分散法[22]等,尽可能去除干扰杂质,降低基质效应,提高灵敏度。针对解决提取难问题的报道甚少,相关报道多采用磷酸盐缓冲液[23-24],或加入蛋白沉淀剂如三氯乙酸[25-26]、高氯酸[27]、乙腈[28-29]等溶液,提取的同时沉淀蛋白,达到净化目的。
通过查阅文献[30-31]和实验研究发现,AGs兽药可与动物源性食品中的蛋白质结合形成稳定结构,缓冲液提取或沉淀蛋白不能很好地将待测组分提取出来。基于此,本研究拟通过离子对竞争性地与AGs兽药结合,将AGs兽药从牛肉样品的蛋白质中释放出来,同时对前处理方法和仪器条件进行优化,采用超高效液相色谱-串联质谱进行检测,以期解决食品中AGs兽药残留检测提取难、保留弱、灵敏度低的难点问题。
1 材料与方法
1.1 材料与试剂
牛肉样品购自广西省内各地农贸市场,独立封装后在-20 ℃下冷冻贮藏,待测时提前取出并于室温下解冻,使用绞肉机处理为均匀肉泥以供前处理。
潮霉素B(纯度9 0.2%)、双氢链霉素(纯度97.7%)、硫酸巴龙霉素(纯度98.0%)、西索米星(纯度95.0%)、硫酸异帕米星(纯度98.6%) 天津阿尔塔有限公司;硫酸链霉素(纯度97.7%)、硫酸卡那霉素(纯度96.4%)、硫酸安普霉素(纯度86.3%)、硫酸庆大霉素(纯度89.2%)、妥布霉素(纯度94.3%)、硫酸新霉素(纯度80.1%)、盐酸壮观霉素(纯度99.9%)、硫酸奈替米星(纯度96.5%)、硫酸依替米星(纯度59.9%)、辛烷磺酸钠(分析纯) 上海安谱璀世标准技术服务有限公司;丁胺卡那霉素(纯度86.2%)、硫酸小诺霉素(纯度80.0%) 广州佳途科技股份有限公司;戊烷磺酸钠、十二烷基硫酸钠(均为分析纯) 上海麦克林生化科技股份有限公司;己烷磺酸钠(分析纯)美国Sigma-Aldrich公司;庚烷磺酸钠、癸烷磺酸钠(均为色谱纯) 美国Fisher Chemical公司;十二烷基磺酸钠(分析纯) 天津市大茂化学试剂厂;乙二胺四乙酸二钠(disodium ethylenediamine tetraacetic acid,Na2EDTA)(优级纯) 天津光复科技发展有限公司;三氯乙酸、磷酸二氢钾、盐酸(均为分析纯) 国药集团化学试剂有限公司;氢氧化钠(分析纯) 广东光华科技股份有限公司;甲酸(色谱纯) 天津市科密欧化学试剂有限公司;甲醇、乙腈(均为色谱纯) 默克股份两合公司;实验用水为GB/T 6682—2008《分析实验室用水规格和试验方法》规定的一级水。
1.2 仪器与设备
Triple Quad 5500三重四极杆液相色谱-质谱联用仪美国AB SCIEX公司;1290超高效液相色谱仪、Hilic Plus色谱柱(2.1 mm×100 mm,3.5 μm) 美国Agilent公司;MS303TS电子天平 梅特勒-托利多仪器(上海)有限公司;Milli-Q Advantage A10超纯水机 德国Millipore公司;MILTIFUGE X3R高速冷冻离心机 美国Thermo Fisher Scientific公司;Multi Reax多管式涡旋振荡器德国Heidolph公司;Genius NM32LA氮气发生器 毕克气体仪器贸易(上海)有限公司;TurboVap LV样品自动浓缩仪 瑞典Biotage公司;Oasis HLB固相萃取小柱(6 mL,200 mg) 美国Waters公司。
1.3 方法
1.3.1 样品前处理
取样品2.0 g,加入10.0 mL提取剂(称取磷酸二氢钾1.36 g,加水980 mL使之溶解,采用1 mol/L盐酸溶液调节pH值至4.0,分别加入戊烷磺酸钠8.70 g、己烷磺酸钠9.41 g、Na2EDTA 0.15 g、三氯乙酸20 g使之溶解,以水定容至1 000 mL),涡旋5 min,超声5 min,10 000 r/min、-10 ℃离心10 min,取上清液,采用10 mol/L氢氧化钠溶液调节pH值至4~5,置于已活化HLB固相萃取小柱(6 mL,200 mg,活化:甲醇(5 mL)→水(5 mL)→提取液(5 mL)),用5 mL水淋洗,抽干,用10 mL 0.5%甲酸甲醇溶液洗脱,于40 ℃水浴氮气吹至近干,用1%甲酸水溶液-乙腈(15∶85,V/V)溶解并定容至1.0 mL,涡旋振荡5 min,过0.22 μm滤膜,上机测定。
1.3.2 标准溶液配制
标准储备溶液:精密称取16 种AGs标准物质各10.0 mg,分别置于10 mL容量瓶中,加水溶解并定容,摇匀,得到质量浓度为1 mg/mL的单标储备溶液,0~5 ℃保存。
混合标准中间液:分别精密移取各单标储备溶液0.1 mL,置于同一10 mL容量瓶中,用水稀释、定容,摇匀,各标准物质质量浓度为10 μg/mL。
混合标准工作液:精密移取混合标准中间液1.0 mL,置于10 mL容量瓶中,用水稀释、定容,各标准物质质量浓度为1.0 μg/mL,用于绘制标准曲线。
称取牛肉空白基质样品,按1.3.1节处理后,得到空白基质溶液。分别精密吸取混合标准工作液0.05、0.10、0.20、0.50、0.75 mL,混合标准中间液0.10、0.12、0.15 mL,用空白基质溶液配制成质量浓度分别为0.05、0.10、0.20、0.50、0.75、1.00、1.20、1.50 μg/mL的系列基质混合标准工作曲线所需溶液。
1.3.3 分析条件
1.3.3.1 色谱条件
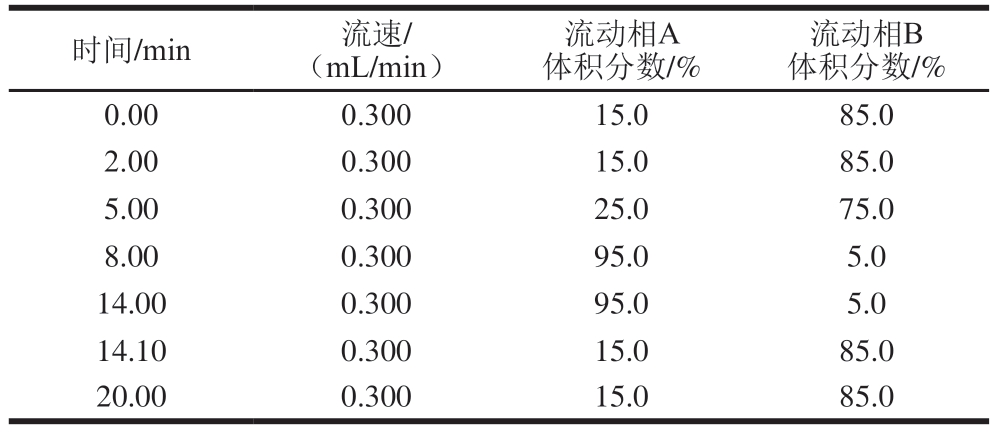
色谱柱:Hilic Plus(2.1 mm×100 mm,3.5 μm);柱温35 ℃;进样量10 μL;流动相A为1%甲酸溶液,B为乙腈;流动相梯度洗脱程序见表1。
表1 流动相梯度洗脱程序
Table 1 Gradient elution program of mobile phase
?
1.3.3.2 质谱条件
电喷雾电离;多反应监测模式;正离子扫描;电喷雾电压5 500 V;碰撞室入口电压10 V;碰撞室出口电压12 V;雾化气(氮气)压力55 psi;辅助加热气压力60 psi;气帘气(氮气)压力35 psi;碰撞气压力9 psi;离子源温度550 ℃;扫描时间60 ms。
1.3.4 基质效应计算
按下式计算:
1.4 数据处理
分别利用Analyst软件和MutiQuant 3.0.2软件进行数据采集及处理,采用Excel 2010软件和Origin 2021软件进行数据汇总和分析。
2 结果与分析
2.1 色谱柱选择
由于AGs兽药含有多个氨基,电离作用强,在反相色谱分离柱中保留极弱甚至无保留。通过在流动相中添加离子对试剂,如戊烷磺酸钠、庚烷磺酸钠、七氟丁酸等,使之与待测物离子结合,形成可在反相色谱柱中保留的分子,但离子对试剂会残留在质谱系统中,损坏质谱系统,造成质谱检测器对负离子分析性能下降。通过在高纯度、具有良好机械稳定性的硅胶基质表面键合高纯度亲水性基团,可得到亲水性反相分离柱,如HILIC柱、R柱、Gold柱等,可大大增强极性化合物在反相色谱柱上的保留能力和选择性[32-35]。本研究对比不同厂家、不同规格、不同型号的亲水作用色谱柱(Sielc obelisk R(2.1 mm×100 mm,5 μm)、HSS T3(2.1 mm×100 mm,1.8 μm)、Hypersil Gold(2.1 mm×100 mm,1.9 μm)、Hypersil Gold AQ(2.1 mm×100 mm,1.9 μm)、Agilent Proshell 120 Hilic(4.6 mm×100 mm,2.7 μm)、Agilent Hilic Plus(2.1 mm×100 mm,3.5 μm)、Agilent RRHD Hilic Plus(2.1 mm×100 mm,1.8 μm)、Waters CORTECS UPLC Hilic(2.1 mm×100 mm,1.6 μm)、Waters ACQUITY UPL BEH Hilic(2.1 mm×100 mm,1.6 μm))。结果表明,使用Agilent Hilic Plus色谱柱时,16 种AGs兽药的保留效果较好,色谱峰峰形尖锐、对称性良好(图1)。故最终选择Agilent Hilic Plus色谱柱(2.1 mm×100 mm,3.5 μm)。
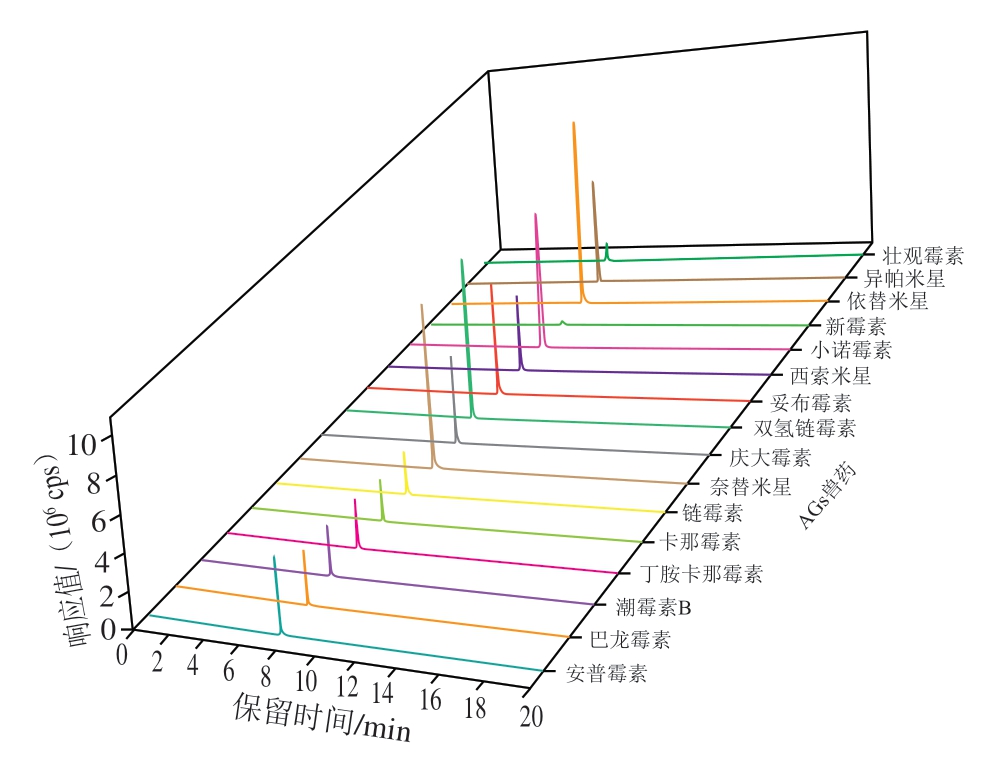
图1 16 种AGs兽药标准溶液的提取离子流图
Fig. 1 Extracted ion chromatograms of 16 AGs standard solutions
2.2 质谱条件优化
AGs兽药分子结构中含有氨基环醇、羟基和伯胺或仲胺基团等碱性基团,可与流动相中甲酸的H+结合,形成带正电荷的[M+H]+,适宜采用正离子扫描模式,通过优化锥孔电压和碰撞能量,选取响应丰度较高、易得到、出峰稳定的母离子和子离子,进而获得定量和定性离子对。具体质谱参数见表2。
表2 16 种AGs兽药质谱采集参数
Table 2 Mass spectrum acquisition parameters of 16 AGs
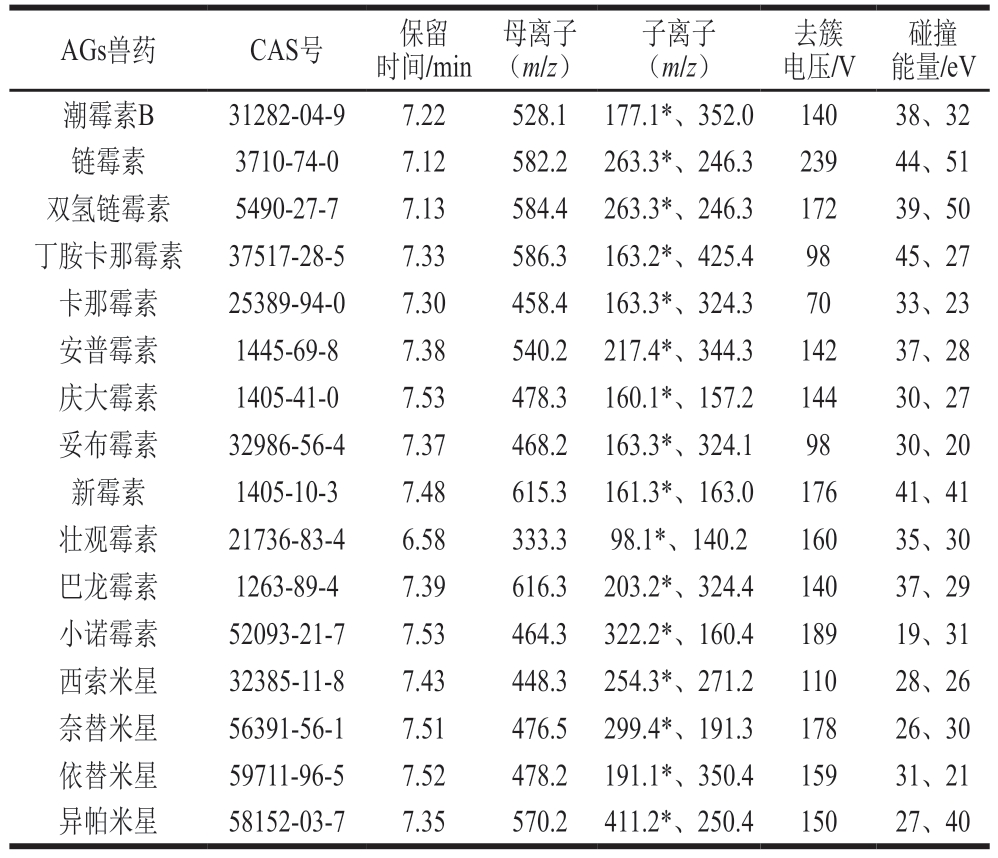
注:*.定量离子。
?
2.3 提取剂优化
AGs兽药具有弱碱性、带正电,可与细胞中的金属离子螯合,同时牛肉中含有大量蛋白质,蛋白质的肽键结构含有羰基(C=O),可与AGs兽药分子结构中的N—H键形成稳定结构,给样品提取和净化带来巨大困难。现阶段去除蛋白质的方法有酸性沉淀剂盐析、有机溶剂脱水、生物酶酶解、加热等。本研究采用三氯乙酸沉淀蛋白、Na2EDTA螯合金属离子、Tris溶液-磷酸盐缓冲液提取、蛋白酶水解蛋白质等方式,通过调节提取剂的酸碱度、水解蛋白质等方式,提取液出现不同程度的浑浊,且存在提取不完全、目标物丢失等现象,均不能取得满意效果。由此可知,单纯地沉淀蛋白质并不能破坏蛋白质与AGs兽药之间的结合力,在沉淀蛋白质的同时,AGs兽药也同时沉淀而被去除。
离子对试剂具有强亲水性和结合力,可与电离能力较强的化合物结合[4-5]。而AGs兽药为阳离子化合物,电离能力强,易与阴离子离子对试剂配对[7]。为此,本研究考察阴离子离子对试剂烷基磺酸盐类(0.1 mol/L戊烷磺酸钠、己烷磺酸钠、庚烷磺酸钠、辛烷磺酸钠、癸烷磺酸钠、十二烷基磺酸钠、十二烷基硫酸钠溶液)对AGs兽药的提取效果。结果表明,在提取过程中,离子对试剂碳链越长(癸烷磺酸钠、十二烷基磺酸钠、十二烷基硫酸钠),产生的泡沫越多,难以消除,导致无法涡旋振荡提取,固相萃取净化时过柱慢,且在浓缩时有白色残渣析出,提取回收率较低(<35%);采用戊烷磺酸钠溶液提取时,所有组分均能出峰,除潮霉素B回收率(<45%)偏低外,其余组分回收率(60%~120%)良好;采用己烷磺酸钠溶液提取时,所有组分亦均能出峰,除链霉素、双氢链霉素、壮观霉素、奈替霉素和小诺霉素回收率(10%~60%)偏低外,其余组分回收率(60%~120%)良好。因此,为保证所有组分能达到更好的提取效果,本研究采用戊烷磺酸钠和己烷磺酸钠组合溶剂作为提取剂。
比较不同浓度的组合溶剂(0.02 mol/L戊烷磺酸钠-0.02 mol/L己烷磺酸钠溶液、0.05 mol/L戊烷磺酸钠-0.05 mol/L己烷磺酸钠溶液、0.1 mol/L戊烷磺酸钠-0.1 mol/L己烷磺酸钠溶液、0.2 mol/L戊烷磺酸钠-0.2 mol/L己烷磺酸钠溶液)对AGs兽药的提取效果。结果表明,随着提取剂浓度的升高,各组分的回收率也升高,提取剂浓度大于0.05 mol/L时,各组分回收率良好,提取效果较理想。因此,本研究采用组合溶剂0.05 mol/L戊烷磺酸钠-0.05 mol/L己烷磺酸钠溶液,通过离子对与蛋白质竞争性结合待测组分,将AGs兽药从蛋白质中释放出来。此外,为更好地降低基质效应,减小蛋白质对待测组分的干扰,本研究加入三氯乙酸沉淀蛋白,提供酸性环境,更有利于AGs兽药提取。
2.4 净化条件优化
目前,最常用的兽药残留检测前处理净化方法为固相萃取法和QuEChERS方法。AGs兽药极易溶于水,宜采用水溶液进行提取,若采用QuEChERS方法净化,水溶液难以浓缩,而兽药残留检测为痕量分析,未经浓缩的样品溶液可导致方法检出限偏低,达不到检测灵敏度要求。因此,本研究拟采用固相萃取法。AGs兽药为弱碱性有机物,宜采用反相固相萃取法或阳离子交换固相萃取法。本研究以16 种AGs兽药的混合标准溶液(1 μg/mL)考察不同品牌、不同填料、不同规格固相萃取柱的净化效果。如表3所示,Oasis MCX柱(150 mg,6 mL)、Bond Elut-Pba柱(100 mg,3 mL)对所有组分均无保留,Oasis WCX柱(500 mg,6 mL)对其中9 种组分(潮霉素B、双氢链霉素、丁胺卡那霉素、卡那霉素、安普霉素、妥布霉素、壮观霉素、巴龙霉素、异帕霉素)有保留;Bond Elut-C18柱对其中11 种组分(双氢链霉素、卡那霉素、安普霉素、庆大霉素、妥布霉素、新霉素、巴龙霉素、小诺霉素、西索米星、奈替米星、依替米星)有保留;HLB填料对16 种AGs兽药均有保留,当填料规格200 mg、柱容量6 mL时,各组分回收率良好。故本研究采用Waters Oasis HLB固相萃取柱(200 mg,6 mL)作为AGs兽药净化的固相萃取柱。
表3 AGs兽药在不同品牌、不同填料、不同规格固相萃取柱中的保留数量和回收率
Table 3 Ability of different brands, fillers and specifications of SPE column to retain AGs and their effects on the recovery of AGs
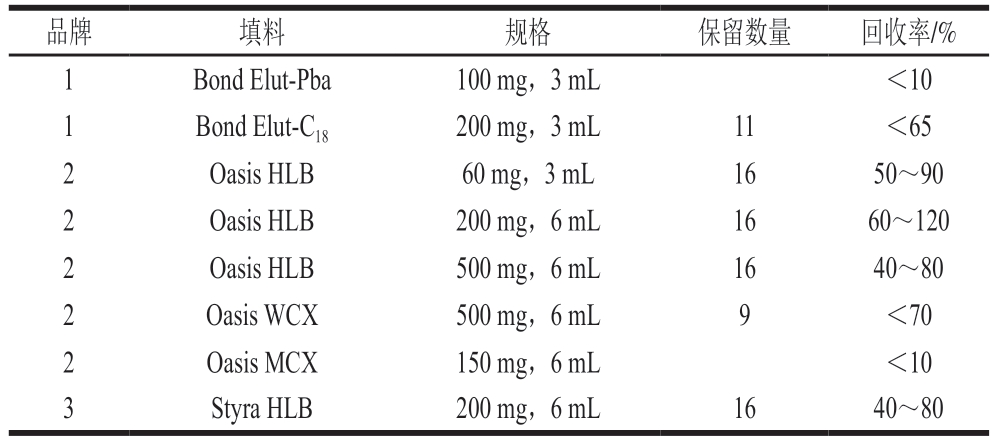
注:品牌1. Agilent;品牌2. Waters;品牌3. SHIMSEN。
?
2.5 基质效应分析
本研究通过空白基质加标法对牛肉中的基质效应进行评价。如图2所示,牛肉基质中,只有丁胺卡那霉素表现为基质增强效应,基质效应为8.5%,其他AGs兽药均表现为基质抑制效应,基质效应为-77.2%~-23.7%,其中潮霉素B、卡那霉素、庆大霉素、新霉素、壮观霉素、奈替米星和依替米星基质效应绝对值均小于50%,而链霉素、双氢链霉素、安普霉素、妥布霉素、巴龙霉素、小诺霉素、西索米星和异帕米星基质效应绝对值大于50%。因此,本研究采用空白基质溶液配制标准曲线溶液,以消除基质效应影响,提高定量分析结果的准确性。
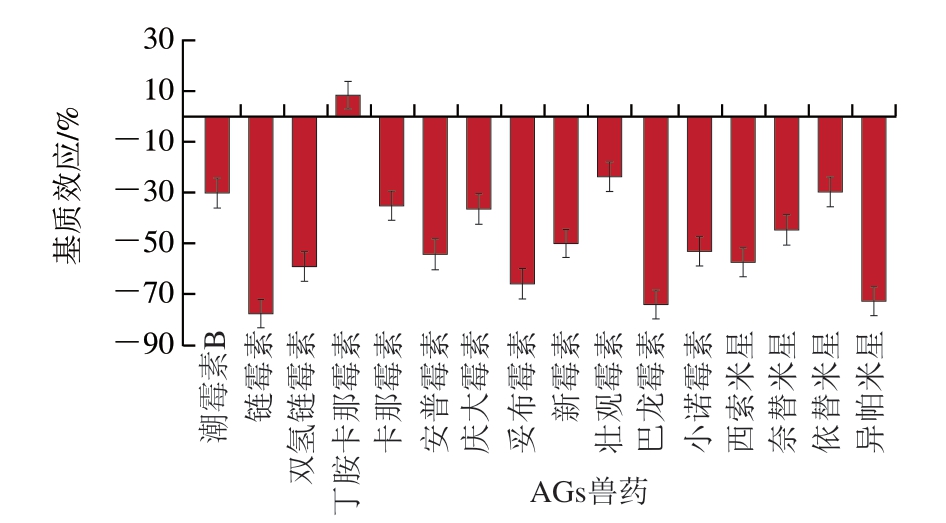
图2 牛肉基质中16 种AGs兽药的基质效应
Fig. 2 Matrix effects of 16 AGs in beef
2.6 方法学验证
2.6.1 线性关系、检出限和定量限
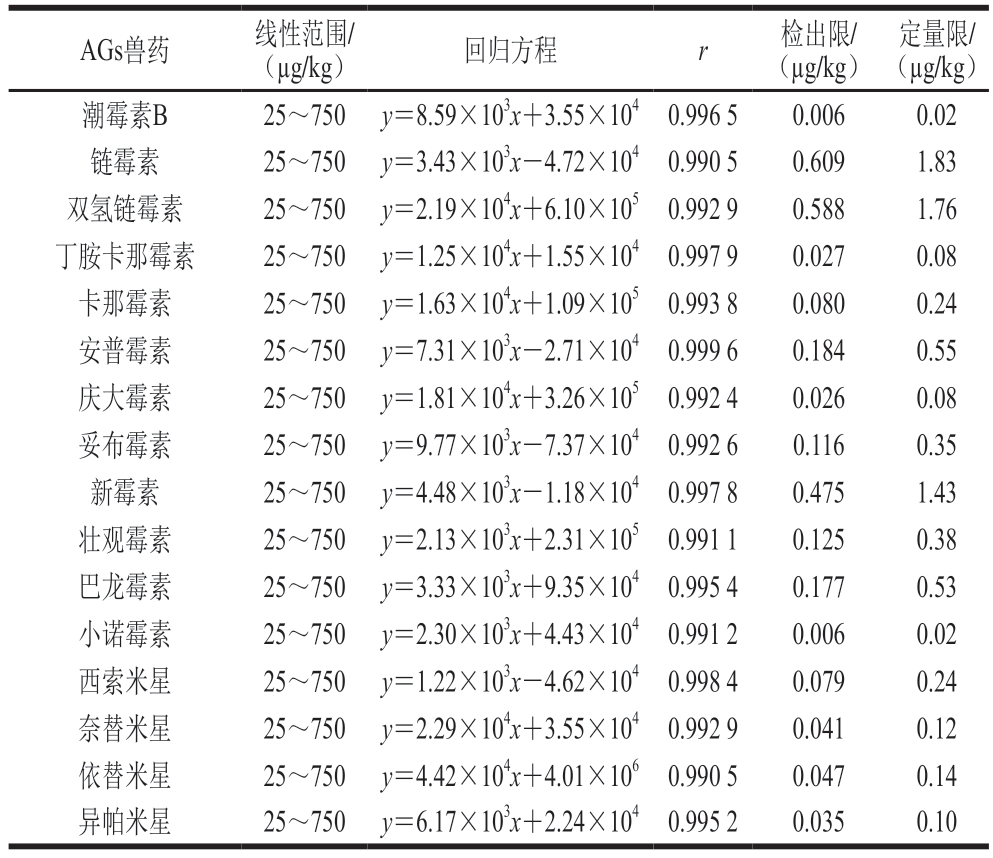
采用阴性牛肉样品制备空白基质标准曲线溶液,按优化条件进行测试,以目标物定量离子的质谱图峰面积(y)为纵坐标、相应的空白基质标准工作溶液质量浓度(x,ng/mL)为横坐标,绘制标准曲线,得到16 种AGs兽药的线性回归方程和相关系数,分别以信噪比(RSN)=3和RSN=10计算检出限和定量限,如表4所示。结果表明,16 种AGs兽药在25~750 µg/kg范围内线性关系良好,相关系数r均大于0.990,检出限为0.006~0.609 µg/kg,定量限为0.02~1.83 µg/kg,满足AGs兽药的检测要求。
表4 16 种AGs兽药的线性范围、回归方程、相关系数、检出限和定量限
Table 4 Linear ranges, regression equations, correlation coefficients,LOD and LOQ for 16 AGs
?
2.6.2 准确度和精密度
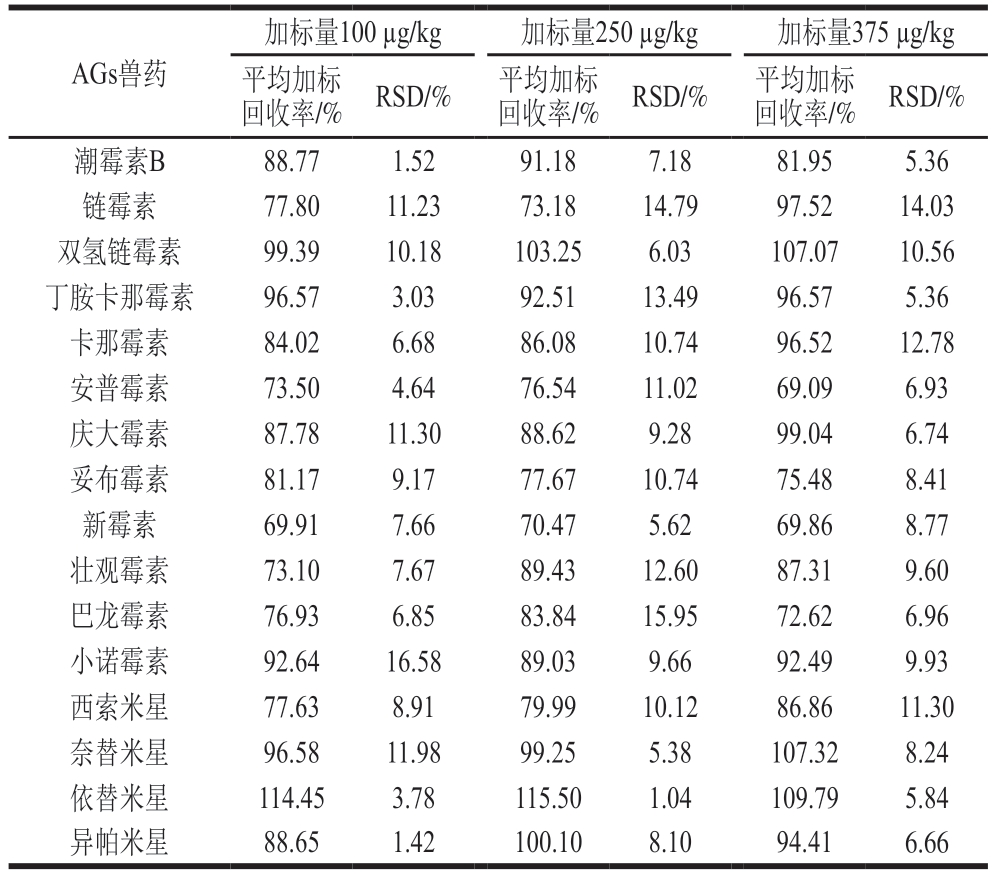
在空白牛肉基质样品中,进行3 个水平(100、250、375 µg/kg)的加标回收实验,每个加标水平平行测定6 次。如表5所示,16 种AGs兽药的平均加标回收率为69.09%~115.50%,相对标准偏差(relative standard deviation,RSD)为1.04%~16.58%(n=6),方法具有良好的准确度与精密度。
表5 16 种AGs兽药的平均加标回收率及RSDs(n=6)
Table 5 Average spiked recoveries and RSDs of 16 AGs (n = 6)
?
2.7 实际样品检测
在广西省内随机选取牛肉样品100 批次,采用本方法对样品中16 种AGs兽药进行检测,100 批次样品中均未检出AGs。
3 结 论
本研究基于超高效液相色谱-串联质谱建立了牛肉中16 种AGs兽药残留的测定方法。通过选择合适的色谱柱,采用三氯乙酸沉淀蛋白,以组合溶剂0.05 mol/L戊烷磺酸钠-0.05 mol/L己烷磺酸钠溶液作为提取剂,HLB固相萃取柱富集净化,实现了16 种AGs兽药的有效提取、保留和准确定量分析。本方法提取效率高、净化效果好、灵敏度高、准确度和精密度良好,适用于牛肉中16 种AGs兽药的同时测定。
[1] 余祖功, 董发明, 刘永旺. 兽药合理应用与联用手册[M]. 北京: 化学工业出版社, 2021: 50-58.
[2] 崔海岚. 氨基糖苷类抗生素临床应用的体会[J]. 当代畜牧, 2022(2):48-49.
[3] 许恒, 唐春雷, 范为正. 氨基糖苷类抗生素的研究进展[J]. 中国新药杂志, 2019, 15(28): 1828-1835.
[4] ALMEIDA M P, REZENDE C P, SOUZA L F, et al. Validation of a quantitative and confirmatory method for residue analysis of aminoglycoside antibiotics in poultry, bovine, equine and swine kidney through liquid chromatography-tandem mass spectrometry[J]. Food Additives & Contaminants: Part A: Chemistry, Analysis, Control,Exposure & Risk Assessment, 2012, 29(4): 517-525. DOI:10.1080/194 40049.2011.623681.
[5] ZHU Z, LIU G H, WANG F, et al. Development of a liquid chromatography tandem mass spectrometric method for simultaneous determination of 15 aminoglycoside residues in porcine tissues[J].Food Analytical Methods, 2016, 9: 2587-2599. DOI:10.1007/s12161-016-0446-1.
[6] 湛嘉, 朱海强, 王园, 等. 猪肉中强极性-极性化学污染物快速通用筛查法的建立[J]. 中国口岸科学技术, 2020(3): 47-54. DOI:10.3969/j.issn.1002-4689.2020.03.007.
[7] TURNIPSEED S B, CLARK S B, KARBIWNYK C M, et al. Analysis of aminoglycoside residues in bovine milk by liquid chromatography electrospray ion trap mass spectrometry after derivatization with phenyl isocyanate[J]. Journal of Chromatography B, 2009, 877(14/15):1487-1493. DOI:10.1016/j.jchromb.2009.03.025.
[8] 苏晶, 汤立忠, 陈长毅, 等. 高效液相色谱串联质谱法同时测定9 种龙虾中氨基糖苷类和四环素类抗生素残留[J]. 食品工业科技, 2016,37(2): 60-63; 67. DOI:10.13386/j.issn1002-0306.2016.02.003.
[9] 黄原飞, 娄晓祎, 周哲, 等. 分子印迹聚合物固相萃取-超高效液-串联质谱法检测水产品中11 种氨基糖苷类药物残留[J]. 分析化学,2018, 46(3): 454-461. DOI:10.11895/j.issn.0253-3820.171175.
[10] PERKONS I, PUGAJEVA I, BARTEVICS V. Simultaneous screening and quantification of aminoglycoside antibiotics in honey using mixed-mode liquid chromatography with quadrupole time-of-flight mass spectroscopy with heated electrospray ionization[J]. Journal of Separation Science,2018, 41(16): 3186-3194. DOI:10.1002/jssc.201800230.
[11] SALUTI G, DIAMANTI I, GIUSEPPONI D, et al. Simultaneous determination of aminoglycosides and colistins in food[J]. Food Chemistry, 2018, 266: 9-16. DOI:10.1016/j.foodchem.2018.05.113.
[12] 吴云辉, 严丽娟, 沈鹭英, 等. 混合型离子交换液相色谱-串联质谱法测定蜂蜜中5 种氨基糖苷类抗生素残留[J]. 色谱, 2019, 37(5): 499-504. DOI:10.3724/SP.J.1123.2018.11043.
[13] CHIAOCHAN C, KOESUKWIWAT U, YUDTHAVORASIT S, et al.Efficient hydrophilic interaction liquid chromatography-tandem mass spectrometry for the multiclass analysis of veterinary drugs in chicken muscle[J]. Analytica Chimica Acta, 2010, 682(1/2): 117-129.DOI:10.1016/j.aca.2010.09.048.
[14] 王志兵, 高杨, 刘洋, 等. 微波辅助衍生-离子液体分散液液微萃取-高效液相色谱法检测牛奶中氨基糖苷类抗生素残留[J]. 现代食品科技, 2014, 30(4): 260-267.
[15] XU X, LIU Z, ZHAO X, et al. Ionic liquid-based microwaveassisted surfactant-improved dispersive liquid-liquid microextraction and derivatization of aminoglycosides in milk samples[J]. Journal of Separation Science, 2013, 36(3): 585-592. DOI:10.1002/jssc.201200801.
[16] BOHM D A, STACHEL C S, GOWIK P. Validation of a method for the determination of aminoglycosides in different matrices and species based on an in-house concept[J]. Food Additives & Contaminants: Part A: Chemistry, Analysis, Control, Exposure & Risk Assessment, 2013,30(6): 1037-1043. DOI:10.1080/19440049.2013.775709.
[17] ZHU W X, YANG J Z, WEI W, et al. Simultaneous determination of 13 aminoglycoside residues in foods of animal origin by liquid chromatography-electrospray ionization tandem mass spectrometry with two consecutive solid-phase extraction steps[J]. Journal of Chromatography A, 2008, 1207(1/2): 29-37. DOI:10.1016/j.chroma.2008.08.033.
[18] 刘雪红, 张秀芹, 侯颖, 等. 超高效液相色谱-串联质谱法检测牛奶中7 种氨基糖苷类药物残留[J]. 中国兽药杂志, 2015, 49(3): 48-52.
[19] 龚强, 丁利, 朱绍华, 等. 高效液相色谱-串联质谱法检测乳制品中10 种氨基糖苷类抗生素残留[J]. 色谱, 2012, 30(11): 1143-1147.DOI:10.3724/SP.J.1123.2012.06024.
[20] 孙雷, 张俪, 黄耀凌, 等. 超高效液相色谱-串联质谱法检测动物源食品中8 种氨基糖苷类药物残留[J]. 质谱学报, 2009, 30(1): 60-64.
[21] 钱疆, 余孔捷, 陈健, 等. 液相荧光法检测乳制品中9 种氨基糖苷类药物残留[J]. 福建分析测试, 2011, 20(3): 13-17. DOI:10.3969/j.issn.1009-8143.2011.03.004.
[22] 王炼, 刘少琼. 杨碧霞, 等. 基质固相分散-亲水交互作用色谱-串联质谱法测定牛奶中5 种氨基糖苷类抗生素残留量[J]. 中国食品卫生杂志, 2019, 31(3): 222-226. DOI:10.13590/j.cjfh.2019.03.006.
[23] TAO Y F, CHEN D M, YU H, et al. Simultaneous determination of 15 aminoglycoside(s) residues in animal derived foods by automated solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2012, 135(2): 676-683.DOI:10.1016/j.foodchem.2012.04.086.
[24] 李敏青, 徐娟, 王岚, 等. 固相萃取/高效液相色谱-串联质谱法测定植物性食品中链霉素与双氢链霉素[J]. 分析测试学报, 2019, 38(7):859-864. DOI:10.3969/j.issn.1004-4957.2019.07.016.
[25] 方秋华, 刘佩怡, 肖田安, 等. 牛奶中氨基糖苷类药物残留量的测定高效液相色谱串联质谱法[C]//2016年动物药品学分会学术年会优秀论文集. 成都: 中国畜牧兽医学会动物药品学分会, 2016: 231-237.
[26] 全德甫, 王甫, 许少坚, 等. 液相色谱串联质谱法测定猪肉中奈替米星、西索米星和小诺霉素的残留量[J]. 中国卫生检验杂志, 2014,24(10): 1404-1406; 1421.
[27] 安冬. 水产品中氨基糖苷类药物残留检测的液-质联用分析法研究[D].重庆: 西南大学, 2009: 18-37. DOI:10.7666/d.y1460392.
[28] KAUFMANN A, BUTCHER P, MADEN K. Determination of aminoglycoside residues by liquid chromatography and tandem mass spectrometry in a variety of matrices[J]. Analytica Chimica Acta, 2012,711: 46-53. DOI:10.1016/j.aca.2011.10.042.
[29] 王小乔, 邱国玉, 杨志敏, 等. 液质联用高通量检测技术基质效应评价与消除[J]. 现代食品, 2020(12): 44-46. DOI:10.16736/j.cnki.cn41-1434/ts.2020.12.017.
[30] LI Z Z, LIU Y Y, CHEN X J, et al. Affinity-based analysis methods for the detection of aminoglycoside antibiotic residues in animalderived foods: a review[J]. Foods, 2023, 12(8): 1587. DOI:10.3390/foods12081587.
[31] 王帅兵, 曲斌, 耿士伟, 等. 亲水作用色谱-高分辨质谱测定生鲜牛乳中7 种氨基糖苷类药物残留[J]. 动物医学进展, 2017, 38(9): 67-72.DOI:10.3969/j.issn.1007-5038.2017.09.014.
[32] 戴辉, 孟晶, 祖立青, 等. 基于HPLC-MS检测食品中新霉素和潮霉素B的残留量[J]. 山西农经, 2016(18): 97-98; 101. DOI:10.16675/j.cnki.cn14-1065/f.2016.18.075.
[33] 宓捷波, 张敏, 柴铭骏, 等. 亲水作用色谱-串联质谱法测定动物源食品中10 种氨基糖苷类药物的残留量[J]. 食品研究与开发, 2019,40(19): 197-204. DOI:10.12161/j.issn.1005-6521.2019.19.036.
[34] DÍEZ C, GUILLARME D, SPÖRRI A S, et al. Aminoglycoside analysis in food of animal origin with a zwitterionic stationary phase and liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2015, 882: 127-139. DOI:10.1016/j.aca.2015.03.050.
[35] ARSAND J B, JANK L, MARTINS M T, et al. Determination of aminoglycoside residues in milk and muscle based on a simple and fast extraction procedure followed by liquid chromatography coupled to tandem mass spectrometry and time of flight mass spectrometry[J].Talanta, 2016, 154: 38-45. DOI:10.1016/j.talanta.2016.03.045.