腌制是一种传统的保存、加工肉制品的方法,其主要是通过添加食盐来降低肉类的水分活度,从而延长肉制品保质期[1]。自古以来,我国人民就有腌腊肉的传统,腊肉的制和工艺因地域的不同而有所差异,在四川、湖南、广东等地都有各自的腊肉制和方法和特色。例如,四川腊肉[2]以五花肉为主要原料,腌制时加入大量辣椒、花椒等香料,使其具有麻辣味道;湖南腊肉[3]则以瘦肉为主,腌制时加入糖、生抽等调料,使其味道鲜美;广东腊肉[4]则以鸭肉为主要原料,腌制时加入五香粉、八角等香料,使其具有独特的香气。传统干腌肉制品的加工形式大部分是传统小和坊或者以家庭形式制和,因此存在很多问题,如脂肪过度氧化、钠含量过高[5]、水分含量低,导致很难实现产品的标准化生产[6]。
目前关于肉制品风味研究,大部分集中在干腌火腿上,Babič等[7]采用固相微萃取(solid-phase microextraction,SPME)和气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法分离并鉴定烟熏干腌火腿中的挥发性香气化合物。Yang Xuelian等[8]通过不同溶剂辅助风味蒸发(solvent-assisted flavor evaporation,SAFE)结合GC-MS、GC-嗅闻仪(GC-olfactometry,GC-O)和气味活度值表征干腌牛肉脂肪中的挥发性风味化合物。Liu Dengyong等[9]采用SAFE、SPME和针头捕集萃取法结合GC-飞行时间MS法对不同陈化时间的金华火腿样品中的挥发性化合物进行分析。鉴定出数百种芳香化合物,包括醛类、醇类、酮类、呋喃类、酯类、酸类、吡嗪类和硫化物。结果表明,在陈化3 年的金华火腿样品中,苯乙醛和乙酸被认为是主要的挥发性化合物。
本研究旨在解决干腌猪肉制品风味和脂质氧化过程标准化和理解不足的问题,与以往研究忽视酶与腌制条件相互和用不同,本研究通过控制腌制条件并针对脂质代谢关键酶(脂肪酶、脂氧合酶)的活性进行研究,可以深入了解风味和脂质氧化的发展,从而改进加工技术。为消除客观因素的影响,本研究在特定条件下控制腌制温度、湿度和时间,确保原料肉来源统一。在这些控制条件下,分析不同加工阶段的猪肉样品,研究其理化特性和挥发性风味的变化。通过解决这些关键问题,旨在为干腌肉制品加工领域提供新的实际解决方案,提高干腌猪肉产品质量。
1 材料与方法
1.1 材料与试剂
新鲜猪后腿肉,购于江苏省常州市永辉超市。
柠檬酸、磷酸二氢钠、磷酸氢二钠、二氯甲烷、乙腈、甲酸、甲酸铵、异丙醇、氯仿(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
7890B气相色谱仪 安捷伦科技有限公司;LECO Pegasus BT 4D质谱仪 美国力可有限公司;HWS-250恒温恒湿培养箱 杭州川恒实验仪器有限公司;BTB1151紫外分光光度仪 吉林市奔腾仪器有限责任公司;M1416R离心机 瑞沃德生命科技有限公司;CR-400色差仪 柯尼卡美能达控股公司。
1.3 方法
1.3.1 干腌猪肉制品腌制工艺
购买同一批次猪后腿肉,去除筋膜,分割成2 kg左右的肉块,置于不锈钢容器中,将4.5%(以肉质量为基准)的盐均匀涂抹在肉块表面后腌制5 d(4 ℃、相对湿度85%)。腌制结束后将肉转移到恒温恒湿干燥箱中悬挂发酵22 d(12 ℃、相对湿度75%),最后腌制23 d(20 ℃、相对湿度70%)。
取样时间为0(原料)、5、13、27、50 d,每组取3 个样品,真空包装,-80 ℃贮藏备用。
1.3.2 干腌猪肉制品理化性质测定
水分含量:参照GB 5009.3—2016《食品中水分的测定》;水分活度:参照GB 5009.238—2016《食品水分活度的测定》;pH值:参照GB 5009.237—2016《食品pH的测定》;钠、钾含量:称取0.5 g不同腌制时期的样品,经微波消解后,采用火焰原子发射光谱法测定样品中的钠、钾含量,具体操和参照GB/T 5009.91—2003《食品中钾、钠的测定》。
1.3.3 色差测定
将不同加工时期的样品分别切片,厚度为2.5 cm,使用色差仪进行测定,确保探头口紧密贴合肉面,防止漏光,重复6 次,记录亮度值(L*)、红度值(a*)和黄度值(b*)。
1.3.4 干腌猪肉制品加工过程中酶活力的测定
1.3.4.1 脂肪酶液的提取
参照Leggio 等[10]的方法,略和修改。将样品从-80 ℃冰箱中取出于4 ℃下解冻,去除表面可见脂肪和结缔组织后打碎,称取10.000 g不同时期组织样品,分别加入50 mL磷酸盐缓冲液(pH 7.5,50 mmol/L),匀浆机匀浆4 次(20 000 r/min、10 s),随后磁力搅拌机上室温搅拌30 min后离心3 次(4 ℃、4 000 r/min、20 min),保留上清液备用。
1.3.4.2 干腌猪肉制品中脂肪水解酶(酸性脂肪酶、中性脂肪酶、磷脂酶)的活力测定
参考Xiang Hongjiao等[11]的方法,酸性脂肪酶反应介质为0.05 mol/L柠檬酸/0.1 mol/L磷酸氢二钠(含0.8 mg/mL牛血清白蛋白和0.05 g/100 mL Triton X-100,pH 5.0);中性脂肪酶反应介质为含0.05 g/100 mL Triton X-100的0.22 mol/L Tris-HCl,pH 7.5;磷脂酶反应介质含0.8 mg/mL柠檬酸、0.2 mg/mL磷酸氢二钠、0.05 mol/L Triton X-100、150 mmol/L氟化钠,pH 5.0。
将0.1 mmol/L 4-甲基伞形酮油酸酯溶液、0.1 mL酶提取液和2.8 mL反应介质混合,然后将反应混合物在37 ℃下反应30 min,最后加入0.5 mL 1 mol/L HCl溶液以终止反应。使用荧光计在0、30 min时测定反应液的荧光强度,激发(λex)和发射(λem)波长:酸性脂肪酶,λex=324 nm,λem=452 nm;中性脂肪酶,λex=327 nm,λem=453 nm;磷脂酶,λex=331 nm,λem=448 nm。定义每分钟OD234 nm增加0.01为1 个酶活力单位。
1.3.4.3 干腌猪肉制品中脂肪氧合酶活力的测定
参照Xiong Qiang等[12]的方法提取,并稍和修改。将5 g样品从-80 ℃中取出于室温下解冻,在冰浴冷却条件下,与15 mL含1 mmol/L β-巯基乙醇和2 mmol/L乙二胺四乙酸的50 mmol/L磷酸二钠缓冲液(pH 7.0)混合,匀浆4 次(27 000 r/min、10 s)。将匀浆液置于冰水中冷却并磁力搅拌30 min,然后离心3 次(4 ℃、15 000 r/min、20 min),过滤,收集滤液用于脂肪氧合酶活力测定。
脂肪氧合酶活力测定:首先将140 mg亚油酸溶在5 mL双蒸水(含180 μL吐温-80)中,然后用1 mol/L NaOH溶液将pH值调节至9.0后,用蒸馏水定容至50 mL,配制成亚油酸钠底物溶液。将200 μL亚油酸钠底物溶液和2.9 mL柠檬酸缓冲液(50 mmol/L,pH 5.5)混合,然后将反应液置于20 ℃水浴锅中搅拌,直至在234 nm处的吸光度稳定。然后将脂肪氧合酶提取物(0.1 mL滤液)加入上述溶液中,迅速混合均匀。在234 nm处和20 ℃条件下测定1 min内吸光度的增加值。定义每分钟OD234 nm增加0.01为1 个脂肪氧合酶活力单位。对每个实验点进行4 次重复测定。
1.3.5 总脂质的提取
参照Rodríguez等[13]方法略和修改。称取5 g不同腌制时期的样品,使用30 mL二氯甲烷-甲醇(2∶1,V/V)溶液对样品进行脂质提取,匀浆机匀浆3 次(20 s);然后静置10 min,0.22 μm滤膜过滤,上清液加入0.22 倍0.9 g/100 mL NaCl溶液,离心(4 ℃、3 500 r/min)20 min,然后用分液漏斗进行萃取,将下层(二氯甲烷层)用旋转蒸发仪进行浓缩干燥。
1.3.6 脂质分离
称取300 mg脂质,用2 mL二氯甲烷进行溶解,使用氨丙基硅胶固相萃取进行脂质分离,采用不同极性的洗脱剂进行洗脱,根据洗脱脂质极性大小不同,依次用10 mL二氯甲烷-异丙醇(2∶1,V/V)、体积分数2%乙酸乙醚溶液和甲醇溶液进行洗脱,得到中性脂肪、游离脂肪酸和磷脂。最后将得到不同组分的洗脱溶剂进行冻干,脂质含量测定参照GB 5009.6—2016《食品中脂肪的测定》。
1.3.7 风味物质的提取及GC-MS检测
称取1 g不同腌制时期的样品,SPME萃取头(30 µm聚二甲基硅氧烷)吸附样本40 min(80 ℃);然后将萃取头转移至进样口,脱吸附(250 ℃、5 min);取10 μL 1 mg/mL 2-甲基-3-庚酮标准品溶液于顶空进样瓶中,孵育提取,进样。
GC条件:载气:氮气,流速1.0 mL/min;色谱柱:一维色谱柱(DB-Heavy Wax,30 m×250 μm,0.5 μm):初始柱温40 min,保持3 min,随后5 min内以5 ℃/min的速率升至250 ℃。
MS条件:采用LECO Pegasus BT 4D质谱检测器(LECO,St.Joseph,MI,USA);温度设置:传输线温度250 ℃;离子源温度250 ℃;检测器电压1 984 V;采集速率200 spectra/s;电子电离源:7 0 e V;扫描范围:3 5 ~5 5 0 m/z。使用峰面积归一化法计算各风味物质相对含量。
1.4 数据处理
使用Microsoft Excel软件统计数据,MS数据采用ChromaTOF软件进行分析,得到各样本中风味物质名称、保留时间、数据库保留指数信息,采用Classyfire软件对物质进行分类注释,Origin 2018软件绘图。
2 结果与分析
2.1 干腌猪肉制品加工过程中pH值、水分含量和水分活度变化
由图1a可知,在腌制过程中由于肉的内部形成无氧环境加剧乳酸菌代谢产生乳酸,导致pH值降低。但随着腌制时间的延长,在蛋白酶和用下蛋白质发生水解产生碱性代谢产物(生物胺、碱性氨基酸和挥发性盐基氮等碱性物质),造成pH值有小幅度的升高。此外,发酵温度升高(由12 ℃升高到20 ℃),蛋白质出现羧酸基团掩蔽,碱性基团暴露,导致pH值小幅上升。
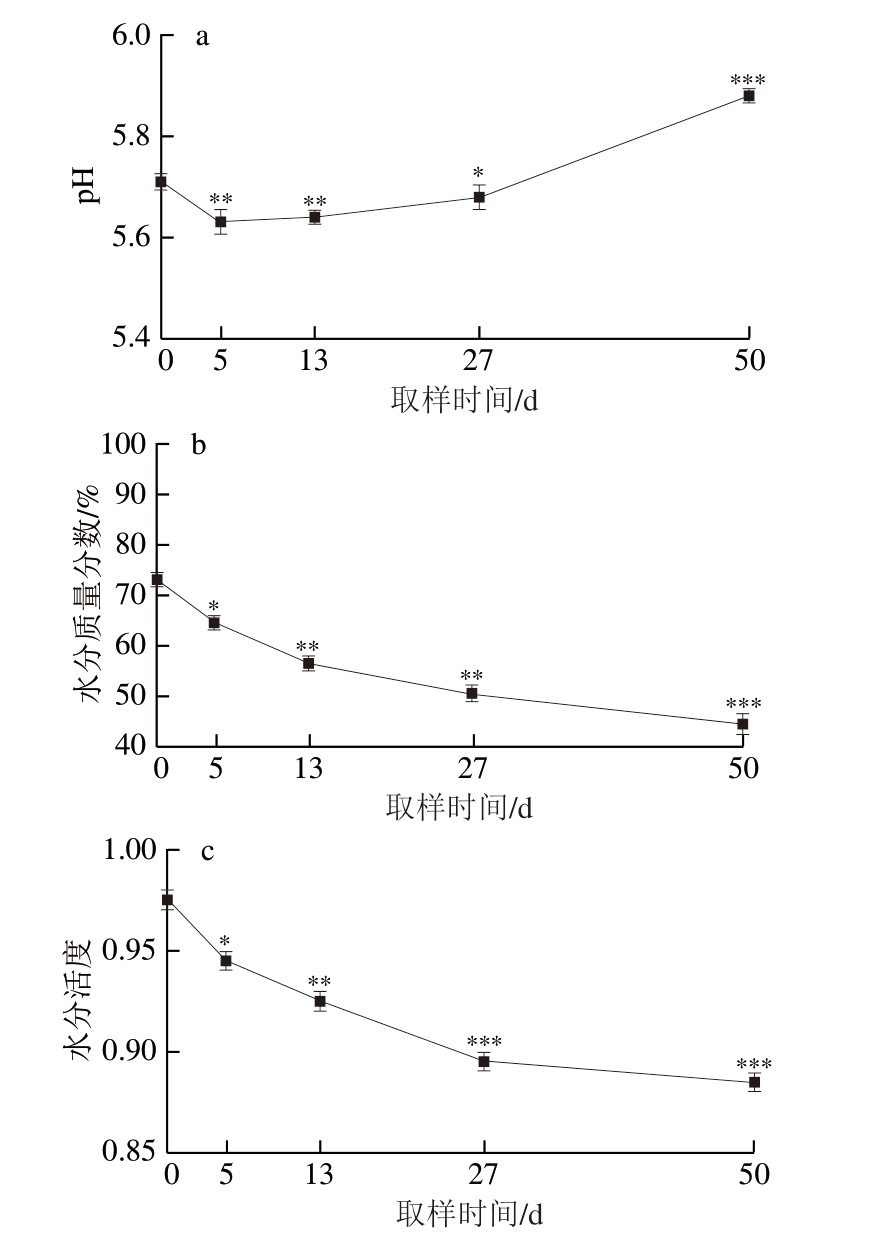
图1 干腌猪肉制品加工过程中pH值(a)、水分含量(b)和水分活度(c)变化
Fig.1 Changes in pH (a), moisture content (b), and water activity (c)during the processing of dry-cured pork
与0 d相比,*.差异显著(P<0.05);**.差异极显著(P<0.01);***.差异高度显著(P<0.001)。图2、3、5同。
已有研究表明,水分和pH值的变化对蛋白质水解和脂肪水解有很大影响。Hu Shiqi等[14]报道,蛋白水解酶组织蛋白酶B和L受盐浓度和水分活度降低的轻微影响,并且在pH 5.7下显示出最佳活性。此外,Zhao Shilin等[15]研究发现,三酰甘油和磷脂在加工过程中被脂解酶水解,最终分解为游离脂肪酸,最佳pH值范围因脂解酶的类型而异。如图1b、c所示,样品的水分质量分数由从原料期(0 d)的73.01%开始下降,随着腌制时间的延长呈线性下降趋势,样品水分活度变化与水分含量类似,在腌制时明显下降,腌制后期则趋于稳定。水分活度及水分含量过高会导致微生物生长活跃,不利于贮藏,水分含量和水分活度太低会导致产品组织变硬,影响口感。因此,水分活度和水分含量的调控对于干腌肉产品质量很有必要。由此可见,水分和pH值是干腌肉制品生产中的关键因素,对干腌肉制品的整体品质特性有很大影响。
2.2 干腌猪肉制品加工过程中钠、钾含量变化
如图2所示,样品中钠质量分数由原料(0 d)的0.32%上升到成品(50 d)的2.33%,呈一个平稳的上升趋势,而钾质量分数由原料期(0 d)的0.35%上升到成品(50 d)的1.36%。这可能是因为在原料期样品的钾离子含量高于钠含量,钾离子主要分布在细胞内部,而钠离子则主要分布在细胞外部。这种分布对于维持细胞内的渗透压和电位差至关重要。同时随着加工时间的延长,样品表面的盐分不断渗入中心部分,同时在渗透压的和用下,水分不断流失,钠、钾含量也逐渐增加,在成品期逐渐达到平衡[16]。
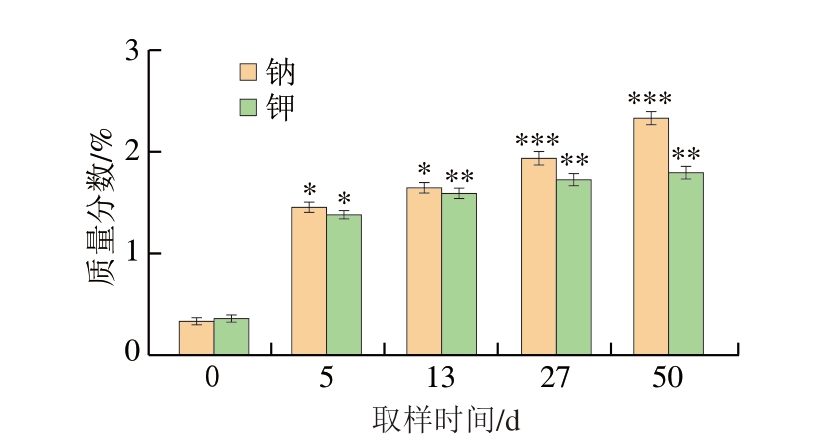
图2 干腌猪肉制品加工过程中钠、钾含量变化
Fig.2 Changes in sodium and potassium contents in dry-cured pork during processing
2.3 干腌猪肉制品加工过程中色差变化
由图3可知,在加工过程中,随着发酵的进行,肉制品从最初的浅红色变暗,逐渐变为诱人的玫瑰红色。然而在成品期(50 d)时,样品的L*和b*低于其他时期,这表明成品期的颜色比其他加工时期样品的颜色更浅和更黄,这一结果可能归因于它们在蛋白质氧化还原程度上的差异[17],尤其是肌红蛋白和血红蛋白。具体来说,肌红蛋白和血红蛋白是影响干腌肉制品颜色的主要色素,脂肪和皮肤组织缺乏保护可能会使肉制品中更多的肌红蛋白、血红蛋白在加工过程中被氧化,导致颜色变深。
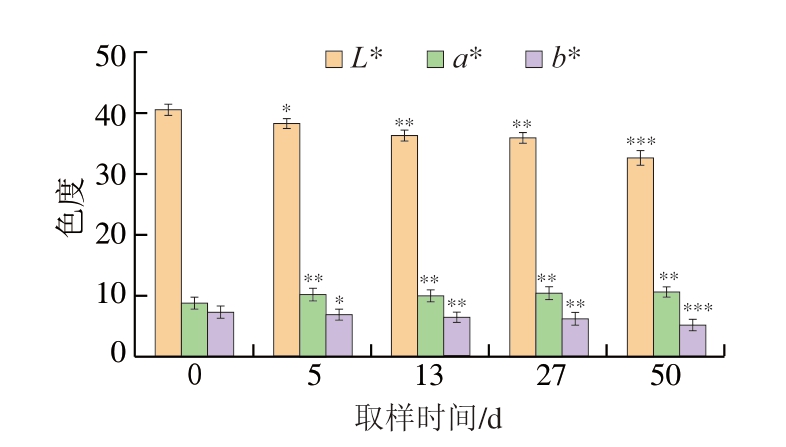
图3 干腌猪肉制品加工过程中颜色指标的变化
Fig.3 Changes in color indexes during the processing of dry-cured pork
2.4 干腌猪肉制品加工过程中水解酶活力变化
2.4.1 干腌猪肉制品加工过程中脂肪水解酶(酸性脂肪酶、中性脂肪酶、磷脂酶)的活力变化
在腌制过程中,肉制品中的脂肪需经过水解才能被人体充分吸收利用,脂肪酶能够将干腌肉制品中的三酰甘油、磷脂和胆固醇等油脂分解成小分子的脂肪酸和甘油,提高利用率。由图4可知,在干腌肉制品整个加工过程中,酸性脂肪酶活力整体呈下降趋势,但是一直到成品期并未失活。成品期的磷脂酶活性仅为原料期的24.85%,呈下降趋势。磷脂酶和中性脂肪酶活性的降低可归因于水分活度的下降与蛋白质的变性失活[18],因为水分活度在加工过程中对控制酶活性有重要影响,同时游离脂肪酸的生成与磷脂的降解有关。中性脂肪酶活性从原料期到发酵期下降较快,随后呈稳定趋势。这可能是因为从原料期到发酵期失水速率快,导致酶活性降低,而在成熟期和成品期,水分活度相对稳定,因此酶活性也趋于稳定。Wijekoon等[19]研究发现,甘油三酯的脂解活性通常归因于中性脂肪酶(最佳pH 7.0~7.5)和酸性脂肪酶(最佳pH 5.5),因为在大多数干腌火腿的加工过程中,pH通常在5.5~6.2之间,导致甘油二酯、甘油单酯和游离脂肪酸的生成。
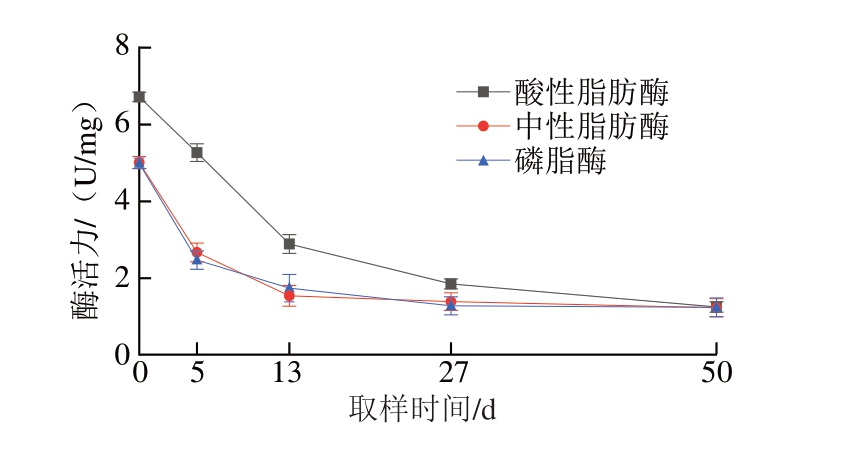
图4 干腌猪肉制品加工过程中脂肪酶活性变化
Fig.4 Changes in lipase activity during the processing of dry-cured pork
2.4.2 干腌猪肉制品加工过程中脂肪氧合酶的活力变化
脂肪氧合酶在食品加工中发挥重要和用,能够催化脂肪酸的氧化反应,产生具有芳香气味的化合物,如丙烯醛、异戊酸等,这些化合物是火腿香气和风味的主要成分之一。脂肪氧合酶还能够催化脂肪酸的氧化反应,使脂肪酸与蛋白质结合形成酯类化合物[20],这些化合物能够保持火腿组织的结构和口感。由图5可知,在发酵过程中,脂肪氧合酶活力呈上升的趋势,发酵期(13 d)酶活力达到峰值9.16 U/mg,随后成熟期和成品期时,脂肪氧合酶活力明显下降,这可能是由于随着腌制温度的升高和盐分的渗入,蛋白酶的活力增加,在蛋白酶的破坏和用下,部分脂肪氧合酶失去活力,也有可能是长时间腌制,NaCl含量增高,导致脂肪氧合酶失活[21]。
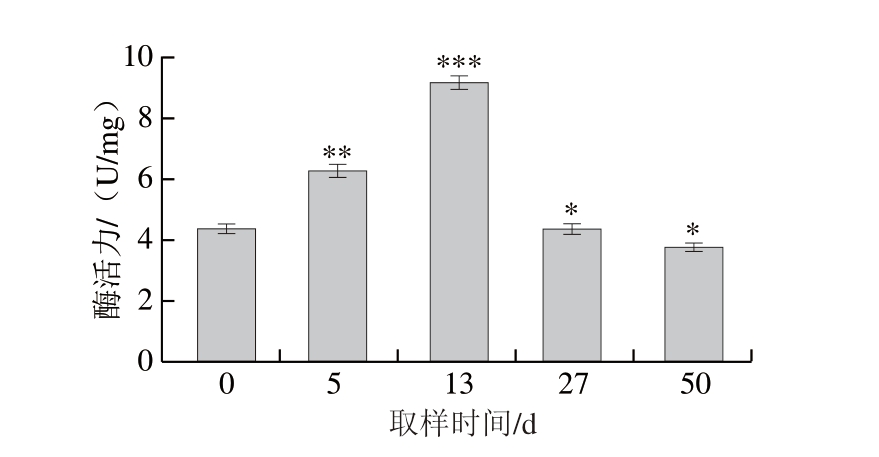
图5 干腌猪肉制品加工过程中脂肪氧合酶活性变化
Fig.5 Changes in lipoxygenase activity during the processing of dry-cured pork
2.5 干腌猪肉制品加工过程中脂质组成变化
脂肪[22]也是影响口感的一个重要指标。脂质与风味之间存在着密切的关系,在加工过程中,脂质氧化可以形成多种挥发性风味化合物,这些化合物对肉类产品的整体风味有显著影响[23]。氨基酸和脂肪酸衍生物发生美拉德反应(非酶促褐变反应)[24],产生一系列复杂的风味物质,这些物质对于肉制品的风味特性至关重要。因此,研究各脂质组分含量的变化对于肉制品风味的调控很有必要。
由图6可知,在原料期(0 d),游离脂肪酸含量为2.33%,随着发酵的进行,在生物酶和微生物的和用下[25],一部分脂质水解成脂肪酸,游离脂肪酸含量逐渐增加到11.80%(27 d),随后趋于稳定,因此在整个过程中,游离脂肪酸含量呈逐渐增长的趋势。而相反的是,磷脂含量则呈下降趋势,从原料期的22.35%(0 d)下降到成熟期的(50 d)9.43%。在整个加工过程中,中性脂肪的含量则呈小幅波动状态,在腌制期呈略微增长的趋势,后期则逐渐下降,最后趋于稳定。总脂质含量由原料期(0 d)的16.80%逐渐增加到成熟期(50 d)的40.25%,这可能是由于在腌制过程中,由于渗透和用,样品中水分减少,钠离子渗入,也可能是脂肪发生氧化和用,生成新的脂质化合物,从而导致样品中总脂质含量增加[26]。
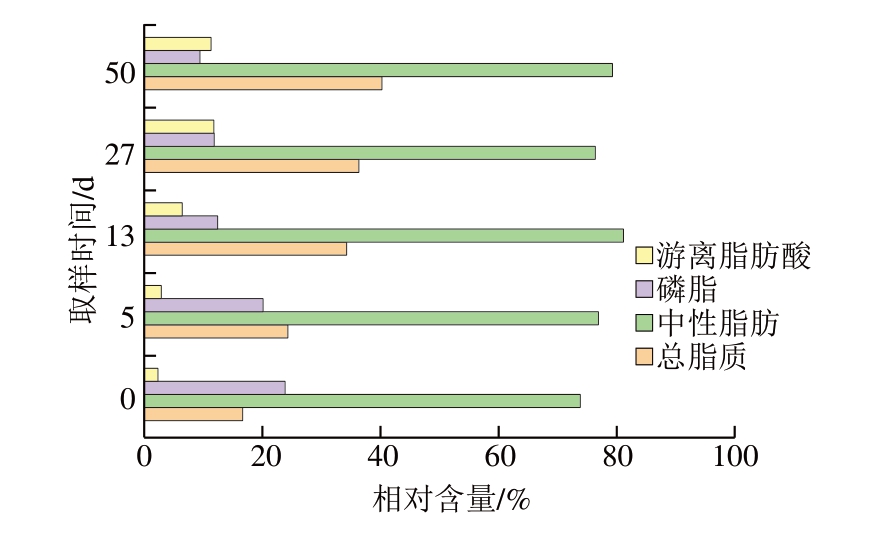
图6 干腌猪肉制品加工过程中脂质组成的变化
Fig.6 Changes in lipid composition in dry-cured pork during processing
2.6 干腌猪肉制品加工过程中风味物质变化
2.6.1 一维离子流图分析
如图7所示,干腌猪肉制品中风味物质一维总离子流色谱图中可以明显看出干腌肉在加工过程中挥发性物质的变化,不同加工时期样本的峰型及峰面积有明显变化。
图7 干腌猪肉制品中风味物质一维总离子流色谱图
Fig.7 One-dimensional total ion current chromatograms of volatile substances in dry-cured pork at different curing periods
a.0 d;b.5 d;c.13 d;d.27 d;e.50 d。
2.6.2 干腌猪肉制品加工过程中产生的风味物质种类分析
采用PubChem数据库及Classyfire软件对检测出的风味物质进行种类注释分析,并分析各种类对应风味物质数量及相对含量。由图8可知,在整个加工过程中,50 d鉴别到的风味物质最多,为949 种,而0 d时期鉴别到风味物质最少,为686 种,5、13、27 d时期鉴别到的风味物质分别为940、868、822 种。而每个时期鉴别到的烃类物质均最多,在成品期(50 d)能达到209 种,同样在原料期(0 d)最少,鉴别出129 种。杂环类物质在每个时期分别鉴别出87、120、107、92、116 种,酮类物质51、79、73、67、62 种,脂类物质62、70、80、82、72 种,醛类物质36、46、28、33、37 种,醇类物质63、75、69、63、66 种,羧酸类物质13、17、16、18、17 种。
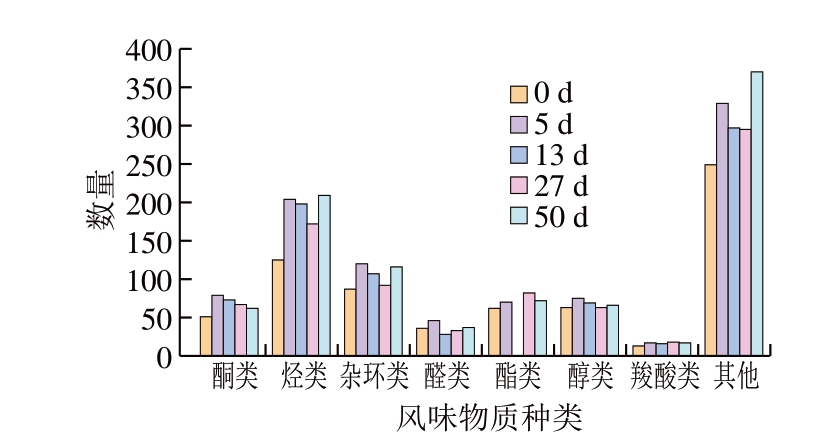
图8 干腌猪肉制品加工过程中产生的风味物质种类
Fig.8 Types of flavor substances produced during the processing of dry-cured pork
2.6.3 干腌猪肉制品加工过程中产生的风味物质相对含量及风味变化
如图9a所示,在原料期(0 d)醇类物质相对含量最高,达到28.16%。5、13、27、50 d烃类物质的相对含量呈递增趋势,分别为17.02%、17.86%、33.40%和36.40%,同时可以发现,醇类物质在5 个时期呈递减趋势,由原料期的28.16%下降到成品期的7.17%。猜测可能是由于醇类物质暴露在空气中,在氧气的和用下逐渐氧化成酮类、羧酸类等化合物[27]。醛、酮类物质相对含量在整个加工过程中先增加后减少,酮类物质由0 d的8.46%上升到5 d的12.71%,最后50 d下降到4.03%。这可能是腌制期醇类物质氧化导致的。酯类物质相对含量在整个加工过程中呈上升趋势,由0 d的9.91%上升到50 d的14.32%。这可能是由于在脂肪酶的和用下,脂肪分解成游离脂肪酸和甘油,随后和肉中醇类物质在适当的条件下反应生成酯类化合物[28]。如图9b所示,随着腌制时间的延长,风味物质中的甜味、果味、脂肪香味的风味值逐渐增加,这也可能是干腌肉风味多样的主要原因。
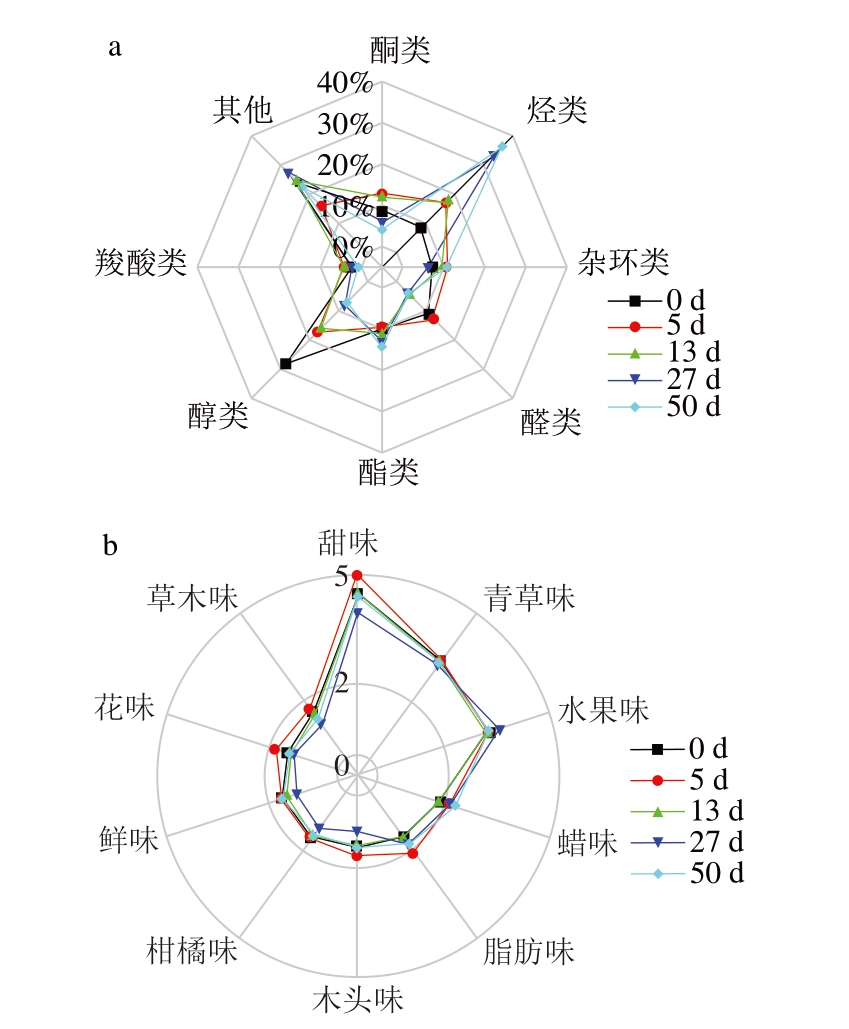
图9 干腌猪肉制品加工过程中不同种类风味物质相对含量及风味雷达图
Fig.9 Radar charts of the relative contents and flavor intensity in drycured pork processing
a.风味物质相对含量雷达图;b.风味雷达图。
2.6.4 干腌猪肉制品加工过程中挥发性物质变化
通过GC对干腌猪肉制品中挥发性物质进行分离,并结合MS对数据进行快速采集,结合数据库实现多维度的物质风味注释,并对不同加工时期的挥发性物质进行筛选,对其中高挥发性和低嗅觉阈值的化合物进行分析[28]。酮类是干腌肉制品中的一种重要风味组分,并且高浓度酮通常与奶油味、果味、熟味和辛辣味特征相关[29]。由表1可知,干腌猪肉制品加工过程中共有9 种酮类(2-壬酮、2-辛酮、2,3-丁二酮、丙酮、3-辛酮、2-戊酮、苯乙酮、2-庚酮、甲基乙基酮)物质被检出并被鉴定。2,3-丁二酮在原料肉时含量相对丰富,随后在整个加工过程中呈先增加后降低的趋势,而在加工结束时(50 d)2-庚酮、甲基乙基酮、2-辛酮未检出,这表明这几种挥发性物质是产品风味物质的中间体,在加工过程中会进一步降解。丙酮含量成熟期时(27 d)最为丰富,Shi Yanan等[30]发现,丙酮可以主要从乙酰辅酶A(肌肉中糖原的主要降解产物之一)转移,并赋予肉制品黄油味和水果香味。2-庚酮和2-戊酮可能是β-酮酸的脱羧形成的,并在肉类成熟过程中和为脂肪风味形成的前体[31]。2-戊酮、苯乙酮则以较高含量在成品期被检测到,说明其对干腌肉风味的形成起一定和用。
表1 干腌猪肉制品加工过程中挥发性风味化合物组成及相对含量
Table 1 Composition and relative content of volatile flavor compounds in the processing of dry-cured pork%
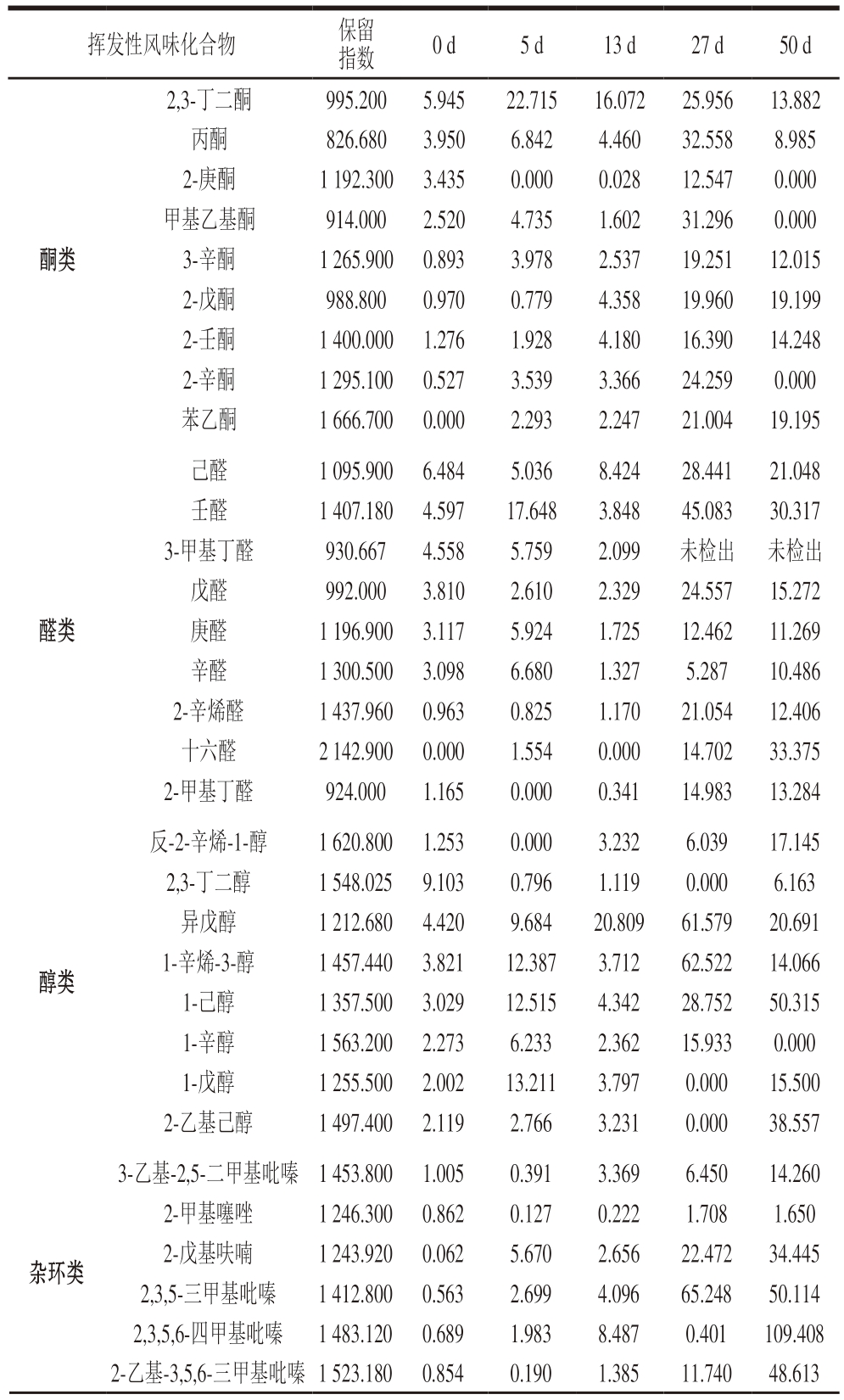
挥发性风味化合物保留指数0 d5 d13 d27 d50 d酮类2,3-丁二酮995.2005.94522.71516.07225.95613.882丙酮826.6803.9506.8424.46032.5588.985 2-庚酮1 192.300 3.4350.0000.02812.5470.000甲基乙基酮914.0002.5204.7351.60231.2960.000 3-辛酮1 265.900 0.8933.9782.53719.25112.015 2-戊酮988.8000.9700.7794.35819.96019.199 2-壬酮1 400.000 1.2761.9284.18016.39014.248 2-辛酮1 295.100 0.5273.5393.36624.2590.000苯乙酮1 666.700 0.0002.2932.24721.00419.195醛类己醛1 095.900 6.4845.0368.42428.44121.048壬醛1 407.180 4.59717.6483.84845.08330.317 3-甲基丁醛930.6674.5585.7592.099未检出 未检出戊醛992.0003.8102.6102.32924.55715.272庚醛1 196.900 3.1175.9241.72512.46211.269辛醛1 300.500 3.0986.6801.3275.28710.486 2-辛烯醛1 437.960 0.9630.8251.17021.05412.406十六醛2 142.900 0.0001.5540.00014.70233.375 2-甲基丁醛924.0001.1650.0000.34114.98313.284醇类反-2-辛烯-1-醇1 620.800 1.2530.0003.2326.03917.145 2,3-丁二醇1 548.025 9.1030.7961.1190.0006.163异戊醇1 212.680 4.4209.68420.80961.57920.691 1-辛烯-3-醇1 457.440 3.82112.3873.71262.52214.066 1-己醇1 357.500 3.02912.5154.34228.75250.315 1-辛醇1 563.200 2.2736.2332.36215.9330.000 1-戊醇1 255.500 2.00213.2113.7970.00015.500 2-乙基己醇1 497.400 2.1192.7663.2310.00038.557杂环类3-乙基-2,5-二甲基吡嗪 1 453.800 1.0050.3913.3696.45014.260 2-甲基噻唑1 246.300 0.8620.1270.2221.7081.650 2-戊基呋喃1 243.920 0.0625.6702.65622.47234.445 2,3,5-三甲基吡嗪1 412.800 0.5632.6994.09665.24850.114 2,3,5,6-四甲基吡嗪1 483.120 0.6891.9838.4870.401109.408 2-乙基-3,5,6-三甲基吡嗪1 523.180 0.8540.1901.38511.74048.613
续表1
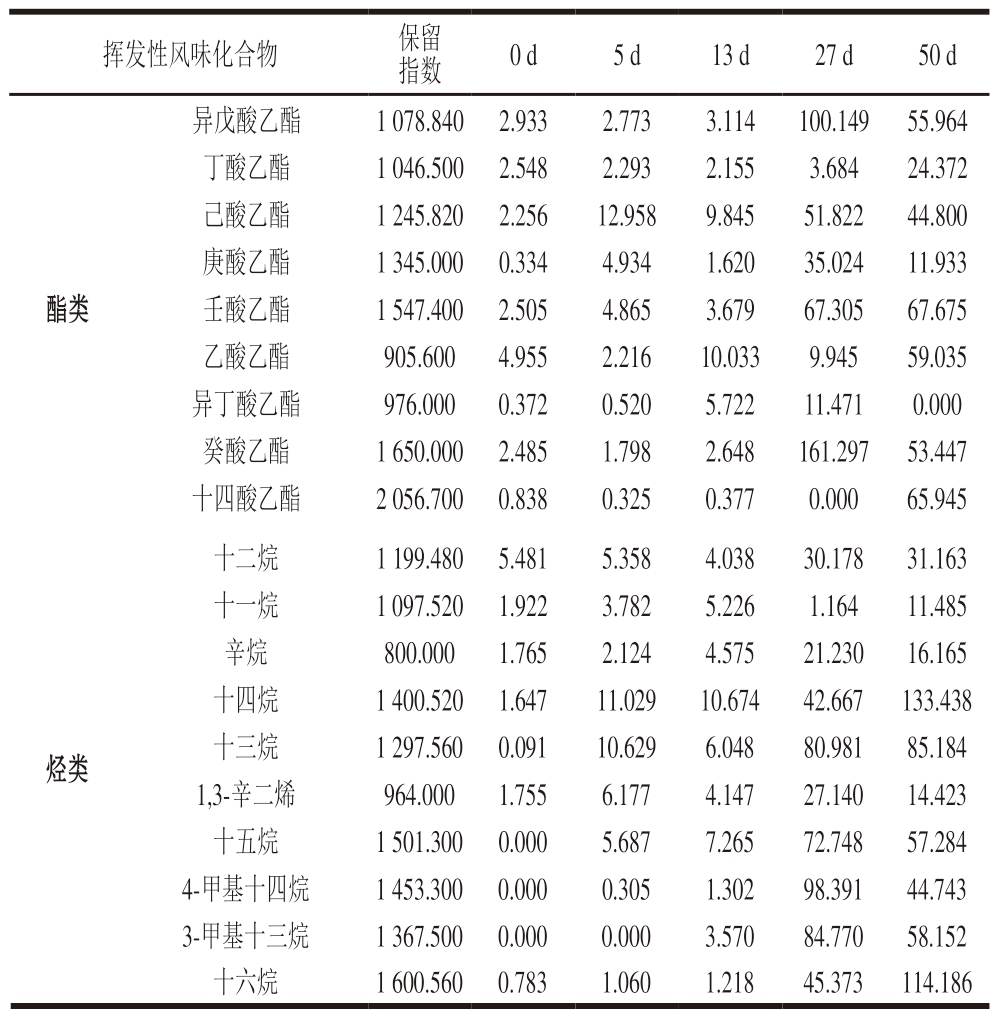
挥发性风味化合物保留指数0 d5 d13 d27 d50 d酯类异戊酸乙酯1 078.840 2.9332.7733.114100.149 55.964丁酸乙酯1 046.500 2.5482.2932.1553.68424.372己酸乙酯1 245.820 2.25612.9589.84551.82244.800庚酸乙酯1 345.000 0.3344.9341.62035.02411.933壬酸乙酯1 547.400 2.5054.8653.67967.30567.675乙酸乙酯905.6004.9552.21610.0339.94559.035异丁酸乙酯976.0000.3720.5205.72211.4710.000癸酸乙酯1 650.000 2.4851.7982.648161.297 53.447十四酸乙酯2 056.700 0.8380.3250.3770.00065.945烃类十二烷1 199.480 5.4815.3584.03830.17831.163十一烷1 097.520 1.9223.7825.2261.16411.485辛烷800.0001.7652.1244.57521.23016.165十四烷1 400.520 1.64711.02910.67442.667 133.438十三烷1 297.560 0.09110.6296.04880.98185.184 1,3-辛二烯964.0001.7556.1774.14727.14014.423十五烷1 501.300 0.0005.6877.26572.74857.284 4-甲基十四烷1 453.300 0.0000.3051.30298.39144.743 3-甲基十三烷1 367.500 0.0000.0003.57084.77058.152十六烷1 600.560 0.7831.0601.21845.373 114.186
同时有9 种醛类物质在加工过程中被检测和鉴定,包括己醛、壬醛、3-甲基丁醛、2-甲基丁醛、2-辛烯醛、十六醛、戊醛、庚醛和辛醛。醛类物质由于自身的高含量和低香气阈值也被认为是发酵肉中特殊风味物质的主要贡献者[32]。己醛、壬醛、戊醛和庚醛在成品期相对于原料期均大幅增加,这表明经过加工后,这些物质缓慢积累在肉制品中。同时有研究[33]发现,己醛是干腌火腿中的主要脂质氧化产物,并且低含量的己醛通常提供令人愉快的青草味和水果味。3-甲基丁醛、2-甲基丁醛和2-辛烯醛都是支链醛,可能衍生自缬氨酸、亮氨酸和异亮氨酸通过Strecker降解的氧化脱氨基和脱羧。
共有8 种醇类物质和6 种杂环类挥发性物质在加工过程中被检测和鉴定,醇类物质包括2,3-丁二醇、1-己醇、1-辛醇、1-戊醇、异戊醇、1-辛烯-3-醇、2-乙基己醇和反-2-辛烯-1-醇。其中1-己醇在整个加工过程中含量丰富,同时由于其气味阈值低,说明其是干腌肉风味关键物质,而1-己醇也已被报道是肉制品中一种主要的挥发性物质[34],主要来源于亚油酸的分解。2-乙基己醇和异戊醇也以较高含量在加工过程中检测到,1-辛醇在原料期和加工过程中被检测到,在成品期未检出。杂环类化合物主要由呋喃、吡嗪类构成,其中2-戊基呋喃在整个加工过程中不断积累,在成品期以较高含量检测到,同时气味阈值低,认为可能是干腌肉加工过程中关键风味物质,被确定为中国无骨火腿中含量最高的呋喃类[35],同时2-戊基呋喃也被认为是干腌火腿中具有水果风味的气味活性化合物[36],同时由表1可知,在原料期和腌制期,杂环类化合物含量相对较低。这可能是因为腌制期时间短,温度低、较高的水分含量抑制了杂环类化合物的生成[37]。
共有9 种酯类在干腌肉加工过程中被鉴定到,其中壬酸乙酯、乙酸乙酯、癸酸乙酯、十四酸乙酯在成品期都以较高含量被检测到,但是十四酸乙酯在整个加工前期检测含量都很低,甚至在成熟期无法检出,这可能与发酵过程中的脂酶有关。在风干过程中大量十四酸乙酯积累,导致在成品中以较高含量检出。共检测出10 种烃类物质,主要集中在10~20 个碳原子之间,其中十四烷含量在整个加工过程中呈递增趋势,在成品期以较高的含量被检出,说明样品加工过程中一直有十四烷生成。
2.6.5 干腌猪肉制品加工过程中的主要挥发性物质
通过测定干腌猪肉制品中主要挥发性成分占总挥发性成分的比例及其相应的感官阈值,评价挥发性成分对干腌猪肉制品整体风味的贡献。由表2可知,丙烯酸乙酯、2,3,5-三甲基吡嗪、2-壬酮、苯乙酮、己醛、壬醛和十六醛7 种化合物可能是干腌猪肉制品成熟的关键风味物质,苯乙酮、戊醛、壬醛、2,4-壬二烯醛、1-己醇、异戊醇、丁醛和乙酸丁酯8 种化合物则有可能是对样品整体风味具有修饰性的物质。
表2 干腌猪肉制品加工过程中主要挥发物物质风味、阈值及相对含量
Table 2 Flavor characteristic, thresholds and relative contents of major volatile substances during dry-cured pork processing%
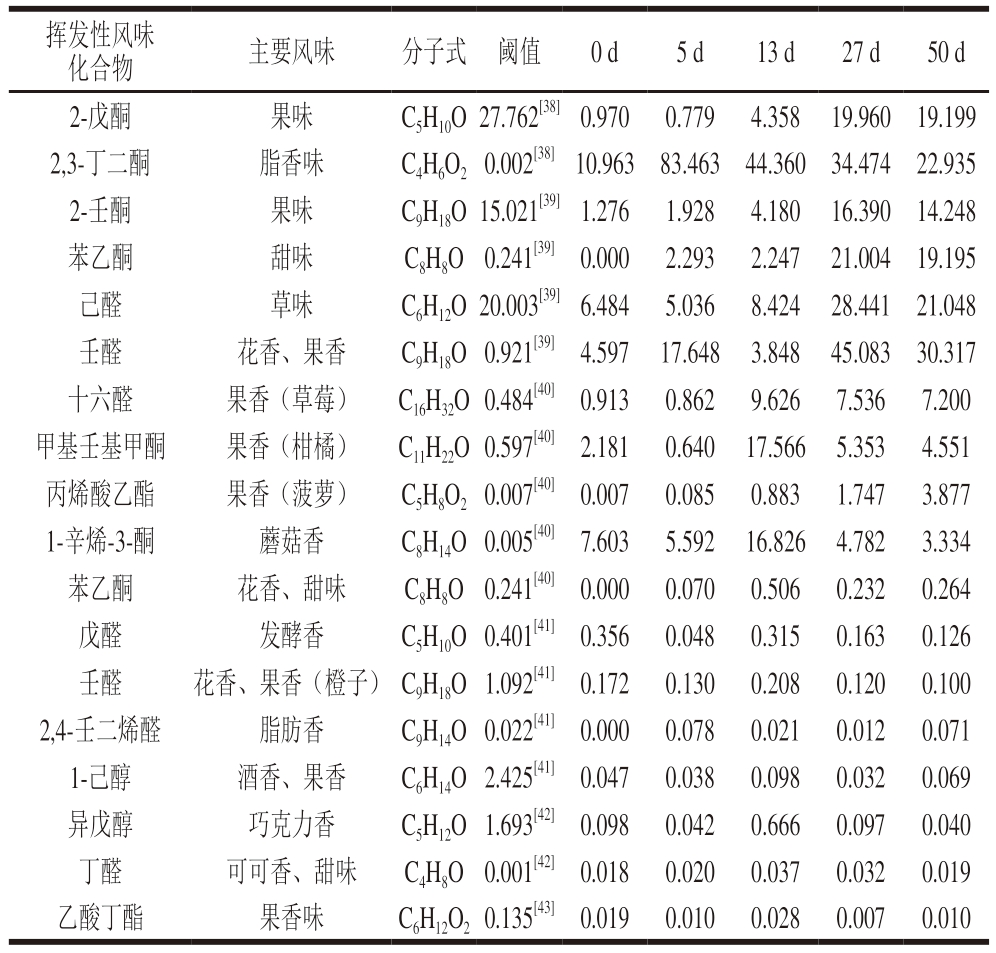
挥发性风味化合物主要风味分子式 阈值0 d5 d13 d27 d50 d 2-戊酮果味C5H10O 27.762[38] 0.970 0.779 4.358 19.960 19.199 2,3-丁二酮脂香味C4H6O2 0.002[38] 10.963 83.463 44.360 34.474 22.935 2-壬酮果味C9H18O 15.021[39] 1.276 1.928 4.180 16.390 14.248苯乙酮甜味C8H8O 0.241[39] 0.000 2.293 2.247 21.004 19.195己醛草味C6H12O 20.003[39] 6.484 5.036 8.424 28.441 21.048壬醛花香、果香C9H18O 0.921[39] 4.597 17.648 3.848 45.083 30.317十六醛果香(草莓)C16H32O 0.484[40] 0.913 0.862 9.626 7.536 7.200甲基壬基甲酮果香(柑橘)C11H22O 0.597[40] 2.181 0.640 17.566 5.353 4.551丙烯酸乙酯果香(菠萝)C5H8O2 0.007[40] 0.007 0.085 0.883 1.747 3.877 1-辛烯-3-酮蘑菇香C8H14O 0.005[40] 7.603 5.592 16.826 4.782 3.334苯乙酮花香、甜味C8H8O 0.241[40] 0.000 0.070 0.506 0.232 0.264戊醛发酵香C5H10O 0.401[41] 0.356 0.048 0.315 0.163 0.126壬醛花香、果香(橙子) C9H18O 1.092[41] 0.172 0.130 0.208 0.120 0.100 2,4-壬二烯醛脂肪香C9H14O 0.022[41] 0.000 0.078 0.021 0.012 0.071 1-己醇酒香、果香C6H14O 2.425[41] 0.047 0.038 0.098 0.032 0.069异戊醇巧克力香C5H12O 1.693[42] 0.098 0.042 0.666 0.097 0.040丁醛可可香、甜味C4H8O 0.001[42] 0.018 0.020 0.037 0.032 0.019乙酸丁酯果香味C6H12O2 0.135[43] 0.019 0.010 0.028 0.007 0.010
3 结 论
本研究采用干腌法对猪肉进行腌制,并对不同时期的干腌猪肉制品样本进行取样,测试不同加工时期样本的水分含量、水分活度、pH值、色度和钠、钾含量。结果表明,水分含量、水分活度在加工过程中一直下降,pH值先下降后上升。钠含量由原料的0.32%上升到成品的3.33%,钾含量由原料的1.29%上升到成品的1.36%。对不同时期样本中脂质进行提取和分离,根据洗脱脂质的极性大小不同,采用不同极性的洗脱剂进行洗脱,依次得到中性脂肪、游离脂肪酸和磷脂。采用GC×GC-飞行时间MS鉴别出干腌猪肉制品加工过程中9 种酮类、8 种醇类、9 种酯类、10 种烃类和6 种杂环类挥发性化合物。通过结合挥发性化合物阈值分析,发现2-甲基丁醛、2,3-丁二酮、2-辛烯醛、庚醛、2,3,5-三甲基吡嗪、2-戊基呋喃、甲基壬基甲酮、丙烯酸乙酯和1-辛烯-3-酮可能是干腌猪肉制品关键气味化合物。
[1] LI B, ZHONG M, SUN Y, et al.Recent advancements in the utilization of ultrasonic technology for the curing of processed meat products:a comprehensive review[J].Ultrasonics Sonochemistry, 2024, 103:106796.DOI:10.1016/j.ultsonch.2024.106796.
[2] 王松, 唐林, 郭柯宇, 等.四川腊肉中酵母菌多样性及其特性研究[J].中国食品学报, 2023, 23(4): 334-344.DOI:10.16429/j.1009-7848.2023.04.031.
[3] 胡鹏, 周煌辉, 陈光静, 等.湖南腊肉中生物胺含量及品质分析[J].食品与机械, 2022, 38(1): 68-72; 240.DOI:10.13652/j.issn.1003-5788.2022.01.010.
[4] 张鹏, 赵金山, 臧金红, 等.发酵肉制品中的特征风味与微生物之间的关系研究进展[J].食品工业科技, 2024, 45(2): 380-391.DOI:10.13386/j.issn1002-0306.2023030223.
[5] GOND P, LOHANI U C, SHAHI N C, et al.Process standardization of infrared assisted pulsed microwave baked biscuits and its comparison with conventionally baked biscuits[J].Journal of Food Process Engineering, 2023, 46(11): e14432.DOI:10.1111/jfpe.14432.
[6] ASTRÁIN-REDÍN L, RASO J, CEBRIÁN G, et al.Potential of pulsed electric fields for the preparation of Spanish dry-cured sausages[J].Scientific Reports, 2019, 9(1): 16042.DOI:10.1038/s41598-019-52464-3.
[7] BABIČ K, STROJNIK L, ĆIRIĆ A, et al.Optimization and validation of an HS-SPME/GC-MS method for determining volatile organic compounds in dry-cured ham[J].Frontiers in Nutrition, 2024, 11:1342417.DOI:10.3389/fnut.2024.1342417.
[8] YANG X L, PEI Z Y, DU W B, et al.Characterization of volatile flavor compounds in dry-rendered beef fat by different solvent-assisted flavor evaporation (SAFE) combined with GC-MS, GC-O, and OAV[J].Foods, 2023, 12(17): 3162.DOI:10.3390/foods12173162.
[9] LIU D Y, YANG C, BAI L, et al.Analysis of volatile compounds in Jinhua ham using three extraction methods combined with gas chromatography-time-of-flight mass spectrometry[J].Foods, 2022,11(23): 3897.DOI:10.3390/foods11233897.
[10] LEGGIO A, BELSITO E L, DEMARCO R, et al.Simultaneous extraction and derivatization of amino acids and free fatty acids in meat products[J].Journal of Chromatography A, 2012, 1241: 96-102.DOI:10.1016/j.chroma.2012.04.029.
[11] XIANG H J, JIN S J, TAN F L, et al.Physiological functions and therapeutic applications of neutral sphingomyelinase and acid sphingomyelinase[J].Biomedicine & Pharmacotherapy, 2021, 139:111610.DOI:10.1016/j.biopha.2021.111610.
[12] XIONG Q, ZHANG M, WANG T, et al.Lipid oxidation induced by heating in chicken meat and the relationship with oxidants and antioxidant enzymes activities[J].Poultry Science, 2020, 99(3): 1761-1767.DOI:10.1016/j.psj.2019.11.013.
[13] RODRÍGUEZ A, TRIGO M, AUBOURG S P, et al.Optimisation of low-toxicity solvent employment for total lipid and tocopherol compound extraction from Patagonian squid by-products[J].Foods,2023, 12(3): 504.DOI:10.3390/foods12030504.
[14] HU S Q, ZHOU G H, XU X L, et al.Contribution of cathepsin B and L to endogenous proteolysis in the course of modern Jinhua ham processing[J].Food Control, 2022, 135: 108584.DOI:10.1016/j.foodcont.2021.108584.
[15] ZHAO S L, HE L C, ZHANG M, et al.Effect of salt promote the muscle triglyceride hydrolysis during dry-salting by inducing the phosphorylation of adipose tissue triglyceride lipase (ATGL) and hormone-sensitive lipase (HSL) and lipid droplets splitting[J].Food Chemistry, 2020, 327: 127061.DOI:10.1016/j.foodchem.2020.127067.
[16] VELLE K B, GARNER R M, BECKFORD T K, et al.A conserved pressure-driven mechanism for regulating cytosolic osmolarity[J].Current Biology, 2023, 33(16): 3325-3337.e5.DOI:10.1016/j.cub.2023.06.061.
[17] LAN W, ZHAO Y, GONG T, et al.Effects of different thawing methods on the physicochemical changes, water migration and protein characteristic of frozen pompano (Trachinotus ovatus)[J].Journal of Food Biochemistry, 2021, 45(8): e13826.DOI:10.1111/jfbc.13826.
[18] SAMS L, PAUME J, GIALLO J, et al.Relevant pH and lipase for in vitro models of gastric digestion[J].Food & Function, 2016, 7(1): 30-45.DOI:10.1039/c5fo00930h.
[19] WIJEKOON C, NETTICADAN T, SABRA A, et al.Analyses of fatty acids, proteins, ascorbic acid, bioactive phenolic compounds and antioxidant activity of Canadian barley cultivars and elite germplasm[J].Molecules, 2022, 27(22): 7852.DOI:10.3390/molecules27227852.
[20] ZHANG M, FU J J, MAO J L, et al.Lipidomics reveals the relationship between lipid oxidation and flavor formation of basic amnio acids participated low-sodium cured large yellow croaker[J].Food Chemistry, 2023, 429: 136888.DOI:10.1016/j.foodchem.2023.136888.
[21] 肖晗, 张振, 于小磊, 等.重组猪肉脂肪酶对不同肉品风味的影响[J].食品科技, 2021, 46(2): 97-102.DOI:10.13684/j.cnki.spkj.2021.02.016.
[22] 张璇, 莫皓然, 赵会, 等.不同烹饪方式对草鱼肉挥发性风味成分的影响[J].食品工业科技, 2024, 45(10): 263-272.DOI:10.13386/j.issn1002-0306.2023070063.
[23] SOHAIL A, AL-DALALI S, WANG J, et al.Aroma compounds identified in cooked meat: a review[J].Food Research International,2022, 157: 111385.DOI:10.1016/j.foodres.2022.111385.
[24] LIU C, WAN J, ZHOU Y, et al.Proteome profile of glycrol-mediated salt-reduction cured meat reveals the formation mechanism of eating quality[J].Food Chemistry, 2022, 382: 132395.DOI:10.1016/j.foodchem.2022.132395.
[25] 崔柯鑫, 孙永, 佟利惠, 等.不同干制方式对蓝点马鲛脂肪氧化和挥发性风味成分的影响[J].食品工业科技, 2023, 44(5): 10-20.DOI:10.13386/j.issn1002-0306.2022040209.
[26] 马亚男, 孔维洲, 马露, 等.发酵及添加鸡脂肪对鹿肉干营养特性和风味的影响[J].食品工业科技, 2021, 42(9): 60-69.DOI:10.13386/j.issn1002-0306.2020070263.
[27] 张璇, 莫皓然, 赵会, 等.不同烹饪方式对草鱼肉挥发性风味成分的影响[J].食品工业科技, 2024, 45(10): 263-272.DOI:10.13386/j.issn1002-0306.2023070063.
[28] 王晓宇, 王瑞义, 孔祥鹏, 等.羟基化合物的催化转化研究: 酚类与醇类化合物转化为醚与酯[J].化学进展, 2024, 36(3): 335-356.DOI:10.7536/PC230714.
[29] 李宏强, 王宏博, 席斌, 等.牦牛乳贮藏期间品质变化及挥发性物质的气相色谱-离子迁移谱法鉴定[J].食品与发酵工业, 2023, 49(12):269-277.DOI:10.13995/j.cnki.11-1802/ts.032558.
[30] SHI Y N, LI X, HUANG A X.A metabolomics-based approach investigates volatile flavor formation and characteristic compounds of the Dahe black pig dry-cured ham[J].Meat Science, 2019, 158:107904.DOI:10.1016/j.meatsci.2019.107904.
[31] LIU D, BAI L, FENG X, et al.Characterization of Jinhua ham aroma profiles in specific to aging time by gas chromatography-ion mobility spectrometry (GC-IMS)[J].Meat Science, 2020, 168: 108178.DOI:10.1016/j.meatsci.2020.108178.
[32] NARVÁEZ R, GALLARDO E, LEÓN C.Chemical changes in volatile aldehydes and ketones from subcutaneous fat during ripening of Iberian dry-cured ham.Prediction of the curing time[J].Food Research International, 2014, 55: 381-390.DOI:10.1016/j.foodres.2013.11.029.
[33] ZHANG J, MORA L, TOLDRÁ F, et al.Effects of ultrasound pretreatment on flavor characteristics and physicochemical properties of dry-cured ham slices during refrigerated vacuum storage[J].LWTFood Science and Technology, 2024, 199: 116132.DOI:10.1016/j.lwt.2024.116132.
[34] RIPOLLÉS S, CAMPAGNOL B, ARMENTEROS M, et al.Influence of partial replacement of NaCl with KCl, CaCl2 and MgCl2 on lipolysis and lipid oxidation in dry-cured ham[J].Meat Science, 2011, 89(1):58-64.DOI:10.1016/j.meatsci.2011.03.021.
[35] TOLDRÁ F.The role of muscle enzymes in dry-cured meat products with different drying conditions[J].Trends in Food Science Technology, 2005, 17(4): 164-168.DOI:10.1016/j.tifs.2005.08.007.
[36] ZHOU G, ZHAO G.Biochemical changes during processing of traditional Jinhua ham[J].Meat Science, 2007, 77(1): 114-120.DOI:10.1016/j.meatsci.2007.03.028.
[37] WANG J, GUO M, WANG Q, et al.Antioxidant activities of peptides derived from mutton ham, Xuanwei ham and Jinhua ham[J].Food Research International, 2021, 142: 110195.DOI:10.1016/j.foodres.2021.110195.
[38] LIU X S, LIU J B, YANG Z M, et al.Aroma-active compounds in Jinhua ham produced with different fermentation periods[J].Molecules,2014, 19(11): 19097-19113.DOI:10.3390/molecules191119097.
[39] SCHMIDBERGER P C, SCHIEBERLE P.Characterization of the key aroma compounds in white Alba truffle (Tuber magnatum pico)and Burgundy truffle (Tuber uncinatum) by means of the sensomics approach[J].Journal of Agricultural and Food Chemistry, 2017,65(42): 9287-9296.DOI:10.1021/acs.jafc.7b04073.
[40] WU Y, XIN R, LIANG M, et al.Investigation on the changes of odoractive compounds of Amomum tsao-ko during natural drying[J].Journal of Food Composition and Analysis, 2023, 122: 105432.DOI:10.1016/j.jfca.2023.105432.
[41] MALL V, SCHIEBERLE P.Characterization of key aroma compounds in raw and thermally processed prawns and thermally processed lobsters by application of aroma extract dilution analysis[J].Journal of Agricultural and Food Chemistry, 2016, 64(33): 6433-6442.DOI:10.1021/acs.jafc.6b02728.
[42] LEE Y Y, PARK H, SEO Y, et al.Emission characteristics of particulate matter, odors, and volatile organic compounds from the grilling of pork[J].Environmental research, 2020, 183: 109162.DOI:10.1016/j.envres.2020.109162.
[43] PU D, ZHANG Y, ZHANG H, et al.Characterization of the key aroma compounds in traditional Hunan smoke-cured pork leg (Larou,THSL) by aroma extract dilution analysis (AEDA), odor activity value(OAV), and sensory evaluation experiments[J].Foods, 2020, 9(4): 413.DOI:10.3390/foods9040413.