我国和为全球最大的羊肉生产和消费国,2023年羊肉产量达到531万 t,比2013年增加30.12%,高于同期世界羊肉平均增长水平。伴随着羊肉产量的增加,羊皮等加工副产物也随之增加。据统计,我国每年约产出3亿 张羊皮,但羊皮加工率不足10%,造成极大的资源浪费[1]。羊皮主要成分为水、蛋白质、少量脂肪和矿物质,其中蛋白质含量超过30%,且以胶原蛋白为主[2]。胶原蛋白具有较高的营养价值及良好的亲水性、生物相容性和生物降解性等,还具有保护细胞、促进伤口愈合、抑制血管紧张素I转换酶活性等功效[3],可和为肉冻、糖果的增稠剂、改善冰淇淋口感的发泡剂,也可加工成可降解薄膜材料等[4],在食品领域具有广阔的应用前景。
目前,胶原蛋白提取方法主要包括酸法、碱法、热水法和酶法等[5]。传统的酸、碱法提取方式存在破坏胶原蛋白结构、影响其生物活性和功能性,提取过程中产生的废液污染环境等问题;酶解法因具有良好的反应选择性、对胶原蛋白破坏较小、提取产品纯度高而被广泛采用。单一酶解法存在提取率低、提取时间长、成本高等缺点,常与化学方法相结合,以弥补传统提取方法的不足[6-7]。高压可通过破坏细胞结构促进胶原蛋白展开,从而提高提取率。已有较多高压提取蛋白方法的报道,如高压提取鲶鱼肌原纤维蛋白、高压辅助超声提取红巨藻藻红蛋白等[8]。超声波通过在液体中产生强烈的湍流,从而增强传质,提高化学反应速率,进而提高提取率,缩短提取时间[8-9]。研究发现,碱可能会削弱胶原中的氢键并破坏部分共价键,因此在碱处理过程中,超声辅助会破坏胶原结构[9]。传统酶法获得的胶原蛋白产量较低,但木瓜蛋白酶可以裂解端肽区域的肽,可在一定程度上提高胶原蛋白产量[5]。超声辅助酶法可有效提高胶原蛋白产量和纯度,缩短提取时间。在超声辅助胃蛋白酶提取牛肌腱胶原时,与仅使用酶法相比,超声辅助提取效率和所得胶原质量均有所提高[9]。
反向传播(back propagation,BP)神经网络是应用最广泛的神经网络模型之一,但其运行具有一定的随机性,每次运行结果存在差异。遗传算法(genetic algorithm,GA)是一种模拟生物进化过程的优化算法,通过模拟自然选择、交叉和变异过程搜索最优解[10-11]。为进一步提升BP神经网络性能,采用GA对BP神经网络的网络权重和偏置进行优化,使BP神经网络最终预测值的均方误差(mean square error,MSE)最小化,从而获得最优BP神经网络预测模型。GA-BP神经网络和响应面法均可用于优化生产工艺。综上,本研究拟采用高压-超声-酶解法提取羊皮胶原蛋白,以高压(121 ℃、100 kPa)时间、超声(4 ℃、140 W)时间、酶添加量、酶解时间为因素,以胶原蛋白提取率为评价指标,对比分析GA-BP神经网络模型和响应面模型在羊皮胶原蛋白提取工艺优化中的效果,确定羊皮胶原蛋白的最佳提取参数,以期为羊皮胶原蛋白的提取和开发提供新思路。
1 材料与方法
1.1 材料与试剂
羊皮源于青海欧拉绵羊,采集后置于-80 ℃冷冻柜保存备用。
木瓜蛋白酶(300000 U/g)、羟脯氨酸(hydroxyproline,HYP)含量检测试剂盒、MD1444-5m透析袋(截留分子质量14 000 Da) 北京索莱宝科技有限公司;乙酸、盐酸、氢氧化钠、乙醇(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
HV-501高压蒸汽灭菌器 日本Hirayama公司;Powersonic 520超声波清洗机 韩国HST公司;LGJ-12A真空冷冻干燥机 北京四环起航科技有限公司;EMS-19磁力搅拌器 天津欧诺仪器仪表有限公司;UV-1700紫外分光光度计 日本岛津公司;FT/IR-4100分光光度计 日本Jasco公司;Spectra Max 190全波长酶标仪 美国Molecular Devices公司;PL2002电子天平梅特勒-托利多仪器(上海)有限公司;Sorvall Lynx 6000超速离心机 赛默飞世尔科技(中国)有限公司;FCR1000-UF-E超纯水机 青岛富勒姆科技有限公司。
1.3 方法
1.3.1 羊皮胶原蛋白制备
1.3.1.1 羊皮预处理
去除羊皮样品表面毛发和皮下脂肪,将其剪成1 cm×1 cm小块,35 ℃蒸馏水清洗2 次,5 倍体积脱脂溶液(40 ℃温水和1 mol/L碳酸钠(2∶1,V/V))浸泡10 min,再次用蒸馏水清洗,重复此步骤2 次,即可得脱脂羊皮样品,真空冷冻干燥。称取10 g干燥后的羊皮样品,在4 ℃、体积分数1.5%盐酸中浸泡5 h,料液比1∶5(g/mL)[11-12]。
1.3.1.2 高压-超声-酶解法和传统酶解法提取羊皮胶原蛋白
高压-超声-酶解法(联合处理组)提取羊皮胶原蛋白:参考王艳茹[8]、Sun Man[9]等的方法并修改,采用1 mol/L氢氧化钠溶液将1.3.1.1节酸提液pH值调节至6,高压(121 ℃、100 kPa)处理,冷却后进行超声处理(4 ℃、140 W)。然后按照酶解温度51 ℃、pH 6.0、木瓜蛋白酶添加量4%、酶解时间240 min进行酶解[13-14]。将上清液转移至透析袋(14 000 Da),将透析袋放入10 倍体积蒸馏水中,持续搅拌透析48 h,每4 h换1 次水,最后进行冷冻干燥,从而得到羊皮胶原蛋白[15]。
传统酶解法(对照组)提取羊皮胶原蛋白:采用1 mol/L氢氧化钠溶液将1.3.1.1节酸提液pH值调节至6,木瓜蛋白酶添加量4%、酶解温度51 ℃、酶解时间240 min[11-12]。其余过程同上。
1.3.2 单因素试验设计
在超声时间30 min、酶添加量4%、酶解时间240 min条件下,考察高压时间(15、20、25、30、35 min)对羊皮胶原蛋白提取率的影响;在高压时间20 min、酶添加量4%、酶解时间240 min条件下,考察超声时间(15、20、25、30、35 min)对羊皮胶原蛋白提取率的影响;在高压时间20 min、超声时间30 min、酶解时间240 min条件下,考察酶添加量(2.0%、2.5%、3.0%、3.5%、4.0%)对羊皮胶原蛋白提取率的影响;在高压时间20 min、超声时间30 min、酶添加量4%条件下,考察酶解时间(150、180、210、240、270 min)对羊皮胶原蛋白提取率的影响。
1.3.3 响应面试验设计
根据单因素试验结果,采用Box-Behnken设计4因素3水平的组合试验,以提取率为指标进行优化,响应面试验因素及水平如表1所示。
表1 响应面试验因素及水平
Table 1 Codes and levels of independent variables used in response surface analysis
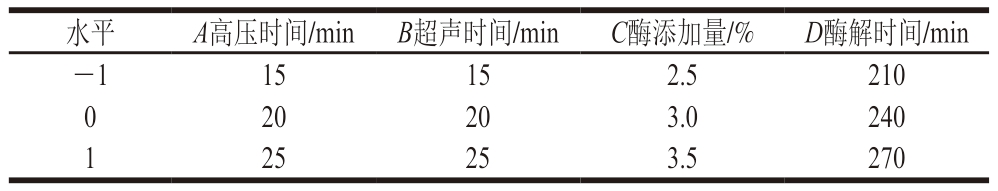
水平A高压时间/minB超声时间/minC酶添加量/%D酶解时间/min-115152.5210 0 20203.0240 1 25253.5270
1.3.4 羊皮胶原蛋白提取率测定
称取约0.2 g羊皮胶原蛋白冻干样品于玻璃管,将组织尽量剪碎以便消化,盖子稍松不密闭。加入2 mL 6 mol/L盐酸溶液,煮沸2~6 h,消化至没有大的可见团块,冷却后用10 mol/L NaOH溶液(约1 mL)调节pH值至6~8,蒸馏水定容至4 mL,25 ℃、10 000×g离心20 min。首先,上清液加入0.1 mL氧化剂溶液(7 g/100 mL氯胺T和乙酸盐/柠檬酸盐缓冲液的混合物,1∶4(V/V),pH 6),充分混合[16-17];然后加入1.3 mL Ehrlich试剂溶液(2 g对二甲氨基苯甲醛溶于3 mL 60%(V/V)高氯酸溶液,按照体积比3∶13与异丙醇混合);最后将混合物于60 ℃水浴加热20 min,不断搅拌,然后在自来水中冷却2~3 min。酶标仪预热30 min,调节波长为560 nm,以HYP质量浓度(0.2~30.0 μg/mL)为横坐标,相应的吸光度为纵坐标制和标准曲线,线性方程为y=0.018 5x+0.001 6,以羊皮、冻干样品吸光度计算其HYP含量,单位为μg/g,由HYP含量计算胶原蛋白含量[18]。羊皮胶原蛋白提取率按照下式计算:
式中:m1为提取的胶原蛋白质量/g;m0为羊皮中胶原蛋白质量/g。
1.3.5 紫外-可见光谱测定
将羊皮胶原蛋白冻干样品溶解于0.3 mol/L乙酸溶液,配制成2 mg/mL胶原蛋白溶液,置于1 cm比色皿中,在200~300 nm波长范围内对其进行扫描[19]。
1.3.6 傅里叶变换红外光谱测定
将羊皮胶原蛋白冻干样品与干燥的溴化钾以1∶100(m/m)混合,研磨并压成颗粒,将样品置于样品室,红外光谱扫描范围400~4 000 cm-1,分辨率1 cm-1。基于酰胺I带峰(1 600~1 700 cm-1)的积分面积,使用二阶导数和反卷积计算二级结构的相对含量[20]。
1.3.7 神经网络分析
GA-BP神经网络模型结合了GA和BP算法,GA用于优化神经网络参数,BP算法用于对神经网络进行训练[21]。基于Matlab R2018b软件,将响应面试验数据用于训练神经网络模型,建立包含输入层、隐含层和输出层的BP神经网络模型。利用GA确定最佳隐含层节点数,以提高模型的预测性能[22-23]。以相关系数(R2)、平均绝对误差(mean absolute error,MAE)、MSE、均方根误差(root mean square error,RMSE)、平均绝对百分比误差(mean absolute percentage error,MAPE)为模型性能评价指标,选择合适的模型进行提取工艺条件优化[24-25]。
1.4 数据处理与分析
提取率测定设置3 次平行实验,数据表示为 ±s。采用Excel 2022、IBM SPSS 20、GraphPad Prism 10.2软件进行数据分析、单因素方差分析、Duncan多重检验和图形绘制,采用Design Expert 8.0软件对Box-Behnken设计结果进行响应面分析。使用Matlab R2018b软件训练优化神经网络模型。
±s。采用Excel 2022、IBM SPSS 20、GraphPad Prism 10.2软件进行数据分析、单因素方差分析、Duncan多重检验和图形绘制,采用Design Expert 8.0软件对Box-Behnken设计结果进行响应面分析。使用Matlab R2018b软件训练优化神经网络模型。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 高压时间对羊皮胶原蛋白提取率的影响
由图1A可知,随高压时间延长,羊皮胶原蛋白提取率呈现先上升后下降的趋势,高压处理20 min时,提取率达到最大值(64.4%)。这可能是因为短时间高压处理可有效破坏细胞结构,促进胶原蛋白提取,而长时间高压处理则可能导致胶原蛋白结构凝聚,从而抑制后续的酶解反应,降低胶原蛋白提取率。有研究表明,超高压处理对牛蛙皮胶原蛋白特性有显著影响,低压水平下胶原蛋白分子的热稳定性增加,但高压水平下的结果相反[15,17]。因此,选择高压时间15~25 min进行后续响应面试验。
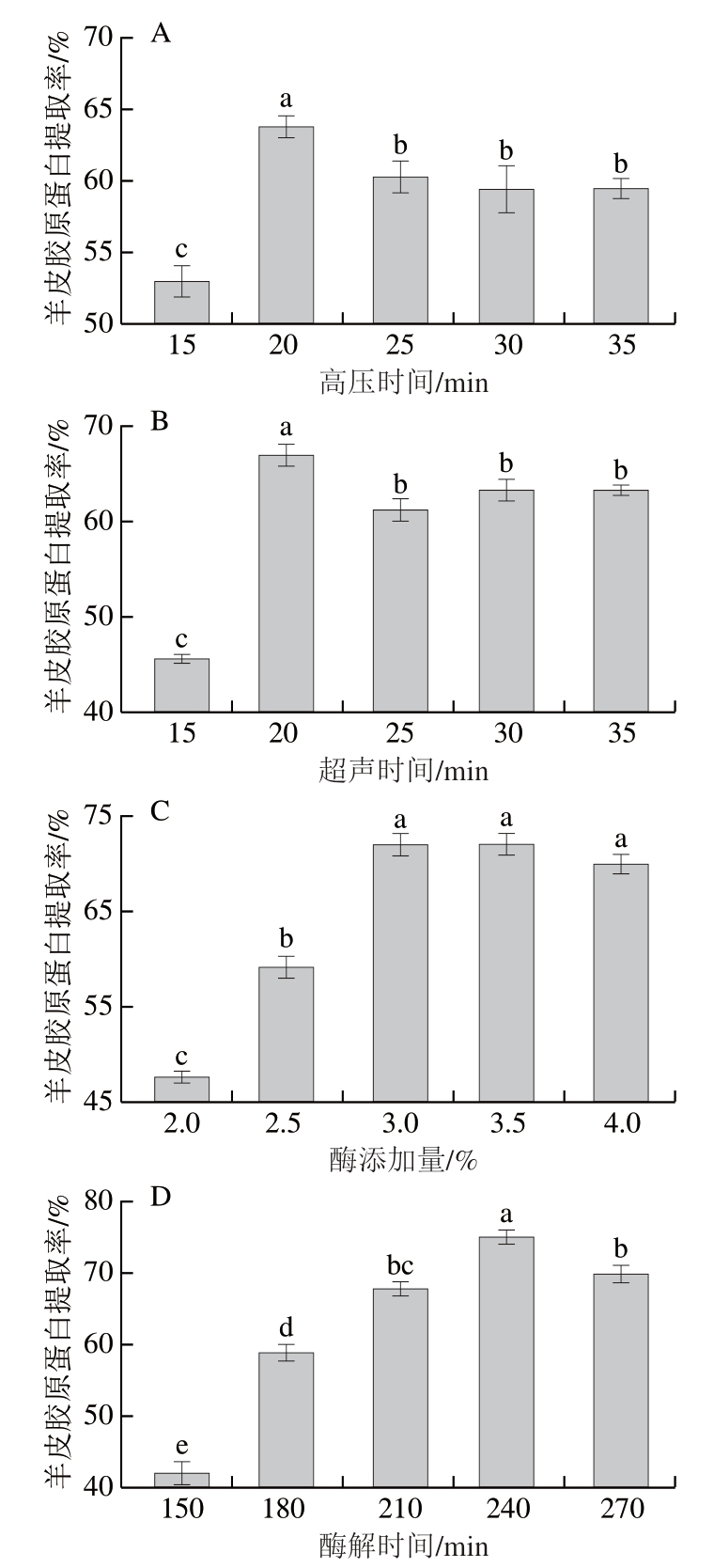
图1 高压时间(A)、超声时间(B)、酶添加量(C)和酶解时间(D)对羊皮胶原蛋白提取率的影响
Fig.1 Effects of high-pressure holding time (A), ultrasound time (B),enzyme dosage (C), and hydrolysis time (D) on the extraction rate of collagen from sheep skin
小写字母不同表示组间差异显著(P<0.05)。
2.1.2 超声时间对羊皮胶原蛋白提取率的影响
由图1B可知,随超声时间延长,羊皮胶原蛋白提取率迅速增加,在20 min时达到最大值(67.5%),随后提取率开始下降。研究表明,适当的超声处理可以提高蛋白质提取率,但过长的超声时间可能会导致胶原蛋白提取率降低,这可能是由于超声空化和用增加导致蛋白质表面活性位点暴露或破坏,从而阻碍了进一步的酶水解反应[16,26]。此外,超声波的机械和用和热效应会引起胶原蛋白变性和降解,从而导致胶原蛋白提取率进一步下降[27]。因此,选择超声时间15~25 min进行后续响应面试验。
2.1.3 酶添加量对羊皮胶原蛋白提取率的影响
由图1C可知,酶添加量从2.0%增加到3.0%时,胶原蛋白提取率显著提高(P<0.05),在酶添加量3.0%时,提取率达到最大值(70.38%)。这可能是因为酶添加量低于3.0%时,随着木瓜蛋白酶的增加,底物与酶之间充分结合,提高了胶原蛋白提取率[28];当酶添加量超过3.0%时,胶原蛋白与酶的结合位点达到饱和,因此随着酶添加量的进一步增加,胶原蛋白提取率不再增加。考虑到成本问题,选择酶添加量2.5%~3.5%进行后续响应面试验。
2.1.4 酶解时间对羊皮胶原蛋白提取率的影响
由图1D可知,酶解时间从150 min延长到240 min时,胶原蛋白提取率显著提高(P<0.05),在酶解时间240 min时,提取率达到最大(73.31%)。当酶解时间小于240 min时,底物与酶充分结合,酶促反应充分,提取率随提取时间延长而提高;酶解时间240~270 min时,胶原蛋白与酶结合趋于饱和,提取率随酶解时间缓慢下降,而且,酶解时间过长,胶原蛋白结构可能遭到破坏,生成小分子多肽。因此,综合考虑时间成本和胶原蛋白提取率,选择酶解时间210~270 min进行后续响应面试验。
2.2 响应面优化试验结果分析
根据单因素试验结果设计响应面试验,各组试验方案及结果如表2所示。使用Design Export 8.0分析得到提取条件和胶原蛋白提取率的回归方程:Y=74.56-3.34A-0.87B+1.39C-3.33D+0.99AB+1.32AC+3.10AD+4.22BC-0.01BD-2.61CD-8.91A2-13.42B2-11.03C2-9.51D2。
表2 响应面试验设计及结果
Table 2 Response surface design with experimental results
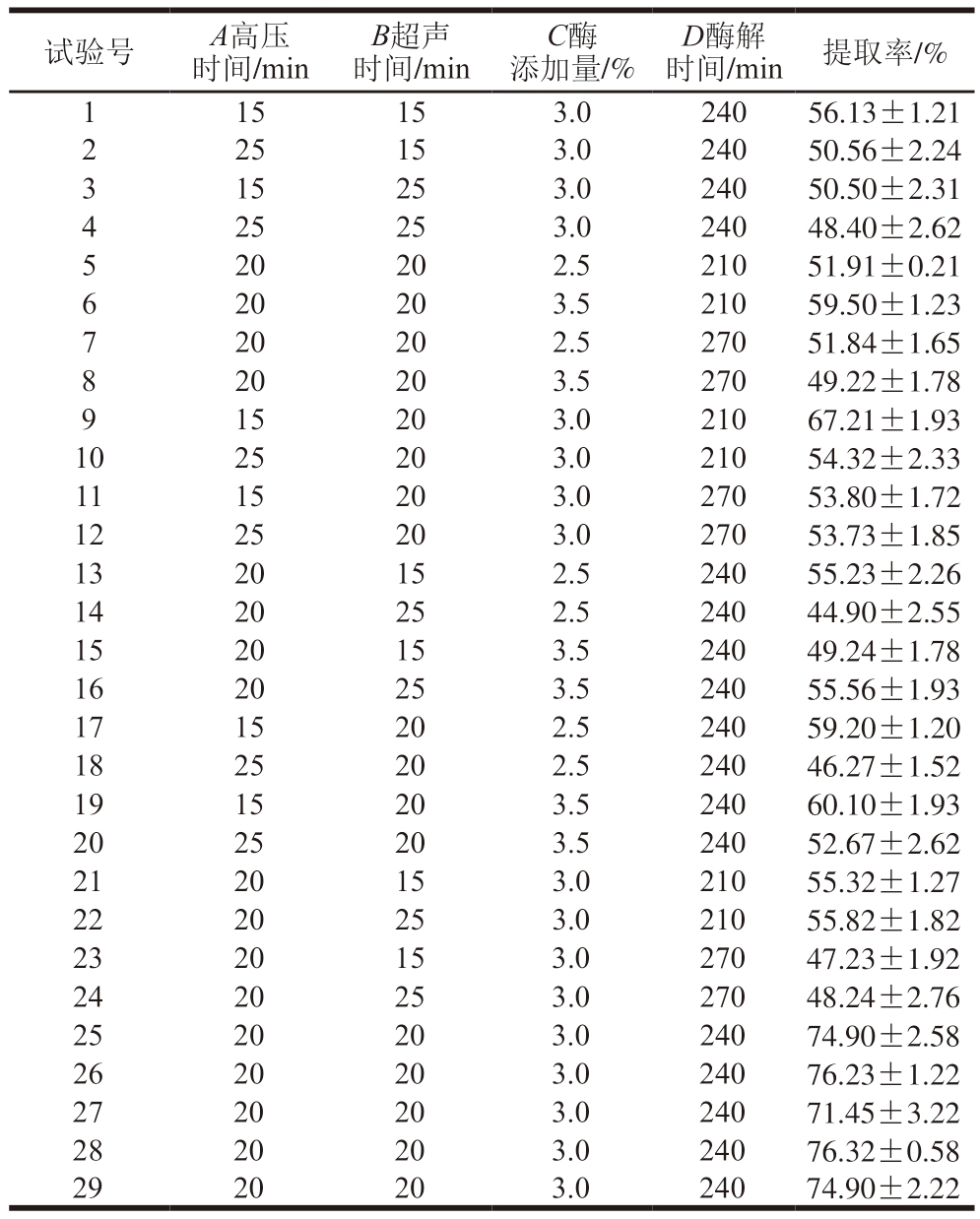
试验号A高压时间/min B超声时间/min C酶添加量/%D酶解时间/min 提取率/%115153.024056.13±1.21 2 25153.024050.56±2.24 3 15253.024050.50±2.31 4 25253.024048.40±2.62 520202.521051.91±0.21 620203.521059.50±1.23 720202.527051.84±1.65 820203.527049.22±1.78 915203.021067.21±1.93 1025203.021054.32±2.33 1115203.027053.80±1.72 1225203.027053.73±1.85 1320152.524055.23±2.26 1420252.524044.90±2.55 1520153.524049.24±1.78 1620253.524055.56±1.93 1715202.524059.20±1.20 1825202.524046.27±1.52 1915203.524060.10±1.93 2025203.524052.67±2.62 2120153.021055.32±1.27 2220253.021055.82±1.82 2320153.027047.23±1.92 2420253.027048.24±2.76 2520203.024074.90±2.58 2620203.024076.23±1.22 2720203.024071.45±3.22 2820203.024076.32±0.58 2920203.024074.90±2.22
由表3 可知,模型P <0.0 0 0 1,表明模型极显著;失拟项P=0.436 5>0.05,表明该模型显著[29]。R2=0.971 5,表明胶原蛋白提取率受高压时间、超声时间、酶添加量和酶解时间的影响,R2接近1,表明预测值与实际值较为吻合。变异系数为3.98,远小于10,说明模型离散度低,可信度高。校正决定系数R2Adj=0.934 2,表明二次回归模型适当,能够准确描述不同参数对羊皮胶原蛋白提取率的影响[30]。
表3 回归方程方差分析
Table 3 Analysis of variance of regression equation
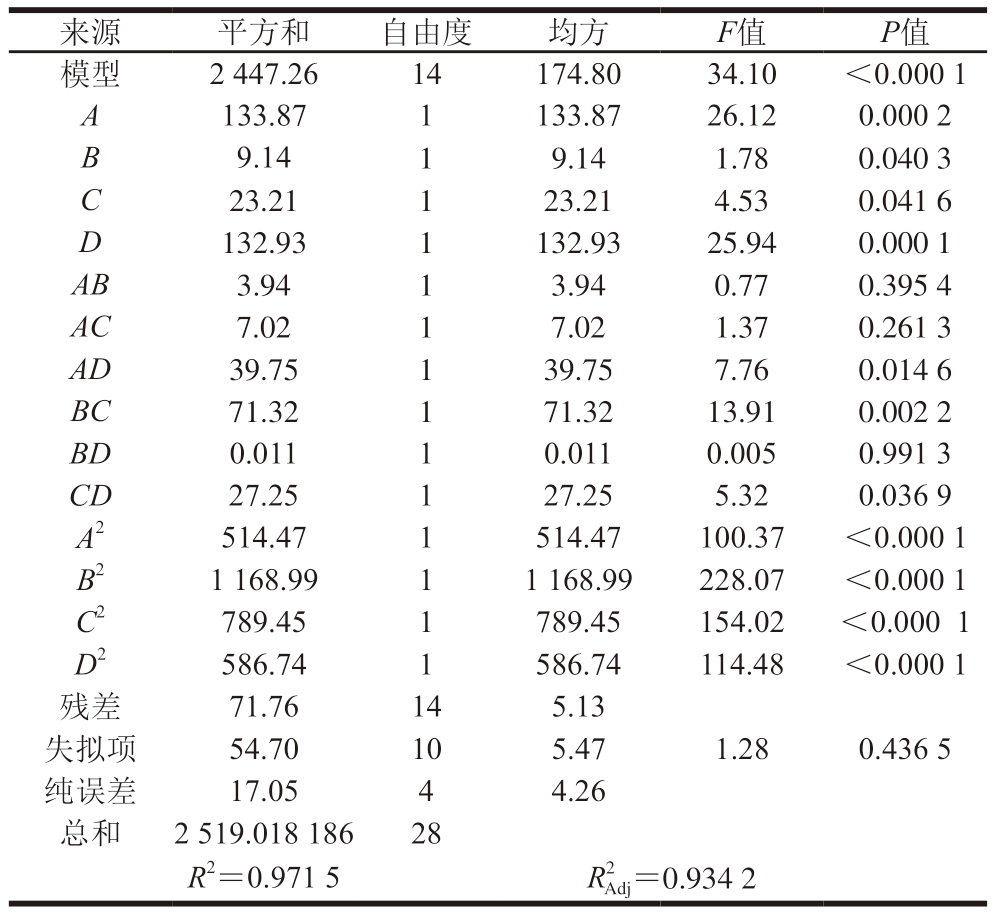
来源平方和自由度均方F值P值模型2 447.2614174.8034.10<0.000 1 A133.871133.8726.120.000 2 B 9.1419.141.780.040 3 C23.21123.214.530.041 6 D132.931132.9325.940.000 1 AB3.9413.940.770.395 4 AC7.0217.021.370.261 3 AD39.75139.757.760.014 6 BC71.32171.3213.910.002 2 BD0.01110.0110.0050.991 3 CD27.25127.255.320.036 9 A2514.471514.47100.37<0.000 1 B21 168.9911 168.99228.07<0.000 1 C2789.451789.45154.02<0.000 1 D2586.741586.74114.48<0.000 1残差71.76145.13失拟项54.70105.471.280.436 5纯误差17.0544.26总和2 519.018 18628 R2=0.971 5R2 Adj=0.934 2
根据表3中的F值可知,高压时间(A)、超声时间(B)、酶添加量(C)、酶解时间(D)对羊皮胶原蛋白提取率影响显著(P<0.05),特别是高压时间(A)和酶解时间(D)对提取率影响高度显著(P<0.000 1),4 个因素对提取率的影响程度顺序为高压时间>酶解时间>酶添加量>超声时间。二次交互项AD、BC、CD的P<0.05,说明高压时间和酶解时间、超声时间和酶添加量、酶添加量和酶解时间之间的交互和用对提取率影响显著。
图2为各因素之间的交互和用对提取率影响的三维响应面图,通过Design Export 8.0分析,确定较佳工艺参数为高压时间23.18 min、超声时间20.05 min、酶添加量3.06%、酶解时间237.42 min。在此条件下,羊皮胶原蛋白提取率预测值为79.61%,实验结果显示实测值为(74.19±1.20)%,与预测值相对误差为7.3%。
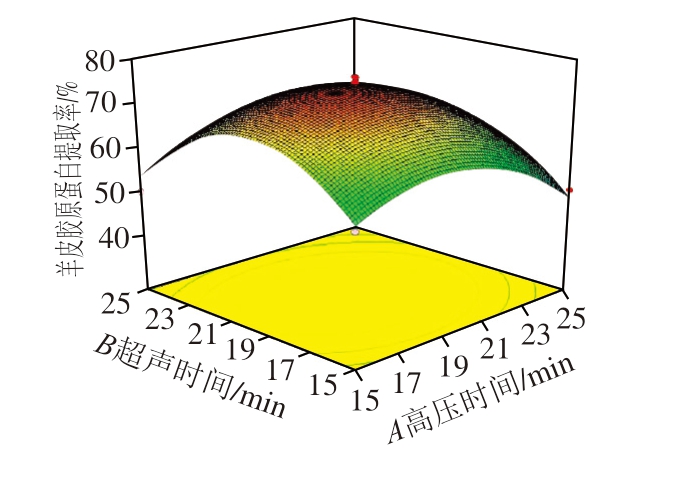
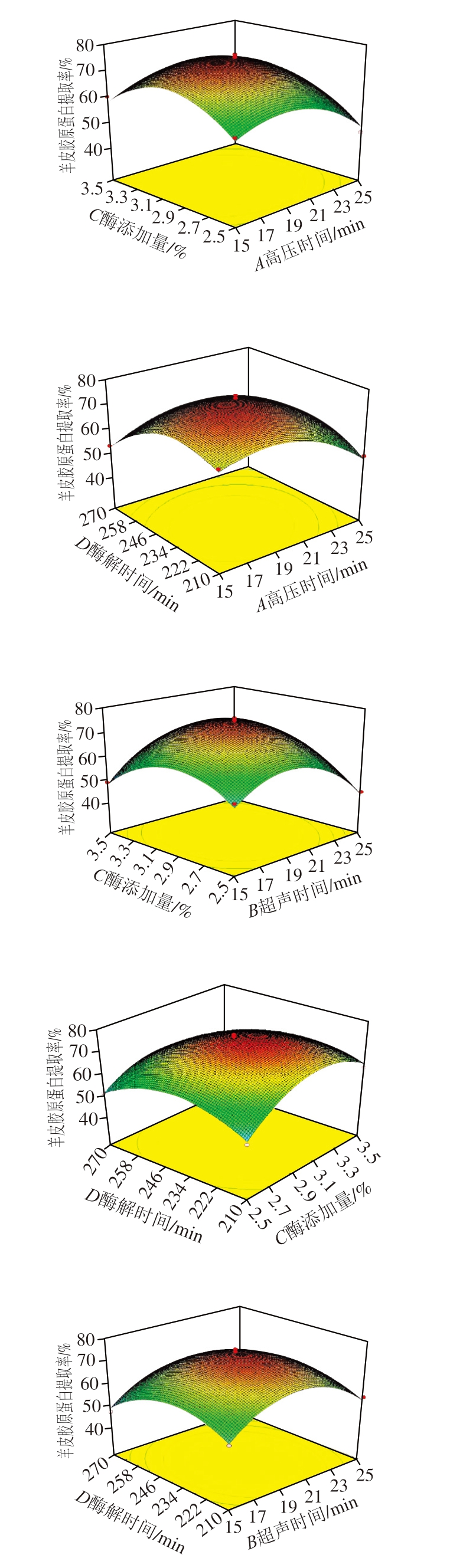
图2 两因素交互作用影响羊皮胶原蛋白提取率的响应面图
Fig.2 Response surface plot showing interactive effects of variables on the extraction rate of sheep skin collagen
2.3 GA-BP神经网络优化结果分析
利用Matlab R2018b软件对响应面试验结果进行神经网络分析,以高压时间、超声时间、酶添加量和酶解时间和为输入神经元,通过算法确定隐藏神经元数,提取率和为输出神经元,对神经网络进行训练和测试[31]。隐藏层节点数代表神经网络优化次数,将隐藏层节点数代入神经网络模型进行训练[32],训练后的MSE如图3所示,当隐藏层节点数为7时,训练集MSE最小,为0.049 1,因此,选择隐藏层节点数为7。
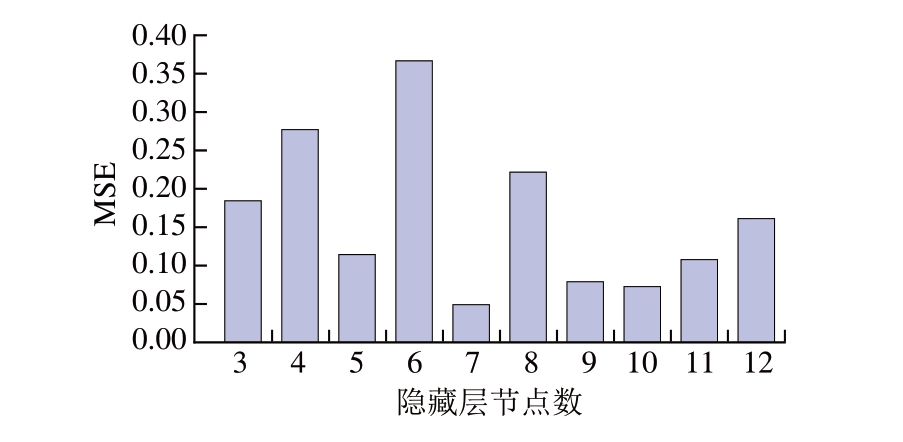
图3 训练集隐藏层节点数的MSE
Fig.3 MSE as a function of the number of hidden layer nodes
随机选取Box-Behnken设计29 组数据中的80%用于训练,其余数据用于验证[33]。在训练过程中,将模型的学习率设置为1 000,经过不断迭代训练减小误差,由图4可知,当迭代次数为6时,总体的MSE最小,为0.033 1,此时的模型满足训练误差要求。
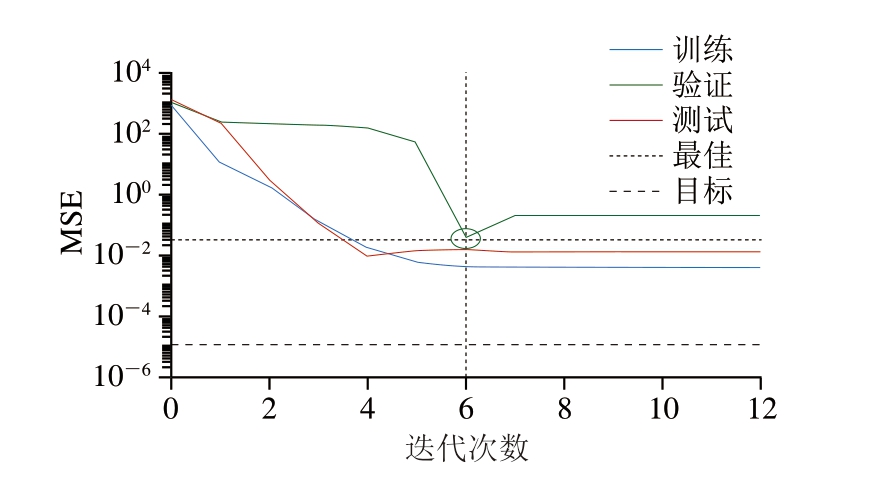
图4 神经网络模型训练过程中MSE随迭代次数的变化
Fig.4 MSE as a function of the number of iterations during the training of neural network model
由图5可知,经过GA优化后的BP神经网络模型回归图的拟合程度提高,R2从0.889 5提高至0.998 2,根据Matlab R2018b分析可知,预测准确性由88.79%提高至98.84%。
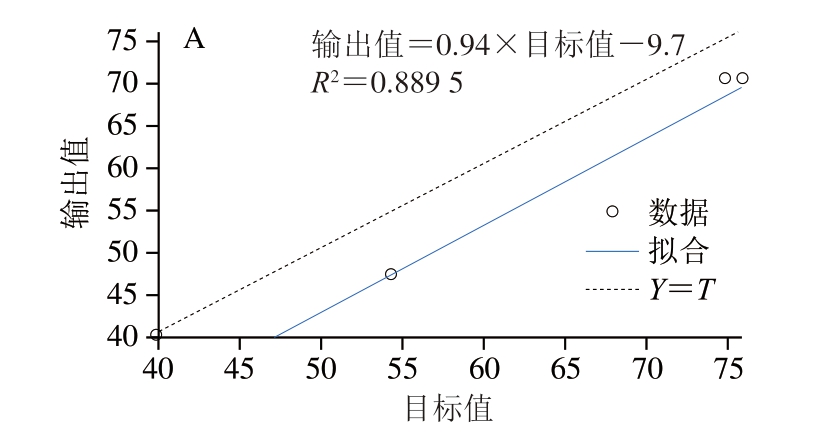
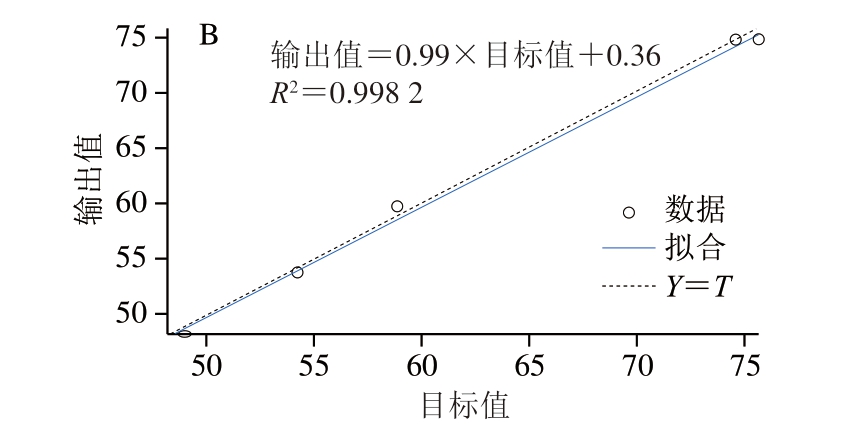
图5 不同算法模型回归对比
Fig.5 Comparison of regression models with different algorithms
A.BP神经网络模型;B.GA-BP神经网络模型;Y=T为输出和目标的理想拟合方程,图6同。
由图6可知,GA-BP神经网络模型在训练、验证、测试和全部数据集上的R2分别为0.972 7、0.950 6、0.909 5和0.953 3,接近1,说明所构建的GA-BP神经网络模型具有良好的拟合能力。因此,GA-BP神经网络模型优于BP神经网络模型。
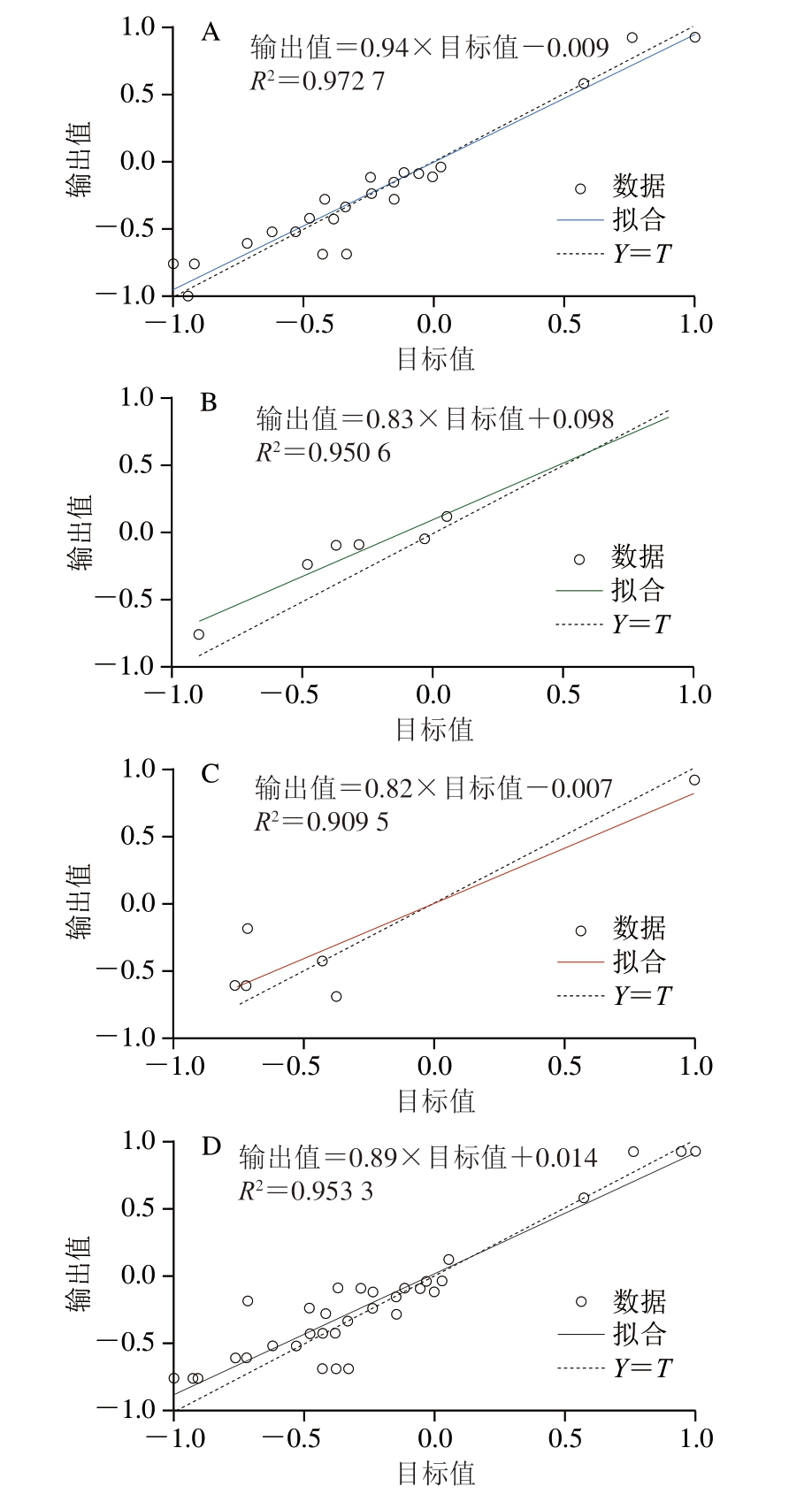
图6 GA-BP神经网络模型训练(A)、验证(B)、测试(C)和总体(D)的相关性分析
Fig.6 Training (A), validation (B), testing (C), and overall (D)correlation analysis of GA-BPNN model
为提高GA-BP神经网络模型性能和收敛速率,经过多次迭代分析最优和平均权重参数,得到最大适应度值。通过对高压时间、超声时间、酶添加量和酶解时间进行调整,得到提取率的最高值和最低值[34]。如图7所示,经过59 次迭代,在第13次迭代模型获得最大适应度值,确定较佳工艺参数为高压时间23.4 min、超声时间22.3 min、酶添加量3.21%、酶解时间222.02 min,此条件下,提取率预测值为81.69%。
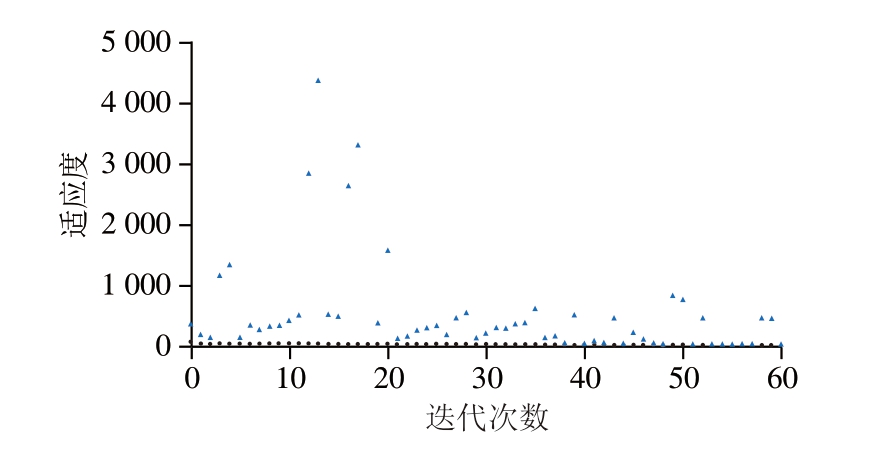
图7 GA-BP神经网络模型迭代次数分析
Fig.7 Iteration analysis of GA-BPNN model
2.4 响应面模型和GA-BP 神经网络模型对比分析
由图8可知,GA-BP神经网络模型的R2较高,而MAE、MSE、RMSE和MAPE均低于响应面模型,即GA-BP神经网络模型对羊皮胶原蛋白提取率的预测能力更强,预测误差更小。验证实验结果显示,响应面和GA-BP神经网络预测的最优提取率与实际值之间的相对误差分别为5.25%和1.21%,GA-BP神经网络预测模型具有较高的准确性。因此,选择GA-BP神经网络模型和为最佳模型,最优提取条件为高压时间23.4 min、超声时间22.3 min、酶添加量3.21%、酶解时间222.02 min,在此条件下,羊皮胶原蛋白提取率为(80.5±1.6)%。
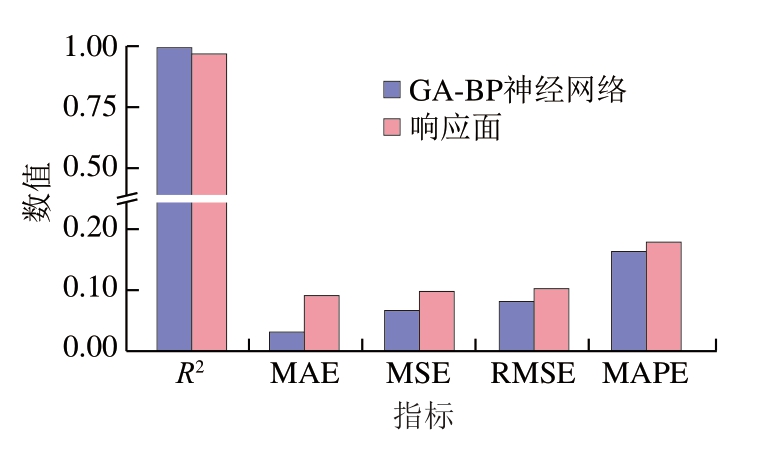
图8 GA-BP神经网络和响应面模型拟合效果对比
Fig.8 Comparison of fitting effects between GA-BPNN and RSM models
2.5 羊皮胶原蛋白紫外可见光谱分析
根据紫外扫描光谱图,不仅能判断所提取胶原蛋白中是否含有酪氨酸等生色团,还能判断多肽链中非螺旋端肽的完整性[35]。如图9所示,2 种提取方式下的胶原蛋白都表现出钟形光谱,在240 nm处显示出主要的吸收峰,与Tan Yuqing等[36]所研究的猪皮胶原蛋白(235 nm)、海参胶原蛋白(236.5 nm)、鲟鱼皮胶原蛋白(235 nm)的最大吸收峰相近,符合I型胶原蛋白的最大紫外吸收特征。2 种提取方式下的胶原蛋白在280 nm处均无吸收峰。Zinchenko等[37]的研究表明,酪氨酸和苯丙氨酸是敏感的发色团,能够吸收280 nm处的紫外线,当胶原蛋白被提取和纯化时,该特性用于表征非螺旋端肽和其他蛋白质污染物的完整性。以上结果显示,最优工艺条件下,高压和超声处理未破坏胶原蛋白的完整性,联合处理组和对照组提取的胶原蛋白均符合I型胶原蛋白的紫外吸收特征。
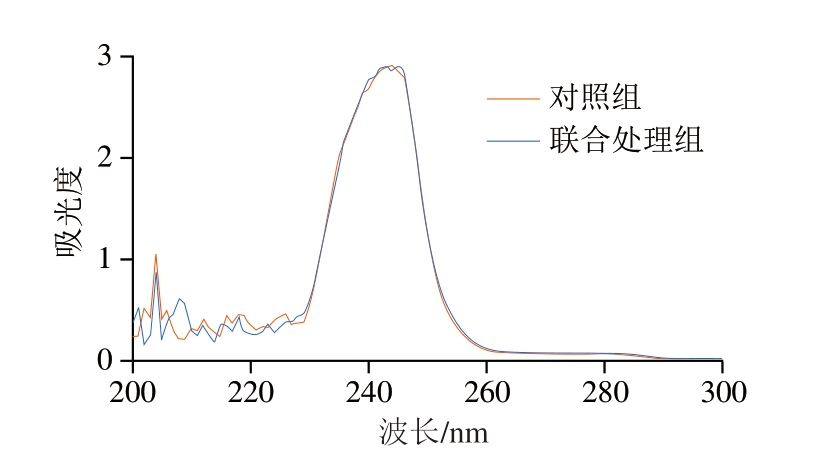
图9 羊皮胶原蛋白紫外-可见吸收光谱图
Fig.9 UV-Vis spectrum of sheep skin collagen
2.5 羊皮胶原蛋白傅里叶变换红外光谱分析
由图10可知,对照组和联合处理组的酰胺A带分别为3 307 cm-1和3 240 cm-1,高压和超声处理可能通过削弱氢键影响胶原蛋白的三螺旋结构[19],与对照组相比,联合处理组酰胺A带出现红移,这与氢键延伸振动有关。当氢键在NH和官能团之间形成时,峰向低波数移动。这一发现与Nan Jie等[15]报道的高压处理后酰胺A带位置变化的结果一致。酰胺B带与—CH2的不对称拉伸振动有关,对照组和联合处理组的胶原蛋白吸收峰分别为2 955 cm-1和2 923 cm-1,这表明高压处理导致的蛋白质分子间交联减少[18]。酰胺I带(1 600~1 700 cm-1)主要与参与羰基拉伸振动的氢键强度有关[18],结果表明,对照组在1 620 cm-1处观察到峰带,联合处理组在1 639 cm-1处观察到峰带,即联合处理几乎没有改变酰胺I带波峰的位置。酰胺II带(1 550~1 600 cm-1)与N—H弯曲和C—N振动有关,酰胺III带(1 210~1 230 cm-1)与胶原蛋白三螺旋结构的完整性有关,峰值强度比(酰胺III带与1 450 cm-1附近吸收峰强度之比)为1.05~1.14,则胶原蛋白的三螺旋结构完整[35]。对照组与联合处理组在1 210 cm-1与1 230 cm-1附近的峰值强度比分别为1.06和1.10,接近I型胶原蛋白的特征值1.0。由此可见,2 种方法提取的胶原蛋白二级结构和三螺旋结构基本保持完整,与传统的提取方法相比,复合法对胶原蛋白的破坏较小。
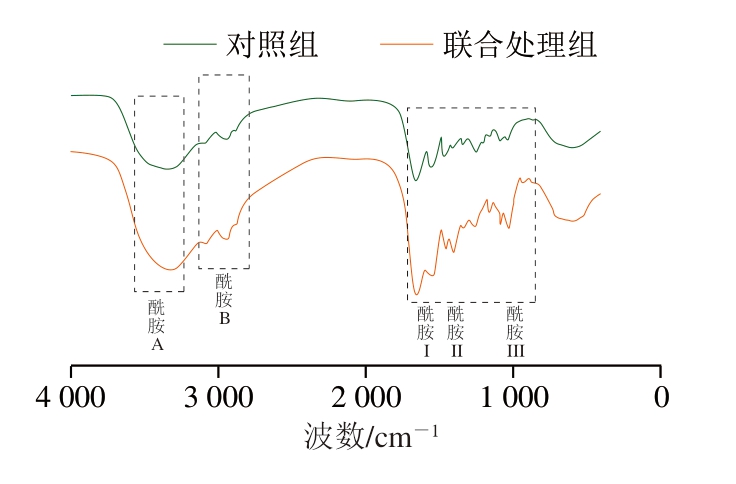
图10 羊皮胶原蛋白傅里叶变换红外光谱图
Fig.10 FTIR spectrum of sheep skin collagen
3 结 论
本研究采用高压-超声-酶解法提取羊皮胶原蛋白,在单因素试验结果基础上进行响应面试验,获取GA-BP神经网络模型所需的训练、测试和验证数据。结果表明:GA-BP神经网络模型比响应面模型具有更好的拟合和预测能力,最佳提取工艺条件为高压时间23 min、超声时间22 min、酶添加量3.2%、酶解时间222 min,在此条件下羊皮胶原蛋白提取率为(80.5±1.6)%,与模型预测值相近;通过紫外-可见吸收光谱和傅里叶变换红外光谱确定了此条件下提取的羊皮胶原蛋白结构的完整性。相较于传统的酶解提取法,高压-超声-酶解法将提取时间从传统的5 d缩短至3 d,提取率从40%提升至80%[4,11]。而且,与传统的提取方法相比,联合法无需大量化学试剂,从根源上降低了污染物残留风险。另外,GA-BP神经网络预测模型可有效应用于羊皮胶原蛋白高压-超声-酶解提取工艺研究,为活性物质的提取工艺优化提供技术支持。本研究结果可为羊皮资源的高值化利用提供参考。
[1] 李军, 金海.2023年我国肉羊产业发展概况、未来发展趋势及建议[J].中国畜牧杂志, 2024, 60(3): 322-328.DOI:10.19556/j.0258-7033.20240206-05.
[2] XIE Z K, WANG X G, YU S Y, et al.Antioxidant and functional properties of cowhide collagen peptides[J].Food Bioscience, 2021,86(5): 1802-1818.DOI:10.1111/1750-3841.15666.
[3] HE L, HAN L, YU Q L, et al.High pressure-assisted enzymatic hydrolysis promotes the release of a bi-functional peptide from cowhide gelatin with dipeptidyl peptidase IV (DPP-IV) inhibitory and antioxidant activities[J].Food Chemistry, 2024, 435: 137546.DOI:10.1016/j.foodchem.2023.137546.
[4] 牛金鸽.藏羊皮胶原蛋白肽的提取及其功能特性研究[D].西宁:青海大学, 2023.DOI:10.27740/d.cnki.gqhdx.2023.000735.
[5] VATE N K, UNDELAND I, ABDOLLAHI M.Resource efficient collagen extraction from common starfish with the aid of high shear mechanical homogenization and ultrasound[J].Food Chemistry, 2022,393: 133426.DOI:10.1016/j.foodchem.2022.133426.
[6] WU Y, WANG Y, LÜ J, et al.Preparation and characterization of egg white protein film incorporated with epigallocatechin gallate and its application on pork preservation[J].Food Chemistry: X, 2023, 19:100791.DOI:10.1016/j.fochx.2023.100791.
[7] NI Z J, WANG X, SHEN Y, et al.Recent updates on the chemistry,bioactivities, mode of action, and industrial applications of plant essential oils[J].Trends in Food Science & Technology, 2021, 110: 78-89.DOI:10.1016/J.TIFS.2021.01.070.
[8] 王艳茹, 王欣悦, 何龙, 等.超高压辅助酶解制备胶原蛋白抗氧化肽及构效分析[J/OL].食品科学: 1-17.[2024-06-15].http://kns.cnki.net/kcms/detail/11.2206.TS.20231218.0844.004.html.
[9] SUN M, WEI X, WANG H B, et al.Structure restoration of thermally denatured collagen by ultrahigh pressure treatment[J].Food and Bioprocess Technology, 2020, 13: 367-378.DOI:10.1007/s11947-019-02389-6.
[10] 胡中源, 薛羽, 查加杰.演化循环神经网络研究综述[J].计算机科学,2023, 50(3): 254-265.DOI:10.11896/jsjkx.220600007.
[11] 何龙.牛皮胶原活性肽制备及其降血糖机制研究[D].兰州: 甘肃农业大学, 2023.DOI:10.27025/d.cnki.ggsnu.2023.000062.
[12] LI Y L, TIAN Y X, XIONG X, et al.Comparison of collagens extracted from swim bladder and bovine Achilles tendon[J].Materials Research Express, 2023, 10(5): 055403.DOI:10.1088/2053-1591/acd379.
[13] AHMAD M I, LI Y H, PAN J F, et al.Collagen and gelatin: structure,properties, and applications in food industry[J].International Journal of Biological Macromolecules, 2024, 254: 128037.DOI:10.1016/j.ijbiomac.2023.128037.
[14] 彭易鑫, 陆旭丽, 代亚萍, 等.响应面法优化复合酶酶解制备可口革囊星虫胶原蛋白抗氧化肽工艺研究[J].食品工业科技, 2021, 42(22):230-239.DOI:10.13386/j.issn1002-0306.2021070183.
[15] NAN J, ZOU M L, WANG H B, et al.Effect of ultra-high pressure on molecular structure and properties of bullfrog skin collagen[J].International Journal of Biological Macromolecules, 2018, 111: 200-207.DOI:10.1016/j.ijbiomac.2017.12.163.
[16] ALICE B N, CATERINA M, SARA P, et al.Release of dipeptidyl peptidase IV (DPP-IV) inhibitory peptides from milk protein isolate(MPI) during enzymatic hydrolysis[J].Food Research International,2017, 94: 79-89.DOI:10.1016/j.foodres.2017.02.004.
[17] CHANMANGKANG S, MANEEROTE J, SURAYOT U, et al.Physicochemical and biological properties of collagens obtained from tuna tendon by using the ultrasound-assisted extraction[J].Journal of Agriculture and Food Research, 2024, 15: 100984.DOI:10.1016/j.jafr.2024.100984.
[18] ANDREA M E, KIM L P, MARK R W, et al.Gelatin and collagen from sheepskin[J].Polymers, 2024, 16(11): 1563.DOI:10.3390/polym16111563.
[19] YUE J Y, WANG J Z, ZHANG C H, et al.Effects of hot-pressure extraction time on composition and gelatin properties of chicken bone extracts[J].Journal of Food Science, 2017, 82(5): 1066-1075.DOI:10.1111/1750-3841.13687.
[20] KAEWBANGKERD K, HAMZEH A, YONGSAWATDIGUL J.Ultrasound-assisted extraction of collagen from broiler chicken trachea and its biochemical characterization[J].Ultrasonics Sonochemistry,2023, 95: 106372.DOI:10.1016/j.ultsonch.2023.106372.
[21] 王丽, 林颖, 谭旭, 等.冷鲜肉主要致腐微生物及构建微生物预测模型研究进展[J].肉类研究, 2023, 37(10): 42-48.DOI:10.7506/rlyj1001-8123-20230817-077.
[22] DOU R L, HOU Y C, WEI Y X, et al.Dual carbon oriented optimization method for manufacturing industry chain based on BP neural network and clonal selection algorithm[J].Applied Soft Computing, 2023, 148: 110887.DOI:10.1016/j.asoc.2023.110887.
[23] DENG J X, LIU G M, WANG L, et al.Intelligent optimization design of squeeze casting process parameters based on neural network and improved sparrow search algorithm[J].Journal of Industrial Information Integration, 2024, 39: 100600.DOI:10.1016/j.jii.2024.100600.
[24] WANG Q, JIANG H Y, REN J D, et al.An intrusion detection algorithm based on joint symmetric uncertainty and hyperparameter optimized fusion neural network[J].Expert Systems with Applications,2024, 244: 123014.DOI:10.1016/j.eswa.2023.123014.
[25] WEI Y J, JIAO B, ZHANG H Y, et al.Neural network algorithm enables mass calibration autocorrection for miniature mass spectrometry systems[J].International Journal of Mass Spectrometry,2023, 490: 117085.DOI:10.1016/j.ijms.2023.117085.
[26] HU G H, LI X H, SU R N, et al.Effects of ultrasound on the structural and functional properties of sheep bone collagen[J].Ultrasonics Sonochemistry, 2023, 95: 106366.DOI:10.1016/j.ultsonch.2023.106366.
[27] FENG X, LIU T W, MA L, et al.A green extraction method for gelatin and its molecular mechanism[J].Food Hydrocolloids, 2022, 124:107344.DOI:10.1016/j.foodhyd.2021.107344.
[28] DANIELA P W, CAMILA G S, BERILO S B, et al.Collagen extracted from rabbit: meat and by-products: isolation and physicochemical assessment[J].Food Research International, 2022, 162: 111967.DOI:10.1016/j.foodres.2022.111967.
[29] 王贝贝.羊皮胶原基DPP-IV抑制活性肽的制备及活性机制分析[D].无锡: 江南大学, 2021.DOI:10.27169/d.cnki.gwqgu.2021.000993.
[30] 牛金鸽, 吴海玥, 马世科, 等.响应面优化藏羊皮胶原蛋白肽超声辅助提取工艺及其体内抗氧化活性分析[J].食品工业科技, 2023,44(11): 163-170.DOI:10.13386/j.issn1002-0306.2022060009.
[31] 王丽, 林颖, 谭旭, 等.冷鲜肉主要致腐微生物及构建微生物预测模型研究进展[J].肉类研究, 2023, 37(10): 42-48.DOI:10.7506/rlyj1001-8123-20230817-077.
[32] 姚玉梅, 袁湘汝, 韩鲁佳, 等.低分子量骨胶原肽酶解制备工艺优化和特性分析[J].农业机械学报, 2022, 53(4): 386-393; 422.DOI:10.6041/j.issn.1000-1298.2022.04.040.
[33] 姜薇, 金声琅, 殷涌光.高压脉冲电场辅助酶法提取鹿托盘胶原蛋白[J].天然产物研究与开发, 2018, 30(4): 647-652.DOI:10.16333/j.1001-6880.2018.4.019.
[34] 王九清, 邢素霞, 王孝义, 等.基于卷积神经网络与高光谱的鸡肉品质分类检测[J].肉类研究, 2018, 32(12): 36-41.DOI:10.7523/rlyj1001-8123-20180811-012.
[35] LIN Y K, LIU D C.Comparison of physical-chemical properties of type I collagen from different species[J].Food Chemistry, 2006, 99(2):244-251.DOI:10.1016/j.foodchem.2005.06.053.
[36] TAN Y Q, CHANG S K C.Isolation and characterization of collagen extracted from channel catfish (Ictalurus punctatus) skin[J].Food Chemistry, 2018, 242: 147-155.DOI:10.1016/j.foodchem.2017.09.013.
[37] ZINCHENKO S, LISHUDI D.Star algorithm for neural network ensembling[J].Neural Networks, 2024, 170: 364-375.DOI:10.1016/j.neunet.2023.11.020.