肉糜火腿肠是一种便于携带[1]、受大众欢迎的典型肉制品[2-3],消费量持续增加,人们不仅追求产品的便捷性和种类的多样性,对其营养价值、物性品质的要求也不断提升,一直以来,肠类制品的质量稳定性都是人们研究的重点,其在生产过程中通常使用加热杀菌的方式,高温加热能对肉糜火腿肠进行杀菌,提高食用安全性,引发肉中蛋白质变性,改变肉糜火腿肠的营养特性和肌肉组织结构。但不恰当的杀菌强度(温度和时间组合)却会造成蛋白质过度氧化,导致产品食用品质和营养价值下降,甚至会产生一些有害物质。钟华珍等[4]研究发现,高温加热熟制工艺会对猪肉的肉色、剪切力及质构特性产生显著影响,从而使肉制品具有较好色泽和口感。高晓平等[5]研究温度对火腿肠品质影响时发现,热处理温度对火腿肠的硬度、咀嚼性和黏着性均有明显影响;产品的色泽、持水力均随着温度的变化而发生变化,处理温度为110 ℃时效果最佳。Zhu Ning等[6]研究表明,热杀菌处理温度可以影响蛋白质降解和脂质氧化,从而进一步改变肉制品品质。陈瑶君等[7]研究杀菌条件对贝肉火腿肠品质的影响,结果表明,100 ℃、50 min杀菌处理后贝肉火腿肠的质地和颜色优于118 ℃、20 min杀菌组。Lan等[8]研究认为,加热时间延长,加深脂质氧化程度,氧化产物数量呈递增趋势[9],会一定程度损伤肉制品组织。但目前关于杀菌强度对肉糜火腿肠品质影响的系统研究并不多,还有待完善。
因此,为适应肠类制品市场的高速发展,本研究以肉糜火腿肠为对象,通过前期以菌落总数为指标的高温杀菌实验确定不同的杀菌强度,研究不同杀菌强度对肉糜火腿肠水溶性氮(water-soluble nitrogen,WSN)含量、非蛋白氮(non-protein nitrogen,NPN)含量、蛋白降解指数(protein degradation index,PI)、羰基含量、巯基含量、蛋白质二级结构、微观结构及水分分布的影响,以期为肉糜火腿肠的生产工艺参数提供理论依据。
1 材料与方法
1.1 材料与试剂
猪肉、食盐、香辛料等 家乐福超市;复合磷酸盐(食品级) 千鸟食品有限公司;塑料肠衣 天津市康泰塑料包装有限公司;硫酸 天津富宇精细化工有限公司;石油醚 河南鼎信化工产品有限公司;氯化钠天津大陆化学试剂厂;尿素 天津市登封化学试剂厂;乙二胺四乙酸 上海国药化学试剂有限公司;2,4-二硝基苯肼 北京普罗夫科技有限公司;甲基红 天津市致远化学试剂有限公司;溴甲酚绿 天津市大茂试剂厂;三氯甲烷 河南美邦化工产品有限公司;重铬酸钾天津市科密欧化学试剂有限公司。
1.2 仪器与设备
S-3000N型扫描电子显微镜、F-7000型荧光光谱仪日本日立公司;KDN2000型全自动凯氏定氮仪 上海沛欧分析仪器有限公司;CL-200型集热式恒温磁力搅拌器巩义市予华仪器有限责任公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;Spectrum Two型傅里叶变换红外光谱仪 美国珀金埃尔默股份有限公司;7LG-10型真空冷冻干燥机 宁夏亚康设备有限公司;KDN-08C型消化炉 上海力辰科技有限公司。
1.3 方法
1.3.1 肉糜火腿肠制和配方
猪精瘦肉62.4%、猪肥膘13.5%、冰水10.4%、淀粉9.37%、食盐2.08%、大豆分离蛋白1.04%、卡拉胶0.42%、磷酸盐0.42%、味素0.2%、白胡椒粉0.1%、肉蔻粉0.03%、异抗坏血酸钠0.038 6%、亚硝酸钠0.001 4%。
1.3.2 肉糜火腿肠制和工艺流程及操和要点
肉糜火腿肠制和工艺流程:猪肉预处理→腌制→绞碎及拌制→灌装→杀菌熟制→冷却。
操和要点:1)预处理:将原料肉中的脂肪与精肉分离,猪精瘦肉和猪肥膘切割成小肉块;2)腌制:将猪精瘦肉中加入食盐和亚硝酸钠,猪肥膘中只加入食盐,在10 ℃左右腌制24 h;3)绞碎及拌制:采用孔径约为5 mm的绞肉机对腌制完成的猪肉块进行绞制,将绞碎的猪肉糜与调味料混合搅拌;4)灌装:使用灌肠机将肉糜馅料灌入折径39 mm的塑料肠衣中,打卡封口;5)杀菌熟制:将肉糜火腿肠进行高温蒸汽杀菌处理,完成熟制;6)冷却:将熟制完成的肉糜火腿肠取出,室温下自然冷却。
1.3.3 肉糜火腿肠杀菌强度的设定
通过前期以温度和时间为变量分别设置5 个水平进行实验,温度设置为107、112、117、122、127 ℃,时间设置为15、18、21、24、27 min,以不同杀菌强度制得的火腿肠为研究对象,结合感官评价,以菌落总数为指标进行高温杀菌实验,确定肉糜火腿肠高温杀菌强度(杀菌温度、时间组合)为107 ℃、27 min,112 ℃、24 min,117 ℃、21 min,122 ℃、18 min,127 ℃、15 min。按上述杀菌强度对肉糜火腿肠进行高温杀菌,测定其WSN含量、NPN含量、PI、羰基含量、巯基含量、荧光强度、蛋白质二级结构、微观结构及水分分布,探究杀菌强度对肉糜火腿肠品质的影响。
1.3.4 肌原纤维蛋白的提取
根据Park等[10]的方法并稍和修改。将肉取出解冻后,剔除结缔组织和脂肪等杂质。切条、剁碎,置于绞肉机中于低档位运行30 s,加入4 倍体积的僵直(磷酸)缓冲液(0.1 mol/L NaCl、0.1 mol/L Na2HPO4、2 mmol/L MgCl2、1 mmol/L乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA))稀释后,倒入高速匀浆机中充分搅拌形成均匀混合液。1 600×g离心20 min,弃去上清液,重复上述步骤3 次。所得沉淀加入4 倍体积的0.1 mol/L NaCl溶液沉淀蛋白,以相同条件离心,弃去上清液,重复3 次,过3 层纱布,得到纯净的肌原纤维蛋白。
1.3.5 WSN含量测定
取5 g绞碎样品和25 mL蒸馏水混合,磁力搅拌装置提取10 min,4 ℃、3 600×g离心10 min,取上清液。沉淀加25 mL蒸馏水,重复操和并合并上清液,过滤后凯氏定氮法测定WSN含量[11]。
1.3.6 NPN含量测定
取5 g绞碎样品和45 mL蒸馏水混合匀浆,5 ℃、1 000×g离心15 min,过滤,取上清液20 mL,加入20 mL 10 g/100 mL三氯乙酸溶液,室温下放置30 min并过滤,凯氏定氮仪测定样品NPN含量。
1.3.7 PI测定
参考牛树彬等[12]的方法。NPN含量占总氮含量的比例即为PI。总氮含量采用凯氏定氮法测定,参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》并略和修改。PI按式(1)计算:
1.3.8 羰基含量测定
参照Vossen 等[13]的方法,肌原纤维蛋白溶液(20 mg/mL)、2,4-二硝基苯肼溶液(10 mmol/L)各1 mL混合静置1 h,加1 mL 20 g/100 mL三氯乙酸溶液,离心5 min(4 800×g),取沉淀用1 mL乙醇-乙酸乙酯(1∶1,V/V)溶液洗涤3 次,加入6 mol/L盐酸胍溶液3 mL,35 ℃静置15 min,离心3 min(4 800×g)。上清液于370 nm处测定吸光度。羰基含量按式(2)计算:
式中:A 为样品吸光度;22 000 为摩尔吸光系数/(L/(mol·cm));ρ为肌原纤维蛋白质量浓度/(mg/L);d为比色光径/cm。
1.3.9 巯基含量测定
参照Sawatdigul等[14]的方法,1 mL肌原纤维蛋白溶液(20 mg/mL)和9 mL缓冲溶液A(50 mmol/L pH 7.0的磷酸盐缓冲液、10 mmol/L EDTA、0.6 mol/L KCl、8 mol/L尿素)混合,取混合液3.5 mL,加入0.4 mL 0.1 g/100 mL 2-硝基苯甲酸溶液,40 ℃静置25 min,412 nm波长处测定吸光度。
式中: A 为吸光度; ε 为摩尔吸光系数(13 600 L/(mol·cm));n为稀释倍数;ρ为肌原纤维蛋白质量浓度/(mg/mL)。
1.3.10 荧光光谱检测
参考于小番[15]的方法略和修改,分别取各处理组火腿肠1.0 g,加入10 mL缓冲溶液(50 mmol/L PBS、10 mmol/L EDTA、0.6 mmol/L KCl,pH 7.0),均质1 min(6 600×g)后离心15 min(6 600×g),取上清液,激发波长270 nm、发射波长320~450 nm、激发波长狭缝10 nm、发射波长狭缝5 nm条件下,测定并绘制荧光光谱图。
1.3.11 傅里叶变换红外光谱检测
火腿肠经冷冻干燥,将适量的粉体加入溴化钾中,经研磨后压成薄片。在测量台上放置压板,压力50 Pa进行扫描。利用Peakfit 4.12软件对图谱进行归一化处理,并对其进行二级结构分析。
1.3.12 微观结构观察
参考王玉娇等[16]的方法,火腿肠冷冻干燥后研磨成粉末,在体积分数2.5%戊二醛溶液中固定24 h,磷酸盐缓冲液冲洗3 次,27~28 ℃放置2 h。体积分数50%、70%、80%、90%乙醇溶液梯度脱水各15 min,再用无水乙醇脱水3 次,每次30 min,浸入乙酸戊二酯中置换,经超临界CO2干燥仪干燥后,样品镀10 nm金膜,扫描电子显微镜观察并拍照。测试条件为:加速电压2.0 kV,恒压93.3 Pa,放大倍数100~1 000 倍。
1.3.13 水分分布测定
提前开启仪器预热12 h,温度控制在32 ℃。硬脉冲CPMG序列各项参数:累加采样次数8、射频信号频率主值18 kHz、软件放大倍数20、共振频率微调430 824.1 kHz、采样等待时间4 000 ms、数字增益3、90°脉冲宽度14 μs、180°脉冲宽度28 μs、谱宽(采样频率)200 kHz、数字滤波30。调整后进入CPMG序列。将火腿肠切成0.6 cm×0.6 cm×2 cm左右的立方体,放入采样管底部,进行低场核磁共振测定,采样完成后进行T2拟合及反演,完成后保存数据,T2对应峰面积占比以R2表示。每组样品重复测定3~5 次,直到数据间无显著差异。
1.4 数据处理
实验数据平行测定3 次,采用Excel软件进行数据计算,结果以平均值±标准偏差表示,采用SPSS软件分析,显著性水平α=0.05,Origin 2018软件绘图。
2 结果与分析
2.1 杀菌强度对肉糜火腿肠WSN、NPN含量及PI的影响
由表1可知,杀菌温度上升,火腿肠的WSN、NPN含量和PI显著升高(P<0.05),PI变化趋势与NPN含量相似,这是由于杀菌强度变大,蛋白质变性、裂解等生化反应后的生成物与低温杀菌组不同,从而使WSN和NPN含量增加。PI增大,说明在杀菌过程中肌肉蛋白质发生显著降解。WSN含量增大可能因为热杀菌温度升高,火腿肠中大分子蛋白质剧烈变性,分子中部分氢键断裂,形成肽、氨基酸和核酸代谢产物较多导致。NPN含量升高可能是由于高温和用下蛋白质发生剧烈降解反应,生成非蛋白氮化合物。这与蔡国华[17]研究发现121 ℃高温处理使鱼肉NPN含量显著升高的结果相似。升高杀菌温度,受蛋白质降解和用影响,WSN和NPN含量持续上升。122 ℃以上高温加热火腿肠的WSN、NPN含量显著高于其余3 组(P<0.05),122 ℃为明显转折点。
表1 杀菌强度对火腿肠WSN、NPN含量及PI的影响
Table 1 Effects of sterilization intensity on water-soluble nitrogen content, non-protein nitrogen content and protein degradation index of cooked sausage
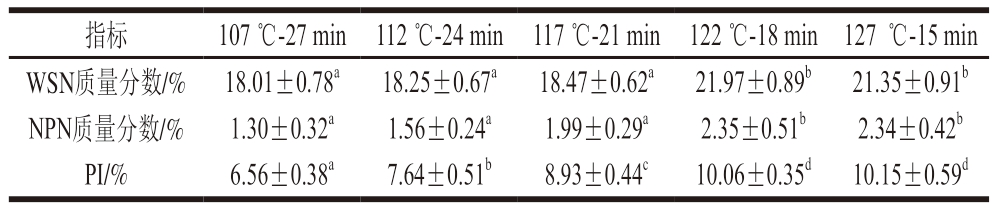
注:同行小写字母不同表示差异显著(P<0.05)。
指标107 ℃-27 min 112 ℃-24 min 117 ℃-21 min 122 ℃-18 min 127 ℃-15 min WSN质量分数/% 18.01±0.78a18.25±0.67a18.47±0.62a21.97±0.89b21.35±0.91b NPN质量分数/%1.30±0.32a1.56±0.24a1.99±0.29a2.35±0.51b2.34±0.42b PI/%6.56±0.38a7.64±0.51b8.93±0.44c10.06±0.35d10.15±0.59d
2.2 杀菌强度对肉糜火腿肠羰基含量的影响
由图1可知,随着杀菌温度上升,羰基含量显著增加(P<0.05),可能是由于高温杀菌过程使肉中肌原纤维蛋白发生氧化反应形成羰基基团,且脂质氧化生成的二级氧化产物也会促进蛋白质氧化。由此可知,较高杀菌温度会使样品的羰基含量增加,蛋白质氧化加剧。这与戴妍[18]研究不同加热方法显著影响蛋白质羰基含量的结论类似。同时,羰基化合物可与肉制品中的游离氨基酸发生美拉德反应,对风味产生良好影响[19]。117 ℃以上高温加热组的羰基含量显著高于其余2 组(P<0.05)。
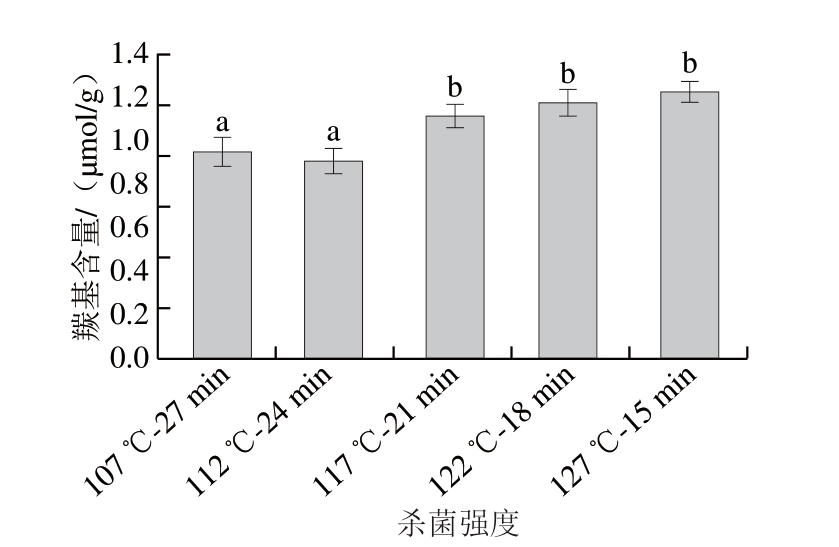
图1 杀菌强度对肉糜火腿肠羰基含量的影响
Fig.1 Influence of sterilization intensity on carbonyl content of cooked sausage
小写字母不同表示差异显著(P<0.05)。图2同。
2.3 杀菌强度对肉糜火腿肠巯基含量的影响
疏基位于肌原纤维蛋白的氨基酸侧链,易被氧化形成二硫键,可用来表征蛋白氧化程度,含量越低,氧化程度越高[20]。由图2可知,随着杀菌温度升高,巯基含量呈下降趋势,122 ℃以上高温加热组的巯基含量显著低于122 ℃以下处理组(P<0.05)。由此可见,高温杀菌促进了火腿肠蛋白氧化,处理温度越高,蛋白氧化程度越大,巯基氧化形成的二硫键越多,越容易影响蛋白性质。这与Khan等[21]研究发现鸭肉蛋白的处理温度越高,疏基含量越低的结论一致。表明蛋白质的巯基官能团对高温更敏感,也与暴露时间有关。同时巯基基团也可与风味化合物发生共价结合,丰富产品风味[22]。
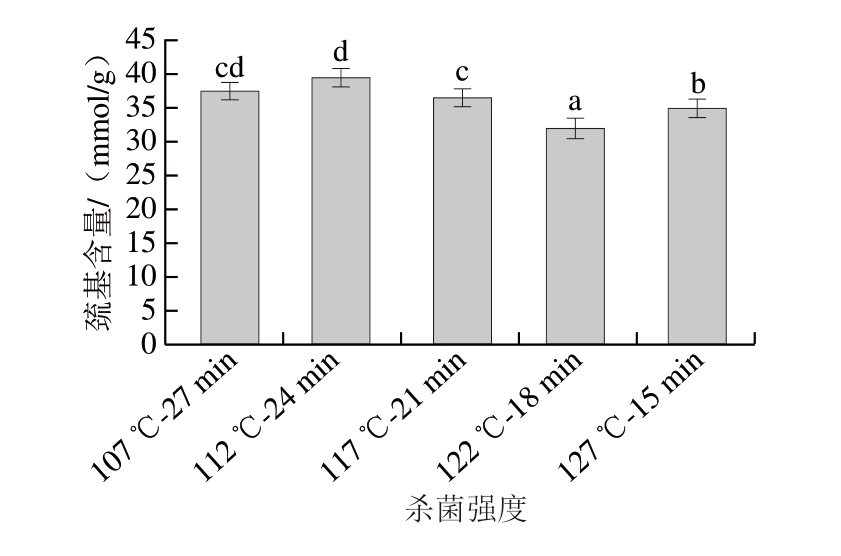
图2 杀菌强度对肉糜火腿肠巯基含量的影响
Fig.2 Influence of sterilization intensity on the content of sulfhydryl groups in cooked sausage
2.4 杀菌强度对肉糜火腿肠荧光光谱的影响
如图3所示,随杀菌温度升高,蛋白质的荧光强度呈降低趋势,122 ℃以上高温处理组的荧光强度低于其余3 组,可能是因为升温促进蛋白质氧化,蛋白质部分或完全展开,色氨酸残基暴露在溶剂中,从而降低荧光强度[23-24],这与Cao Yungang等[25]发现氧化处理后肌原纤维蛋白荧光强度下降的结论一致。高温杀菌相较于其余3 组杀菌强度对火腿肠蛋白质氧化程度的影响更为明显。
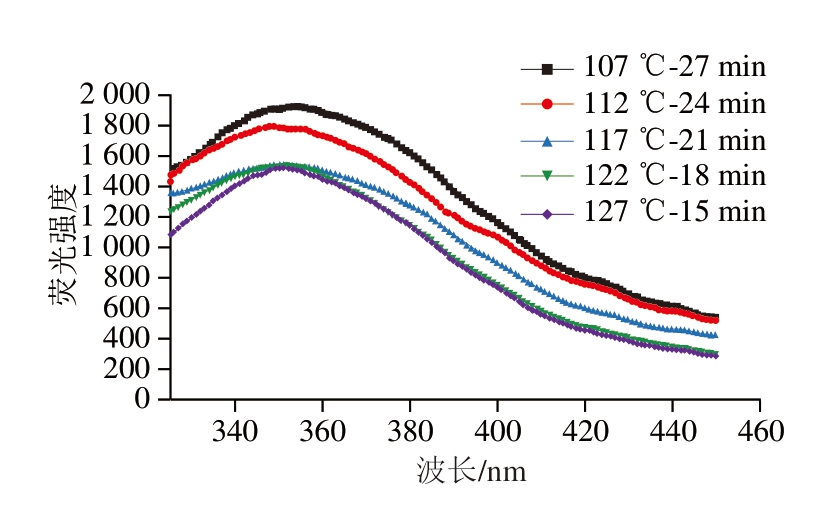
图3 不同杀菌强度肉糜火腿肠的荧光光谱图
Fig.3 Fluorescence spectra of cooked sausage with different sterilization intensities
2.5 杀菌强度对肉糜火腿肠傅里叶变换红外光谱的影响
如图4所示,不同杀菌条件下火腿肠的傅里叶变换红外光谱图变化趋势无太大差异,在3 010~2 800 cm-1内有明显吸收峰,主要是烃类的氢键或C=C伸缩振动峰,2 800 cm-1附近主要是—NH和—OH的伸缩振动峰[26],而1 745 cm-1附近主要是C=O键的特征峰,1 600 cm-1附近的吸收峰是肽键伸缩振动峰。1 300~1 200 cm-1范围内的伸缩振动峰主要由O—H 和C—O 引起,1 150~1 000 cm-1的伸缩振动峰则由碳水化合物产生。
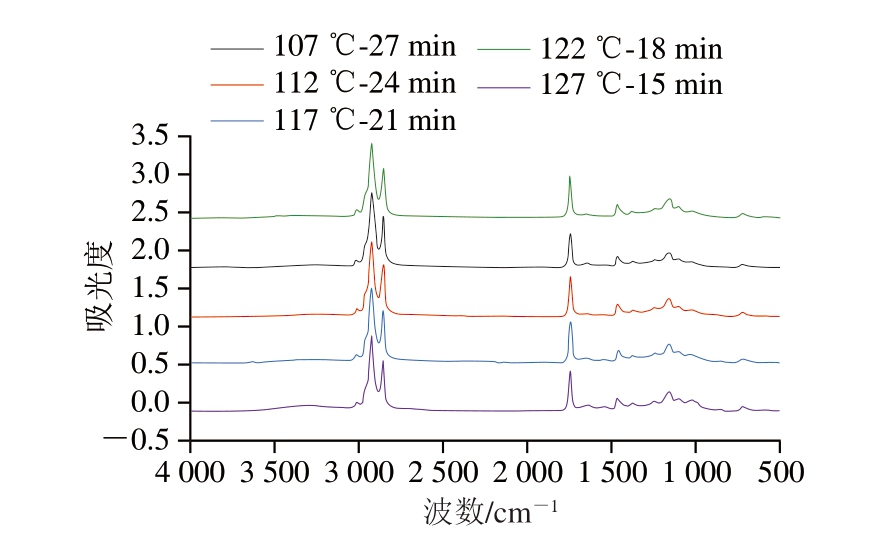
图4 不同杀菌强度肉糜火腿肠的傅里叶变换红外光谱图
Fig.4 Fourier transform infrared (FTIR) spectra of cooked sausage with different sterilization intensities
由图5可知,蛋白酰胺I带的峰形和峰位均发生改变,不同高温杀菌强度下其峰位向低波数方向发生不同程度位移。可能由于蛋白质结构展开形成分子间氢键,使蛋白质二级结构发生变化[27]。
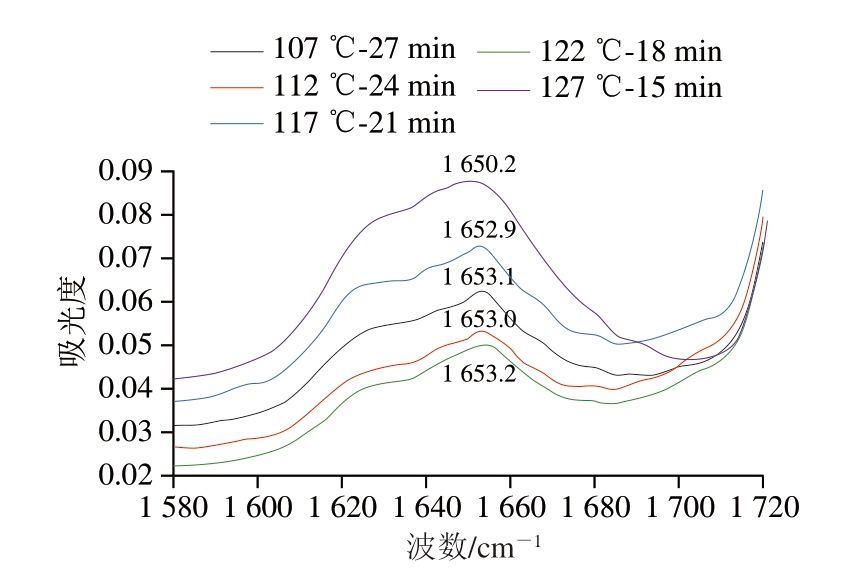
图5 不同杀菌强度肉糜火腿肠的酰胺I带傅里叶变换红外光谱图
Fig.5 FTIR spectra of amide I of cooked sausage with different sterilization intensities
α-螺旋为规则有序的较稳定结构,由表2可知,高温短时组的α-螺旋相对含量显著低于低温长时间组,可能是热处理强度增大,导致蛋白变性,氢键断裂。高温短时处理组相比于低温长时间处理组的无规卷曲含量显著升高(P<0.05),是因为杀菌强度增大导致蛋白二级结构被破坏,蛋白部分有序结构逐渐向无规卷曲结构转化。122 ℃以上高温处理组的蛋白质分子被剧烈破坏,α-螺旋和β-折叠向无规卷曲转化的程度高于低温处理组。这与蛋白的变性及逐渐形成聚集体有关,β-折叠结构易转变为β-转角结构,同时部分β-折叠结构向无规卷曲转变,与康怀彬等[28]研究结果相似。
表2 不同杀菌强度肉糜火腿肠的二级结构相对含量
Table 2 Percentages of secondary structure of proteins in cooked sausage with different sterilization intensities %
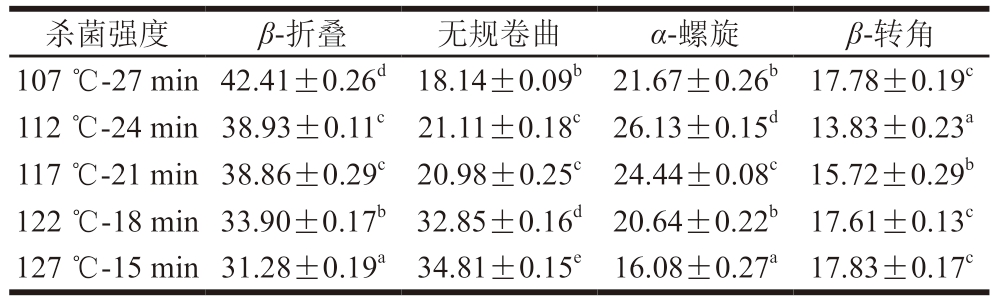
注:同列小写字母不同表示差异显著(P<0.05)。
杀菌强度β-折叠无规卷曲α-螺旋β-转角107 ℃-27 min 42.41±0.26d 18.14±0.09b 21.67±0.26b 17.78±0.19c 112 ℃-24 min 38.93±0.11c 21.11±0.18c 26.13±0.15d 13.83±0.23a 117 ℃-21 min 38.86±0.29c 20.98±0.25c 24.44±0.08c 15.72±0.29b 122 ℃-18 min 33.90±0.17b 32.85±0.16d 20.64±0.22b 17.61±0.13c 127 ℃-15 min 31.28±0.19a 34.81±0.15e 16.08±0.27a 17.83±0.17c
2.6 杀菌强度对肉糜火腿肠微观结构的影响
由图6可知,随着杀菌温度升高,火腿肠凝胶结构出现较大空腔和不连续团状聚集体,这可能是由于杀菌过程中肌原纤维蛋白氧化聚集导致。杀菌温度升高,火腿肠中肌肉纤维结构完整性被破坏程度变大,空间状态改变,持水性下降,肌纤维收缩,肌纤维之间空隙增加,肌内膜和肌束膜分离,肌束膜出现颗粒化,可能因为高温使可溶性胶原蛋白和肌原纤维蛋白分解。107 ℃-27 min处理组有孔洞,112 ℃-24 min和117 ℃-21 min处理组可以观察到细小颗粒、孔洞相对较少,此状态下火腿肠保水性较高,质构品质较好,产品更紧实,切片更光滑。当温度升高到122、127 ℃时,火腿肠微观结构有较多孔洞,比较粗糙,此状态下肠体结构较松散,切面不光滑。由此可见,与低温处理组相比,122 ℃以上高温处理组肌内膜的颗粒化程度增大,肌束膜变成松散絮状结构,保水性变差。从微观结构变化来看,122 ℃以上高温处理使产品结构变差。Jiang Qixing等[29]研究加热对草鱼微观结构的影响,发现处理温度越高,肉中的肌纤维收缩越严重,这与本研究结果一致。

图6 不同杀菌强度肉糜火腿肠的微观结构
Fig.6 Microstructure of cooked sausage with different sterilization intensities
A.1 0 7 ℃-2 7 m i n;B.1 1 2 ℃-2 4 m i n;C.117 ℃-21 min;D.122 ℃-18 min;E.127 ℃-15 min。
2.7 杀菌强度对肉糜火腿肠水分分布的影响
由图7可知,横向弛豫时间T2在1~1 000 ms弛豫时间内有4 个峰,与孔金花[30]研究结果一致。如表3所示,杀菌温度越高,R20越小。122 ℃以上高温处理组R20均小于低温处理组,但127 ℃的R20过小,会使火腿肠保水性下降。这是由于火腿肠受热后蛋白变性,一部分蛋白迅速紧缩,导致结合水与蛋白质结合能力降低,使结合水含量减少。同时,较高的杀菌温度会使T20减小,T22增大,可能是高温杀菌促进火腿肠中一部分结合水向自由水迁移,这会使保水性变差。Hughes等[31]研究表明,热杀菌会使肉制品蛋白变性收缩,使水分从肌原纤维间排出,肉品多汁性和嫩度也会随之改变,与本研究结论相符。
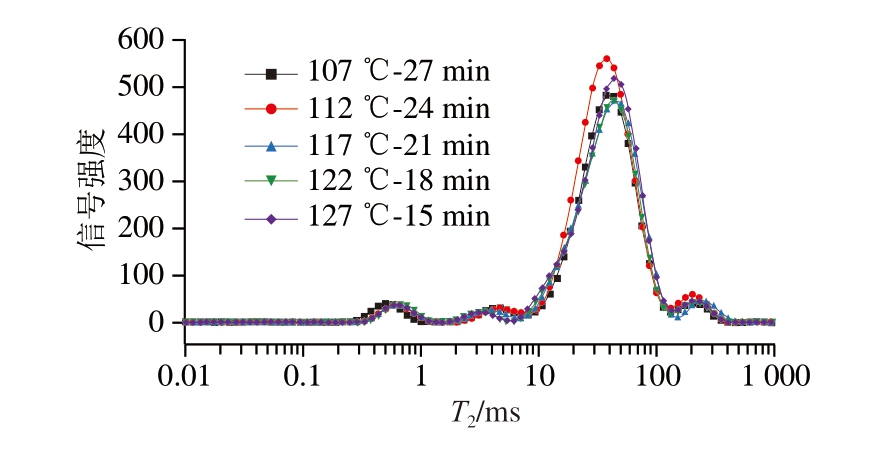
图7 不同杀菌强度肉糜火腿肠水分分布情况
Fig.7 Water distribution of cooked sausage sterilization intensities
表3 不同杀菌强度肉糜火腿肠的横向弛豫时间T2和峰面积占比R2
Table 3 Transverse relaxation time T2 and peak area ratio R2 of cooked sausage with different sterilization intensities
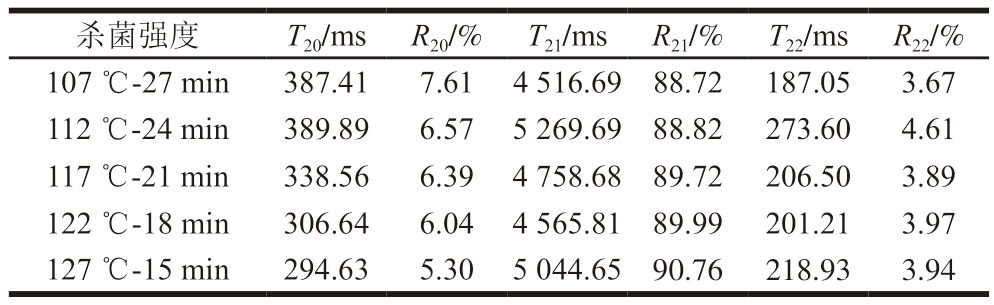
杀菌强度T20/ms R20/% T21/ms R21/% T22/ms R22/%107 ℃-27 min387.417.61 4 516.69 88.72 187.053.67 112 ℃-24 min389.896.57 5 269.69 88.82 273.604.61 117 ℃-21 min338.566.39 4 758.68 89.72 206.503.89 122 ℃-18 min306.646.04 4 565.81 89.99 201.213.97 127 ℃-15 min294.635.30 5 044.65 90.76 218.933.94
3 结 论
高温肉糜火腿肠加热杀菌时,杀菌温度升高,火腿肠蛋白质降解程度增大,且高温处理组(127 ℃、15 min和122 ℃、18 min)的WSN、NPN含量及PI较大,显著高于其余3 组(P<0.05)。随杀菌温度升高,蛋白质氧化程度增大,羰基含量显著增大,巯基含量显著减小(P<0.05),122 ℃以上高温处理组羰基含量较大,且两组间差异不显著;荧光光谱测定结果表明,升温促进蛋白质氧化,122 ℃以上高温杀菌对火腿肠蛋白质氧化程度影响更大;通过傅里叶变换红外光谱检测发现,杀菌温度升高导致蛋白部分有序结构逐渐向无规卷曲结构转化,高温处理下蛋白质分子被剧烈破坏;通过扫描电子显微镜发现,低温处理组细小颗粒、孔洞相对较少,但随杀菌温度升高,微观结构变差;通过低场核磁共振检测发现,随着杀菌温度升高,自由水含量增大,保水性变差。综上分析,122 ℃以上高温杀菌会促进蛋白质的降解与氧化,进一步影响蛋白质二级结构及微观结构,导致高温肉糜火腿肠保水性及风味等发生变化。关于加热导致蛋白质氧化对火腿肠风味的影响及机制还有待进一步探究。
[1] 林瑞君.复配卡拉胶在改善火腿肠品质方面的应用研究[D].厦门:集美大学, 2018: 8-18.
[2] DE OLIVEIRA R F, DA COSTA HENRY F, DO VALLE F, et al.Effect of the fruit aqueous extract of Brazilian pepper tree (Schinus terebinthifolius, Raddi) on selected quality parameters of frozen fresh pork sausage[J].Journal of Agriculture and Food Research, 2020, 2:100055.DOI:10.3844/ajidsp.2012.163.167.
[3] BARBIERATO E, GRIBAUDO M, IACONO M.Performance evaluation of NoSQL big-data applications using multi-formalism models[J].Future Generation Computer Systems, 2014, 37: 345-353.DOI:10.1016/j.future.2013.12.036.
[4] 钟华珍, 刘永峰, 甘斐, 等.高温加工方式对肉品质的影响[J].食品与机械, 2017,33(11): 190-194.DOI:10.13652/j.issn.1003-5788.2017.11.039.
[5] 高晓平, 赵改名, 杨家威, 等.温度对高温火腿肠品质的影响[J].肉类工业, 2019(5): 19-24.DOI:10.3969/j.issn.1008-5467.2019.05.005.
[6] ZHU N, ZHANG S, ZHAO B, et al.Effect of processing on protein degradation and quality of emulsion sausages[J].Food Bioscience,2020, 37(3): 100685.DOI:10.1016/j.fbio.2020.100685.
[7] 陈瑶君, 曾少葵, 陈振邦, 等.杀菌条件对贝肉火腿肠质构和色泽的影响[J].轻工科技, 2022, 38(6): 7-10.
[8] LAN C M, KAO T H, CHEN B H.Effects of heating time and antioxidants on the formation of heterocyclic amines in marinated foods[J].Journal of Chromatography B, 2004, 802(1): 27-37.DOI:10.1016/j.jchromb.2003.09.025.
[9] DA D, NIAN Y, ZOU B, et al.Influence of induction cooking on the flavor of fat cover of braised pork belly[J].Journal of Food Science,2021, 86(5): 1997-2010.DOI:10.1111/1750-3841.15710.
[10] PARK D, XIONG Y L, ALDERTON A L.Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J].Food Chemistry, 2007, 101(3):1239-1246.DOI:10.1016/j.foodchem.2006.03.028.
[11] LIU P, WANG S, ZHANG H, et al.Influence of glycated nitrosohaemoglobin prepared from porcine blood cell on physicochemical properties, microbial growth and flavour formation of Harbin dry sausages[J].Meat Science, 2019, 148: 96-104.DOI:10.1016/j.meatsci.2018.10.008.
[12] 牛树彬, 田婧, 周慧敏, 等.风干肠加工和贮藏过程中蛋白质的降解规律[J].肉类研究, 2020, 34(4): 1-7.DOI:10.7506/rlyj1001-8123-20200203-031.
[13] VOSSEN E, DE SMET S.Protein oxidation and protein nitration influenced by sodium nitrite in two different meat model systems[J].Agricultural and Food Chemistry, 2015, 63(9): 2550-2556.DOI:10.1021/jf505775u.
[14] YONGSAWATDIGUL J, PARK J W.Thermal denaturation and aggregation of threadfin bream actomyosin[J].Food Chemistry, 2003,83(3): 409-416.DOI:10.1016/S0308-8146(03)00105-5.
[15] 于小番.不同烹调热处理对刀额新对虾蛋白质结构、氧化特性及消化性的影响[D].扬州: 扬州大学, 2021: 17-21.DOI:10.27441/d.cnki.gyzdu.2021.000138.
[16] 王玉娇, 陈晓红, 李伟, 等.青梅汁酸凝豆腐质构优化及显微结构分析[J].食品科学, 2014, 35(6): 40-43.DOI:10.7506/spkx1002-6630-201406008.
[17] 蔡国华.海鱼干的工艺优化及其加工过程中的品质变化[D].太原:山西农业大学, 2016: 24-27.
[18] 戴妍.欧姆加热对猪肉蛋白质降解、氧化以及凝胶特性的影响[D].北京: 中国农业大学, 2014: 23-26.
[19] 殷小钰, 刘昊天, 邹汶蓉, 等.肌肉蛋白与挥发性风味物质的相互和用机制及影响因素研究进展[J].食品科学, 2020, 41(15): 288-294.DOI:10.7506/spkx1002-6630-20190815-158.
[20] MA J B, WANG X Y, ZHANG Q, et al.Oxidation of myofibrillar protein and crosslinking behavior during processing of traditional air-dried yak (Bos grunniens) meat in relation to digestibility[J].LWT-Food Science and Technology, 2021, 142(1): 110984-111002.DOI:10.1016/j.lwt.2021.110984.
[21] KHAN M A, ALI S, YANG H, et al.Improvement of color, texture and food safety of ready-to-eat high pressure-heat treated duck breast[J].Food Chemistry, 2018, 277(9): 277-313.DOI:10.1016/j.foodchem.2018.11.006.
[22] WANG K, ARNTFIELD S D.Binding of carbonyl flavours to canola,pea and wheat proteins using GC/MS approach[J].Food Chemistry,2014, 157: 364-372.DOI:10.1016/j.foodchem.2014.02.042.
[23] ZHANG Y, CHEN L, LÜ Y, et al.Inhibition of interaction between epigallocatechin-3-gallate and myofibrillar protein by cyclodextrin derivatives improves gel qualityunder oxidative stress[J].Food Research International, 2018, 108: 8-17.DOI:10.1016/j.foodres.2018.03.008.
[24] 夏超.烤制过程中牛肉脂质和蛋白质的氧化规律及晚期糖基化终产物对小鼠健康的影响[D].扬州: 扬州大学, 2022: 13-17.DOI:10.27441/d.cnki.gyzdu.2022.001421.
[25] CAO Y G, TRUE A D, CHEN J, et al.Dual role (anti- and pro-oxidant)of gallic acid in mediating myofibrillar protein gelation and gel in vitro digestion[J].Journal of Agricultural and Food Chemistry, 2016,64(15): 3054-3061.DOI:10.1021/acs.jafc.6b00314.
[26] XU B, YUAN J, WANG L, et al.Effect of multi-frequency power ultrasound (MFPU) treatment on enzyme hydrolysis of casein[J].Ultrasonics Sonochemistry, 2019, 63: 104930.DOI:10.1016/j.ultsonch.2019.104930.
[27] 刘锞琳, 何悦珊, 王钊, 等.傅里叶红外光谱法与拉曼光谱法测定蛋白质二级结构研究进展[J].食品与发酵工业, 2023, 49(10): 293-298.DOI:10.13995/j.cnki.11-1802/ts.031883.
[28] 康怀彬, 邹良亮, 张慧芸, 等.高温处理对牛肉蛋白质化学和用力及肌原纤维蛋白结构的影响[J].食品科学, 2018, 39(23): 80-86.DOI:10.7506/spkx1002-6630-201823013.
[29] JIANG Q X, HAN J W, GAO P, et al.Effect of heating temperature and duration on the texture and protein composition of bighead carp(Aristichthys nobilis) muscle[J].International Journal of Food Properties,2018, 21(1): 2110-2120.DOI:10.1080/10942912.2018.1489835.
[30] 孔金花.小龙虾生产工序工程化应用研究[D].扬州: 扬州大学,2022: 12-15.DOI:10.27441/d.cnki.gyzdu.2022.001527.
[31] HUGHES J, OISETH S, PURSLOW P, et al.A structural approach to understanding the interactions between colour, water-holding capacity and tenderness[J].Meat Science, 2014, 98(3): 520-532.DOI:10.1016/j.meatsci.2014.05.022.