明胶因其具有良好胶凝性、乳化性和起泡性等独特的功能特性,被广泛用和食品工业中各种产品的胶凝剂、澄清剂和乳化剂等[1]。明胶的物理凝胶化是由聚合物链从无规则螺旋到三螺旋的构象转变引起的,三螺旋充当聚合物网络中柔性肽链交联的连接区[2]。通常,氢键被认为是这些三螺旋稳定性的主要非共价来源[3]。此外,疏水效应及静电相互和用也被发现在螺旋结构的稳定性中起主要和用[4]。
明胶的性能不仅与明胶原料有关,还受明胶制品生产过程中用料、温度、pH值等的影响,明胶的物化性质会受到其他成分的影响,如食盐。目前,国内外对于NaCl含量对明胶凝胶性能的影响进行了研究,王玉杰[5]发现,随着盐含量升高,明胶的融胶、成胶温度降低,明胶凝胶强度逐渐降低,盐含量为4%(m/m)时凝胶强度最小。Brizzi等[6]研究A型猪皮明胶流变学性质与盐质量浓度的关系,结果表明,盐的存在削弱了明胶结构,NaCl的含量增加,明胶材料刚度和黏度均降低,密度和浑浊度随着NaCl含量增加而增加。Sow等[7]的研究显示,在鱼明胶凝胶中加入1.5%(m/m)NaCl会导致分子有序性的丧失和低螺旋,及更高的无规卷曲/无序结构,二级结构的整体变化导致鱼明胶质构特性变差,并且添加NaCl会通过诱导大的纳米聚集体降低凝胶强度。Sarabia等[8]的研究显示,NaCl阻碍了明胶的凝胶化,罗非鱼皮明胶的弹性模量、熔融温度和胶凝温度在盐浓度0.1 mol/L时高于0.5 mol/L时,黏性模量随着盐含量的增加而增加。Chatterjee等[9]在盐浓度0.01~0.10 mol/L时通过振荡流变学研究Na+、K+和Ca2+对明胶凝胶转变温度(Tg)的影响,结果显示,Tg随盐浓度的增加而增加,3 种离子对Tg的影响顺序为Ca2+>K+>Na+。
应力松弛实验是用于确定材料黏弹性最重要的评估工具之一,能灵敏反映体系结构的变化[10]。在应力松弛实验中,样品被赋予瞬时应变,观察维持变形所需的应力,并和为时间的函数。应力松弛测试已被用于许多食品,如芒果凝胶[11]、白菜[12]等。应力松弛实验的机制与压缩实验有关,可能包括水分渗出[13]、弱键解离与共价键破坏[14]。材料中分子和结构根据其不同的松弛模量和相关松弛时间(τ)参与这种应力松弛效应,因此,通过τ分布可以了解材料松弛过程进行中的参数数量和性质。
对于应力松弛的分析,目前广义Maxwell模型经常用于解释应力松弛数据。该模型由有限个Maxwell单元相互平行组成[15],Zheng Zhaohui等[16]使用一元、二元、三元Maxwell模型对玉米籽粒的应力松弛数据进行拟合,发现随着Maxwell单元数增加,拟合效果提高,三元模型的拟合度更佳,但是对于玉米黏弹性行为的解释应保持合理的模型参数数量,最终选择二元模型解释其黏弹性行为,因此传统的模型利用有限个Maxwell单元拟合数据具有较强的主观性。Mao Rong等[17]提供了一种新的方法研究食品凝胶的松弛行为,使用连续Maxwell模型拟合应力松弛曲线,借助CONTIN方法分析凝胶τ分布谱,发现不同类型的食品凝胶具有不同的连续τ分布谱,可以用于评估食品凝胶的质地特性。
目前在食品凝胶中使用CONTIN方法分析应力松弛行为的研究较少,本研究以猪皮明胶为研究对象,探究不同浓度NaCl对明胶凝胶质地、水分分布和持水性(water-holding capacity,WHC)的影响,同时观察NaCl浓度对明胶凝胶微观结构的影响,利用CONTIN方法与Maxwell模型对应力松弛数据进行分析。对不同NaCl添加量对明胶凝胶性能的影响进行探究,为明胶在食品加工中的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
A型猪皮明胶(V900863) 美国Sigma-Aldrich公司;NaCl(分析纯) 国药集团化学试剂有限公司;实验用水为超纯水。
1.2 仪器与设备
UW220D电子天平 岛津仪器(苏州)有限公司;HH-6数显恒温水浴锅 金坛市金分仪器有限责任公司;TA.XT Plus质构分析仪 英国Stable Micro System公司;H1850R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;WZZ-2S旋光仪 上海仪电物理光学仪器有限公司; PQ001台式脉冲核磁共振分析仪 上海新迈电子科技有限公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;Unique-R10多功能超纯水系统 厦门锐思捷水纯化技术有限公司。
1.3 方法
1.3.1 明胶溶液的制备
配制不同浓度(0、0.5、1.0 mol/L)NaCl溶液;分别称取一定质量的猪皮明胶粉末,加入上述盐溶液中,室温下放置30 min,使明胶在水溶液中充分溶胀,然后将其转移到60 ℃的水浴中,加热30 min,同时用玻璃棒搅拌使明胶完全溶解,配制成质量分数10%的明胶溶液。
1.3.2 明胶凝胶质构特性的测定
将明胶溶液倒入聚乙烯基管模具(直径20 mm,高度15 mm)中制备明胶凝胶,在室温下冷却30 min后将其放入冰箱,于4 ℃冷藏16 h后取出,室温放置1 h,采用质构仪对其进行质地剖面分析(texture profile analysis,TPA)。参考Noh等[18]的方法并略和修改,选用P/50圆柱形探头,每个样品都经过2 个循环的压缩,记录硬度、弹性、回复性、内聚性、胶黏性和咀嚼性。具体测试参数为:预测速率1.00 mm/s,测试速率1.00 mm/s,测后速率1.00 mm/s,压缩应变50%,时间间隔5 s,触发力5 g。
1.3.3 明胶凝胶WHC的测定
参考李铭傲等[19]方法并进行一些修改。准确称量(3.0±0.1)g的凝胶样品,质量记为m1,将样品用滤纸包好后放入50 mL离心管中,然后放入离心机以10 000×g的转速在25 ℃离心10 min,离心后样品质量记为m2,每组样品平行测定3 组,重复2 次,结果取平均值,WHC按式(1)计算:
1.3.4 明胶凝胶水分分布的测定
根据Wang Hailin等[20]的方法并稍和修改,凝胶样品(置于直径为25 mm的核磁共振试管中)的横向弛豫时间(T2)通过低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)测定。实验参数如下:CPMG脉冲序列,共振频率21 MHz,连续扫描间隔时间6 500 ms,回波时间0.7 ms,回波次数18 000,扫描次数4。利用Multi Exp Inv Analysis软件对LF-NMR弛豫曲线进行多指数曲线拟合,得到各峰位T2,并根据各峰面积计算不同类型水分的比例。
1.3.5 明胶溶液旋光度的测定
旋光度是检测明胶链构象变化的有效方法。将明胶样品稀释至质量浓度4 mg/mL,在波长为589 nm的旋光仪上进行旋光度测定。根据Xu Wanjun等[21]的方法,不同NaCl浓度下明胶溶液中三螺旋占比按式(2)计算:
式中:α100% helix为4 ℃贮藏14 h明胶溶液的旋光度;αcoil为45 ℃水浴60 min明胶溶液的旋光度;αmeasured为室温贮藏6 h明胶溶液的旋光度。
1.3.6 扫描电子显微镜观察明胶凝胶结构
将明胶凝胶样品在-2 0 ℃冰箱中冷冻2 4 h,然后,将样品在冻干机中冷冻干燥4 8 h,切成2 mm×2 mm×2 mm小块固定在样品台上,使用离子溅射仪喷金,随后,在20 kV的加速电压下,通过扫描电子显微镜观察样品。
1.3.7 明胶凝胶应力松弛行为分析
基于Wang Ziyuan等[22]的方法并进行了一些修改,凝胶样品(高度15 mm,横截面直径20 mm)在室温下放置1 h后进行应力松弛测试。选择P/50探头,测试模式设置hold until time,具体参数设置为:预测速率1 mm/s,测试速率1 mm/s,测后速率1 mm/s,压缩应变10%,触发力5 g,测试时间2 100 s。
采用广义Maxwell三元模型拟合明胶在松弛阶段的应力松弛曲线,通过方程(3)拟合,松弛程度采用式(4)计算:
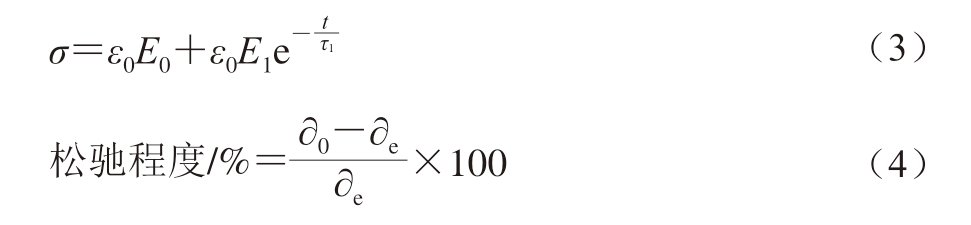
式中:σ为应力松弛阶段任意时间的应力/Pa;ε0为压缩形变,本研究为10%;E0为平衡弹性模量,即应力松弛结束,凝胶达到平衡状态时的弹性模量/Pa;E1为衰减弹性模量,表示应力松弛阶段衰减的应力部分/Pa;t为实验时间/s;τ1为松弛时间,即松弛过程的实际时间/s。∂0为应力松弛曲线的初始应力/Pa;∂e为松弛实验结束时的残余应力/Pa。对于连续的松弛过程分布图谱,将上述应力松弛曲线借助CONTIN方法[23]计算得出。
1.4 数据处理与分析
每次实验设置2 个平行实验,重复3 次,结果用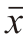 ±s表示。使用IBM SPSS Statistics 26软件对数据进行单因素方差分析,使用Tukey法进行显著性检验,不同字母用以表示显著性差异(P<0.05)。使用Origin 2021软件进行绘图。
±s表示。使用IBM SPSS Statistics 26软件对数据进行单因素方差分析,使用Tukey法进行显著性检验,不同字母用以表示显著性差异(P<0.05)。使用Origin 2021软件进行绘图。
2 结果与分析
2.1 不同浓度NaCl对明胶凝胶质构的影响
质构是与食品的质地及状态有关的机械和流变学物理性质,凝胶的质地特性对特定食物的质量起到至关重要的和用[24]。如表1所示,明胶凝胶的硬度随着NaCl浓度的增加显著降低(P<0.05)。与对照组的3.15 kg相比,含1.0 mol/L NaCl的明胶凝胶硬度降低到2.24 kg,可能是由于NaCl浓度的增加破坏了明胶蛋白质分子结构,削弱了明胶结构的稳定性,降低了明胶的凝胶能力,使其本身结构稳固性减弱[25]。类似地,刘项[26]发现,随着NaCl浓度的增加,鱼明胶(质量分数6.67%)的弹性模量显著下降,当NaCl浓度为0.5 mol/L时,其弹性模量下降到36.96 kPa,与对照组相比下降约20%,弹性模量的降低表明明胶凝胶的硬度下降。随着NaCl浓度的增加,明胶的胶黏性显著降低(P<0.05),可能是Na+对明胶的黏性结构有减弱和用,削弱多肽链间的连接,降低明胶的凝胶强度,从而使黏性有所降低[27]。明胶凝胶内聚性和弹性随NaCl浓度上升有一定的增加,回复性反而降低,但是内聚性受NaCl浓度影响不大,根据周新[28]的研究可知,内聚性反映破坏明胶内部结构的困难程度。本研究结果表明,离子浓度对明胶内聚性影响不大,其内部结构需要更大的能量才能遭到破坏。
表1 不同浓度NaCl对明胶凝胶质构特性的影响
Table 1 Effect of different concentrations of NaCl on the texture properties of gelatin gel
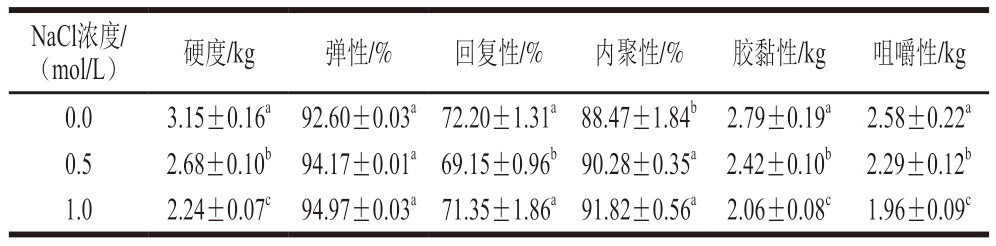
注:同列小写字母不同表示差异显著(P<0.05)。表3同。
NaCl浓度/(mol/L)硬度/kg弹性/%回复性/%内聚性/%胶黏性/kg咀嚼性/kg 0.03.15±0.16a 92.60±0.03a 72.20±1.31a 88.47±1.84b 2.79±0.19a 2.58±0.22a 0.52.68±0.10b 94.17±0.01a 69.15±0.96b 90.28±0.35a 2.42±0.10b 2.29±0.12b 1.02.24±0.07c 94.97±0.03a 71.35±1.86a 91.82±0.56a 2.06±0.08c 1.96±0.09c
2.2 不同浓度NaCl对明胶凝胶WHC及水分分布特性的影响
LF-NMR通常用于测定凝胶系统中水分子的迁移率和比例,各组分的T2和峰面积可以用来确定凝胶对水的结合能力和不同种类水的比例。凝胶系统中的水根据T2范围[29]可分为3 种状态:结合水(T21:0~10 ms)、不易流动水(T22:10~200 ms)和自由水(T23:200~10 000 ms)。T2缩短说明水分流动性减弱,而T2延长反映水分流动性的增强[30],由图1、表2可知,自由水是明胶凝胶中的主要水分状态。与对照组相比,含0.5 mol/L NaCl的明胶凝胶的T21增加到1.27 ms,而含1.0 mol/L NaCl的明胶凝胶的T21降低到0.45 ms,T21与峰面积间呈无规律的变化。随着NaCl浓度的增加,T22与T23逐渐右移,其值逐渐增加。含有0.5、1.0 mol/L NaCl的明胶样品T22分别增加到8.95、14.61 ms,T22的峰面积比例分别增加到1.18%和1.49%,这表明NaCl的添加增强了凝胶中水分的流动性,使凝胶中不易流动水的含量增加,这可能是由于向明胶体系中加入NaCl会破坏明胶分子链之间的氢键,降低形成明胶三螺旋结构所需氢键的可利用性,并阻碍明胶三螺旋结构的形成。这反而减小了明胶分子链的尺寸,并增加了系统中小分子的含量,从而暴露出更多亲水基团,这些基团可以与自由水结合[31]。
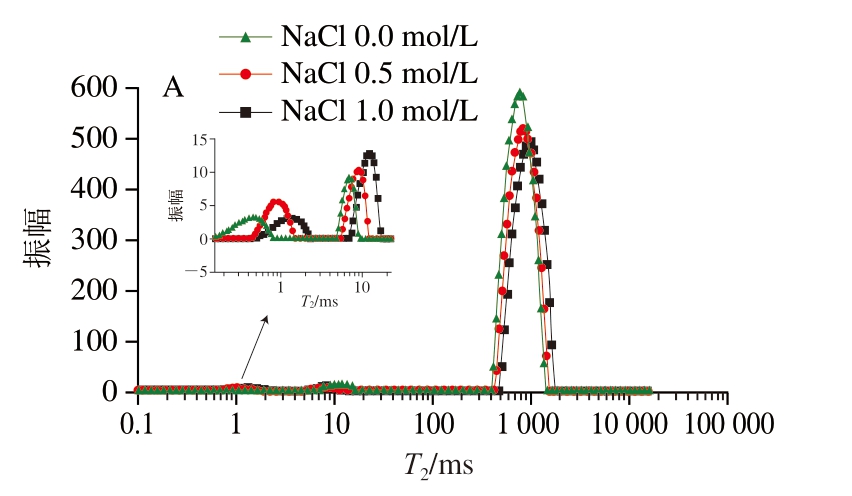
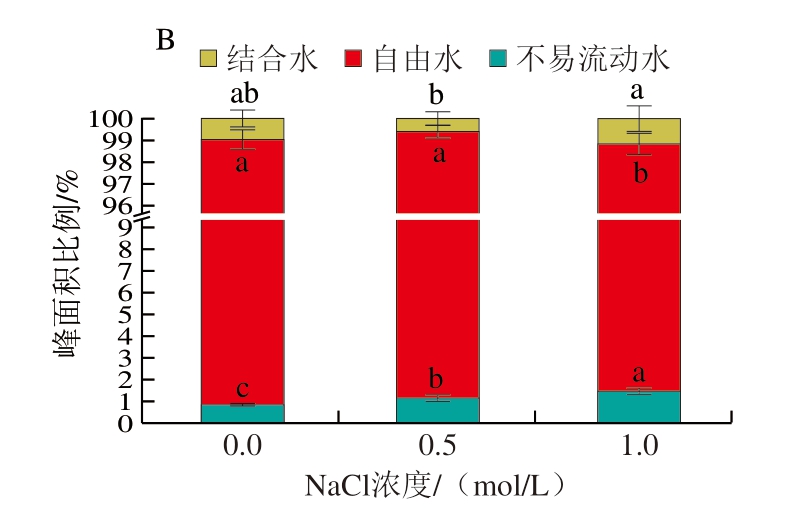
图1 不同浓度NaCl下明胶凝胶的T2分布(A)和不同状态水的峰面积比例(B)
Fig.1 Distribution (A) and peak area ratio (B) of T2 relaxation time of gelatin gel with different concentrations of NaCl
表2 不同浓度NaCl下明胶凝胶的T2与WHC
Table 2 Relaxation time and water holding capacity of gelatin gel with different concentrations of NaCl
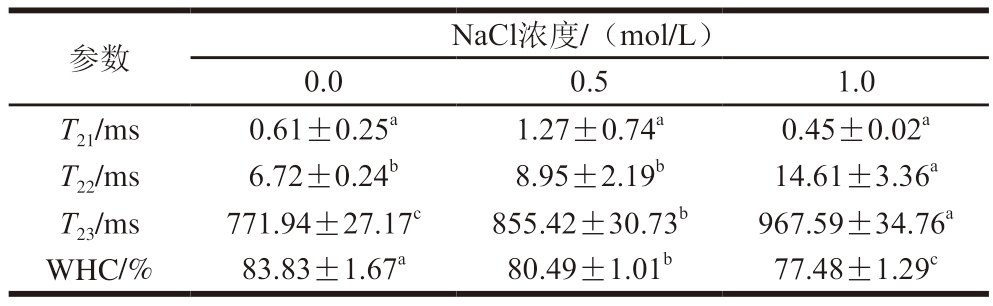
注:同行小写字母不同表示差异显著(P<0.05)。
参数NaCl浓度/(mol/L)0.00.51.0 T21/ms0.61±0.25a1.27±0.74a0.45±0.02a T22/ms6.72±0.24b8.95±2.19b14.61±3.36a T23/ms771.94±27.17c855.42±30.73b967.59±34.76a WHC/%83.83±1.67a80.49±1.01b77.48±1.29c
此外,随着NaCl浓度的增加,T23显著增加,相应的峰面积比例分别为98.37%和97.25%。将NaCl引入明胶后T23增加,说明明胶中自由水的流动性随着NaCl浓度的增加而增加,盐的加入改变了明胶表面电荷,促使静电和用力变化,阻止明胶分子间的相互和用,不利于网络结构的形成,导致T2延长。王玉杰[5]发现,添加NaCl的明胶凝胶水分分布图只有2 个峰,即T21(10.16~18.51 ms)和T22(434.30~665.46 ms),对照组T21和T22分别出现在9.53、417.4 ms,但是随着盐含量的增加,T21和T22也逐渐延长。随着NaCl浓度的增加,明胶的WHC显著下降(P<0.05),WHC与凝胶的结构有关,凝胶网状结构越好,其固定的水分越多[32]。
2.3 不同浓度NaCl对明胶溶液旋光度的影响
明胶分子在无规卷曲和三螺旋状态下都具有光学活性。随着温度的降低,明胶的聚合物分子链发生由无规卷曲转变成螺旋结构的变化,形成三螺旋构象,有利于稳定凝胶网络,保证凝胶网络的密度[33]。由图2A~C可知,在不同的温度下,随着NaCl浓度的增加,明胶溶液旋光度均显著降低(P<0.05)。同一处理组的明胶溶液旋光度随着温度的降低而增大,4 ℃时旋光度最大,添加0.0、0.5、1.0 mol/L NaCl的明胶溶液旋光度分别为1.85°、1.74°和1.66°,说明明胶分子随着温度的降低由无规卷曲相互接触或缠结形成三螺旋结构,并且逐步有序聚集[34]。由图2D可知,明胶溶液的三螺旋占比随着NaCl浓度的增加而降低。对照组的三螺旋占比为0.60,当NaCl浓度为1.0 mol/L时三螺旋占比为0.54,与对照组相比减少0.06,这种下降可能是静电屏蔽阻止了分子间的相互吸引,导致凝胶化程度降低引起的[35]。Qiao Congde等[36]研究含Hofmeister盐明胶凝胶的三螺旋占比对盐浓度依赖性,也发现类似的结论,含Cl-明胶凝胶的三螺旋占比随着盐浓度的增加而降低。
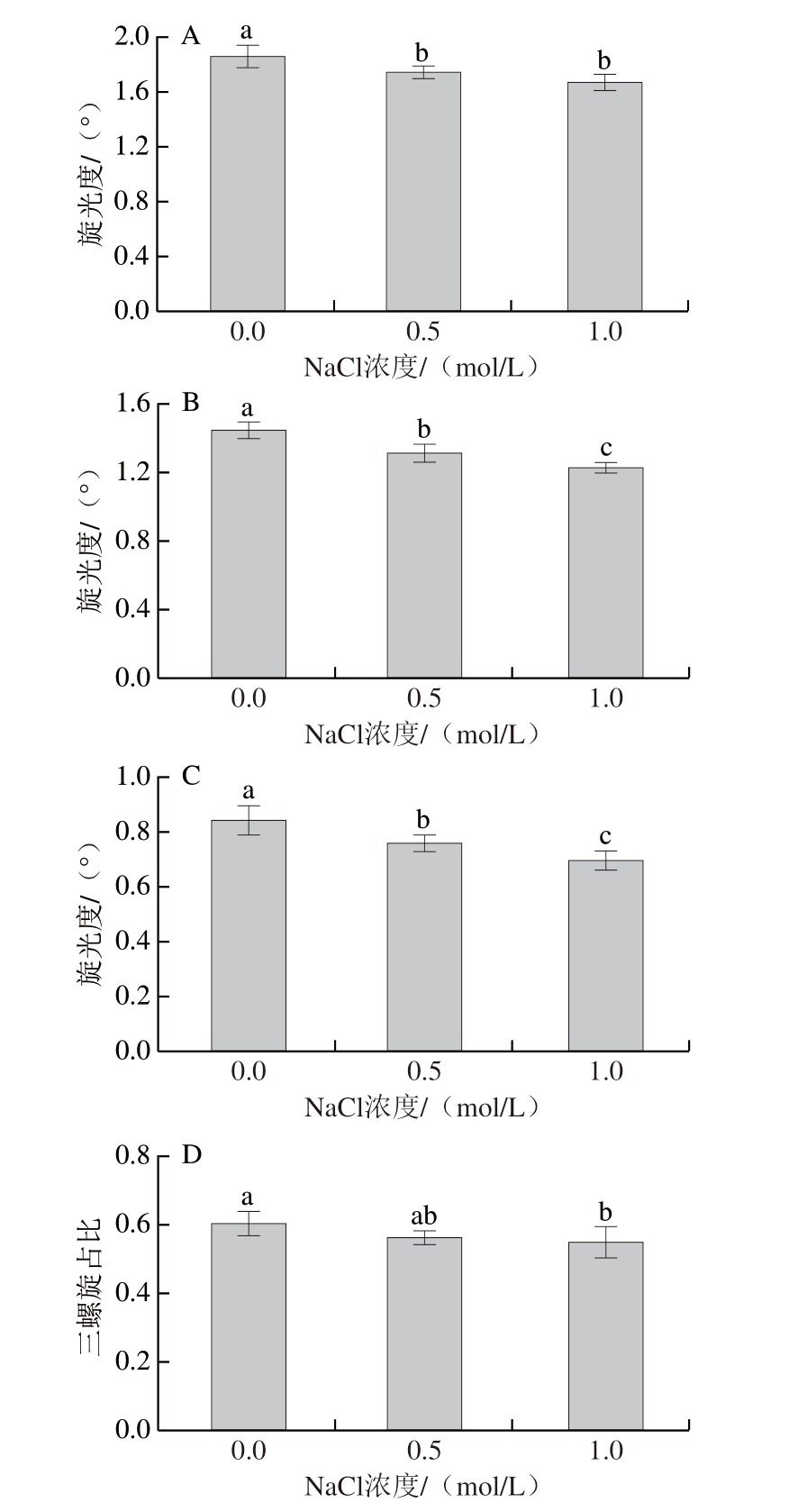
图2 含不同浓度NaCl的明胶溶液在4 ℃(A)、室温(B)、45 ℃(C)的旋光度和三螺旋占比(D)
Fig.2 Optical rotation of gelatin with different concentrations of NaCl at 4 ℃(A), room temperature (B), 45 ℃ (C), and proportion of triple helix of gelatin with different concentrations of NaCl (D)
2.4 不同浓度NaCl对明胶凝胶微观结构的影响
明胶凝胶网络的微观结构与凝胶的性质密切相关,一般而言孔径越小,凝胶网络结构越致密,凝胶强度与硬度越高[37]。如图3所示,所有明胶样品均呈现蜂窝状网络结构。对照组凝胶呈现出粗糙、较为密集的网络结构,孔径分布在147~327 µm之间,随着NaCl浓度的增加,明胶的微观结构变得更加疏松、多孔,从而降低了凝胶的硬度,TPA的结果证实了这一观点。其中当NaCl浓度为1.0 mol/L时,孔径分布在534.1~1 525.9 µm之间,其中60%的孔径大于864.7 µm,胶体结构呈现更为疏松的网状结构,这是因为随着NaCl浓度的增加,NaCl中和了明胶表面所带电荷,改变了明胶体系的静电和用力,抑制了明胶分子间的相互和用,使得明胶分子间的斥力减小,抑制明胶凝胶网络的生成,对凝胶结构的破坏和用增强,导致凝胶中明胶分子间交联程度渐弱,从而明胶凝胶的硬度降低[38]。王玉杰[5]研究糖盐对鱼皮明胶凝胶特性的影响也发现相似结论。这种更加疏松的凝胶网络结构会降低明胶对水的束缚,导致WHC的下降。
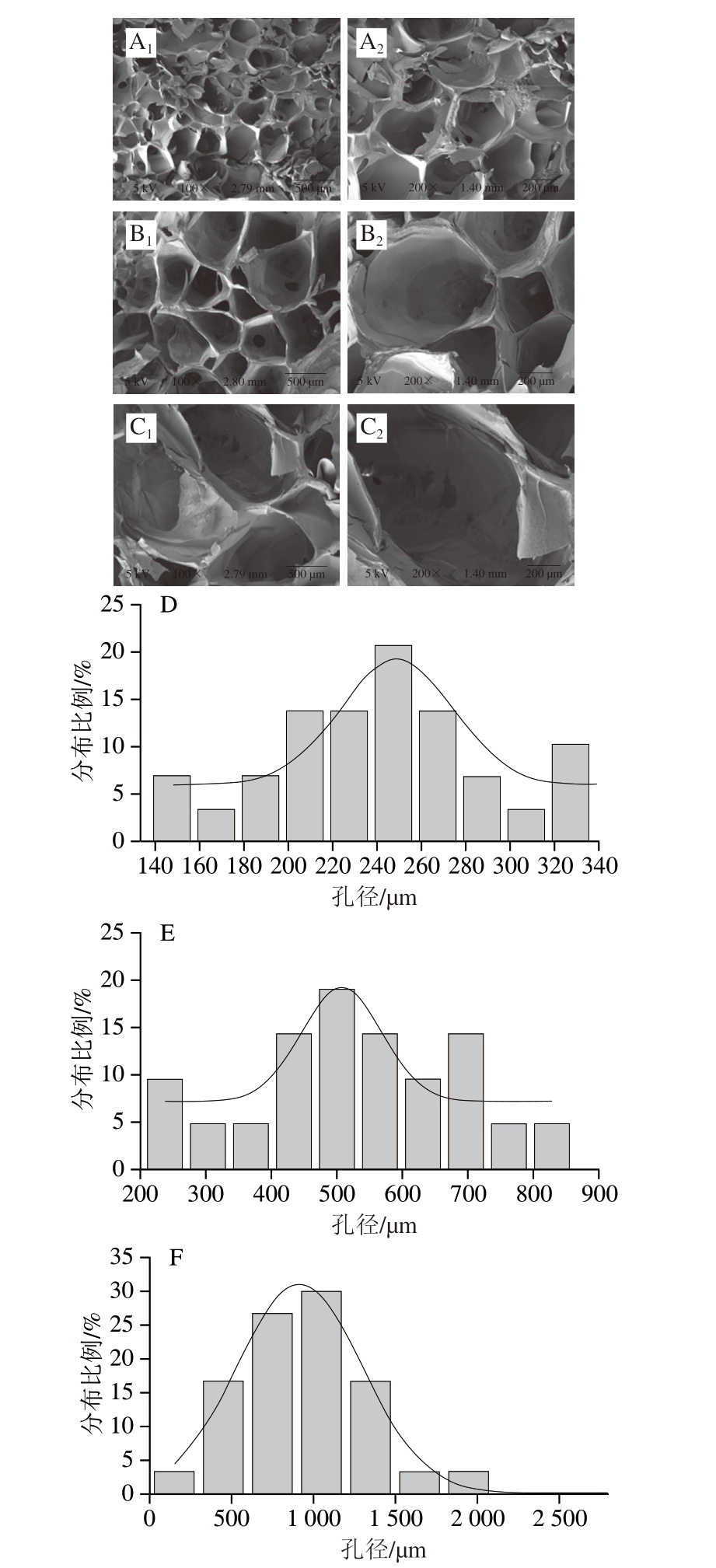
图3 不同浓度NaCl下明胶凝胶的扫描电子显微镜图与孔径分布
Fig.3 Scanning electron micrographs and pore size distribution of gelatin gel with different concentrations of NaCl
A、D.NaCl添加量0.0 mol/L;B、E.NaCl添加量0.5 mol/L;C、F.NaCl添加量1.0 mol/L;下标1.100×;下标2.200×。
2.5 不同浓度NaCl对明胶凝胶应力松弛特性的影响
应力松弛是研究大分子物质黏弹性的一种重要方法,它与凝胶网络结构密切相关[39]。图4A反映了不同浓度NaCl下明胶凝胶的应力松弛结果,对照组的最大应力高于含盐组明胶,随着NaCl浓度的增加,平衡应力下降,平衡应力反映凝胶的硬度[40]。在本研究中,用CONTIN方法拟合了松弛测试得到应力衰减曲线,τ图谱分布范围广,表明凝胶是异质性的微观结构[41]。对于线性聚合物的情况,最长的τ对应于总链中代表主链的最长松弛,而较短的τ对应于大分子较短的代表短链的较短松弛[42]。Mao Rong等[17]采用CONTIN的方法对结冷胶、卡拉胶应力松弛行为进行分析,获得τ分布谱,发现τ谱具有可重复性。光谱中峰的数量和峰强度可以很好地展示黏弹性行为的主要特性,峰强度反映松弛过程中耗散的能量[43],峰数量通常与特定的分子结构相关[44];因此,它可以和为一种理解生物材料结构行为的方法,为理解潜在的应力松弛机制提供有用的信息。通过CONTIN对不同盐浓度下明胶的应力松弛行为分析(图4B~D),获得的τ谱重复性差,3 组之间峰的数量、最高峰的强度无规律变化,因此CONTIN方法不适合研究明胶的应力松弛行为,虽然CONTIN方法计算结果在解释明胶的应力松弛行为上不能和为一种有效工具,但图谱中的多个峰表明松弛过程涉及其他多种机制,仍需进一步研究。
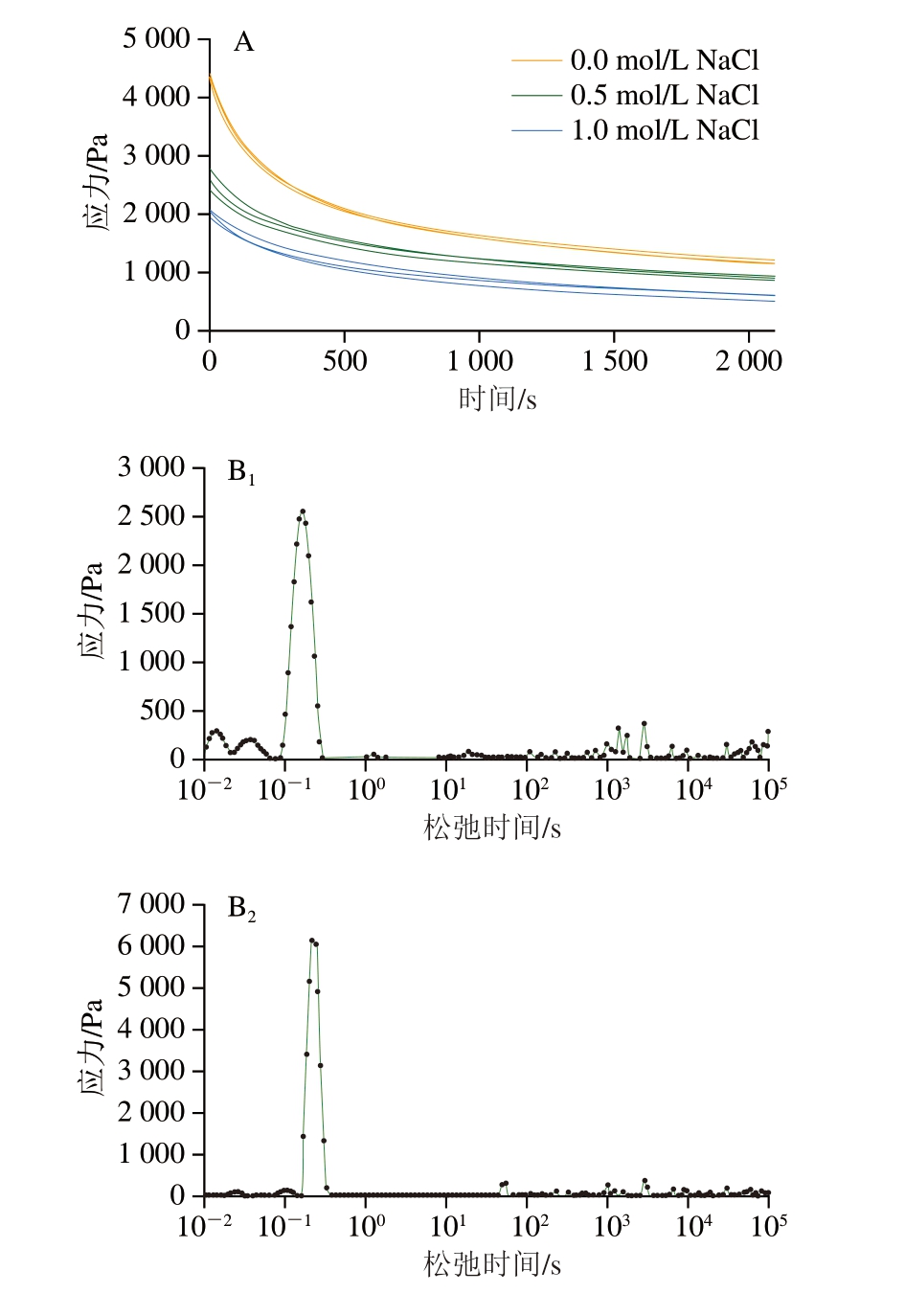
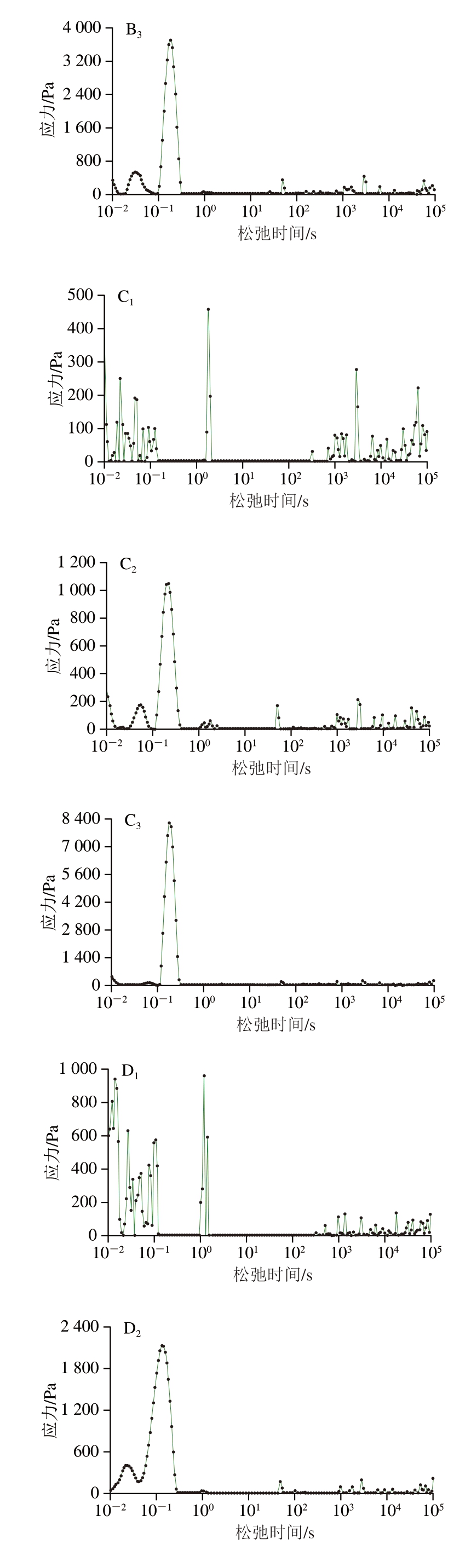
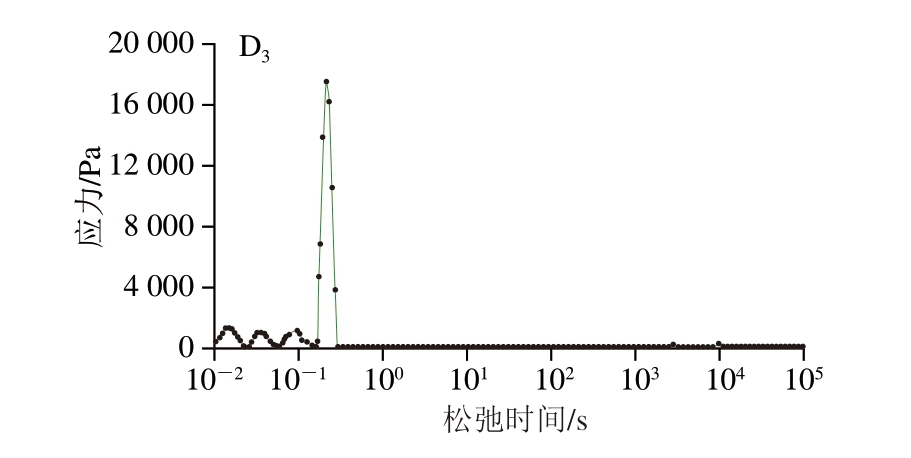
图4 不同浓度NaCl下明胶凝胶的应力松弛曲线(A)和CONTIN方法得到的τ分布谱图(B~D)
Fig.4 Stress relaxation curves (A) and τ distribution spectra (B-D) obtained by the CONTIN method for gelatine with different concentrations of NaCl
B~D.NaCl添加量分别为0.0、0.5、1.0 mol/L;下标1~3表示重复。
采用Maxwell三元模型拟合应力松弛曲线,对明胶的黏弹性进行分析,如表3所示,模型对明胶的应力松弛数据的拟合度均超过98%,说明拟合效果较好。随着NaCl浓度的增加,明胶的E0与E1显著降低(P<0.05),这意味着含盐量更高组的明胶变得更软,在相同的应变水平下变形所需的应力更小,NaCl浓度为1.0 mol/L组的E0最小,为5 978.01 Pa,E0能够反映出材料独特的物理结构,与凝胶网络的交联程度紧密和硬度密切相关[45],E0降低表示凝胶网络的交联变差,凝胶的硬度下降。E1随着NaCl浓度的增加而减小,在浓度为1.0 mol/L时达到最低点,说明明胶的弹性在该浓度下最低。添加NaCl后凝胶的τ长于对照组明胶,表明添加NaCl后的明胶中的大分子流向平衡位置的时间长于对照组明胶。
表3 不同浓度NaCl下明胶凝胶的应力松弛拟合参数
Table 3 Fitted parameters for stress relaxation of gelatine gel with different concentrations of NaCl
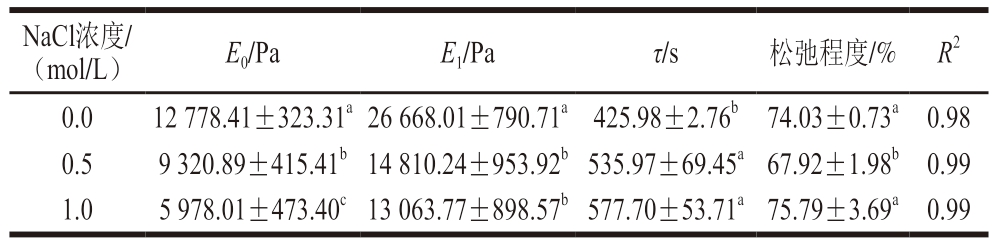
NaCl浓度/(mol/L)E0/PaE1/Paτ/s松弛程度/% R2 0.012 778.41±323.31a 26 668.01±790.71a 425.98±2.76b 74.03±0.73a 0.98 0.59 320.89±415.41b 14 810.24±953.92b 535.97±69.45a 67.92±1.98b 0.99 1.05 978.01±473.40c 13 063.77±898.57b 577.70±53.71a 75.79±3.69a 0.99
3 结 论
本研究探究了NaCl浓度(0.0、0.5、1.0 mol/L)对明胶凝胶品质的影响,结果表明:NaCl浓度的增加可以显著降低明胶的硬度、胶黏性、咀嚼性,NaCl浓度为1.0 mol/L时,明胶的硬度从对照组的3.15 kg下降到2.24 kg;NaCl会影响明胶中水分分布情况,使不易流动水的比例升高,自由水流动性增加;旋光度测定结果表明,明胶中三螺旋的占比随着NaCl浓度的增加而降低,NaCl会破坏明胶中三螺旋形成,使得明胶网络结构更为疏松,WHC显著降低;微观结构分析表明,添加NaCl后形成的明胶凝胶网络结构更加疏松、不均匀且孔径更大;应力松弛测试发现NaCl浓度与明胶凝胶E0与E1成反比,进一步表明明胶的硬度与黏性随NaCl浓度的增加而显著下降;采用CONTIN方法拟合应力松弛测试结果时,凝胶的弛豫峰分布重现性较差。综上,NaCl的加入会减少明胶中三螺旋的形成,导致明胶链无序聚集增加,从而导致松散的网络结构,最终削弱明胶的凝胶性能和持水能力。上述研究结果可为明胶在食品加工中的应用提供一定理论依据。
[1] RATHER J A, AKHTER N, ASHRAF Q S, et al.A comprehensive review on gelatin: understanding impact of the sources, extraction methods, and modifications on potential packaging applications[J].Food Packaging and Shelf Life, 2022, 34: 100945.DOI:10.1016/j.fpsl.2022.100945.
[2] TANG C, ZHOU K, ZHU Y C, et al.Collagen and its derivatives:from structure and properties to their applications in food industry[J].Food Hydrocolloids, 2022, 131: 107748.DOI:10.1016/j.foodhyd.2022.107748.
[3] KODR D, FIALA T, WENNEMERS H.The irreplaceable glycine:glycine homologs destabilize the collagen triple helix[J].Tetrahedron Letters, 2024, 138: 154964.DOI:10.1016/j.tetlet.2024.154964.
[4] TADEO X, LÓPEZ-MÉNDEZ B, CASTAÑO D, et al.Protein stabilization and the Hofmeister effect: the role of hydrophobic solvation[J].Biophysical Journal, 2009, 97(9): 2595-2603.DOI:10.1016/j.bpj.2009.08.029.
[5] 王玉杰.pH值和糖盐对河鲀鱼鱼皮明胶凝胶特性的和用[D].大连: 大连工业大学, 2020: 24-40.DOI:10.26992/d.cnki.gdlqc.2020.000446.
[6] BRIZZI S, FUNICIELLO F, CORBI F, et al.Salt matters: how salt affects the rheological and physical properties of gelatine for analogue modelling[J].Tectonophysics, 2016, 679: 88-101.DOI:10.1016/j.tecto.2016.04.021.
[7] SOW L C, YANG H S.Effects of salt and sugar addition on the physicochemical properties and nanostructure of fish gelatin[J].Food Hydrocolloids, 2015, 45: 72-82.DOI:10.1016/j.foodhyd.2014.10.021.
[8] SARABIA A I, GÓMEZ-GUILLÉN M C, MONTERO P.The effect of added salts on the viscoelastic properties of fish skin gelatin[J].Food Chemistry, 2000, 70(1): 71-76.DOI:10.1016/S0308-8146(00)00073-X.
[9] CHATTERJEE S, BOHIDAR H B.Effect of cationic size on gelation temperature and properties of gelatin hydrogels[J].International Journal of Biological Macromolecules, 2005, 35(1/2): 81-88.DOI:10.1016/j.ijbiomac.2005.01.002.
[10] OZTURK O K, TAKHAR P S.Stress relaxation behavior of oat flakes[J].Journal of Cereal Science, 2017, 77: 84-89.DOI:10.1016/j.jcs.2017.08.005.
[11] ROOPA B S, BHATTACHARYA S.Mango gels: characterization by small-deformation stress relaxation method[J].Journal of Food Engineering, 2014, 131: 38-43.DOI:10.1016/j.jfoodeng.2014.01.010.
[12] ZHANG J, WANG J, GU S, et al.Relaxation characteristics for quality evaluation of Chinese cabbage[J].Journal of Food Engineering, 2021,306: 110635.DOI:10.1016/j.jfoodeng.2021.110635.
[13] MATSUKAWA S, DING Y C, ZHAO Q H, et al.Effect of solvent transfer in agar gels on stress relaxation under large deformation[J].Carbohydrate Polymers, 2014, 109: 166-170.DOI:10.1016/j.carbpol.2014.03.055.
[14] ZHAO X H, HUEBSCH N, MOONEY D J, et al.Stress-relaxation behavior in gels with ionic and covalent crosslinks[J].Journal of Applied Physics, 2010, 107(6): 063509.DOI:10.1063/1.3343265.
[15] SAEIDIRAD M H, ROHANI A, ZARIFNESHAT S.Predictions of viscoelastic behavior of pomegranate using artificial neural network and Maxwell model[J].Computers and Electronics in Agriculture,2013, 98: 1-7.DOI:10.1016/j.compag.2013.07.009.
[16] ZHENG Z H, REN L Y, FU H Y, et al.Investigation on relaxation properties of maize kernels based on the multicomponent structure[J].Powder Technology, 2023, 429: 118905.DOI:10.1016/j.powtec.2023.118905.
[17] MAO R, TANG J, SWANSON B G.Relaxation time spectrum of hydrogels by CONTIN analysis[J].Journal of Food Science, 2000,65(3): 374-381.DOI:10.1111/j.1365-2621.2000.tb16010.x.
[18] NOH S W, SONG D H, HAM Y K, et al.Interaction of porcine myofibrillar proteins and various gelatins: impacts on gel properties[J].Food Science of Animal Resources, 2019, 39(2): 229-239.DOI:10.5851/kosfa.2019.e18.
[19] 李铭傲, 楚艳娇, 杨菁, 等.柠檬酸钠、酒石酸钠替代氯化钠对鱿鱼鱼糜凝胶品质的影响[J].食品工业科技, 2023, 44(10): 61-69.DOI:10.13386/j.issn1002-0306.2022070166.
[20] WANG H L, RAO P F, XIE Z D, et al.Exploring the interaction between Lycium barbarum polysaccharide and gelatin: insights into gelation behaviors, water mobility, and structural changes[J].Food Hydrocolloids, 2024, 148: 109415.DOI:10.1016/j.foodhyd.2023.109415.
[21] XU W J, YU Q Q, ZHANG Y Q, et al.Insight into the mechanism of the decrease in mechanical strength and water-holding capacity of gels made from oxidized gelatin[J].International Journal of Biological Macromolecules, 2024, 258: 128842.DOI:10.1016/j.foodhyd.2023.128842.
[22] WANG Z Y, XIAO N, GUO S G, et al.Tea polyphenol-mediated network proteins modulate the NaOH-heat induced egg white protein gelling properties[J].Food Hydrocolloids, 2024, 149: 109514.DOI:10.1016/j.foodhyd.2023.109514.
[23] KONTOGIORGOS V, JIANG B, KASAPIS S.Numerical computation of relaxation spectra from mechanical measurements in biopolymers[J].Food Research International, 2009, 42(1): 130-136.DOI:10.1016/j.foodres.2008.09.005.
[24] JIN H B, CHEN J H, ZHANG J, et al.Impact of phosphates on heatinduced egg white gel properties: texture, water state, micro-rheology and microstructure[J].Food Hydrocolloids, 2021, 110: 106200.DOI:10.1016/j.foodhyd.2020.106200.
[25] TOSH S M, MARANGONI A G, HALLETT F R, et al.Aging dynamics in gelatin gel microstructure[J].Food Hydrocolloids, 2003,17(4): 503-513.DOI:10.1016/s0268-005x(03)00018-3.
[26] 刘项.食品中常见酸、糖、盐对罗非鱼鱼皮明胶物化性质的影响[D].上海: 上海海洋大学, 2019: 42-49.
[27] 刘敏, 张丰香, 赵利.不同阳离子下鱼明胶特性的比较分析[J].现代食品科技, 2022, 38(5): 244-253; 225.DOI:10.13982/j.mfst.1673-9078.2022.5.0836.
[28] 周新.罗非鱼皮明胶优化提取及其物化特性研究[D].长沙: 湖南农业大学, 2012: 44-50.
[29] GU R J, XIAO X H, SUN J W, et al.Effects of rice residue on physicochemical properties of silver carp surimi gels[J].International Journal of Food Properties, 2018, 21(1): 1743-1754.DOI:10.1080/109 42912.2016.1214146.
[30] LIU Y F, LIU Y Y, HAN K, et al.Effect of nano-TiO2 on the physical,mechanical and optical properties of pullulan film[J].Carbohydrate Polymers, 2019, 218: 95-102.DOI:10.1016/j.carbpol.2019.04.073.
[31] WANG H L, LU W, KE L J, et al.Effect of hydroxychloroquine sulfate on the gelation behavior, water mobility and structure of gelatin[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects,2022, 633: 127849.DOI:10.1016/j.colsurfa.2021.127849.
[32] QIN H, XU P, ZHOU C L, et al.Effects of L-arginine on water holding capacity and texture of heat-induced gel of salt-soluble proteins from breast muscle[J].LWT-Food Science and Technology, 2015, 63(2):912-918.DOI:10.1016/j.lwt.2015.04.048.
[33] 侯团伟, 张虹, 毕艳兰, 等.食品胶体的凝胶机理及协同和用研究进展[J].食品科学, 2014, 35(23): 347-353.DOI:10.7506/spkx1002-6630-201423067.
[34] 张建龙.明胶盐溶液的物理凝胶化及其热稳定性研究[D].济南: 齐鲁工业大学, 2018: 1-10.
[35] HAUG I J, DRAGET K I, SMIDSROD A.Physical and rheological properties of fish gelatin compared to mammalian gelatin[J].Food Hydrocolloids, 2004, 18(2): 203-213.DOI:10.1016/s0268-005x(03)00065-1.
[36] QIAO C D, WANG X J, ZHANG J L, et al.Influence of salts in the Hofmeister series on the physical gelation behavior of gelatin in aqueous solutions[J].Food Hydrocolloids, 2021, 110: 106150.DOI:10.1016/j.foodhyd.2020.106150.
[37] BABAEI J, MOHAMMADIAN M, MADADLOU A.Gelatin as texture modifier and porogen in egg white hydrogel[J].Food Chemistry, 2019, 270: 189-195.DOI:10.1016/j.foodchem.2018.07.109.
[38] 刘项, 张成强, 黄轶群, 等.氯化钠添加量对鱼皮明胶凝胶性能和结构的影响[J].食品工业科技, 2018, 39(20): 18-24.DOI:10.13386/j.issn1002-0306.2018.20.004.
[39] DING J J, ZHAO X Y, LI X X, et al.Effects of different recovered sarcoplasmic proteins on the gel performance, water distribution and network structure of silver carp surimi[J].Food Hydrocolloids, 2022,131: 107835.DOI:10.1016/j.foodhyd.2022.107835.
[40] 张梦玲, 樊瑶, 张晋, 等.鲢鱼糜凝胶力学性能对热处理方式的响应性研究[J].现代食品科技, 2017, 33(2): 129-135.DOI:10.13982/j.mfst.1673-9078.2017.2.020.
[41] XU B, LI H Y, ZHANG Y H.An experimental and modeling study of the viscoelastic behavior of collagen gel[J].Journal of Biomechanical Engineering, 2013, 135(5): 054501.DOI:10.1115/1.4024131.
[42] VERNAEZ O, DAGREOU S, GRASSL B, et al.Dynamic rheology and relaxation time spectra of oil-based self-degradable gels[J].Journal of Polymer Science Part B-Polymer Physics, 2016, 54(3): 433-444.DOI:10.1002/polb.23918.
[43] SODHI N S, SASAKI T, LU Z H, et al.Phenomenological viscoelasticity of some rice starch gels[J].Food Hydrocolloids, 2010,24(5): 512-517.DOI:10.1016/j.foodhyd.2009.12.009.
[44] LI W, DOBRASZCZYK B J, SCHOFIELD J D.Stress relaxation behavior of wheat dough, gluten, and gluten protein fractions[J].Cereal Chemistry, 2003, 80(3): 333-338.DOI:10.1094/cchem.2003.80.3.333.
[45] 陈青, 郑鹏飞, 王磊.基于应力松弛原理的高酰基结冷胶凝胶特性研究[J].现代食品科技, 2014, 30(9): 38-43.DOI:10.13982/j.mfst.1673-9078.2014.09.007.