滩羊和为宁夏地区的特色畜种之一,其鲜肉及相关制品(手抓羊肉、卤羊肉和风干羊肉等)广受消费者喜爱[1]。当下滩羊在农场屠宰后多经冷却、排酸后直接进入市场,肉的嫩度、持水性难以进一步改善,且微生物指标难以控制。此外,由于内源性酶的自溶降解和用,肉的质构特征在贮藏过程中会不可避免地发生劣变,从而导致品质下降[2]。
高压处理是一种冷处理方式,其最大优势在于灭活微生物、延长食品货架期的同时可较好地保留食品原有的营养和风味[3]。目前,国内外学者针对高压处理技术对海产品[4-5]、各类畜产品包括羊肉[1,6]、牛肉[7]及猪肉[8-9]等肉类食品品质特性的影响和用进行了广泛研究。适当的高压处理有利于提高肉品的嫩度,但过度高压处理会引起僵直后期质构特性的劣变。高压处理主要通过介导肌肉蛋白氧化特性对肉品质产生影响,适度蛋白氧化有利于肉质改善,而过度蛋白氧化会造成肉质劣变[10]。因此,探究高压处理对僵直后期肌肉蛋白的氧化效应及机制对调控肉品质、指导高压处理工艺非常重要。半胱氨酸氧化修饰蛋白质组学是阐明蛋白质氧化还原调控机制的关键技术。半胱氨酸氧化位点、氧化形式鉴定及高通量蛋白质组学技术的应用有助于阐明蛋白质氧化还原机制及其相关下游代谢网络。如Fu Qingquan等[11]利用氧化修饰蛋白质组学研究了体外氧化对牛肉肌纤维分离蛋白生化特性的影响。
在肉品的质构特性中,硬度是影响消费者购买欲望最关键的指标之一。应力松弛实验是测定样品黏弹特性最重要的评价方法之一,可用于高压处理肉类的质构特性评价,具有快速、稳定和无损的特点,该方法所得结果已被证明与质地剖面分析实验确定的结构蛋白变化和质构特性具有一致性,可和为监测肌肉品质变化的方法[12]。尽管一些研究报道了高压处理对海鲜和肉类产品贮藏期间质构特性的影响[13],却很少有研究通过应力松弛实验监测羊肉贮藏过程中的微观质构变化,并从蛋白质氧化和半胱氨酸氧化修饰位点角度进一步建立加压肉质特性与半胱氨酸氧化修饰位点的相关性。因此,本研究以僵直后期滩羊背最长肌为研究对象,借助半胱氨酸氧化修饰蛋白质组学技术鉴定高压处理诱导僵直后期肌肉蛋白的半胱氨酸氧化修饰位点概况,寻找决定其贮藏过程中品质特性形成的关键蛋白氧化修饰位点,并通过鉴定肌肉蛋白氧化修饰强度、修饰位点与肉质构特性的相关性,了解高压处理诱导滩羊肉僵直后期蛋白氧化变化与机制。
1 材料与方法
1.1 材料与试剂
滩羊背最长肌采集于69 只中国宁夏盐池县新海牧场公滩羊(约8 月龄)。
乙二醇双(2-氨基乙醚)四乙酸(ethylene glycol bis(2-aminoethyl ether) tetraacetic acid,EGTA)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)(分析纯)北京博润莱特科技有限公司;磷酸缓冲盐溶液(phosphate buffered saline,PBS)(分析纯) 生工生物科技股份有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(分析纯) 美国Sigma公司;Tris-HCl、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、三氯乙酸(trichloroacetic acid,TCA)、乙酸乙酯、盐酸胍、甘氨酸、尿素、脱氧胆酸钠、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)(分析纯) 国药集团化学试剂有限公司;蛋白酶抑制剂、N-乙基顺丁烯二酰亚胺(N-ethylmaleimide,NEM)、三氟乙酸(trifluoroacetic acid,TFA)、三(2-羧乙基)膦(tris(2-chloroethyl)phosphate,TCEP)、二甲基亚砜(dimethyl sulfoxide,DMSO)、3-吲哚乙酸(indole-3-acetic acid,IAA)、叶酸(folic acid,FA)(均为分析纯)、BCA蛋白浓度测定试剂盒 美国Thermo Fisher Scientific公司。
1.2 仪器与设备
HPP-600超高压处理设备 包头科发有限公司;TA-XT Plus质构分析仪(配备Exponent 5.1.2.0软件)英国Stable Micro Systems公司;Q-Exactive HF-X质谱仪、Reprosil-Pur C18色谱柱(75 μm×150 mm,3 μm)美国Thermo Fisher Scientific公司;GL-10C低温离心机上海安亭科学仪器有限公司;722N紫外分光光度计上海精密科学仪器有限公司。
1.3 方法
1.3.1 样品处理
在屠宰3 h内从左半胴体上取背最长肌,在保鲜膜包裹下用冰袋于2 h内运送到实验室。剔除多余结缔组织及可见脂肪后,将处于僵直后期的背最长肌分割、修剪为大小、质量基本一致的长方体肉块(长×宽×高约为2.0 cm×5.5 cm×6.5 cm),总共189 块,并将其随机分为3 组(n=63),从每组中随机抽取3 块肉,真空包装。
参考本课题前期研究结果[14],以150 MPa、15 min为样品硬度显著劣化的临界压力条件,450 MPa、15 min为质构特性不再随压力呈明显递增效应的边界条件,基于此,最终选定200 MPa、15 min及500 MPa、15 min为本研究的压力阈值。参照Marcos等[15]的方法并进行改进。以5 MPa/s的上升速率达到预设压力200 MPa和500 MPa,维持15 min,释放压力时间为10 s,传压介质为蒸馏水,压力温度设置为18 ℃。以未高压处理的空白组(NT)为对照。所有样品在(4±1)℃下保存,在相应贮藏期(1、3 d)取样,后在-80 ℃超低温冰箱保存。在贮藏7 d时,将剩余样品从4 ℃冰箱取出,分为2 份,一份迅速装入冻存管并放置在-80 ℃超低温冰箱贮存,用于半胱氨酸氧化修饰蛋白质组学分析,另一份用于应力松弛实验和蛋白氧化测定实验。
1.3.2 应力松弛实验
参照Peleg[16]的方法并进行改进,使用质构分析仪以垂直于肌纤维方向从不同背最长肌样品中切出厚度为(20±1)mm的切片,用36 mm铝圆筒探针以1 mm/s的十字头速率压缩30%。将肉块样品压缩面垂直于肌纤维方向放置,保持压缩60 s,使应力达到平衡。每种处理条件(NT、200 MPa、500 MPa)下分析5 个肉块样品。采用Maxwell模型的修正版本进行力-时间关系拟合,如式(1)所示:
式中:δ(t)表示给定时间的应力/N;Ci表示应力松弛常数/N;δ0表示平衡应力/N;τi表示麦克斯韦元素的松弛时间/s;i表示第i个松弛过程;n表示模型中松弛过程的总数。
δ0值越高,硬度与弹性越低;Ci值越高,弹性越低;τi值越高,硬度与弹性越高。
1.3.3 肌原纤维蛋白(myofibrillar protein,MP)定量测定
参考Peng Zeyu等[17]的方法并进行改进。每个样品中加入适量含4 g/100 mL SDS的1×PBS(pH 7.4)及100×蛋白酶抑制剂的PBS,冰浴超声破碎2 min,1 000×g离心15 min,取上清液。使用BCA蛋白浓度测定试剂盒进行蛋白定量。
1.3.4 羰基含量测定
参照Shah等[18]的方法并进行改进。取1 mL MP溶液(4 mg/mL)于20 mL试管中,加入1 mL 10 mmol/L的DNPH溶液(溶解于2 mol/L HCl),室温下反应1 h,期间每隔20 min涡旋振荡1 次,再加入1 mL 20 g/100 mL TCA溶液,混匀,4 ℃、10 000×g离心5 min,弃去上清液,沉淀中加入1 mL乙酸乙酯和乙醇的混合液(1∶1,V/V)进行清洗,重复清洗3 次直至完全脱色,之后加入3 mL 6 mol/L的盐酸胍溶液,在37 ℃水浴锅中反应30 min,使沉淀全部溶解,反应液中的部分杂质或轻微不溶解物质通过10 000 r/min离心5 min去除,测定所得上清液在370 nm波长处的吸光度。羰基含量按式(2)计算:
式中:A表示370 nm波长处吸光度;n表示稀释倍数;ε表示摩尔吸光系数(22 000 L/(mol·cm));ρ表示MP溶液质量浓度/(mg/mL)。
1.3.5 总巯基含量测定
参考Peng Zeyu等[17]的方法并略和修改。取1 mL 1 mg/mL MP溶液,加入8 mL反应缓冲溶液(含86 mmol/L Tris、90 mmol/L甘氨酸、8 mol/L尿素和4 mmol/L EDTA,pH 8.0),然后将上述混合物在10 000×g离心15 min,取上清液4.5 mL,加入500 μL 10 mmol/mL的DTNB-Tris-Gly缓冲液(pH 8.0),25 ℃搅拌1 h,然后以12 000×g离心10 min,测定上清液在412 nm波长处的吸光度,总巯基含量按式(2)计算,式中ε为13 600 L/(mol·cm)。
1.3.6 消化和标记
参照Liang Longhui等[19]的方法并进行改进,实验由上海拜谱生物蛋白组学公司进行。MP溶液加入NEM,60 ℃封闭半胱氨酸30 min,采用TCA-丙酮沉淀法去除NEM后,将蛋白沉淀复溶于含4 g/100 mL SDS的PBS(pH 7.4)中,加入TCEP,50 ℃下还原氧化位点1 h,再采用TCA-丙酮沉淀法去除TCEP。
取样品复溶,25 ℃下孵育3 h,经过5 kDa超滤管浓缩蛋白,沉淀过夜,清洗干燥,冰浴超声后,再次复溶,加入碳酸氢铵和胰蛋白酶过夜酶解,酶解后的肽段使用C18 Cartridge脱盐,真空冻干得到肽段。
1.3.7 氧化肽段富集
参照Tao Yingmei 等[20]的方法并进行改进。各取1mg 肽段,加入适量上样/洗脱缓冲液(含0.1 g/100 mL SDS、0.5 g/100 mL脱氧胆酸钠和150 mol/L NaCl)充分溶解,分别加入100 µL高浓度链霉亲和素Beads,室温混匀3 h;用1 mL上样/洗脱缓冲液清洗Beads 1 次,PBS清洗Beads 4 次;100 μL洗脱缓冲液(50 mol/L NH4CO3,pH 8.2)、100 μL 5 mol/L TCEP溶液洗脱肽段;重复洗脱1 次,合并洗脱液,加入IAA,使其终浓度为20 mol/L,室温避光反应1 h;干燥后脱盐,真空浓缩,加入10 µL 0.1 g/100 mL FA溶液溶解,用于液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)分析。
1.3.8 LC-MS/MS分析
参考Parvin等[21]的方法并进行改进,取各组样品的适量肽段进行LC-MS/MS分析,通过Easy nLC 1200色谱系统进行分离,缓冲液A和B分别为体积分数0.1%甲酸溶液和含体积分数0.1%甲酸的乙腈溶液。95%的缓冲液A用于色谱柱平衡,待肽段样品进样到补集柱后,在色谱分析柱中以300 nL/min流速进行梯度分离。待肽段分离完成后,在质谱仪的数据依赖性采集模式下进行质谱分析。
1.4 数据处理
使用Origin Pro2018软件对应力松弛曲线进行Levemberg-Marquardt回归分析拟合,对蛋白差异氧化位点氧化强度与应力松弛特性指标进行Pearson相关性分析;蛋白氧化组学采用的质谱数据库检索软件为MaxQuant 1.6.17.0,蛋白质数据库为UniProt_Ovis_aries(Sheep)-28115-20200506.fasta;利用基因本体论(Gene Ontology,GO)(http://geneontology.org/)对差异氧化蛋白进行功能注释,利用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(http://www.genome.jp/kegg/)对差异氧化蛋白生物学路径进行分析;Shapiro-Wilk检验和Levene检验用于评估数据的正态性和方差齐性,对于不同组的质量参数,采用SPSS 25.0软件对平均值进行单因素方差分析。所有样品均采用3 个重复。
2 结果与分析
2.1 高压处理对滩羊肉质构特性的影响
应力松弛特性可表征滩羊肌肉的质构特性,拟合结果中,最大相对差(maximum relative difference,MRD)<5%和决定系数(R2)>0.99表明模型的拟合能力较好,可用于后续分析。Ci和为Maxwell模型的衰变力,代表弹性分量,可以和为原料弹性的度量参数。如表1所示,贮藏7 d后,NT组的Ci(C1、C2和C3)显著低于贮藏1 d(P<0.05),500 MPa处理组Ci没有显著变化(P>0.05),而200 MPa高压处理组Ci较贮藏1 d显著上升(P<0.05)。贮藏7 d后,200、500 MPa处理组的Ci均显著高于NT组(P<0.05),而2 个高压处理组Ci差异不显著(P>0.05)。τi表示麦克斯韦元素的松弛时间,也可以用来衡量肌肉的硬度和弹性[22],除τ3以外,τ1和τ2未受到高压处理和冷藏的显著影响(P>0.05)。结果表明,僵直后的滩羊肉在冷藏7 d后会出现弹性降低、质地劣化、软化的问题,而200、500 MPa高压处理的羊肉在冷藏后仍保持较高的硬度和弹性,这可能是因为高压处理能够诱导MP变性和聚集,从而增加肌肉硬度[23]。Campus等[24]利用δ0的三元Maxwell模型评估高压处理后鲷鱼肌肉的应力松弛特性变化,其结果与本研究一致。
表1 高压处理对僵直后期滩羊肉贮藏期间Maxwell模型常数的影响
Table 1 Effect of HPP treatment on Maxwell model of post-rigor Tan sheep muscle during storage
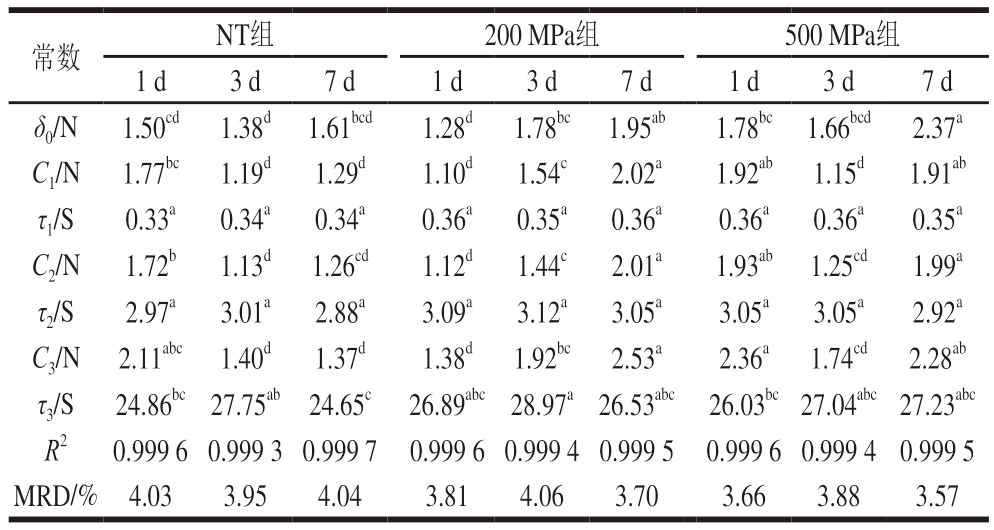
注:不同处理组每个贮藏时间取5 次测量值的平均值;同行小写字母不同表示组间差异显著(P<0.05)。
常数NT组200 MPa组500 MPa组1 d3 d7 d1 d3 d7 d1 d3 d7 d δ0/N1.50cd 1.38d 1.61bcd1.28d 1.78bc 1.95ab1.78bc 1.66bcd 2.37a C1/N 1.77bc 1.19d1.29d1.10d1.54c2.02a1.92ab 1.15d1.91ab τ1/S0.33a0.34a0.34a0.36a0.35a0.36a0.36a0.36a0.35a C2/N1.72b1.13d 1.26cd1.12d1.44c2.01a1.93ab 1.25cd1.99a τ2/S2.97a3.01a2.88a3.09a3.12a3.05a3.05a3.05a2.92a C3/N 2.11abc 1.40d1.37d1.38d 1.92bc 2.53a2.36a 1.74cd 2.28ab τ3/S 24.86bc 27.75ab 24.65c 26.89abc 28.97a 26.53abc 26.03bc 27.04abc 27.23abc R20.999 6 0.999 3 0.999 7 0.999 6 0.999 4 0.999 5 0.999 6 0.999 4 0.999 5 MRD/% 4.033.954.043.814.063.703.663.883.57
综上,200、500 MPa高压处理的滩羊肉冷藏7 d后,其Ci和τi普遍高于NT组样品,表明高压处理可提高滩羊肉贮藏过程中的弹性和硬度。
2.2 高压处理对滩羊肉MP氧化的影响
如图1A所示,各处理组的羰基含量随贮藏时间的延长而升高。500 MPa高压处理样品的羰基含量显著高于其他处理样品(P<0.05)。羰基含量的增加代表蛋白氧化程度增加、氧化稳定性减弱,提示样品中MP的交联和断裂[25]。高压处理诱导的蛋白氧化增强与自由基的潜在形成有关[26]。MP在高压处理下变性,肌肉系统Fe2+释放量增加,继而促进赖氨酸、精氨酸、脯氨酸和苏氨酸残基侧链中特定位置的金属催化氧化,形成羰基衍生物[27]。这与Wang Yang等[28]研究结果一致。

图1 高压处理对僵直后期滩羊肉贮藏期间MP氧化特性的影响
Fig.1 Effects of HPP on the oxidative characteristics of MP in post-rigor Tan sheep muscle during storage
大写字母不同表示组内差异显著(P<0.05),小写字母不同表示组间差异显著(P<0.05)。
如图1B所示,各贮藏期样品总巯基含量均随处理压强增加而降低。随着贮藏时间的延长,除NT组之外,高压处理样品在贮藏7 d后的总巯基含量均显著低于贮藏1 d(P<0.05)。蛋白质巯基含量的降低与巯基对高压处理的敏感性有关,MP在高压和用下发生变性,蛋白构象发生改变,内部巯基暴露,并氧化形成二硫键,使MP中的总巯基含量减少[29]。这与Shang Xiaolan等[30]研究结果一致。表明在贮藏7 d后,高压处理增加了肌肉的氧化程度。
2.3 半胱氨酸氧化修饰蛋白质组学分析
上述结果表明,贮藏7 d时高压处理组的应力松弛特性及氧化程度与NT组差异显著(P<0.05),故对贮藏7 d样本进行半胱氨酸氧化修饰蛋白质组学分析。由表2可知,从3 组处理样品中共鉴定到蛋白742 个、肽段3 007 个、氧化修饰蛋白602 个、氧化修饰肽段2 235 个及氧化修饰位点总数1 537 个。通过统计筛选样本组内非空值数据,以上调倍数大于1.5或下调倍数小于0.7、P<0.05为条件筛选显著差异氧化位点(significantly differential oxidation sites,SDOS)。如图2所示,200 MPa vs.NT组共筛选到169 个SDOS,其中上调131 个,下调38 个;500 MPa vs.NT组共筛选到266 个SDOS,其中上调205 个,下调61 个;500 MPa vs.NT组中的SDOS数量远高于200 MPa vs.NT组,表明500 MPa高压处理样本贮藏7 d后蛋白氧化程度高于200 MPa高压处理样本。
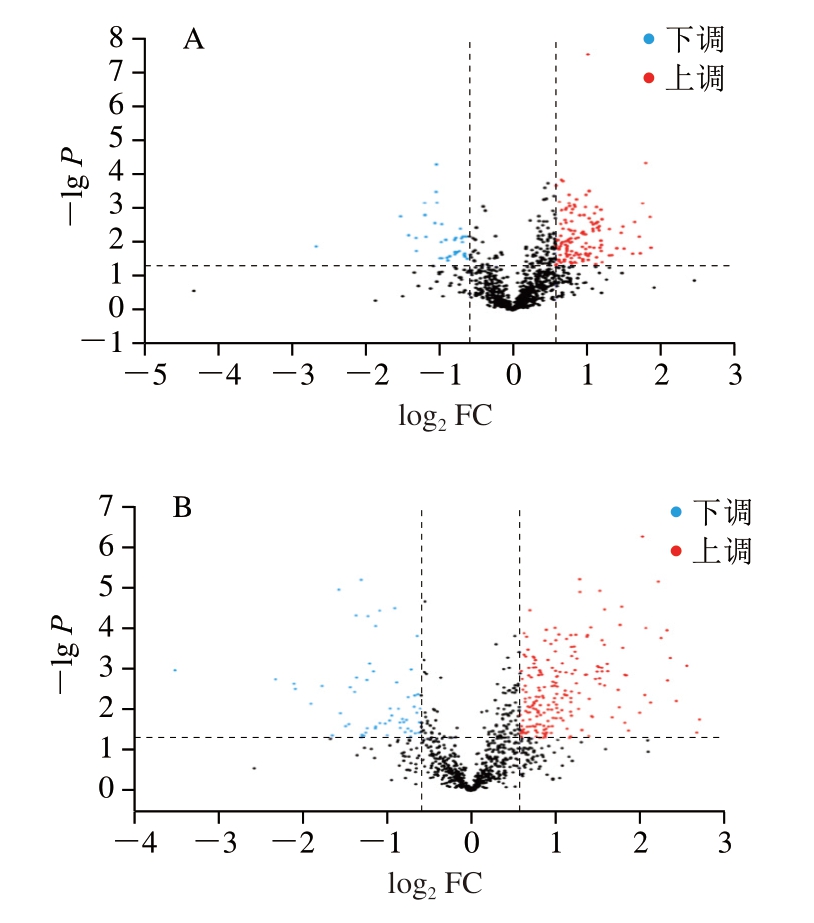
图2 高压处理僵直后期滩羊肉不同比较组SDOS火山图
Fig.2 Volcano plots of SDOS in the HPP-treated versus NT groups
A.200 MPa vs.NT;B.500 MPa vs.NT;FC.差异表达倍数(fold change)。图3同。
表2 高压处理僵直后期滩羊肉贮藏7 d后蛋白、肽段及氧化修饰位点数量
Table 2 Numbers of proteins, peptides and oxidative modification sites in post-rigor Tan sheep muscle stored for 7 days
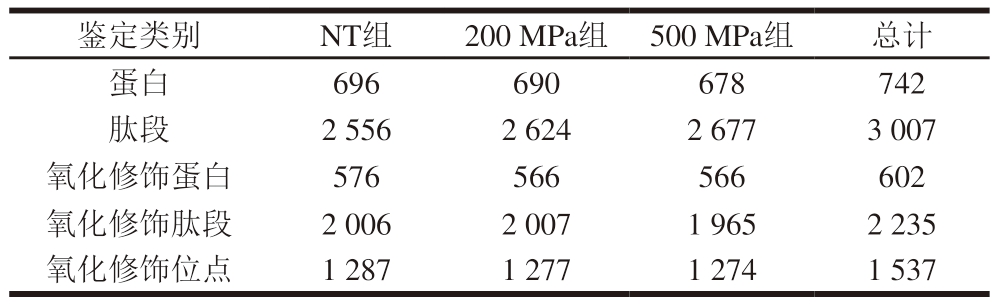
鉴定类别NT组200 MPa组 500 MPa组总计蛋白696690678742肽段2 5562 6242 6773 007氧化修饰蛋白576566566602氧化修饰肽段2 0062 0071 9652 235氧化修饰位点1 2871 2771 2741 537
如图3所示,为了更好地可视化分析高压处理与对照组之间蛋白质丰度的差异,对氧化位点进行层次聚类分析,图中不同颜色代表SDOS在样品中的丰度,红色代表高丰度和高氧化水平,蓝色代表低丰度和低氧化水平,3 个不同处理组颜色分布差异明显,表明高压处理组与NT组蛋白位点氧化程度存在差异。从3 个处理组中共鉴定到388 个重叠SDOS,这些SDOS对应的蛋白有望成为高压处理滩羊肉冷藏期间品质调控的潜在生物标记蛋白。
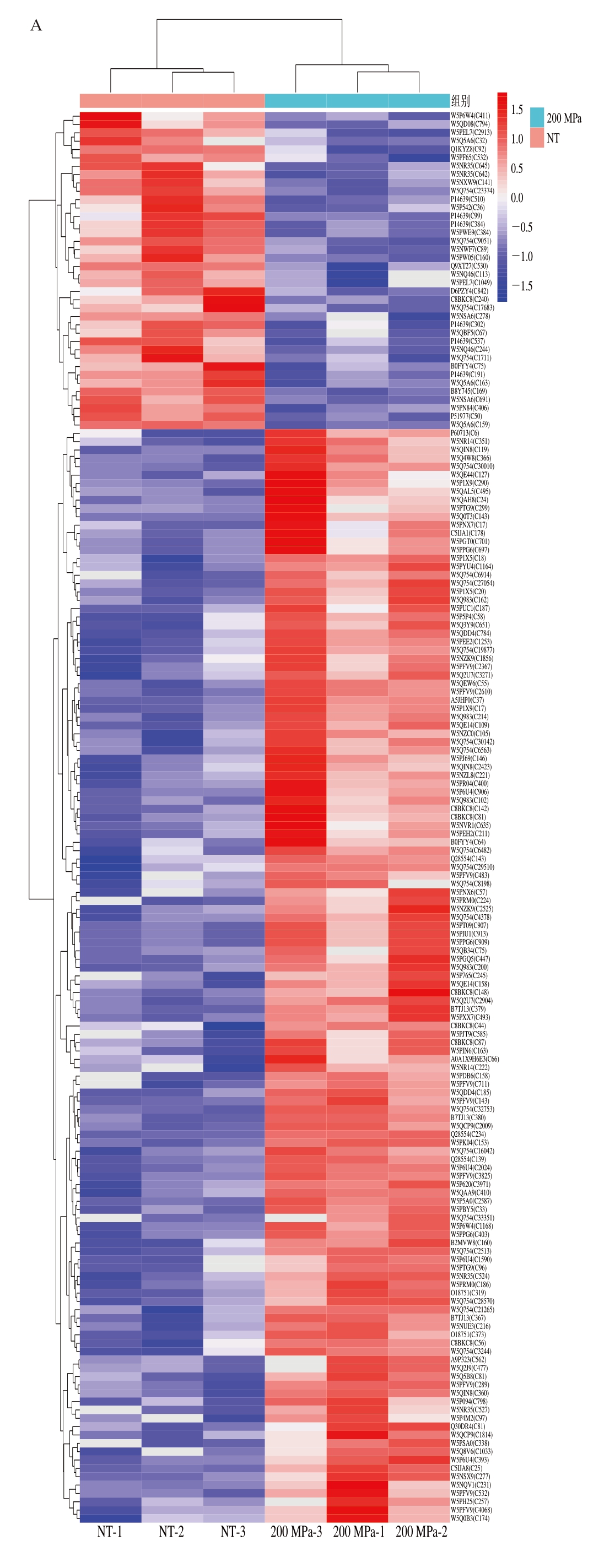
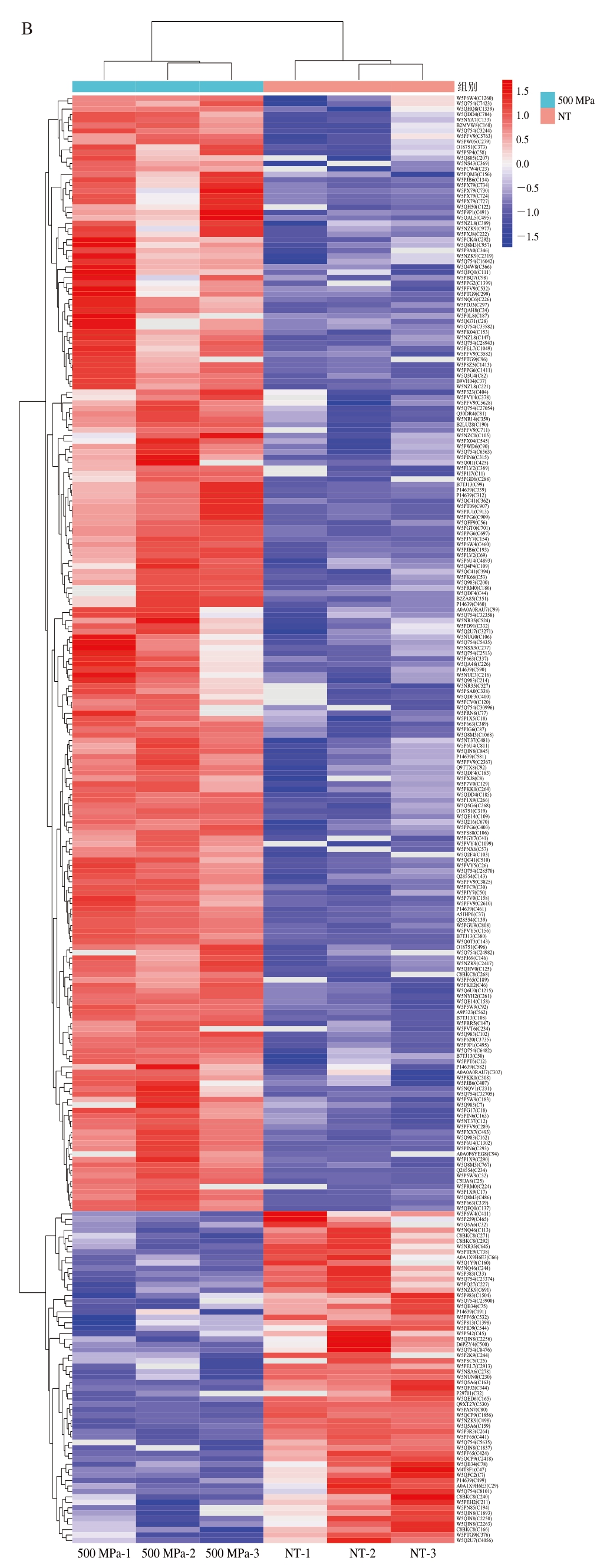
图3 高压处理僵直后期滩羊肉不同比较组SDOS层次聚类图
Fig.3 Hierarchical cluster analysis of SDOS in the HPP-treated versus NT groups
2.4 SDOS的生物信息学分析
根据基因或基因产物,GO将388 个重叠SDOS所对应蛋白的功能特性鉴定为生物过程、分子功能及细胞成分。如图4A所示,蛋白质主要参与产生前体代谢物途径、氧化还原酶活性、细胞骨架蛋白结合、肌动蛋白结合、小分子结合、细胞质部分及细胞外区域部分。
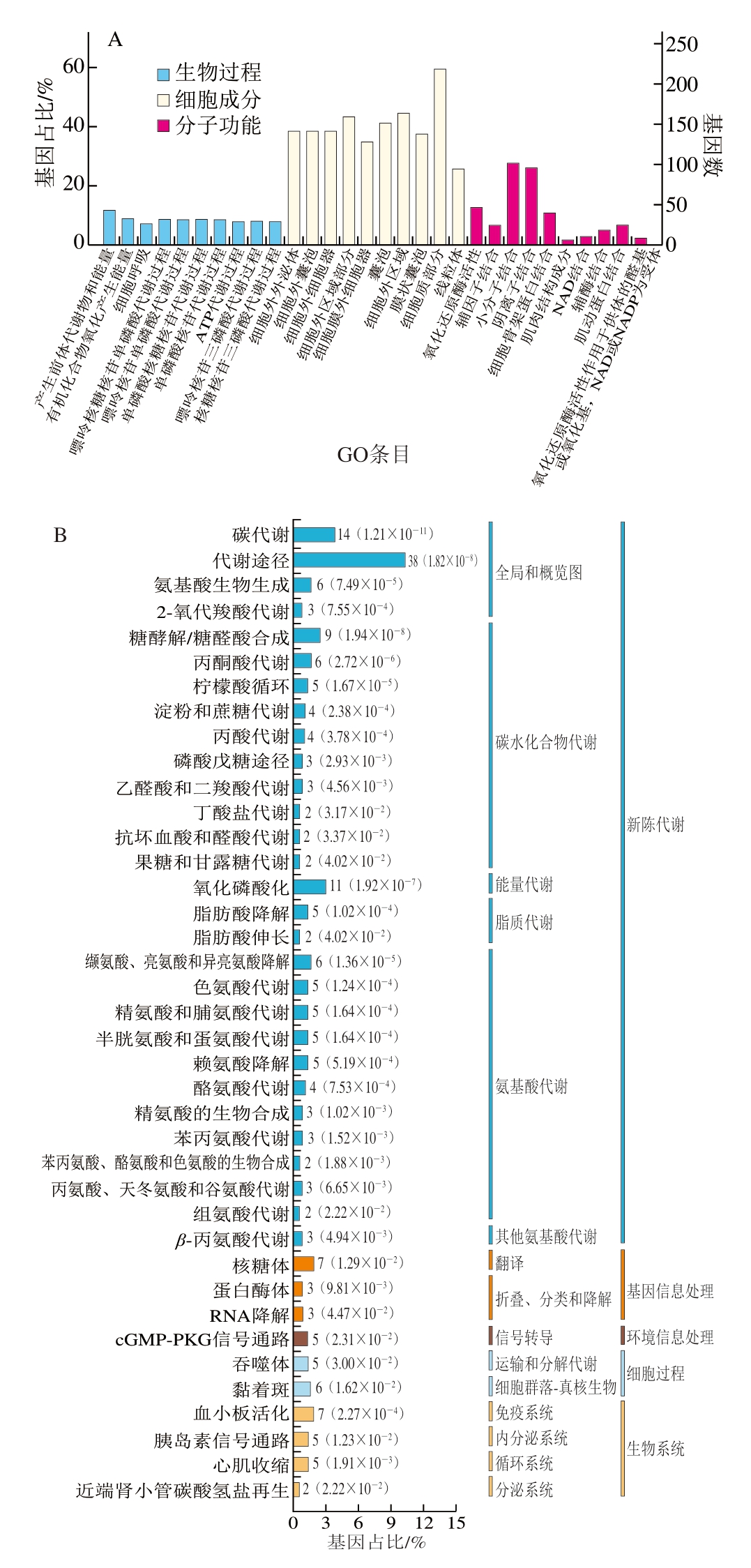
图4 不同处理组重叠SODS的GO功能注释(A)和KEGG通路(B)
Fig.4 GO functional annotation (A) and KEGG pathway (B) of overlapping SODS among treatment groups
肌肉细胞内不同通路互相协调,共同调节细胞生物学行为。以KEGG通路为单位,以所有定性蛋白质为背景,通过Fisher精确检验计算各个通路蛋白质富集度的显著性水平,从而确定受到显著影响的代谢和信号转导通路。由图4B可知,388 个SDOS共映射到102 条生物学通路,其中39 条通路显著富集(P<0.05),包括碳代谢、氨基酸生物合成、糖酵解/糖醛酸生成、丙酮酸代谢、氧化磷酸化、柠檬酸循环及半胱氨酸和蛋氨酸代谢。
2.5 SDOS与滩羊肉应力松弛特性的相关性分析
将388 个重叠SODS对应蛋白中的未标记蛋白及蛋白片段剔除后,共计筛选到360 个重叠SODS,将其氧化丰度与应力松弛特性指标(δ0、C1、C2、C3、τ1、τ2、τ3)进行Pearson相关性分析,获得4 个重叠SODS与C2、τ3呈显著及极显著正相关(P<0.05、P<0.01),1 个重叠SODS与τ2呈极显著负相关(P<0.01),11 个重叠SODS与δ0、C1、C3呈显著或极显著正负相关(P<0.05、P<0.01),其SODS对应的蛋白包含6 种结构蛋白、5 种代谢酶类和1 种其他蛋白。
2.5.1 结构蛋白SODS与应力松弛特性的相关性分析
本研究在高压处理样本中鉴定到大量肌联蛋白(titin,TTN)氧化位点,该蛋白氧化位点与品质指标呈正相关或负相关与特定残基氧化介导的蛋白质代谢和收缩特性有关[20]。如表3所示,TTN在Cys29171残基的氧化与样本C3值呈显著正相关(P<0.05),而TTN在Cys32358残基的氧化与样本C1和C3值呈显著及极显著负相关(P<0.05、P<0.01),TTN在Cys32705、Cys26405残基的氧化与样本τ3值呈显著及极显著正相关(P<0.05、P<0.01),表明尽管TTN在贮藏过程中发生了氧化降解,但不同位点处的氧化修饰程度与肉品质特性的关联性存在差异。Huff-Lonergan等[31]通过双向电泳研究宰后成熟时间、动物年龄和性别对TTN的影响,发现TTN降解产生的一些新条带与肌肉硬度的变化直接相关。在生理条件下,伴肌动蛋白(nebulin,NEB)与影响肌肉收缩的肌动蛋白-肌球蛋白相互和用密切相关[32],该蛋白在Cys5628残基的氧化与样本δ0值呈显著正相关(P<0.05)。MP中,TTN和NEB是维持肌纤维结构完整性的关键结构蛋白,分别位于肌球蛋白和肌动蛋白附近,它们的降解会破坏粗丝和细丝的完整性及Z线、M线和肌丝之间的连接,进而影响宰后肉的硬度与弹性[33]。此外,相关研究报道显示,膜联蛋白(annexins,ANXA11)和TNN可用于养殖鲑鱼的质构预测[34],这与本研究结果一致。ANXA11在Cys292残基的氧化与样本C1和C3值呈显著负相关(P<0.05)。
表3 高压处理僵直后期滩羊肉贮藏7 d应力松弛特性与结构蛋白SODS相关性分析
Table 3 Correlation analysis between stress relaxation properties and SODS of structural proteins in HPP-treated sheep muscle stored for 7 days
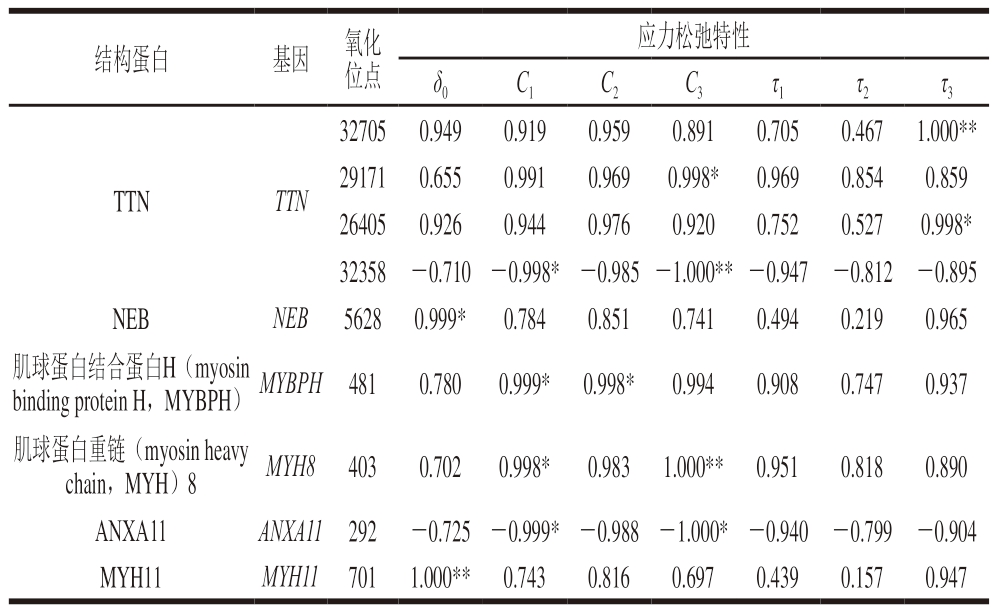
注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。表4、5同。
结构蛋白基因 氧化位点应力松弛特性δ0C1C2C3τ1τ2τ3 32705 0.9490.9190.9590.8910.7050.467 1.000**29171 0.6550.9910.9690.998*0.9690.8540.859 26405 0.9260.9440.9760.9200.7520.5270.998*32358 -0.710 -0.998* -0.985 -1.000** -0.947 -0.812 -0.895 NEBNEB 5628 0.999*0.7840.8510.7410.4940.2190.965肌球蛋白结合蛋白H(myosin binding protein H,MYBPH) MYBPH 4810.7800.999* 0.998*0.9940.9080.7470.937 TTNTTN肌球蛋白重链(myosin heavy chain,MYH)8MYH8 4030.7020.998*0.983 1.000** 0.9510.8180.890 ANXA11ANXA11 292 -0.725 -0.999* -0.988 -1.000* -0.940 -0.799 -0.904 MYH11MYH11 701 1.000** 0.7430.8160.6970.4390.1570.947
MYBPH是骨骼肌粗丝的组成部分,对肌球蛋白有很强的亲和力[17],通过C端结构域与肌原纤维粗丝A带中的肌球蛋白相关联[35]。据报道,在鸡和兔骨骼肌中,MYBPH主要与快速收缩肌纤维有关[36]。本研究中,MYBPH在Cys481残基的氧化与样本C1和C2值呈显著正相关(P<0.05),张瑞等[37]研究发现,不同贮藏温度(-2、-18、4 ℃)滩羊肉MYBPH在Cys451残基的氧化与肌肉硬度呈显著正相关性(P<0.05),与本研究结果一致。
肌球蛋白是骨骼肌纤维的主要成分,在骨骼肌纤维的收缩特性中发挥着重要和用。肌球蛋白分子由6 条链组成,包括2 条重链和4 条轻链,肌球蛋白轻链和MYH的完整性是肌肉功能的必要条件[36]。本研究中,MYH8在Cys403残基的氧化与样本C1和C3值呈显著及极显著正相关(P<0.05、P<0.01)。Tao Yingmei等[20]研究也发现,MYH8在Cys403残基的氧化与不同温度贮藏滩羊肉剪切力和咀嚼性呈显著正相关(P<0.05),与本研究结果一致。
2.5.2 代谢酶SODS与应力松弛特性的相关性分析
如 表4 所 示 , 磷 酸 葡 萄 糖 变 位 酶 1(phosphoglucomutase 1,PGM1)在Cys407残基的氧化与样本δ0值呈显著正相关(P<0.05),而PGM1在C y s 1 3 4 残基的氧化与样本τ2值呈极显著负相关(P<0.01)。这可能是因为PGM1活性增加可促进葡萄糖-1-磷酸向葡萄糖-6-磷酸的转化,糖酵解速率加快,从而影响肌肉嫩度[38]。丙酮酸激酶(pyruvate kinase,PKM)在Cys510残基的氧化也与样本δ0值呈显著正相关(P<0.05),L-乳酸脱氢酶(L-lactate dehydrogenase,LDHA)在Cys315残基的氧化与样本τ3值呈显著正相关(P<0.05)。Kim等[39]研究表明,猪胸腰最长肌不同区域的LDHA与剪切力(P<0.05)、滴水损失(P<0.01)和蒸煮损失(P<0.01)呈极显著正相关。糖原磷酸化酶(glycogen phosphorylase,PYGM)在Cys496残基的氧化与样本δ0值呈显著正相关(P<0.05),这可能与PYGM在该位点氧化修饰介导的酶活变化有关。Chen Lijuan等[40]报道,PYGM的高磷酸化水平会导致酶活性降低,继而延迟结构蛋白的水解并影响肌肉硬度,而Bai Yuqiang等[41]报道,体外4 ℃孵育期间,羊肉PYGM磷酸化会促进其活性。由此可见,PYGM对一些特殊的酶学修饰尤为敏感,其酶活特性也易受此影响,从而影响肌肉硬度。
表4 高压处理僵直后期滩羊肉贮藏7 d后应力松弛特性与代谢酶类SODS相关性分析
Table 4 Correlation analysis between stress relaxation properties and SODS of metabolic enzymes in HPP-treated sheep muscle stored for 7 days
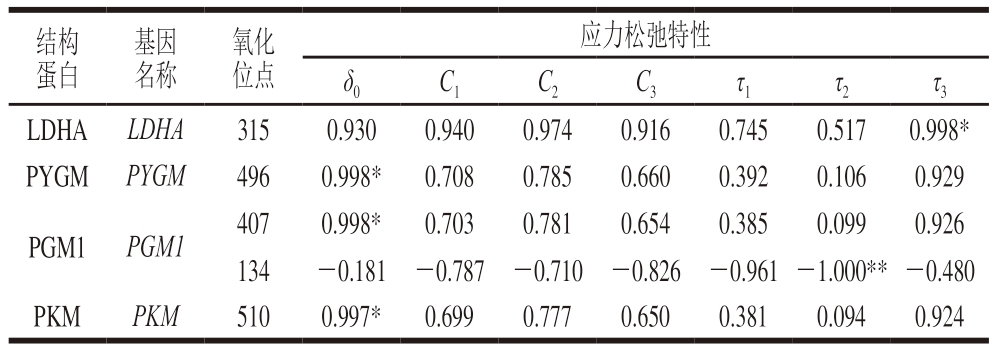
基因名称结构蛋白氧化位点应力松弛特性δ0C1C2C3τ1τ2τ3 LDHALDHA3150.9300.9400.9740.9160.7450.5170.998*PYGM PYGM4960.998*0.7080.7850.6600.3920.1060.929 PGM1PGM14070.998*0.7030.7810.6540.3850.0990.926 134-0.181 -0.787 -0.710 -0.826 -0.961 -1.000** -0.480 PKMPKM5100.997*0.6990.7770.6500.3810.0940.924
2.5.3 其他蛋白SODS与应力松弛特性的相关性分析
钙转运ATP酶(calcium-transporting ATPase,ATP2A2)水解ATP并产生肌肉收缩力,对稳定肌球蛋白的结构、完整性和功能起重要和用[42]。如表5所示,ATP2A2在Cys651残基的氧化与样本δ0值呈显著负相关(P<0.05),这可能与高压处理诱导位于肌球蛋白头部催化中心的活性巯基氧化有关。肌球蛋白构象的变化,如基于巯基氧化形成二硫交联,可导致ATP2A2活性降低[42]。
表5 高压处理僵直后期滩羊肉贮藏7 d后应力松弛特性与其他蛋白SODS相关性分析
Table 5 Correlation analysis between stress relaxation properties and SODS of other proteins in HPP-treated sheep muscle stored for 7 days
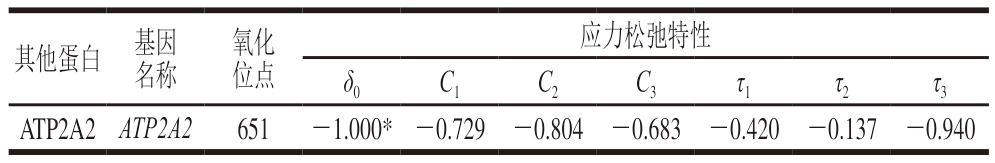
其他蛋白 基因名称氧化位点应力松弛特性δ0C1C2C3τ1τ2τ3 ATP2A2 ATP2A2651-1.000* -0.729 -0.804 -0.683 -0.420 -0.137 -0.940
3 讨 论
随着贮藏时间的延长,高压处理显著改善了滩羊肉的质构特性。Ma Hanjun等[43]研究表明,随着高压处理水平从200 MPa提高到400 MPa,高压处理僵直后期牛肉硬度显著高于未处理牛肉(P<0.05)。Shao Ying等[44]研究表明,高压处理(200~500 MPa/5 min)小龙虾肌肉硬度显著高于对照组(P<0.05)。Melody等[45]认为,宰后肌肉的糖酵解速率与肌肉蛋白氧化稳定性是影响宰后肉品质形成的2 个关键因素。Huang Caiyan等[46]认为,高压介导的蛋白氧化在糖酵解酶结构、功能、信号传导及活性调节中起调控和用。同时,高压处理诱导MP关键组分显著氧化,使蛋白的结构破坏,造成肌肉硬度增加,质构特性劣变。因此,高压处理诱导的蛋白半胱氨酸氧化修饰可能一方面通过诱导僵直后期滩羊背最长肌骨架蛋白、糖酵解酶及抗应激蛋白氧化,使肌肉结构蛋白变性,继而诱导贮藏期肌肉硬度增加,另一方面降低了内源性蛋白酶系活力,阻碍宰后成熟水解进程,间接劣化肉品质。
4 结 论
研究高压处理对滩羊肉贮藏期品质及MP氧化的影响,利用半胱氨酸氧化修饰蛋白质组学分析技术鉴定其半胱氨酸氧化修饰位点,并进一步与应力松弛特性进行相关性分析,结果表明:确定了15 个(10 个结构蛋白、4 个代谢酶和1 个其他蛋白)SODS对应的蛋白与至少1 个应力松弛特性指标显著相关(P<0.05、P<0.01);其中NEB、TTN是介导高压处理质构特性变化的关键骨架蛋白,PGM1、LDHA是介导高压处理样本质构特性变化的关键糖酵解酶;高压处理诱导结构蛋白的部分氧化位点发生氧化修饰,使蛋白变性和聚集,进而降低蛋白本身的降解程度,肌肉硬度与弹性随着降解程度的变化而变化,从而使硬度与弹性增加。本研究结果可为高压处理诱导滩羊肉僵直后期蛋白氧化变化与机制研究提供理论支持,为高压处理在肉类中的实际应用提供理论指导。
[1] LI D D, PENG Y L, ZHANG H H, et al.Relationship between quality changes of post-rigor tan mutton and myofibrillar protein following high-pressure treatment[J].CyTA-Journal of Food, 2021, 19(1): 378-388.DOI:10.1080/19476337.2020.1863476.
[2] DE O G, DELGADO E F, STEADHAM E M, et al.Association of calpain and calpastatin activity to postmortem myofibrillar protein degradation and sarcoplasmic proteome changes in bovine Longissiumus lumborum and Triceps brachii[J].Meat Science, 2019,155: 50-60.DOI:10.1016/j.meatsci.2019.04.015.
[3] CHEN Y T, XU A Q, YANG R Y, et al.Myofibrillar protein structure and gel properties of Trichiurus haumela surimi subjected to high pressure or high pressure synergistic heat[J].Food and Bioprocess Technology, 2020, 13(4): 589-598.DOI:10.1007/s11947-020-02416-x.
[4] KUMAR V, RAO P S, PUROHIT S R, et al.Effects of high pressure processing (HPP) and acid pre-treatment on quality attributes of hilsa(Tenualosa ilisha) fillets[J].LWT-Food Science and Technology, 2019,111: 647-652.DOI:10.1016/j.lwt.2019.05.084.
[5] RAJENDRAN S, MALLIKARJUNAN P K, O NEILL E.High pressure processing for raw meat in combination with other treatments:a review[J].Journal of Food Processing and Preservation, 2021,46(10): e16049.DOI:10.1111/jfpp.16049.
[6] LI D D, PENG Y L, TAO Y M, et al.Quality changes in high pressure processed Tan mutton during storage[J].Food Science and Technology International, 2021, 27(6): 517-527.DOI:10.1177/1082013220970781.
[7] BOLUMAR T, ANDERSEN M L, ORLIEN V.Mechanisms of radical formation in beef and chicken meat during high pressure processing evaluated by electron spin resonance detection and the addition of antioxidants[J].Food Chemistry, 2013, 150: 422-428.DOI:10.1016/j.foodchem.2013.10.161.
[8] HUANG Y C, ZHANG W, XIONG S L.Modeling the effect of thermal combined with high-pressure treatment on intramuscular lipid oxidation in pork[J].Journal of Food Process Engineering, 2019,42(6): e13240.DOI:10.1111/jfpe.13240.
[9] JIA G L, ORLIEN V, LIU H, et al.Effect of high pressure processing of pork (Longissimus dorsi) on changes of protein structure and water loss during frozen storage[J].LWT-Food Science and Technology,2020, 135: 110084.DOI:10.1016/j.lwt.2020.110084.
[10] TRAORE S, AUBRY L, GATELLIER P, et al.Effect of heat treatment on protein oxidation in pig meat[J].Meat Science, 2011, 91(1): 14-21.DOI:10.1016/j.meatsci.2011.11.037.
[11] FU Q Q, LIU R, WANG H O, et al.Effects of oxidation in vitro on structures and functions of myofibrillar protein from beef muscles[J].Journal of Agricultural and Food Chemistry, 2019, 67(20): 5866-5873.DOI:10.1021/acs.jafc.9b01239.
[12] PITA-CALVO C, GUERRA-RODRÍGUEZ E, SARAIVA J A, et al.Effect of high-pressure processing pretreatment on the physical properties and colour assessment of frozen European hake (Merluccius merluccius) during long term storage[J].Food Research International,2018, 112: 233-240.DOI:10.1016/j.foodres.2018.06.042.
[13] CAMPUS M.High pressure processing of meet, meet products and seafood[J].Food Engineering Reviews, 2010, 2: 256-273.DOI:10.1007/s12393-010-9028-y.
[14] 李冬冬.基于蛋白氧化揭示高压处理滩羊肉品质变化的机理研究[D].银川: 宁夏大学, 2021.DOI:10.27257/d.cnki.gnxhc.2021.001512.
[15] MARCOS B, MULLEN A M.High pressure induced changes in beef muscle proteome: correlation with quality parameters[J].Meat Science, 2014, 97(1): 11-20.DOI:10.1016/j.meatsci.2013.12.008.
[16] PELEG M.Characterization of the stress relaxation curves of solid foods[J].Journal of Food Science, 2010, 44(1): 277-281.DOI:10.1111/j.1365-2621.1979.tb10062.x.
[17] PENG Z Y, ZHU M M, ZHANG J, et al.Physicochemical and structural changes in myofibrillar proteins from porcine longissimus dorsi subjected to microwave combined with air convection thawing treatment[J].Food Chemistry, 2020, 343: 121482.DOI:10.1016/j.foodchem.2020.128412.
[18] SHAH A M, RAJPUT N, LI C B, et al.Effect of freeze-thaw cycles on lipid oxidation and myowater in broiler chickens[J].Brazilian Journal of Poultry Science, 2016, 18(1): 35-40.DOI:10.1016/j.foodchem.2014.09.095.
[19] LIANG L H, LIU C C, CHEN B, et al.LC-HRMS screening and identification of novel peptide markers of ricin based on multiple protease digestion strategies[J].Toxins, 2019, 11(7): 393.DOI:10.3390/toxins11070393.
[20] TAO Y M, MA L, LI D D, et al.Proteomics analysis to investigate the effect of oxidized protein on meat color and water holding capacity in tan mutton under low temperature storage[J].LWT-Food Science and Technology, 2021, 146: 111429.DOI:10.1016/j.lwt.2021.111429.
[21] PARVIN R, ZAHID M A, SEO J, et al.Influence of reheating methods and frozen storage on physicochemical characteristics and warmedover flavor of nutmeg extract-enriched precooked beef meatballs[J].Antioxidants, 2020, 9(8): 670.DOI:10.3390/antiox9080670.
[22] ZHAO W Q, FANG Y, ZHANG Q A, et al.Correlation analysis between chemical or texture attributes and stress relaxation properties of ‘Fuji’ apple[J].Postharvest Biology and Technology, 2017, 129: 45-51.DOI:10.1016/j.postharvbio.2017.03.010.
[23] ZHANG H J, PAN J, WU Z Y.Investigation of the effects of high pressure processing on the process of rigor in pork[J].Meat Science,2018, 145: 455-460.DOI:10.1016/j.meatsci.2018.07.013.
[24] CAMPUS M, ADDIS M F, CAPPUCCINELLI R, et al.Stress relaxation behaviour and structural changes of muscle tissues from gilthead sea bream (Sparus aurata L.) following high pressure treatment[J].Journal of Food Engineering, 2010, 96(2): 192-198.DOI:10.1016/j.jfoodeng.2009.07.013.
[25] LI D D, ZHANG H H, MA L, et al.Effects of ficin, high pressure and their combination on quality attributes of post-rigor Tan mutton[J].LWT-Food Science and Technology, 2021, 137: 110407.DOI:10.1016/j.lwt.2020.110407.
[26] SHI L, XIONG G Q, YIN T, et al.Effects of ultra-high pressure treatment on the protein denaturation and water properties of red swamp crayfish (Procambarus clarkia)[J].LWT-Food Science and Technology, 2020, 133: 110124.DOI:10.1016/j.lwt.2020.110124.
[27] DE OLIVEIRA F A, NETO O C, DOS SANTOS L M R, et al.Effect of high pressure on fish meat quality: a review[J].Trends in Food Science and Technology, 2017, 66: 1-19.DOI:10.1016/j.tifs.2017.04.014.
[28] WANG Y, TIAN X J, LIU X Z, et al.Effects of different cooking methods on physicochemical, textural properties of yak meat and its changes with intramuscular connective tissue during in vitro digestion[J].Food Chemistry, 2023, 422: 136188.DOI:10.1016/j.foodchem.2023.136188.
[29] ZHOU A M, LIN L Y, LIANG Y, et al.Physicochemical properties of natural actomyosin from threadfin bream (Nemipterus spp.) induced by high hydrostatic pressure[J].Food Chemistry, 2014, 156: 402-407.DOI:10.1016/j.foodchem.2014.02.013.
[30] SHANG X L, GUO J J, LIU W Y, et al.Interrelationship among protein structure, protein oxidation, lipid oxidation and quality of grass carp surimi during multiple freeze-thaw cycles with different pork backfat contents[J].Journal of Food Biochemistry, 2022, 46(10):e146139.DOI:10.1111/jfbc.14319.
[31] HUFF-LONERGAN E, PARRISH F C J, ROBSON R M.Effects of postmortem aging time, animal age, and sex on degradation of titin and nebulin in bovine longissimus muscle[J].Journal of Animal Science,1995, 73(4): 1064-1073.DOI:10.2527/1995.7341064x.
[32] LOPEZ-PEDROUSO M, LORENZO J M, Di STASIO L, et al.Quantitative proteomic analysis of beef tenderness of piemontese young bulls by SWATH-MS[J].Food Chemistry, 2021, 356: 129711.DOI:10.1016/j.foodchem.2021.129711.
[33] YANG F, JIA S N, LIU J X, et al.The relationship between degradation of myofibrillar structural proteins and texture of superchilled grass carp (Ctenopharyngodon idella) fillet[J].Food Chemistry, 2019, 301:125278.DOI:10.1016/j.foodchem.2019.125278.
[34] ØRNHOLT-JOHANSSON G, FROSCH S, GUDJONSDOTTIR M,et al.Muscle protein profiles used for prediction of texture of farmed salmon (Salmo solar L.)[J].Journal of Agricultural and Food Chemistry, 2017, 65(16): 3414-3422.DOI:10.1021/acs.jafc.6b05588.
[35] CONTI A, RIVA N, PESCA M, et al.Increased expression of myosin binding protein h in the skeletal muscle of amyotrophic lateral sclerosis patients[J].Biochimica Et Biophysica Acta-Molecular Basis of Disease, 2014, 1842(1): 99-106.DOI:10.1016/j.bbadis.2013.10.013.
[36] 王稳航, 徐倩倩, 刘婷, 等.超高压处理对僵直前獭兔肉品质及微观结构的影响[J].食品科学, 2014, 35(21): 73-78.DOI:10.7506/spkx1002-6630-201421015.
[37] 张瑞, 陶迎梅, 高钰茸, 等.不同贮藏温度下半胱氨酸氧化位点鉴定及对滩羊肉嫩度的影响[J].食品科学, 2024, 45(10): 54-61.DOI:10.7506/spkx1002-6630-20230403-015.
[38] ANDERSON M J, LONERGAN S M, HUFF-LONERGAN E.Differences in phosphorylation of phosphoglucomutase 1 in beef steaks from the longissimus dorsi with high or low star probe values[J].Meat Science, 2013, 96(1): 379-384.DOI:10.1016/j.meatsci.2013.07.017.
[39] KIM G, JEONG J, YANG H, et al.Differential abundance of proteome associated with intramuscular variation of meat quality in porcine longissimus thoracis et lumborum muscle[J].Meat Science, 2019, 149:85-95.DOI:10.1016/j.meatsci.2018.11.012.
[40] CHEN L J, LI X, NI N, et al.Phosphorylation of myofibrillar proteins in post-mortem ovine muscle with different tenderness[J].Journal of the Science of Food and Agriculture, 2016, 96(5): 1474-1483.DOI:10.1002/jsfa.7244.
[41] BAI Y Q, LI X, ZHANG D Q, et al.Effects of phosphorylation on the activity of glycogen phosphorylase in mutton during incubation at 4 ℃ in vitro[J].Food Chemistry, 2020, 313: 126162.DOI:10.1016/j.foodchem.2020.126162.
[42] WANG B, KONG B H, LI F F, et al.Changes in the thermal stability and structure of protein from porcine longissimus dorsi induced by different thawing methods[J].Food Chemistry, 2020, 316: 126375.DOI:10.1016/j.foodchem.2020.126375.
[43] MA H J, LEDWARD D A.High pressure/thermal treatment effects on the texture of beef muscle[J].Meat Science, 2004, 68(3): 347-355.DOI:10.1016/j.meatsci.2004.04.001.
[44] SHAO Y, XIONG G Q, LING J G, et al.Effect of ultra-high pressure treatment on shucking and meat properties of red swamp crayfish(Procambarus clarkia)[J].LWT-Food Science and Technology, 2017,87: 234-240.DOI:10.1016/j.lwt.2017.07.062.
[45] MELODY J L, LONERGAN S M, ROWE L J, et al.Early postmortem biochemical factors influence tenderness and water-holding capacity of three porcine muscles[J].Journal of Animal Science, 2004, 82(4):1195-1205.DOI:10.2527/2004.8241195x.
[46] HUANG C Y, BLECKER C, CHEN L, et al.Integrating identification and targeted proteomics to discover the potential indicators of postmortem lamb meat quality[J].Meat Science, 2023, 199: 109126.DOI:10.1016/j.meatsci.2023.109126.