加热熟制是人们食用肉类前的重要环节,可以杀灭微生物和病原菌。在熟制过程中,大部分消费者通过观察中心肉色来判断牛肉的熟制程度,然而利用感官判断并不完全准确。高pH值的黑切(dark, firm, dry,DFD)牛肉加热至中心温度71.1 ℃甚至更高时,牛肉的中心肉色仍为粉红色,呈现熟制不充分的假象,导致消费者继续对其加热[1-2],这种现象称为持续粉红(persistent pinking,PP)现象。该现象容易使肉类熟制过度,造成嫩度下降、汁液流失过多等品质下降问题。
原料肉中3 种状态的肌红蛋白热稳定性有所不同,其热稳定性顺序为:高铁肌红蛋白<氧合肌红蛋白<脱氧肌红蛋白[3]。DFD牛肉中含有更高比例的脱氧肌红蛋白[4],这是导致其熟制时肌红蛋白热变性慢、呈现PP现象的原因之一。然而,除了肌红蛋白本身的化学状态外,肉的pH值也是影响肌红蛋白热稳定性的一个重要因素,进而成为影响熟制肉色的重要因素[5]。许多研究发现,这3 种肌红蛋白的热稳定性均随着pH值的升高而升高[6-7]。在pH 7.0时,高铁肌红蛋白直到60 ℃时才发生变性,而在pH≤5.6时,其变性温度则降至50 ℃[7],同样,其他状态的肌红蛋白热稳定性也呈现相同的规律。因此,原料肉pH值高于正常范围也是导致DFD牛肉熟制肉色呈现红色或粉色的一个重要原因。
然而,截至目前,大部分关于DFD牛肉肉色的研究均集中在其生鲜肉色的形成机制和调控方面[8-10],而关于其熟制时存在的PP现象研究尚不多。且关于该现象的有限研究也集中在对该现象的改善方面,而对于其形成机制研究还很少。Moiseev等[11]发现,DFD牛肉饼中添加微胶囊化的乳酸能显著提高肌红蛋白的变性程度,形成可接受的肉色,但是产生了强烈的异味;而添加CaO2虽然提高了肌红蛋白的变性程度,但是造成了过度氧化,添加焦糖色素亦不能改善DFD牛肉熟制后的肉色。同时,Apple[12]、Nair[13]等的研究也再次证实添加乳酸可以降低DFD牛肉的pH值,从而改善生鲜肉色和熟肉肉色,由此可见,添加乳酸是改善DFD牛肉PP现象的可行措施之一。这些研究进一步证实了原料肉的高pH值是影响DFD牛肉熟制肉色的重要因素。
目前,高pH值影响肌红蛋白热稳定性的机制研究报道较少。肌红蛋白分子是一种较稳定的球状水溶性蛋白,由153 个氨基酸组成的多肽链和1 个血红素辅基构成。多肽链为血红素基团提供了一个疏水空腔,能够有效避免2 价铁被氧化,其三级结构稳定性对肉色稳定性具有重要影响[14]。基于此,本研究推测,在DFD牛肉加热过程中,高pH值通过影响加热过程中肌红蛋白结构稳定性影响其热稳定性,进而对熟制肉色产生影响。针对该推测,本研究拟通过体外实验配制正常牛肉pH值(5.6)和DFD牛肉pH值(6.4)的肌红蛋白溶液,在冷藏(4 ℃)(生鲜牛肉状态)和加热(72 ℃)(牛肉完全熟制时的状态)条件下孵育,研究其在不同条件下的分子结构变化和热变性程度,探究不同pH值对肌红蛋白结构和热稳定性的影响,进而探讨其影响熟制肉色的机制,以期进一步丰富肉色理论,为熟制肉色控制技术开发提供理论支持。
1 材料与方法
1.1 材料与试剂
马骨骼肌肌红蛋白(分子质量1 7 0 0 0 D a)美国Sigma Aldrich公司;MD44透析袋(截留分子质量7 000 Da) 北京索莱宝科技有限公司;磷酸二氢钠、磷酸氢二钠、氢氧化钠、连二亚硫酸钠(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
TU 1901紫外-可见分光光度计 北京普析通用仪器有限责任公司;Lumina荧光磷光分光光度计 德国Fisher公司;BCD-610W西门子冰箱 博西华家用电器有限公司;Raman Pro便携式拉曼仪 美国B&W Tek LLC公司;Epoch2酶标仪 美国BioTek公司。
1.3 方法
1.3.1 肌红蛋白溶液配制与处理
称取30 mg马骨骼肌肌红蛋白,分别溶于10 mL pH 5.6(模拟正常牛肉的pH值)和pH 6.4(模拟DFD牛肉的pH值)的50 mmol/L磷酸盐缓冲溶液,配制成质量浓度为3 mg/mL的肌红蛋白原液,向其中加入3 mg连二亚硫酸钠还原肌红蛋白,并将溶液转入透析袋(截留分子质量为7 000 Da),在4 ℃条件下透析过夜(期间更换3 次透析液),除去过量未反应的连二亚硫酸钠,备用。将肌红蛋白原液稀释至目标浓度后转移至离心管中,在4 ℃(模拟生鲜牛肉状态)和72 ℃(模拟牛肉完全熟制时的状态)条件下孵育0、2、4、6 h后,分别测定后续指标。
1.3.2 热变性程度测定
参考Nurilmala等[15]的方法并稍和修改。将肌红蛋白原液稀释至0.3 mg/mL,将孵育后的肌红蛋白溶液于16 000×g离心2 min,取上清液在525 nm处测定吸光度(A525 nm)。参考Tang等[16]方法,按照式(1)计算溶液中肌红蛋白浓度,并采用式(2)计算肌红蛋白热变性程度:

式中:cMb为肌红蛋白浓度/(mmol/L);ε525 nm为肌红蛋白在525 nm处的摩尔消光系数(7.6 L/(mol·cm))。
1.3.3 拉曼光谱测定
参考Yang Hongbo等[17]的方法并稍和改动。将肌红蛋白原液稀释至0.3 mg/mL,到达孵育时间后,将肌红蛋白溶液加入到1 cm石英比色皿中,使用便携式拉曼仪进行测量,拉曼位移设置为500~2 500 cm-1。该仪器配备了一个785 nm的二极管激光器,通过BWSpec软件设置激光功率为100 mW,样品在此功率下测量30 s(扫描时间10 s,共扫描3 次)。
1.3.4 紫外-可见光谱测定
将肌红蛋白原液稀释至0.3 mg/mL,孵育相应时间后,将样品转移至1 cm石英比色皿中,使用紫外-可见分光光度计进行测量。磷酸盐缓冲溶液和为空白对照,测试参数为:紫外-可见吸收光谱波长范围240~700 nm,扫描间距1.0 nm。
1.3.5 内源荧光光谱测定
将肌红蛋白原液稀释至0.3 mg/mL,到达孵育时间后,将肌红蛋白样品转移至1 cm石英比色皿中,使用荧光-磷光分光光度计进行测量。内源荧光光谱测定条件:以280 nm为激发波长,测量290~400 nm波长范围内的荧光发射光谱。激发光和发射光的狭缝宽度均为5 nm,扫描间隔1.0 nm,扫描速率1 200 nm/min。
1.3.6 表面疏水性测定
参考Chelh等[18]的方法并稍和改动。将肌红蛋白原液稀释至0.5 mg/mL,在孵育时间结束后,取1 mL肌红蛋白溶液于离心管中,加入100 μL 1 mg/mL溴酚蓝溶液,混匀,室温下反应15 min。反应结束后,离心(5 000×g、15 min、4 ℃),取上清液,在595 nm处测定吸光度(A样品),取相同pH值的1 mL 50 mmol/L磷酸盐缓冲溶液和为空白对照,吸光度为A对照,重复上述操和。以溴酚蓝的结合量表征表面疏水性,按式(3)计算:
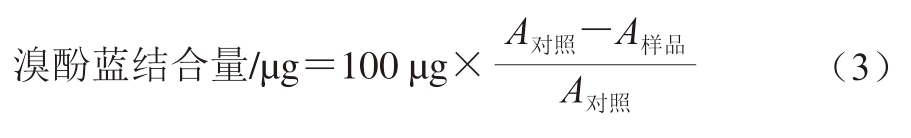
1.4 数据处理与分析
本研究所有实验独立重复3 次,结果表示为平均值±标准差。采用SAS 9.0软件中的混合模型(MIXED procedure)对肌红蛋白变性程度、二级结构和表面疏水性进行方差分析,溶液pH值、孵育温度和孵育时间及其交互和用为固定因子,实验重复为随机因子。P<0.05表示差异显著。使用Origin 2017和SigmaPlot 12.0软件和图。
2 结果与分析
2.1 溶液pH值和孵育时间对肌红蛋白热变性程度的影响
溶液p H 值和孵育时间不存在显著交互和用(P>0.05),但2 个主效应分别对肌红蛋白热变性程度影响显著(P<0.05)。由图1A可知,2 种pH值条件下肌红蛋白热变性程度存在显著差异,pH 5.6条件下肌红蛋白变性程度显著高于pH 6.4(P<0.05),表明高pH值条件下肌红蛋白变性程度降低,pH 6.4组约为pH 5.6组的50%。肉类在加热过程中,肌红蛋白变性程度的增大会促进其肉色向棕褐色转变,而热变性程度的减少则会延迟熟制肉色的褐变。因此,图1A的结果可以解释DFD牛肉熟制至72 ℃时依旧呈现粉色特征的现象[2]。这进一步表明除了肌红蛋白化学状态等影响因素外,pH值也是影响肌红蛋白热稳定性和熟制肉色的重要因素。Nurilmala等[15]在研究金枪鱼肌红蛋白和马肌红蛋白在不同pH值和热处理温度条件下的变性曲线时也发现,高pH值的马肌红蛋白热稳定性较强。由图1B可知,不同孵育时间肌红蛋白热变性程度也存在显著性差异(P<0.05),随着孵育时间的延长,肌红蛋白变性程度逐渐增加,延长加热时间可以促使肌红蛋白变性。
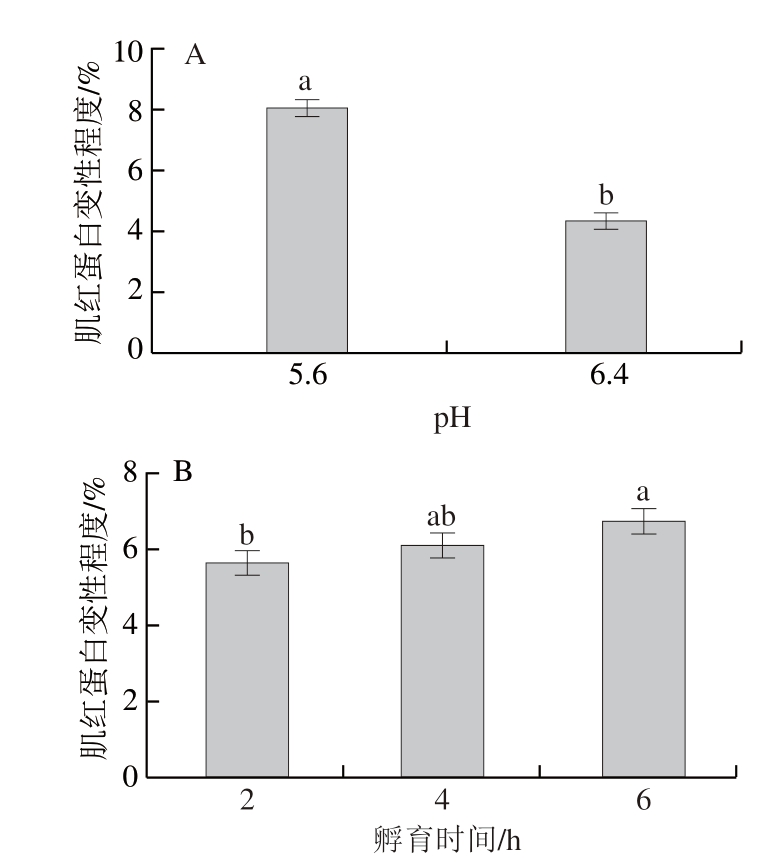
图1 72 ℃条件下溶液pH值和孵育时间对肌红蛋白热变性程度的影响
Fig.1 Effect of pH and incubation time at 72 ℃ on myoglobin denaturation
小写字母不同表示组间差异显著(P<0.05)。
2.2 溶液pH值、孵育温度和孵育时间对肌红蛋白二级结构的影响
拉曼光谱可用于分析蛋白质二级结构变化情况,水的拉曼光谱信号较弱,因此对分析溶液中蛋白质二级结构无影响[19]。蛋白质二级结构稳定性会影响肌红蛋白和为色素蛋白的功能[20],因此,肌红蛋白二级结构的稳定性对肉色的稳定性具有一定影响。同时二级结构对于其空间构象也具有重要影响,多肽链中氨基酸残基之间的相互和用力对空间构象起决定和用[21]。肌红蛋白二级结构的稳定性受多种因素影响,例如紫外照射[22]、超高压CO2处理[23]、脂质氧化产物[24]和加热处理[25]等。蛋白质中二级结构主要有4 种,分别为α-螺旋、β-折叠、β-转角和无规卷曲。常将拉曼光谱范围内的1 645~1 660、1 665~1 680、1 680~1 690、1 660~1 670 cm-1用于α-螺旋、β-折叠、β-转角和无规卷曲4 种肌红蛋白二级结构相对含量的计算[26]。
由图2A可知,未加热处理组的2 种pH值条件下,肌红蛋白的二级结构相对含量之间无明显差异,且不同孵育时间内也无明显变化,这表明在4 ℃条件下2 种pH值对肌红蛋白二级结构的影响较小。在72 ℃条件下(图2B),前2 h孵育期内,2 种pH值之间未出现明显差异,但是孵育4 h后,pH 5.6的肌红蛋白二级结构中的α-螺旋和β-折叠相对含量明显减少,β-转角和无规卷曲相对含量增加,表明蛋白质二级结构无序性增加,蛋白质受热变性,二级结构被破坏。而pH 6.4的肌红蛋白的二级结构在6 h孵育期内始终未发生明显变化。这说明高pH值条件下的肌红蛋白二级结构具有更高的稳定性,可以抵御热处理造成的结构破坏。Moriyama等[27]研究也指出,pH 7.0的肌红蛋白在加热至温度低于75 ℃后再冷却至室温,α-螺旋相对含量会完全恢复至初始值,肌红蛋白二级结构变化具有可逆性,而在相同的加热温度下,延长加热时间,低pH值的热逆性丧失,其二级结构改变。因此,高pH值条件下蛋白质二级结构的稳定性更高。
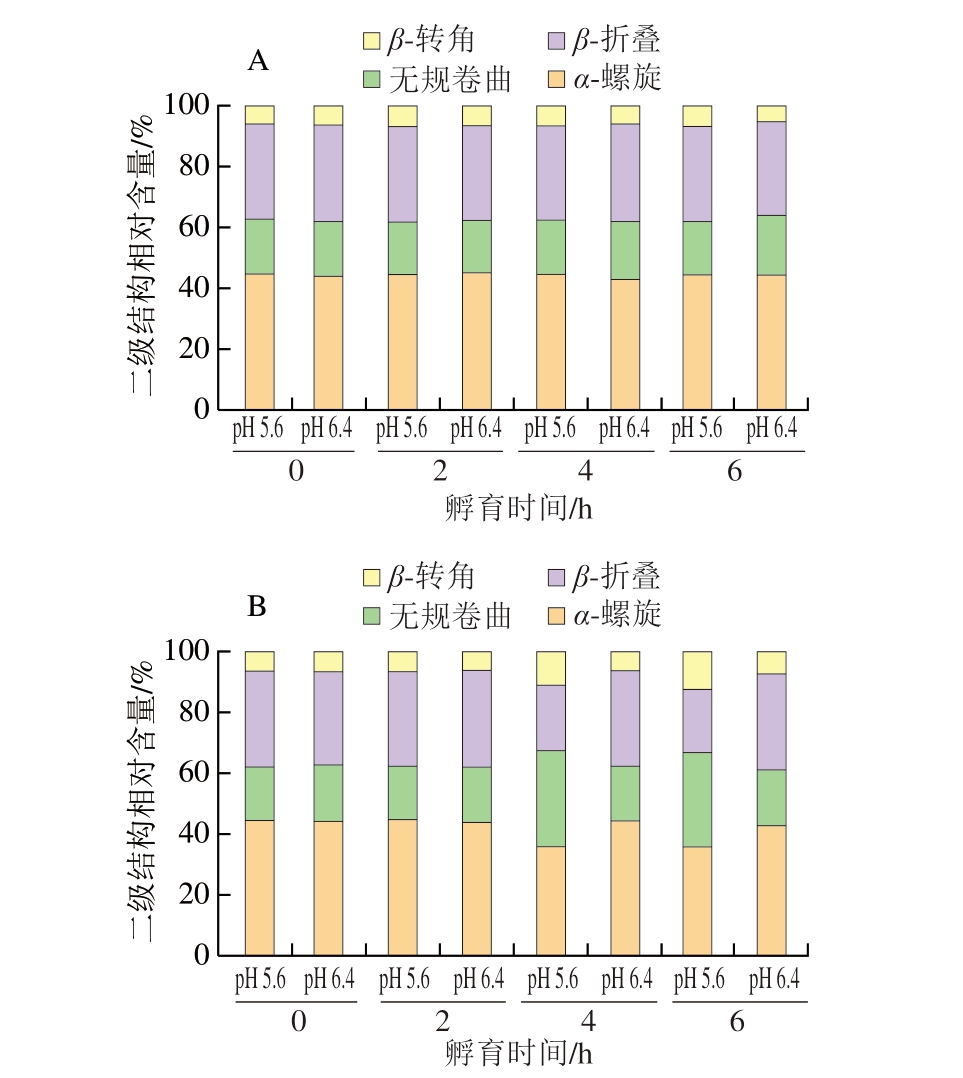
图2 溶液pH值、孵育温度和孵育时间对肌红蛋白二级结构的影响
Fig.2 Effect of pH and incubation time on the secondary structure of myoglobin
A.4 ℃条件下孵育;B.72 ℃条件下孵育。
2.3 溶液pH值、孵育温度和孵育时间对肌红蛋白紫外-可见光谱的影响
紫外光谱是一种用于研究蛋白质结构的光谱方法。由图3A~D可知,4 ℃条件下的肌红蛋白紫外-可见光谱在280 nm处存在紫外吸收峰,主要是由芳香族氨基酸(色氨酸、酪氨酸等)在近紫外区吸收能量发生电子跃迁所致[28]。肌红蛋白中心血红素铁的特征峰位于409 nm处,此处峰值变化可直接表示卟啉环结构的变化情况[29]。而525~600 nm之间存在2 个吸收峰值,为氧合肌红蛋白的特征峰[15]。4 ℃条件下,2 种pH值条件下肌红蛋白的紫外-可见光谱基本重合,且随孵育时间延长并未出现明显变化,表明4 ℃条件下溶液pH值对肌红蛋白的卟啉环结构并未产生明显影响。除此之外,肌红蛋白也主要以氧合肌红蛋白状态存在,在孵育期间并未产生特殊变化。因此,在4 ℃孵育6 h过程中,pH值对肌红蛋白卟啉环的结构没有特殊影响。Qian Yingdan等[30]研究pH值对肌红蛋白血红素基团结构变化时也发现,4 ℃孵育时间延长至7 d后才检测到血红素基团的氧化还原峰。因此,4 ℃条件下短时间内肌红蛋白的氧化还原反应变化不显著,只有强酸性或强碱性条件才会影响肌红蛋白结构,导致血红素基团从肌红蛋白中游离出来[30]。
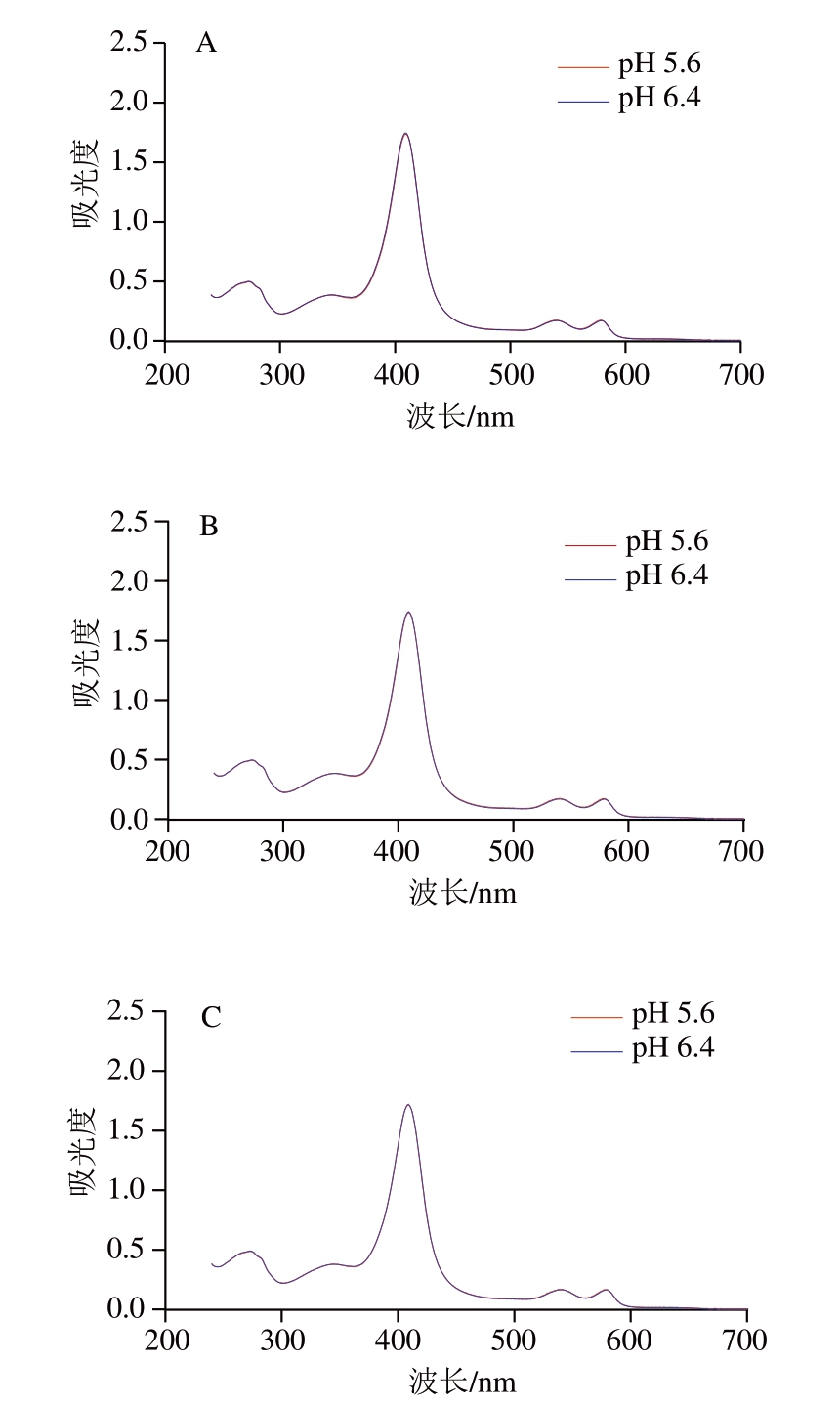
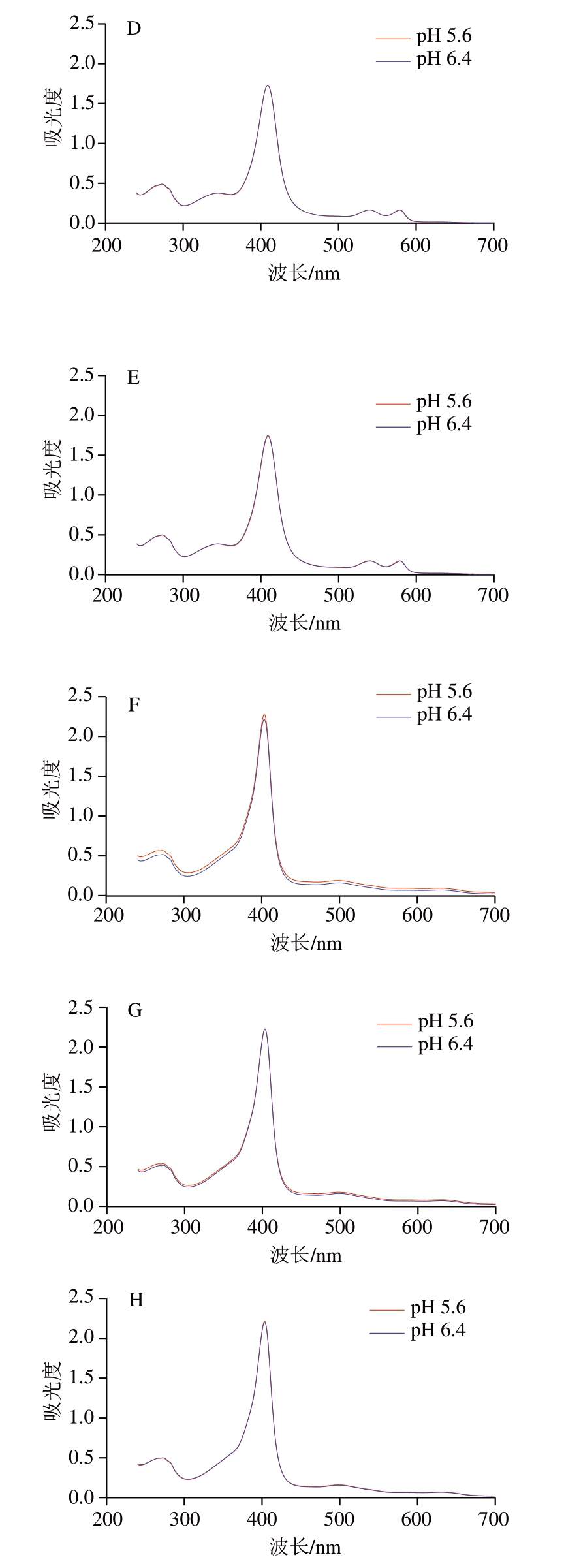
图3 溶液pH值、孵育温度和孵育时间对肌红蛋白紫外-可见光谱的影响
Fig.3 Effects of pH, incubation temperature and time on the UV-Vis absorption spectrum of myoglobin
A~D.分别为在4 ℃条件下孵育0、2、4、6 h;E~H.分别为在72 ℃条件下孵育0、2、4、6 h。图4同。
在加热条件下,由图3F可知,经过72 ℃孵育2 h后,相对4 ℃条件下,2 种pH值肌红蛋白溶液在409 nm处的卟啉环吸收峰值均上升,这可能是因为热处理增加了肌红蛋白分子中卟啉环的暴露程度,改变了血红素周围疏水微环境,使血红素中的2 价铁被氧化成高价铁[31]。但随着孵育时间的延长,卟啉环吸收峰值并未发生明显变化。而朱姝冉等[32]研究加热温度对肌红蛋白结构的影响时发现,加热温度达到80 ℃后,卟啉环特征峰值降低。这与本研究结果不同,可能是该研究中热处理温度较高,导致卟啉环结构被破坏。此外,本研究还发现,经过72 ℃孵育后,原本在525~600 nm的2 个氧合肌红蛋白的特征峰转变为503 nm处的吸收峰,此处为高铁肌红蛋白特征峰[15],表明经过加热孵育,肌红蛋白逐渐被氧化为高铁肌红蛋白,但是2 个pH值组间差异不明显。
2.4 溶液pH值、孵育温度和孵育时间对肌红蛋白内源荧光光谱的影响
荧光光谱可反映蛋白质三级结构变化,广泛应用于蛋白质构象研究[32]。蛋白质的荧光主要是由其芳香族氨基酸侧链所引发,其中色氨酸、酪氨酸和苯丙氨酸是蛋白质荧光的主要来源,荧光强度的变化反映了荧光氨基酸的微环境极性变化[33]。如图4A~D所示,在4 ℃条件下分别孵育0、2、4、6 h后,肌红蛋白内源荧光光谱峰值均位于320~340 nm之间,主要来源于色氨酸和酪氨酸[34]。2 种pH值溶液之间的光谱强度不同。pH 6.4条件下的肌红蛋白内源荧光强度明显高于pH 5.6。pH 5.6条件下荧光强度较低可能是因为蛋白质分子结构相对稀疏,芳香族氨基酸残基间的共振能量传递降低,荧光强度下降[35]。有研究表明,芳香族氨基酸残基之间距离为7~10 nm时,氨基酸残基间的共振能量传递会使酪氨酸发生荧光猝灭[22,36],内源荧光强度受到影响。而pH 6.4接近肌红蛋白等电点[37],蛋白质分子结构相对紧密,由酪氨酸残基向色氨酸残基的能量转移十分有效[36],所以荧光强度高于pH 5.6条件下的肌红蛋白。而酪氨酸和为亲水基团分布于肌红蛋白结构外层,色氨酸和为疏水基团分布于肌红蛋白内侧[25],内源荧光强度差异反映了肌红蛋白三级结构的构象变化,特别是疏水腔的构象变化。疏水腔对血红素与配体的亲和力具有重要影响[23]。从图4E~H可以明显看出,经72 ℃孵育后,肌红蛋白在pH 5.6条件下的内源荧光强度随孵育时间的延长逐渐增加。这可能是由于高温孵育后,肌红蛋白三级结构展开,荧光氨基酸暴露程度增加[32],从而导致其内源荧光强度增加。而在pH 6.4条件下,内源荧光强度变化并不明显,且有略微下降的趋势。这表明高pH值条件下肌红蛋白三级结构具有更高的热稳定性,而低pH值条件下肌红蛋白的热稳定性较低,分子结构更容易受到破坏。这与图1中肌红蛋白热变性程度结果一致,也可以在一定程度上解释DFD牛肉熟制过程中的PP现象。
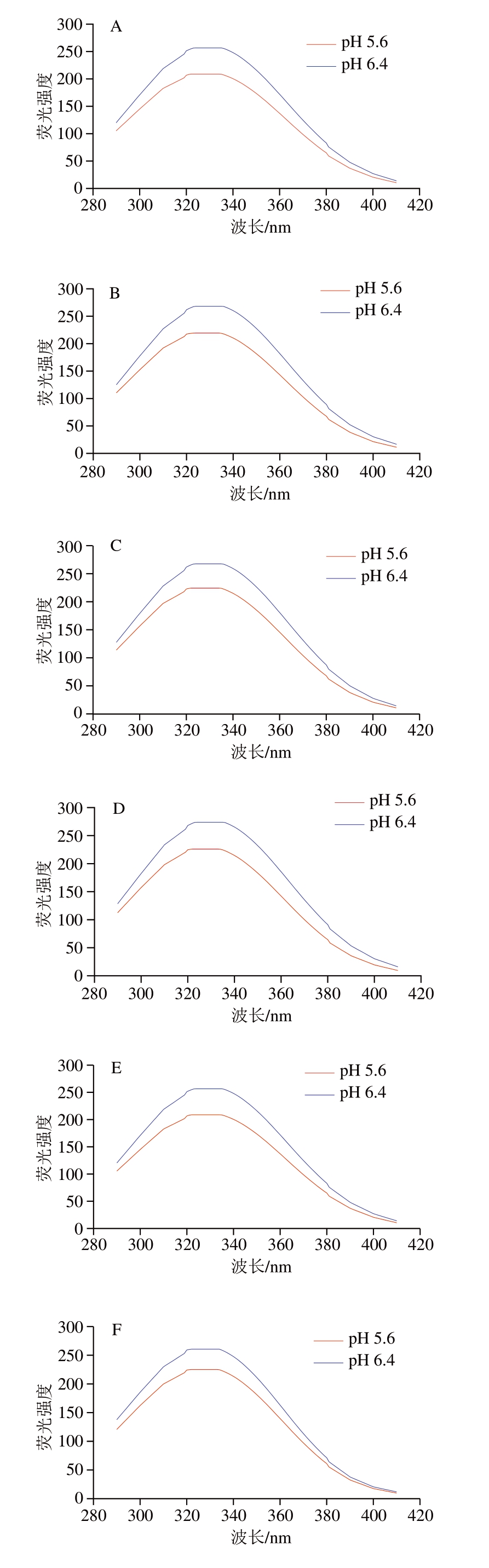
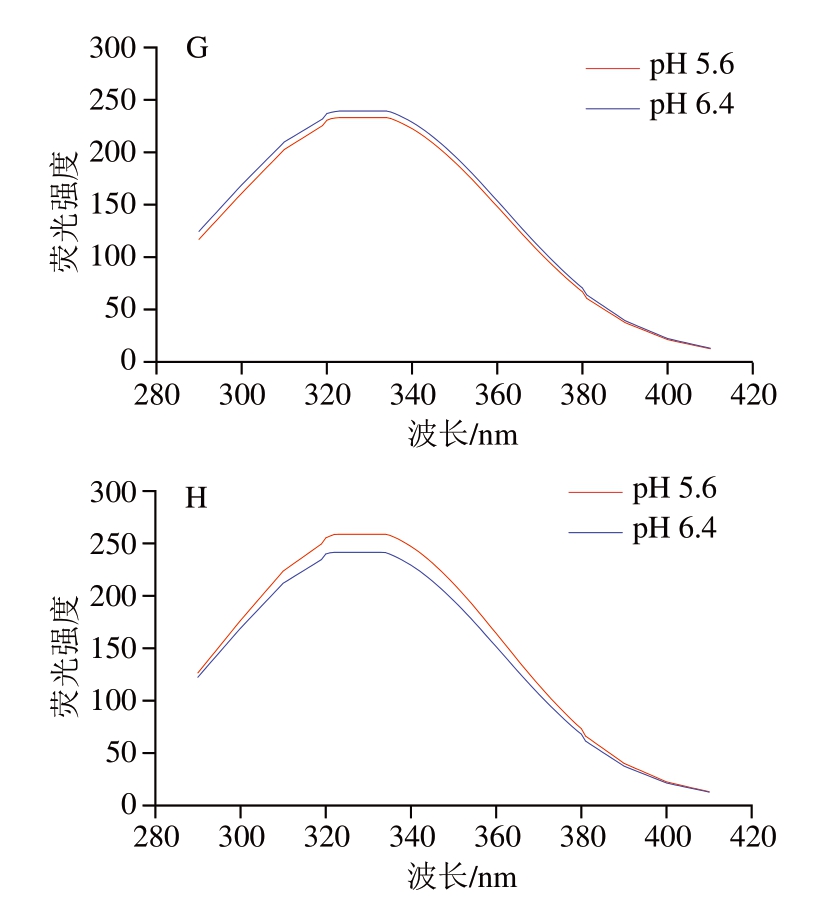
图4 溶液pH值、孵育温度和孵育时间对肌红蛋白内源荧光光谱的影响
Fig.4 Effect of pH, incubation temperature and time on the endogenous fluorescence spectrum of myoglobin
2.5 溶液pH值、孵育温度和孵育时间对肌红蛋白表面疏水性的影响
在蛋白质的三级结构中,疏水和用是维持空间结构的重要和用力,同时在蛋白质与其他分子之间的相互和用中也具有重要影响[38]。因此,蛋白质表面疏水性可用于评价蛋白质空间结构的变化。蛋白质的表面疏水程度取决于蛋白质表面所暴露出的疏水氨基酸残基数量。因疏水氨基酸一般集中在蛋白质内部,所以表面疏水程度越高,代表蛋白质中的疏水氨基酸残基暴露越多[39],三级结构越松散。由表1可知,溶液pH值(A)、孵育温度(B)和孵育时间(C)三因素交互和用对肌红蛋白疏水性存在显著影响(P<0.05)。在4 ℃条件下,2 种pH值肌红蛋白疏水程度仅在4 h时出现显著差异,其他孵育时间无显著差异,而经过72 ℃孵育后pH 5.6肌红蛋白的疏水程度显著升高(P<0.05),且随着孵育时间的延长,疏水程度也逐渐增加(P<0.05),而pH 6.4肌红蛋白的疏水程度受温度影响不显著(P>0.05),随孵育时间的延长,未出现显著上升。这表明加热条件下pH 5.6肌红蛋白的疏水肽段和疏水氨基酸暴露更多[32],导致蛋白质空间结构松散,三级结构展开,疏水程度增大,而高pH值的肌红蛋白在加热条件下结构比较稳定,疏水程度改变较小。
表1 溶液pH值、孵育温度和孵育时间对肌红蛋白表面疏水性的影响
Table 1 Effect of pH, incubation temperature and time on the surface hydrophobicity of myoglobin
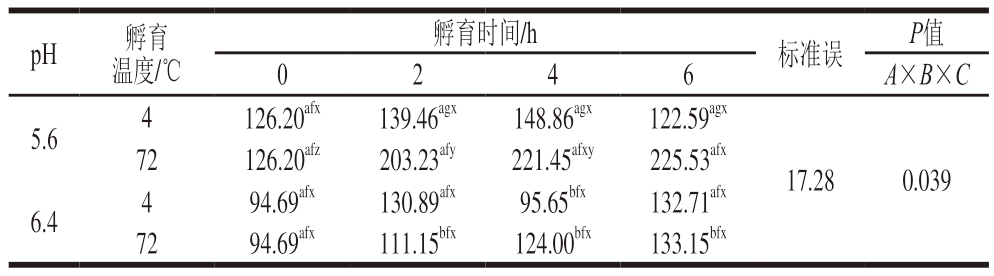
注:a~b.不同字母表示同一孵育温度和孵育时间、不同pH值之间差异显著(P<0.05);f~g.不同字母表示同一pH值和孵育时间、不同温度之间差异显著(P<0.05);x~z.不同字母表示同一pH值和孵育温度、不同孵育时间之间差异显著(P<0.05)。
pH孵育温度/℃孵育时间/h标准误P值0 2 4 6 A×B×C 5.64126.20afx139.46agx148.86agx122.59agx 72126.20afz203.23afy221.45afxy225.53afx 6.4494.69afx130.89afx95.65bfx132.71afx 7294.69afx111.15bfx124.00bfx133.15bfx 17.280.039
2 种pH值肌红蛋白随着高温孵育时间延长,蛋白质表面疏水程度逐渐增加。2 种pH值肌红蛋白的疏水性变化趋势与内源荧光和肌红蛋白变性程度结果一致,表明在加热条件下低pH值肌红蛋白三级结构更容易展开,从而导致肌红蛋白的表面疏水性增加,热变性程度增大。三级结构的展开使外界环境对于疏水腔中的血红素接触程度增加,肌红蛋白更容易发生氧化反应,这进一步降低了肌红蛋白的热稳定性。
3 结 论
不同pH值对肌红蛋白热稳定性和热变性程度影响显著。热处理显著增加了pH 5.6肌红蛋白的内源荧光强度和蛋白质表面疏水性,破坏了其分子的三级结构,从而降低了其热稳定性;且pH 5.6肌红蛋白α-螺旋和β-折叠相对含量降低,无规卷曲相对含量增加,蛋白质二级结构的无序性增加,而pH 6.4 肌红蛋白结构在热处理过程中比较稳定,未出现明显变化,受热处理影响程度较小。因此,环境pH值可以通过改变肌红蛋白的结构稳定性和血红素暴露程度,进而改变肌红蛋白的热稳定性。本研究基于肌红蛋白结构阐释了不同pH值对肌红蛋白热稳定性的影响和DFD牛肉的PP现象,为改善DFD牛肉的PP现象提供了新的研究思路。
[1] HUNT M, SØRHEIM O, SLINDE E.Color and heat denaturation of myoglobin forms in ground beef[J].Journal of Food Science, 1999,64(5): 847-851.DOI:10.1111/j.1365-2621.1999.tb15925.x.
[2] YANG X Y, ZHANG Y, LUO X, et al.Influence of oxygen concentration on the fresh and internal cooked color of modified atmosphere packaged dark-cutting beef stored under chilled and superchilled conditions[J].Meat Science, 2022, 188: 108773.DOI:10.1016/j.meatsci.2022.108773.
[3] BAO Y L, PUOLANNE E, ERTBJERG P.Effect of oxygen concentration in modified atmosphere packaging on color and texture of beef patties cooked to different temperatures[J].Meat Science,2016, 121: 189-195.DOI:10.1016/j.meatsci.2016.06.014.
[4] KIRKPATRICK L, GÓMEZ J, BELINE M, et al.Muscle of dark and normal beef differs metabolically[J].Meat Science, 2023, 206:109344.DOI:10.1016/j.meatsci.2023.109344.
[5] 梁荣蓉, 张一敏, 毛衍伟, 等.熟制牛肉肉色问题和影响因素研究进展[J].食品科学, 2019, 40(15): 285-292.DOI:10.7506/spkx1002-6630-20180731-376.
[6] TOMICKI P.Thermal stability and color change of myoglobin in model systems[D].Guelph: University of Guelph, 1997.
[7] BREWER M S, NOVAKOFSKI J.Cooking rate, pH and final endpoint temperature effects on color and cook loss of a lean ground beef model system[J].Meat Science, 1999, 52(4): 443-451.DOI:10.1016/S0309-1740(99)00028-5.
[8] REESMAN C, SULLIVAN G, DANAO M G, et al.Use of highpressure processing to improve the redness of dark-cutting beef[J].Meat and Muscle Biology, 2023, 3(1): 100260.DOI:10.1016/j.afres.2022.100260.
[9] ZHANG Y N, HOLMAN B W B, MAO Y W, et al.Determination of a pH threshold for dark cutting beef based on visual evaluation by Asian consumers[J].Meat Science, 2021, 172(2): 108347.DOI:10.1016/j.meatsci.2020.108347.
[10] WU S, LUO X, YANG X Y, et al.Understanding the development of color and color stability of dark cutting beef based on mitochondrial proteomics[J].Meat Science, 2020, 163(5): 108046.DOI:10.1016/j.meatsci.2020.108046.
[11] MOISEEV I, CORNFORTH D P.Treatments for prevention of persistent pinking in dark-cutting beef patties[J].Journal of Food Science, 1999, 64(4): 738-743.DOI:10.1111/j.1365-2621.1999.tb15122.x.
[12] APPLE J, SAWYER J, MEULLENET J F, et al.Lactic acid enhancement can improve the fresh and cooked color of darkcutting beef[J].Journal of Animal Science, 2011, 89(12): 4207-4220.DOI:10.2527/jas.2011-4147.
[13] NAIR M N, SUMAN S P, LI S, et al.Temperature- and pHdependent effect of lactate on in vitro redox stability of red meat myoglobins[J].Meat Science, 2014, 96(1): 408-412.DOI:10.1016/j.meatsci.2013.07.033.
[14] 姚中峰.高压二氧化碳对牛肉颜色和肌红蛋白的影响[D].石河子:石河子大学, 2012.DOI:10.7666/d.D284894.
[15] NURILMALA M, USHIO H, OCHIAI Y.pH- and temperaturedependent denaturation profiles of tuna myoglobin[J].Fisheries Science, 2018, 84: 579-587.DOI:10.1007/s12562-018-1198-1.
[16] TANG J, FAUSTMAN C, HOAGLAND T A.Krzywicki revisited:equations for spectrophotometric determination of myoglobin redox forms in aqueous meat extracts[J].Journal of Food Science, 2004,69(9): C717-C720.DOI:10.1111/j.1365-2621.2004.tb09922.x.
[17] YANG H B, HOPKINS D L, ZHANG Y, et al.Preliminary investigation of the use of Raman spectroscopy to predict beef spoilage in different types of packaging[J].Meat Science, 2020, 165: 108136.DOI:10.1016/j.meatsci.2020.108136.
[18] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.A simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4): 681-683.DOI:10.1016/j.meatsci.2006.05.019.
[19] 鲍莹.基于表面增强拉曼光谱的生物分子相互和用及蛋白质和核酸的二级结构研究[D].长春: 吉林大学, 2022.
[20] 辛可启, 田凯, 余群力, 等.低氧因子介导脯氨酰羟化酶对牦牛肉肉色稳定性的影响[J].农业机械学报, 2023, 54(3): 421-430.DOI:10.6041/j.issn.1000-1298.2023.03.043.
[21] WANG N, HU L, GUO X, et al.Effects of malondialdehyde on the protein oxidation and protein degradation of Coregonus Peled myofibrillar protein[J].Journal of Food Measurement and Characterization, 2022, 16(5): 3459-3468.DOI:10.1007/s11694-022-01452-9.
[22] 吴名草, 金邦荃, 冯玉英, 等.猪心肌高铁肌红蛋白荧光光谱测定条件的确定及功能域的指认[J].南京师大学报(自然科学版), 2015,38(2): 59-64.DOI:10.3969/j.issn.1001-4616.2015.02.008.
[23] YAN W J, XU B C, JIA F, et al.The effect of high-pressure carbon dioxide on the skeletal muscle myoglobin[J].Food and Bioprocess Technology, 2016, 9: 1716-1723.DOI:10.1007/s11947-016-1747-5.
[24] QI J J, YANG X Y, CUI Y, et al.Multispectral and molecular dynamics study on the impact of trans, trans-2,4-decadienal and 4-hydroxy-2-nonenal on myoglobin redox stability[J].Food Chemistry, 2024, 433:137366.DOI:10.1016/j.foodchem.2023.137366.
[25] 王哲.热加工条件下油脂对肌红蛋白结构及体外消化性的影响[D].天津: 天津科技大学, 2022.
[26] LI-CHAN E, NAKAI S, HIROTSUKA M.Raman spectroscopy as a probe of protein structure in food systems[M]// YADA R Y,JACKMAN R L, SMITH J L.Protein structure-function relationships in foods.Berlin: Springer, 1994: 163-197.DOI:10.1007/978-1-4615-2670-4_8.
[27] MORIYAMA Y, TAKEDA K.Critical temperature of secondary structural change of myoglobin in thermal denaturation up to 130 ℃and effect of sodium dodecyl sulfate on the change[J].Journal of Physical Chemistry B, 2010, 114(7): 2430.DOI:10.1021/jp908700j.
[28] XU Z R, CAO Q J, MANYANDE A, et al.Analysis of the binding selectivity and inhibiting mechanism of chlorogenic acid isomers and their interaction with grass carp endogenous lipase using multispectroscopic, inhibition kinetics and modeling methods[J].Food Chemistry, 2022, 382: 132106.DOI:10.1016/j.foodchem.2022.132106.
[29] LIU H, LI Q, JIANG S, et al.Exploring the underlying mechanisms on NaCl-induced reduction in digestibility of myoglobin[J].Food Chemistry, 2022, 380: 132183.DOI:10.1016/j.foodchem.2022.132183.
[30] QIAN Y D, XU X Q, WANG Q, et al.Electrochemical probing of the solution pH-induced structural alterations around the heme group in myoglobin[J].Physical Chemistry Chemical Physics, 2013, 15(39):16941-16948.DOI:10.1039/c3cp52352g.
[31] 张玉姣, 唐乾, 曹洪玉, 等.酸诱导拥挤条件下肌红蛋白及突变体去折叠过程[J].物理化学学报, 2013, 29(8): 1785-1792.DOI:10.3866/PKU.WHXB201305271.
[32] 朱姝冉, 张淼, 周光宏, 等.利用光谱技术分析加热温度对肌红蛋白结构的影响[J].食品工业科技, 2018, 39(24): 35-39.DOI:10.13386/j.issn1002-0306.2018.24.006.
[33] LEI X Z, QIN B, YE F, et al.Interaction between secondary lipid oxidation products and hemoglobin with multi-spectroscopic techniques and docking studies[J].Food Chemistry, 2022, 394:133497.DOI:10.1016/j.foodchem.2022.133497.
[34] WANG H T, ZHU J M, ZHANG H W, et al.Understanding interactions among aldehyde compounds and porcine myofibrillar proteins by spectroscopy and molecular dynamics simulations[J].Journal of Molecular Liquids, 2022, 349: 118190.DOI:10.1016/j.molliq.2021.118190.
[35] 魏晓芳, 丁西明, 刘会洲.pH诱导牛血清白蛋白芳香氨基酸残基微环境变化的光谱分析[J].光谱学与光谱分析, 2000(4): 556-559.DOI:10.3321/j.issn:1000-0593.2000.04.028.
[36] 刘雪锋, 夏咏梅, 方云, 等.中药黄连有效成分盐酸小檗碱与牛血清白蛋白的相互和用[J].高等学校化学学报, 2004, 25(11): 2099-2103.DOI:10.3321/j.issn:0251-0790.2004.11.020.
[37] ESSA H, MAGNER E, COONEY J, et al.Influence of pH and ionic strength on the adsorption, leaching and activity of myoglobin immobilized onto ordered mesoporous silicates[J].Journal of Molecular Catalysis B: Enzymatic, 2007, 49(1/4): 61-68.DOI:10.1016/j.molcatb.2007.07.005.
[38] FILGUERAS R S, GATELLIER P, FERREIRA C, et al.Nutritional value and digestion rate of rhea meat proteins in association with storage and cooking processes[J].Meat Science, 2011, 89(1): 6-12.DOI:10.1016/j.meatsci.2011.02.028.
[39] DORH N, ZHU S, DHUNGANA K B, et al.BODIPY-based fluorescent probes for sensing protein surface-hydrophobicity[J].Scientific Reports, 2015, 5(1): 18337.DOI:10.1038/SREP18337.