随着生活水平的提高,人们对于肉质的要求越来越高,通过运用遗传育种和营养调控等手段使动物的生长性能显著提高,但依然存在肉品质量差的问题,因此提高肉品质成为亟待解决的问题[1]。骨骼肌在机体中起着调节全身能量代谢的作用,骨骼肌主要由肌纤维组成,肌纤维具有很强的可塑性,为了适应机体不同的生理状态,肌纤维的类型组成会发生改变。肌纤维的数量在动物出生后基本不会发生变化,肌纤维类型的转化会伴随动物整个生长发育期。肌纤维类型是影响肉品质的关键因素之一,氧化型肌纤维所占比例越高,肉品质越好,糖酵解型肌纤维所占比例越高,肉品质越差,肌纤维类型的转化受遗传、年龄、性别、营养、运动、温度等多种因素的影响[2-3]。白藜芦醇是一种非黄酮类天然多酚化合物,是植物响应伤害或在植物受到病原体(如细菌或真菌)感染时产生的植物抗毒素。食物中白藜芦醇的来源包括葡萄、蓝莓、覆盆子、桑葚皮和花生皮等[4]。白藜芦醇具有广泛的生物活性,一直是多领域的研究热点,研究表明,白藜芦醇能够调节骨骼肌的新陈代谢、发育及肌纤维类型的转化[4]。白藜芦醇作为一种绿色饲料添加剂可以起到改善肉质的作用,将其添加到鸡饲料中能显著降低鸡肉的滴水损失,改善鸡肉品质,预防因热应激受损的肉品质[5];将其添加到鸭饲料中可以显著降低鸭肉的滴水损失和蒸煮损失,抑制氧化应激,增强抗氧化能力,改善肉品质[6];将其添加到猪饲料中不仅能够提高猪的生长性能,促进肌纤维类型由快肌向慢肌转化,还能够提高肉的抗氧化能力[7]。在畜牧生产中将白藜芦醇作为一种饲料添加剂可以发挥其潜在的价值。此外,在体外研究中发现白藜芦醇也能够调节肌纤维类型转化。Wen Wanxue等[8]研究发现,在C2C12肌管细胞中添加白藜芦醇可以提高慢肌纤维的比例;Zhang Jingyue等[9]研究发现,在牛肌管细胞中添加白藜芦醇促进了快肌到慢肌的转化。本文综合国内外的相关研究报道,总结白藜芦醇对肌纤维类型的影响及调控机制研究进展,为改善畜禽肉品质提供理论基础。
1 肌纤维的分类
肌肉的主要组成部分是肌细胞,经过分化后的肌细胞呈纤维状,因此又叫肌纤维。骨骼肌是一种多功能组织,参与各种生物过程,由不同类型的肌纤维组成。肌肉纤维占肌肉的75%~90%,是影响肌肉特性的主要因素。根据所含肌球蛋白重链(myosin heavy chains,MyHC)类型的不同,将肌纤维分为4 类:慢速氧化型(MyHC I)、快速氧化型(MyHC IIa)、快速糖酵解型(MyHC IIb)和中间型(MyHC IIx)。不同的肌纤维类型具有不同的生理生化特性。I型肌纤维又叫红肌纤维,肉色红,含有丰富的肌红蛋白和线粒体,有利于脂肪酸氧化,比无氧糖酵解产生ATP的效率高,苹果酸脱氢酶、琥珀酸脱氢酶等有氧代谢酶活性较高,主要依赖有氧代谢提供能量,肌肉收缩慢且持久。II型肌纤维又叫白肌纤维,肉色白,含有少量的肌红蛋白。IIa是快速氧化型肌纤维,含有肌红蛋白和线粒体,能量来源可以是糖酵解也可以是线粒体氧化。IIb是快速糖酵解型肌纤维,含有的线粒体和肌红蛋白少,糖酵解酶(如乳酸脱氢酶)和ATP酶活性高,几乎全部从糖酵解途径获取能量,肌纤维收缩快但耐性差。IIx是中间型肌纤维,生理生化特征介于IIa和IIb之间[7-12]。
在动物出生之后,肌纤维的数量不再发生变化,后期的生长发育主要体现在肌纤维直径的增大和肌纤维类型之间的转化[1]。肌纤维类型的转化会伴随动物整个生长发育期,肌纤维类型一般按照MyHC I↔MyHC IIa↔MyHC IIx↔MyHC IIb的顺序进行转化[3]。每种肌纤维类型具有不同的生化生理特征,例如,收缩速率、氧化或糖酵解代谢特征、代谢物含量、遗传、运动、营养、激素水平、温度和年龄等因素都会影响肌纤维类型的转化。氧化型肌纤维所占的比例与肥胖和II型糖尿病呈负相关,而糖酵解型肌纤维所占的比例与肥胖和II型糖尿病呈正相关[13],因此肌纤维类型转化的调节不仅在动物肌肉转化为肉类方面广受关注,而且在人类骨骼肌健康和运动医学方面也具有重要意义。
2 肌纤维类型对肉品质的影响
骨骼肌由不同类型的肌纤维组成,其分子、结构、收缩和代谢特性不同,这导致它们功能和肉质量的差异,骨骼肌具有可塑性,在外部刺激下可以在不同类型的肌纤维之间进行转换。肌纤维类型会影响肉的保水性、肉色、质地等品质性状,I型肌纤维所占比例与嫩度呈正相关,I型肌纤维比例越高,肌肉的剪切力越小,肉的嫩度提高,品质越好[1-3];IIb型肌纤维所占比例与嫩度呈负相关,IIb型肌纤维比例越高,肌肉的剪切力越大,肉的嫩度降低,品质下降。更多的I型和IIa型肌纤维与改善肉嫩度有关,并提供对于胰岛素抵抗和代谢失调的保护[10-12]。Lu Xiao等[14]研究中国鲁西黄牛和秦川牛肌纤维特性与肉质的关系,研究发现,牛肉中肌纤维类型与肉品质密切相关,I型肌纤维所占的比例与剪切力呈负相关,与肌节长度和蒸煮损失率呈正相关,可以通过提高I型肌纤维的数量改善秦川牛和鲁西牛的肉嫩度。I和IIx型肌纤维所占比例与肉质性状显著相关,Chaosap等[15]研究不同泰国本地牛肌肉的肉质特性和MyHC亚型,发现MyHC I与不溶性胶原蛋白、总胶原蛋白、pH值、肉色(红度值、黄度值)和水分含量呈正相关,而与亮度值(L*)、剪切力、蛋白质和灰分呈负相关;MyHC IIx则与之相反。由于I型肌纤维和IIa型肌纤维的脂质含量较高,因此会影响肌肉中的脂肪沉积。在巴马香猪中,敖秋栀[12]研究发现,MyHC I基因表达与剪切力呈负相关,与肌内脂肪含量呈正相关;MyHC IIb表达与肌内脂肪含量呈负相关。肉色的深浅取决于所含肌红蛋白的多少,氧化型肌纤维中所含肌红蛋白的含量高,所以当氧化型肌纤维含量高时,肉色更加鲜红,当酵解型肌纤维含量高时,肉色则显得苍白。Ryu等[16]报道,白肌比例过高导致PSE(pale, soft and exudative)猪肉的出现,I型肌纤维与滴水损失和L*呈负相关,而II型肌纤维与滴水损失呈正相关,且对系水力有直接影响。动物宰杀后,肌肉代谢方式由有氧呼吸变为无氧酵解,导致乳酸积累,肉的pH值下降,虽然宰后肌肉pH值很大程度上由肌糖原含量决定,但肉中含快速酵解型纤维比例高时,肉的pH值会快速下降导致PSE肉的产生。呼红梅等[17]研究发现,莱芜猪和杜洛克猪的MyHC I、IIa、IIx的表达量与宰后pH值显著正相关,其表达量越高,肉的pH值越高。综上所述,MyHC 4 种亚型的表达与肉的品质性状显著相关。
3 白藜芦醇对肌纤维类型转化的影响及机制
肌纤维的数量在动物出生后就不会发生改变,为了适应不同的环境条件,肌肉通过改变肌纤维的类型来改变其功能特性,肌纤维类型可以由慢肌转化为快肌,也可以由快肌转化为慢肌。白藜芦醇具有广泛的生物活性,具有抗炎症和抗氧化作用,预防早期动脉粥样硬化事件,治疗肥胖和糖尿病[18]。在锯腹脂鲤的饲料中添加白藜芦醇,发现白藜芦醇可以提高较大直径(40~60、>60 μm)的肌纤维数量[19]。白藜芦醇在肌纤维类型的调节中起着重要作用,通过调节肌纤维的类型来改善肉品质。Zhang Cheng等[7]在育肥猪的饲粮中添加白藜芦醇,发现可以提高猪肉的抗氧化能力,增加猪肉的红润度,降低背最长肌的滴水损失和剪切力,改善猪肉品质。表1总结了近些年来体内外实验关于白藜芦醇对于肌纤维类型的影响,这些结果表明,白藜芦醇可以调控肌纤维类型的转化。白藜芦醇可以调控肌纤维的类型由糖酵解型转化为氧化型,但可能由于添加量及物种之间的差异等原因造成实验结果差异,以及不同物种的胃肠道中存在的相关代谢反应的酶可能不同,从而影响白藜芦醇的生物利用度。肌纤维类型的转化是信号分子之间相互作用的结果,这些复杂而庞大的调控通路和信号分子感知外界环境的变化,从而调节肌纤维类型的转化,图1总结了近年来白藜芦醇影响肌纤维类型转化的可能机制。
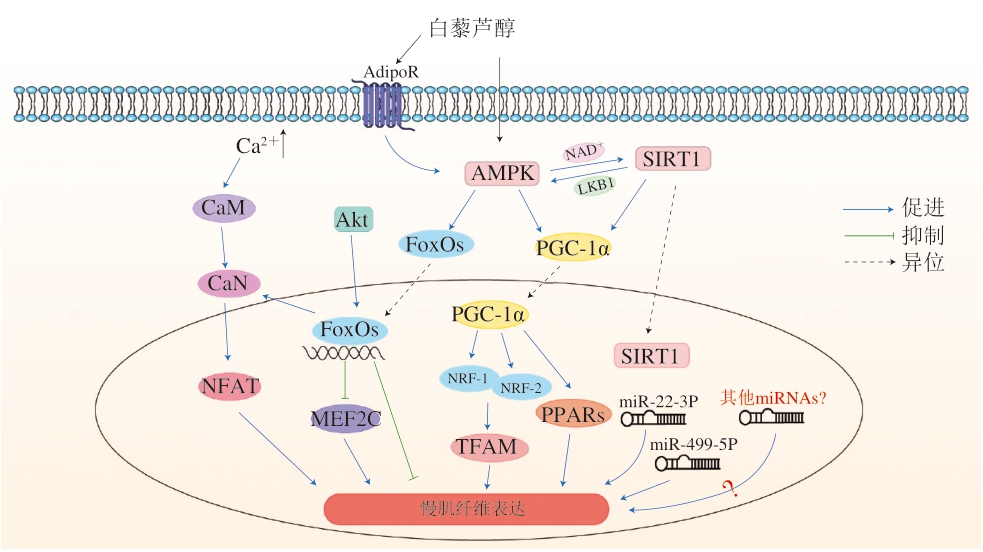
图1 骨骼肌纤维类型转化信号通路
Fig.1 Signaling pathways involved in skeletal muscle fiber transiti on
CaM.钙调素(calmodulin);CaN.钙调神经磷酸酶(calcineurin);NFAT.活化T细胞核因子(nuclear factor of activated T cells);MEF2.肌细胞特异性增强结合因子2(myocyte-specific enhancer- binding factor 2);LKB1.肝激酶B1(liver kinase B1);NAD+.烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide);FoxO.叉头框转录因子O(forkhead box O);Akt.蛋白激酶B(protein kinase B);PPARs.过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors);NRF-1.核呼吸因子1(nuclear respiratory factor 1);TFAM.线粒体转录因子A(mitochondrial transcription factor A)。
表1 白藜芦醇对于肌纤维转化的影响及其机理
Table 1 Effect of resveratrol on muscle fiber transformation and its mechanism
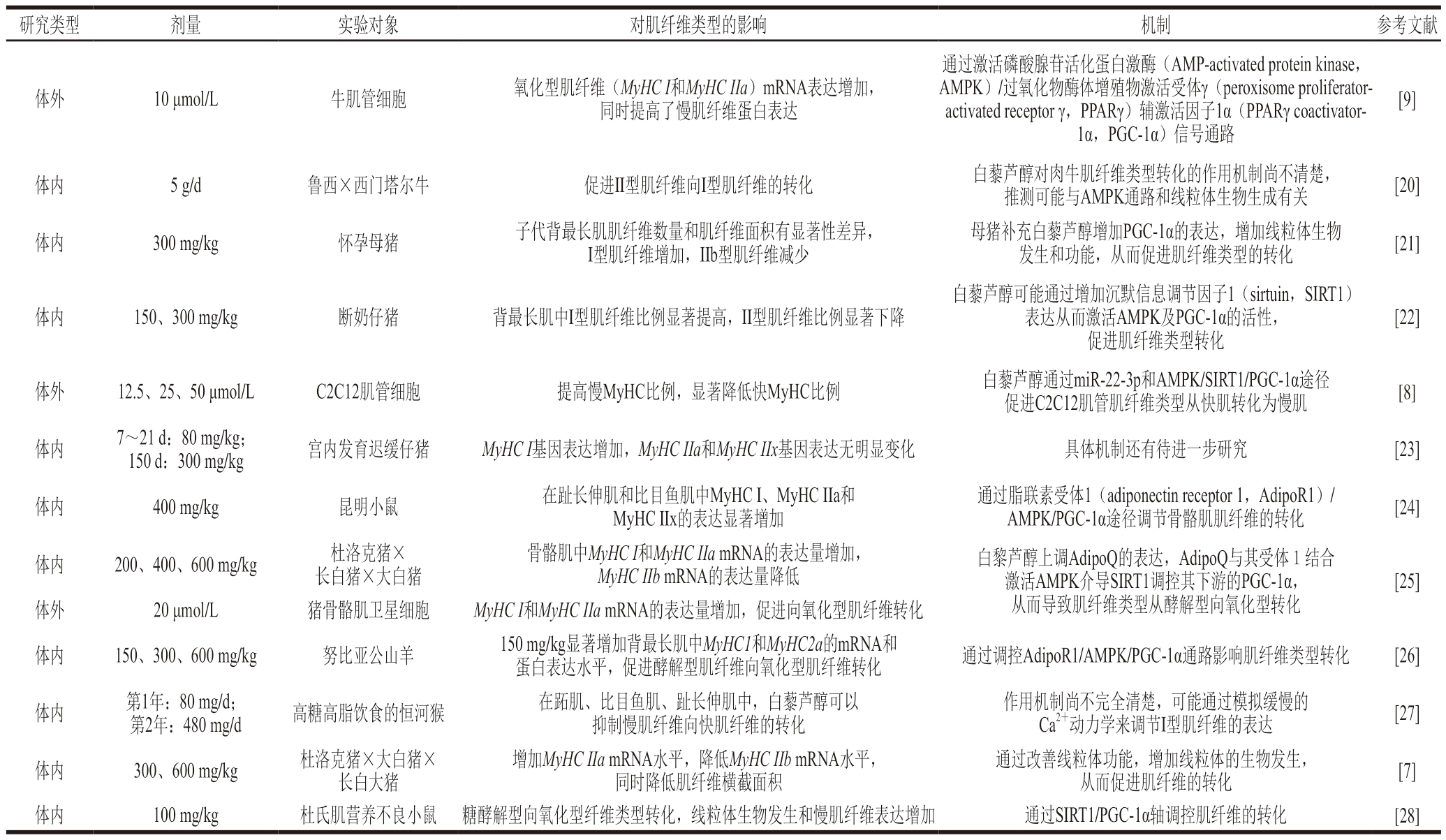
研究类型剂量实验对象对肌纤维类型的影响机制参考文献体外10 μmol/L牛肌管细胞氧化型肌纤维(MyHC I和MyHC IIa)mRNA表达增加,同时提高了慢肌纤维蛋白表达通过激活磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)/过氧化物酶体增殖物激活受体γ(peroxisome proliferatoractivated receptor γ,PPARγ)辅激活因子1α(PPARγ coactivator-1α,PGC-1α)信号通路[9]体内5 g/d鲁西×西门塔尔牛促进II型肌纤维向I型肌纤维的转化白藜芦醇对肉牛肌纤维类型转化的作用机制尚不清楚,推测可能与AMPK通路和线粒体生物生成有关[20]体内300 mg/kg怀孕母猪子代背最长肌肌纤维数量和肌纤维面积有显著性差异,I型肌纤维增加,IIb型肌纤维减少母猪补充白藜芦醇增加PGC-1α的表达,增加线粒体生物发生和功能,从而促进肌纤维类型的转化[21]体内150、300 mg/kg断奶仔猪背最长肌中I型肌纤维比例显著提高,II型肌纤维比例显著下降白藜芦醇可能通过增加沉默信息调节因子1(sirtuin,SIRT1)表达从而激活AMPK及PGC-1α的活性,促进肌纤维类型转化[22]体外12.5、25、50 μmol/LC2C12肌管细胞提高慢MyHC比例,显著降低快MyHC比例白藜芦醇通过miR-22-3p和AMPK/SIRT1/PGC-1α途径促进C2C12肌管肌纤维类型从快肌转化为慢肌[8]体内7~21 d:80 mg/kg;150 d:300 mg/kg宫内发育迟缓仔猪MyHC I基因表达增加,MyHC IIa和MyHC IIx基因表达无明显变化具体机制还有待进一步研究[23]体内400 mg/kg昆明小鼠在趾长伸肌和比目鱼肌中MyHC I、MyHC IIa和MyHC IIx的表达显著增加通过脂联素受体1(adiponectin receptor 1,AdipoR1)/AMPK/PGC-1α途径调节骨骼肌肌纤维的转化[24]体内200、400、600 mg/kg杜洛克猪×长白猪×大白猪骨骼肌中MyHC I和MyHC IIa mRNA的表达量增加,MyHC IIb mRNA的表达量降低白黎芦醇上调AdipoQ的表达,AdipoQ与其受体1结合激活AMPK介导SIRT1调控其下游的PGC-1α,从而导致肌纤维类型从酵解型向氧化型转化[25]体外20 μmol/L猪骨骼肌卫星细胞MyHC I和MyHC IIa mRNA的表达量增加,促进向氧化型肌纤维转化体内150、300、600 mg/kg努比亚公山羊150 mg/kg显著增加背最长肌中MyHC1和MyHC2a的mRNA和蛋白表达水平,促进酵解型肌纤维向氧化型肌纤维转化通过调控AdipoR1/AMPK/PGC-1α通路影响肌纤维类型转化[26]体内第1年:80 mg/d;第2年:480 mg/d高糖高脂饮食的恒河猴在跖肌、比目鱼肌、趾长伸肌中,白藜芦醇可以抑制慢肌纤维向快肌纤维的转化作用机制尚不完全清楚,可能通过模拟缓慢的Ca2+动力学来调节I型肌纤维的表达[27]体内300、600 mg/kg杜洛克猪×大白猪×长白大猪增加MyHC IIa mRNA水平,降低MyHC IIb mRNA水平,同时降低肌纤维横截面积通过改善线粒体功能,增加线粒体的生物发生,从而促进肌纤维的转化[7]体内100 mg/kg杜氏肌营养不良小鼠糖酵解型向氧化型纤维类型转化,线粒体生物发生和慢肌纤维表达增加通过SIRT1/PGC-1α轴调控肌纤维的转化[28]
3.1 microRNA(miRNA)与肌纤维类型转化
miRNA是一类长度约22 个核苷酸、广泛存在于真核生物中的成熟非编码RNA,通过与靶mRNA的3’非翻译区结合抑制靶miRNA或降解靶miRNA[29]。大多数miRNA的靶标和相互作用在很大程度上是未知的,但越来越多的证据表明它们能够调节骨骼肌细胞增殖分化和肌纤维类型转化等一系列生物学过程。miRNA在骨骼肌分化和发育中发挥重要作用,miRNA分为肌肉特异性miRNA和非肌肉特异性miRNA,肌肉特异性miRNA是指优先或只在肌肉中表达的miRNA,如miR-1、miR-206、mi-27a、miR-351h和miR-199a等[30]。
在神经突和脂肪细胞中miR-129-5p具有抑制分化的作用[31-32],细胞环境不同,其对细胞分化的影响也不同,向C2C12细胞中转染miR-129-5p模拟物,结果发现,I型肌纤维的mRNA和蛋白水平的表达被显著抑制,说明在C2C12细胞成肌分化过程中miR-129-5p影响I型肌纤维的形成[33]。在水产动物的肌纤维生长发育中miRNA也具有重要的调控作用,张方亮[34]通过比较鳜鱼的慢肌和快肌,发现32 个显著上调的miRNAs和27 个显著下调的miRNAs,其中miR-103和miR-144分别作用于快肌和慢肌中的靶基因SymD1a和SymD1b,从而影响鳜鱼骨骼肌纤维的生长分化。肌球蛋白重链蛋白是骨骼肌细胞收缩的主要决定因素。肌球蛋白基因Myh7b的内含子编码miR-499。猪骨骼肌卫星细胞中转染miR-499-5p模拟物,I型肌纤维和IIa型肌纤维的mRNA表达量显著提高,当细胞内miR-499-5p含量增加时,猪Sox6 mRNA的表达会明显下调,反之亦然,由此证明,miR-499-5p促进猪骨骼肌慢肌纤维的表达通过抑制Sox6的表达实现[35]。以C2C12细胞为模型,miR-22-3p抑制I型、IIa型肌纤维的表达,促进IIb型肌纤维的表达,而miR-22-3p抑制剂得到相反的结果[36]。在猪成肌细胞中加入精氨酸后促进了肌纤维类型由快肌向慢肌的转化,当过表达miR-27a时抑制了肌纤维类型的转化,表明miR-27a参与亮氨酸诱导的猪成肌细胞肌纤维类型的转化[30]。Wen Wanxue等[8]报道,白藜芦醇通过抑制miR-22-3p促进C2C12肌管肌纤维类型从快肌转化为慢肌。综上所述,miRNAs在不同程度上参与肌纤维类型的转化,目前对于miRNA的研究已受到关注,但是miRNA的下游靶基因之间的相互作用存在多种可能性,未来需要更多的研究去验证其下游靶基因的具体作用机制和相关信号通路,白藜芦醇通过哪些miRNA调控肌纤维类型转化有待进一步研究。
3.2 AMPK/SIRT1/PGC-1α信号通路与肌纤维类型转化
线粒体的主要功能是能量代谢,肌纤维类型转化与线粒体密切相关,因此,细胞能量代谢调节肌纤维类型转化[36]。AMPK、SIRT1、PGC-1α均为细胞能量感受器,形成AMPK/SIRT1/PGC-1α能量感应网络,在肌纤维类型转化过程中发挥重要作用[37]。
3.2.1 AMPK对肌纤维类型转化的影响
AMPK是一个由3 种蛋白质组成的异源三聚体复合体(α1、α2、β1、β2、γ1、γ2和γ3),AMPKα亚基的Thr172位点的磷酸化导致其激活,这种磷酸化受钙/钙调蛋白依赖性激酶2(calmodulin dependent protein kinase kinase 2,CaMKK2)和LKB1的调节[38]。AMPK是一个重要的能量感受器,在机体能量代谢过程中起着重要作用,AMPK可以通过升高的5’-腺苷酸(5’-adenosine monophosphate,AMP)浓度对运动和肌肉收缩作出反应而被激活[39]。AMPK是白藜芦醇的一个关键靶点,白藜芦醇激活AMPK的最可能机制依赖于白藜芦醇及其他多酚(如苦皮酚和槲皮素)直接结合和抑制线粒体F1F0-ATP酶/ATP合成酶(复合体V)的能力,导致AMP/ATP比值升高,从而激活AMPK[40]。
AMPK在肌纤维类型转化中发挥重要调控作用,AMPK调节肌纤维的类型是通过调节糖脂代谢进行,激活的AMPK通过上调葡萄糖转运蛋白4(glucose transporter type 4,Glut4)来改善胰岛素敏感性,并增加线粒体生物合成,将快速糖酵解型肌纤维转变为氧化型肌纤维[41]。AMPK具有组织表达特异性,AMPKα2是骨骼肌细胞中主要表达形式。运动诱导小鼠肌肉中IIb型肌纤维向IIa和IIx型肌纤维转化,而在AMPKα2突变小鼠中这种转化明显减弱[42]。猪骨骼肌卫星细胞中加入精氨酸同时转染AMPKα2-siRNA抑制AMPK活性,结果表明,精氨酸显著抑制了磷酸化的AMPK及精氨酸诱导的I型肌纤维表达上调[43]。AMPK的激活可以促进肌纤维向氧化型的转化,柚皮苷可以激活AMPK的磷酸化,促进其下游基因PGC-1α的表达,进而促进骨骼肌纤维从II型向I型转化[44]。5-氨基-4甲酰胺咪唑核糖核苷酸(5-aminoimidazol-4-formamide ribonucleotide,AICAR)被认为是AMP的类似物,可以激活AMPK,然后上调线粒体氧化代谢酶的活性。通过给大鼠注射AICAR激活AMPK,促进氧化型肌纤维转换,AICAR处理不仅增加了I型肌纤维的数量比例,还增加了I型肌纤维的面积比例,降低了IIb型肌纤维的数量比例[45]。6-[4-[2-(1-哌啶基)乙氧基]苯基]-3-(4-吡啶基)吡唑并[1,5-A]嘧啶是一种常见的AMPK抑制剂,在C2C12细胞中加入AMPK抑制剂抑制I和IIa型肌纤维的表达,促进IIb型肌纤维的表达[36]。上述研究团队成员Zhang Jingyue等[9]研究表明,10 μmol/L白藜芦醇可通过激活AMPK提高牛肌管细胞氧化型肌纤维(MyHC I和MyHC IIa)mRNA表达增加,同时提高慢肌纤维蛋白的表达。
3.2.2 SIRT1对肌纤维类型转化的影响
SIRT是一类高度保守、NAD+依赖的去乙酰化酶家族蛋白,具有去乙酰化酶活性。哺乳动物中一共有7 个成员(SIRT1~7),其中SIRT1和SIRT2在胞质和细胞核中都有定位,SIRT6和SIRT7主要定位于细胞核中,SIRT3、SIRT4、SIRT5则主要定位于线粒体中[40]。SIRT1的研究最为广泛,SIRT1是一种组蛋白脱乙酰化酶,需要SIRT1的磷酸化才能提高脱乙酰酶活性,SIRT1的底物种类繁多,其中包括线粒体呼吸、脂质代谢和衰老过程的关键调节因子。
SIRT1在肌纤维类型转化代谢网络中发挥重要作用。Dugdale等[4]在C2C12小鼠成肌细胞中添加不同剂量的白藜芦醇和EX-527(SIRT1抑制剂),在正常葡萄糖条件下,添加白藜芦醇诱导与慢肌纤维形成相关的基因增加,而EX-527的应用导致与中间型肌纤维形成相关的基因表达降低。白藜芦醇是SIRT1的天然激活剂,肌营养不良症模型小鼠接受6 周的白藜芦醇治疗后,与对照组相比,治疗组中比目鱼肌和趾长伸肌中I型肌纤维的表达增加,白藜芦醇治疗后可以抵抗对于肌营养不良的病理变化[46]。AMPK通过增加细胞NAD+水平来增强SIRT1的活性,从而导致下游SIRT1靶标的去乙酰化和活性调节,这些靶标包括PGC-1α和FoxO1和FoxO3a[47]。SIRT1能够调控肌纤维类型的转化与其下游转录因子PGC-1α相关。Chen Xiaoling等[48]以C2C12细胞为模型研究阿魏酸对肌纤维类型的影响,结果表明,阿魏酸可以诱导慢肌纤维的表达,加入SIRT1抑制剂EX527减弱了阿魏酸诱导的慢肌纤维和PGC-1α蛋白的表达。在饲喂白藜芦醇的断奶仔猪中同样揭示了该机制,与正常组相比,饲喂白藜芦醇的断奶仔猪的背最长肌中I型肌纤维和PGC-1α的表达量显著增加,而II型肌纤维的表达量下降[22]。在骨骼肌组织的能量代谢过程中SIRT1调节PGC-1α活性发挥重要作用,SIRT1介导下游靶点PGC-1α去乙酰化而被激活,从而促进肌纤维类型向I型肌纤维方向转化。
3.2.3 PGC-1α对肌纤维类型转化的影响
PGC-1α被认为是线粒体生物发生的主要调节因子,可诱导线粒体编码基因的转录,这些基因负责线粒体的生物发生,并在肌纤维类型和线粒体功能方面起到重要的调节作用[49]。PGC-1α蛋白具有转录激活区和LXXLL结构域,NRF、肌细胞增强因子2C(myocyte enhancer factor 2C,MEF2C)和PPARγ相互作用[50]。PGC-1α基因可能通过PGC-1α/MEF2、PGC-1α/缺氧诱导因子2α、PGC-1α/PPARδ调控肌纤维类型的转化。PGC-1α主要在线粒体丰富的组织中表达,如心脏、棕色脂肪组织、骨骼肌、肾脏和肝脏,需要翻译后修饰(乙酰化和磷酸化)才具有活性,在骨骼肌萎缩和慢肌纤维发育过程中起重要作用[51]。
从线粒体含量来说,肌纤维类型组成的形成和PGC-1α密切相关,PGC-1α在I型肌纤维中含量较多,而II型肌纤维则相反。AMPK下游的PGC-1α被认为部分参与了AMPK对肌肉纤维转化的影响,PGC-1α通过上调氧化肌纤维特异性基因的表达,促进糖酵解肌纤维转化为氧化型肌纤维[52]。在人体中,PGC1-α的表达与氧化肌纤维(I型)呈正相关,与糖酵解肌纤维(IIb型)呈负相关[53]。小鼠实验表明,肌肉特异性过表达PGC-1α表现为线粒体数量和功能的增加,以及I型氧化纤维的相对数量更高;相反,肌肉特异性缺失PGC-1α的小鼠表现为葡萄糖稳态异常,I型氧化纤维数量适度减少、耐力下降和线粒体基因表达降低[54],证明PGC-1α是肌肉线粒体生物发生的关键调节因子。PGC-1α在调节肌纤维类型转变方面发挥重要作用,利用慢病毒转染在鸡原代成肌细胞中过表达PGC-1α基因,上调了慢肌的表达,同时下调了鸡成肌细胞中快肌的表达[55]。众所周知,线粒体是调节全身所需能量产生的细胞器,Chen Xiaoling等[56]将线粒体复合体I抑制剂鱼藤酮添加到断奶仔猪饲料中,鱼藤酮抑制线粒体电子传递链,下调了线粒体生物发生的主要调节因子PGC-1α的表达,并使精氨酸诱导的I型肌纤维形成无效,验证了PGC-1α是线粒体生物发生的主要调节因子。PGC-1α通过促进线粒体呼吸,在快速糖酵解型肌纤维转化为慢速氧化型肌纤维的过程中发挥重要作用。作者团队成员Zhang Jingyue等[9]也证明了白藜芦醇可以通过激活AMPK进而激活PGC-1α诱导牛肌管肌纤维类型由快肌向慢肌的转化。
3.3 脂联素信号通路与肌纤维类型转化
脂联素最初被鉴定为脂肪组织分泌的蛋白质,但现在已知脂联素在包括骨骼肌在内的多种组织中都有表达。脂联素与其他典型的代谢激素(如胰岛素、瘦素等)一起通过控制血糖和脂肪酸氧化帮助调节新陈代谢[57]。国内外对于脂联素的研究主要集中在糖脂代谢方面,对于调控肌纤维类型方面有少量报道。脂联素不仅可以调节脂肪沉积,在骨骼肌氧化代谢中也发挥重要调节作用,AdipoR1和AdipoR2是主要的AdipoR亚型,AdipoR1和AdipoR2在各组织中都可以表达,AdipoR1主要在骨骼肌中表达,AdipoR2主要在肝脏、脂肪中表达[58]。柚皮苷可以通过AdipoR1信号通路诱导骨骼肌纤维从快肌转变为慢肌,通过沉默AdiopR1特异性抑制AdipoR1信号消除柚皮苷由快肌到慢肌的转化[59]。张佳[60]将重组脂联素添加到皖南花猪骨骼肌卫星细胞中,结果表明,脂联素可能与AdipoR1和AdipoR2结合后通过增加AMPK和PPARα这2 条信号通路调控肌纤维类型的转化,发现MyHC I、MyHC IIa、MyHC IIx的基因表达量增加,MyHC IIb的基因表达量下降,皖南花猪的肉质得到改善。李维新等[61]给小鼠腹腔注射重组脂联素,小鼠骨骼肌中IIa型肌纤维的表达量增加,IIx、IIb型肌纤维的表达量降低,体内实验与体外实验相结合证明了脂联素具有调控肌纤维类型转化的作用。黄艳娜[62]利用流体效应法使小鼠体内脂联素超表达,脂联素可能通过影响肌肉中的转录因子PGC-1α来调控肌纤维的比例,发现腓肠肌和趾长伸肌中氧化型肌纤维的比例增加。以肥育猪为研究对象,夏琴[25]发现,日粮中添加白藜芦醇能够提高血浆中AdipoQ水平,增加肌肉中AdipoR1,激活AMPK/PGC-1α途径,促进肌纤维类型的转化,氧化型肌纤维比例增加。综上所述,脂联素促进肌纤维类型从糖酵解型转化为氧化型,从而影响肌纤维类型的转化。
3.4 FoxO1与肌纤维类型转化
Fox家族的O亚族主要包括FoxO1、FoxO3a、FoxO4和FoxO6,它们广泛存在于生物体中,在无脊椎动物和哺乳动物中发挥重要作用,调节各种细胞功能,包括增殖、存活、细胞周期、代谢和肌肉萎缩[63]。FoxO1是肌肉生长、代谢、细胞增殖和分化的关键调节因子,与肌纤维类型密切相关,Shi等[64]研究发现,在猪骨骼肌中发现磷酸化FoxO1的表达与MyHC I的表达呈正相关,与MyHC IIx和MyHC IIb的表达呈负相关,FoxO1可能负向调节MyHC I,正向调节MyHC IIx和MyHC IIb。慢病毒转染C2C12细胞使FoxO1过表达,阻断内脂素诱导的I型肌纤维、IIa型肌纤维和IIb型肌纤维的上调[65]。FoxO1调节肌纤维类型与多种因素和信号传导途径相关联,如PGC-1α、MEF2C、钙调素依赖性蛋白激酶(calmodulin dependent protein kinase,CaMK)和CaN途径[66]。
PGC-1α是FoxO1的直接共激活因子,可协同激活肌肉中的PPARγ[13],是氧化代谢、线粒体生物发生和慢肌纤维形成所需的代谢转录共激活因子。PGC-1α具有分化I型纤维和控制糖酵解向氧化纤维型转换的潜能,FoxO1可能参与了这些过程。FoxO1和PGC-1α对慢肌纤维的影响比快肌纤维更有效,实验小鼠通过后肢卸载处理,发现PGC-1α在比目鱼肌中表达下调,但在足底肌中表达不下调,后肢卸载过程中,比目鱼肌的氧化酶活性和I型纤维所占比例降低,糖酵解纤维所占比例增加,而足底肌中的氧化酶活性和I型纤维所占比例降低[67]。目前还没有研究能够证实FoxO1与骨骼肌中的PGC1-α可以直接相互作用。
MEF2C转录因子是肌肉发育的关键调节因子,在氧化性肌纤维中被优先激活,转基因小鼠中过表达活性形式MEF2C可以促进慢肌纤维的形成,并响应钙依赖的信号通路,促进糖酵解型肌纤维转化为氧化型肌纤维[68]。MEF2C是骨骼肌中肌纤维特性和肌钙蛋白的必要上游转录激活因子,除此之外,钙信号的下游分子CaMK参与钙依赖信号的转导,上调骨骼肌中I型纤维特异性基因的表达。CaN产生的信号增强了MEF2C的转录激活功能和I型纤维特异性基因的表达[69]。在骨骼肌特性的FoxO1转基因小鼠骨骼肌中,I型肌纤维的数量明显减少,MEF2C和CaMK mRNA水平显著降低,FoxO1可能通过抑制MEF2C和CaMK基因的表达来降低I型纤维的基因表达[70]。
CaN是一种钙依赖、钙调蛋白依赖的蛋白磷酸酶,当细胞内Ca2+浓度升高时被激活,CaN可以直接将钙信号与蛋白质磷酸化状态联系起来,并在许多信号传导过程中发挥重要作用[69]。CaN途径是一条重要的代谢调控途径,刺激慢肌纤维选择性基因的表达和慢肌纤维形成。激活的CaN在体内诱导慢肌纤维基因的表达,给大鼠全身注射CaN抑制剂环孢素A会导致体内慢肌纤维的部分缺失[71]。CaN的过度表达抑制FoxO因子蛋白水平,并阻止肌管萎缩[72]。FoxO1和CaN之间的相互关系表明,FoxO1可能通过CaN途径控制肌纤维转化。Yuan Yuan等[73]研究表明,具有结构性活性的FoxO1突变体导致内源性CaN活性显著降低,CaN信号通路的下游靶基因MCIP1.4(调节性CaN相互作用蛋白外显子4亚型)表达量也显著下调,而加入白藜芦醇后,细胞中MCIP1.4表达量显著升高,表明抑制FoxO1可逆转其对CaN途径表达的负面影响。因此,FoxO1促进了慢肌纤维向快肌纤维的转化,可能通过抑制CaN途径实现。白藜芦醇可以抵消过表达的FoxO1引起的由快肌纤维向慢肌纤维的转变,但其具体调控机理和分子机制尚不明确,未来需要更多的体内与体外实验来探索白藜芦醇通过FoxO1调控肌纤维类型转化的分子机理。
4 结 语
肌纤维是构成骨骼肌的基本单位,肌纤维类型与肉品品质密切相关。白藜芦醇是具有广泛生物活性的天然多酚物质,对肌纤维类型转化具有重要调控作用。miRNAs、AMPK/SIRT1/PGC-1α、脂联素及FoxO1信号通路在白藜芦醇调控肌纤维类型转化的过程中有着极其重要的作用。调控肌纤维转化的信号通路复杂多样,不同的信号通路对于肌纤维类型转化的作用机理不同。近年来在miRNAs分子水平对于肌纤维类型的调控研究越来越深入,通过控制骨骼肌卫星细胞的定向分化可以调控肌纤维类型转化,未来应进一步深入研究白藜芦醇可通过哪些miRNA调控肌纤维转化及其机理,为靶向调控肌纤维类型以改善畜禽肉品质提供理论基础。
[1] 刘雪明, 阎璐, 霍蔚然, 等.肌纤维类型对肉品质的影响[J].当代畜牧, 2021(7): 34-37.
[2] 欧秀琼, 李睿, 张晓春, 等.肌纤维类型组成对猪肌肉品质与能量代谢的影响研究进展[J].浙江农业学报, 2022, 34(1): 196-203.DOI:10.3969/j.issn.1004-1524.2022.01.22.
[3] 徐洋.中药添加剂对夏季高温条件下肉牛肌肉品质及肌纤维类型的影响[D].南昌: 江西农业大学, 2018: 4-6.
[4] DUGDALE H F, HUGHES D C, ALLAN R, et al.The role of resveratrol on skeletal muscle cell differentiation and myotube hypertrophy during glucose restriction[J].Molecular and Cellular Biochemistry, 2018, 444(1): 109-123.DOI:10.1007/s11010-017-3236-1.
[5] 马玉静, 何荣香, 杨玲, 等.白藜芦醇的生物学功能及其在动物生产中的应用[J].中国畜牧兽医, 2019, 46(11): 3234-3243.DOI:10.16431/j.cnki.1671-7236.2019.11.012.
[6] 禹琪芳.白藜芦醇调控脂质代谢影响肉鸭肉品质的机制研究[D].长沙: 湖南农业大学, 2021: 42-47.
[7] ZHANG C, LUO J, YU B, et al.Dietary resveratrol supplementation improves meat quality of finishing pigs through changing muscle fiber characteristics and antioxidative status[J].Meat Science, 2015, 102:15-21.DOI:10.1016/j.meatsci.2014.11.014.
[8] WEN W X, CHEN X L, HUANG Z Q, et al.Resveratrol regulates muscle fiber type conversion via miR-22-3p and AMPK/SIRT1/PGC-1α pathway[J].Journal of Nutritional Biochemistry, 2020, 77: 108297.DOI:10.1016/j.jnutbio.2019.108297.
[9] ZHANG J Y, LI J Q, LIU Y G, et al.Effect of resveratrol on skeletal slow-twitch muscle fiber expression via AMPK/PGC-1α signaling pathway in bovine myotubes[J].Meat Science, 2023, 204: 109287.DOI:10.1016/j.meatsci.2023.109287.
[10] JIN S, PANG Q, YANG H, et al.Effects of dietary resveratrol supplementation on the chemical composition, oxidative stability and meat quality of ducks (Anas platyrhynchos)[J].Food Chemistry, 2021,363: 130263.DOI:10.1016/j.foodchem.2021.130263.
[11] 苏琳.巴美肉羊肌纤维特性、糖酵解潜力对羊肉品质的影响和MyHC表达量分析[D].呼和浩特: 内蒙古农业大学, 2015: 2-5.
[12] 敖秋桅.骨骼肌肌纤维类型与巴马香猪肉质性状的相关性研究[D].南宁: 广西大学, 2014: 2-7.
[13] CANTÓ C, AUWERX J.PGC-1α, SIRT1 and AMPK, an energy sensing network that controls energy expenditure[J].Current Opinion in Lipidology, 2009, 20(2): 98-105.DOI:10.1097/mol.0b013e328328d0a4.
[14] LU X, YANG Y, ZHANG Y, et al.The relationship between myofiber characteristics and meat quality of Chinese Qinchuan and Luxi cattle[J].Animal Bioscience, 2021, 34(4): 743-750.DOI:10.5713/ajas.20.0066.
[15] CHAOSAP C, SIVAPIRUNTHEP P, SITTHIGRIPONG R, et al.Meat quality, post-mortem proteolytic enzymes, and myosin heavy chain isoforms of different Thai native cattle muscles[J].Animal Bioscience,2021, 34(9): 1514-1524.DOI:10.5713/ab.20.0798.
[16] RYU Y C, CHOI Y M, LEE S H, et al.Comparing the histochemical characteristics and meat quality traits of different pig breeds[J].Meat Science, 2008, 80(2): 363-369.DOI:10.1016/j.meatsci.2007.12.020.
[17] 呼红梅, 王继英, 朱荣生, 等.莱芜猪和杜洛克猪肌肉肌球蛋白重链组成对肉质性状的影响[J].中国科学(生命科学), 2008, 41(11): 60-65.
[18] REPOSSI G, DAS U N, EYNARD A R.Molecular basis of the beneficial actions of resveratrol[J].Archives of Medical Research,2020, 51(2): 105-114.DOI:10.1016/j.arcmed.2020.01.010.
[19] SALOMAO R A S, DE PAULA T G, ZANELLA B T T, et al.The combination of resveratrol and exercise enhances muscle growth characteristics in pacu (Piaractus mesopotamicus)[J].Comparative Biochemistry and Physiology-Part A: Molecular and Integrative Physiology, 2019, 235: 46-55.DOI:10.1016/j.cbpa.2019.05.002.
[20] LI J, LIANG R, MAO Y, et al.Effect of dietary resveratrol supplementation on muscle fiber types and meat quality in beef cattle[J].Meat Science, 2022, 194: 108986.DOI:10.1016/j.meatsci.2022.108986.
[21] MENG Q, SUN S, BAI Y, et al.Effects of dietary resveratrol supplementation in sows on antioxidative status, myofiber characteristic and meat quality of offspring[J].Meat Science, 2020,167: 108176.DOI:10.1016/j.meatsci.2020.108176.
[22] 曾子悠.饲粮添加白藜芦醇对断奶仔猪肌纤维类型、抗氧化能力及肠道屏障功能的影响[D].成都: 四川农业大学, 2019: 30-32.
[23] CHENG K, YU C, LI Z, et al.Resveratrol improves meat quality,muscular antioxidant capacity, lipid metabolism and fiber type composition of intrauterine growth retarded pigs[J].Meat Science,2020, 170: 108237.DOI:10.1016/j.meatsci.2020.108237.
[24] JIANG Q, CHENG X, CUI Y, et al.Resveratrol regulates skeletal muscle fibers switching through the AdipoR1-AMPK-PGC-1α pathway[J].Food and Function, 2019, 10: 3334-3343.DOI:10.1039/c8fo02518e.
[25] 夏琴.基于脂联素信号通路研究白藜芦醇调控猪肉品质和骨骼肌肌纤维类型转化的作用机制[D].南宁: 广西大学, 2019: 40-42.
[26] 申玉建.白藜芦醇调控山羊骨骼肌生长和肌纤维类型转化的机制研究[D].南宁: 广西大学, 2022: 6-7.
[27] HYATT J P K, NGUYEN L, HALL A E, et al.Muscle-specific myosin heavy chain shifts in response to a long-term high fat/high sugar diet and resveratrol treatment in nonhuman primates[J].Frontiers in Physiology, 2016, 7: 77.DOI:10.3389/fphys.2016.00077.
[28] LJUBICIC V, BURT M, LUNDE J A, et al.Resveratrol induces expression of the slow, oxidative phenotype in mdx mouse muscle together with enhanced activity of the SIRT1-PGC-1α axis[J].American Journal of Physiology-Cell Physiology, 2014, 307(1):C66-C82.DOI:10.1152/ajpcell.00357.2013.
[29] YANG Y, YUJIAO W, FANG W, et al.The roles of miRNA, lncRNA and circRNA in the development of osteoporosis[J].Biological Research, 2020, 53(1): 1-16.DOI:10.1186/s40659-020-00309-z.
[30] 张树润.亮氨酸与miR-27a影响猪成肌细胞分化和肌纤维类型转化的机理研究[D].成都: 四川农业大学, 2018: 10-12.
[31] LOFFREDA A, NIZZARDO M, AROSIO A, et al.miR-129-5p:a key factor and therapeutic target in amyotrophic lateral sclerosis[J].Progress in Neurobiology, 2020, 190: 101803.DOI:10.1016/j.pneurobio.2020.101803.
[32] FU X, JIN L, HAN L, et al.miR-129-5p inhibits adipogenesis through autophagy and may be a potential biomarker for obesity[J].International Journal of Endocrinology, 2019, 2019(1): 5069578.DOI:10.1155/2019/5069578.
[33] PENG Y, XU M, DOU M, et al.MicroRNA-129-5p inhibits C2C12 myogenesis and represses slow fiber gene expression in vitro[J].American Journal of Physiology-Cell Physiology, 2021, 320(6):C1031-C1041.DOI:10.1152/ajpcell.00578.2020.
[34] 张方亮.鳜鱼快慢肌蛋白组学与miRNA组学比较分析[D].桂林:广西师范大学, 2018: 52-55.
[35] WANG X Y, CHEN X L, HUANG Z Q, et al.MicroRNA-499-5p regulates porcine myofiber specification by controlling Sox6 expression[J].Animal, 2017, 11(12): 2268-2274.DOI:10.1017/s1751731117001008.
[36] WEN W, CHEN X, HUANG Z, et al.miR-22-3p regulates muscle fiber-type conversion through inhibiting AMPK/SIRT1/PGC-1α pathway[J].Animal Biotechnology, 2021, 32(2): 254-261.DOI:10.108 0/10495398.2020.1763375.
[37] 文超越, 段叶辉, 李颖慧, 等.能量感应网络AMPK/SIRT1/PGC-lα对骨骼肌纤维类型转化调节[J].动物营养学报, 2016, 28(1): 57-63.DOI:10.3969/j.issn.1006-267x.2016.01.009.
[38] VILCHINSKAYA N A, KRIVOI I I, SHENKMAN B S.AMPactivated protein kinase as a key trigger for the disuse-induced skeletal muscle remodeling[J].International Journal of Molecular Sciences,2018, 19(11): 3558.DOI:10.3390/ijms19113558.
[39] DUAN Y, LI F, TAN B, et al.Metabolic control of myofibers:promising therapeutic target for obesity and type 2 diabetes[J].Obesity Reviews, 2017, 18(6): 647-659.DOI:10.1111/obr.12530.
[40] KULKARNI S S, CANTÓ C.The molecular targets of resveratrol[J].Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2015, 1852(6): 1114-1123.DOI:10.1016/j.bbadis.2014.10.005.
[41] GOH K P, LEE H Y, LAU D P, et al.Effects of resveratrol in patients with type 2 diabetes mellitus on skeletal muscle SIRT1 expression and energy expenditure[J].Internation Journal of Sport Nutrition and Exercise Metabolism, 2014, 24(1): 2-13.DOI:10.1123/ijsnem.2013-0045.
[42] ROCKL K S, HIRSHMAN M F, BRANDAUER J, et al.Skeletal muscle adaptation to exercise training: AMP-activated protein kinase mediates muscle fiber type shift[J].Diabetes, 2007, 56(8): 2062-2069.DOI:10.2337/db07-0255.
[43] CHEN X, GUO Y, JIA G, et al.Arginine promotes slow myosin heavy chain expression via Akirin2 and AMPK signaling pathway in porcine skeletal muscle satellite cells[J].Journal of Agricultural and Food Chemistry, 2018, 66(18): 4743-4740.DOI:10.1021/acs.jafc.8b00775.
[44] XUE Y, HUANG Z, CHEN X, et al.Naringin induces skeletal muscle fiber type transformation via AMPK/PGC-1α signaling pathway in mice and C2C12 myotubes[J].Nutrition Research, 2021, 92: 99-108.DOI:10.1016/j.nutres.2021.06.003.
[45] HOU Y, SU L, ZHAO Y, et al.Effect of chronic AICAR treatment on muscle fiber composition and enzyme activity in skeletal muscle of rats[J].Journal of Applied Animal Research, 2021, 49(1): 89-96.DOI:10.1080/09712119.2021.1889563.
[46] LJUBICIC V, BURT M, LUNDE J A, et al.Resveratrol induces expression of the slow, oxidative phenotype in mdx mouse muscle together with enhanced activity of the SIRT1-PGC-1α axis[J].American Journal of Physiology-Cell Physiology, 2014, 307(1):C66-C82.DOI:10.1152/ajpcell.00357.2013.
[47] CANTÓ C, GERHART-HINES Z, FEIGE J N, et al.AMPK regulates energy expenditure by modulating NAD+ metabolism and SIRT1 activity[J].Nature,2009, 458(7241): 1056-1060.DOI:10.1038/nature07813.
[48] CHEN X L, GUO Y F, JIA G, et al.Ferulic acid regulates muscle fiber type formation through the Sirt1/AMPK signaling pathway[J].Food and Function, 2019, 10(1): 259-265.DOI:10.1039/c8fo01902a.
[49] ZHANG Y, YU B, YU J, et al.Butyrate promotes slow-twitch myofiber formation and mitochondrial biogenesis in finishing pigs via inducing specific microRNAs and PGC-1α expression[J].Journal of Animal Science, 2019, 97(8): 3180-3192.DOI:10.1093/jas/skz187.
[50] YING F, ZHANG L, BU G, et al.Muscle fiber-type conversion in the transgenic pigs with overexpression of PGC1α gene in muscle[J].Biochem Biophys and Biochemistry, 2016, 480(4): 669-674.DOI:10.1016/j.bbrc.2016.10.113.
[51] WANG J, WANG F, ZHANG P, et al.PGC-1α over-expression suppresses the skeletal muscle atrophy and myofiber-type composition during hindlimb unloading[J].Bioscience Biotechnology and Biochemistry,2017, 81(3): 500-513.DOI:10.1080/09168451.2016.1254531.
[52] SELSBY J T, MORINE K J, PENDRAK K, et al.Rescue of dystrophic skeletal muscle by PGC-1α involves a fast to slow fiber type shift in the mdx mouse[J].PLoS ONE, 2012, 7(1): e30063.DOI:10.1371/journal.pone.0030063.
[53] KRÄMER D K, AHLSÉN M, NORRBOM J, et al.Human skeletal muscle fibre type variations correlate with PPARα, PPARδ and PGC-1α mRNA[J].Acta Physiologica, 2006, 188(3/4): 207-216.DOI:10.1111/j.1748-1716.2006.01620.x.
[54] HANDSCHIN C, CHIN S, LI P, et al.Skeletal muscle fiber-type switching, exercise intolerance, and myopathy in PGC-1α musclespecific knock-out animals[J].Journal of Biological Chemistry, 2007,282(41): 30014-30021.DOI:10.1074/jbc.M704817200.
[55] SHAN Y, JI G, ZOU J, et al.PGC-1α differentially regulates the mRNA expression profiles of genes related to myofiber type specificity in chicken[J].Journal of Integrative Agriculture, 2020, 19(8): 2083-2094.DOI:10.1016/S2095-3119(20)63177-X.
[56] CHEN X L, LUO X M, CHEN D W, et al.Arginine promotes porcine type I muscle fibers formation through improvement of mitochondrial biogenesis[J].British Journal of Nutrition, 2019, 123(5): 1-30.DOI:10.1017/S000711451900309X.
[57] KRAUSE M P, MILNE K J, HAWKE T J.Adiponectin-consideration for its role in skeletal muscle health[J].Internatianal Journal of Molecular Sciences, 2019, 20(7): 1528.DOI:10.3390/ijms20071528.
[58] LIU Y, SWEENEY G.Adiponectin action in skeletal muscle[J].Best Practtice and Research Clinical Endocrinology and Metabolism, 2014,28(1): 33-41.DOI:10.1016/j.beem.2013.08.003.
[59] LI P, ZHANG S, SONG H, et al.Naringin promotes skeletal muscle fiber remodeling by the AdipoR1-APPL1-AMPK signaling pathway[J].Journal of Agricultural and Food Chemistry, 2021, 69(40): 11890-11899.DOI:10.1021/acs.jafc.1c04481.
[60] 张佳.脂联素对皖南花猪骨骼肌生长和肌纤维类型的影响[D].合肥: 安徽农业大学, 2010: 16-18.
[61] 李维新, 周杰, 邵康, 等.重组脂联素对小鼠骨骼肌生长及肌纤维类型的影响[J].江苏农业科学, 2012, 40(11): 204-207.DOI:10.15889/j.issn.1002-1302.2012.11.171.
[62] 黄艳娜.超表达瘦素和脂联素对肌纤维类型和肌肉中脂肪分解关键功能基因影响的研究[D].杭州: 浙江大学, 2011: 63-65.
[63] XING Y, LI A, YANG Y, et al.The regulation of FOXO1 and its role in disease progression[J].Life Sciences, 2018, 193: 124-131.DOI:10.1016/j.lfs.2017.11.030.
[64] SHI X E, SONG Z Y, YANG Q M, et al.Correlation of forkhead box transcription factor O1 and myosin heavy chain isoforms in porcine skeletal muscle[J].Genetics and Molecular Research, 2014, 13(4):10231-10240.DOI:10.4238/2014.December.4.18.
[65] ZHOU L N, LIN Y N, GU C J, et al.AMPK/FOXO1 signaling pathway is indispensable in visfatin-regulated myosin heavy chain expression in C2C12 myotubes[J].Life Sciences, 2019, 224: 197-203.DOI:10.1016/j.lfs.2019.03.060.
[66] MENG X, XIAOLING C, DAIWEN C, et al.FoxO1: a novel insight into its molecular mechanisms in the regulation of skeletal muscle differentiation and fiber type specification[J].Oncotarget, 2017, 8(6):10662-10674.DOI:10.18632/oncotarget.12891.
[67] NAGATOMO F, FUJINO H, KONDO H, et al.PGC-1α and FOXO1 mRNA levels and fiber characteristics of the soleus and plantaris muscles in rats after hindlimb unloading[J].Histology and Histopathology, 2011, 26(12): 1545-1553.DOI:10.14670/HH-26.1545.
[68] POTTHOFF M J, WU H, ARNOLD M A, et al.Histone deacetylase degradation and MEF2 activation promote the formation of slowtwitch myofibers[J].The Journal of Clinical Investigation, 2007,117(9): 2459-2467.DOI:10.1172/JCI31960.
[69] CREAMER T P.Calcineurin[J].Cell Communication and Signaling,2020, 18(1): 137.DOI:10.1186/s12964-020-00636-4.
[70] KAMEI Y, MIURA S, SUZUKI M, et al.Skeletal muscle FOXO1(FKHR) transgenic mice have less skeletal muscle mass, downregulated Type I (slow twitch/red muscle) fiber genes, and impaired glycemic control[J].Journal of Biological Chemistry, 2004, 279(39):41114-41123.DOI:10.1074/jbc.M400674200.
[71] NAYA F J.Stimulation of slow skeletal muscle fiber gene expression by calcineurin in vivo[J].Journal of Biological Chemistry, 2000,275(7): 4545-4548.DOI:10.1074/jbc.275.7.4545.
[72] LARA-PEZZI E, WINN N, PAUL A, et al.A naturally occurring calcineurin variant inhibits FoxO activity and enhances skeletal muscle regeneration[J].Journal of Cell Biology, 2007, 179(6): 1205-1218.DOI:10.1083/jcb.200704179.
[73] YUAN Y, SHI X E, LIU Y G, et al.FoxO1 regulates muscle fibertype specification and inhibits calcineurin signaling during C2C12 myoblast differentiation[J].Molecular and Cellular Biochemistry,2011, 348(1/2): 77-87.DOI:10.1007/s11010-010-0640-1.