牛肉营养成分多样化,深受消费者的喜爱。但不适当的保存方法往往会加速牛肉的腐败变质[1]。冷冻是一种常见的长期保藏技术,将肉品冷却到冰点以下温度,降低食品的水分活度,减缓化学和酶促反应的发生,从而延长其保质期[2-3]。但在冷冻过程中,肉品以较慢的速率通过最大冰晶形成带(-1~-5 ℃),会使细胞产生大而不均匀的冰晶,从而引起肌肉一系列的物理和化学变化,包括pH值、颜色、持水力、质构、风味、脂质氧化和蛋白质变性[4-5]。营养的损失和品质的下降会降低消费者的接受度。
为了克服这些问题,近年来开发了许多新型冷冻技术,如高压冷冻[6]、超声辅助浸渍冷冻[7]、电场辅助冷冻[8]和磁场(magnetic field,MF)辅助冷冻[9]等。其中MF又可以主要分为静磁场(static magnetic field,SMF)、交变磁场(alternating magnetic field,AMF)、振荡磁场(oscillating magnetic field,OMF)和脉冲磁场。大量研究证实,MF会影响水的性质,包括表面张力、黏度、折射率、介电常数、电导率和氢键结构等[10-11]。因此,MF可以通过影响食物中的水分来影响肉品品质。Gan Sunlong等[9]使用SMF辅助猪肉浸渍冷冻,结果发现,SMF处理提高了猪肉的品质。Wei Heyun等[12]研究AMF对罗非鱼冷冻的影响,结果表明,AMF有助于提高产品质量。虽然MF辅助冷冻在一定程度上可以提高样品质量,但并非所有类型的MF(如不同MF类型、强度)和研究对象都适用。Rodríguez等[13]研究指出,弱OMF辅助冷冻对猪里脊的品质特性并未产生显著影响。Yang Bing等[11]在鲶鱼片的研究中发现,SMF和AMF辅助冷冻虽然缩短了样品的相变时间,但蛋白质结构会受到MF强度的影响。尽管近年来对MF辅助冷冻的研究有所增多,但对于SMF辅助牛背最长肌冷冻的研究,特别是冷冻参数和品质影响方面的研究仍然相对较少。
本研究通过分析不同SMF强度(0、2、4、6、8、10 mT)辅助冷冻对牛背最长肌冷冻参数(总冻结时间和相变时间)、持水力、色泽、pH值、脂质氧化、嫩度及肌原纤维蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamidegel electrophoresis,SDS-PAGE)的影响,旨在为提高冷冻牛肉的品质及SMF辅助冷冻(SMF assisted freezing,SMAF)技术的推广应用提供理论依据。
1 材料与方法
1.1 材料与试剂
从实验室附近的一家商业屠宰场选择6 头健康状况和体质量相近的西门塔尔牛(24 月龄),屠宰后4 ℃排酸24 h,取12 条牛背最长肌,并在1 h内使用便携式保温箱运送至实验室(2~6 ℃)。
2-硫代巴比妥酸(2-thiobarbituric acid,2-TBA)(分析纯) 上海科丰化学试剂有限公司;三氯乙酸(trichloroacetic acid,TCA) 上海易恩化学技术有限公司;pH校准液(pH 4.01、7.00) 上海方畦仪器有限公司;氯化钾、氯化镁、磷酸氢二钾、乙二胺四乙酸(均为分析纯) 天津市鑫桥化工贸易有限公司。
1.2 仪器与设备
BC/BD-318HD海尔冰箱 青岛海尔股份有限公司;YCD-EL260中科美菱医用冷藏冷冻箱 中科美菱低温制冷有限公司;176-P1温湿度记录仪、Testo 205 pH计德图仪器国际贸易有限公司;DP3020直流稳压电源深圳市迈斯泰克电子有限公司;TD8650特斯拉计、XQ-540磁场发生器 绵阳市涪城区力田磁电科技有限公司;CR-400色彩色差计 日本柯尼卡美能达公司;TA-XT Plus质构仪 英国Stable Micro Systems公司。
1.3 方法
1.3.1 样品处理
将12 条牛背最长肌剔除可见的筋膜、脂肪及结缔组织后,切分为42 块(5 cm×4 cm×4 cm,(80±5)g),然后随机分为7 组,立即对新鲜组样品进行质量指标评估。将剩余的样品快速包裹在聚乙烯保鲜膜中,4 ℃稳定2 h后,置于-18 ℃不同磁场强度(0、2、4、6、8、10 mT)下冷冻24 h,并分别标记为对照组、SMAF-2、SMAF-4、SMAF-6、SMAF-8、SMAF-10组(对照组除无SMF处理外,其余操作与SMAF组保持一致)。冷冻结束时,将冷冻样品于(4.0±0.3)℃解冻24 h后进行各项指标的测定。在本次实验中,亥姆霍兹线圈在空间内产生的欧姆热使用温度进行补偿,确保实验组之间无温度差异。整个实验进行4 次,以确保其可重复性。
1.3.2 实验系统
SMAF的设备包括SMF生成系统(连接到直流电源的亥姆霍兹线圈:线圈直径40 cm;平均线圈半径20 cm;电压0~150 V;电流0~15 A)、温度控制系统和温度检测系统,如图1所示。每1 min记录一次样品中心和样品平台的温度。使用特斯拉计测量样品平台上SMF的强度。
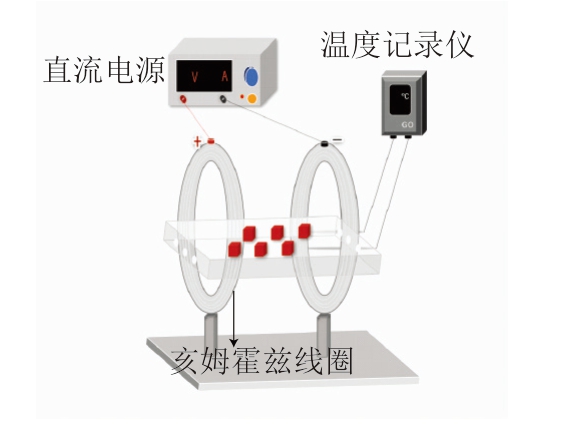
图1 牛肉SMAF装置示意图
Fig.1 Schematic diagram of SMAF device
1.3.3 冻结曲线测定
将探头插入样品几何中心,使用温湿度记录仪记录不同SMAF处理组牛肉样品的冻结过程。
1.3.4 解冻损失率测定
参照Wang Wenxin等[14]的方法进行测定。
1.3.5 蒸煮损失率测定
参照Hu Rui等[15]的方法进行测定,并略作修改。将样品(2 cm×2 cm×2 cm)置于80 ℃水浴中,加热至样品中心温度达到75 ℃后,于室温下冷却1 h。冷却结束后,用吸水纸擦去样品表面的水分后称质量。蒸煮损失率按式(1)计算:
式中:m1为蒸煮前样品质量/g;m2为蒸煮后最终样品质量/g。
1.3.6 离心损失率测定
参照Lin Hengxun等[16]的方法进行测定,并略作修改。将2 g样品用滤纸包裹后离心(2 500 r/min、4 ℃)10 min。离心损失率按式(2)计算:
式中:m3为离心前样品质量/g;m4为离心后样品质量/g。
1.3.7 色泽测定
使用CR-400色彩色差计测定样品的色泽。利用亮度值(L*)、红度值(a*)和黄度值(b*)表征样品色泽变化。在进行测定之前,在常温下使用白色瓷板进行校准(Y=93.5,x=0.311 4,y=0.319 0)。每个样品在6 个不同表面进行测定。总色差(ΔE)参照Wang Wenxin等[14]的方法进行测定,按式(3)计算:
式中:L*0、a*0、b*0为新鲜样品的色泽指标;L*、a*、b*为解冻后样品的色泽指标。
1.3.8 pH值测定
使用便携式pH计测定样品pH值。样品测定前pH计使用pH缓冲液(pH 4.01和7.00)进行校准。将探头插入牛肉样品组织2 cm,待读数稳定后记录。每个样品在不同位置测定2 次。
1.3.9 硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARS)值测定
参照林珩迅[17]的脂质氧化方法进行测定,并略作修改。将10 g样品与20 mL 20 g/100 mL TCA溶液混合并匀浆(8 000 r/min、1 min)。过滤混合物,5 mL滤液和5 mL 0.02 mol/L 2-TBA溶液在沸水浴中孵育20 min。将混合物冷却至室温,并在532 nm波长处测定吸光度,空白处理为5 mL TCA溶液与5 mL 2-TBA溶液混合。TBARS值按式(4)计算:
1.3.10 剪切力测定
参照Yar等[18]的方法进行测定,并略作修改。将样品(3 cm×1 cm×1 cm)放入密封袋后进行水浴加热(80 ℃),直至每个样品的中心温度达到71 ℃,加热后的样品在室温下冷却30 min。使用HDP/BS刀片在质构仪上测定牛肉样品的剪切力。测前、测中和测后速率分别为1.5、1.5、10.0 mm/s。距离25 mm,触发力20 g。
1.3.11 肌原纤维小片化指数(myofibrillar fragmentation index,MFI)测定
参照田园等[19]的方法进行测定,并略作修改。2 g样品加入10 倍体积预冷后的MFI缓冲液(含0.1 mol/L氯化钾、0.02 mol/L磷酸氢二钾、1 mmol/L乙二胺四乙酸、1 mmol/L氯化镁)后,在冰浴上均质30 s,匀浆离心15 min(8 000 r/min、4 ℃),去除上清液;将沉淀物与7.5 倍体积预冷MFI缓冲液混匀后离心15 min(8 000 r/min、4 ℃);最后将沉淀物与2.5 倍体积预冷MFI缓冲液混合均匀后,用纱布过滤,所得滤液使用双缩脲法测定蛋白含量,用MFI缓冲液调整蛋白质量浓度至0.5 mg/mL后,在540 nm波长处测定吸光度,所得吸光度乘以200即为MFI。
1.3.12 SDS-PAGE
参照Lin Hengxun等[16]的方法进行检测。
1.4 数据统计分析
使用Excel 2010软件进行数据录入与整理,Origin 8.5软件绘图。实验数据以4 次平行测定结果的平均值±标准差表示。使用SPSS软件进行单因素方差分析,采用Duncan的多范围检验确定差异显著性(P<0.05)。
2 结果与分析
2.1 SMAF对牛肉冷冻时间的影响
牛肉样品中心温度从4 ℃降至-18 ℃,被视为完成冷冻过程。如图2所示,与对照组相比,SMAF-2、4、6、8、10处理组的冷冻时间分别缩短79.3、47.3、106.0、154.7、92.3 min,SMAF-2、4、6、8、10处理组的相变时间分别缩短15.0、10.0、31.0、51.0、13.7 min,其中与对照组相比,SMAF-6、8、10处理组相变时间分别显著缩短15%、25%和6.7%(P<0.05),SMAF-8处理组的冻结效率最高,这可能是牛背最长肌的特殊冷冻参数。这与Tang Junyan等[20]研究结果一致,适当强度下SMF处理可以节省猪肉的相变时间。SMAF处理节省了样品的冻结时间和相变时间,这可能是由于SMF破坏了自由水分子的氢键,导致小冰晶形成,从而缩短了牛肉的相变时间[15]。相变时间越短,冷冻过程中形成的冰晶越小、越均匀,冷冻过程对样品质量的影响越小[20]。但在本研究中,冻结效率并不随着磁场强度的增加而提高,这与Gan Sunlong等[9]的实验结果一致,样品冷冻效率会因食品的特殊性质和SMF的强度而有所差异。基于磁场强度对样品相变时间的影响,选择有显著性差异的SMAF-6、SMAF-8、SMAF-10处理组进行后续的品质验证实验。
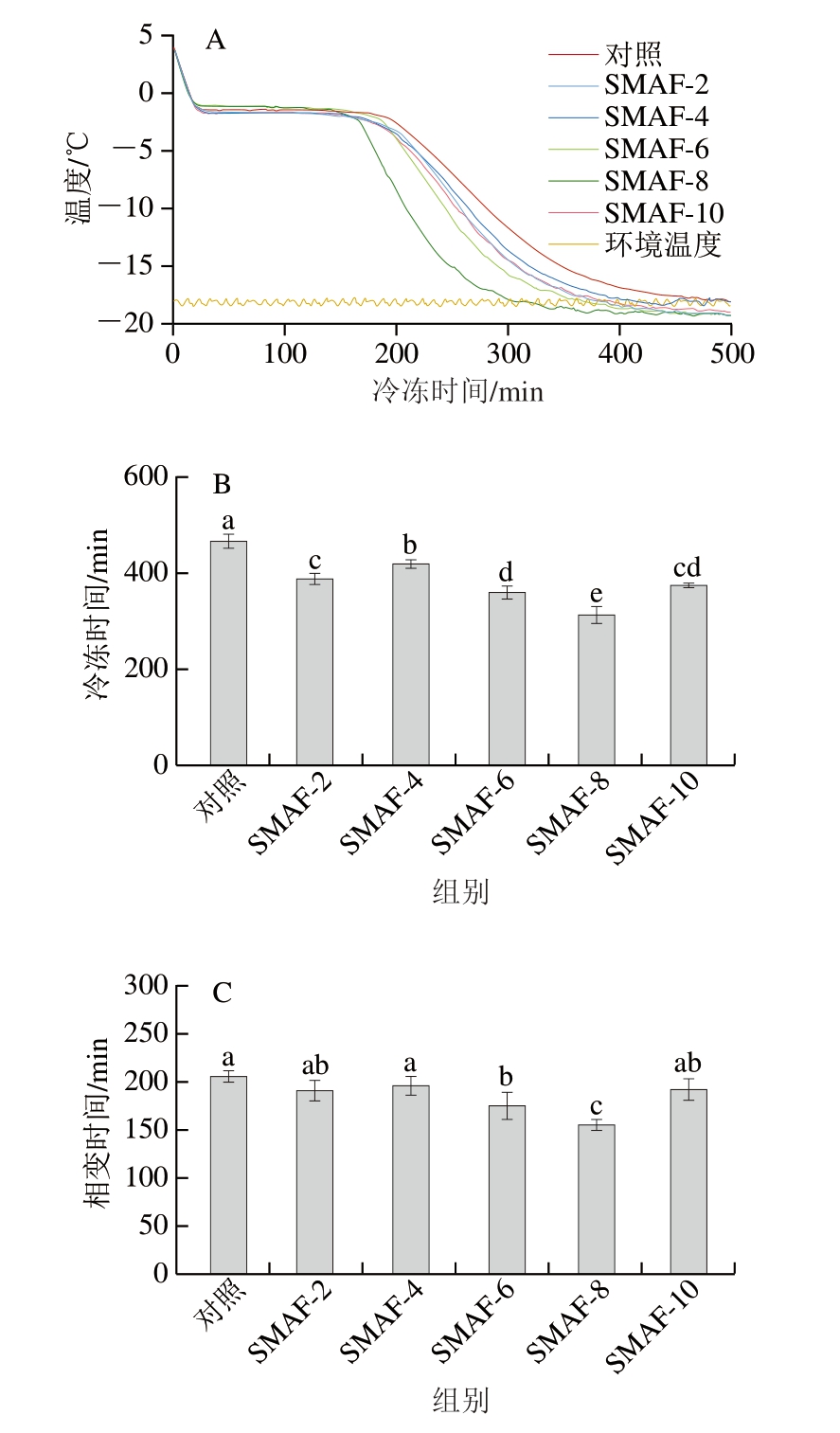
图2 不同SMF强度对牛肉冻结参数的影响(n =4)
Fig.2 Effects of different SMF intensity on freezing parameters of beef (n = 4)
A.温度-时间曲线;B.总冷冻时间;C.相变时间;小写字母不同表示组间差异显著(P<0.05)。图3~9同。
2.2 SMAF对牛肉解冻损失率的影响
牛肉的持水力与解冻后的失水量变化有关,在冷冻过程中产生的冰晶会压迫肌肉组织,从而破坏肌肉纤维,导致汁液渗出[21]。冷冻-解冻后样品的持水能力越小,说明组织结构损伤越大。如图3所示,SMAF-6、8、10处理组的解冻损失率分别为4.91%、4.44%、4.97%。这可能是由于SMAF处理缩短了样品在冷冻过程中通过最大冰晶形成区的时间,提高了冷冻速率,从而降低解冻过程中样品的解冻损失[22]。不同处理组解冻损失率的变化趋势与冷冻曲线上的冷冻时间相对应,这也证实解冻损失的减少与SMAF处理有较快的冷冻速率有关。实验结果表明,适当强度的SMAF处理可以显著降低牛肉样品的解冻损失率(P<0.05),其中SMAF-8处理组的解冻损失率最低,与其相变时间最短结果一致。
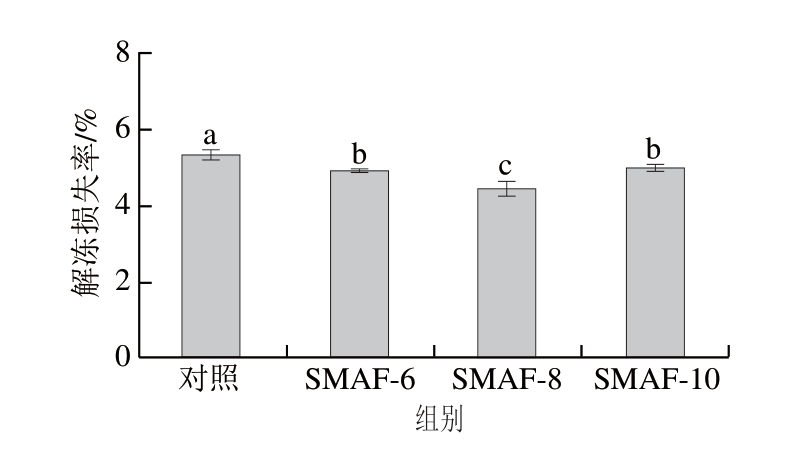
图3 SMAF对牛肉解冻损失率的影响(n=4)
Fig.3 Effect of SMAF on the thawing loss of beef (n = 4)
2.3 SMAF对牛肉蒸煮损失率的影响
蒸煮损失率是与牛肉样品的持水能力相关的参数。蒸煮损失率主要是热诱导的肌原纤维蛋白变性导致肌肉结构受损所致[23]。冷冻会导致样品的蒸煮损失率增加,如图4所示,所有样品组的蒸煮损失率均比新鲜组高,这可能是因为在冷冻过程中冰晶成核破坏了蛋白质网络,影响蛋白质网络与水分子的结合[24]。SMAF处理组的蒸煮损失率显著低于对照组(P<0.05),这是由于适当的MF强度减小了自由水团簇的尺寸,增加结合水含量,提高了蛋白质结构的稳定性[25]。此外,SMAF-6与SMAF-10处理组之间无显著差异,而SMAF-8处理组的蒸煮损失率显著低于对照组、SMAF-6和SMAF-10处理组。这与SMAF-8组冷冻时间较短有关,较快的冷冻速率产生更小的冰晶,对细胞结构的损害更小[26],与解冻损失的变化趋势相一致。实验结果表明,SMAF处理可以显著降低牛肉的蒸煮损失率(P<0.05),其中SMAF-8处理组的蒸煮损失率最低。
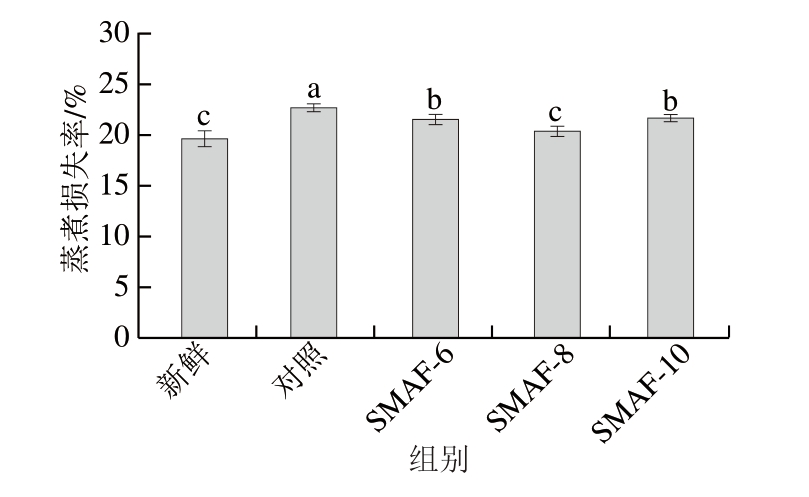
图4 SMAF对牛肉蒸煮损失率的影响(n=4)
Fig.4 Effect of SMAF on the cooking loss of beef (n = 4)
2.4 SMAF对牛肉离心损失率的影响
离心损失率反映肉类样品在受到外力作用时与水的结合能力[27]。离心损失率越大,牛肉样品的持水力降低越多,肉质越差[28]。如图5所示,与新鲜样品相比,冷冻-解冻后牛肉样品离心损失率有不同程度的增加。SMAF-6、SMAF-8、SMAF-10处理组样品的离心损失率均低于对照组,这表明SMAF处理可以显著降低牛肉样品的离心损失率(P<0.05)。这与SMAF处理组表现出较低的解冻损失和蒸煮损失的现象相一致。SMAF处理缩短了样品在冷冻过程中最大冰晶形成区的时间,提高了冷冻速率,有利于维持样品的持水力。Liu Fan等[29]的研究也证实SMAF可有效提高肉品的保水性。
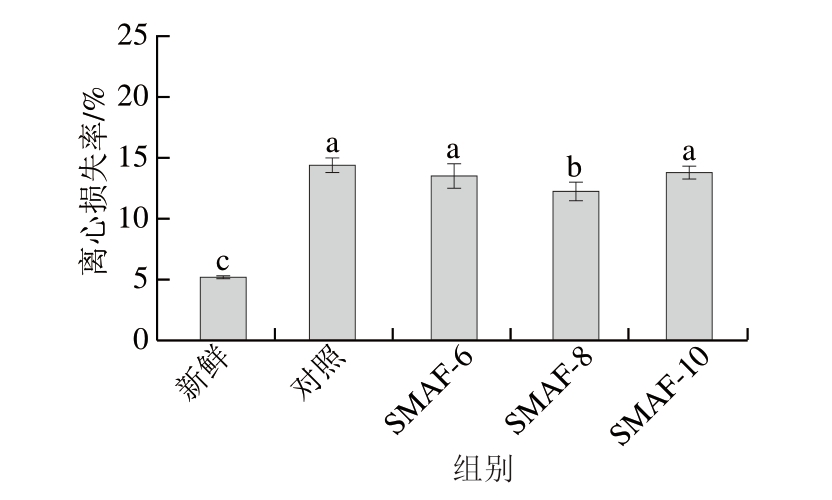
图5 SMAF对牛肉离心损失率的影响(n=4)
Fig.5 Effect of SMAF on the centrifugal loss of beef (n = 4)
2.5 SMAF对牛肉色泽的影响
肉品的色泽作为判断肉类新鲜度的重要指标,直接影响消费者的接受度[30]。如表1所示,与新鲜牛肉相比,冷冻-解冻后牛肉样品的L*和a*减小,但b*增加。SMAF-6和SMAF-8处理组样品的a*显著高于对照组(P<0.05)。这可能是由于SMF辅助样品冷冻时形成了较小的冰晶,减少了因冰晶损伤导致的肌红蛋白和血红素的释放,从而抑制了a*的下降[15],但不同处理之间的L*和b*无显著性差异(P>0.05)。ΔE表示与新鲜样品相比,不同处理组样品的颜色变化程度。ΔE测定结果表明,SMAF各处理组之间无显著性差异,而SMAF处理组均显著小于对照组,其中SMAF-8处理显示出最小的ΔE。因此SMAF处理可维持牛肉色泽的稳定性,其中SMAF-8对样品颜色的影响最小,与新鲜样品更相似。
表1 SMAF对牛肉色泽的影响
Table 1 Effect of SMAF on beef color

注:同行小写字母不同表示组间差异显著(P<0.05)。
色泽新鲜组对照组SMAF-6组SMAF-8组SMAF-10组L*39.96±0.79a37.79±0.85b38.32±0.51b38.43±1.19b38.07±0.64b a*21.21±1.52a18.41±1.16b20.56±0.92a20.55±0.88a20.11±0.93b b*7.97±0.91a8.58±1.40a8.34±0.38a8.39±0.45a8.44±0.74a ΔE4.25±0.92a1.98±0.50b1.86±1.07b2.45±0.54b
2.6 SMAF对牛肉pH值的影响
牛肉样品pH值的变化与肌糖原的无氧酵解和ATP的分解和脂质氧化密切相关[27]。如图6所示,与新鲜样品相比,冷冻-解冻后的样品pH值显著下降(P<0.05)。这可能是由于肌糖原和ATP分解产生的乳酸和无机磷酸盐造成的pH值下降[23]。对照组、SMAF-6组、SMAF-8组和SMAF-10组的pH值分别为5.85、5.83、5.88和5.84,SMAF处理组的pH值较高,其中SMAF-8处理组的pH值最高,且最接近新鲜样品,但与对照组无显著差异(P>0.05)。实验结果表明,SMAF处理对维持肉样的pH值无显著影响,可能是SMAF处理对减缓肌糖原和ATP分解的作用微弱,具体原因还需进一步研究。
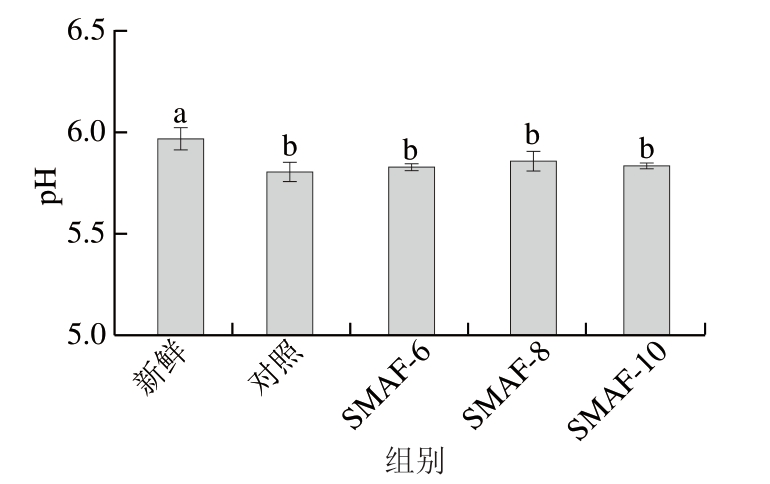
图6 SMAF对牛肉pH值的影响(n=4)
Fig.6 Effect of SMAF on the pH of beef (n = 4)
2.7 SMAF对牛肉脂质氧化的影响
TBARS值是反映肉品脂质氧化的主要指标之一[31]。脂质氧化可促进蛋白质氧化,从而改变蛋白质的结构和功能特性[32]。在冷冻过程中,冰晶的生长会破坏肌肉细胞的完整性,导致氧化剂的释放,尤其是非血红素铁,因此加速了氧化反应[14]。如图7所示,与新鲜样品相比,冷冻-解冻后牛肉样品的TBARS值均显著增加(P<0.05),这表明样品发生了脂质氧化。对照组、SMAF-6、SMAF-8和SMAF-10处理组的TBARS值分别为0.151 9、0.142 0、0.140 1、0.145 4 mg/kg,对照组的TBARS值高于SMAF组,其中SMAF-8处理组的TBARS值最低,但各处理组之间无显著差异(P>0.05)。实验结果表明,SMAF处理对减缓牛肉的脂肪氧化速率没有显著影响,这可能与样品在-18 ℃下的冷冻时间较短有关。
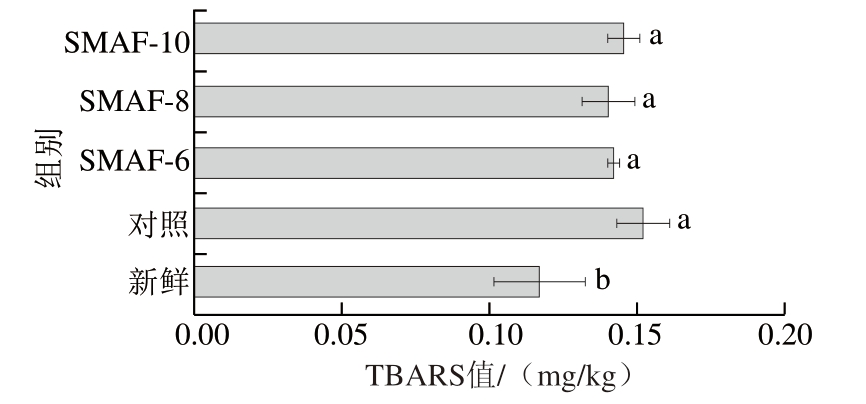
图7 SMAF对牛肉TBARS值的影响(n=4)
Fig.7 Effect of SMAF on the TBARS value of beef (n = 4)
2.8 SMAF对牛肉剪切力的影响
如图8所示,牛肉样品经过冷冻-解冻后,剪切力显著下降(P<0.05)。样品剪切力的下降是由于蛋白质分解过程中酶促作用对肌肉纤维的分解、老化及冰晶形成导致的组织结构完整性丧失的综合结果。牛肉样品的剪切力在新鲜组中最高,在对照组中最低。SMAF-8处理组的剪切力高于SMAF-6和SMAF-10处理组,其中SMAF-6与SMAF-10组无显著差异(P>0.05)。在冷冻过程中,施加SMF处理能够降低细胞外大冰晶的形成对肌肉物理结构的破坏,从而减弱肌纤维的断裂,保持肌肉的质地和口感[22,33]。无磁场处理组在冷冻过程中可能对肌肉组织破坏程度较大,而不同SMAF处理组对样品剪切力的影响差异主要与冷冻时间和相变时间相关。这表明SMAF处理可显著抑制牛肉硬度的降低,这也与SMAF处理组的冻结速率显著高于对照组的结果一致。

图8 SMAF对牛肉剪切力的影响(n=4)
Fig.8 Effect of SMAF on the shear force of beef (n = 4)
2.9 SMAF对牛肉MFI的影响
MFI可以用于表征肌原纤维小片化程度,MFI越大说明肌原纤维蛋白降解程度越大,肌肉嫩度较高[34]。如图9所示,冷冻-解冻后样品的MFI高于新鲜样品,这是由于样品在冷冻过程中形成的冰晶破坏肌原纤维结构,导致解冻后样品MFI增加。与对照组相比,SMAF处理组的MFI减小,说明SMAF处理可能促进了均匀分布的小冰晶形成,从而维持了肌原纤维的完整性。SMAF-6与SMAF-10处理组的MFI无显著差异(P>0.05),但均显著高于SMAF-8处理组(P<0.05)。SMAF-8处理组的MFI最接近新鲜样品的MFI。这表明在冻结过程中,SMAF处理可能减少了大尺寸冰晶的形成,减轻了肌原纤维结构的损伤程度,从而抑制了MFI的增加,这进一步验证了剪切力的结果。
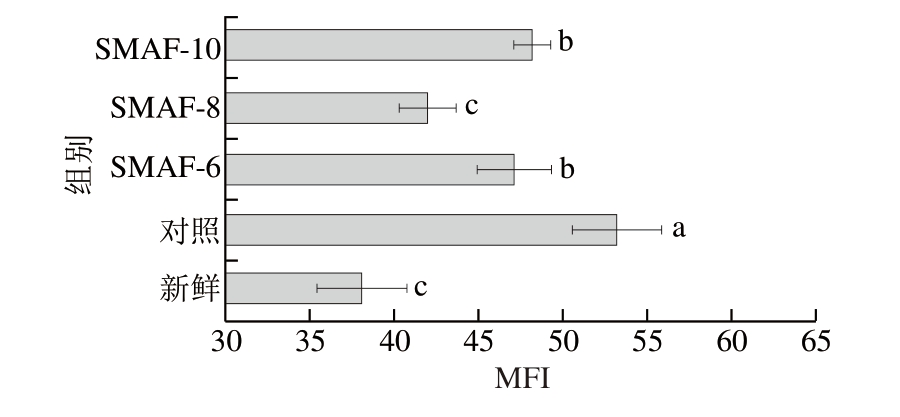
图9 SMAF对牛肉MFI的影响(n=4)
Fig.9 Effect of SMAF on MFI of beef (n = 4)
2.10 SMAF对牛肉蛋白SDS-PAGE图谱的影响
如图10所示,肌球蛋白重链(245 kDa)和肌动蛋白链(43 kDa)是肌原纤维蛋白的主要条带。在冻融循环过程中,蛋白质的分子质量随着冻融循环的增加而变化[35]。同时,蛋白质交联和聚集会导致重分子链的形成,而重分子链又可以降解为轻分子链[36]。本研究SDSPAGE图中所有处理组均没有条带消失和新条带出现,说明蛋白质的一级结构和共价键没有断裂[37]。SMAF处理组与对照组之间的SDS-PAGE条带无差异,这可能与样品冷冻和解冻时间短以及冻融次数只有1 次有关。在一些研究中也观察到了类似的结果[11,36,38]。但经过冷冻-解冻后,对照组的蛋白质条带强度有所降低,说明对照组的蛋白质含量降低,而SMAF处理组的蛋白质条带强度高于对照组。SDS-PAGE结果表明,SMAF处理可以减少蛋白质含量的降低,但与Yang Bing等[11]研究结果不同,可能与SMF强度和样品类型不同有关。
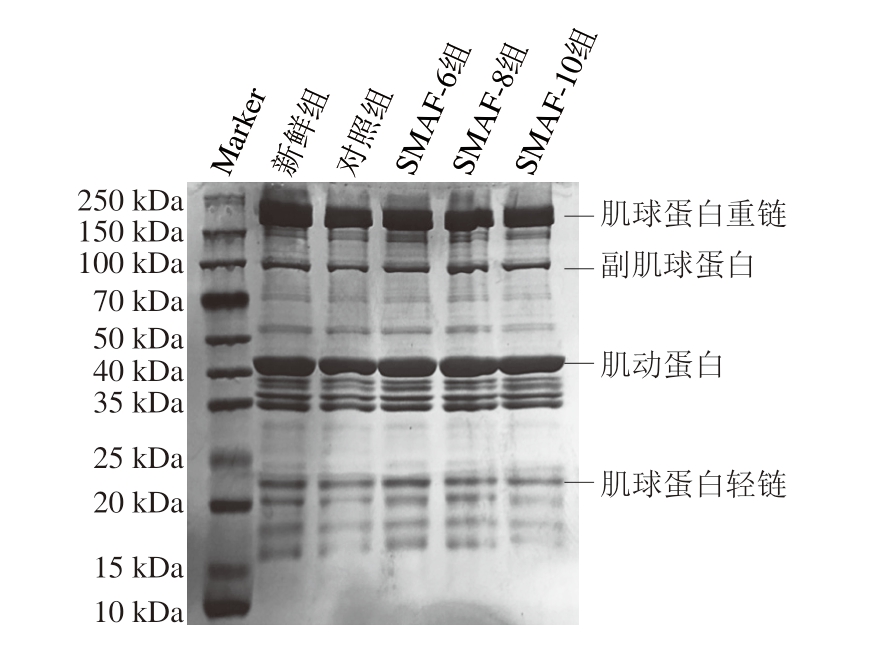
图10 不同SMAF处理组肌原纤维蛋白的SDS-PAGE图谱
Fig.10 SDS-PAGE patterns of myofibrillar proteins in different SMAF treatment groups
3 结 论
不同SMF强度辅助冷冻会对牛肉品质产生不同程度的影响,本研究分析SMAF(0、2、4、6、8、10 mT)处理对牛肉冷冻参数和品质的影响。结果表明:与对照组相比,SMAF-6、8、10处理可以显著缩短牛肉的相变时间,有效抑制牛肉色泽劣变和剪切力的降低,但对抑制牛肉pH值的降低和TBARS值的升高无显著影响;此外,SMAF处理增强了牛肉的持水力,抑制了蛋白质含量的降低,但影响效果并未随磁场强度的增加而变得更显著,其中SMAF-8处理组的效果最好。综上所述,SMAF处理可以通过缩短牛肉的相变时间加速冻结过程,进而提升其持水力并改善其品质。因此,SMAF技术在牛肉等肉类冻藏中具有巨大的应用潜力。但仍需要进一步的研究揭示SMAF对牛肉品质及其蛋白质结构的影响机制。
[1] ZHAN X M, SUN D W, ZHU Z W, et al.Improving the quality and safety of frozen muscle foods by emerging freezing technologies:a review[J].Critical Reviews in Food Science and Nutrition, 2018,58(17): 2925-2938.DOI:10.1080/10408398.2017.1345854.
[2] HASANI A, KOKTHI E, ZOTO O, et al.Analyzing consumer perception on quality and safety of frozen foods in emerging economies: evidence from Albania and Kosovo[J].Foods, 2022, 11(9):1247.DOI:10.3390/foods11091247.
[3] CHENG L N, SUN D W, ZHU Z W, et al.Emerging techniques for assisting and accelerating food freezing processes: a review of recent research progresses[J].Critical Reviews in Food Science and Nutrition,2017, 57(4): 769-781.DOI:10.1080/10408398.2015.1004569.
[4] 桑燕菲.小龙虾冷冻贮藏期间虾肉品质变化及蛋白变性机理[D].合肥: 合肥工业大学, 2022: 1-5.
[5] KIANI H, ZHANG Z H, DELGADO A, et al.Ultrasound assisted nucleation of some liquid and solid model foods during freezing[J].Food Research International, 2011, 44(9): 2915-2921.DOI:10.1016/j.foodres.2011.06.051.
[6] FERNáNDEZ P P, SANZ P D, MOLINA-GARCÍA A D, et al.Conventional freezing plus high pressure-low temperature treatment:Physical properties, microbial quality and storage stability of beef meat[J].Meat Science, 2007, 77(4): 616-625.DOI:10.1016/j.meatsci.2007.05.014.
[7] ZHANG M C, NIU H L, CHEN Q, et al.Influence of ultrasoundassisted immersion freezing on the freezing rate and quality of porcine longissimus muscles[J].Meat Science, 2018, 136: 1-8.DOI:10.1016/j.meatsci.2017.10.005.
[8] WANG Q J, DONGA Q X, WANG L S, et al.Quality attributes of pork tenderloin frozen under different high voltage electric fields with ultrahigh permittivity ceramic-enhanced electrodes[J].LWTFood Science and Technology, 2023, 184: 114989.DOI:10.1016/j.lwt.2023.114989.
[9] GAN S L, ZHANG M, JIANG Q Y.Pork freezing and quality improvement: the effect of immersion freezing assisted by magnetic field[J].Food and Bioprocess Technology, 2024, 17(1): 73-82.DOI:10.1007/s11947-023-03121-1.
[10] ZHAN X M, ZHU Z W, SUN D W.Effects of extremely low frequency electromagnetic field on the freezing processes of two liquid systems[J].LWT-Food Science and Technology, 2019, 103: 212-221.DOI:10.1016/j.lwt.2018.12.079.
[11] YANG B, YANG L, XU R H, et al.Effects of static magnetic field(SMF) and alternating magnetic field (AMF) assisted freezing on the microstructure and protein properties of channel catfish (Ictalurus punctatus) fillet[J].Food Chemistry, 2024, 434: 137509.DOI:10.1016/j.foodchem.2023.137509.
[12] WEI H Y, LUO K X, FU R H, et al.Impact of the magnetic fieldassisted freezing on the moisture content, water migration degree,microstructure, fractal dimension, and the quality of the frozen tilapia[J].Food Science and Nutrition, 2022, 10(1): 122-132.DOI:10.1002/fsn3.2653.
[13] RODRÍGUEZ A C, JAMES C, JAMES S J.Effects of weak oscillating magnetic fields on the freezing of pork loin[J].Food and Bioprocess Technology, 2017, 10(9): 1615-1621.DOI:10.1007/s11947-017-1931-2.
[14] WANG W X, LIN H X, GUAN W Q, et al.Effect of static magnetic field-assisted thawing on the quality, water status, and myofibrillar protein characteristics of frozen beef steaks[J].Food Chemistry, 2024,436: 137709.DOI:10.1016/j.foodchem.2023.137709.
[15] HU R, ZHANG M, MUJUMDAR A S.Novel assistive technologies for efficient freezing of pork based on high voltage electric field and static magnetic field: a comparative study[J].Innovative Food Science and Emerging Technologies, 2022, 80: 103087.DOI:10.1016/j.ifset.2022.103087.
[16] LIN H X, HE X X, LIU C H, et al.Static magnetic field-assisted supercooling preservation enhances water-holding capacity of beef during subzero storage[J].Innovative Food Science and Emerging Technologies, 2022, 80: 103106.DOI:10.1016/j.ifset.2022.103106.
[17] 林珩迅.静磁场辅助超冰温贮藏对牛肉品质的影响[D].天津: 天津商业大学, 2021: 16.
[18] YAR M K, JASPAL M H, ALI S, et al.Physicochemical, shear force and sensory characteristics of PUFA-tenderising solution injected restructured blade and brisket beef steaks during ageing[J].International Journal of Food Science and Technology, 2023, 58(6):3273-3284.DOI:10.1111/ijfs.16152.
[19] 田园, 孙志昶, 余群力, 等.低压电刺激对牦牛肉宰后成熟过程中嫩度及肌纤维超微结构的影响[J].食品科学, 2014, 35(7): 43-47.DOI:10.7506/spkx1002-6630-201407009.
[20] TANG J Y, SHAO S Q, TIAN C Q.Effects of the magnetic field on the freezing parameters of the pork[J].International Journal of Refrigeration, 2019, 107: 31-38.DOI:10.1016/j.ijrefrig.2019.07.019.
[21] WEI H Y, FU R H, LIN X D, et al.Effect of magnetic field-assisted freezing on water migration, fractal dimension, texture, and other quality changes in tilapia[J].Journal of Food Processing and Preservation, 2021, 45(11): e15940.DOI:10.1111/jfpp.15940.
[22] RUAN J W, WANG H Q, ZHAO J P, et al.Effect of magnetic field on frozen food quality characteristics[J].Food Engineering Reviews,2024(5): 1-26.DOI:10.1007/s12393-024-09366-6.
[23] SUN Q X, SUN F D, XIA X F, et al.The comparison of ultrasoundassisted immersion freezing, air freezing and immersion freezing on the muscle quality and physicochemical properties of common carp (Cyprinus carpio) during freezing storage[J].Ultrasonics Sonochemistry, 2019, 51: 281-291.DOI:10.1016/j.ultsonch.2018.10.006.
[24] LIANG Y, QU Z T, LIU M, et al.Further interpretation of the strengthening effect of curdlan on frozen cooked noodles quality during frozen storage: studies on water state and properties[J].Journal of Cereal Science, 2020, 95: 128908.DOI:10.1016/j.foodchem.2020.128908.
[25] SUN Q X, ZHANG H H, YANG X Q, et al.Insight into muscle quality of white shrimp (Litopenaeus vannamei) frozen with static magneticassisted freezing at different intensities[J].Food Chemistry: X, 2023,17: 100518.DOI:10.1016/j.fochx.2022.100518.
[26] CHOI E J, PARK H W, CHUNG Y B, et al.Effect of tempering methods on quality changes of pork loin frozen by cryogenic immersion[J].Meat Science, 2017, 124: 69-76.DOI:10.1016/j.meatsci.2016.11.003.
[27] HU R, ZHANG M, FANG Z.A novel synergistic freezing assisted by infrared pre-dehydration combined with magnetic field: effect on freezing efficiency and thawed product qualities of beef[J].Food and Bioprocess Technology, 2022, 15(6): 1392-1405.DOI:10.1007/s11947-022-02825-0.
[28] JHA P K, VIDOT K, XANTHAKIS E, et al.Benchmarking of techniques used to assess the freeze damage in potatoes[J].Journal of Food Engineering, 2019, 262: 60-74.DOI:10.1016/j.jfoodeng.2019.05.008.
[29] LIU F, YANG N, ZHANG L T, et al.Effect of weak magnetic field on the water-holding properties, texture, and volatile compounds of pork and beef during frozen storage[J].Food Bioscience, 2023, 53: 102667.DOI:10.1016/j.fbio.2023.102667.
[30] GUO Z L, GE X Z, YANG L H, et al.Ultrasound-assisted thawing of frozen white yak meat: effects on thawing rate, meat quality, nutrients,and microstructure[J].Ultrasonics Sonochemistry, 2021, 70: 105345.DOI:10.1016/j.ultsonch.2020.105345.
[31] TURGUT S S, ISIKSI F, SOYER A.Antioxidant activity of pomegranate peel extract on lipid and protein oxidation in beef meatballs during frozen storage[J].Meat Science, 2017, 129: 111-119.DOI:10.1016/j.meatsci.2017.02.019.
[32] CAO J X, ZHOU C Y, WANG Y, et al.The effect of oxidation on the structure of G-actin and its binding ability with aroma compounds in carp grass skeletal muscle[J].Food Chemistry, 2018, 240: 346-353.DOI:10.1016/j.foodchem.2017.07.068.
[33] LEYGONIE C, BRITZ T J, HOFFMAN L C.Impact of freezing and thawing on the quality of meat: review[J].Meat Science, 2012, 91(2):93-98.DOI:10.1016/j.meatsci.2012.01.013.
[34] 张莉.不同宰后成熟、冷冻及解冻方式对哈萨克羊肉品质的影响[D].乌鲁木齐: 新疆农业大学, 2023: 22-23.
[35] ALI S, ZHANG W G, RAJPUT N, et al.Effect of multiple freeze-thaw cycles on the quality of chicken breast meat[J].Food Chemistry, 2015,173: 808-814.DOI:10.1016/j.foodchem.2014.09.095.
[36] LI D N, ZHAO H H, MUHAMMAD A I, et al.The comparison of ultrasound-assisted thawing, air thawing and water immersion thawing on the quality of slow/fast freezing bighead carp (Aristichthys nobilis) fillets[J].Food Chemistry, 2020, 320: 126614.DOI:10.1016/j.foodchem.2020.126614.
[37] ZHANG Z Y, YANG Y L, ZHOU P, et al.Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J].Food Chemistry, 2017, 217: 678-686.DOI:10.1016/j.foodchem.2016.09.040.
[38] KONG D W, HAN R W, YUAN M D, et al.Ultrasound combined with slightly acidic electrolyzed water thawing of mutton:effects on physicochemical properties, oxidation and structure of myofibrillar protein[J].Ultrasonics Sonochemistry, 2023, 93: 106309.DOI:10.1016/j.ultsonch.2023.106309.