牛肉味道鲜美、营养丰富,含有较高含量的维生素、肌氨酸、铁及较低含量的脂肪和胆固醇,是人们生活中补充蛋白质的重要来源[1-2]。牛肉在贮藏与运输过程中极易受到微生物的污染[3-4],如假单胞菌[5]、肠杆菌[6]、乳酸杆菌[7]及热链球菌等[8]。这些菌株通过加速蛋白质和脂肪的降解,使牛肉产生黏液、异味及质构特性变化,并且菌株会释放有害毒素,引发心脏、肺部、神经系统或胃肠道炎症[9-10]。因此,抑制牛肉在运输或加工过程中的腐败已成为研究人员日益关注的重点[11]。
荧光假单胞菌(Pseudomonas fluorescens)是一种常见的革兰氏阴性细菌,属于假单胞菌属[12]。它具有强大的氧化能力,能够在低温下利用多种有机化合物和无机物进行代谢,被公认为食品基质微生物区系中最主要的腐败细菌之一[13]。此外,荧光假单胞菌能够产生多种酶类,包括蛋白酶、脂肪酶和淀粉酶等,以利用周围环境中的营养物质[14]。假单胞菌属已被证明是造成生鲜肉类变质的主要菌种[15-17],具有较强的蛋白和脂质水解能力,容易导致肉类食品产生黏液并散发难闻气味,从而降低肉品质量、造成资源浪费和经济损失[18]。因此,荧光假单胞菌对食品的污染以及对食品加工环境的危害需要进一步的研究和控制。
随着抗生素滥用导致的耐药性问题日益严重,人们对天然提取物作为抗菌剂的研究日益深入。天然提取物是从植物、微生物、海洋生物等自然来源提取具有生物活性的化合物,具有广泛的生物活性和较低的毒副作用。在抑菌领域,天然提取物展现出显著潜力,为抗菌新药的发展提供了新思路[19-21]。这些化合物具有不同的生物活性,能够干扰细菌的代谢、膜结构和DNA复制,从而达到抑菌效果[22]。王雅莹[23]研究发现,香芹酚对荧光假单胞菌的最小抑菌浓度(minimum inhibitory concentration,MIC)为1.6 mmol/L,可以显著抑制荧光假单胞菌的生物被膜生成、多糖产生、黏附性及运动性。Lan Weiqing等[24]研究显示,壳聚糖-咖啡酸接枝共聚物以1.25 mg/mL(MIC)抑制了荧光假单胞菌的生长,通过破坏菌体细胞、细胞膜、抑制菌体运动并破坏细菌DNA,从而阻碍荧光假单胞菌正常生长繁殖。然而,这些天然抑制剂都需要较大的抑制浓度才能达到对荧光假单胞菌较好的抑菌效果。因此,研究能够提高抑菌效率的天然抑菌剂,可以提高其在食品工业中的潜在应用。
异硫氰酸苄酯(benzyl isothiocyanate,BITC)是由芥子酶介导的硫代葡萄糖苷的主要次级代谢物,通过启动硫代葡萄糖苷水解酶作为抵抗病原体的防御系统,以硫代葡萄糖苷的形式广泛存在于豆瓣菜、卷心菜、花椰菜、甘蓝和西兰花等十字花科植物中[25-26]。其分子结构中含有异硫氰基和苄酯基,这2 种基团赋予BITC抗菌特性[27]。BITC对单核细胞增生李斯特氏菌[28]、金黄色葡萄球菌[29]、大肠杆菌[30]和副溶血性弧菌[31]具有良好的抑菌效果。此外,Wu Hongyan等[32]研究发现,含有BITC的复合膜对牛肉具有良好的保护效果;Huang Yue等[33]研究证明,添加BITC的天然复合膜包裹处理后,对金黄色葡萄球菌和单核细胞增生李斯特氏菌在鸡肉表面的增殖具有持续抑制作用;Li Zhaolun等[34]研究结果同样证明BITC减缓了鸡肉中微生物的生长,对鸡肉中的细菌具有较好的抑制作用。BITC作为可使用的食品添加剂(GB 2769—2014《食品添加剂使用标准》),对大多数致病菌具有抑制作用,但鲜有其对荧光假单胞菌抑制效果以及直接对冷鲜牛肉抑菌保鲜的相关研究与报道,因而BITC作为一种具有多种生物活性的天然化合物,在食品工业中具有广泛的应用前景。
本研究以不同浓度的BITC作为保鲜抑制剂,通过牛津杯实验探究BITC对荧光假单胞菌的MIC。通过细胞形态和代谢活力探明不同浓度BITC对荧光假单胞菌活性的影响。此外,将BITC应用于牛肉中,通过菌落总数、色差、pH值、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、电子鼻测定及感官评定,研究BITC对被荧光假单胞菌侵染的牛肉品质特性的影响。
1 材料与方法
1.1 材料与试剂
牛上脑 大连市华润万家超市;荧光假单胞菌ATCC 13525 中国工业微生物菌种保藏管理中心。
BITC(分析纯,纯度98%) 美国Sigma公司;二甲基亚砜(dimethyl sulfoxide,DMSO,分析纯)天津大茂化学试剂厂;氯化钠 北京宝希迪科技有限公司;LB肉汤、琼脂粉、磷酸缓冲盐溶液(phosphate buffered saline,PBS)、甲醛、无菌采样袋 山东海博生物公司;磷钨酸负染色液(2%,pH 7.0) 北京雷根生物技术有限公司。
1.2 仪器与设备
GN1324型电子天平 上海民桥精密科学仪器有限公司;DGG-9140A型高压灭菌锅 上海森信实验仪器有限公司;ZHWY-100B型恒温培养振荡器、ZHJH-C1112C型超净工作台 上海智城分析仪器制造有限公司;DDS-11A型电热恒温鼓风干燥箱 海尔集团股份有限公司;SpectraMax M2型全波长酶标仪 美国MD仪器公司;JEM-2100型透射电子显微镜(transmission electron microscopy,TEM) 日本东京电子公司;T50型匀浆机 德国IKA公司;HZP-L502型pH计 华志(福建)电子科技限公司;K9840型自动凯氏定氮仪海能未来技术集团股份有限公司;DS-700D型分光测色仪深圳市金准仪器设备有限公司;PEN3型电子鼻 埃尔森斯(北京)科技有限公司。
1.3 方法
1.3.1 样品处理
BITC储备液制备:吸取适量BITC原液,用适量的DMSO溶解至1 mol/L。
无菌生理盐水制备:称取0.85 g氯化钠于100 mL去离子水中,121 ℃高压蒸汽灭菌处理后,置于4 ℃保存备用。
无菌牛肉制备:将超市采购的现杀牛肉在超净工作台中使用无菌水清洗表面,紫外照射1 h。随后,使用灭菌处理的剪刀将鲜牛肉剪切成3 g的方形肉块,并装进带压条的无菌采样袋(12 cm×18 cm)中密封备用。荧光假单胞菌培养至稳定期,使用无菌生理盐水将菌液稀释至104 CFU/mL,与BITC储备液(终浓度为1/2 MIC和MIC)混合,对照组加入生理盐水,吸取1 mL混合液加入无菌采样袋中的牛肉上,通过匀浆机(3 000 r/min、3 min)使混合液与牛肉充分接触。对照组、MIC处理组和1/2 MIC处理组均制备3 份样品,每份为7 d所需的样品量(21 块牛肉)。一份肉块与无菌生理盐水1∶9(V/V)稀释后均质,吸取上清液涂板用于测定菌落总数;一份用于色差、电子鼻及pH值测定;一份用于TVB-N含量测定。每一样品设置3 个平行。将制备好的样品置于4 ℃培养7 d,每隔1 d进行菌落总数、pH值、色差、TVB-N含量、电子鼻测定和感官评价,结合各项检测指标以评价冷藏期间牛肉的新鲜度变化。
1.3.2 菌种活化及培养
1.3.2.1 菌种活化
使用接种环蘸取-80 ℃保存的荧光假单胞菌于LB琼脂平板上划线,30 ℃培养24 h。挑取荧光假单胞菌单菌落加入100 mL LB液体培养基中,30 ℃、150 r/min摇床培养24 h。重复上述活化步骤2 次,将培养好的单菌落平板于4 ℃保存备用。
1.3.2.2 菌种培养
无菌环境中,使用接种环挑取荧光假单胞菌单菌落加入100 mL LB液体培养基中培养,30 ℃、150 r/min摇床培养24 h。
1.3.3 BITC对荧光假单胞菌抑制效果研究
1.3.3.1 牛津杯实验
参照赵玉明等[35]牛津杯实验法测定BITC对荧光假单胞菌的MIC。菌株在30 ℃过夜培养,用无菌生理盐水稀释至104 CFU/mL用于检测。无菌LB固体培养基倒入已灭菌的玻璃皿中,牛津杯打孔,凝固后将配制好的菌悬液涂布,在孔中加入70 μL稀释至不同终浓度的BITC(0、0.03、0.06、0.13、0.25、0.50 mmol/L),30 ℃培养24 h后观察荧光假单胞菌生长情况,以无菌落生长的BITC浓度作为MIC。
1.3.3.2 菌体形态观察
根据Shu Huizhen等[36]的研究稍加改动。荧光假单胞菌在LB培养基中生长至对数期,通过0、1/2 MIC和MIC的BITC处理,并在30 ℃培养12 h。取一滴细菌悬浮液漂浮在铜网格上5 min,使用磷钨酸染色法进行染色。在TEM上采集图像,观察细菌形态。
1.3.3.3 代谢活力测定
荧光假单胞菌培养至稳定期,使用PBS清洗菌体。处理过的菌悬液与BITC(0、1/2 MIC和MIC)于30 ℃培养3、12 h。培养结束后,12 000×g离心2 min,无菌PBS清洗菌体。使用甲醇-水溶液(1∶1,V/V)配制0.01 mol/L碘硝基氯化四氮唑蓝(iodonitrotetrazolium chloride,INT)溶液,INT溶液与菌悬液1∶9(V/V)混合,30 ℃条件下培养30 min,测定630 nm波长处的光密度(optical density,OD)[37]。
1.3.4 BITC对牛肉的保鲜效果研究
1.3.4.1 菌落总数测定
参照GB 4789.2—2022《食品微生物学检验 菌落总数测定》,处理后的菌液涂布在LB固体培养基上进行菌落总数测定。
1.3.4.2 色差测定
将样品用滤纸吸干多余液体,使用分光测色仪测定牛肉的色泽,测量前仪器用黑色和白色标准板校准,每个牛肉样品至少测定3 个不同的区域。色差值(ΔE)按下式计算[38]:
式中:ΔL*表示所测亮度值(L*)与初始L*之差;Δa*表示所测红度值(a*)与初始a*之差;Δb*表示所测黄度值(b*)与初始b*之差。
1.3.4.3 pH值测定
参照GB 5009.237—2016《食品pH值的测定》。
1.3.4.4 TVB-N含量测定
参照GB 5009.228—2016《食品中挥发性盐基氮的测定》。
1.3.4.5 电子鼻测定
电子鼻是可以检测复杂气味的电化学传感器系统,包含10 种传感器,不同传感器对不同类型气味具有不同的敏感程度,具体描述见表1[39]。将样品绞碎,静置30 min后进行电子鼻检测。
表1 电子鼻各传感器敏感物质描述
Table 1 Performance description of electronic nose sensors

传感器名称性能描述W1C对芳香族化合物灵敏W5S对氮氧化合物灵敏W3C对氨和芳香族化合物灵敏W6S对氢气灵敏W5C对烯烃和芳香族化合物灵敏W1S对碳氢化合物灵敏W1W对硫化氢灵敏W2S对醇类和部分芳香族化合物灵敏W2W对有机硫化物和芳香族化合物灵敏W3S对烷烃、甲烷灵敏
1.3.4.6 感官评价
参照GB 2707—2016《鲜(冻)畜、禽产品》对牛肉的感官品质进行评价。由15 名专业人员组成感官评定小组,根据视觉、嗅觉、触觉判断牛肉色泽、气味、形态及质地状态。同一样品、同一项目评分取平均值,同一天的总评分为各个评价项目分数平均值的总和。评价标准如表2所示。
表2 贮藏过程中牛肉感官评价标准
Table 2 Criteria for sensory evaluation of beef
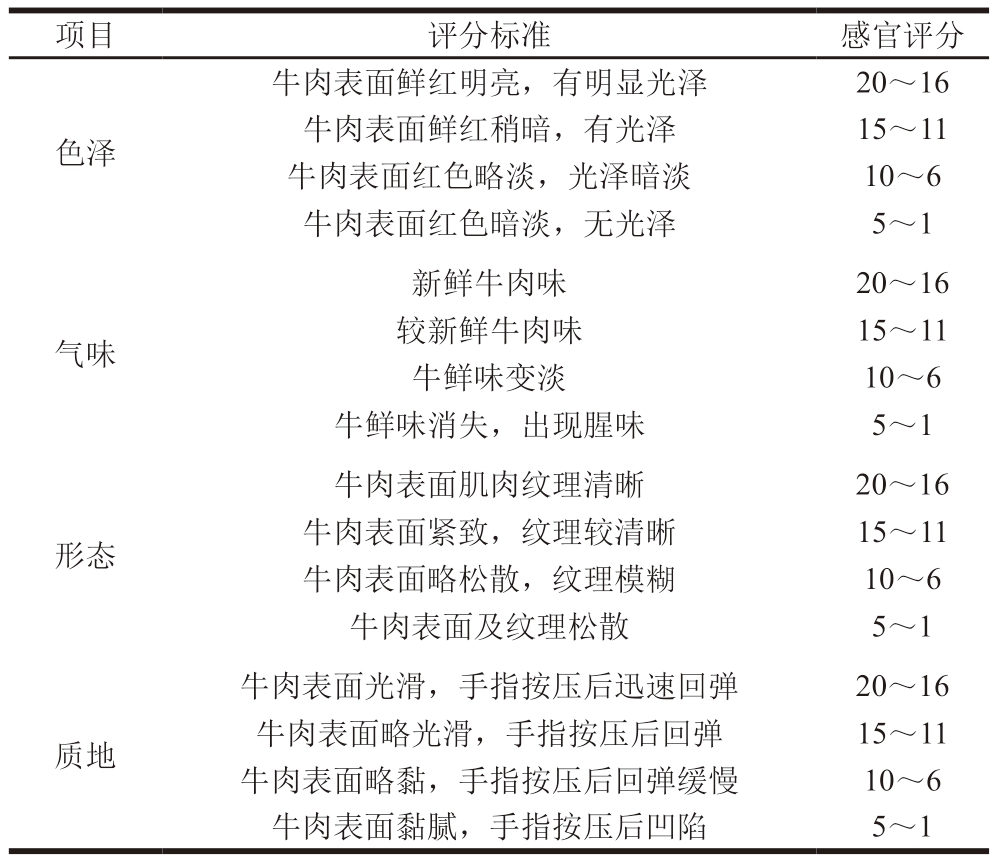
项目评分标准感官评分色泽牛肉表面鲜红明亮,有明显光泽20~16牛肉表面鲜红稍暗,有光泽15~11牛肉表面红色略淡,光泽暗淡10~6牛肉表面红色暗淡,无光泽5~1气味新鲜牛肉味20~16较新鲜牛肉味15~11牛鲜味变淡10~6牛鲜味消失,出现腥味5~1形态牛肉表面肌肉纹理清晰20~16牛肉表面紧致,纹理较清晰15~11牛肉表面略松散,纹理模糊10~6牛肉表面及纹理松散5~1质地牛肉表面光滑,手指按压后迅速回弹20~16牛肉表面略光滑,手指按压后回弹15~11牛肉表面略黏,手指按压后回弹缓慢10~6牛肉表面黏腻,手指按压后凹陷5~1
1.4 数据处理与统计分析
所有实验均设置3 组平行,数据以平均值±标准差表示。采用OriginPro 2019b软件(美国Origin Lab公司)进行绘图,SPSS Statistic 27软件(美国SPSS公司)进行方差分析,使用单因素方差分析和Tukey检验校正法检验数据间的差异是否显著,P<0.05表明有显著性差异。
2 结果与分析
2.1 BITC对荧光假单胞菌生长情况的影响
如表3所示,牛津杯实验显示,当BITC浓度超过0.06 mmol/L时,BITC对荧光假单胞菌的生长出现抑制作用。当BITC浓度达到0.25 mmol/L,荧光假单胞菌的生长完全受到抑制,说明BITC对荧光假单胞菌的MIC为0.25 mmol/L。
表3 荧光假单胞菌生长情况
Table 3 Effect of BITC concentration on growth of P.fluorescens
注:—.无菌落;+.少量菌落;++.部分菌落;+++.大量菌落。
BITC浓度/(mmol/L)0.000.030.060.130.250.50荧光假单胞菌+++++++++——
微生物的微观结构,包括细胞壁、细胞膜、细胞内容物(蛋白质和核酸)、生理活动所需能量及相关酶类对微生物的生长繁殖十分必要[40]。而抑菌剂可以通过影响这些微观结构达到抑制微生物的作用[41]。因此,BITC可能通过影响一种或多种微观结构,从而具有较好的抑菌性能。
2.2 BITC对荧光假单胞菌细胞形态和代谢活力的影响
如图1A所示,对照组的荧光假单胞菌细胞形态完整,呈椭圆杆状,菌体数量较多且无透光部位出现。MIC处理后,细胞边缘出现肿胀现象,导致细胞内蛋白质和核酸等内容物泄露,这可能是细菌细胞膜和细胞壁受到破坏所引起的[42],说明BITC会导致荧光假单胞菌细胞膜的损伤,并且高浓度处理组损伤程度更严重。Shu Huizhen等[36]研究表明,3-蒈烯处理后,荧光假单胞菌细胞损伤及细胞壁分离。Yao Xiaolin等[43]的研究显示,荧光假单胞菌经聚甲氧基黄酮处理后细胞形态受损,膜被破坏。
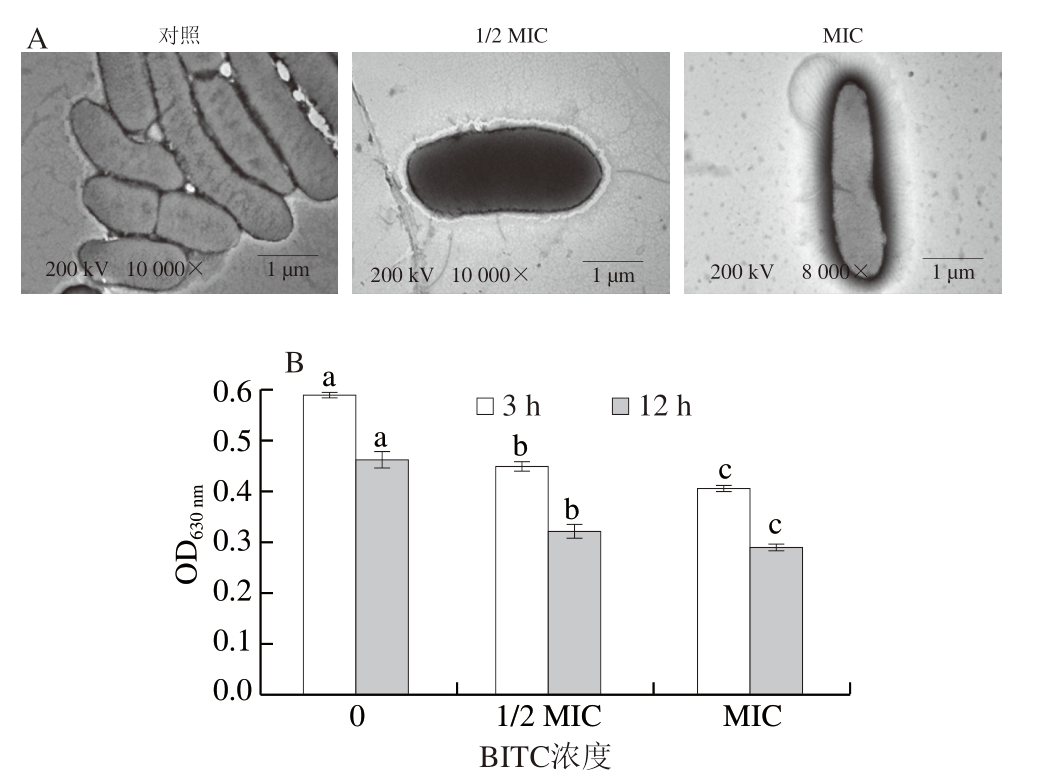
图1 BITC对荧光假单胞菌细胞形态(A)和代谢活力(B)的影响
Fig.1 Effect of BITC on cell morphology (A) and metabolic activity (B) of P.fluorescens
小写字母不同表示同一时间组间差异显著(P<0.05)。图2、6B同。
代谢能力是多数微生物产生能量的主要途径,可以影响细胞ATP的生成,呼吸系统也被认为是抗菌作物的主要靶点之一[44]。呼吸链中脱氢酶介导INT发生还原反应并生成紫红色甲瓒沉淀,影响OD630 nm。因此,OD630 nm越大,说明甲瓒生成速率越快,细胞代谢活力越强[45]。如图1B所示,培养3 h后,对照组的OD630 nm为0.60,BITC(1/2 MIC和MIC)处理后,OD630 nm分别降低至0.45和0.41。培养12 h后,对照组的OD630 nm为0.47,BITC(1/2 MIC和MIC)处理后,OD630 nm分别降低至0.33和0.29。经BITC处理12 h后,MIC处理组与对照组的OD630 nm间均存在显著差异(P<0.05),荧光假单胞菌的代谢活力降低38.30%。说明随着时间的延长,BITC对荧光假单胞菌代谢活力的影响越明显,这可能归因于BITC的加入干扰了呼吸链脱氢酶氧化还原反应的发生,影响甲瓒的生成,从而导致OD630 nm下降[46]。这些结果说明,BITC可以通过调节荧光假单胞菌呼吸代谢能力影响菌体生理活动所需能量,造成呼吸代谢紊乱。
细菌细胞膜提供的渗透压屏障是菌体正常运转的重要因素,包括能量转换、代谢调控及信息传递等[47]。BITC的疏水性使其进入细菌细胞膜,引起膜内外渗透压增加,破坏膜完整性,使细胞内容物如蛋白质、核酸、ATP等泄露,菌体形态发生肿胀或皱缩,从而抑制细菌的增殖[48]。
2.3 BITC对侵染荧光假单胞菌牛肉品质的影响
2.3.1 BITC对侵染荧光假单胞菌牛肉菌落总数的影响
菌落总数可以直接反映牛肉被微生物侵染的程度,是评判牛肉新鲜度的重要指标。当牛肉微生物菌落总数大于6(lg(CFU/mL))时,就可以被认定为变质牛肉[49]。如图2所示,各组的菌落总数随贮藏时间的延长而增加。这可能由于牛肉中游离氨基酸和水溶性蛋白质等较为丰富的营养物质引起微生物的富集生长[50]。对照、1/2 MIC和MIC组的初始菌落总数约为3.8(lg(CFU/mL))。对照组贮藏第5天的菌落总数明显上升,在第6天超过6(lg(CFU/mL)),已经达到腐败标准。1/2 MIC处理组在第0~4天内生长缓慢,可能由于BITC短暂影响荧光假单胞菌的生长繁殖。第5天后,荧光假单胞菌趋于正常生长,这归因于低浓度BITC难以维持长期、有效的抑制效果,但牛肉仍属于新鲜肉标准。MIC处理组在第3天的荧光假单胞菌菌落总数为3.69(lg(CFU/mL)),明显低于对照组,这种现象可能与BITC和冷藏温度共同作用相关。随着贮藏时间的延长,菌落总数缓慢上升,而1/2 MIC和MIC处理组在1 周之内仍符合新鲜牛肉的标准,与对照组相比,1 周内1/2 MIC和MIC处理组的菌落总数抑制率分别为26.32%和35.73%,说明BITC可以通过抑制牛肉中荧光假单胞菌的生长延长牛肉保持新鲜度的时间。此外,1/2 MIC和MIC处理组在第2天开始出现菌落总数的显著性差异(P<0.05),虽然在第7天时1/2 MIC处理组的菌落总数仍然保持在安全范围内,但仍有较为明显的增长。而MIC处理组的菌落总数基本不变。
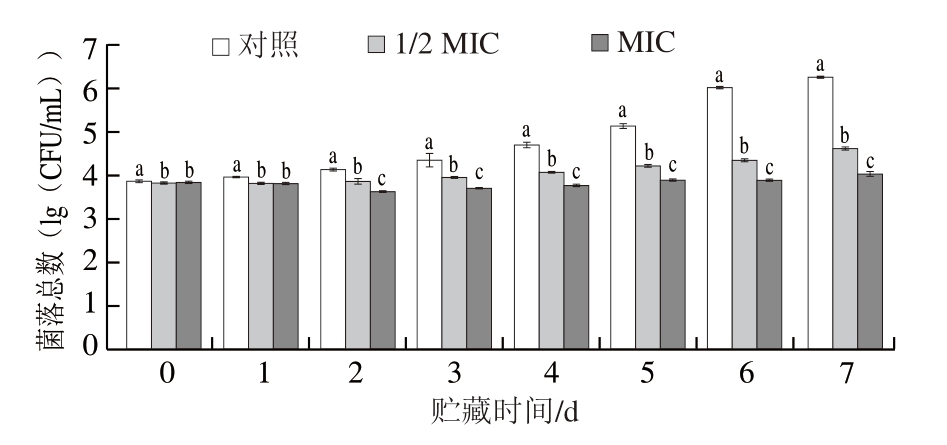
图2 不同浓度BITC对牛肉菌落总数的影响
Fig.2 Effect of different concentrations of BITC on total viable count of beef
微生物是导致低温贮藏肉类及水产品腐败的关键因素,假单胞菌是其中的优势腐败菌[51]。潘莹等[52]研究显示,荷叶提取物及曲酸单独或联合作用于牛肉中,均可有效抑制假单胞菌等微生物的生长繁殖;杨胜平等[53]研究发现,牛至精油对三文鱼中的荧光假单胞菌具有较好的抑制能力,贮藏12 d后,牛至精油处理组较对照组菌落总数减少1.34(lg(CFU/mL));Li Zhaolun等[34]研究表明,BITC可有效抑制鸡肉中的微生物生长,降低生鲜鸡肉中单核细胞增生李斯特氏菌的含量。综上所述,已有研究均与本研究有类似结果,BITC可有效抑制腐败菌的生长繁殖,延长肉制品货架期。
2.3.2 BITC对侵染荧光假单胞菌牛肉色差的影响
微生物如细菌、霉菌等在肉类表面或内部生长,其代谢活动会产生酸性物质、酶和其他化合物,这些物质可能会与肉类中的色素相互作用,导致色素的分解或变化,从而影响肉类的颜色[54]。如图3所示,对照组的ΔE在贮藏过程中不断升高,并在第4天出现明显的上升趋势,这是由于牛肉在贮藏过程中与空气接触,荧光假单胞菌可以较好地生长。牛肉中的肌红蛋白逐步被氧化成高铁肌红蛋白,失去鲜红的色泽,并伴随脂质氧化,导致L*、a*和b*呈现上升趋势,进而促进ΔE的增加[55-56]。在1/2 MIC处理组中,前3 d的ΔE趋于稳定,在第4天有较为明显的上升。MIC处理组可以将新鲜牛肉的颜色保持4 d,在第5天时出现明显的变化。此外,MIC处理组贮藏第7天ΔE的变化远低于对照组牛肉,与对照组相比,1 周内MIC处理组的牛肉ΔE降低21.52%,原因可能是MIC通过抑制荧光假单胞菌的生长降低牛肉TVB-N含量,阻断其氧化反应的发生,减缓牛肉的颜色变化。
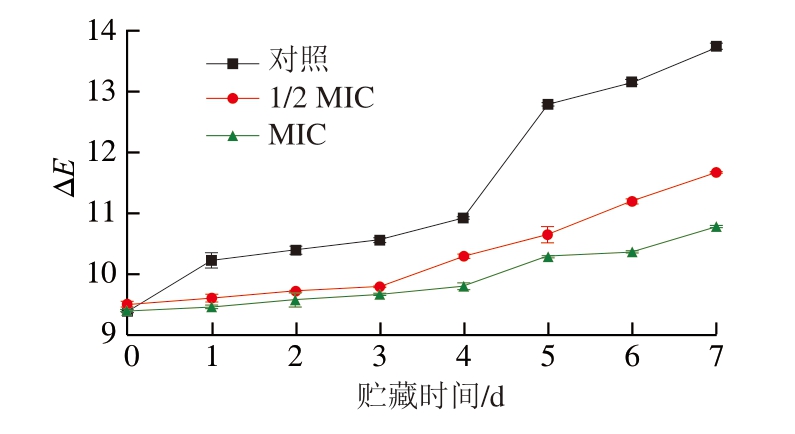
图3 不同浓度BITC对牛肉ΔE的影响
Fig.3 Effect of different concentrations of BITC on the color difference of beef
2.3.3 BITC对侵染荧光假单胞菌牛肉pH值的影响
微生物在生长过程中会分解肉类中的蛋白质、碳水化合物等,释放出氨、胺等碱性产物,这些碱性产物可能会提高肉类的pH值[57]。如图4所示,牛肉贮藏7 d时1/2 MIC和MIC处理组的pH值明显低于对照组。与对照组相比,1/2 MIC和MIC处理组可以延缓1.53%和4.53%的牛肉pH值上升。此外,MIC处理组的pH值极为稳定,说明BITC可以通过抑制荧光假单胞菌减少牛肉中蛋白质和碳水化合物等营养物质的分解,稳定牛肉pH值。
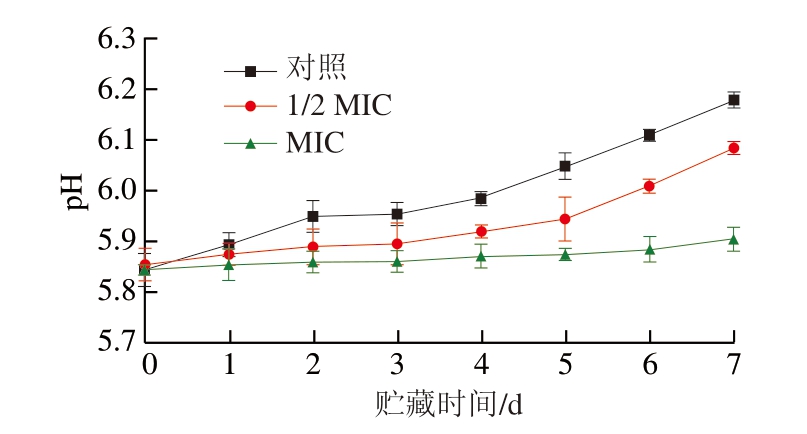
图4 不同浓度BITC对牛肉pH值的影响
Fig.4 Effect of different concentrations of BITC on the pH of beef
pH值是评价肉类品质的重要指标,冷鲜肉中pH值的变化程度与肌肉蛋白特性有关,进而影响肉类品质[58]。在本研究中,pH值处于上升的趋势,这可能是由于牛肉中糖原含量下降导致糖酵解速率减缓,以及牛肉中增殖的荧光假单胞菌等微生物和内源性蛋白酶降解蛋白质产生碱性氨基酸所致[59]。BITC的加入有效缓解pH值的上升,可能是由于其对荧光假单胞菌的有效抑制减少了碱性物质的产生,保持牛肉品质。
2.3.4 BITC对侵染荧光假单胞菌牛肉TVB-N含量的影响
肉类中的TVB-N主要包括挥发性碱和氨等。微生物可能对肉类TVB-N含量产生影响,其影响主要来自微生物的代谢活动和腐败过程[60]。如图5所示,各组牛肉的TVB-N含量随着贮藏时间的延长而增加,尤其是对照组与1/2 MIC处理组牛肉,这可能由于上述2 组牛肉适合荧光假单胞菌生长繁殖,产生的代谢产物和酶类物质增多,加速了牛肉中氮氧化合物降解,从而使TVB-N含量上升[52]。各处理组初始TVB-N含量约为10 mg/100 g,BITC处理组的TVB-N含量始终低于对照组,MIC处理组贮藏7 d时的TVB-N含量相比于对照组降低54.39%。目前的卫生标准规定牛肉中TVB-N含量的变质阈值为0.2 mg/g[61],对照组第7天的TVB-N含量已经接近该阈值,而BITC处理组仍处于鲜肉标准,说明BITC处理可有效缓解TVB-N的生成。
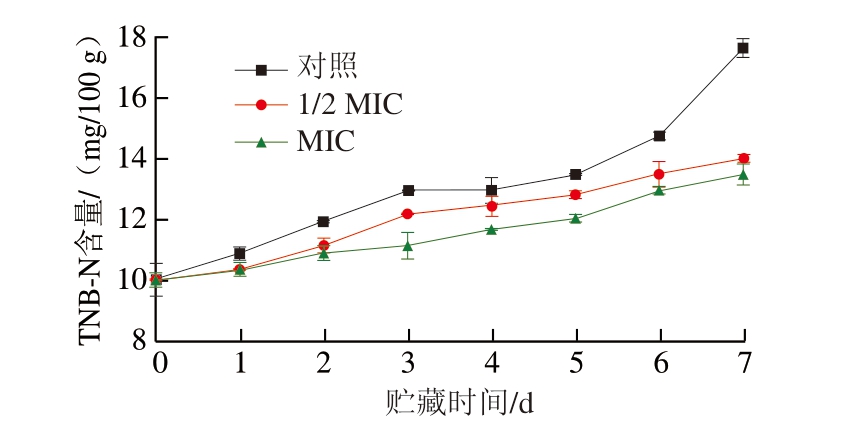
图5 不同浓度BITC对牛肉TVB-N含量的影响
Fig.5 Effect of different concentrations of BITC on TVB-N content of beef
2.3.5 BITC对侵染荧光假单胞菌牛肉电子鼻测定结果的影响
如图6A所示,电子鼻W5S传感器对牛肉样品的响应值较其他传感器更强。随着时间的延长,W5S传感器信号强度持续增加,说明在贮藏过程中产生了氮氧化合物。氮氧化合物主要来源于氨基酸和还原糖之间的美拉德反应,其香气阈值较低,是肉制品中重要的呈味物质,并与荧光假单胞菌生长有一定关系[62]。如图6B所示,与贮藏第1天相比,贮藏第7天对照组W5S传感器响应值上升141.89%,说明荧光假单胞菌使牛肉逐渐变质,产生大量氮氧化合物。贮藏第7天时,1/2 MIC和MIC处理组的信号强度相比于对照组分别降低1.51%和4.78%,说明BITC处理具有延缓牛肉腐败的作用,降低牛肉中氮氧化物的产生,以达到保鲜作用。
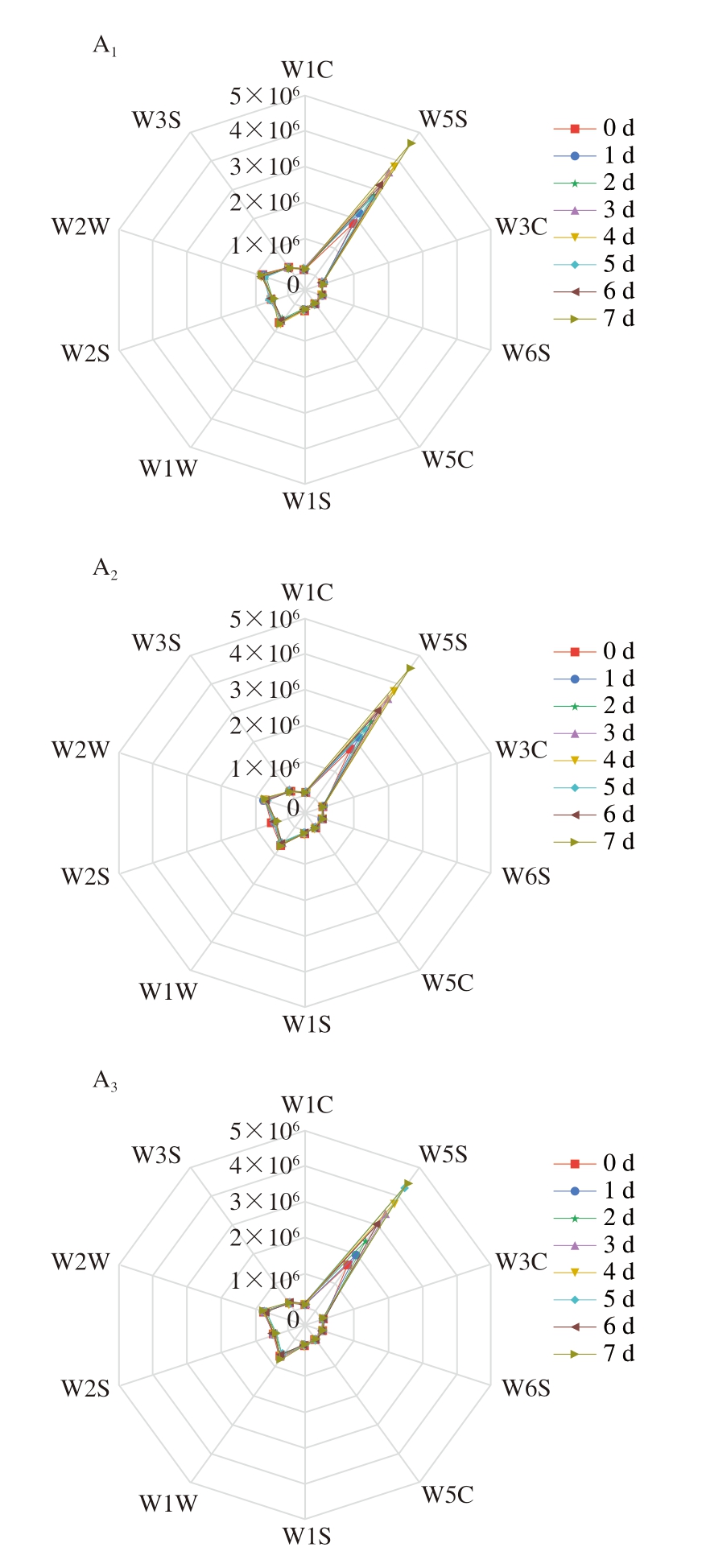
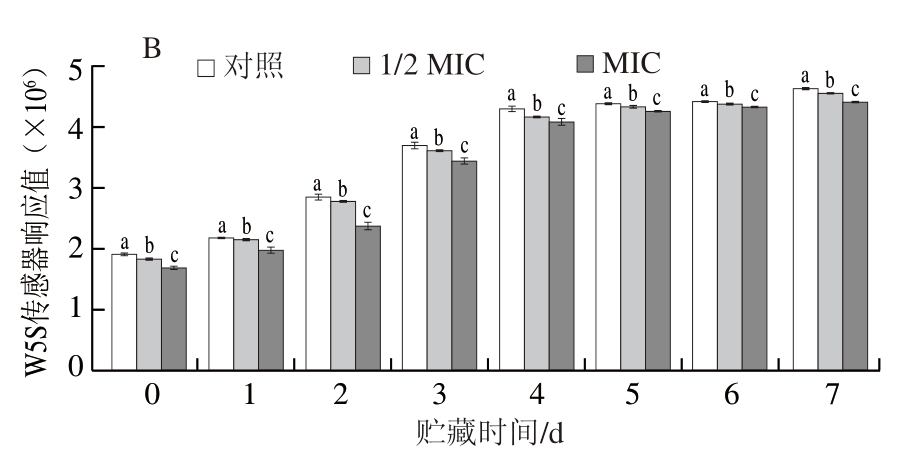
图6 不同浓度BITC对牛肉气味的影响
Fig.6 Effect of different concentrations of BITC on beef flavor
A.雷达图,下标1~3分别为对照、1/2 MIC、MIC;B.响应值。
在肉类风味和品质评定方面,电子鼻技术常用于对不同肉类挥发性气味的检测,其主要通过风味识别、肉质评估、新鲜度识别和风味调控等方面对肉类品质进行调控[63]。侯宝睿等[64]研究发现,使用防腐剂包装的酱牛肉在18 d之内依旧可以达到保鲜的效果。沈秋霞等[39]通过电子鼻技术快速判断不同冷藏时间三文鱼片挥发性物质,并发现氮氧化合物可导致真空包装三文鱼片发生腐败变质现象。这些研究均与本研究结果一致,说明BITC可有效改善牛肉风味,延缓牛肉腐败变质。
2.3.6 BITC对侵染荧光假单胞菌牛肉感官评分的影响
如图7所示,随着贮藏时间延长,各组别的感官评分均下降,由于荧光假单胞菌代谢过程中利用氨基酸,释放氨气等刺激性气体,进而导致牛肉感官品质发生劣变[65]。BITC处理组评分始终高于对照组,且1 周内感官评分较对照组相比提高10.45%,可能是因为BITC抑制荧光假单胞菌的增殖,降低蛋白质分解速率并减弱氨氧化合物的生成[66]。贮藏第4天各处理组牛肉感官评分下降趋势显著,说明牛肉的感官品质已经发生改变,BITC处理保证了牛肉的品质,达到延长牛肉货架期的作用。
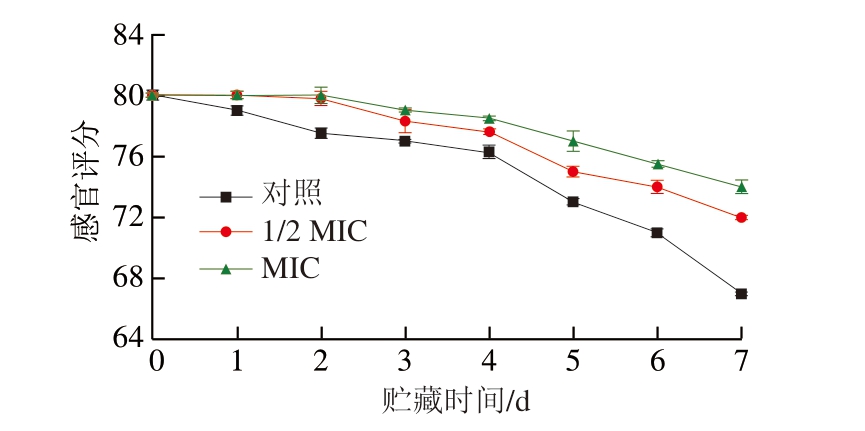
图7 不同浓度BITC对牛肉感官评分的影响
Fig.7 Effect of different concentrations of BITC on sensory score of beef
3 结 论
本研究以BITC为抑制剂,研究其对荧光假单胞菌的抑菌活性及应用于牛肉中的保鲜效果。结果表明:BITC对荧光假单胞菌的MIC为0.25 mmol/L,能够破坏荧光假单胞菌细胞膜的通透性及代谢活性;此外,在贮藏第7天时,与对照组相比,MIC处理组牛肉中的荧光假单胞菌数量、ΔE、pH值、TVB-N含量、氮氧化合物含量及感官评分均明显改善。综上所述,BITC作为天然抑制剂及可使用的食品添加剂,能够有效抑制荧光假单胞菌的生长并延长冷鲜牛肉货架期,在肉类的冷藏保鲜中具有广阔的应用前景。
[1] 汪海棠, 王守伟, 李家鹏, 等.荷斯坦去势公牛肉质与加工特性分析与挖掘[J].肉类研究, 2024, 38(1): 1-9.DOI:10.7506/rlyj1001-8123-20231229-119.
[2] 刘提广, 张庆伟, 许宝琛, 等.不同真空低温煮制时间和温度组合对牛半膜肌食用品质的影响[J].肉类研究, 2024, 38(1): 44-50.DOI:10.7506/rlyj1001-8123-20240119-021.
[3] 张宜新, 刘通, 张峰.冷链储运中生鲜食品劣变的快检技术研究进展[J/OL].食品科学, 2024: 1-18.[2024-05-09].http://kns.cnki.net/kcms/detail/11.2206.TS.20240416.1348.005.html.
[4] 张顺君, 王东亮, 陈宏柱, 等.超高压杀菌对酱卤肉制品贮藏期品质的影响[J].肉类研究, 2023, 37(12): 54-60.DOI:10.7506/rlyj1001-8123-20240111-014.
[5] GE Y Y, ZHU J L, YE X F, et al.Spoilage potential characterization of Shewanella and Pseudomonas isolated from spoiled large yellow croaker (Pseudosciaena crocea)[J].Letters in Applied Microbiology,2017, 64(1): 86-93.DOI:10.1111/lam.12687.
[6] YU H H, CHIN Y W, PAIK H D.Application of natural preservatives for meat and meat products against food-borne pathogens and spoilage bacteria: a review[J].Foods, 2021, 10(10): 2418.DOI:10.3390/foods10102418.
[7] TENDERIS B, KILIÇ B, YALÇIN H, et al.Controlling growth of Listeria monocytogenes and Pseudomonas fluorescens in thermally processed ground beef by sodium lactate, encapsulated or unencapsulated polyphosphates incorporation[J].LWT-Food Science and Technology, 2021, 144: 111169.DOI:10.1016/j.lwt.2021.111169.
[8] 王丽, 林颖, 谭旭, 等.冷鲜肉主要致腐微生物及构建微生物预测模型研究进展[J].肉类研究, 2023, 37(10): 42-48.DOI:10.7506/rlyj1001-8123-20230817-077.
[9] WANG Z L, WANG Z X, JI L L, et al.A review: microbial diversity and function of fermented meat products in China[J].Frontiers in Microbiology, 2021, 1212: 645435.DOI:10.3389/fmicb.2021.645435.
[10] 张琪, 庞立冬, 苏群超, 等.CRISPR/Cas-等温扩增技术在食源性病原菌检测中的研究进展[J].食品科学, 2024, 45(7): 310-321.DOI:10.7506/spkx1002-6630-20230804-033.
[11] 刘雨辰, 曲梦锐, 曹恺洋, 等.壳聚糖-留兰香精油复合膜对酱猪肉保鲜效果的影响[J].肉类研究, 2023, 37(10): 37-41.DOI:10.7506/rlyj1001-8123-20230830-080.
[12] XU Y, ZHANG T, CHE J R, et al.Evaluation of the antimicrobial mechanism of biogenic selenium nanoparticles against Pseudomonas fluorescens[J].Biofouling, 2023, 39(2): 157-170.DOI:10.1080/08927 014.2023.2199932.
[13] WANG Y Y, FENG L F, LU H X, et al.Transcriptomic analysis of the food spoilers Pseudomonas fluorescens reveals the antibiofilm of carvacrol by interference with intracellular signaling processes[J].Food Control, 2021, 127: 108115.DOI:10.1016/j.foodcont.2021.108115.
[14] WANG Y B, WANG Y Z, CHEN J, et al.Screening and preservation application of quorum sensing inhibitors of Pseudomonas fluorescens and Shewanella baltica in seafood products[J].LWT-Food Science and Technology, 2021, 149: 111749.DOI:10.1016/j.lwt.2021.111749.
[15] SUN Y M, OCKERMAN H W.Growth of Pseudomonas fluorescens and Escherichia coil in aseptically-prepared fresh ground beef[J].Journal of Muscle Foods, 2004, 15(3): 155-171.DOI:10.1111/j.1745-4573.2004.tb00681.x.
[16] SHAW B G, LATTY J B.A numerical taxonomic study of Pseudomonas strains from spoiled meat[J].Journal of Applied Bacteriology, 1982, 52(2): 219-228.DOI:10.1111/j.1365-2672.1982.tb04843.x.
[17] CROWLEY K M, PRENDERGAST D M, SHERIDAN J J, et al.Survival of Pseudomonas fluorescens on beef carcass surfaces in a commercial abattoir[J].Meat Science, 2010, 85(3): 550-554.DOI:10.1016/j.meatsci.2010.03.004.
[18] 袁旖旎, 周广晖, 董鹏程, 等.假单胞菌生物被膜形成机制及控制:基于群体感应与第二信使关系[J/OL].食品科学, 2024: 1-13.[2024-05-09].http://kns.cnki.net/kcms/detail/11.2206.TS.20240329.1143.002.html.
[19] XU Y S, JIANG X Q, GE L H, et al.Inhibitory effect of edible additives on collagenase activity and softening of chilled grass carp fillets[J].Journal of Food Processing and Preservation, 2017, 41(2):e12836.DOI:10.1111/jfpp.12836.
[20] KONG B H, GUO Y Y, XIA X F, et al.Cryoprotectants reduce protein oxidation and structure deterioration induced by freeze-thaw cycles in common carp (Cyprinus carpio) surimi[J].Food Biophysics, 2013,8(2): 104-111.DOI:10.1007/s11483-012-9281-0.
[21] KANATT S R, CHANDER R, SHARMA A.Chitosan and mint mixture: a new preservative for meat and meat products[J].Food Chemistry, 2008, 107(2): 845-852.DOI:10.1016/j.foodchem.2007.08.088.
[22] TAN L, HOW C, FOO J B, et al.Resveratrol as a potential broadspectrum compound for cancer treatment[J].Progress in Microbes and Molecular Biology, 2020, 3: a0000098.DOI:10.36877/pmmb.a0000098.
[23] 王雅莹.基于群体感应研究香芹酚对鱼源荧光假单胞菌单/混生物被膜的抑制作用[D].杭州: 浙江工商大学, 2020: 24-54.
[24] LAN W Q, DU J T, SUN Y Q, et al.Insight into the antibacterial activity and mechanism of chitosan caffeic acid graft against Pseudomonas fluorescens[J].International Journal of Food Science and Technology, 2023, 58(3): 1317-1325.DOI:10.1111/ijfs.16290.
[25] DINH T N, PARAT M O, ONG Y S, et al.Anticancer activities of dietary benzyl isothiocyanate: a comprehensive review[J].Pharmacological Research, 2021, 169: 105666.DOI:10.1016/j.phrs.2021.105666.
[26] DUFOUR V, ALAZZAM B, THEPAUT M, et al.Antimicrobial activities of isothiocyanates against Campylobacter jejuni isolates[J].Frontiers in Cellular and Infection Microbiology, 2012, 2: 53.DOI:10.3389/fcimb.2012.00053.
[27] JANG M, HONG E, KIM G H.Evaluation of antibacterial activity of 3-butenyl, 4-pentenyl, 2-phenylethyl, and benzyl isothiocyanate in brassica vegetables[J].Journal of Food Science, 2010, 75(7):M412-M416.DOI:10.1111/j.1750-3841.2010.01725.x.
[28] WU H Y, XU Y H, WEI L N, et al.Inhibitory effects of 3-(methylthio)propyl isothiocyanate in comparison with benzyl isothiocyanate on Listeria monocytogenes[J].Journal of Food Measurement and Characterization, 2022, 16(2): 1768-1775.DOI:10.1007/s11694-022-01290-9.
[29] LIU J N, WU H Y, AO X Y, et al.Characterization of the inclusion complexes of isothiocyanates with γ-cyclodextrin for improvement of antibacterial activities against Staphylococcus aureus[J].Foods, 2021,11(1): 60.DOI:10.3390/foods11010060.
[30] YANG C X, WU H T, LI X X, et al.Comparison of the inhibitory potential of benzyl isothiocyanate and phenethyl isothiocyanate on Shiga toxin-producing and enterotoxigenic Escherichia coli[J].LWTFood Science and Technology, 2020, 118: 108806.DOI:10.1016/j.lwt.2019.108806.
[31] LIU J N, ZHANG K, SONG J, et al.Bacteriostatic effects of benzyl isothiocyanate on Vibrio parahaemolyticus: transcriptomic analysis and morphological verification[J].BMC Biotechnology, 2021, 21: 56.DOI:10.1186/s12896-021-00716-4.
[32] WU H Y, AO X Y, LIU J N, et al.A bioactive chitosan-based film enriched with benzyl isothiocyanate/α-cyclodextrin inclusion complex and its application for beef preservation[J].Foods, 2022, 11(17): 2687.DOI:10.3390/foods11172687.
[33] HUANG Y, LIU J N, LI Z L, et al.Antibacterial film based on κ-carrageenan with benzyl isothiocyanate-β-cyclodextrin inclusion complex: characterization and application in chicken preservation[J].Food Hydrocolloids, 2023, 145: 109063.DOI:10.1016/j.foodhyd.2023.109063.
[34] LI Z L, WU H Y, LIU J N, et al.Synergistic effects of benzyl isothiocyanate and resveratrol against Listeria monocytogenes and their application in chicken meat preservation[J].Food Chemistry,2023, 419: 135984.DOI:10.1016/j.foodchem.2023.135984.
[35] 赵玉明, 田晋梅, 彭晓光.复合香辛料精油配方优化及对冰温贮藏牛肉保鲜效果研究[J].食品研究与开发, 2017, 38(12): 182-187.DOI:10.3969/j.issn.1005-6521.2017.12.040.
[36] SHU H Z, ZHANG W M, YUN Y H, et al.Metabolomics study on revealing the inhibition and metabolic dysregulation in Pseudomonas fluorescens induced by 3-carene[J].Food Chemistry, 2020, 329:127220.DOI:10.1016/j.foodchem.2020.127220.
[37] 舒慧珍.3-蒈烯对荧光假单胞菌的抑菌机理研究[D].海口: 海南大学, 2020: 25-35.
[38] 李佳林, 梁超, 黄青.均匀交变磁场对鲫鱼肉冷冻保鲜效果的影响[J].安徽大学学报(自然科学版), 2023, 47(6): 37-41.DOI:10.3969/j.issn.1000-2162.2023.06.006.
[39] 沈秋霞, 王晓君, 卢朝婷, 等.基于电子鼻技术对真空包装三文鱼片的新鲜度评价[J].食品与发酵工业, 2018, 44(10): 241-247.DOI:10.13995/j.cnki.11-1802/ts.01530.
[40] ZONG R, RUAN H N, LIU C M, et al.Bacteria and bacterial components as natural bio-nanocarriers for drug and gene delivery systems in cancer therapy[J].Pharmaceutics, 2023, 15(10): 2490.DOI:10.3390/pharmaceutics15102490.
[41] 刘晓宇.番木瓜籽提取物异硫氰酸苄酯抑菌及应用研究[D].天津:天津科技大学, 2016: 19-23.
[42] 倪荣, 郭雪松, 韩艳霞, 等.壳聚糖复合保鲜剂对荧光假单胞菌的抑菌活性[J].现代食品科技, 2023, 39(12): 178-183.DOI:10.13982/j.mfst.1673-9078.2023.12.1172.
[43] YAO X L, ZHU X R, PAN S Y, et al.Antimicrobial activity of nobiletin and tangeretin against Pseudomonas[J].Food Chemistry,2012, 132(4): 1883-1890.DOI:10.1016/j.foodchem.2011.12.021.
[44] YANG S Z, LIU L M, LI D M, et al.Use of active extracts of poplar buds against Penicillium italicum and possible modes of action[J].Food Chemistry, 2016, 196: 610-618.DOI:10.1016/j.foodchem.2015.09.101.
[45] MALDONADO F, PACKARD T T, GÓMEZ M.Understanding tetrazolium reduction and the importance of substrates in measuring respiratory electron transport activity[J].Journal of Experimental Marine Biology and Ecology, 2012, 434/435: 110-118.DOI:10.1016/j.jembe.2012.08.010.
[46] 李远颂, 何荣荣, 蔡佳欣, 等.芳樟醇对莓实假单胞菌的抑菌活性及机制[J].食品科学技术学报, 2022, 40(4): 55-63.DOI:10.12301/spxb202100543.
[47] 闫世雄, 郝亭亭, 张芯燕, 等.香芹酚和百里香酚对畜禽肠道健康的调控[J].饲料研究, 2022, 45(3): 129-133.DOI:10.13557/j.cnki.issn1002-2813.2022.03.026.
[48] 萨仁高娃, 胡文忠, 冯可, 等.植物精油及其成分对病原微生物抗菌机理的研究进展[J].食品科学, 2020, 41(11): 285-294.DOI:10.7506/spkx1002-6630-20190603-018.
[49] 孟庆, 孙亚楠.生姜提取物/虾青素复配液对冷鲜牛肉保鲜效果的影响[J].中国食品添加剂, 2022, 33(6): 115-121.DOI:10.19804/j.issn1006-2513.2022.06.016.
[50] JIA S L, LIU Y M, ZHUANG S, et al.Effect of ε-polylysine and ice storage on microbiota composition and quality of pacific white shrimp(Litopenaeus vannamei) stored at 0 ℃[J].Food Microbiology, 2019,83: 27-35.DOI:10.1016/j.fm.2019.04.007.
[51] 王琳, 李宇轩, 范维, 等.金银花提取物对冷却肉中假单胞菌黏附性的影响[J].肉类研究, 2020, 34(2): 20-26.DOI:10.7506/rlyj1001-8123-20190709-159.
[52] 潘莹, 张晓明, 乔宏宇.荷叶提取物与曲酸的抑菌作用及其对牛肉保鲜效果的研究[J].食品科技, 2023, 48(7): 99-106.DOI:10.13684/j.cnki.spkj.2023.07.026.
[53] 杨胜平, 章缜, 程颖, 等.牛至精油对荧光假单胞菌的抑制作用及其对冷藏三文鱼品质的影响[J].食品科学, 2020, 41(1): 215-222.DOI:10.7506/spkx1002-6630-20190530-380.
[54] EL-DIN AHMED BEKHIT A, MORTON J D, BHAT Z F, et al.Encyclopedia of food chemistry: Volume 2[M].Amsterdam: Elsevier,2019: 202-210.DOI:10.1016/B978-0-08-100596-5.21665-X.
[55] 黄文权, 阚启鑫, 刘果, 等.冷冻及冻藏过程中鸡肉的食用品质及化学质量属性变化研究进展[J].食品科学, 2024, 45(6): 326-336.DOI:10.7506/spkx1002-6630-20230404-039.
[56] 吕锦涛, 舒一梅, 全威, 等.牛肉宰后冷却贮藏期肉色稳定性的变化及其机制[J/OL].食品科学, 2024: 1-14.[2024-05-09].http://kns.cnki.net/kcms/detail/11.2206.TS.20240329.1707.051.html.
[57] 满涛, 熊晓辉, 王亚楠, 等.玉米蛋白美拉德反应产物膜对冷鲜牛肉的保鲜效果[J].现代食品科技, 2023, 39(4): 154-162.DOI:10.13982/j.mfst.1673-9078.2023.4.0649.
[58] 王艳梅, 张校铷, 鞠贵春, 等.肉牛宰前体表温度和牛肉pH值间关系的研究[J].经济动物学报, 2014, 18(4): 221-227.DOI:10.13326/j.jea.2014.1054.
[59] 杨致昊, 刘畅, 窦露, 等.苏尼特羊宰后成熟过程中单磷酸腺苷活化蛋白激酶活性、糖酵解与肉品质指标的变化分析[J].食品科学,2022, 43(11): 156-162.DOI:10.7506/spkx1002-6630-20210426-377.
[60] 黄明明, 乔维维, 章建浩, 等.低温等离子体冷杀菌对生鲜牛肉主要腐败菌及生物胺抑制效应研究[J].食品科学技术学报, 2018, 36(4):17-23.DOI:10.3969/j.issn.2095-6002.2018.04.003.
[61] MI H B, QIAN C L, ZHAO Y Y, et al.Comparison of superchilling and freezing on the microstructure, muscle quality and protein denaturation of grass carp (Ctenopharyngodon idellus)[J].Journal of Food Processing and Preservation, 2013, 37(5): 546-554.DOI:10.1111/j.1745-4549.2012.00678.x.
[62] 李彦, 符慧靖, 秦建鹏, 等.天然复合添加剂对卤牛肉贮藏品质及风味的影响[J].中国食品学报, 2023, 23(11): 231-245.DOI:10.16429/j.1009-7848.2023.11.023.
[63] 杜春林, 赵春萍, 谭娅.肉类风味物质检测技术研究进展[J].肉类研究, 2023, 37(8): 46-51.DOI:10.7506/rlyj1001-8123-20230517-047.
[64] 侯宝睿, 孟静南, 顾胜, 等.复配防腐剂对气调包装酱牛肉保鲜效果研究[J].肉类工业, 2017(4): 28-34.DOI:10.3969/j.issn.1008-5467.2017.04.008.
[65] 顾春涛, 毕伟伟, 朱军莉.冷鲜牛肉贮藏中菌群结构及优势菌致腐性的分析[J].食品科学, 2019, 40(18): 76-82.DOI:10.7506/spkx1002-6630-20180925-263.
[66] 黄明明, 乔维维, 章建浩, 等.低温等离子体冷杀菌对生鲜牛肉主要腐败菌及生物胺抑制效应研究[J].食品科学技术学报, 2018, 36(4):17-23.DOI:10.3969/j.issn.2095-6002.2018.04.003.