我国是世界上最大的猪肉生产和消费国,拥有全球最大的猪肉市场。据国家统计局数据,2023年全年生猪出栏量72 662万 头,猪肉产量5 794万 t。我国每年出栏的商品猪中90%以上都是杜长大三元杂交猪,即以杜洛克作为终端父本,利用长白×大白二元杂交母猪作为母本进行三元杂交生产商品猪。然而,由于长期育种过程一直追求生长速度、瘦肉率等性能,致使杜洛克、长白猪和大白猪肉质逐渐下降。很多研究表明杜长大三元杂交猪与地方猪相比肉质较差[1-2],PSE(pale, soft, and exudative)肉等劣质肉的发生率较高[3-4]。
PSE肉的肉色苍白、质地松软、缺乏弹性,表面有汁液渗出。这种肉极易变质、口感粗硬、营养成分流失多,大大降低了食用和营养价值[5],是一种劣质肉,且容易被消费者误认为是“注水肉”,严重影响企业形象和市场销售。PSE肉产生的机理尚未完全查明,其中屠宰前突然、强烈的应激导致糖酵解加速、肌肉pH值快速下降和肌肉蛋白质变性是形成PSE肉的首要原因[6-7]。PSE肉的产生受到诸多因素的影响,如遗传、应激及屠宰方式等[8-10],探究PSE肉产生原因及机制对有效控制及防止PSE猪肉的产生具有很大意义。
动物的血液由血浆和有形细胞两大部分组成,流动于动物机体的循环系统,参与机体的代谢和免疫活动,与机体的功能密切相关。血常规检验的是血液的有形细胞部分,通过观察其数量及形态变化进行诊断,是反映机体免疫状态、健康状况及抗病能力的重要基础指标。血液生化指标是指血浆中的一些酶和蛋白质,这些小分子酶和蛋白质在代谢、免疫调节、能量传递及生长发育等方面发挥十分重要的作用,提供关于动物代谢、营养和健康状况的信息。而且,血液采集方法简单,对动物的损伤小,是开展研究的重要组织材料,血液被广泛应用于疾病诊断、营养调控和遗传育种研究中[11-13]。
随着人们生活水平的提高,消费者对猪肉品质的要求越来越高。目前,国内外PSE肉研究主要集中在遗传基因、宰前因素、形成机理等方面[4,8,10],而对于PSE肉和正常肉个体肉质和生理生化指标系统比较研究很少。本研究在大规模测定杜长大商品猪的胴体、肉品质、血常规和血液生化指标的基础上,对比分析PSE肉个体和正常肉个体的胴体、肉品质、血常规和血液生化指标差别,探讨血液生化指标作为PSE肉标记物的可行性。本研究结果将为PSE肉形成机理研究中样本选择提供一定的科学参考依据,同时也对通过营养调控、遗传改良等方法降低PSE肉发生率、提高猪肉品质具有重要意义。
1 材料与方法
1.1 材料与试剂
从山东郓城华宝食品有限公司正常屠宰的商品猪中随机选取392 头、100 kg左右的杜长大商品猪,宰前静养、禁食、自由饮水,按照标准工艺屠宰。
谷氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)、总蛋白(total protein,TP)、碱性磷酸酶(alkaline phosphatase,ALP)、尿素、血清肌酐(serum creatinine,CR)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)、载脂蛋白A1(apolipoprotein A1,ApoA-1)、肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)、乳酸(lactic acid,LAC)、葡萄糖(glucose,GLU)、免疫球蛋白G(immunoglobulin G,IgG)、IgA、IgM共18 项指标检测试剂盒 宁波美康生物科技股份有限公司;二胺氧化酶(diamine oxidase,DAO)检测试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
FE28台式pH计 瑞士梅特勒-托利多仪器有限公司;3nh精密色差仪 深圳三恩时科技有限公司;HXJ34绞肉机 佛山海迅电器有限公司;7100全自动生化分析仪 日本日立公司;全自动血细胞分析仪 深圳迈瑞医疗器械有限公司。
1.3 方法
1.3.1 胴体和肉质指标测定
屠宰后40 min,在左半胴体胸腰椎结合处取背最长肌(300±50)g,参考NY/T 825—2004《瘦肉型猪胴体性状测定技术规范》[14]和NY/T 821—2019《猪肉品质测定技术规程》[15]进行背膘厚、体长、宰后45 min的亮度值(L*45 min)、宰后24 h的亮度值(L*24 h)、pH值、滴水损失率、失水率、肌内脂肪(intramuscular fat,IMF)含量等胴体和肉质指标测定。
1.3.2 血常规指标检测
猪心脏放血后,用一次性纸杯接取血液2 mL于EDTA-K2抗凝管中,轻轻摇匀,使用全自动血细胞分析仪测定白细胞数(white blood cell count,WBC)、红细胞数(red blood cell count,RBC)、血红蛋白质量浓度(hemoglobin concentration,HGB)、红细胞压积(hematocrit,HCT)、平均红细胞体积(mean corpuscular volume,MCV)、平均红细胞血红蛋白含量(mean corpuscular hemoglobin content,MCH)、平均红细胞血红蛋白质量浓度(mean corpuscular hemoglobin concentration,MCHC)、红细胞分布宽度变异系数(red blood cell distribution width,RDW)、血小板数(platelet count,PLT)、平均血小板体积(mean platelet volume,MPV)、血小板分布宽度(platelet distribution width,PDW)和血小板压积(platelet hematocrit,PCT)。
1.3.3 血液生化指标检测
猪心脏放血后,用一次性纸杯接取血液10 mL于促凝管中轻轻混匀,静置1 h后,3 000 r/min离心10 min,分离血清,-80 ℃保存,使用全自动生化分析仪测定血清中的19 项生化指标。
1.4 数据处理
通过Office Excel软件进行数据整理和汇总,利用SPSS 26软件,采用单因素方差分析法分析PSE肉与正常肉差别,结果使用平均值±标准差表示。P<0.01表示差异极显著,P<0.05表示差异显著,P>0.05表示差异不显著。利用R包factoMineR和factoextra[16]进行血液生化指标主成分分析(principal components analysis,PCA)和可视化。
2 结果与分析
2.1 PSE肉发生率
参考NY/T 821—2019[15]中PSE肉判定标准及屠宰测定时现场记录,采用pH45 min<5.9、pH24 h<5.6、滴水损失率>5.0%、失水率>20.0%中的2 项及以上指标为标准进行PSE肉判定。如表1所示,392 个样本中有40 头实验猪为PSE肉,发生率为10.2%。屠宰时39 头实验猪表型表现有PSE肉症状,发生率为9.95%。而且,33 头实验猪肉质指标判定和现场观察表型判定结果相一致,二者的一致率为82.5%。本研究表明,部分个体肉质指标判定和现场观察表型判定不一致,在PSE肉研究中选择实验样本时需要特别注意。
表1 正常肉和PSE肉发生率
Table 1 Incidence of normal and PSE pork

项目测定指标表型判定测定指标与表型判定一致性头数发生率/%头数发生率/%头数一致率/%正常肉35289.835390.0534999.1 PSE肉4010.2399.953382.5
2.2 PSE肉与正常肉样本的胴体和肉质指标比较
如表2所示,胴体指标方面,除胴体斜长外,PSE肉个体的胴体质量、胴体直长和肩部背膘厚、最后肋背膘厚和腰荐结合处背膘厚与正常肉个体没有显著差别,表明PSE肉的产生与否与胴体质量和背膘厚等胴体性状相关性不大。肉质指标方面,PSE肉个体的pH45 min、pH24 h和IMF含量均显著低于正常肉个体(P<0.05),而L*45 min、L*24 h、滴水损失率和失水率均显著高于正常肉个体(P<0.05)。
表2 整体猪群、PSE肉个体与正常肉个体的胴体及肉质指标比较
Table 2 Comparison of carcass and meat quality indexes among all pigs, PSE pigs and normal pigs
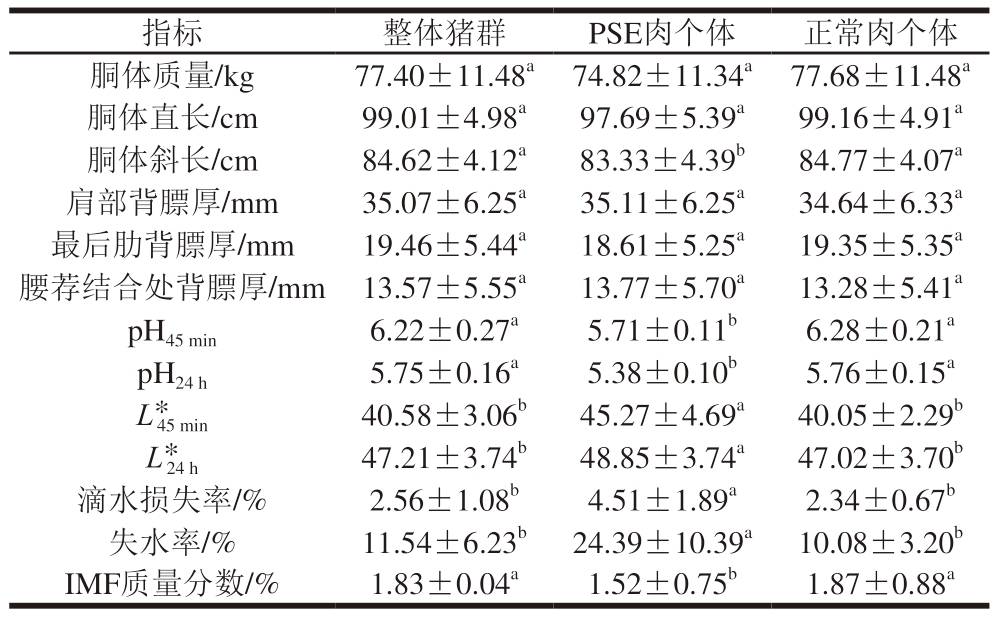
注:同行小写字母不同表示差异显著(P<0.05)。下同。
指标整体猪群PSE肉个体正常肉个体胴体质量/kg77.40±11.48a74.82±11.34a77.68±11.48a胴体直长/cm99.01±4.98a97.69±5.39a99.16±4.91a胴体斜长/cm84.62±4.12a83.33±4.39b84.77±4.07a肩部背膘厚/mm35.07±6.25a35.11±6.25a34.64±6.33a最后肋背膘厚/mm19.46±5.44a18.61±5.25a19.35±5.35a腰荐结合处背膘厚/mm13.57±5.55a13.77±5.70a13.28±5.41a pH45 min 6.22±0.27a5.71±0.11b6.28±0.21a pH24 h 5.75±0.16a5.38±0.10b5.76±0.15a L*45 min40.58±3.06b45.27±4.69a40.05±2.29b L*24 h47.21±3.74b48.85±3.74a47.02±3.70b滴水损失率/%2.56±1.08b4.51±1.89a2.34±0.67b失水率/%11.54±6.23b24.39±10.39a10.08±3.20b IMF质量分数/%1.83±0.04a1.52±0.75b1.87±0.88a
如表3所示,PSE猪肉个体的肉质性状相关系数与正常肉个体不同,PSE猪肉个体的肉质指标间的相关系数更高,达到显著水平的指标更多。PSE猪肉个体的L*45 min与pH45 min、pH24 h呈极显著负相关(r=-0.42、r=-0.28,P<0.01),与失水率呈极显著正相关(r=0.48,P<0.01),与IMF含量呈负相关但没有达到显著水平(r=-0.25,P>0.05),但正常肉个体的L*45 min与pH45 min、pH24 h基本不相关(r=-0.09、r=0.02),与失水率呈正相关但没有达到显著水平(r=0.14,P>0.05),与IMF含量基本不相关(r=0.01)。PSE猪肉个体的pH45 min与滴水损失率和失水率呈极显著负相关(r=-0.42、r=-0.58,P<0.01),但正常肉个体的pH45 min与滴水损失率和失水率基本不相关(r=-0.01、r=-0.03)。PSE猪肉个体的滴水损失率和失水率呈极显著正相关(r=0.51,P<0.01),但正常肉个体的滴水损失率和失水率基本不相关(r=0.01)。正常肉个体的IMF含量与其他肉质性状间相关系数均较低(r=-0.08~0.01),但PSE猪肉个体的IMF含量与滴水损失率和失水率呈显著负相关(r=-0.40、r=-0.37,P<0.05)。
表3 整体猪群、PSE肉个体与正常肉个体的肉质指标相关性分析
Table 3 Correlation analysis of meat quality traits of all pigs, PSE pigs and normal pigs
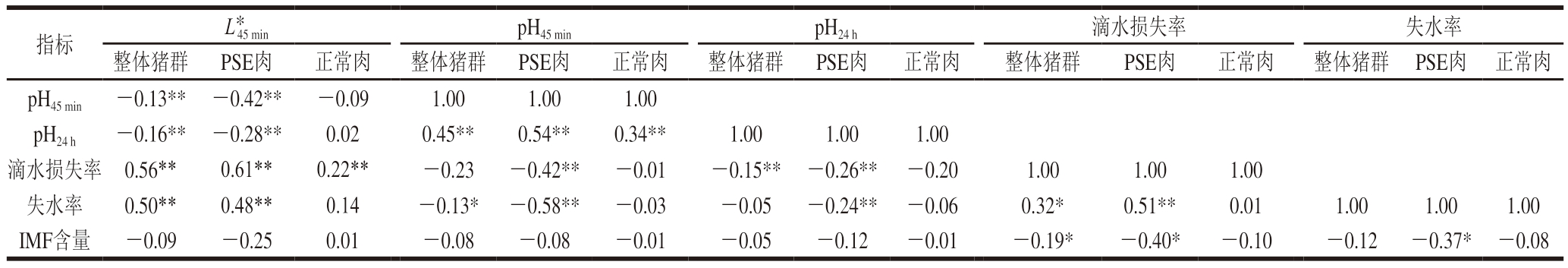
注:*.显著相关(P<0.05);**.极显著相关(P<0.01)。
指标L*45 minpH45 minpH24 h滴水损失率失水率整体猪群PSE肉正常肉整体猪群PSE肉正常肉整体猪群PSE肉正常肉整体猪群PSE肉正常肉整体猪群PSE肉正常肉pH45 min-0.13**-0.42**-0.091.001.001.00 pH24 h-0.16**-0.28**0.020.45**0.54**0.34**1.001.001.00滴水损失率0.56**0.61**0.22**-0.23-0.42**-0.01-0.15**-0.26**-0.201.001.001.00失水率0.50**0.48**0.14-0.13*-0.58**-0.03-0.05-0.24**-0.060.32*0.51**0.011.001.001.00 IMF含量-0.09-0.250.01-0.08-0.08-0.01-0.05-0.12-0.01-0.19*-0.40*-0.10-0.12-0.37*-0.08
2.3 PSE肉与正常肉样本的血常规指标比较
由表4可知,白细胞、红细胞和血小板各性状在PSE肉个体与正常肉个体间无显著差异(P>0.05)。虽然PSE肉个体与正常肉个体在血常规指标间差异均不显著,但PSE肉个体的WBC(24.12×109 个/L)比正常肉个体(22.06×109 个/L)高9.34%,PLT(382.47×109 个/L)比正常肉个体(415.83×109 个/L)低8.02%。
表4 整体猪群、PSE肉个体与正常肉个体的血常规指标比较
Table 4 Comparison of routine blood indexes among all pigs, PSE pigs and normal pigs
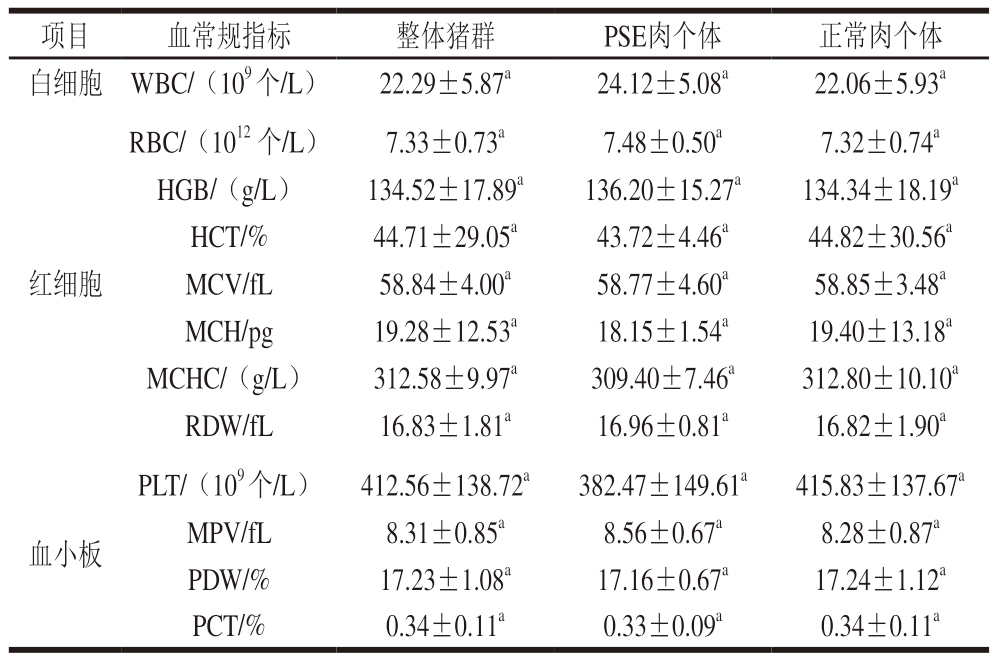
项目血常规指标 整体猪群PSE肉个体正常肉个体白细胞WBC/(109 个/L)22.29±5.87a24.12±5.08a22.06±5.93a红细胞RBC/(1012·个/L)7.33±0.73a7.48±0.50a7.32±0.74a HGB/(g/L)134.52±17.89a136.20±15.27a134.34±18.19a HCT/%44.71±29.05a43.72±4.46a44.82±30.56a MCV/fL58.84±4.00a58.77±4.60a58.85±3.48a MCH/pg19.28±12.53a18.15±1.54a19.40±13.18a MCHC/(g/L)312.58±9.97a309.40±7.46a312.80±10.10a RDW/fL16.83±1.81a16.96±0.81a16.82±1.90a血小板PLT/(109 个/L)412.56±138.72a382.47±149.61a415.83±137.67a MPV/fL8.31±0.85a8.56±0.67a8.28±0.87a PDW/%17.23±1.08a17.16±0.67a17.24±1.12a PCT/%0.34±0.11a0.33±0.09a0.34±0.11a
2.4 PSE肉与正常肉样本血液生化指标对比
由表5可知,本研究测定的19 项血液生化指标中的7 项,PSE肉个体显著高于正常肉个体(P<0.05),包括肝功能指标AST、肾功能指标尿素和CR、心血管指标CK和LDH,以及与能量代谢相关的指标LAC和GLU。而且,这7 项血液生化指标,PSE肉个体不仅均值显著高于正常肉个体,其标准差也大于正常肉个体,表明这些指标在PSE肉中的变异系数也较高。血脂功能有关的5 个指标和3 个免疫球蛋白指标在PSE肉个体和正常肉个体中均差异不显著。本研究结果表明,肝功能、肾功能、心血管和能量代谢与PSE肉的发生存在一定相关性,而血脂和免疫球蛋白与PSE肉的发生没有相关性。
表5 整体猪群、PSE肉个体与正常肉个体的血液生化指标比较
Table 5 Comparison of blood biochemical indexes among all pigs, PSE pigs and normal pigs
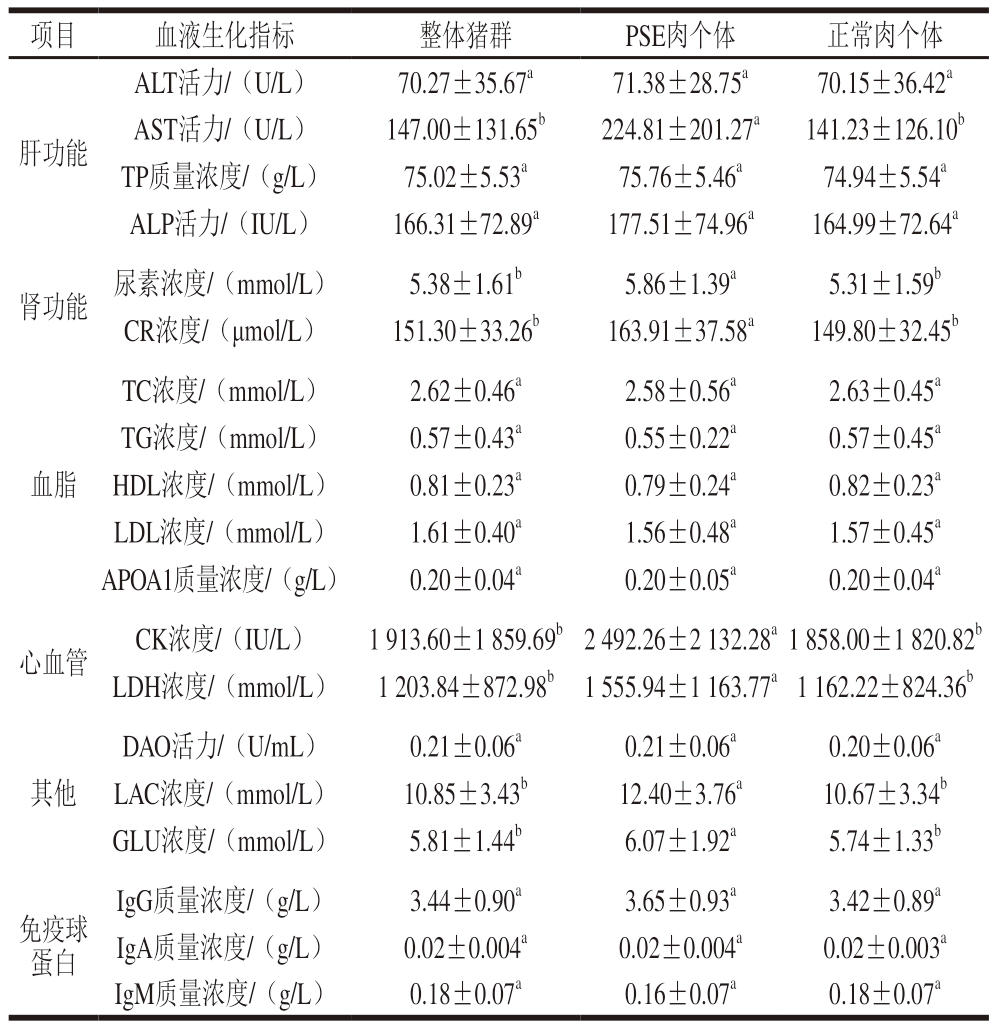
项目血液生化指标整体猪群PSE肉个体 正常肉个体ALT活力/(U/L)70.27±35.67a71.38±28.75a70.15±36.42a AST活力/(U/L)147.00±131.65b224.81±201.27a141.23±126.10b TP质量浓度/(g/L)75.02±5.53a75.76±5.46a74.94±5.54a ALP活力/(IU/L)166.31±72.89a177.51±74.96a164.99±72.64a肾功能尿素浓度/(mmol/L)5.38±1.61b5.86±1.39a5.31±1.59b CR浓度/(μmol/L)151.30±33.26b163.91±37.58a149.80±32.45b肝功能TC浓度/(mmol/L)2.62±0.46a2.58±0.56a2.63±0.45a TG浓度/(mmol/L)0.57±0.43a0.55±0.22a0.57±0.45a HDL浓度/(mmol/L)0.81±0.23a0.79±0.24a0.82±0.23a LDL浓度/(mmol/L)1.61±0.40a1.56±0.48a1.57±0.45a APOA1质量浓度/(g/L)0.20±0.04a0.20±0.05a0.20±0.04a心血管CK浓度/(IU/L)1 913.60±1 859.69b2 492.26±2 132.28a1 858.00±1 820.82b LDH浓度/(mmol/L)1 203.84±872.98b1 555.94±1 163.77a1 162.22±824.36b血脂其他DAO活力/(U/mL)0.21±0.06a0.21±0.06a0.20±0.06a LAC浓度/(mmol/L)10.85±3.43b12.40±3.76a10.67±3.34b GLU浓度/(mmol/L)5.81±1.44b6.07±1.92a5.74±1.33b免疫球蛋白IgG质量浓度/(g/L)3.44±0.90a3.65±0.93a3.42±0.89a IgA质量浓度/(g/L)0.02±0.004a0.02±0.004a0.02±0.003a IgM质量浓度/(g/L)0.18±0.07a0.16±0.07a0.18±0.07a
为探索19 个血液生化指标之间的相关性,筛选能够区分PSE肉个体和正常肉个体的综合变量,本研究进一步开展了血液生化指标PCA。绘制PCA的碎石图[17],由图1、2可知,第1主成分占总方差的20.7%,第2主成分占14.9%,其他主成分占3.5%~11.7%,前2 个主成分只占到总方差的35.6%,不足以区分PSE肉和正常肉个体(图2)。
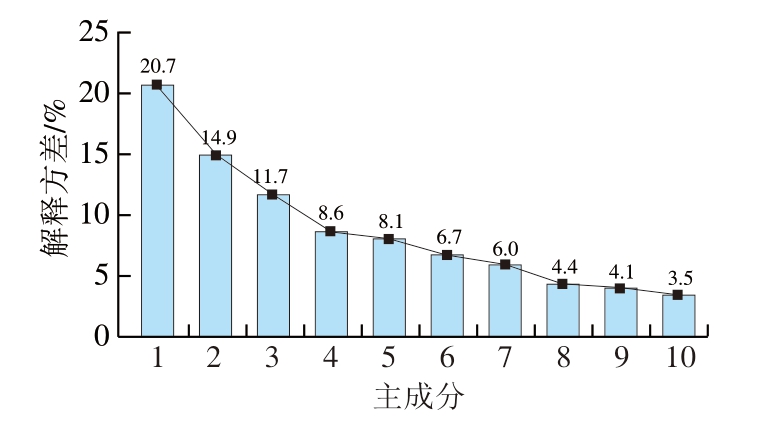
图1 PCA碎石图
Fig.1 Scree plot of principal component analysis
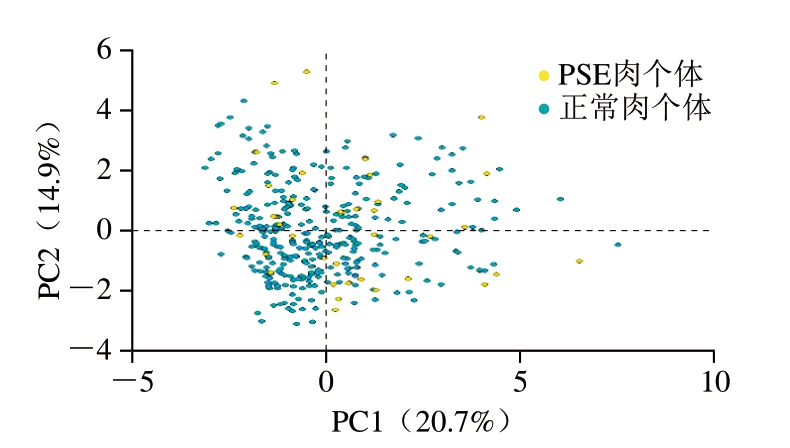
图2 PCA散点图
Fig.2 Scatter plot of principal component analysis
3 讨 论
3.1 PSE肉发生率的衡量指标
PSE肉是一种常见的劣质肉,其高发病率仍然是猪肉行业尚未解决的问题。PSE肉可以通过主观或客观方法进行检测。主观方法通常依赖于检验者的经验,而客观方法通常是基于pH值、L*(L4*5 min、L*24 h)、电导率和滴水损失率等肉质指标。不同研究中采用不同品种的猪及不同的衡量指标来判定PSE肉,所以报道的PSE肉发生率差别较大。本研究屠宰时现场判定PSE肉发生率为9.95%,以pH45 min<5.9、pH24 h<5.6、滴水损失率>5.0%和失水率>20.0%中2 项及以上判定PSE肉发生率为10.2%,位于已有研究范围内。朱良齐等[18]研究季节、运输距离和待宰时间对PSE猪肉发生率的影响,以pH45 min≤5.8为判定标准,PSE肉发生率春季较低(2.53%),夏季较高(15.35%);Guàrdia等[19]以电导率>6为判断标准,发现皮肤未受损猪的PSE猪肉发生率为14.2%,皮肤有擦伤猪为21.8%;Trevisan等[4]测定1 038 头猪胴体的pH45 min值,利用pH45 min≤5.8的判定标准,得出PSE肉发生率为19.17%;Qu Daofeng等[20]测定200 头杜长大猪的肉质,利用pH45 min≤6.0、L*≥60和电导率≥6.0为评判标准,得出PSE发生率为7.5%。可以看出,选择的衡量指标及衡量指标的数量影响PSE肉发生率的判定,从而影响不同研究结果之间的比较。
肌肉pH值变化的速率和程度直接影响其他肉品质性状。宰后pH值的下降程度和最终pH值的大小决定了蛋白质的结构和功能,从而影响肌肉的肉色和保水性。本研究与已有研究一致,不同肉质指标之间存在相关性[21-24]。而且本研究发现PSE猪肉个体的肉质性状相关系数与正常肉个体不同,PSE猪肉个体肉质指标间的相关系数更高,达到显著的指标更多。本研究分析了PSE肉个体肉质性状间的相关系数,揭示了PSE肉个体肉质性状间独特的相关性。
3.2 血常规指标与PSE肉的相关性
无论是屠宰时现场判定PSE肉还是基于pH值、L*、电导率、滴水损失率和剪切力等肉质指标进行判定,都只对屠宰的猪有效,不能在屠宰前检测PSE肉,寻找能在屠宰前检测PSE肉的遗传标记和生理指标一直是肉质研究关注的重点。PSE肉的发生率与屠宰前的急性应激有关[6-7],而血液血细胞和生化指标可以灵敏、准确地反映猪的状态,是屠宰前应激的良好指标[22,25]。本研究发现PSE肉样本的白细胞、红细胞和血小板与正常肉样本虽无显著差异(P>0.05),但PSE肉样本的WBC(24.12×109 个/L)比正常肉样本(22.06×109 个/L)高9.34%,PLT(382.47×109 个/L)比正常肉样本(415.83×109 个/L)低8.02%。白细胞是血液中一种非常重要的血细胞,不同种类的白细胞以不同的方式参与机体的防御反应。本研究只检测了白细胞总数,没有区分其中嗜中性粒细胞、淋巴细胞、嗜酸性粒细胞、嗜碱性粒细胞和单核细胞。下一步白细胞对PSE肉的影响研究中应细分白细胞类群,分析各类白细胞对PSE肉的影响。血小板的主要功能是凝血和止血作用,修补破损的血管。血小板数降低可能与猪应激状态下肌肉受损及机体损伤修复作用增强有关。
3.3 血液生化指标与PSE肉的相关性
已有研究表明,猪对屠宰前应激的生理反应与血浆CK、LDH、AST、LAC和GLU的变化有关。细胞酶CK、LDH和AST通常被用作应激指标[26],LAC和GLU不仅被用作应激水平衡量指标,而且与肉质显著相关。本研究发现PSE肉样本的AST、CK、LDH、LAC、GLU含量显著高于正常肉样本(P<0.05),这与已有研究[27-29]一致。而且,本研究还发现PSE肉样本的尿素、CR含量显著高于正常肉样本(P<0.05)。尿素是氮代谢的最终代谢产物,CR是肌肉组织中肌酸代谢的终产物,PSE肉样本的尿素、CR含量显著升高可能与应激状态下代谢增强有关。
Qu Daofeng等[20]基于PCA发现利用CK、LDH、AST、GLU和LAC可区分PSE肉和正常肉个体,是屠宰前检测PSE肉的良好指标。本研究参考Qu Daofeng等[20]开展19 个血液生化指标的PCA,发现前2 个主成分只占到总方差的35.6%,不足以分离PSE肉和正常肉个体,与Qu Daofeng等[20]的研究结果不一致。徐新萍[30]基于反映应激程度的14 种血清生理生化指标,利用PCA和反向传播神经网络(back propagation neural network,BPNN)对不同屠宰方式的血清样本进行分类预测,揭示PCA和BPNN分类预测正确率,但没有指出对PSE肉预测的准确率。进一步检索,其他利用CK、LDH、AST、GLU和LAC区分PSE肉和正常肉个体的研究仍较少,故本研究结果表明,利用CK、LDH、AST、GLU和LAC等作为区分PSE肉和正常肉个体的指标还有待进一步验证。
4 结 论
本研究392 头杜长大实验猪中,39 头猪屠宰时表现为PSE肉症状,40 头猪的肉质指标判定为PSE肉,其中33 头猪(82.5%)的肉质指标和现场表型判定结果相一致,表明部分个体肉质指标判定和现场观察表型判定不一致,在PSE肉研究中选择实验样本时需要特别注意。PSE肉个体与正常肉个体的肉质指标存在显著差异(P<0.05),血常规指标均无显著差异(P>0.05),PSE肉个体的部分糖代谢、肾功能、肝功能和心血管功能方面血液生化指标显著高于正常肉样本(P<0.05)。本研究揭示了PSE肉个体和正常肉个体在胴体、肉品质和血液生化指标方面的差别,为探究PSE肉形成机理、筛选PSE肉血液标记物等研究提供科学参考依据。
[1] YU T Y, TIAN X K, LI D, et al.Transcriptome, proteome and metabolome analysis provide insights on fat deposition and meat quality in pig[J].Food Research International, 2023, 166: 112550.DOI:10.1016/j.foodres.2023.112550.
[2] HUANG Y Z, ZHOU L S, ZHANG J J, et al.A large-scale comparison of meat quality and intramuscular fatty acid composition among three Chinese indigenous pig breeds[J].Meat Science, 2020, 168: 108182.DOI:10.1016/j.meatsci.2020.108182.
[3] XU Z Q, SHAO Y G, XU H, et al.Transcriptome-based analysis of early post-mortem formation of pale, soft, and exudative(PSE) pork[J].Meat Science, 2022, 194: 108962.DOI:10.1016/j.meatsci.2022.108962.
[4] TREVISAN L, BRUM J S.Incidence of pale, soft and exudative (PSE)pork meat in reason of extrinsic stress factors[J].Anais Da Academia Brasileira De Ciencias, 2020, 92(3): e20190086.DOI:10.1590/0001-3765202020190086.
[5] LI S S, DIAO X Y, MAO X R, et al.The red, firm, non-exudative and pale, soft, exudative pork have different in vitro digestive properties of protein[J].Meat Science, 2023, 198: 109110.DOI:10.1016/j.meatsci.2023.109110.
[6] LIU R, LI K Y, YANG T Y, et al.Exploring the role of protein DJ-1 in quality of pale, soft and exudative (PSE) and red, firm and nonexudative (RFN) pork during post-mortem aging[J].Food Chemistry,2023, 398: 133817.DOI:10.1016/j.foodchem.2022.133817.
[7] GRANDIN T.Cattle and pigs are easy to move and handle will have less preslaughter stress[J].Foods, 2021, 10(11): 2583.DOI:10.3390/foods10112583.
[8] ČOBANOVIĆ N, STAJKOVIĆ S, BLAGOJEVIĆ B, et al.The effects of season on health, welfare, and carcass and meat quality of slaughter pigs[J].International Journal of Biometeorology, 2020, 64(11): 1899-1909.DOI:10.1007/s00484-020-01977-y.
[9] TWELOUW E M C, PICARD B, DEISS V, et al.Understanding the determination of meat quality using biochemical characteristics of the muscle: stress at slaughter and other missing keys[J].Foods, 2021,10(1): 84.DOI:10.3390/foods10010084.
[10] LIU Y, LIU Y, MA T, et al.A splicing mutation in PHKG1 decreased its expression in skeletal muscle and caused PSE meat in Duroc ×Luchuan crossbred pigs[J].Animal Genetics, 2019, 50(4): 395-398.DOI:10.1111/age.12807.
[11] CHEN Y L, LONERGAN S, LIM K S, et al.Plasma protein levels of young healthy pigs as indicators of disease resilience[J].Journal of Animal Science, 2023, 101: skad014.DOI:10.1093/jas/skad014.
[12] 陶新, 邓波, 袁启志, 等.饲粮中添加氨基酸络合铁对生长肥育猪生长性能、血液指标、肝脏铁沉积和肉质性状的影响[J].动物营养学报, 2023, 35(8): 4932-4945.DOI:10.12418/CJAN2023.458.
[13] 李平会, 蒲广, 王中宇, 等.日粮纤维水平对梅山猪血液和肠道免疫指标的影响及其机理初步解析[J].畜牧兽医学报, 2023, 54(10):4260-4277.DOI:10.11843/i.issn.0366-6964.2023.10.023.
[14] 农业部.瘦肉型猪胴体性状测定技术规范: NY/T 825—2004[S].北京: 中国农业出版社, 2004: 2.
[15] 农业部.猪肉品质测定技术规程: NY/T 821—2019[S].北京: 中国农业出版社, 2019: 2-8.
[16] LUO S, CHEN Y, SU X, et al.Mmeta: an R package for multivariate meta-analysis[J].Journal of Statistical Software, 2014, 56(11): 11.
[17] ŠLENKER M, KOUTECKÝ P, MARHOLD K.MorphoTools2: an R package for multivariate morphometric analysis[J].Bioinformatics,2022, 38(10): 2954-2955.DOI:10.1093/bioinformatics/btac173.
[18] 朱良齐, 周光宏, 车海栋, 等.季节、运输距离和待宰时间对PSE猪肉发生率的影响[J].肉类工业, 2015(10): 35-38; 42.DOI:10.3969/j.issn.1008-5467.2015.10.016.
[19] GUÀRDIA M D, ESTANY J, BALASCH S, et al.Risk assessment of skin damage due to pre-slaughter conditions and RYR1 gene in pigs[J].Meat Science, 2009, 81(4): 745-751.DOI:10.1016/j.meatsci.2008.11.020.
[20] QU D F, ZHOU X, YANG F, et al.Development of class model based on blood biochemical parameters as a diagnostic tool of PSE meat[J].Meat Science, 2017, 128: 24-29.DOI:10.1016/j.meatsci.2017.01.012.
[21] 廖印长, 高虎, 张跃博, 等.宁乡猪宰后pH和肉色性状的全基因组关联分析[J].中国畜牧杂志, 2021, 57(增刊1): 174-181.DOI:10.19556/j.0258-7033.20210630-08.
[22] SHEN L Y, MA J F, ZHOU H D, et al.Plasma metabolomic profiling reveals preliminary biomarkers of pork quality based on pH value[J].Foods, 2022, 11(24): 4005.DOI:10.3390/foods11244005.
[23] BEE G, ANDERSON A L, LONERGAN S M, et al.Rate and extent of pH decline affect proteolysis of cytoskeletal proteins and waterholding capacity in pork[J].Meat Science, 2007, 76(2): 359-365.DOI:10.1016/j.meatsci.2006.12.004.
[24] SCHÄFER A, ROSENVOLD K, PURSLOW P P, et al.Physiological and structural events post mortem of importance for drip loss in pork[J].Meat Science, 2002, 61(4): 355-366.DOI:10.1016/s0309-1740(01)00205-4.
[25] ČOBANOVIĆ N, STANKOVIĆ S, DIMITRIJEVIĆ M, et al.Identifying physiological stress biomarkers for prediction of pork quality variation[J].Animals, 2020, 10(4): 614.DOI:10.3390/ani10040614.
[26] FÀBREGA E, MANTECA X, FONT J, et al.Effects of halothane gene and pre-slaughter treatment on meat quality and welfare from two pig crosses[J].Meat Science, 2002, 62(4): 463-472.DOI:10.1016/s0309-1740(02)00040-2.
[27] CHOE J H, CHOI M H, RYU Y C, et al.Estimation of pork quality traits using exsanguination blood and postmortem muscle metabolites[J].Asian-Australasian Journal of Animal Sciences, 2015,28(6): 862-869.DOI:10.5713/ajas.14.0768.
[28] OGAWA N N, SILVA G L, DA COSTA BARBON A P A, et al.Animal welfare assessment and meat quality through assessment of stress biomarkers in fattening pigs with and without visible damage during slaughter[J].Animals, 2024, 14(5): 700.DOI:10.3390/ani14050700.
[29] XU Z Q, SHAO Y G, LIU G J, et al.Proteomics analysis as an approach to understand the formation of pale, soft, and exudative(PSE) pork[J].Meat Science, 2021, 177: 108353.DOI:10.1016/j.meatsci.2020.108353.
[30] 徐新萍.不同屠宰应激对生猪血液生化特性及肉质的影响[D].杭州: 浙江工商大学, 2015: 34-40.