乳液是由两相混合成的不稳定体系,两相通常是水相和油相,它们之间互不相溶,通过强烈的机械作用力使其中一相均匀分散到另一相中。该不稳定体系随着时间推移逐渐发生分离,研究发现在乳液中加入两亲性的小分子化合物或固体颗粒可以延长乳液稳定的时间。这些小分子化合物和固体颗粒被称为乳化剂。其中由固体颗粒作为乳化剂制备的乳液也被称为Pickering乳液。与传统乳液相比,Pickering乳液具有更好的生物相容性,对外界影响不敏感。固体颗粒一般分为有机和无机2 种,而在食品领域通常使用有机固体颗粒,如蛋白质[1]、多糖[2]或蛋白质-多糖复合物[3]来稳定乳液。这些成分具有安全性高、稳定性好的特点。
肌肉中蛋白质主要分为3 种,分别为肌原纤维蛋白(myofibrillar protein,MP)、肌浆蛋白和结缔组织蛋白,其中MP是肌肉蛋白质中含量最多的蛋白,占肌肉蛋白质的50%~56%[4]。它是优质动物蛋白,可以提供比植物蛋白更加全面的氨基酸[5]。食用肉制品可以补充肉类蛋白的摄入,但一些原因导致吞咽困难或无法消化肉制品的人群容易缺乏肉制品中的营养素。出于这些考虑,将MP加入到饮料[6]、蛋白粉[7]、固体奶片[8]等制品中作为一种营养补充剂,成为MP用途之一。但MP在加热时趋向聚集[9],这也给应用MP造成困难。
提取MP的方法比较简单,基本原理是在低离子强度溶液中去除溶解的肌浆蛋白,在高离子强度溶液中MP发生溶解,去除不溶的结缔组织,经过滤、离心、沉淀即可获得纯度较高的MP。MP和肌浆蛋白均具有乳化能力,能湿润油相和水相,可以用于制备Pickering乳液,但研究发现,MP的竞争吸附能力较强[10]。基于MP具有天然无毒、营养价值高[5]、制备方法简单[11]、乳化性强[12]等优点,MP稳定的Pickering乳液成为当前研究热点之一。Pickering乳液在食品中有很多用途,如包埋递送生物活性物质[13-14]、代替动物脂肪[15-16]及作为3D打印食品的原材料[17-18]等。但Pickering乳液本身随时间延长会发生相分离,Pickering乳液稳定性制约其在食品、药品、化妆品等行业的使用。
本文综述MP作为乳化剂稳定Pickering乳液的作用机理、影响因素,以及在MP稳定的Pickering乳液中加入多糖、蛋白水解物、氨基酸和酚类物质等对乳液的影响。旨在为更加稳定和具有更多功能的Pickering乳液的制备提供一定的参考。
1 稳定机理
1.1 Pickering乳液稳定机理
Pickering乳液主要由水相、油相、固体粒子乳化剂3 个部分组成。由于近年来对于食品安全的重视,天然可食用的固体粒子乳化剂成为主要研究热点。稳定Pickering乳液的乳化剂通过物理或化学处理的方法分散成几微米甚至几纳米的小颗粒。Pickering乳液的乳化剂颗粒存在形式不同,蛋白质包括蛋白质纳米粒子、微凝胶、纤维状蛋白等[19],多糖存在天然多糖、改性多糖及多糖-多糖复合物等形式[20]。蛋白质-多糖结合后有蛋白质-多糖共价复合物、蛋白质-多糖非共价复合物等存在形式[21]。其中蛋白质-多糖共价复合物一般通过蛋白质与多糖偶联,通过美拉德反应形成,蛋白质-多糖非共价复合物则常常通过物理作用(静电相互作用、空间排斥、疏水相互作用、氢键等)连接[22]。颗粒稳定Pickering乳液的理论有3 种:一是界面膜理论,即小颗粒不可逆吸附在油-水界面上,形成一层界面膜,这种界面膜通过阻隔分散相之间接触,增加空间位阻,使乳液稳定[23];二是三维黏弹性粒子网络理论,即在分散相液滴表面和连续相中都存在乳化剂,通过范德华力作用形成三维网络结构,将分散相固定在网络中,从而保持乳液稳定[24];三是消耗稳定,即乳液连续相中存在非吸附聚合物,以渗透压来促进乳滴和颗粒絮凝[19]。Pickering乳液颗粒存在形式示意图如图1所示。
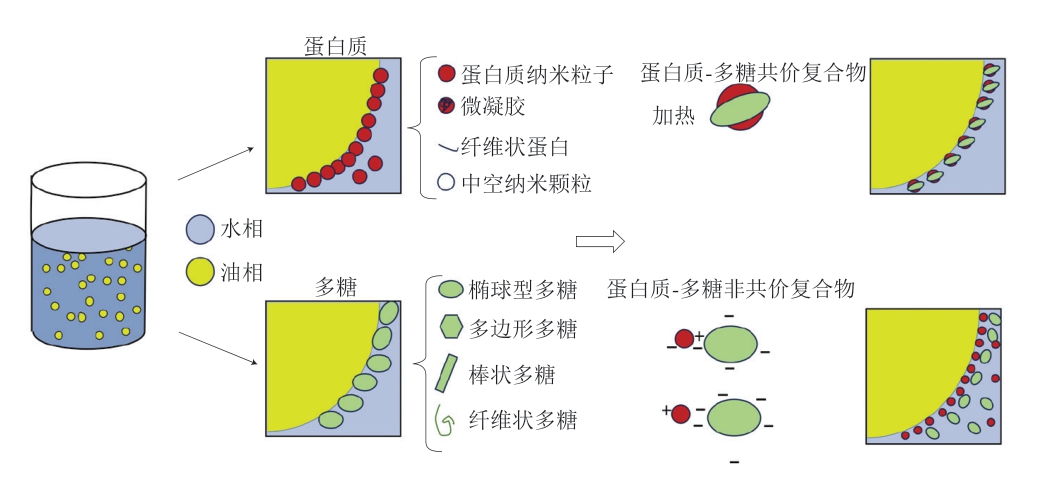
图1 Pickering乳液颗粒存在形式
Fig.1 Existing forms of particles in Pickering emulsions
1.2 MP稳定的Pickering乳液稳定机理
天然的MP很难溶解在水中形成Pickering乳液,所以一般要进行改性,使蛋白质增溶、减小颗粒尺寸等。可以在制备乳液之前单独改性(磷酸化、pH值迁移、糖基化等),也可以制备乳液时使用物理方法(超声处理、高压处理、高速剪切等),在乳液形成的同时进行改性。蛋白质的二、三、四级结构在改性处理过程中会发生变化,一般来说,由于氢键断裂二级结构中,α-螺旋减少,β-折叠和β-转角增加,代表蛋白质的结构更加无序化,这也导致MP结构更加灵活。巯基则在MP内部存在,通过氧化形成二硫键,当二硫键被破坏,表现为MP的活性巯基含量增加、结构展开,其次,疏水相互作用是蛋白质三级结构的主要作用力,表面疏水性增加代表疏水氨基酸暴露,原本在蛋白质内部的疏水基团随着蛋白质的展开而暴露在表面。MP主要由肌球蛋白和肌动蛋白组成,在溶胀作用下,MP原本的规则结构被破坏,解离成肌动蛋白、原肌球蛋白、肌球蛋白重链和肌球蛋白轻链等。稳定Pickering乳液主要依靠肌动蛋白和肌球蛋白,其中肌动蛋白以二硫键交联成聚集体吸附在界面上[25],肌球蛋白的蛋白重链则伸向油相,蛋白轻链伸向水相[26],通过亲水-亲油平衡固定在油-水界面上形成界面膜。MP稳定的Pickering乳液稳定机理如图2所示。
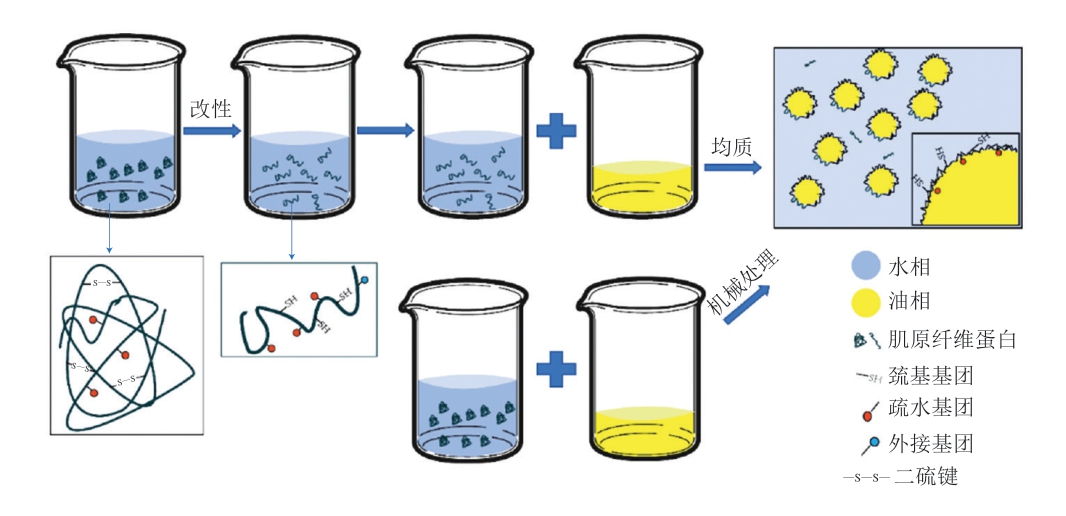
图2 MP稳定的Pickering乳液稳定机理
Fig.2 Mechanism for MP stabilization of Pickering emulsions
在形成Pickering乳液的过程中,MP自发向油-水界面移动,聚集在分散相表面,形成一层界面蛋白膜。通过静电斥力、空间位阻等作用阻止分散相间聚集,在这一过程中受到静电斥力、两相湿润性、蛋白尺寸、表面疏水性及蛋白质二级结构等影响。MP带有电荷,这会增加液滴间的静电斥力[27]。静电斥力一般用Zeta电位表示,当pH值大于MP等电点,Zeta电位呈负值,并在一定范围内绝对值越大,乳液液滴间越难以相互聚集,乳液稳定性越高[28]。MP是具有两亲性的蛋白质,在水相和油相中均表现出一定的湿润性,湿润性一般用三相接触角来表示,接触角90°左右时,乳液稳定性最高。接触角过高或过低代表过于亲油或亲水,平衡被打破,这会使MP无法在界面上稳定。MP尺寸越小,越容易迁移到界面上,并发生蛋白质-蛋白质间的交联包裹分散相液滴,所以不同的处理方法目的都是解聚MP,从而使蛋白质的二、三、四级结构发生变化,MP颗粒减小、溶解度增加,一般来说,乳化剂需要小于乳液液滴至少1 个数量级。乳液液滴的粒径分布是评价Pickering乳液稳定性的一个重要指标,通常粒径范围窄,粒径分布峰值在颗粒尺寸较小的位置,代表乳液具有良好的乳化能力。乳化活性指数(emulsion activity index,EAI)是指MP在界面上被吸附的能力,由蛋白质-蛋白质和蛋白质-脂质相互作用决定[29]。乳化稳定性指数(emulsion stability index,ESI)是指乳液贮藏一定时间后MP停留在油-水界面上的能力[30]。EAI和ESI是综合体现乳液乳化能力的指标,与蛋白质结构变化、疏水作用和乳液粒径分布等密切相关。
2 MP稳定的Pickering乳液影响因素
MP是一种无毒、经济且提取效率高的固体粒子,使用MP稳定Pickering乳液具有包埋活性成分、替代氢化植物油等应用。影响MP稳定Pickering乳液的因素有很多,对MP乳液的影响也各不相同,如MP的浓度和油相类型影响蛋白质迁移到油-水界面的能力和速率,但不会改变MP的二级结构,乳液的原料肉预处理方式、离子强度、pH值和制备方法不同对MP的展开状态、溶解性产生影响(表1)。
表1 MP稳定的Pickering乳液影响因素
Table 1 Factors affecting MP-stabilized Pickering emulsions
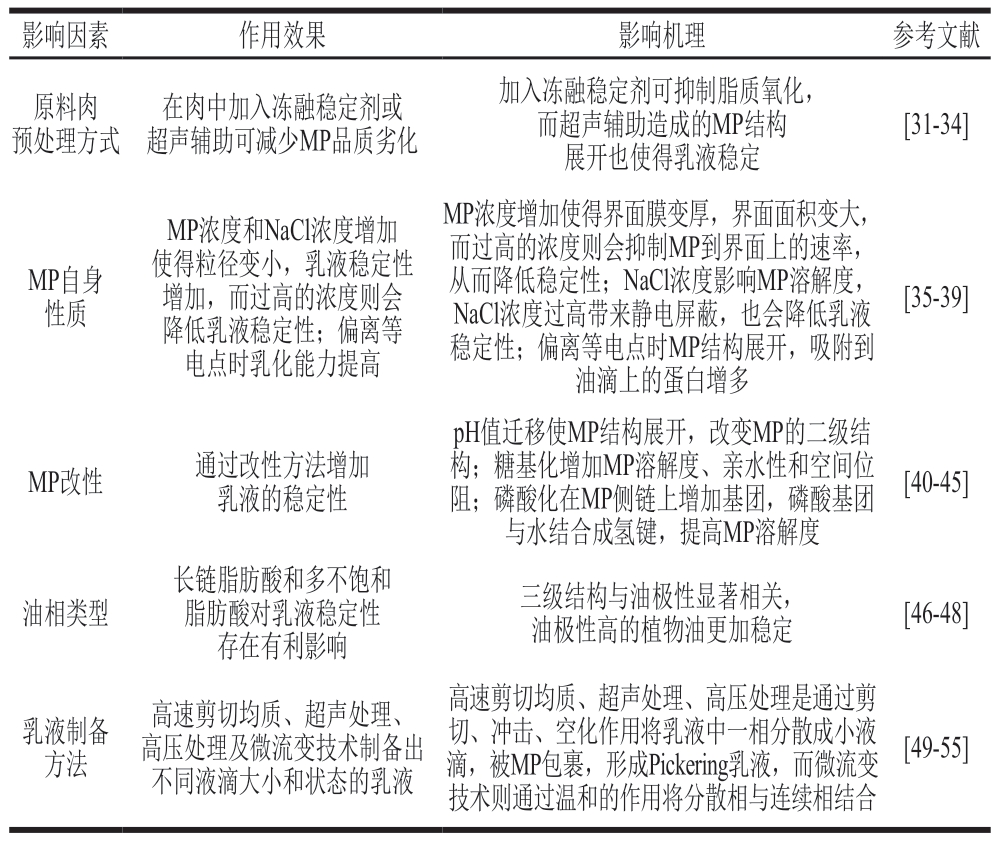
对于MP稳定的Pickering乳液,为保证MP的溶解度,通常需要加入NaCl,大量研究表明,加入0.6 mol/L的NaCl可达到最高溶解度[37,56-57]。但根据《中国居民膳食指南》建议,成年人每日摄入的食盐不应超过5 g。为了扩大MP稳定的Pickering乳液的应用范围,减少NaCl的用量成为研究热点[58-59],通常将MP改性或使用其他盐类以减少NaCl的添加。
2.1 原料肉预处理方式对Pickering乳液稳定性的影响
肉类屠宰后到使用前,为防止腐败变质经常使用腌制或冷冻的方法保存,冷冻一直是保持肉制品新鲜的主要方式,在MP提取前,不同原料肉通常会经过冷冻,甚至会反复冻融。有研究发现,冷冻对MP结构产生影响,使其更容易氧化变性[60],从而溶解度降低,蛋白质聚集,对乳液的稳定性产生不利影响。Sun Qinxiu等[33]对鲤鱼肉进行冻结处理,并设置新鲜鱼肉作为对照组,发现冷冻后的鱼肉制成的乳液EAI、Zeta电位等均低于对照组,说明冷冻造成的蛋白质变性会影响乳液的稳定性。
为减少原料肉冷冻过程中导致的MP变性最终对乳液产生的不利影响,Chen Hongsheng等[31]使用主要成分为蔗糖和山梨醇的冻融稳定剂减少反复冻融过程中MP的功能特性劣化,经过冻融的MP发生聚集,溶解度降低,且MP氧化程度加重,这些都对MP乳液的稳定性产生不利影响,而冻融稳定剂的加入抑制羰基形成和脂质氧化,并对蛋白质变性具有保护作用。冰结构蛋白也是一种冻融稳定剂,加入冰结构蛋白再进行原料冷冻,提取制成MP乳液后,有效抑制了乳化性能降低[32]。超声辅助冻结或超声辅助解冻均可以改善由低温造成的蛋白质功能丧失和乳液失稳现象。Sun Qinxiu等[33]还研究了冻结方法(空气冷冻、浸泡冷冻、超声辅助冷冻)对MP乳液稳定性的影响,超声辅助冷冻方法处理的鱼肉解冻后制成的MP乳液,比其他2 种方法得到的MP乳液液滴尺寸显著减小,并且超声功率为175 W时能有效改善冷冻鱼肉的乳化性。Zhang Chao等[34]对比鸡肉MP空气解冻、水解冻和超声辅助解冻效果,发现用300 W超声辅助浸泡进行解冻,MP溶解度最高,乳液的液滴细小且均匀,这可能是由于超声导致蛋白结构展开,更容易吸附在油滴表面。
2.2 MP自身性质对Pickering乳液稳定性的影响
2.2.1 MP含量对Pickering乳液稳定性的影响
MP含量是乳液能否稳定的重要因素,在一定范围内随着浓度增加,乳液的稳定性也会增加[61]。较高的MP含量可以负载更多的分散相,并有一部分存在于连续相中,提高连续相的黏度[38]。Pei Zhisheng等[35]研究罗非鱼MP乳液凝胶,发现在MP含量0.50%时不能完全乳化乳液,而1.25%~2.00%时乳液凝胶具有高弹性模量、较好的热稳定性和冻融稳定性。Rajasekaran等[36]研究不同质量浓度(15~45 mg/mL)鱼MP制成的乳液,发现15 mg/mL的MP乳液EAI最高,而45 mg/mL的MP乳液ESI最高,这可能是由于MP质量浓度不同,质量浓度增加时蛋白扩散速率可能会变慢,蛋白不能快速展开并迁移到界面上,但较高的MP质量浓度(45 mg/mL)制成的乳液贮藏稳定性较高。
2.2.2 盐类对Pickering乳液稳定性的影响
MP是盐溶性蛋白质,在使用时常常加入0.6 mol/L的NaCl溶液,以提高MP溶解程度。但NaCl浓度过高可能会产生静电屏蔽作用,从而导致乳液更容易絮凝。当溶解度较低时,乳液中MP的界面吸附不足,乳液稳定性较差。随着NaCl浓度增加,MP上负电荷增多,静电斥力变大,这也提高了MP的溶胀作用,促进MP的展开,暴露出疏水基团。Ren Zhongyang等[62]研究不同NaCl浓度(0~1 mol/L)对带鱼MP乳化性能的影响也发现,随着NaCl浓度从0 mol/L升高到0.6 mol/L,MP中的α-螺旋转变为β-折叠,暴露的疏水基团增多,且在0.6 mol/L时制备的MP乳液稳定性更好,但NaCl浓度为0.8~1.0 mol/L时,乳液液滴尺寸和乳析指数均有升高趋势。而Zhu Chaozhi等[39]发现,0.6 mol/L NaCl浓度下的猪肉MP乳液溶解度高达74.5%,而无盐条件下几乎不溶解,随着盐浓度增加,EAI和ESI均逐步提高,而与Ren Zhongyang等[62]的研究不同的是,猪肉MP的二级结构没有显著变化,因此NaCl浓度对乳液影响的具体机理还应该进一步研究。
在最近的研究中,用其他盐类取代N a C l,以减少钠盐的使用是一个研究热点[63-64],研究表明,碳酸氢钠可以在一定程度上代替NaCl的作用,添加0.8 g/100 mL NaCl和0.4 g/100 mL碳酸氢钠的蛋白溶液与添加2 g/100 mL NaCl的蛋白溶液相比,其Zeta电位、粒径显著增加,蛋白质展开程度增加[64]。碳酸氢钠可以提高PSE(pale,soft and exudative)肉中MP的乳化性能,在加入碳酸氢钠后PSE肉的溶解度显著增加,说明蛋白质的聚集程度降低,颗粒尺寸减小,而乳液EAI和ESI随着碳酸氢钠添加量从0增加到6 g/kg而随之增加,且乳液的稳定性在碳酸氢钠添加量为6 g/kg时最高[65]。也有研究使用KCl、MgCl2、CaCl2取代一部分钠盐溶解MP,发现取代0.2 mol/L的钠盐,MP仍保持较高的展开程度和结构变化[66]。Wang Jiafei等[67]研究表明,加入Na+或K+对MP稳定的Pickering乳液稳定性的提高作用比加入Mg2+更显著。
2.2.3 pH值对Pickering乳液稳定性的影响
MP的乳化性能会受到自身溶解度的影响,pH值不同,溶解行为不同,此外,pH值还会改变MP的二、三级结构,对乳液造成不同的综合影响。pH值<等电点时,溶解度随着盐浓度的增加而降低,pH值≥等电点时,在一定的盐浓度(0.2~0.8 mol/L)下,溶解度随之增加[68],从而MP更多吸附在乳液的油-水界面上,对乳液产生影响。MP通过pH值改性,可以提高乳液的吸附能力和乳化性能。Li Liyuan等[59]研究pH值(7~12)对PSE鸡肉MP功能特性的影响,发现随着pH值增加,EAI和溶解性增加,表现出蛋白质在油-水界面上吸附能力提高,说明提高pH值可以显著改善乳液的乳化性能,同时MP的疏水基团被更多暴露,α-螺旋减少,说明蛋白质结构发生改变,可以形成更厚的界面膜,包裹在油滴表面,原子力显微镜观察也发现,随着pH值增加,MP逐渐变为球状。
2.3 MP改性对Pickering乳液稳定性的影响
2.3.1 pH值迁移对Pickering乳液稳定性的影响
调整pH值可以显著提高MP的乳化能力,但极端pH值很难用于具体生产。Lu Junmeng等[41]先将MP调整到pH 11~12,放置一定时间后再将pH值调整到7,这样处理后的MP用于制备乳液,乳液吸附蛋白比率增加,蛋白界面膜更厚,从而乳液稳定性提高。
2.3.2 糖基化反应对Pickering乳液稳定性的影响
糖基化是在蛋白质上偶联碳水化合物的过程,MP通过糖基化后功能性质改善,如溶解性[43]、热稳定性和抗氧化性[42]等。葡聚糖是由单体葡萄糖聚合而成的多糖,Xu Yujuan等[44]通过MP和葡聚糖之间的糖基化反应,改变和展开MP的构象,在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophe resis,SDS-PAGE)中测得分子质量更大的条带,说明糖基化产物形成,处理后的MP活性巯基含量和浊度均有所提高,制成的乳液中EAI和ESI随着糖基化程度增加而增加。Li Yali等[40]将MP和葡萄糖混合,循环4 次完成连续糖基化反应,连续糖基化的蛋白质溶解性更高,pH值为5~11范围内均显著高于天然蛋白质,偶联的碳水化合物增加了蛋白质的亲水性,葡萄糖分子接枝增加了MP乳液的空间位阻,大大延缓了乳液分层时间,在pH=11的条件下,48 h后乳液才出现分层。
2.3.3 磷酸化改性对Pickering乳液稳定性的影响
磷酸盐的加入可以改善蛋白质的功能性质,通过与蛋白质结合,增加了蛋白质含有的负电荷,让蛋白质更易展开,并对乳液稳定性产生积极影响。Chen Jinyu等[58]主要研究加入焦磷酸钠对MP乳液的影响,磷酸盐可以与蛋白质侧链上的氨基或羟基发生反应,这种结合提高了乳液凝胶的强度,但pH值为8~9时,磷酸盐过度结合,蛋白质静电斥力过高,从而乳液结构失去稳定性,同时研究表明,磷酸化位点主要在丝氨酸残基、苏氨酸残基和酪氨酸残基上。Jia Beibei等[63]对MP乳液进行磷酸化处理,通过紫外吸收光谱发现,焦磷酸钠和三聚磷酸钠的加入促进了酪氨酸和色氨酸的暴露,说明蛋白质结构发生膨胀和展开,特别是加入0.03 mol/L KCl后,磷酸盐和KCl结合制成的凝胶和乳液具有更高的凝胶强度和乳化活性。夏立志等[45]也发现了类似结果。
2.3.4 超声MP对Pickering乳液稳定性的影响
超声处理MP是制备精细乳液的方法,是现在较常见的蛋白改性和乳液制备方法[69-70]。其原理是通过空化作用产生极端物理条件及机械作用,将MP破裂,并增加其溶解性。Li Jiao等[71]使用400 W超声波处理虾MP,测得MP二、三级结构改变,螺旋结构向折叠结构改变,暴露出巯基,乳液EAI和ESI均因超声作用显著增加,而随着超声时间延长(5~10 min),EAI和ESI差异不显著,说明超声时间对乳液的影响较小。PSE鸡肉的MP也可以在超声作用下得到改善,有效提高其乳化能力[72]。
2.4 油相类型对Pickering乳液稳定性的影响
油相作为Pickering乳液主要组成成分之一,根据来源不同,油脂脂肪酸组成、油极性和物理状态等也会不同,这些都会影响乳液的稳定性。Zheng Jinyue等[73]考察大豆油、黄油和猪油对MP乳液的Zeta电位、液滴尺寸等的影响,发现大豆油MP乳液的Zeta电位绝对值显著高于黄油和猪油制成的乳液,液滴尺寸也更小,造成大豆油MP乳液稳定性高的原因可能是长链脂肪酸和多不饱和脂肪酸影响MP形成更厚的界面膜。动物油脂和植物油制成的乳液之间也有显著差异。Kim等[47]研究玉米油和多种动物油脂(猪油、鸡油、牛油、鸭油)作为油相的MP乳液的稳定性,结果发现,玉米油MP乳液的稳定性高于动物油脂MP乳液,鸡油制成的乳液次之。而不同植物油对乳液的油-水界面张力也会存在差异。Zhang Weiyi等[48]对5 种油极性不同的植物油制成的MP乳液进行分析,研究表明,肌原纤维的二级结构没有受到油极性的影响,三级结构与油极性显著相关,根据界面张力测得油极性最高的为棉籽油,之后依次为花生油>橄榄油>芝麻油≈大豆油,油极性会影响蛋白吸附,极性较高的油具有较高的界面张力,油极性高的植物油不易受到不稳定因素的影响,因此乳液物理稳定性较高,但油极性过高也会使界面膜坍塌,乳液失稳,所以选择中等极性的油(橄榄油和花生油)可能更容易在实际生产中应用。对油脂进行甘油化和精制也可以提高乳液的乳化性能,以猪油作为对照组,将甘油化处理的猪油和甘油化后精制的猪油分别制成MP乳液,发现甘油化和精制均可以提高乳液的乳化性能[46]。
2.5 乳液制备方法对Pickering乳液稳定性的影响
乳液是由水相和油相混合成的不稳定体系,由于两相之间不相溶,所以为了稳定乳液通常需要强烈的机械作用。常用的乳液制备方法有均质处理、超声处理、高压处理和微流控技术等。
2.5.1 高速剪切均质处理
高速剪切均质是食品行业中用于混合液体、生产饮料等的常用技术,随着剪切速率的增加,高速剪切会产生空化效应,但剪切力过高也会影响乳液的稳定性,这可能是由于疏水基团过度暴露增加了液滴间相互聚集碰撞的概率[55]。Zhou Lei等[53]研究高速剪切均质对鸡肉MP结构的影响和乳液的稳定性,发现β-转角含量显著增加,α-螺旋含量显著减少,疏水基团暴露,转速为14 500 r/min时,MP乳液的EAI和ESI均达到最高,但在更高的转速下,乳化性能急剧下降,可能的原因是MP发生聚集。而Li Ruren等[49]使用高速剪切均质方法制备猪肉MP乳液,考察随着均质速率提高乳液稳定性的变化,发现在较高的转速下,乳液形成了更为细小的液滴,但在48 h内乳液不稳定并从乳液中析出大量水相,而较低转速(4 000~8 000 r/min)下乳液未析出水相,保持稳定,这与Zhou Lei等[53]的结论有所差异,高速剪切均质处理下的乳液,由于MP的来源不同,通过剪切导致MP聚集的转速可能不同,从而造成2 种MP在制备稳定乳液时的差异。
2.5.2 超声处理
在超声过程中,乳液中一相被分散成小液滴,被MP包裹,形成Pickering乳液。适度的超声处理可以使MP断裂,制成的乳液液滴粒径小,过度超声处理会导致蛋白质分子结构的改变,乳液粒径增大,稳定性降低。猪肉MP稳定的Pickering乳液,随着超声功率的提高,颗粒尺寸减小,在450 W时达到最小,但在600 W时有增加的趋势,可能是过度超声造成的,同时Zeta电位绝对值在450 W时达到最高,放置7 d后无水相析出,说明450 W超声功率下乳液稳定性良好[50]。在鸡肉MP稳定的Pickering乳液中也得到了类似结论,在超声功率为450 W时乳液液滴最小、贮藏稳定性最高[69]。
有研究者称,超声作用是将大颗粒乳液经空化和高剪切力作用破碎成小颗粒,但在乳液乳化时进行超声处理将导致水中蛋白质浓度降低,可能是由于疏水基团通过超声处理和脂肪颗粒更多结合在一起,作用力大于蛋白质分子和水溶液的结合力[54]。超声处理也可以协同多糖改善MP乳液的稳定性,提高MP与多糖的络合作用,采用葡聚糖[74]、瓜尔豆胶[75]、壳聚糖[76]和黄原胶[77]等与MP协同制备乳液,发现超声后MP-多糖乳液稳定性均有所提升。
单频超声存在均匀性差的问题,近年来提出了双频超声的做法,即采用2 种频次的超声波同时超声乳液,以提高超声的均匀性和稳定性,有研究表明,这种双频超声的乳液可以暴露出更多疏水基团,蛋白质展开加剧,在共聚焦显微镜中也观察到了粒径更小的液滴[70]。Chen Jiahui等[78]研究双频超声对MP稳定的乳液包埋黄芩素稳定性的影响,发现黄芩素与MP之间的氢键和疏水相互作用可能随着双频超声加强,提高了黄芩素的稳定性,而乳液的EAI和ESI也随着双频超声时间延长(0~6 min)而显著增加。
2.5.3 高压处理
高压均质处理是通过强烈的剪切、冲击和空化作用改变了蛋白质的结构,使MP更多溶解在液体中。但高压均质处理没有使多肽链断裂,SDS-PAGE分析发现,高压均质处理后的多肽链条带和未处理的条带差异不显著[79]。经过高压均质处理,蛋白质的二级结构发生变化[52],这种变化可以增大乳液的乳化性能。高压均质处理的鸡肉MP表现出比大豆分离蛋白和乳清分离蛋白更好的乳化能力,MP制成的乳液EAI和ESI均高于其他2 种蛋白制成的乳液,这可能是由于高压均质处理后MP暴露出更多的疏水基团[12]。80 MPa下处理MP制备乳液可能是较适宜的压力,Yu Cuiping等[80]研究贻贝MP稳定的乳液,在不同压力(0~100 MPa)下处理MP,发现随着压力的增大,溶解性提高,在80 MPa下乳液的EAI和ESI均最高,可能是MP二、三级结构的变化使MP展开,包裹住油滴。Wu Fan等[81]使用高压均质处理牡蛎MP,并用处理后的MP制备乳液,研究发现,80 MPa下处理MP制成的乳液有较高的乳化活性和Zeta电位,以及较窄的粒径分布,这些都说明高压处理可以提高乳液的稳定性,以作为潜在的蛋白质补充剂等应用。Cha Yue等[82]使用高压均质方法制备MP和卵磷脂复合乳液,经过80 MPa高压均质处理的MP溶解度提高到75.1%,复合乳液有较窄的粒径分布和较高的Zeta电位,表明高压均质可以有效提高乳液贮藏稳定性。
高压均质处理后蛋白质的功能特性与处理时间、处理次数和压力有关,有研究报道,在172.369 MPa下进行11 次循环高压处理后,蛋白质发生重新聚集,这可能是过度处理造成的[83]。而Lee等[84]在研究高压处理猪肉MP时发现,在120~150 MPa下,MP出现类似牛顿流体的现象,这同样不利于乳液的形成和稳定。
2.5.4 微流控技术
微流控技术是一种温和的处理方法,不依靠机械作用,而是通过精准的控制实现分散相和连续相的结合,从而制备乳液。Sun Yi等[51]研究微流控技术对MP凝胶颗粒稳定Pickering乳液的影响,使用150 MPa处理MP微凝胶颗粒,并设置MP对照组,研究发现,MP制成的乳液液滴尺寸和絮凝程度显著高于微流控技术制备的乳液,并且MP微凝胶颗粒可以更快扩散到油-水界面上,从这一点也可以发现,微流控技术可以提高乳液的乳化能力。
3 MP-多糖稳定的Pickering乳液
多糖的加入对MP稳定的Pickering乳液造成不同的影响,本节主要对蛋白质-多糖非共价复合物形式的Pickering乳液进行综述。根据多糖在乳液中的作用可分为具有乳化能力的多糖和无法单独稳定乳液的多糖,例如,纳米纤维素[85]可单独稳定乳液,而海藻酸钠等多糖在乳液中的主要作用在于增加黏度及空间位阻,减缓乳液的相分离速率[86]。
3.1 车前子壳对MP稳定的Pickering乳液的影响
车前子壳中含有丰富的可溶及不可溶膳食纤维,由于膳食纤维具有吸水性,Shao Ting等[87]研究发现,随着车前子壳的加入(0.1%~0.8%),样品接触角变小(88.7%~77.9%),这也说明亲水性提高也可能破坏了乳液的亲水-疏水平衡,从而不利于乳液稳定,但多糖具有的增稠作用也使得分散相难以聚集,对乳液的稳定性存在积极影响,因此随着车前子壳的加入,MP乳液保水能力和贮藏稳定性依然得到提升,同时也提高了乳液的假塑性,形成弱凝胶网络。
3.2 再生纤维素对MP稳定的Pickering乳液的影响
再生纤维素由微晶纤维素通过化学改性的方法生产得到[88]。Zhao Yinyu等[89]研究表明,加入再生纤维素有利于乳液的黏度增大,形成乳液凝胶状态,有利于延长乳液的贮藏时间,再生纤维素添加量为0.8%~1.2%时,乳液贮藏7 d期间保持稳定,但在添加量1.2%时,乳液粒径增加,这可能是黏度过大产生了团聚现象,使用电子显微镜和共聚焦显微镜观察,发现添加0.8%再生纤维素使乳液呈现三维网状结构,蛋白界面膜随着再生纤维素添加量增加而变厚。
3.3 海藻酸钠对MP稳定的Pickering乳液的影响
海藻酸钠是亲水性多糖,一般认为是通过增加水相黏度及空间位阻作用[90]来提高乳液的稳定性。Zhao Ning等[91]研究MP与海藻酸钠在中性pH值条件下的乳化性能,发现随着海藻酸钠的添加(0.1%~0.5%),乳液黏度系数逐渐增加,海藻酸钠的添加量为0.4%时,MP-海藻酸钠乳液的粒径分布最窄,乳析指数也最低,通过傅里叶变换红外光谱显示,可能是由于MP和海藻酸钠在氢键作用下形成了可溶性络合物,这种络合物阻止MP聚集并使乳液具有一定黏度,从而稳定性提高。薛山等[92]研究发现,加入海藻酸钠在一定范围内(0.25%~0.35%)增加Zeta电位绝对值,使得静电斥力增加,进而使乳液体系更稳定。
3.4 柑橘纤维对MP稳定的Pickering乳液的影响
柑橘纤维的主要成分是果胶和纤维素,并含有少量的蛋白质。Zhu Chenyan等[93]提取羊肉的MP和柑橘纤维共同稳定乳液,其中柑橘纤维被分为水溶性纤维和不溶性纤维来研究,发现水溶性纤维可以形成稳定乳液,随着水溶性纤维的添加(2.5%~10.0%,基于MP浓度),EAI和ESI在水溶性纤维添加量为5%时最高,但过多添加水溶性纤维(10%)也会造成聚集,而随着不溶性纤维的添加,EAI和ESI均成下降趋势,且液滴尺寸逐渐增大,可能是由于不溶性纤维吸水导致絮凝。
3.5 壳聚糖对MP稳定的Pickering乳液的影响
壳聚糖是一种阳离子多糖,由于其独特的结构,使得加入壳聚糖可以提高高内相乳液的稳定性,使其可以作为3D打印的原材料[94]。Huang Mingyuan等[95]对负载虾青素的MP和壳聚糖复合乳液进行研究,结果表明,随着壳聚糖的加入,MP与壳聚糖之间的静电相互作用减小了乳液的液滴粒径,提高了受到环境胁迫时保持稳定的能力,且虾青素得到了更好地保留。
4 其他食品组分对MP稳定的Pickering乳液的影响
4.1 蛋白水解物对MP稳定的Pickering乳液的影响
氧化会使食品品质劣变,在MP乳液中,蛋白质形成界面蛋白膜包裹油相,可以减缓脂肪氧化酸败的进程。但MP同样会随着时间或添加其他组分发生氧化。与对照组相比,氧化MP表面疏水性增加,制成乳液后乳液粒径显著增大,乳析指数显示了氧化对MP乳液的负面影响[29]。
蛋白水解物是一类潜在的抗氧化剂,通过酶水解可以很容易分散在乳液中,形成一层保护膜[96]。Li Yuanyuan等[97]使用玉米醇溶蛋白水解物与MP协同制备乳液,随着玉米醇溶蛋白水解物含量的增加(0~5 mg/mL),乳液中MP在界面上吸附量显著增加,说明乳液液滴表面形成较厚的界面膜,乳液中液滴尺寸逐渐减小,当水解物含量为5 mg/mL时,乳液一直到第5天才出现相分离,氧化速率减缓,但更高的水解物含量(10 mg/mL)也会降低界面膜上蛋白质的吸附。大豆水解物也是一种天然抗氧化剂,与MP协同制备乳液可以显著提高乳液的EAI和ESI,并改善MP乳液的抗氧化能力[98]。
4.2 氨基酸对MP稳定的Pickering乳液的影响
氨基酸的加入会改变蛋白结构,影响乳液pH值,以此提高乳液的稳定性。Li Linxian等[99]研究精氨酸和赖氨酸对乳液影响时,设置与加入氨基酸的乳液pH值一致的对照组,证明了氨基酸对乳液稳定性的积极贡献。组氨酸在之前的研究中被认为可以提高MP的溶解性,Guo Xinyun等[100]研究发现,L-组氨酸对低离子强度(0.15 mol/L NaCl)下MP稳定的乳液有显著影响,增加了MP的界面负载量,改变了MP的结构,使得MP乳液稳定性提高。该团队还研究L-精氨酸对MP乳液的影响,发现加入精氨酸可以有效减少α-螺旋,这可能表明MP发生解螺旋现象,并显著提高EAI,对液滴尺寸、乳析指数等均有积极影响[101]。
4.3 酚类化合物对MP稳定的Pickering乳液的影响
多酚作为抗氧化剂广泛应用于食品中,由于不同酚类物质与MP之间相互作用不同,对MP乳液也产生不同的影响[102]。首先,多酚对乳液的乳化性能很难产生正效应,Hu Yunpeng等[103]发现,茶多酚的加入可能会引起MP的聚集,EAI先降低后增加,可能是溶解性和表面疏水性降低导致的。Cheng Jingrong等[104]发现,桑多酚的加入导致乳液粒径增大,但放置30 d后乳液粒径反而减小,可能是由于桑多酚具有抗氧化能力和贮藏期间酚类物质的降解。在儿茶素-MP乳液中加入亚麻籽胶可以改善由于加入多酚而引起的乳液不稳定,可能的原因是亚麻籽胶提高了乳液的表观黏度[105]。其次,多酚的加入可以提高乳液的抗氧化性能,表没食子儿茶素没食子酸酯作为茶多酚中活性成分,Cao Yungang等[106]报道,该成分添加量500~1 000 mg/L时会显著降低乳液的EAI,而加入添加量50 mg/L则可以显著降低乳液复合凝胶的氧化速率,在7 d内硫代巴比妥酸反应物值几乎无上升。
5 结语
MP稳定的Pickering乳液具有很多优点,如稳定性良好、经济、对环境友好等。MP浓度、离子强度、pH值、制备方法,以及改性处理(磷酸化、糖基化等)等影响因素都会对MP稳定的Pickering乳液造成不同影响。具体是通过改变MP结构使其展开和断裂,包裹住分散相液滴,从而形成界面蛋白膜,稳定乳液。加入多糖则是起到增稠、吸水的作用,提高乳液黏度,进而增加空间位阻,提高乳液的稳定性。而蛋白水解物、酚类化合物的加入作为抗氧化剂可以提高乳液的氧化稳定性。以上策略提高了乳液的稳定性,使得MP稳定的Pickering乳液可以在食品行业得到更广泛的应用。加入乳液的食品受到乳液稳定性的影响,例如乳液代替动物脂肪可能使食品原本的口感、质地发生劣化,因此通过新型技术进一步提高MP的乳化能力,或者加入多糖模拟动物脂肪的黏度,还需要进一步研究完善。乳液中包埋递送生物活性物质的能力需要进一步提高,例如在胃的酸性环境下,开发在酸碱环境胁迫下仍保持稳定的乳液,并进一步提高其营养价值和生物利用率是未来值得研究的方向。综上所述,MP稳定的Pickering乳液具有较大的发展潜力。
[1] DICKINSON E.Hydrocolloids at interfaces and the influence on the properties of dispersed systems[J].Food Hydrocolloids,2003,17(1):25-39.DOI:10.1016/s0268-005x(01)00120-5.
[2] 钱晓晴,王立敏,张文,等.壳聚糖基Pickering乳液及其在食品中的应用[J].食品科学,2023,44(21): 386-395.DOI:10.7506/spkx1002-6630-20230428-280.
[3] 吴彤,冯进,黄午阳,等.牛蒡果胶多糖/玉米醇溶蛋白复合颗粒稳定的Pickering乳液构建及对姜黄素的递送功效[J].食品科学,2023,44(14): 37-46.DOI:10.7506/spkx1002-6630-20221102-014.
[4] CHEN X,TUME R K,XIONG Y L,et al.Structural modification of myofibrillar proteins by high-pressure processing for functionally improved,value-added,and healthy muscle gelled foods[J].Critical Reviews in Food Science and Nutrition,2018,58(17): 2981-3003.DOI:10.1080/10408398.2017.1347557.
[5] BOHRER B M.Review: nutrient density and nutritional value of meat products and non-meat foods high in protein[J].Trends in Food Science and Technology,2017,65: 103-112.DOI:10.1016/j.tifs.2017.04.016.
[6] WANG K,LI Y,ZHANG Y,et al.Improving myofibrillar proteins solubility and thermostability in low-ionic strength solution:a review[J].Meat Science,2022,189: 108822.DOI:10.1016/j.meatsci.2022.108822.
[7] 陈星.高压均质实现骨骼肌肌原纤维蛋白的水溶解及其新型加工特性的探索[D].南京: 南京农业大学,2018: 140-150.
[8] 张学全,刘玉青,刘爱国.富含肌原纤维蛋白奶片的配方研究[J].食品研究与开发,2021,42(16): 129-134;43.DOI:10.12161/j.issn.1005-6521.2021.16.019.
[9] 王正雯,田宏伟,周富裕,等.加热温度对麻鸭肌原纤维蛋白结构与凝胶特性的影响[J].食品科学,2020,41(13): 61-68.DOI:10.7506/spkx1002-6630-20191128-280.
[10] LIN L,XIONG Y.Competitive adsorption and dilatational rheology of pork myofibrillar and sarcoplasmic proteins at the O/W emulsion interface[J].Food Hydrocolloids,2021,118: 106816.DOI:10.1016/j.foodhyd.2021.106816.
[11] XIONG Y L.Myofibrillar protein from different muscle fiber types:implications of biochemical and functional properties in meat processing[J].Critical Reviews in Food Science and Nutrition,1994,34(3): 293-320.DOI:10.1080/10408399409527665.
[12] CHEN X,LI Y,ZHOU R Y,et al.Water-soluble myofibrillar proteins prepared by high-pressure homogenisation: a comparison study on the composition and functionality[J].International Journal of Food Science and Technology,2017,52(11): 2334-2342.DOI:10.1111/ijfs.13515.
[13] SHEN S K,CHEN Y W,YU W T,et al.High internal phase Pickering emulsions stabilized by modified sturgeon myofibrillar protein for quercetin delivery[J].Food Hydrocolloids,2023,144: 108926.DOI:10.1016/j.foodhyd.2023.108926.
[14] 罗钰湲,张欢,陈媛,等.柠檬籽纤维素纳米晶/纳米纤丝协同稳定Pickering乳液包埋姜黄素研究[J].食品与发酵工业,2022,48(15):162-168.DOI:10.13995/j.cnki.11-1802/ts.028953.
[15] 贾永京.肌原纤维蛋白/酚酯粒子稳定的茶油乳液基乳化肠的研究[D].合肥: 合肥工业大学,2021: 20-40.
[16] 冯潇,陈龙薇,狄雨,等.基于藜麦蛋白Pickering乳液模拟牛油[J].食品科学,2024,45(7): 28-34.DOI:10.7506/spkx1002-6630-20230809-064.
[17] ZHANG F,WANG P,HUANG M,et al.Modulating the properties of myofibrillar proteins-stabilized high internal phase emulsions using chitosan for enhanced 3D-printed foods[J].Carbohydrate Polymers,2024,324: 121540.DOI:10.1016/j.carbpol.2023.121540.
[18] 魏孔菊,董同珺,朱国花,等.天然生物大分子稳定高内相Pickering乳液及其在食品中的应用[J].食品科学,2023,44(23): 270-281.DOI:10.7506/spkx1002-6630-20221115-179.
[19] YAN X J,MA C C,CUI F Z,et al.Protein-stabilized Pickering emulsions: formation,stability,properties,and applications in foods[J].Trends in Food Science and Technology,2020,103: 293-303.DOI:10.1016/j.tifs.2020.07.005.
[20] CUI F Z,ZHAO S L,GUAN X,et al.Polysaccharide-based Pickering emulsions: formation,stabilization and applications[J].Food Hydrocolloids,2021,119: 106812.DOI:10.1016/j.foodhyd.2021.106812.
[21] EVANS M,RATCLIFFE I,WILLIAMS P A.Emulsion stabilisation using polysaccharide-protein complexes[J].Current Opinion in Colloid and Interface Science,2013,18(4): 272-282.DOI:10.1016/j.cocis.2013.04.004.
[22] 梁洛丹,曹伟伟,李琳琳,等.蛋白质-多糖非共价及共价复合物包埋活性成分的研究进展[J].食品科学,2023,44(21): 368-376.DOI:10.7506/spkx1002-6630-20221026-274.
[23] 窦新梾,郭银梅,吉语宁,等.不同类型固体颗粒稳定的食品级Pickering乳液研究进展[J].中国食品学报,2024,24(1): 475-486.DOI:10.16429/j.1009-7848.2024.01.044.
[24] 赵文琪,邓燕君,朱春英,等.纳米粒子稳定的Pickering乳液及其液滴聚并动力学研究进展[J].化工学报,2024,75(1): 33-46.DOI:10.11949/0438-1157.20230752.
[25] MA W C,WANG J M,XU X B,et al.Ultrasound treatment improved the physicochemical characteristics of cod protein and enhanced the stability of oil-in-water emulsion[J].Food Research International,2019,121: 247-256.DOI:10.1016/j.foodres.2019.03.024.
[26] GORDON A,BARBUT S.Mechanisms of meat batter stabilization:a review[J].Critical Reviews in Food Science and Nutrition,1992,32(4): 299-332.DOI:10.1080/10408399209527602.
[27] 方佳琪,薛茜,王芳,等.NaCl对可口革囊星虫体壁肌原纤维蛋白理化和凝胶性质的影响[J].中国食品学报,2023,23(12): 77-86.DOI:10.16429/j.1009-7848.2023.12.009.
[28] LI W,JIAO B,LI S,et al.Recent advances on Pickering emulsions stabilized by diverse edible particles: stability mechanism and applications[J].Frontiers in Nutrition,2022,9: 864943.DOI:10.3389/fnut.2022.864943.
[29] SUN W Z,ZHOU F B,SUN D W,et al.Effect of oxidation on the emulsifying properties of myofibrillar proteins[J].Food and Bioprocess Technology,2013,6(7): 1703-1712.DOI:10.1007/s11947-012-0823-8.
[30] WU M G,XIONG Y L,CHEN J,et al.Rheological and microstructural properties of porcine myofibrillar protein-lipid emulsion composite gels[J].Journal of Food Science,2009,74(4):E207-E217.DOI:10.1111/j.1750-3841.2009.01140.x.
[31] CHEN H S,KONG B H,GUO Y Y,et al.The effectiveness of cryoprotectants in inhibiting multiple freeze-thaw-induced functional and rheological changes in the myofibrillar proteins of common carp(Cyprinus carpio) surimi[J].Food Biophysics,2013,8(4): 302-310.DOI:10.1007/s11483-013-9305-4.
[32] DU X,LI H J,PAN N,et al.Effectiveness of ice structuring protein on the myofibrillar protein from mirror carp (Cyprinus carpio L.)during cryopreservation: reduction of aggregation and improvement of emulsifying properties[J].International Journal of Refrigeration,2022,133: 1-8.DOI:10.1016/j.ijrefrig.2021.10.003.
[33] SUN Q X,ZHANG C,LI Q X,et al.Changes in functional properties of common carp (Cyprinus carpio) myofibrillar protein as affected by ultrasound-assisted freezing[J].Journal of Food Science,2020,85(9):2879-2888.DOI:10.1111/1750-3841.15386.
[34]ZHANG C,LIU H T,XIA X F,et al.Effect of ultrasound-assisted immersion thawing on emulsifying and gelling properties of chicken myofibrillar protein[J].Food Science and Technology,2021,142:111016.DOI:10.1016/j.lwt.2021.111016.
[35] PEI Z S,WANG H B,XIA G H,et al.Emulsion gel stabilized by tilapia myofibrillar protein: application in lipid-enhanced surimi preparation[J].Food Chemistry,2023,403: 134424.DOI:10.1016/j.foodchem.2022.134424.
[36] RAJASEKARAN B,SINGH A,ZHANG B,et al.Changes in emulsifying and physical properties of shrimp oil/soybean oil-in-water emulsion stabilized by fish myofibrillar protein during the storage[J].European Journal of Lipid Science and Technology,2022,124(10):2200068.DOI:10.1002/ejlt.202200068.
[37] REN Z,CUI Y,WANG Y,et al.Effect of ionic strength on the structural properties and emulsion characteristics of myofibrillar proteins from hairtail (Trichiurus haumela)[J].Food Research International,2022,157: 111248.DOI:10.1016/j.foodres.2022.111248.
[38] YANG J Y,XIONG Y L.Inhibition of lipid oxidation in oil-in-water emulsions by interface-adsorbed myofibrillar protein[J].Journal of Agricultural and Food Chemistry,2015,63(40): 8896-8904.DOI:10.1021/acs.jafc.5b03377.
[39] ZHU C Z,JIN H Q,YIN F,et al.Emulsion-forming properties of heatinduced pork myofibrillar protein affected by NaCl[J].International Journal of Food Science and Technology,2021,56(6): 3016-3025.DOI:10.1111/ijfs.14945.
[40] LI Y L,XU Y J,XU X L,et al.Explore the mechanism of continuous cyclic glycation in affecting the stability of myofibrillar protein emulsion: the influence of pH[J].Food Research International,2022,161: 111834.DOI:10.1016/j.foodres.2022.111834.
[41] LU J M,ZHANG W Y,ZHAO X,et al.Comparison of the interfacial properties of native and refolded myofibrillar proteins subjected to pH-shifting[J].Food Chemistry,2022,380: 131734.DOI:10.1016/j.foodchem.2021.131734.
[42] NISHIMURA K,MURAKOSHI M,KATAYAMA S,et al.Antioxidative ability of chicken myofibrillar protein developed by glycosylation and changes in the solubility and thermal stability[J].Bioscience Biotechnology and Biochemistry,2011,75(2): 247-254.DOI:10.1271/bbb.100548.
[43] SAEKI H,INOUE K.Improved solubility of carp myofibrillar proteins in low ionic strength medium by glycosylation[J].Journal of Agricultural and Food Chemistry,1997,45(9): 3419-3422.DOI:10.1021/jf970302t.
[44] XU Y J,DONG M,TANG C B,et al.Glycation-induced structural modification of myofibrillar protein and its relation to emulsifying properties[J].Food Science and Technology,2020,117: 108664.DOI:10.1016/j.lwt.2019.108664.
[45] 夏立志,鲁玉凤,李强,等.3 种磷酸盐对白鲢鱼肌原纤维蛋白磷酸化的影响[J].肉类研究,2024,38(1): 10-18.DOI:10.7506/rlyj1001-8123-20240122-026.
[46] DIAO X Q,GUAN H N,ZHAO X X,et al.Properties and oxidative stability of emulsions prepared with myofibrillar protein and lard diacylglycerols[J].Meat Science,2016,115: 16-23.DOI:10.1016/j.meatsci.2016.01.001.
[47] KIM T K,LEE M H,YONG H I,et al.Impacts of fat types and myofibrillar protein on the rheological properties and thermal stability of meat emulsion systems[J].Food Chemistry,2021,351(30): 129401.DOI:10.1016/j.foodchem.2020.128930.
[48] ZHANG W Y,XU X L,ZHAO X,et al.Insight into the oil polarity impact on interfacial properties of myofibrillar protein[J].Food Hydrocolloids,2022,128: 107563.DOI:10.1016/j.foodhyd.2022.107563.
[49] LI R R,HE Q,RONG L Y,et al.High homogenization speeds for preparing unstable myofibrillar protein-olive oil emulsions[J].Journal of Food Science,2019,84(5): 1113-1121.DOI:10.1111/1750-3841.14502.
[50] LIU H T,ZHANG J N,WANG H,et al.High-intensity ultrasound improves the physical stability of myofibrillar protein emulsion at low ionic strength by destroying and suppressing myosin molecular assembly[J].Ultrasonics Sonochemistry,2021,74: 105554.DOI:10.1016/j.ultsonch.2021.105554.
[51] SUN Y,MA L,FU Y,et al.Fabrication and characterization of myofibrillar microgel particles as novel Pickering stabilizers: effect of particle size and wettability on emulsifying capacity[J].Food Science and Technology,2021,151: 112002.DOI:10.1016/j.lwt.2021.112002.
[52] YANG H J,TAO F,CAO G T,et al.Stability improvement of reduced-fat reduced-salt meat batter through modulation of secondary and tertiary protein structures by means of high pressure processing[J].Meat Science,2021,176: 108439.DOI:10.1016/j.meatsci.2021.108439.
[53] ZHOU L,FENG X,YANG Y L,et al.Effects of high-speed shear homogenization on the emulsifying and structural properties of myofibrillar protein under low-fat conditions[J].Journal of the Science of Food and Agriculture,2019,99(14): 6500-6508.DOI:10.1002/jsfa.9929.
[54] ZHOU L,ZHANG J,YIN Y T,et al.Effects of ultrasound-assisted emulsification on the emulsifying and rheological properties of myofibrillar protein stabilized pork fat emulsions[J].Foods,2021,10(6): 1201.DOI:10.3390/foods10061201.
[55] 韩柯颖,杨玉玲.高速剪切均质对鸡肉肌原纤维蛋白乳化特性和结构的影响[J].肉类研究,2022,36(12): 1-6.DOI:10.7506/rlyj1001-8123-20220829-101.
[56] XUE C,PEI Z,WEN P,et al.Effects of pH and NaCl on the spatial structure and conformation of myofibrillar proteins and the emulsion gel system-insights from computational molecular dynamics on myosin of golden pompano[J].Gels,2023,9(4): 270.DOI:10.3390/gels9040270.
[57] ZHU C Z,JIN H Q,YIN F,et al.Emulsion-forming properties of heatinduced pork myofibrillar protein affected by NaCl[J].International Journal of Food Science and Technology,2021,56(6): 3016-3025.DOI:10.1111/ijfs.14945.
[58] CHEN J Y,REN Y X,ZHANG K S,et al.Phosphorylation modification of myofibrillar proteins by sodium pyrophosphate affects emulsion gel formation and oxidative stability under different pH conditions[J].Food and Function,2019,10(10): 6568-6581.DOI:10.1039/c9fo01397k.
[59] LI L Y,ZHAO X,XU X L.Trace the difference driven by unfoldingrefolding pathway of myofibrillar protein: emphasizing the changes on structural and emulsion properties[J].Food Chemistry,2022,367:130688.DOI:10.1016/j.foodchem.2021.130688.
[60] XIA X F,KONG B H,LIU Q,et al.Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freeze-thaw cycles[J].Meat Science,2009,83(2): 239-245.DOI:10.1016/j.meatsci.2009.05.003.
[61] 李儒仁,谢振峰,荣良燕,等.肌原纤维蛋白界面膜协同凝胶基质提高乳液的稳定性[J].中国食品学报,2019,19(10): 68-76.DOI:10.16429/j.1009-7848.2019.10.008.
[62] REN Z Y,CUI Y Q,WANG Y Q,et al.Effect of ionic strength on the structural properties and emulsion characteristics of myofibrillar proteins from hairtail (Trichiurus haumela)[J].Food Research International,2022,157: 111248.DOI:10.1016/j.foodres.2022.111248.
[63] JIA B B,CHEN J Y,YANG G R,et al.Improvement of solubility,gelation and emulsifying properties of myofibrillar protein from mantis shrimp (Oratosquilla oratoria) by phosphorylation modification under low ionic strength of KCl[J].Food Chemistry,2023,403: 134497.DOI:10.1016/j.foodchem.2022.134497.
[64] LI Y P,ZHANG X H,LU F,et al.Effect of sodium bicarbonate and sodium chloride on aggregation and conformation of pork myofibrillar protein[J].Food Chemistry,2021,350: 129233.DOI:10.1016/j.foodchem.2021.129233.
[65] ZOU X L,KANG Z L,LI Y P,et al.Effect of sodium bicarbonate on solubility,conformation and emulsion properties of pale,soft and exudative meat myofibrillar proteins[J].Food Science and Technology,2022,157: 113097.DOI:10.1016/j.lwt.2022.113097.
[66] YANG H H,ZHONG C,SUN L C,et al.Effects of partial substitution of NaCl on myofibrillar protein properties from pearl mussel Hyriopsis cumingii muscle: structural characteristics and aggregation behaviors[J].Food Chemistry,2021,356: 129734.DOI:10.1016/j.foodchem.2021.129734.
[67] WANG J F,CUI Y Q,SHI L F,et al.Effect of ionic types on the characteristics of Pickering emulsions stabilized by myofibrillar proteins from hairtail (Trichiurus lepturus)[J].LWT-Food Science and Technology,2023,189: 115559.DOI:10.1016/j.lwt.2023.115559.
[68] WU L J,WU T,WU J Q,et al.Effects of cations on the “salt in” of myofibrillar proteins[J].Food Hydrocolloids,2016,58: 179-183.DOI:10.1016/j.foodhyd.2016.02.028.
[69] FU Q Q,SHI H B,LEI Z,et al.Effects of ultrasound power on the properties of non-salt chicken myofibrillar protein emulsions[J].International Journal of Food Science and Technology,2022,57(4):2523-2534.DOI:10.1111/ijfs.15626.
[70] CHEN J H,ZHANG X,XUE S W,et al.Effects of ultrasound frequency mode on myofibrillar protein structure and emulsifying properties[J].International Journal of Biological Macromolecules,2020,163: 1768-1779.DOI:10.1016/j.ijbiomac.2020.09.114.
[71] LI J,DAI Z C,CHEN Z H,et al.Improved gelling and emulsifying properties of myofibrillar protein from frozen shrimp (Litopenaeus vannamei) by high-intensity ultrasound[J].Food Hydrocolloids,2023,135: 108188.DOI:10.1016/j.foodhyd.2022.108188.
[72] 李可,张俊霞,王欣瑶,等.不同超声波功率处理对类PSE鸡肉肌原纤维蛋白结构和乳化稳定性的影响[J].食品科学,2023,44(13): 23-31.DOI:10.7506/spkx1002-6630-20220624-269.
[73] ZHENG J Y,SUN D,LI X X,et al.The effect of fatty acid chain length and saturation on the emulsification properties of pork myofibrillar proteins[J].LWT-Food Science and Technology,2021,139: 110242.DOI:10.1016/j.lwt.2020.110242.
[74] LI Z,ZHENG Y,SUN Q,et al.Structural characteristics and emulsifying properties of myofibrillar protein-dextran conjugates induced by ultrasound Maillard reaction[J].Ultrasonics Sonochemistry,2021,72: 105458.DOI:10.1016/j.ultsonch.2020.105458.
[75] 缪雨雁,曹燕,立静芝,等.不同黏度多糖阿拉伯胶和瓜尔胶对肌原纤维蛋白乳化性质的影响[J].食品科学,2023,44(6): 57-64.DOI:10.7506/spkx1002-6630-20220710-103.
[76] GAO T X,ZHAO X,LI R,et al.Synergistic effects of polysaccharide addition-ultrasound treatment on the emulsified properties of lowsalt myofibrillar protein[J].Food Hydrocolloids,2022,123: 107143.DOI:10.1016/j.foodhyd.2021.107143.
[77] XIONG Y,LI Q R,MIAO S,et al.Effect of ultrasound on physicochemical properties of emulsion stabilized by fish myofibrillar protein and xanthan gum[J].Innovative Food Science and Emerging Technologies,2019,54: 225-234.DOI:10.1016/j.ifset.2019.04.013.
[78] CHEN J H,XU Y J,PIUS B A,et al.Changes of myofibrillar protein structure improved the stability and distribution of baicalein in emulsion[J].LWT-Food Science and Technology,2021,137: 110404.DOI:10.1016/j.lwt.2020.110404.
[79] CHEN X,XU X L,ZHOU G H.Potential of high pressure homogenization to solubilize chicken breast myofibrillar proteins in water[J].Innovative Food Science and Emerging Technologies,2016,33: 170-179.DOI:10.1016/j.ifset.2015.11.012.
[80] YU C P,WU F,CHA Y,et al.Effects of high-pressure homogenization on functional properties and structure of mussel(Mytilus edulis) myofibrillar proteins[J].International Journal of Biological Macromolecules,2018,118: 741-746.DOI:10.1016/j.ijbiomac.2018.06.134.
[81] WU F,SHI X J,ZOU H N,et al.Effects of high-pressure homogenization on physicochemical,rheological and emulsifying properties of myofibrillar protein[J].Journal of Food Engineering,2019,263: 272-279.DOI:10.1016/j.jfoodeng.2019.07.009.
[82] CHA Y,SHI X J,WU F,et al.Improving the stability of oil-inwater emulsions by using mussel myofibrillar proteins and lecithin as emulsifiers and high-pressure homogenization[J].Journal of Food Engineering,2019,258: 1-8.DOI:10.1016/j.jfoodeng.2019.04.009.
[83] SU C,HE Z F,WANG Z F,et al.Aggregation and deaggregation:the effect of high-pressure homogenization cycles on myofibrillar proteins aqueous solution[J].International Journal of Biological Macromolecules,2021,189: 567-576.DOI:10.1016/j.ijbiomac.2021.08.133.
[84] LEE M H,YONG H I,KIM Y J,et al.High-pressure induced structural modification of porcine myofibrillar protein and its relation to rheological and emulsifying properties[J].Meat Science,2023,196:109032.DOI:10.1016/j.meatsci.2022.109032.
[85] 李想,隋沅均,庞一帆,等.基于纤维素稳定乳液的生物活性物质运载体系研究进展[J].食品工业科技,2024,45(4): 389-399.DOI:10.13386/j.issn1002-0306.2023040175.
[86] 李嘉惠,熊雅婷,龙敏,等.多糖颗粒制备Pickering乳液稳定机制研究进展[J].食品研究与开发,2023,44(13): 190-194.DOI:10.12161/j.issn.1005-6521.2023.13.028.
[87] SHAO T,ZHOU Y,DAI H J,et al.Regulation mechanism of myofibrillar protein emulsification mode by adding psyllium (Plantago ovata) husk[J].Food Chemistry,2022,376: 131939.DOI:10.1016/j.foodchem.2021.131939.
[88] LI Z G,HU P P,YU J R,et al.Preparation and characterization of regenerated cellulose fibers from a novel solvent system[J].Journal of Macromolecular Science Part B-Physics,2008,47(2): 288-295.DOI:10.1080/00222340701849079.
[89] ZHAO Y Y,HOU Q,CAO S,et al.Effect of regenerated cellulose fiber on the properties and microstructure of emulsion model system from meat batters[J].Food Hydrocolloids,2019,87: 83-89.DOI:10.1016/j.foodhyd.2018.07.044.
[90] MCCLEMENTS D J.Advances in fabrication of emulsions with enhanced functionality using structural design principles[J].Current Opinion in Colloid and Interface Science,2012,17(5): 235-245.DOI:10.1016/j.cocis.2012.06.002.
[91] ZHAO N,ZOU H N,SUN S,et al.The interaction between sodium alginate and myofibrillar proteins: the rheological and emulsifying properties of their mixture[J].International Journal of Biological Macromolecules,2020,161: 1545-1551.DOI:10.1016/j.ijbiomac.2020.08.025.
[92]薛山,罗娟.多糖添加对兔肌原纤维蛋白Pickering乳液稳定性及凝胶特性的影响[J].食品工业科技,2023,44(13): 21-29.DOI:10.13386/j.issn1002-0306.2022110340.
[93] ZHU C Y,ZHANG S L,ZHU N,et al.Effects of citrus fiber on the emulsifying properties and molecular structure of mutton myofibrillar protein: an underlying mechanisms study[J].Food Bioscience,2023,51: 102304.DOI:10.1016/j.fbio.2022.102304.
[94] ZHANG F,WANG P,HUANG M,et al.Modulating the properties of myofibrillar proteins-stabilized high internal phase emulsions using chitosan for enhanced 3D-printed foods[J].Carbohydrate Polymers,2024,324: 121540.DOI:10.1016/j.carbpol.2023.121540.
[95] HUANG M Y,XU Y J,XU L N,et al.The evaluation of mixedlayer emulsions stabilized by myofibrillar protein-chitosan complex for delivering astaxanthin: fabrication,characterization,stability and in vitro digestibility[J].Food Chemistry,2024,440: 138204.DOI:10.1016/j.foodchem.2023.138204.
[96] ZHANG X,XIONG Y L,CHEN J,et al.Synergy of licorice extract and pea protein hydrolysate for oxidative stability of soybean oil-inwater emulsions[J].Journal of Agricultural and Food Chemistry,2014,62(32): 8204-8213.DOI:10.1021/jf5016126.
[97] LI Y Y,KONG B H,LIU Q,et al.Improvement of the emulsifying and oxidative stability of myofibrillar protein prepared oil-in-water emulsions by addition of zein hydrolysates[J].Process Biochemistry,2017,53: 116-124.DOI:10.1016/j.procbio.2016.11.010.
[98] GUAN H N,DIAO X Q,LIU D Y,et al.Effect of high-pressure processing enzymatic hydrolysates of soy protein isolate on the emulsifying and oxidative stability of myofibrillar protein-prepared oilin-water emulsions[J].Journal of the Science of Food and Agriculture,2020,100(10): 3910-3919.DOI:10.1002/jsfa.10433.
[99] LI L X,CHEN L,NING C,et al.L-Arginine and L-lysine improve the physical stability of soybean oil-myosin emulsions by changing penetration and unfolding behaviors of interfacialmyosin[J].Food Hydrocolloids,2020,98: 105265.DOI:10.1016/j.foodhyd.2019.105265.
[100] GUO X Y,GAO F,ZHANG Y W,et al.Effect of L-histidine and L-lysine on the properties of oil-in-water emulsions stabilized by porcine myofibrillar proteins at low/high ionic strength[J].LWT-Food Science and Technology,2021,141: 110883.DOI:10.1016/j.lwt.2021.110883.
[101] GUO X Y,ZHANG Y W,JAMALI M A,et al.Manipulating interfacial behaviour and emulsifying properties of myofibrillar proteins by L-arginine at low and high salt concentration[J].International Journal of Food Science and Technology,2021,56(2): 999-1012.DOI:10.1111/ijfs.14752.
[102] 裘乐芸,邢倩,邓泽元,等.植物多酚与鲢鱼肌球蛋白相互作用及其对肌原纤维蛋白结构和凝胶形成的影响[J].中国食品学报,2021,21(5): 48-56.DOI:10.16429/j.1009-7848.2021.05.006.
[103] HU Y P,GAO Y F,SOLANGI I,et al.Effects of tea polyphenols on the conformational,functional,and morphological characteristics of beef myofibrillar proteins[J].LWT-Food Science and Technology,2022,154: 112596.DOI:10.1016/j.lwt.2021.112596.
[104] CHENG J R,TANG D B,YANG H G,et al.The dose-dependent effects of polyphenols and malondialdehyde on the emulsifying and gel properties of myofibrillar protein-mulberry polyphenol complex[J].Food Chemistry,2021,360: 130005.DOI:10.1016/j.foodchem.2021.130005.
[105] JIA N,LIN S W,ZHANG F X,et al.Improved effect of flaxseed gum on the weakened gelling properties of myofibrillar protein induced by catechin[J].Food Chemistry,2022,372: 131136.DOI:10.1016/j.foodchem.2021.131136.
[106] CAO Y G,AI N,TRUE A D,et al.Effects of (-)-epigallocatechin-3-gallate incorporation on the physicochemical and oxidative stability of myofibrillar protein-soybean oil emulsions[J].Food Chemistry,2018,245: 439-445.DOI:10.1016/j.foodchem.2017.10.111.