鸡肉是消费者餐桌上的食用佳品,其蛋白质含量高、风味独特、脂肪含量低,是全球销量最高的肉类之一[1]。与鸡胸肉相比,经过加工的鸡肉肠口感更好,而且开袋即食更为便捷,因此深受健身人群喜爱。鸡肉肠中丰富的营养物质和水分为微生物快速繁殖提供了有利条件,在其加工、贮藏和销售过程中极易滋生微生物,发生脂肪和蛋白质氧化,导致鸡肉肠的颜色、嫩度、口感和风味等发生劣变[2]。因此,需要对包装的鸡肉肠进行二次杀菌,以保证产品质量,常用的高温灭菌法通常需要在121 ℃进行,持续15~20 min,这种温度和时间的组合通常足以有效杀灭芽孢和其他微生物。然而,高温环境会对肉制品造成许多负面影响,如蛋白质过度变性、产品质地改变、口感变差、加速物质分解和氧化、风味变差及营养损失等[3]。与高温肉制品相比,低温肉制品能够最大限度保留肉类原有的营养成分及风味物质;此外,真空包装是低温肉制品最常用的一类包装方式,真空包装可以有效降低含氧量,抑制肉制品中的好氧微生物繁殖、脂肪和蛋白质氧化。但真空包装低温肉制品易因杀菌不彻底在贮藏和销售过程中出现胀袋现象。Ekonomou等[4]研究发现,假单胞菌属、能够产H2S的细菌和肠杆菌等是引起真空包装熏鱼腐败胀袋的优势菌群。Zhang Peipei等[5]发现,梭状芽孢杆菌属及乳酸杆菌属的细菌是引起真空包装猪肉“吹包”变质的主要菌属。杨琴[6]通过对胀袋后的产品进行兼性厌氧微生物分离发现,酵母菌属是引起真空包装凤爪胀袋的主要原因。从这些研究可以看出,引起真空包装食品胀袋和腐败的微生物类型较多且各具特点。胀袋现象的微生物原因不单一,涉及的微生物种类包括但不限于芽孢杆菌属、假单胞菌属和乳酸杆菌属等。这些微生物都有产气特性,能在包装内部产生气体,导致包装膨胀。微生物来源多样,可能包括原料本身的微生物载量、加工过程中的污染和灭菌不彻底等多种因素,这种多源性和复杂性说明在食品加工和包装过程中均需要严格的微生物控制和监测措施,以确保食品安全和质量。
明确真空包装鸡肉肠产品中微生物种群特征及其多样性是阐明其加工过程中微生物污染的首要条件。高通量测序技术具有高通量、低成本及高准确率等优点,不仅能够在短时间内分析出复杂微生物群落的多样性,还能检测到较低丰度及不可培养的微生物,目前在微生物多样性研究中有着广泛应用[7]。本研究采用传统培养法结合高通量测序研究胀袋腐败鸡肉肠中的优势菌属,同时用传统培养法分离、纯化、鉴定产品原材料及产品加工过程中所能接触到的器具及台面上的细菌,旨在找到引起产品胀袋的细菌及其来源,从而为企业在实际生产中解决问题提供一定参考和指导。
1 材料与方法
1.1 材料与试剂
胀袋腐败鸡肉肠、未胀袋的正常鸡肉肠、加工过程中的鸡肉样品、加工过程中所能接触器具、台面擦拭所得样品、鸡肉肠生产所需原辅料均来自于山东某食品加工厂。
平板计数琼脂(plate count agar,PCA)、营养肉汤(nutrient broth,NB)、胰胨-亚硫酸盐-环丝氨酸(tryptose-sulfite-cycloserine,TSC)琼脂基础、胰蛋白胨葡萄糖酵母浸膏肉汤(trypticase glucose yeast extract broth,TPGY)、卵黄琼脂(egg yolk agar,EYA)培养基青岛海博生物技术有限公司;TIANamp细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司。
1.2 仪器与设备
GI100T高压灭菌锅 厦门致微仪器有限公司;B1-150A生化培养箱 施都凯仪器设备(上海)有限公司;DYY-12电泳仪 北京市六一仪器厂;TGradient梯度聚合酶链式反应(polymerase chain reaction,PCR)仪德国Biometra公司。
1.3 方法
1.3.1 胀袋鸡肉肠微生物多样性分析
将4 份胀袋腐败鸡肉肠样本分别编号A、B、C、D,3 份未胀袋的正常样品分别编号E、F、G,委托北京奥维森基因科技有限公司,利用Illumina Miseq PE300高通量测序平台测序。使用Pear软件对Fastq数据进行质控,去除有引物错配、有模糊碱基的序列,再对序列进行修剪,去除序列中质量值低于Q20的碱基,根据双端测序的重叠关系对两端序列进行拼接处理,最小重叠范围设置为10 bp,P值设置为0.000 1,得到Fasta序列,使用Vsearch软件根据已知数据库用uchime方法[8]比对去除Fasta序列的嵌合体,对于未知数据库使用自比对方法进行去除,同时去除不符合要求短序列。使用归类操作方法,对序列按照相似性进行操作分类单元(operational taxonomic units,OTU)划分,OTU聚类的相似度水平设置为97%。
1.3.2 胀袋鸡肉肠中可培养微生物的分离鉴定
分别称取4 份胀袋腐败鸡肉肠各50 g,分别放入装有50 mL 0.9 g/100 mL无菌生理盐水的均质袋中振荡混合均匀备用,将样品液进行10 倍梯度稀释,分别吸取100 μL稀释液(稀释度10-3)加入PCA、TSC、EYA培养基中,PCA平板放入37 ℃培养箱中静置培养48 h;TSC和EYA平板放入厌氧培养罐中,37 ℃厌氧培养48 h至菌体长出,用于菌落计数及后续菌株分离与纯化。
从上述培养24 h的培养基中根据形态(颜色、大小等)挑取典型单菌落在相应培养基进行多次纯化,然后分别将菌落接种到液体培养基(PCA平板中的菌落接种至NB培养基,TSC、EYA平板中的菌落接种至TPGY培养基)中培养,于-80 ℃甘油保存。
使用细菌基因组D N A 提取试剂盒提取细菌基因组D N A 作为后续P C R 反应模板。利用引物2 7 F(5’-AGAGTTTGATCMTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)扩增16S rDNA。PCR扩增条件为:PCR扩增体系为30 μL,其中两端引物27F、1492R(均为10 μmol/L)各1.25 μL、2×Taq Master Mix 15 μL、模板1.5 μL、纯水12 μL。PCR反应程序为94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸90 s,共30 次循环,最后72 ℃延伸10 min。将PCR扩增产物进行琼脂糖凝胶电泳检测,使用凝胶成像分析仪确定扩增情况,将亮度清晰、条带长度为1 500 bp的扩增产物送至生工生物工程(上海)股份有限公司进行测序。测序结果通过NCBI数据库进行BLAST比对,确定菌种类型。
1.3.3 鸡肉肠原辅料中可培养微生物的分离鉴定
分别称取50 g加工过程中的鸡肉制品(解冻后鸡胸肉、熟化后鸡肉肠和杀菌后鸡肉肠),以及鸡肉肠制作过程中的辅料(谷朊粉、大豆分离蛋白粉、卡拉胶、魔芋粉、异抗坏血酸钠、粉末类细料、膏状细料和油状细料),放入装有50 mL无菌生理盐水的均质袋中振荡混合均匀,按照1.3.2节的方法进行微生物分离鉴定。
1.3.4 鸡肉肠加工环境中可培养微生物的分离鉴定
采用擦拭取样方法,擦拭鸡肉肠产品加工过程中所接触到的台面及器具(拉伸膜、装馅车、解冻台面、灌肠机、斩拌刀具、剪肠工具、挂杆、蒸箱、铝模包装设备和装框)。使用无菌棉球在10 cm×10 cm的取样范围内擦拭取样部位,然后把带有菌落的棉球放入装有100 mL无菌生理盐水的均质袋中振荡混合均匀,按照1.3.2节的方法行微生物分离鉴定。
1.3.5 鸡肉肠原辅料与加工环境中可培养微生物菌落总数测定
将1.3.3与1.3.4节中的样品均质液进行10 倍梯度稀释,吸取100 μL稀释液(稀释度10-3)分别加入PCA培养基中,放入37 ℃培养箱中倒置培养24~48 h至菌体长出,用于菌落计数。
1.3.6 产气微生物的验证
将从胀袋鸡肉肠中分离鉴定后的细菌接种至对应的液体培养基中,在37 ℃下培养24 h后用无菌生理盐水离心(8 000 r/min、10 min),将细菌悬浮于无菌生理盐水中备用,菌悬液细菌浓度约为8(lg(CFU/g))。称取9 g经高温灭菌的鸡肉肠样品,放置于无菌均质袋中,吸取1 mL菌悬液加入均质袋中,排尽袋中空气,于37 ℃培养3 d,每种菌株3 组平行,同时将接入无菌生理盐水的均质袋作为空白对照组。
1.4 数据处理
使用SPSS软件进行结果统计分析,所有分析均使用最小显著差异检验,显著性水平为0.05,所有结果均以平均值±标准差表示,使用Origin 2021软件进行主成分分析、数据分析和作图。
2 结果与分析
2.1 胀袋鸡肉肠微生物多样性分析
2.1.1 序列信息统计
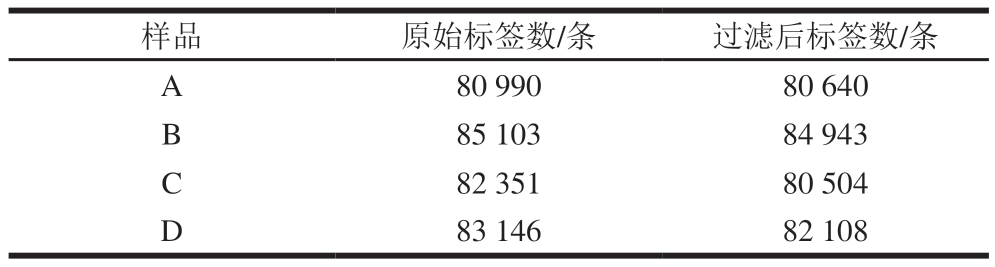
由表1可知,胀袋腐败鸡肉肠样品A、B、C、D经Fastq数据去除样品标签和引物序列、质控拼接后得到的原始数据,经进一步去除嵌合体、短序列后得到优质序列清洗标签的数量分别为80 640、84 943、80 504、82 108 条,优质序列长度分布大多集中在400~420、420~440 bp。此外,未胀袋样品(E、F、G)由于微生物含量少、提取出的基因组质量较低,因此无法上机建库,后续仅对4 份胀袋腐败鸡肉肠样品进行微生物多样性分析。
表1 拼接结果统计
Table 1 Statistics of splicing results
2.1.2 胀袋鸡肉肠菌群结构分析
将4 组胀袋鸡肉肠样品中获得的OTU序列从门和属2 个水平进行分析和注释,统计所有OTU在不同分类水平上的物种分类信息,观测样本在不同分类水平上的群落结构,分析和比较不同样本之间的差异性。
由图1可知,在门水平,鸡肉肠中微生物种群的主要组成部分按丰度优势依次为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidota)。其中,厚壁菌门占据绝对优势,相对丰度达到98.01%,这可能是因为厚壁菌门细菌有较高适应性,能够适应多种环境条件,对低温、低氧环境较为耐受,这使得它们能够在冷藏或冷冻条件下生长和繁殖。厚壁菌门细菌具有较强的蛋白质分解能力,肉制品中含有丰富的蛋白质和水分,厚壁菌门细菌能够利用这些蛋白质和水分作为养分进行生长和繁殖;此外,厚壁菌门细菌通常能够产生荚膜,这可以帮助其附着于肉品表面形成生物膜,为细菌生长繁殖提供保护[9-11]。厚壁菌门中的芽孢杆菌属(Clostridium)细菌最有可能引起真空包装产品腐败胀袋,这些芽孢杆菌属细菌具有耐热、耐压特性,能够在真空包装产品中生长繁殖,并且产生气体,导致包装袋胀气[12]。除厚壁菌门细菌外,变形菌门中的霍乱弧菌、拟杆菌门中产气杆菌属(Aerobacter)的一些亚种在特定条件下也可能产生气体,引起真空包装产品胀袋腐败[13-14]。
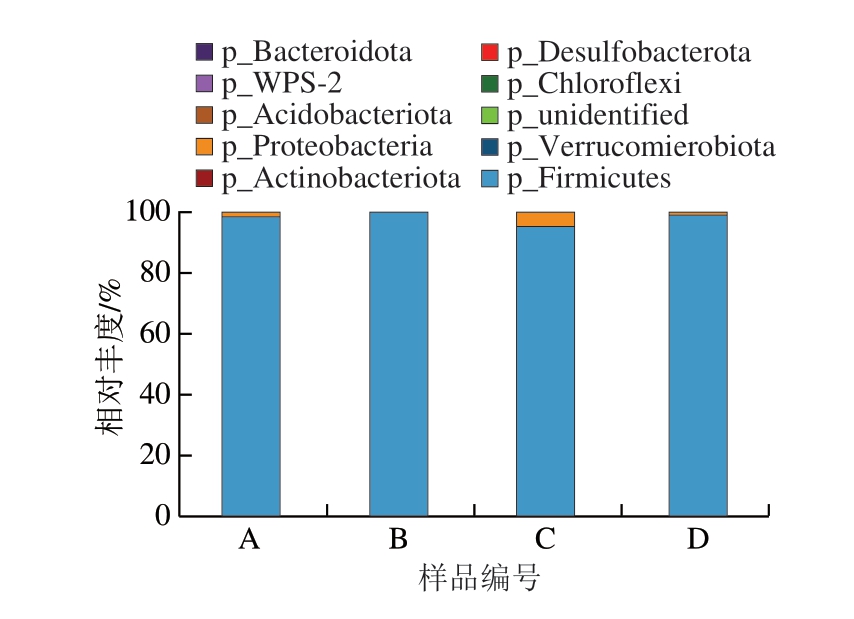
图1 胀袋腐败鸡肉肠门水平的细菌相对丰度
Fig.1 Relative abundance of bacteria at the phylum level in BPS chicken sausages
由图2可知,在属水平上,鸡肉肠中微生物种群的主要组成部分按丰度优势依次为梭菌属(Clostridium)、寡养单胞菌属(Stenotrophomonas)和不动杆菌属(Acinetobacter)。其中,梭菌属相对丰度为97.87%,处于绝对优势,说明梭菌属是引起真空鸡肉肠产品胀袋腐败的主要菌属,这与Palevich等[12]研究结果一致。原因是梭菌属菌株具有产气能力,它们能够通过发酵产生气体,主要是二氧化碳和氢气,因此,如果在真空包装环境下存在这些菌株,它们会持续产生气体,导致包装内部压力升高,并可能导致包装膨胀[15];此外,梭菌属菌株可以形成孢子,这些孢子具有较高耐热性,如果在真空包装过程中未将食品彻底杀菌或在包装后再次暴露于适宜的温度和湿度条件下,这些孢子可能会转化为活跃菌株,开始产生气体[16]。梭菌属菌株对于一些特定营养条件较为耐受,特别是在低酸性和低氧环境下[17],真空包装通常会减少食品与外界的接触,从而为梭菌属菌株生长提供适宜营养条件。除此之外,在胀袋鸡肉肠中还检出肠杆菌属(Enterobacter),4 组鸡肉肠中平均相对丰度为0.05%。肠杆菌为兼性厌氧菌,在真空条件下可转化为厌氧发酵,产生气体,造成产品胀包。因此,引起鸡肉肠胀袋的微生物主要是梭状芽孢杆菌,肠杆菌可能也起到一定作用。
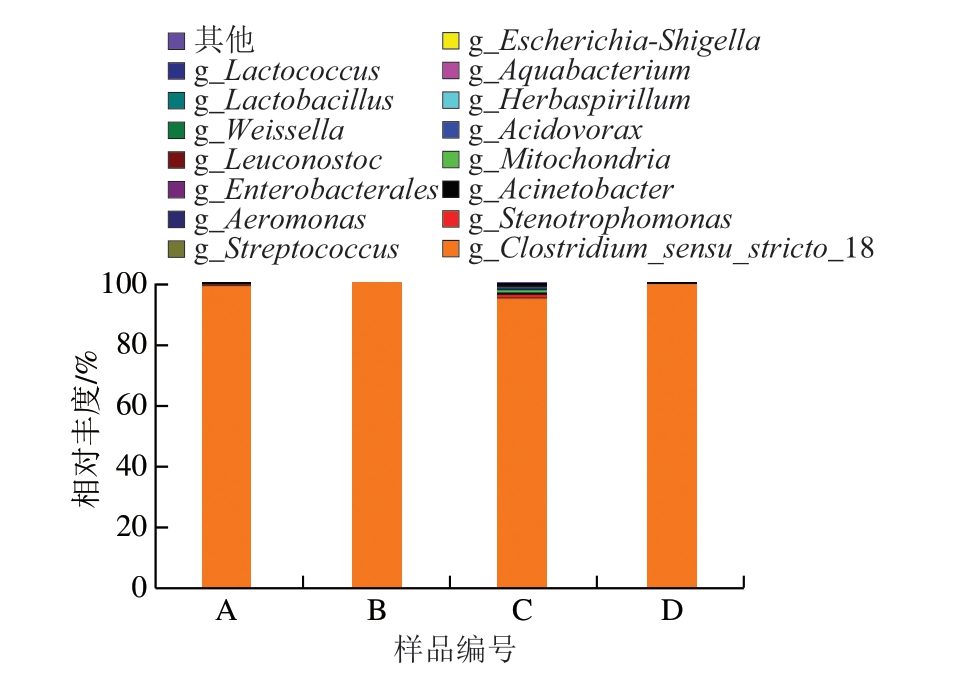
图2 胀袋腐败鸡肉肠属水平的细菌相对丰度
Fig.2 Relative abundance of bacteria at the genus level in BPS chicken sausages
2.1.3 样品菌群变化的热图分析
为更清晰、直观了解细菌在属水平上的微生物分布,对所有样本的种类和丰度进行分析并得到菌群分布热图,不同颜色代表图中每个物种的聚集度,越偏暖色表示聚集度越高,越偏冷色表示聚集度越低。由图3可知,不同样本之间的整体差异较小,胀袋腐败鸡肉肠中微生物群落明显聚集,引起4 种真空包装鸡肉肠胀袋的主要菌属一致,梭状芽孢杆菌为绝对优势菌属,这些结果为后续菌种的确定提供了参考。
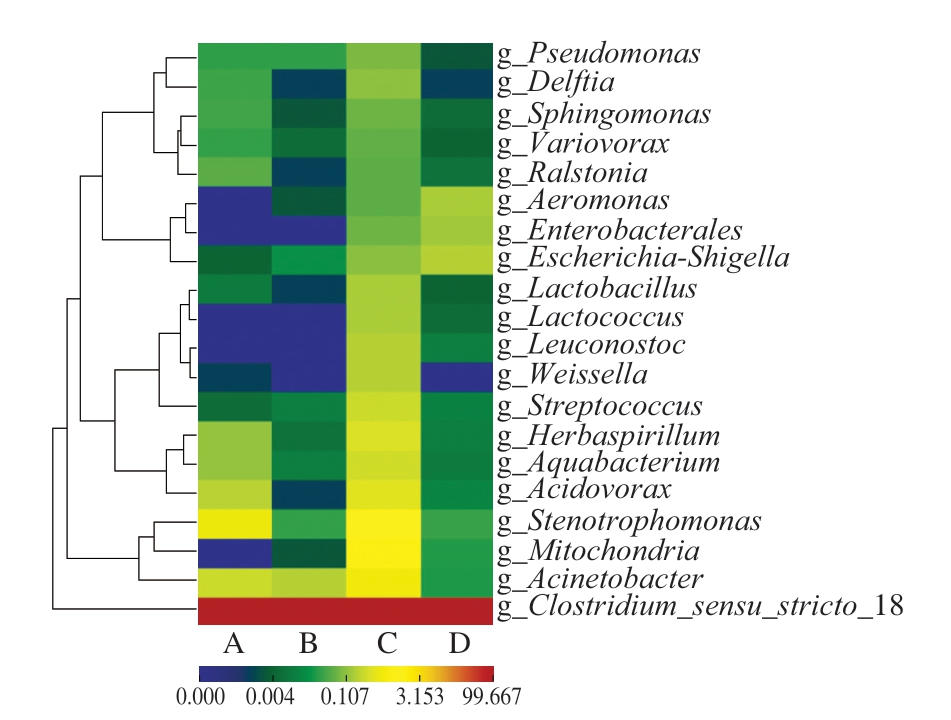
图3 胀袋腐败鸡肉肠微生物群落热图
Fig.3 Heatmap of microbial community in BPS chicken sausages
2.2 胀袋鸡肉肠微生物分离鉴定
通过PCA、TSC、EYA培养基分离鸡肉肠中的微生物,初步分离筛选共获得不同菌落形态的菌株38 株,其中PCA平板中获得14 株、TSC平板中获得15 株、卵黄琼脂平板中获得9 株。将38 株菌株的测序结果利用16S rDNA的通用引物进行PCR扩增,对PCR扩增产物进行琼脂糖凝胶电泳分析,以确定扩增产物条带亮度和长度无误,其中亮度清晰、条带长度为1 500 bp的9 株菌DNA扩增产物电泳结果如图4所示。然后将扩增产物进行测序,去除重复菌株,共从胀袋腐败鸡肉肠筛选出9 株细菌。
图4 PCR扩增产物电泳结果
Fig.4 Electrophoresis of PCR amplification products
M.100 bp DNA分子标记;泳道1~9.分别为产气荚膜梭菌、乙醇陆孢杆菌、彭氏变形杆菌、德氏肠球菌、蜡样芽孢杆菌、苏云金芽孢杆菌、假鸟肠球菌、草狄肠杆菌和深海黄杆菌。
由表2 可知,4 个样品中均有产气荚膜梭菌(Clostridium perfringens)检出,结合鸡肉肠中属水平的菌群结构分析结果,梭状芽孢杆菌可能是引起鸡肉肠产品胀袋腐败的主要原因,同时将以上9 种菌株分离纯化后接种至无菌鸡肉肠样品中进行产气性验证。
表2 胀袋鸡肉肠中菌株分离及鉴定
Table 2 Isolation and identification of bacteria in BPS chicken sausages

2.3 不同加工原辅料中微生物分离鉴定与菌落总数
2.3.1 不同加工原辅料中微生物菌落总数
由表3可知,异抗坏血酸钠、粉末类细料预混物、膏状细料预混物、油状细料预混物、谷朊粉、大豆分离蛋白粉、卡拉胶和魔芋粉均未检出细菌。未经杀菌处理的鸡胸肉中细菌数量相对较多,菌落总数最高,达到4.57(lg(CFU/g))。熟化后的鸡肉肠和杀菌后的鸡肉肠菌落总数小于GB 2726—2016《食品安全国家标准 熟肉制品》中规定的2(lg(CFU/g))。
表3 不同加工原辅料中微生物菌落总数
Table 3 Total number of bacteria in raw and auxiliary materials

2.3.2 不同加工原辅料中微生物的筛选与鉴定
通过初步分离筛选共获得不同菌落形态的菌株17 株,将它们利用16S rDNA进行菌种鉴定。由表4可知,17 株菌株均来自于解冻鸡胸肉,其中,从PCA平板中分离出4 株、TSC平板中分离出7 株、卵黄琼脂平板中分离出6 株。解冻后的鸡胸肉中菌株复杂多样,但并未分离到梭状芽孢杆菌,推测解冻鸡胸肉不是引起真空包装鸡肉肠胀袋的主要污染源。
表4 解冻鸡胸肉中菌株分离及鉴定
Table 4 Isolation and characterization of strains from thawed chicken breast

2.4 不同加工环境中微生物分离鉴定与菌落总数
2.4.1 不同加工环境中微生物菌落总数
由图5可知,拉伸膜、剪肠工具、蒸箱、铝模包装设备、装框中的菌落总数较少,微生物防控效果较好,微生物数量保持在较低水平;解冻台面、灌肠机、斩拌刀具细菌数量分别到达5.55、5.55、4.09(lg(CFU/cm2)),微生物防控效果较差,微生物数量保持在较高水平,这可能是生产过程中污染的主要来源。
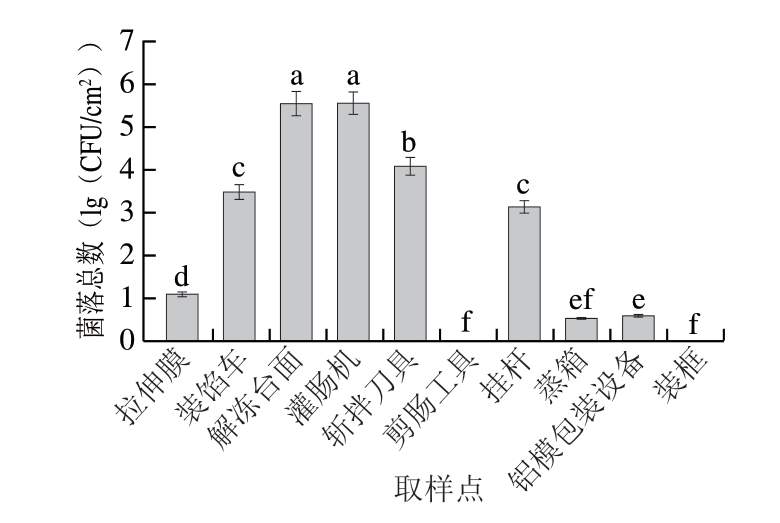
图5 不同加工环境中微生物菌落总数
Fig.5 Total number of bacteria in different processing environments
小写字母不同表示差异显著(P<0.05)。
2.4.2 不同加工环境中微生物的筛选与鉴定
通过初步分离筛选,共获得不同菌落形态菌株33 株,其中PCA平板中分离出10 株、TSC平板中分离出12 株、卵黄琼脂平板中分离出11 株。由表5可知,通过16S rDNA菌种鉴定,分别从解冻台面、灌肠机和斩拌刀具中各分离出1 株产气荚膜梭菌,除此之外还有弗氏柠檬酸杆菌等检出。
表5 不同加工环境中菌株分离及鉴定结果
Table 5 Isolation and identification of bacteria in different processing environments

由表5可知,导致鸡肉肠胀袋腐败的污染源最有可能来自解冻台面、灌肠机和斩拌刀具。解冻台面、灌肠机和斩拌刀具中各分离出1 株产气荚膜梭菌,其在厌氧环境中可以产生大量气体,是引起产品胀袋腐败的主要原因[18],还有弗氏柠檬酸杆菌、苏云金芽孢杆菌等可能引起食品腐败的菌种[19-20]。灌肠机中存在弗氏柠檬杆菌、河流乳球菌、阿米津氏菌、阿斯布氏肠杆菌、豚鼠气单胞菌和吉氏库尔退菌等多种可能引起食品腐败的菌种[21-23]。特别是豚鼠气单胞菌,它在厌氧环境下可以分解蛋白质产生氨,同时产生难闻气味,引起食品腐败[24]。斩拌刀具中存在黏质沙雷氏菌、苏云金芽孢杆菌等可能引起食品腐败的菌种[25]。装馅车、挂杆和铝模包装设备等其他加工环境虽然微生物数量相对较少,但由于出现了莱克锐克氏菌、霍氏肠杆菌等可能引起食品腐败的菌种,同样也不能忽视[26]。
2.5 产气微生物的验证
为明确引起真空包装鸡肉肠胀袋的微生物种类,将从胀袋鸡肉肠中分离纯化后的9 种细菌,包括乙醇陆孢杆菌、彭氏变形杆菌、德氏肠球菌、蜡样芽孢杆菌、苏云金芽孢杆菌、假鸟肠球菌、草狄肠杆菌、深海黄杆菌和产气荚膜梭菌进行产气性质验证。结果表明,空白对照组在贮藏过程中未出现胀袋现象,说明实验结果准确无误。接种产气荚膜梭菌的均质袋出现明显的胀袋现象,接种假鸟肠球菌的鸡肉也出现了较弱的涨袋现象,其他细菌均未引起均质袋胀袋。因此,真空包装鸡肉肠胀袋腐败可能是由梭状芽孢杆菌属的产气荚膜梭菌引起的。假鸟肠球菌也能引起产品胀袋,但是前期微生物多样分析显示肠杆菌属占比较低,且不是每一个样品中均检出肠杆菌属,因此推测假鸟肠球菌不是引起鸡肉肠胀袋的主要菌种。
高鹏等[27]研究发现,梭状芽胞杆菌属细菌是引起真空包装肘花产品胀袋腐败的优势菌属。李慧等[28]从胀袋腐败的真空包装土豆烧牛肉方便菜肴产品中发现5 株芽孢杆菌属细菌和2 株表皮葡萄球菌。张园园等[29]经产气验证实验鉴定出引起红烧肉和酱料包胀袋的产气微生物为贝莱斯芽孢杆菌、蜡样芽孢杆菌、太平洋芽孢杆菌、解淀粉芽孢杆菌、巴氏柠檬酸杆菌及弗氏柠檬酸杆菌等。结合本研究结果,梭状芽孢杆菌是引起真空包装肉制品胀袋的主要微生物之一。其原因可能是因为真空包装肉制品杀菌温度低、杀菌不彻底造成耐热菌尤其是芽孢杆菌的芽孢残留,当环境适宜细菌生长时芽孢则会再次萌发,细菌大量繁殖,导致真空包装的低温肉制品出现胀袋、腐败等问题[30-32]。因此,如何有效控制真空包装肉制品中芽孢数量至关重要,是解决由梭状芽孢杆菌引起肉制品真空包装胀袋的关键。
3 结论
本研究对胀袋腐败的鸡肉肠及其生产原料和加工环境的微生物进行分析。通过传统培养法从胀袋腐败鸡肉肠中共分离出38 株菌,结合鸡肉肠的菌群结构分析表明,梭状芽孢杆菌是引起鸡肉肠胀袋腐败的主要原因。再对产品生产所需的原材料和加工环境菌落总数进行计数,对菌株进行筛选、分离和鉴定。结果表明:解冻后的鸡胸肉菌落总数较高,但无梭状芽孢杆菌检出,其他原材料中未检出细菌;熟化、杀菌后的鸡肉肠符合国家标准,引起鸡肉肠胀袋的细菌可能源自解冻台面、灌肠机和斩拌刀具,因此应加强对以上几个生产环节的微生物控制。此外,由于芽孢有较高的抗逆性,因此常用的杀菌手段难以将其彻底杀灭,应进一步研究对芽孢的控制技术,避免真空包装产品出现胀袋腐败现象。
[1] 黄柳娟,冯博,刘海燕,等.冷鲜鸡肉表面及内部细菌菌群的多样性分析[J].上海农业学报,2021,37(1): 104-109.DOI:10.15955/j.issn1000-3924.2021.01.18.
[2]贾珊珊.变温模式下乳酸菌对鸡肉制品的生物保护作用研究[D].合肥: 合肥工业大学,2017: 5-20.
[3] 张慢,熊晓筱,刘俊,等.真空低温烹调技术对肉制品品质的影响研究进展[J].食品工业科技,2024,45(11): 333-340.DOI:10.13386/j.issn1002-0306.2023030298.
[4] EKONOMOU S I,PARLAPANI F F,KYRITSI M,et al.Preservation status and microbial communities of vacuum-packed hot smoked rainbow trout fillets[J].Food Microbiology,2022,103: 103959.DOI:10.1016/j.fm.2021.103959.
[5] ZHANG P P,WARD P,MCMULLEN L M,et al.A case of‘blown pack’ spoilage of vacuum-packaged pork likely associated with Clostridium estertheticum in Canada[J].Letters in Applied Microbiology,2020,70(1): 13-20.DOI:10.1111/lam.13236.
[6] 杨琴.泡椒凤爪中兼性厌氧产气微生物的分离、鉴定与控制研究[D].南昌: 江西农业大学,2019: 15-24.
[7] 张咚咚,赵金凤,谢思源,等.基于高通量测序的玉米中微生物多样性分析[J].中国食品学报,2023,23(10): 305-314.DOI:10.16429/j.1009-7848.2023.10.030.
[8] EDGAR R C,HAAS B J,CLEMENTE J C,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16): 2194-2200.DOI:10.1093/bioinformatics/btr381.
[9] WANG X H,DENG Y H,SUN J S,et al.Unraveling characterizations of bacterial community and spoilage profiles shift in chilled pork during refrigerated storage[J].Food Science and Technology,2022,42:e80321.DOI:10.1590/fst.80321.
[10] SONG S J,HUANG Z Y,LIN Y Y,et al.Microbial community diversity in egg curds with different shelf life revealed by Illumina MiSeq sequencing[J].Food and Fermentation Industries,2020,46(24):24-30.DOI:10.13995/j.cnki.11-1802/ts.024560.
[11] YUAN Y H,LIU L X,GUO L,et al.Changes of bacterial communities and volatile compounds developed from the spoilage of white Hypsizygus marmoreus under different storage conditions[J].LWT-Food Science and Technology,2022,168: 113906.DOI:10.1016/j.lwt.2022.113906.
[12] PALEVICH N,PALEVICH F P,MACLEAN P H,et al.Comparative genomics of Clostridium species associated with vacuum-packed meat spoilage[J].Food Microbiology,2021,95: 103687.DOI:10.1016/j.fm.2020.103687.
[13] CHEN D,CI M X,DAI R Q,et al.Changes in the microbial communities of tiger frog (Rana tigrina) meat during refrigerated storage[J].Journal of Food Protection,2021,84(7): 1136-1340.DOI:10.4315/JFP-20-381.
[14] GAN L,ZHENG J W,XU W H,et al.Deciphering the virulent Vibrio harveyi causing spoilage in muscle of aquatic crustacean Litopenaeus vannamei[J].Scientific Reports,2022,12(1): 16296.DOI:10.1038/s41598-022-20565-1.
[15] ROOD L,BOWMAN J P,ROSS T,et al.Spoilage potential of bacterial species from chilled vacuum-packed lamb[J].Food Microbiology,2022,107: 104093.DOI:10.1016/j.fm.2022.104093.
[16] ESTEVES E,KOOLMAN L,WHYTE P,et al.An evaluation of sporicidal treatments against blown pack spoilage associated Clostridium estertheticum and Clostridium gasigenes spores[J].Applied Sciences,2022,12(3): 1663.DOI:10.3390/app12031663.
[17] DORN-IN S,FÜHRER L,GAREIS M,et al.Cold-tolerant microorganisms causing spoilage of vacuum-packed beef undertime-temperature abuse determined by culture and qPCR[J].Food Microbiology,2023,109: 104107.DOI:10.1016/j.fm.2022.104147.
[18] 田源.产气荚膜梭菌噬菌体的分离鉴定及其在生禽肉中的抑菌应用研究[D].镇江: 江苏大学,2022: 10-20.
[19] 刘亚暖,姜肇旭,颜世敢.弗氏柠檬酸杆菌的致病性及分型研究进展[J].工业微生物,2023,53(4): 53-56.DOI:10.3969/j.issn.1001-6678.2023.04.016.
[20] HE C N,YE W Q,ZHU Y Y,et al.Antifungal activity of volatile organic compounds produced by Bacillus methylotrophicus and Bacillus thuringiensis against five common spoilage fungi on loquats[J].Molecules,2020,25(15): 3360.DOI:10.3390/molecules25153360.
[21] XIA J Y,JIANG N,ZHANG B,et al.Bacterial changes in boiled crayfish between different storage periods and characterizations of the specific spoilage bacteria[J].Foods,2023,12(16): 3006.DOI:10.3390/foods12163006.
[22] MATAJIRA C E C,POOR A P,MORENO L Z,et al.Vagococcus sp.a porcine pathogen: molecular and phenotypic characterization of strains isolated from diseased pigs in Brazil[J].Journal of Infection in Developing Countries,2020,14(11): 1314-1319.DOI:10.3855/jidc.12081.
[23] MAHAMI T,ODAI B T,NETTEY S N A,et al.Microbial food safety of lettuce produced under irrigated wastewater from Onyasia River in Ghana[J].Heliyon,2023,9(9): e19273.DOI:10.1016/j.heliyon.2023.e19273.
[24] BHOWMICK U D,BHATTACHARJEE S.Bacteriological,clinical and virulence aspects of Aeromonas-associated diseases in humans[J].Polish journal of Microbiology,2018,67(2): 137-149.DOI:10.21307/pjm-2018-020.
[25] DECIMO M,CABEZA M C,ORDÓÑEZ J A,et al.Volatile organic compounds associated with milk spoilage by psychrotrophic bacteria[J].International Journal of Dairy Technology,2018,71(3):593-600.DOI:10.1111/1471-0307.12485.
[26] PARLAPANI F F,BOZIARIS I S.Monitoring of spoilage and determination of microbial communities based on 16S rRNA gene sequence analysis of whole sea bream stored at various temperatures[J].LWT-Food Science and Technology,2016,66:553-559.DOI:10.1016/j.lwt.2015.11.007.
[27] 高鹏,伏毅,陈谦,等.真空包装肘花胀袋微生物的鉴定及验证[J].湖北农业科学,2016,55(13): 3434-3438.DOI:10.14088/j.cnki.issn0439-8114.2016.13.041.
[28] 李慧,卢玉,钟鸣,等.土豆烧牛肉方便菜肴胀袋微生物分离鉴定及产气特性研究[J].粮油食品科技,2020,28(4): 36-42.DOI:10.16210/j.cnki.1007-7561.2020.04.006.
[29] 张园园,朱瑶迪,李苗云,等.胀袋红烧肉和酱料包中产气微生物的分离与鉴定[J].现代食品科技,2022,38(7): 12-26.DOI:10.13982/j.mfst.1673-9078.2022.7.1095.
[30] 项丰娟,宋琳琳,秦仁炳,等.不同浓度芽孢萌发剂对肉毒梭菌芽孢萌发的影响[J].食品工业科技,2021,42(8): 88-94.DOI:10.13386/j.issn1002-0306.2020050293.
[31] 任宏荣,李苗云,朱瑶迪,等.产气荚膜梭菌在食品中的危害及其控制研究进展[J].食品科学,2021,42(7): 352-359.DOI:10.7506/spkx1002-6630-20200325-363.
[32] 朱瑶迪,张佳烨,李苗云,等.肽聚糖对肉制品中产气荚膜梭菌芽孢萌发率影响及预测[J].农业工程学报,2020,36(4): 287-293.DOI:10.11975/j.issn.1002-6819.2020.04.034.