肉鸽是我国广东省特色优势家禽产业,其营养丰富,素有“一鸽胜九鸡”的美誉[1],已逐步发展成为继鸡、鸭、鹅之后的第四大家禽[2]。2022年全国乳鸽出栏5.84亿 只,年产量约30万 t。肉鸽屠宰加工过程中产生大量的血液,约占肉鸽体质量6%~8%,由于难保存、血腥味重等原因,这部分血液资源通常被当作废弃物直接排放,鲜少加工利用,造成大量的资源浪费和严重的环境污染[3]。
畜禽血液中含有丰富的蛋白质,约占血液干基的90%,其中60%~65%为血红蛋白。血红素铁是血红蛋白中的重要活性成分,其携带的铁离子具有良好的补铁功效[4]。缺铁性贫血是目前临床上最常见的贫血症,目前全球约20%的人口存在缺铁性贫血的症状[5-7]。与非血红素铁相比,血液中的血红素铁更易于被吸收和利用,其吸收率比一般补铁剂高3 倍,生物转化利用率高,可作为铁强化剂的更优选择,应用于改善缺铁性贫血[8-9]。因此,从畜禽血液中提取血红素铁并将其开发为铁强化剂应用于各类食品基质中,不仅可以显著改善缺铁性贫血人群的健康状况,还能提升畜禽加工副产物的综合利用率和附加值。
目前,血液中血红素铁的提取方法主要有冰醋酸法、酶水解法、鞣酸法、选择溶剂法和羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na)法等,每种方法得到的产物有所差异,工艺也存在不同的优缺点[10]。其中冰醋酸法主要利用2 价铁与组氨酸的配位键在pH<3.5时发生断裂、解离提取血红素铁,但存在溶剂使用量大、成本高、不易回收等问题;鞣酸法提取纯度高达90%,通常采用5%的鞣酸作为提取剂,但所用鞣酸无法回收,生产成本较高;CMC-Na法工艺过程相对简单,不需要使用有机溶剂,但提取纯度低。酶水解法是通过蛋白酶对血红蛋白进行水解,把蛋白质水解成多肽和氨基酸,血红素铁连接在多肽链上,一定程度上克服单体血红素的不足,同时产生的多肽具有一定的生理功能,可以增强水解产物的功能活性和应用范围[11-12],且该法反应条件温和,是目前最为绿色、环保的血红素铁提取方法[13]。
因此,本研究以肉鸽血液为原料,采用酶法水解提取肉鸽血液中的血红素铁,以血红素铁含量为主要筛选指标,对蛋白酶种类、酶添加量、血水比、酶解时间等工艺条件进行优化,以期得到最佳的肉鸽血液血红素铁酶法提取工艺,为肉鸽血液资源的开发和高附加值综合利用提供理论和实践指导。
1 材料与方法
1.1 材料与试剂
肉鸽血液由梅州市金绿现代农业发展有限公司提供。
木瓜蛋白酶(800 U/mg)、中性蛋白酶(100 U/mg)、碱性蛋白酶(200 U/mg)、风味蛋白酶(20 U/mg)、复合蛋白酶(120 U/mg)、四硼酸钠、乙醇、邻苯二甲醛、二硫苏糖醇、丝氨酸、十二烷基硫酸钠 上海源叶生物科技有限公司;氯化高铁血红素(纯度≥90%)美国Sigma公司;酒石酸钾钠、氢氧化钠、硫酸铜(均为分析纯)天津大茂化学试剂厂;其他试剂均为分析纯。
1.2 仪器与设备
pHS-3C pH计 上海雷磁仪器有限公司;Neo 15R高速冷冻离心机 上海力申科学仪器有限公司;SHZ-B水浴恒温振荡器 上海博迅实业有限公司;UV-1780紫外分光光度计 岛津仪器(苏州)有限公司;HH-4数显恒温水浴锅 常州国宇仪器制造有限公司。
1.3 方法
1.3.1 蛋白酶水解提取鸽血血红素铁技术路线
新鲜鸽血→预处理→溶血→调节血水比→调节pH值→酶解→灭酶(95 ℃、10 min)→离心(4 ℃、10 000 r/min、20 min)→取上清液→酶解液待测。
1.3.2 血红蛋白制备
抗凝处理:以5 g/100 mL柠檬酸三钠溶液为抗凝剂,将抗凝剂与新鲜鸽血按体积比1∶9混匀,冷藏作抗凝处理,用纱布过滤除去杂质后,密封保存于4 ℃冷藏备用。
冻融破碎:将鸽血置于-18 ℃冰箱,2 h后取出,在室温下缓慢溶解,以破碎大部分动物性的细胞及细胞内的颗粒,并于5 000 r/min下离心20 min,收集上层红细胞液,并将其作为原料进行酶解实验。
1.3.3 血红蛋白含量的测定
采用双缩脲法对红细胞液中的蛋白质含量进行测定[14]。
标准曲线的绘制:首先配制10 mg/mL标准牛血清蛋白溶液备用,分别吸取0.0、0.2、0.4、0.6、0.8、1.0 mL配制好的标准蛋白溶液于试管中,加入超纯水补充至1 mL,最后在各样液试管中分别加入4 mL的双缩脲试剂,涡旋混匀后,反应30 min。反应结束后,使用分光光度计于540 nm波长处快速进行比色测定。采用3 组平行的实验方法分别进行测定,并以其蛋白含量和测得吸光度绘制标准曲线,得到的蛋白含量标准曲线方程为y=0.046 7x+0.079 4(R2=0.999 2)。将样品的质量浓度调节至曲线的线性范围内,血红蛋白含量按式(1)计算:
式中:ρ为蛋白质量浓度/(mg/mL);V为血清样品体积/mL;n为稀释倍数。
1.3.4 血红素铁含量的测定
采用紫外-可见分光光度法测定血红素铁含量[15]。准确称取1.0 mg氯化高铁血红素,使用0.1 mol/L氢氧化钠溶液进行溶解,稀释并定容至100 mL后,充分摇匀,以此作为10 μg/mL标准储备液。分别取0、1、2、4、6、8、10 mL标准储备液,使用0.1 mol/L氢氧化钠溶液定容至10 mL,稀释为不同质量浓度,涡旋混匀后,用0.1 mol/L氢氧化钠溶液作空白调零,从低质量浓度到高质量浓度依次于385 nm波长处测定吸光度[16]。绘制的卟啉铁浓度-吸光度标准曲线方程为:y=0.055 1x+0.017 9(R2=0.997 4)。将样品质量浓度调整到标准曲线线性范围内即可测定其血红素铁含量。
1.3.5 水解度(degree of hydrolysis,DH)的测定
参考张建萍等[17]方法,采用邻苯二甲醛法测定DH。DH是指特定条件下蛋白质被水解为小分子肽时,断裂的肽键数在蛋白质总肽键数中的占比[18],通过式(2)~(4)计算:
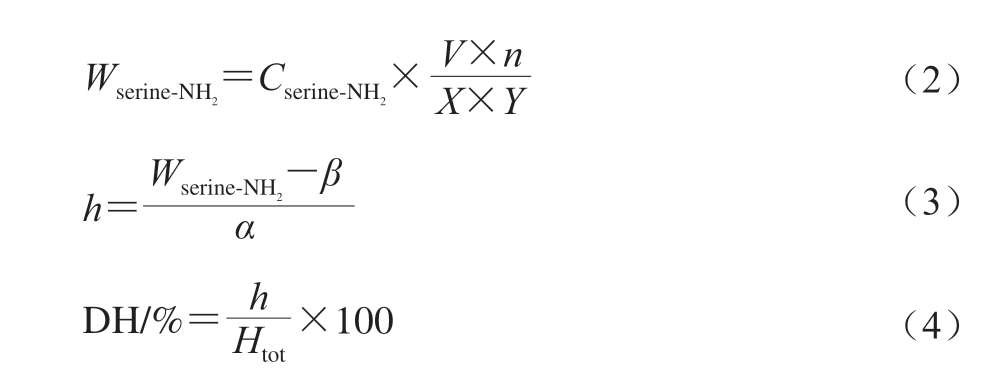
式中:Cserine-NH2为L-丝氨酸含量/(mmol/g);V为原始水解液体积/μL;n为水解液稀释倍数;X为制备样品体积/μL;Y为样品中蛋白含量/(mmol/g);h为每克蛋白断裂产生的肽键数/(mmol/g);Htot为蛋白中总肽键数(Htot=8 mmol/g);α、β均为修正因子,α=1.00,β=0.4。
1.3.6 酶解工艺条件优化
1.3.6.1 酶种类筛选试验
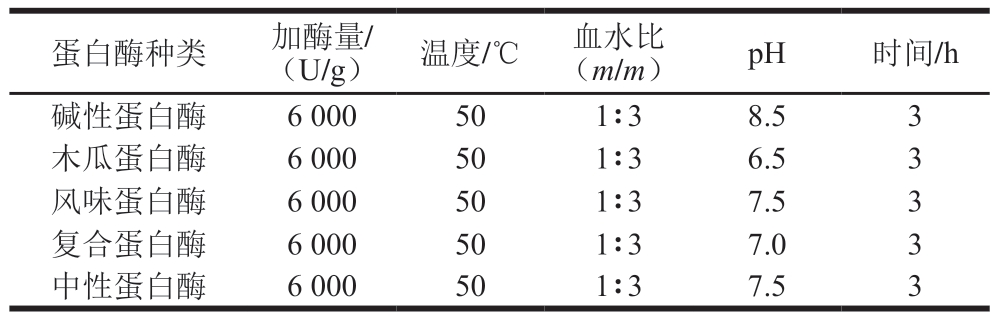
选取木瓜蛋白酶、风味蛋白酶、碱性蛋白酶、复合蛋白酶和中性蛋白酶,参照表1的酶解条件对上述处理的肉鸽血液样品进行酶解。肉鸽血液样品的pH值分别调节至各酶的最适pH值条件。酶解结束后测定各酶解产物的DH,并以血红素铁含量作为主要评价指标,从中选取2 种酶作为复配用酶进行双酶酶解。
表1 不同蛋白酶酶解肉鸽血液工艺条件
Table 1 Experimental conditions for enzymatic hydrolysis of meattype pigeon blood with different proteases
1.3.6.2 酶配比对肉鸽血液酶解的影响
在总加酶量6 000 U/g、酶解时间3 h、血水比1∶3(m/m)、温度50 ℃、pH 7.0下,探究不同酶(木瓜蛋白酶∶复合蛋白酶)配比(1∶0、1∶1、1∶2、2∶1、0∶1)对肉鸽血液蛋白质DH与血红素铁含量的影响。
1.3.6.3 pH值对肉鸽血液酶解的影响
在不同pH值(6.5、7.0、7.5、8.0)下进行酶解,其余酶解条件为总加酶量6 000 U/g、酶配比2∶1、酶解时间3 h、血水比1∶3(m/m)、温度50 ℃。
1.3.6.4 血水比对肉鸽血液酶解的影响
在不同血水比(1∶1、1∶2、1∶3、1∶4,m/m)下分别酶解,其余酶解条件为酶配比2∶1、总加酶量6 000 U/g、酶解时间3 h、温度50 ℃、pH 7.0。
1.3.6.5 总加酶量对肉鸽血液酶解的影响
在不同总加酶量(2 000、4 000、6 000、8 000、10 000、12 000 U/g)下分别酶解,其余酶解条件为酶配比2∶1、酶解时间3 h、血水比1∶3(m/m)、温度50 ℃、pH 7.0。
1.3.6.6 酶解时间对肉鸽血液酶解的影响
酶解不同时间(2、3、4、5 h),其余酶解条件为酶配比2∶1(m/m)、总加酶量6 000 U/g、血水比1∶3(m/m)、温度50 ℃、pH 7.0。
1.3.6.7 正交试验工艺优化设计
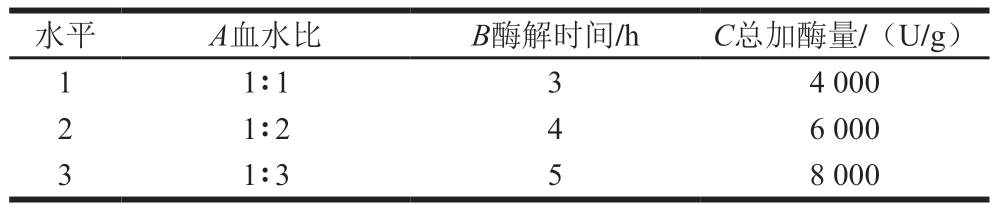
根据单因素试验结果,选取血水比(A)、酶解时间(B)和总加酶量(C)为试验因素,以血红素铁含量、DH为筛选指标,采用L9(34)正交试验确定最佳酶解工艺。正交试验因素水平见表2。
表2 正交试验因素水平表
Table 2 Factors and levels used in orthogonal array design
1.4 数据处理
每组数据经过3 次平行测定,结果使用平均值±标准差形式表示,采用SPSS 22.0软件进行显著性分析,P<0.05表示差异显著。使用Origin 2022软件进行作图。
2 结果与分析
2.1 蛋白酶种类对血红蛋白DH和血红素铁含量的影响
酶种类的选择是影响蛋白质酶解效率的关键因素[19],不同酶作用于不同水解肽键位点,从而得到不同酶解特性的水解产物[20-21]。如图1所示,5 种酶中DH最大的是风味蛋白酶,其次是木瓜蛋白酶,碱性蛋白酶和复合蛋白酶的DH差异不显著(P>0.05),中性蛋白酶DH最低。风味蛋白酶因其同时存在内切酶和外切酶2 种酶的酶切位点,酶外切作用产生更多游离氨基酸[22],其DH显著高于其他蛋白酶(P<0.05),但是其酶解上清液含量较少,蛋白回收率较低。从酶解后得到的血红素铁含量可以看出,木瓜蛋白酶得率最高,含量为57.23 μg/mL;其次是风味蛋白酶和复合蛋白酶。考虑到风味蛋白酶蛋白回收率较低,本研究选用木瓜蛋白酶和复合蛋白酶进行后续双酶酶解试验。
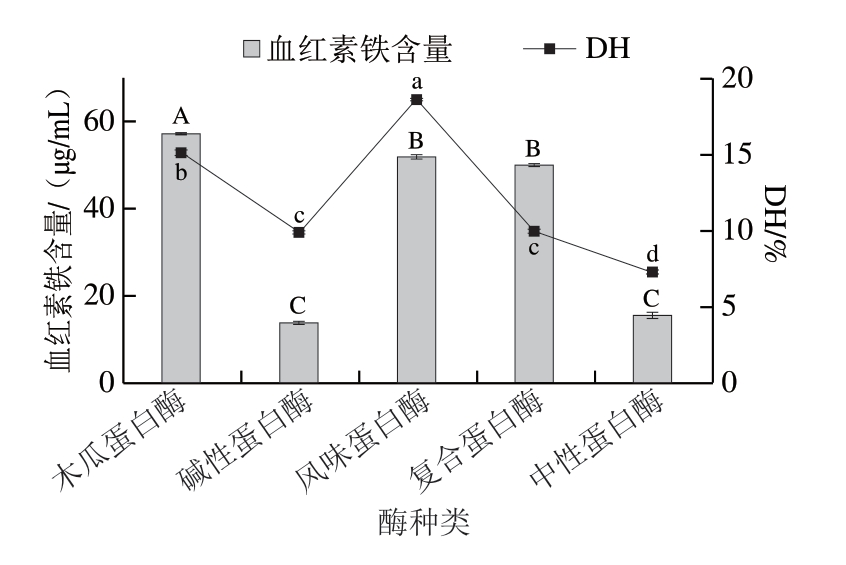
图1 不同蛋白酶对水解反应的影响
Fig.1 Effect of different proteases on the yield of heme iron and degree of hydrolysis
小写字母不同表示DH差异显著(P<0.05);大写字母不同表示血红素铁含量差异显著(P<0.05)。下同。
2.2 酶配比对血红蛋白DH和血红素铁含量的影响
如图2所示,木瓜蛋白酶与复合蛋白酶的配比不同,肉鸽血液的DH与血红素铁含量也产生相应变化,在酶配比为2∶1时达到最高,分别为13.93%与70.24 μg/mL,显著高于其他酶配比(P<0.05)。说明在给定pH值和温度下,增大木瓜蛋白酶的比例有助于酶解效率的提高。而使用单一蛋白酶进行酶解的效果不如双酶酶解,后者从肉鸽血液中提取出的血红素铁含量比单酶酶解提升约22.73%。原因是组合使用蛋白酶进行酶解时能够增加酶切位点,扩大作用范围[23-24]。根据试验结果,选择酶配比为2∶1作为后续试验条件。
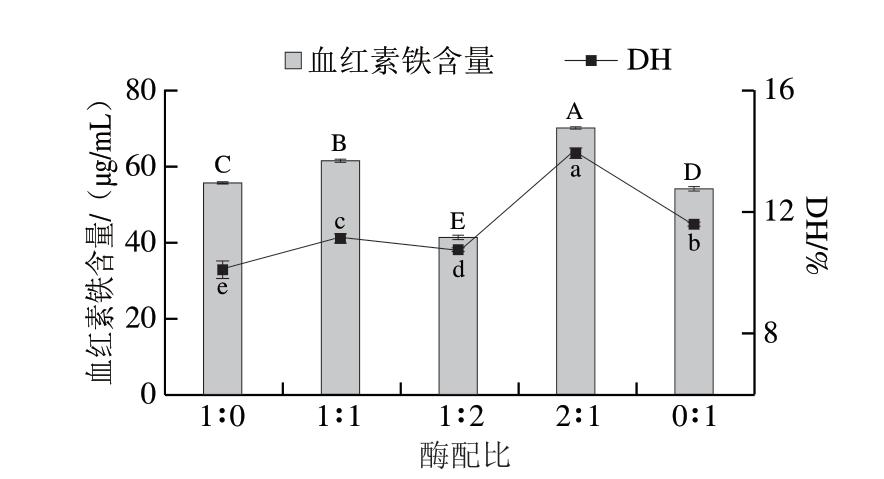
图2 木瓜蛋白酶和复合蛋白酶配比对水解反应的影响
Fig.2 Effect of ratio of papain to protamex on the yield of heme iron and degree of hydrolysis
2.3 pH值对血红蛋白DH和血红素铁含量的影响
不同pH值对酶解效率有较大的影响,当pH值处于最适范围时,酶活性会有所提高[25]。因此有必要对双酶酶解作用的pH值进行优化。如图3所示,随着pH值的增加,肉鸽血液的DH呈现先增加后降低的趋势,在pH 7.0时达到最大值,且差异显著(P<0.05)。这和木瓜蛋白酶和复合蛋白酶的最适pH值在中性附近有关[26]。血红素铁的含量随pH值、DH的变化规律类似,表明血红素铁的含量和肉鸽血红蛋白的水解程度密切相关。根据试验结果,2 种指标在pH 7.0时达到最大值,故选择pH 7.0作为下一步的试验条件。
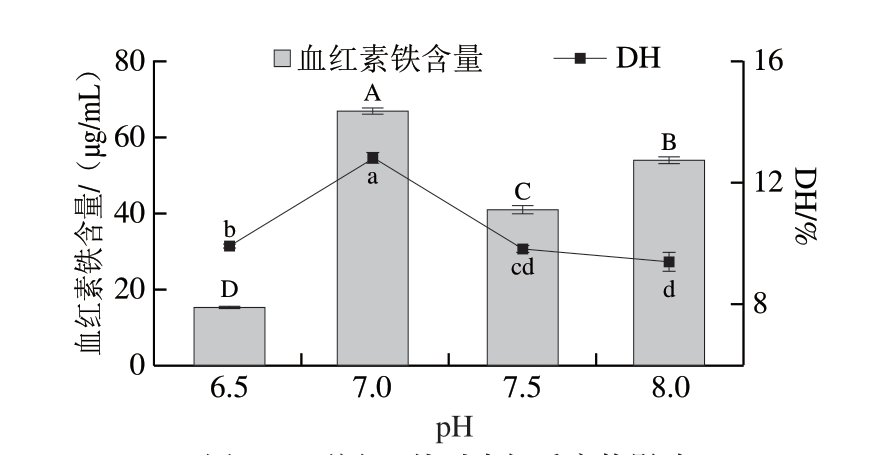
图3 不同pH值对水解反应的影响
Fig.3 Effect of hydrolysis pH on the yield of heme iron and degree of hydrolysis
2.4 血水比对血红蛋白DH和血红素铁含量的影响
肉鸽血液和水的混合比例关系到酶解反应的底物浓度,直接影响蛋白酶对底物的水解效果[27]。如图4所示,血水比1∶1时,因底物即血红蛋白浓度过高,酶的扩散受到限制,部分血红蛋白没有被有效水解,酶的水解反应发生抑制效应[28],从而使血红素铁含量和DH较低;当血水比为1∶2时,底物浓度最合适,此时底物可以与酶进行充分反应,血红蛋白可以在此条件下进行充分、有效的水解。之后,随着血水比增加至1∶3、1∶4时,底物浓度逐步降低,酶与底物的接触减少,反应效率也下降。因此,选择血水比1∶2酶解效果最好。
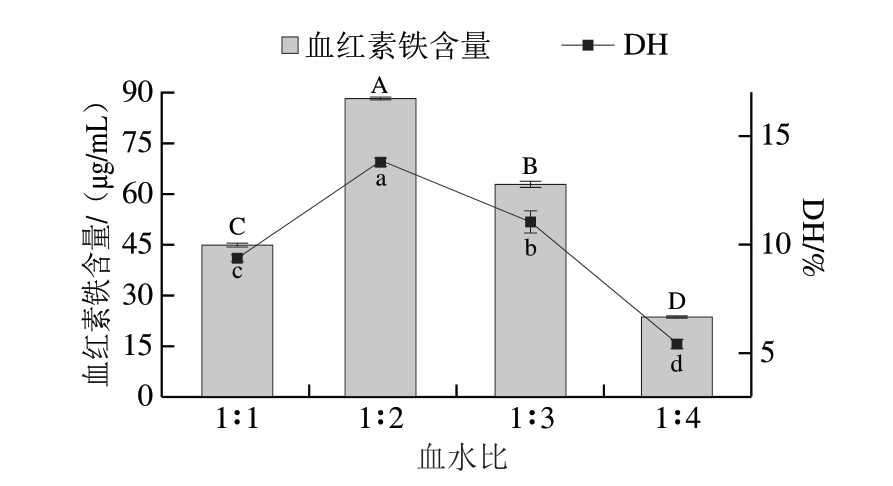
图4 不同血水比对水解反应的影响
Fig.4 Effect of blood-to-water ratio on the yield of heme iron and degree of hydrolysis
2.5 总加酶量对血红蛋白DH和血红素铁含量的影响
当酶用量过少时,反应速率会受到限制,随着酶用量增大,酶水解效率提高。由图5可知,随着总加酶量的提高,能参与底物反应的酶也较多,因此整体有正向促进作用,水解效率随之增加。总加酶量为6 000 U/mg时,所提取出的血红素铁含量达到最大,为69.64 μg/mL。当总加酶量继续增大时,由于底物浓度不变,底物与酶作用趋于饱和,这时再提高酶用量并不能明显提高酶促效应,相反,此时过高的酶浓度会引起酶自溶,反而产生一定的负效应[29-30]。说明6 000 U/g是一个重要的拐点,超过这个点反而会产生负效应。因此,选用6 000 U/g作为酶添加量。
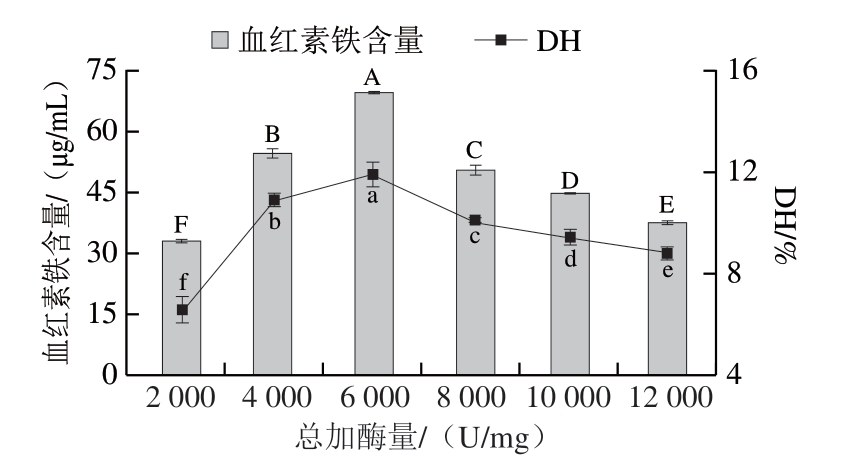
图5 不同总加酶量对水解反应的影响
Fig.5 Effect of enzyme dosage on the yield of heme iron and degree of hydrolysis
2.6 酶解时间对血红蛋白DH和血红素铁含量的影响
由图6可知,随着酶解时间的延长,DH不断增加,酶解至4 h时,DH达到13.51%,进一步延长酶解时间,DH无显著增加(P>0.05),说明此时底物蛋白质的有效酶切部位已得到较充分地水解。血红素铁含量随着酶解时间的延长缓慢增加。在酶解至4 h时,血红素铁含量达到最大,为71.4 μg/mL。此后,血红素铁含量呈现下降的趋势。这可能是由于蛋白质在降解过程中产生大量中间产物,从而产生产物抑制,使得血红素铁得率降低[31]。为提高血红素铁含量,必须控制好酶解时间,综合考虑,4 h为最佳水解时间。
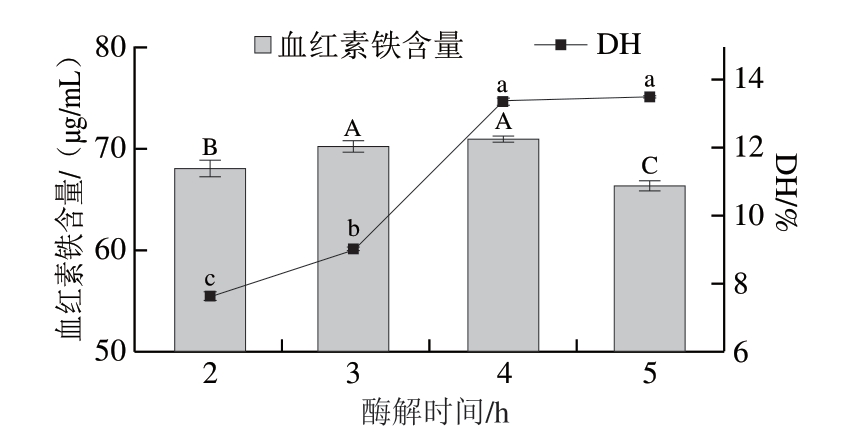
图6 不同酶解时间对水解反应的影响
Fig.6 Effect of enzymatic hydrolysis time on the yield of heme iron and degree of hydrolysis
2.7 正交试验结果
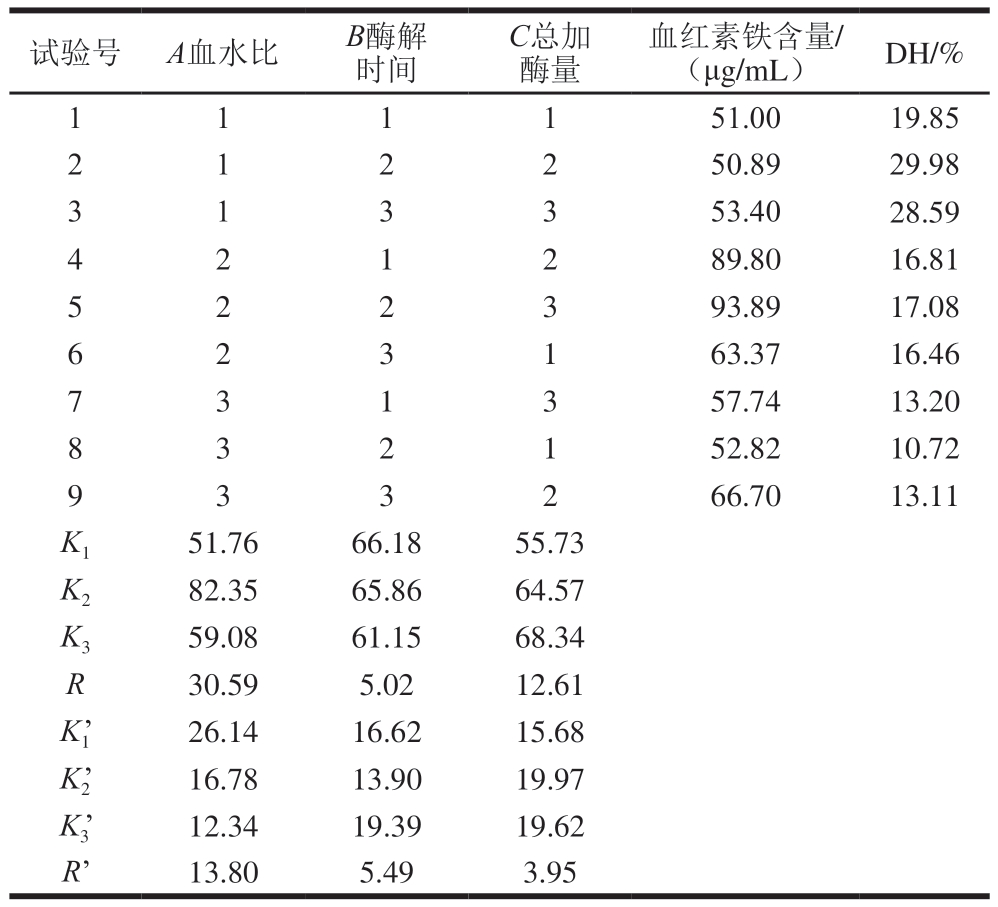
选取对血红素铁含量和DH影响较大的工艺条件:血水比、酶解时间和总加酶量3 个因素进行3水平正交试验,由表3可知,R值说明不同因素对血红素铁含量的影响次序为A>C>B,即血水比>总加酶量>酶解时间。通过K值可知,以血红素铁含量为筛选指标得到的最佳酶解工艺为A2B1C3,即血水比1∶2、酶解时间3 h、总加酶量8 000 U/g;同时,以DH为评价指标得出R’值,可知在DH的影响因素中,血水比同样是第1位,酶解时间作用次之,而总加酶量对DH的影响最小,主次顺序为A>B>C,最佳工艺条件为A1B3C2,即血水比1∶1、酶解时间5 h、总加酶量6 000 U/g。
表3 正交试验设计及结果
Table 3 Orthogonal array design matrix with experimental results
对正交试验所得的2 组最优条件组合进行验证。其中以酶解后所提取的血红素铁含量为指标所得出的A2B1C3组合的血红素铁提取量为95.43 μg/mL,DH为18.41%。以DH为指标得出的A1B3C2组合条件进行酶解后,所得血红素铁提取量为56.72 μg/mL,DH为30.93%。因此正交试验得到的2 组最优组合条件下血红素铁含量和DH均最高,说明正交试验结果可信。2 个指标之间以血红素铁含量为首要评价指标,因此得到最佳血红素铁提取工艺为A2B1C3,即血水比1∶2、酶解时间3 h、总加酶量8 000 U/g,在此条件下得到的血红素铁含量比单一酶解所得的含量提高66.74%,显著提升了肉鸽血液中血红素铁的提取量。
3 结论
利用生物蛋白酶水解从肉鸽血液中提取血红素铁,以DH和血红素铁含量作为优化指标,对酶解工艺条件进行优化。双酶复配酶解工艺研究结果表明,不同血水比产生的血红素铁含量差异较显著,水解效果明显;酶添加量对血红素铁产量影响较大,对于DH影响不显著,在4 000~8 000 U/g范围内均可进行有效水解。最终确定双酶酶解血红素铁的最佳提取工艺为:木瓜蛋白酶、复合蛋白酶配比2∶1、pH 7.0、血水比1∶2、总加酶量8 000 U/g、温度50 ℃、酶解时间3 h,在此条件下对肉鸽血液进行双酶酶解后,血红素铁提取量为95.43 μg/mL,DH为18.41%,效果最佳。与单酶酶解相比,双酶酶解的血红素铁提取率提高约66.74%,说明双酶酶解能够有效提高血红素铁的提取量。
双酶酶解法能够提高血红素铁提取量,并且适用于工业化方法和设备,适合大规模生产,为提高肉鸽血液资源利用及减少资源、环境污染提供一条合理的新途径,对经济、环保具有重大的可持续发展意义。未来针对血红素铁在不同提取条件下的稳定性及产品开发应用方面仍需更进一步的研究。
[1] 鲁照见,王润之,黄一忠,等.肉鸽养殖技术要点与分析[J].家禽科学,2015(4): 17-19.DOI:10.3969/j.issn.1673-1085.2015.04.006.
[2] 常玲玲,卜柱,刘敏,等.不同生产模式对乳鸽生长性能、屠宰性能和肉品质的影响[J].中国家禽,2022,44(7): 84-89.DOI:10.16372/j.issn.1004-6364.2022.07.014.
[3] 力俊琛.鸽血抗氧化肽的分离、结构鉴定及体外抗氧化活性评价[D].乌鲁木齐: 新疆农业大学,2022: 88.DOI:10.27431/d.cnki.gxnyu.2022.000034.
[4] 李潘,李平,王兆明,等.畜禽血液功能特性及加工适应性研究进展[J].食品研究与开发,2023,44(9): 191-196.DOI:10.12161/j.issn.1005-6521.2023.09.027.
[5] TANSUKKASEM S,KAEWPATHOMSRI P,JONJAROEN V,et al.Production and characterization of heme iron polypeptide from the blood of skipjack tuna (Katsuwonus pelamis) using enzymatic hydrolysis for food supplement application[J].Foods,2023,12(17):3249.DOI:10.3390/foods12173249.
[6] JARZEBSKI M,WIERUSZEWSKI M,KOSCINSKI M,et al.Heme iron as potential iron fortifier for food application: characterization by material techniques[J].Reviews on Advanced Materials Science,2023,62(1): 315-322.DOI:10.1515/rams-2023-0128.
[7] 韩晴,王维婷,杜鹏飞,等.畜禽血液中血红素的提取、检测及应用[J].黑龙江畜牧兽医,2023(16): 28-34.DOI:10.13881/j.cnki.hljxmsy.2022.07.0032.
[8] MAN Y,XU T,ADHIKARI B,et al.Iron supplementation and iron-fortified foods: a review[J].Critical Reviews in Food Science and Nutrition,2022,62(16): 4504-4525.DOI:10.1080/10408398.2021.1876623.
[9] ZHOU W J,CEN J W,HU Q R,et al.Study on extractiing of heme from tilapias blood by enzymatic method[J].Advanced Materials Research,2014,941-944: 2641-2645.DOI:10.4028/www.scientific.net/AMR.941-944.2641.
[10] 赵剑龙.利用马血制备氯化血红素技术的研究[D].乌鲁木齐: 新疆农业大学,2013: 66.DOI:10.7666/d.D368580.
[11] 岑剑伟,李来好,杨贤庆,等.酶解法提取罗非鱼血液中血红素的工艺条件优化[J].食品科学,2014,35(16): 29-33.DOI:10.7506/spkx1002-6630-201416006.
[12] 张立娟,夏继华,沈峰,等.猪血血红蛋白肽的研究进展[J].肉类研究,2011,25(6): 54-57.DOI:10.3969/j.issn.1001-8123.2011.06.013.
[13] 李晨光,庄红,吕学举,等.动物血液血红素铁提取方法研究[J].食品工业科技,2008(1): 308-310.DOI:10.13386/j.issn1002-0306.2008.01.036.
[14] 李惟栋,王永霞,孙敏,等.超声辅助碱溶酸沉法提取鸡腿菇蛋白质工艺优化[J].食品工业,2022,43(1): 43-47.
[15] LOMBARDO M E,ARAUJO L S,CICCARELLI A B,et al.A spectrophotometric method for estimating hemin in biological systems[J].Analytical Biochemistry,2005,341(2): 199-203.DOI:10.1016/j.ab.2004.11.002.
[16] 吴保承,沈国强,杨春霞,等.酶法提取猪血中血红素的工艺研究[J].化学与生物工程,2009,26(8): 61-63.DOI:10.3969/j.issn.1672-5425.2009.08.018.
[17] 张建萍,陈振家,闫舟,等.不同蛋白酶水解小米分离蛋白工艺[J].食品工业,2019,40(12): 123-127.
[18] NIELSEN P M,PETERSEN D,DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science,2001,66(5): 642-646.DOI:10.1111/j.1365-2621.2001.tb04614.x.
[19] 孟莹,江晓,孙建安,等.不同水解工艺对鱼溶浆蛋白水解效果的影响[J].中国渔业质量与标准,2021,11(3): 1-9.DOI:10.3969/j.issn.2095-1833.2021.03.001.
[20] SILA A,BOUGATEF A.Antioxidant peptides from marine by-products: isolation,identification and application in food systems:a review[J].Journal of Functional Foods,2016,21: 10-26.DOI:10.1016/j.jff.2015.11.007.
[21] LIU F,LI Y,WANG C,et al.Physicochemical,functional and antioxidant properties of mung bean protein enzymatic hydrolysates[J].Food Chemistry,2022,393: 133397.DOI:10.1016/j.foodchem.2022.133397.
[22] ZHOU X,CUI H P,ZHANG Q,et al.Taste improvement of maillard reaction intermediates derived from enzymatic hydrolysates of pea protein[J].Food Research International,2021,140: 109985.DOI:10.1016/j.foodres.2020.109985.
[23] 熊科,邓蕾,柳佳芸,等.蛋白酶水解底物特异性机制研究进展[J].食品与发酵工业,2019,45(19): 292-298.DOI:10.13995/j.cnki.11-1802/ts.021238.
[24] DE CASTRO R J S,SATO H H.Synergistic actions of proteolytic enzymes for production of soy protein hydrolysates with antioxidant activities: an approach based on enzymes specificities[J].Biocatalysis and Agricultural Biotechnology,2015,4(4): 694-702.DOI:10.1016/j.bcab.2015.08.012.
[25] 蔡新东,马石霞,冉权,等.碱性蛋白酶酶解血液蛋白的工艺优化[J].农村实用技术,2020(8): 115-117.
[26] KRISTINSSON H G,RASCO B A.Fish protein hydrolysates:production,biochemical,and functional properties[J].Critical Reviews in Food Science and Nutrition,2000,40(1): 43-81.DOI:10.1080/10408690091189266.
[27] 吴文锦,汪兰,孙静,等.鸡血血红蛋白酶法提取血红素工艺优化[J].食品研究与开发,2021,42(9): 90-96.DOI:10.12161/j.issn.1005-6521.2021.09.014.
[28] JIN S K,CHOI J S,YIM D G.Hydrolysis conditions of porcine blood proteins and antimicrobial effects of their hydrolysates[J].Food Science of Animal Resources,2020,40(2): 172-182.DOI:10.5851/kosfa.2020.e2.
[29] 刘又维,刘战民,李聪,等.响应面法优化酶法制备亚铁血红素肽工艺[J].肉类研究,2020,34(4): 34-39.DOI:10.7506/rlyj1001-8123-20200228-058.
[30] 韩晴,王维婷,王守经,等.羊血亚铁血红素的酶法制备及抗氧化活性研究[J].食品科技,2023,48(3): 147-154.DOI:10.13684/j.cnki.spkj.2023.03.023.
[31] 杨军楠,栾俊家,崔方超,等.不同蛋白酶海参酶解液的制备及其体外免疫调节活性[J].食品研究与开发,2023,44(11): 43-52.DOI:10.12161/j.issn.1005-6521.2023.11.007.