蟠龙菜,又称盘龙菜、卷切,俗名剁菜,是湖北钟祥经典名菜之一,主要原料包括猪肉、鱼肉、鸡蛋、大葱和生姜等,具有色泽鲜艳、肥而不腻、肉滑油润及香味绵长的特点,迄今已有约500 年的食用历史[1-2]。近年来,蟠龙菜经初步改良后进入了工业化生产阶段,相关推广策略研究也稳步推进[3]。蟠龙菜产品作为调理肉制品的一种,含有丰富的蛋白质、脂肪等营养素,有利于微生物生长繁殖,因此,在生产加工、运输及销售等环节易被食源性致病菌污染[4-5]。造成蟠龙菜生产安全性风险的原因有生产规范化和现代化程度较低,大多由作坊式生产而成,因而生产设备和生产环境洁净程度不达标;蟠龙菜原辅料品种较多,且加工工艺较为复杂,这提高了生产过程中引入外源微生物及其他外源物质的风险;为避免高温灭菌加速蟠龙菜中脂肪劣变,使其产生令人不能接受的不良风味[6],需降低杀菌温度,缩短杀菌时间;此外,蟠龙菜加工工程中一般未使用防腐剂、抗氧化剂等添加剂。这些问题导致蟠龙菜产品货架期普遍较短,运输和销售需要一定冷藏条件,在一定程度上限制了其商品化发展。
目前,已有一些研究者对肉及肉制品腐败微生物进行了探讨。Zhou Zhonglian等[7]认为假单胞菌和热杀索丝菌是冷冻猪肉中的主要腐败菌,且这2 种菌相互作用会加速猪肉的腐败进程。Borch等[8]研究发现,与冷藏肉制品变质有关的细菌主要包括嗜热芽孢杆菌属、肉杆菌属、乳酸杆菌属、明串珠菌属和魏斯氏菌属,且乳酸菌是其中的优势腐败微生物。研究者在对不同熟肉制品进行研究后得出相同结论,认为乳酸菌是其中存在的优势菌种[9-11]。Dalgaard[12]认为优势腐败菌主导包装鱼产品的腐败变质。然而,关于蟠龙菜菌相分析和微生物控制的相关研究还很少。
近年来,高通量测序技术已被证明比传统微生物分析方法或聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)更快速、有效和可靠,因而被广泛用于监测食品中微生物群落的动态变化[13-16]。Połka等[16]采用传统培养方法结合PCR-DGGE及高通量测序研究意大利萨拉米香肠成熟过程中的菌相变化,发现与PCR-DGGE相比,高通量测序技术鉴定出的生肉发酵主要参与者(乳酸杆菌和葡萄球菌)的多样性更高。Tian Xiaojing等[17]采用传统方法和高通量测序方法研究熟制后猪肉冷藏过程中的细菌多样性变化,发现贮藏初期主要为芽孢杆菌、肠杆菌、假单胞菌和乳球菌,贮藏末期肉食杆菌属成为优势菌群。本研究采用高通量测序技术研究蟠龙菜贮藏期间微生物群落丰度及多样性的动态变化,为识别核心腐败微生物和控制蟠龙菜腐败提供参考,对于后续产品货架期延长和质量提升具有重要意义。
1 材料与方法
1.1 材料与试剂
猪肉、草鱼、大葱、生姜、鸡蛋、马铃薯淀粉、食盐、味精 荆楚理工学院南门超市;大豆分离蛋白、卡拉胶、转谷氨酰胺酶(均为食品级)河南万邦化工科技有限公司。
1.2 仪器与设备
C21-SN2105型电磁炉 广东美的生活电器制造有限公司;FA224C型电子分析天平 上海力辰邦西仪器科技有限公司;CH-LL06型家用小型绞肉机 河北廊坊近都家居用品有限公司;101-0A型电热鼓风干燥箱 天津赛得利斯实验分析仪器制造厂;DW-86L626型立式超低温保存箱 青岛海尔特种电器有限公司;ZK-380型真空包装机 永康斯飞格电器有限公司;BSP-100型生化培养箱 上海博迅医疗生物仪器股份公司。
1.3 方法
1.3.1 蟠龙菜制备工艺
工艺流程:原料选择→原料预处理→绞肉→搅拌并加料→成型→蒸制→冷却→真空包装→灭菌。
操作要点:绞肉:将猪瘦肉、鱼肉按比例混合,绞成肉糜状,肥肉绞至最大块体积不超过1.5 cm3;搅拌并加料:按表1进行加料,逆时针手动搅拌5 min;成型:将混合均匀的肉糜置于洁净的保鲜膜上,将其裹成长约10 cm、直径约6 cm的类圆柱体;蒸制:将成型后的肉糜坯置于蒸笼,蒸制20 min,在表面刷蛋黄液,继续蒸5 min;真空包装:将冷却后的蟠龙菜装袋并在0.1 MPa真空度下进行抽真空操作并封口;灭菌:105 ℃灭菌20 min。
表1 蟠龙菜配料
Table 1 Ingredients of Panlongcai

1.3.2 样品采集
参照Samelis[18]、Kaur[19]等的方法。将4 ℃贮藏样品在其包装后的第0、10、20、30、40天取样,分别命名为A-1~A-5;将20 ℃贮藏样品在其包装后的第0、5、10、15、20、25、30天取样,分别命名为B-1~B-7。从超净台中取3 袋平行样品,分别称取10 g,切碎混合后作为该批次的最终样品密封于无菌取样袋中,4 ℃样品共5 袋,20 ℃样品共7 袋。取样后将其置于-80 ℃避光贮藏,随后基于16S rDNA进行Illumina NovaSeq高通量测序,测序平台为NovaSeq PE250。
1.3.3 基因组提取及Illumina NovaSeq测序
使用细菌基因组DNA提取试剂盒提取纯化菌株的DNA,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。以提取的基因组DNA为模板,通过388F-806R通用引物扩增16S rDNA V3~V4区。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸30 s;72 ℃稳定延伸10 min;扩增27 个循环,在4 ℃下保存。PCR产物使用1%琼脂糖凝胶电泳检测扩增目的条带大小,并用Agencourt AMPure XP核酸纯化试剂盒纯化。纯化后构建克隆文库,并进行Illumina NovaSeq双向测序。
1.3.4 传统培养微生物的分离、纯化和鉴定
从1.3.2节中4 ℃培养20、40 d的30~300 CFU的PCA平板中挑选典型菌落进行纯化培养,然后进行革兰氏染色、显微镜镜检和过氧化氢实验。挑取纯菌落用甘油保存于-80 ℃冰箱中备用。后续使用细菌基因组DNA提取试剂盒提取纯化菌株DNA,用1%琼脂糖凝胶电泳检测菌株DNA。以提取纯化的细菌DNA为模板,用细菌通用引物进行16S rDNA PCR扩增,将扩增产物进行测序,对测序结果进行序列拼接校准后与NCBI上GenBank数据库中的已知序列进行同源性比对分析,进而得出该微生物在属种上的分类结果。
1.4 数据处理
利用fastp(v0.12.4)软件对下机数据进行质控:采用滑动窗口策略,窗口大小设置为4,平均质量值为20,最小保留序列长度为100,fastq自动去除接头序列;利用QIIME2(2020.2.0)软件dada2插件对质控后的序列进行reads的拼接、去重、嵌合体过滤,生成代表性序列,根据序列相似度将其归为多个操作分类单元(operational taxonomic units,OTU)。根据物种注释,统计每个样品在门、属分类水平上的序列数目。使用R语言绘制稀释曲线、等级聚类曲线和热图。采用QIIME软件(version 1.9.1)进行α多样性分析,通过Origin 2021软件绘制样品间的层级聚类树,同时绘制门水平和属水平相对丰度柱状图。使用凌波微课云平台绘制主坐标分析(principal coordinate analysis,PCoA)图和Venn图。
2 结果与分析
2.1 高通量测序数据合理性分析
通过Illumina NovaSeq平台对蟠龙菜细菌群落进行测序分析,12 个样品的下机数据中含有0.46 G原始数据碱基和1 778 622 条原始序列读段,对原始数据进行拼接和过滤,得到815 019 条有效序列,然后对其进行质控、去噪、拼接、嵌合体过滤,形成OTU。以97%的相似度为标准对优质细菌序列进行聚类和物种分类处理,共获得1 733 个OTU,各蟠龙菜样本的OTU数量分布处于74~245之间。各样本的覆盖率均大于99%,说明测序数目充足,测序序列可以代表蟠龙菜细菌群落组成情况,并进行后续分析。
由图1可知,当序列数大于20 000后,稀释曲线逐渐趋于平坦,增加测序数只能发现极少量物种,表明本次测序数据量足以反映蟠龙菜样本的多样性,也能体现样品中大部分菌群的组成情况。
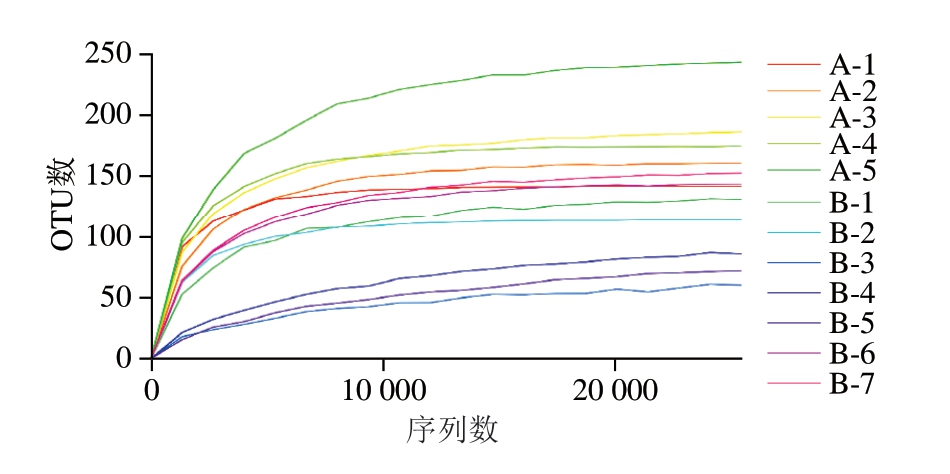
图1 稀释曲线
Fig.1 Rarefaction curves
由图2可知,不同样品微生物丰度和均匀度存在显著差异,其中B-3、B-4、B-5组样品曲线较陡峭、水平跨度小,表明20 ℃贮藏样品在贮藏第10~20天时微生物分布不均匀且丰富度较低。
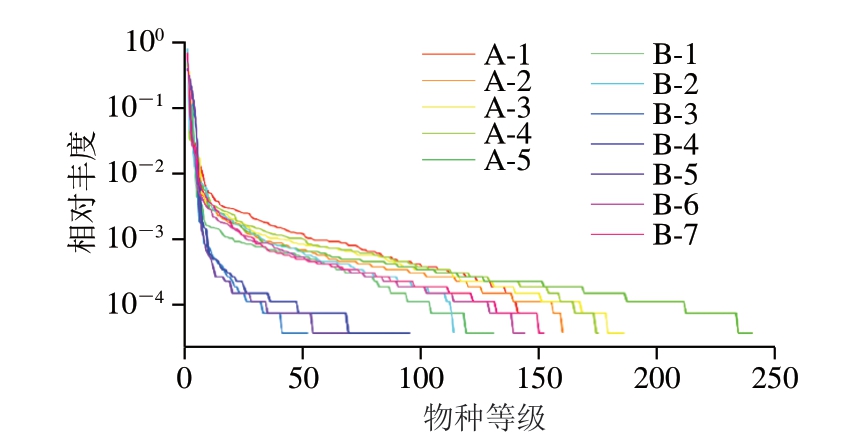
图2 等级聚类曲线
Fig.2 Rank abundance curves
2.2 蟠龙菜细菌群落的α多样性分析
Shannon指数能够反映物种多样性;Chao1指数能够反映物种丰富度,其能更敏捷地对稀有物种做出指示[20];ACE指数可用来估计群落中含有OTU数目的指数,ACE指数越大,表明群落的丰富度越高。由表2可知,A组样品Chao1指数、物种数、ACE指数在贮藏20 d内不断增大,贮藏20~40 d期间先减小后增加,并且贮藏结束时和贮藏开始时的值分别为最大值和最小值,说明4 ℃保存样品的物种丰富度在40 d内整体呈现不断上升趋势。同时,A组样品Shannon指数和Simpson指数变化趋势相同,为先下降后缓慢上升,然后降低,最终维持在一个相对稳定的状态,这表明蟠龙菜样品贮藏初期(10 d内)物种多样性减少,在10~20 d内不断增加,随后的20 d内缓慢下降并保持稳定。肖香[21]研究肴肉贮藏期间微生物多样性时发现,贮藏22 d时的物种多样性最高,与本研究结果基本一致。物种多样性呈上述动态变化可能是因为样品制作过程模拟了作坊式生产,生产环境并非完全无菌状态,从而导致加工过程引入较多外源微生物,并且杀菌环节不能杀灭全部微生物,所以在贮藏0 d时具有较高的α多样性水平;4 ℃的低温抑制了部分嗜热细菌生长,导致0~10 d时蟠龙菜中细菌多样性下降;在之后10 d内,部分受损或蛰伏细菌适应环境后开始生长和繁殖,故出现较多的特有菌群;随贮藏时间延长,微生物之间出现共生、协同和拮抗等作用,加之营养成分和环境变化,从而导致菌群多样性再次下降;最终蟠龙菜样品中的不同细菌在竞争后形成一个较为稳定的分布格局,整体处于动态平衡之中。
表2 基于16S rDNA及高通量平台评估蟠龙菜贮藏期间细菌α多样性
Table 2 Bacterial α-diversity during Panlongcai storage assessed by 16S rDNA HTS
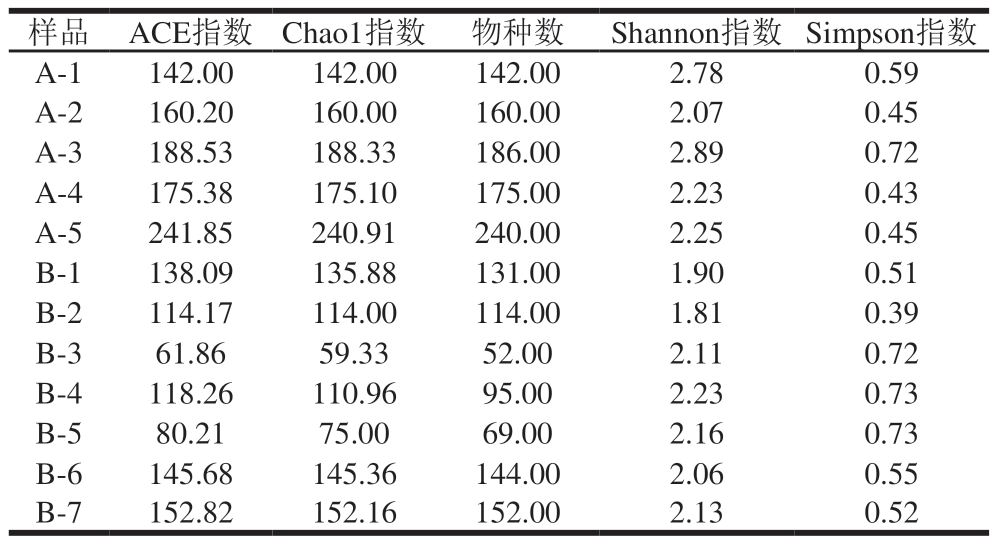
20 ℃贮藏样品Chao1指数、物种数、ACE指数总体呈现出先回落后上升的趋势,且最终数值大于初始值,表明在此期间蟠龙菜样品的菌群丰富度先下降随后波动上升。同时,其Shannon指数、Simpson指数在贮藏15 d时均为最大值,表明蟠龙菜样品细菌多样性在常温贮藏15 d时最高。
2.3 蟠龙菜细菌群落的β多样性分析
为深入探究蟠龙菜细菌群落在贮藏过程中存在的相似性,对细菌群落进行PCoA和非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类分析。由图3可知,PCo1为73.10%,PCo2为22.49%,其总和为95.59%,说明能在2 个主坐标上对不同样本细菌群落结构进行解释。从贮藏温度上来看,4 ℃贮藏样品除A-3外的其他样品距离较近,表明该温度下样品中菌群组成在贮藏初期和末期存在较大相似性。20 ℃贮藏蟠龙菜样品细菌组成在制作完成时(B-1)、贮藏初期(B-2)、中期(B-3、B-4、B-5)和后期(B-6、B-7)均显示出明显差异,说明在该温度条件下样品中不同细菌间呈现出较强的竞争状态,菌群结构变化较快。与叶可萍等[22]的研究结果基本一致。
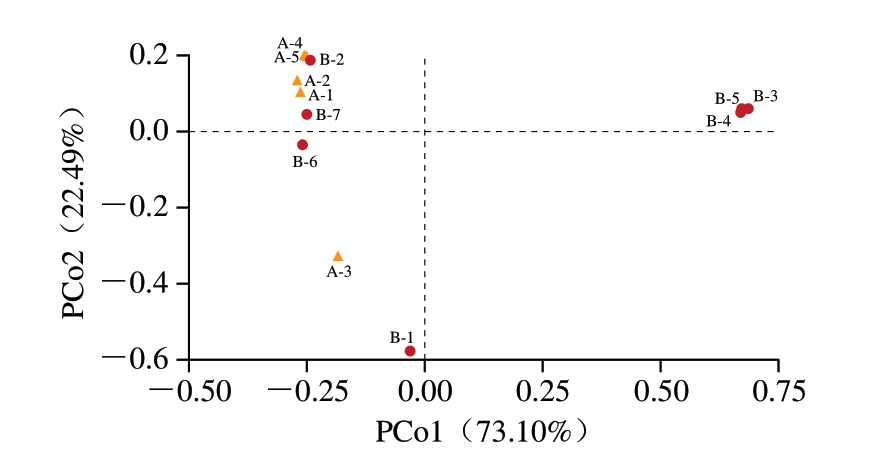
图3 不同温度贮藏期间蟠龙菜细菌群落PCoA
Fig.3 PCoA plot of bacterial communities in Panlongcai stored at different temperatures
由图4可知,在4 ℃贮藏条件下,所有蟠龙菜样品分为2 簇,其中A-1单独为一簇,其他样品聚集成簇,说明在贮藏前30 d内每10 d均有明显差异。20 ℃贮藏条件下的样品聚为3 簇,B-1单独为一簇,B-3、B-4、B-5聚为一簇,其他样品聚为一簇。综合PCoA和UPGMA,二者结果基本一致,说明随贮藏时间的延长,蟠龙菜细菌群落组成的相似性和差异性有一定变化,且20 ℃贮藏样品的变化更为明显。
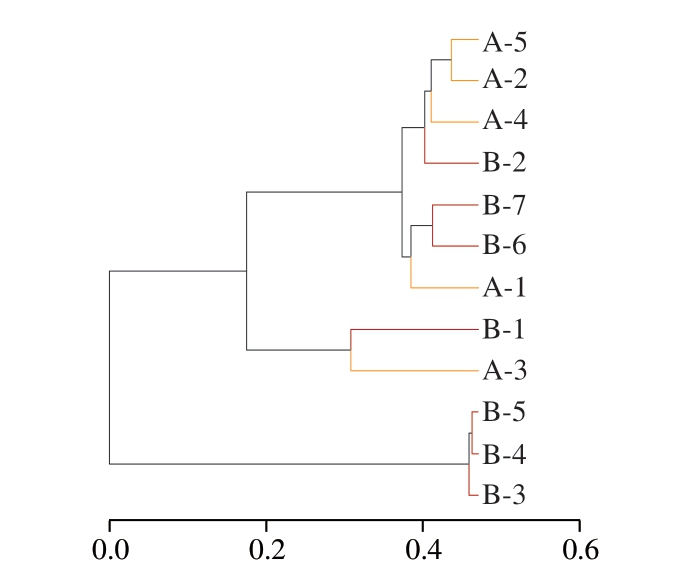
图4 不同温度贮藏期间蟠龙菜细菌群落UPGMA聚类分析
Fig.4 UPGMA clustering analysis of bacterial communities in Panlongcai stored at different temperatures
2.4 门水平菌群结构分析
聚类热图基于距离对物种和样本分别进行聚类,能反映所有样本在特定分类水平上物种组成的相似性及差异性,同时揭示了某些菌群可能存在分布的特异性。本研究选择相对丰度排名前100的物种绘制热图,选择相对丰度排名前10的物种绘制柱状图。在所有蟠龙菜样品中共检测到19 个细菌门。由图5可知,细菌主要组成分别为蓝菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)4 个门。赵睿等[23]研究不同腌腊肉制品时得出的优势菌种同样为这4 个菌门,相关研究[24-26]也表明,变形菌门、厚壁菌门这2 类门水平微生物是巴氏杀菌乳、烧鸡和肴肉贮藏期间的主要优势菌群。
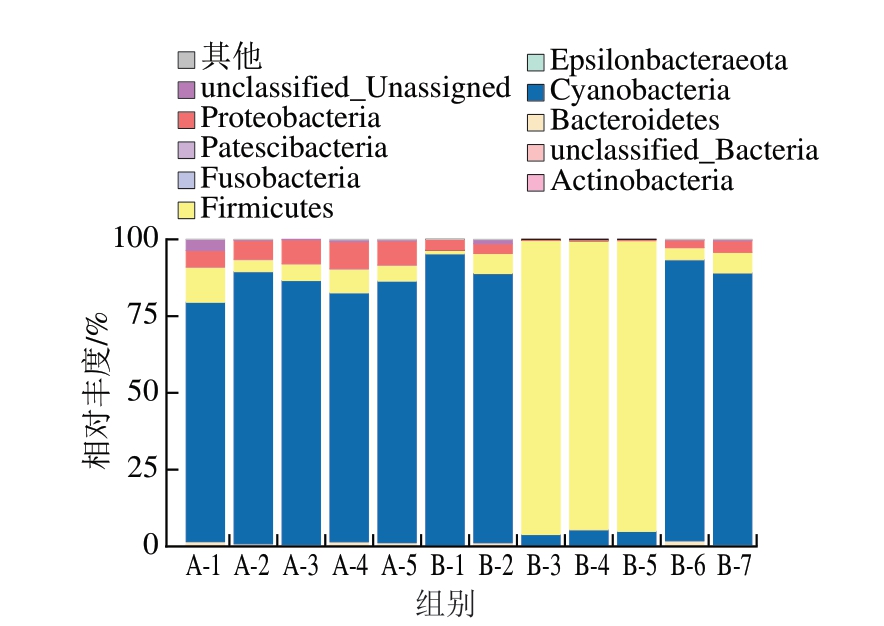
图5 蟠龙菜贮藏过程中细菌群落在门水平的分布情况
Fig.5 Distribution of bacterial communities at the phylum level in Panlongcai during storage
在低温贮藏过程中,蓝菌门占据绝对优势,前10 d其相对丰度由78.01%上升至88.62%,然后在之后的20 d内在8%范围内波动;厚壁菌门相对丰度波动范围为5.03%~7.62%;变形菌门相对丰度在前30 d从5.39%不断增加到8.83%,随后下降至7.84%,其相对丰度变化范围较小。常温贮藏过程中,蓝菌门或厚壁菌门在不同时期内变化较大,且在具有绝对优势时相对丰度最高,均超过87%;变形菌门和拟杆菌门相对丰度变化(2.44%~3.80%)较小。由图6可知,蟠龙菜中物种的丰度随贮藏时间延长而不断发生变化,且A组中丰度较高的物种较多,与图5所得结果一致。
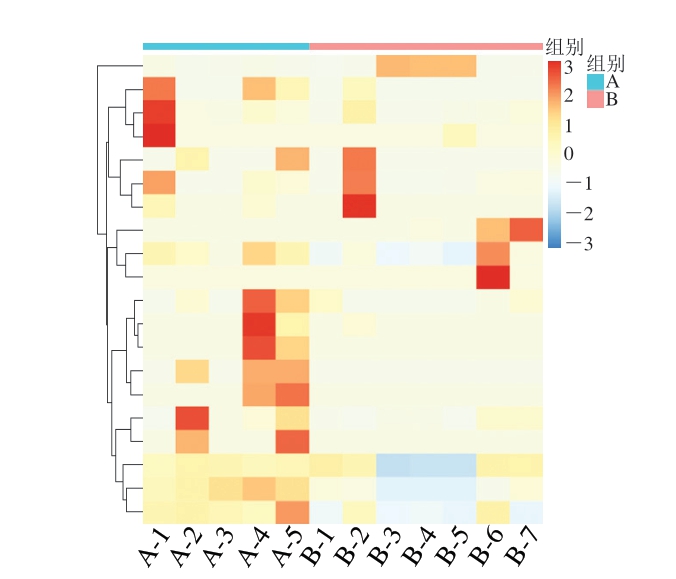
图6 蟠龙菜贮藏过程中细菌群落门水平分布热图
Fig.6 Heatmaps of phylum-level distribution of bacterial communities of Panlongcai during storage
2.5 属水平菌群结构分析
如图7所示,在属水平上,共检测出166 个属,在全部样品中排名前10的优势细菌属分别为不动杆菌属(Acinetobacter)、气单胞菌属(Aeromonas)、芽孢杆菌属(Bacillus)、unclassified_Chloroplast、unclassified_Enterobacteriaceae、乳杆菌属(Lactobacillus)、unclassified_Mitochondria、类芽孢杆菌属(Paenibacillus)、假单胞菌属(Pseudomonas)和链球菌属(Streptococcus),占总丰度的98.86%,这与Stellato等[27]的研究结果基本一致。
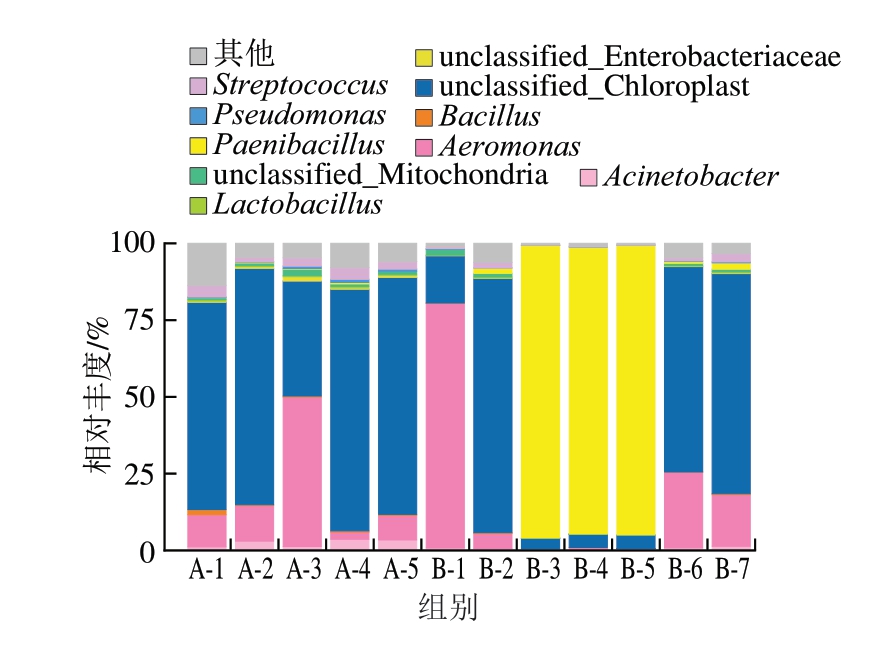
图7 蟠龙菜贮藏过程中细菌群落在属水平的分布情况
Fig.7 Distribution of bacterial communities at the genus level of Panlongcai during storage
在各贮藏条件下,随着贮藏时间的延长,属水平上细菌的相对丰度有明显波动,但组成并无明显变化。低温贮藏样品中相对丰度变化最大的是unclassified_Chloroplast和Aeromonas,unclassified_Chloroplast在20 d时相对丰度最低,为37.43%,在其他时期均在70%左右;Aeromonas相对丰度出现多次变化,且幅度(2.31%~7.99%)存在较大变化;此外,Acinetobacter的相对丰度在贮藏后期比初期上升约3 倍。常温贮藏样品中变化较大的是unclassified_Chloroplast、Aeromonas和Paenibacillus。unclassified_Chloroplast相对丰度在5 d内迅速从15.40%增至82.83%,随后5 d快速下降至4%左右,直至25 d时再次快速升至66.89%,其菌群相对丰度呈现大幅度波动,且与低温贮藏时呈现不同的波动趋势,说明温度对其生长繁殖产生了影响。Aeromonas相对丰度从贮藏初期的79.64%不断下降至0.22%,随后保持该相对丰度直至贮藏25 d(24.65%)。对Paenibacillus来说,在第10~20天内相对丰度保持在94%,但是在贮藏0 d时,该属物种处于不可检测状态,相对丰度存在较大变化。由图7可知,Paenibacillus在低温条件下并未占据优势,而是始终处于边缘地位,其相对丰度维持在0.46%以内,这是因为Paenibacillus最适生长温度为28~40 ℃[28],低温抑制了其生长繁殖。综上所述,推测常温贮藏蟠龙菜的腐败菌为Aeromonas和Acinetobacter,低温贮藏蟠龙菜的腐败菌为Aeromonas、Acinetobacter和Paenibacillus。
由图8可知,不同贮藏温度和不同贮藏阶段的样品细菌属水平组成具有明显差异。在属水平上,A组样品中具有较高丰度的物种在不同贮藏阶段变化明显;B组样品具有高丰度的物种较少,与A组间呈现较大差异。
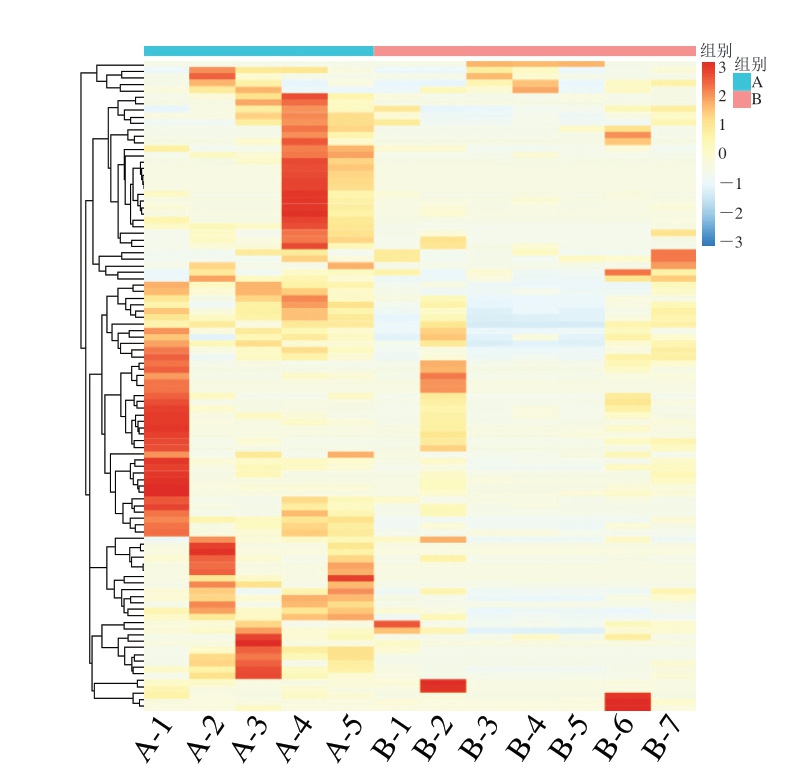
图8 蟠龙菜贮藏过程中细菌群落属水平分布热图
Fig.8 Heatmap of genus-level distribution of bacterial communities in Panlongcai stored at different temperatures
2.6 蟠龙菜贮藏期间菌相变化
花瓣图基于细菌菌群组成的相似性及差异,图中每个花瓣代表一个样品,花瓣共有部分代表所有样品共有的OTU数,花瓣上的数字代表该样品特有的OTU数目。由图9A可知,4 ℃贮藏样品核心OTU共有30 个,核心共有OTU数占总数的18.63%,说明蟠龙菜贮藏期间菌相具有较大变化。蟠龙菜制作当天样品中特有OTU数为48,在贮藏10 d时特有OTU数为11,贮藏20 d时上升至55,30 d时下降到9,40 d时为8,最后2 个阶段OTU数几乎持平。结果表明,贮藏期间菌群不断演化;20 d时有最高数量的特有菌株,表明这个阶段微生物处于快速生长时期,菌株较为丰富。
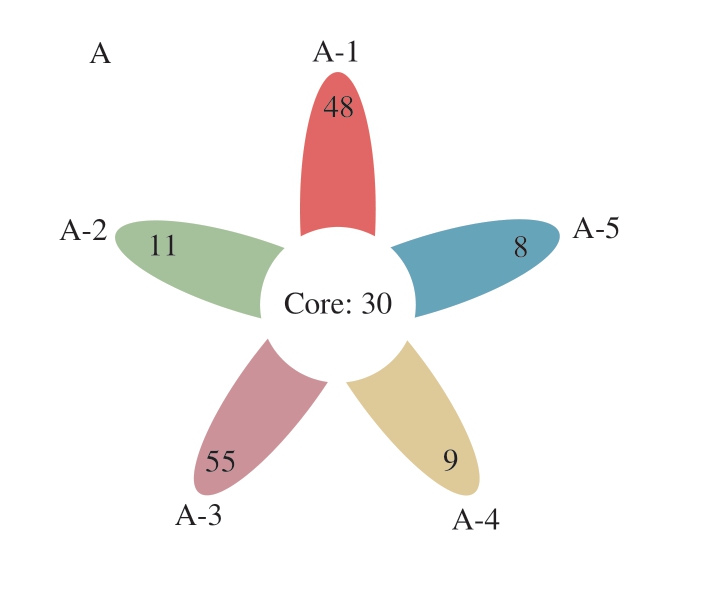
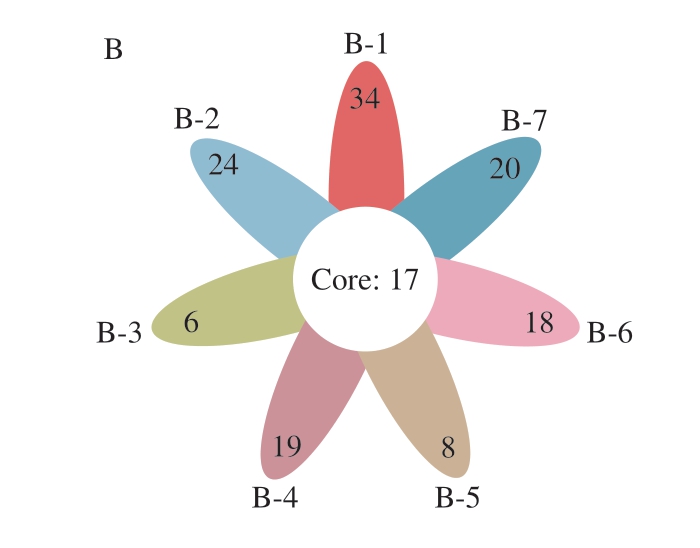
图9 蟠龙菜贮藏期间基于OTU的花瓣图
Fig.9 Flower plots showing the unique and shared OTUs of bacterial communities across different storage times
A.4 ℃;B.20 ℃。
由图9B可知,20 ℃贮藏样品核心OTU数为17,核心共有OTU数占总数的比例为11.64%,说明样品微生物多样性在贮藏期间同样具有较大变化。0~5 d样品中特有OTU数从34降低至24,在贮藏10 d时降到最低值6,此后上升至19后又下降至8,25~30 d时几乎持平,分别为18和20,表明贮藏期间菌群不断演化。
由图10可知,2 组样品共有OTU数为291,且占比为63.54%。常温贮藏样品特有OTU数为44,4 ℃贮藏样品中特有OTU数为123,约为常温贮藏样品的3 倍,这表明低温环境有利于生产过程中引入的外源微生物的生长繁殖。常温贮藏样品特有OTU较少可能是由于在短时间内优势腐败菌取得竞争优势,从而在一定程度上抑制了其他微生物生长。
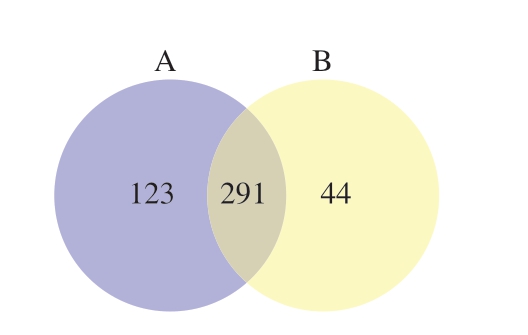
图10 不同温度贮藏蟠龙菜基于OTU的Venn图
Fig.10 Venn plot showing the unique and shared OTUs of bacterial communities across different storage temperatures
2.7 传统培养法微生物菌种鉴定结果
由表3可知,16S rDNA全长扩增测序比对后鉴定出的细菌分别为肠杆菌属(Enterobacter)、分散潘托菌(Pantoea dispersa)、托霍尼斯假单胞菌(Pseudomonas tohonis)、托拉假单胞菌(Pseudomonas juntendi)和耐冷假单胞菌(Pseudomonas psychrotolerans)。肠杆菌属细菌在自然界中广泛分布,例如土壤、水体、植物及动物肠道,它们能利用多种碳源,并且具有分解复杂有机物质的能力。在食品工业中,这些细菌可能参与食品腐败过程,对人类健康和食品安全构成风险。分散潘托菌是一种革兰氏阴性细菌,属于泛菌属,通常具有较高的基因多样性,并且能产生生物膜[29],这使得它们能够适应不同生态位和环境压力。虽然分散潘托菌主要与植物相关,但在某些情况下,它也可能与人类和动物的感染有关[30]。
表3 传统分离菌落16S rDNA鉴定结果
Table 3 Results of 16S rDNA identification of traditional colony isolates
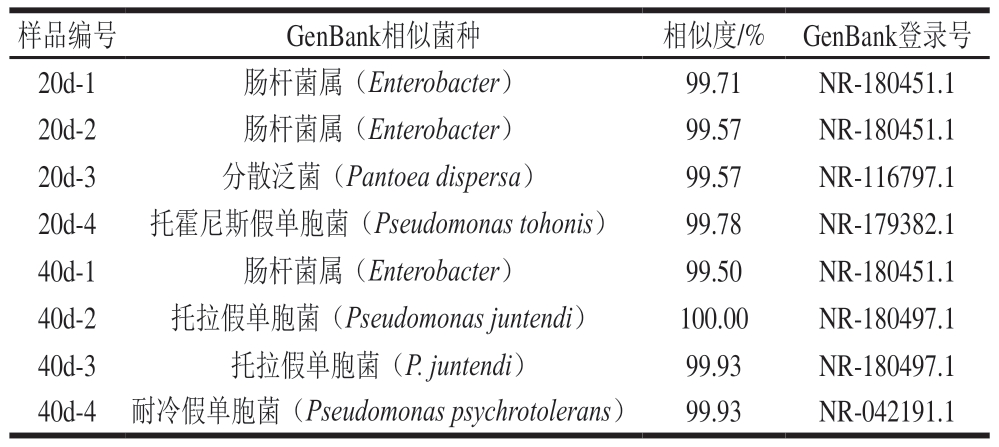
假单胞菌属是一类革兰氏阴性杆状细菌,广泛存在于自然界中,包括土壤、水体和植物表面,且具有代谢多样性和适应性强的特点。大量研究表明,假单胞菌在低温肉制品中广泛存在,且生长迅速,为优势菌种[31-32]。从蟠龙菜中分离出的托霍尼斯假单胞菌在低温(0~10 ℃)、高湿环境中能发展成为优势菌群,这使它在冷藏食品的腐败过程中尤为重要。托拉假单胞菌能在较宽的温度范围(4~40 ℃)和盐质量浓度范围(1~7 g/100 mL NaCl)内生长[33],但该细菌在食品中的腐败作用鲜见报道。耐冷假单胞菌能够在低温环境中生长和繁殖,不仅代谢能力强,而且能分解多种有机物,因而可能在蟠龙菜低温贮藏中的腐败过程中发挥一定作用。
结合高通量测序结果,假单胞菌属的细菌相对丰度处于前10位,可将其作为潜在优势腐败菌。因此在蟠龙菜加工和贮藏过程中,将假单胞菌属的细菌作为抑菌防腐的重点之一有助于开发有效的防腐策略,以延长蟠龙菜保质期并确保食品安全。
3 结论
在所有蟠龙菜样品中相对丰度最大的10 个属占总丰度的98.86%。在各贮藏温度条件下,随着贮藏时间的延长,属水平上细菌的丰度存在明显波动。低温贮藏蟠龙菜的物种丰富度在40 d内随时间的延长不断上升,贮藏后期较初期物种多样性减少。常温贮藏样品的菌群丰富度降低后波动上升,物种多样性在贮藏期间不断增加。同时,常温贮藏样品中优势菌群在较短时间内取得竞争优势,菌相变化更为显著。根据高通量测序结果,推测常温贮藏蟠龙菜的腐败菌为气单胞菌属和不动杆菌属,低温贮藏蟠龙菜的腐败菌为气单胞菌属、不动杆菌属和类芽孢杆菌属。采用传统微生物培养法从冷藏蟠龙菜中分离出托霍尼斯假单胞菌、托拉假单胞菌和耐冷假单胞菌3 种假单胞菌,推测假单胞菌属的细菌为潜在腐败菌。本研究对4、20 ℃贮藏蟠龙菜样品不同阶段菌群动态变化及优势腐败菌进行探讨,识别出核心优势微生物,对于后续产品针对性腐败控制、保质期延长和质量提升提供了一定理论支持,对其工业化和规模化发展具有一定现实意义。
[1] 鲁红梅.地方文化彰显与土特产形象设计研究: 以钟祥蟠龙菜包装为例[J].艺术品鉴,2020(3): 33-34.
[2] 王虹.蟠龙菜制作技艺保护与传承策略的研究[J].文化月刊,2023(12): 61-63.
[3] 董珍珍,刘香雨,汪进东.“互联网+”地方传统特色菜产品的跨地区推广营销: 以湖北钟祥蟠龙菜为例[J].品牌研究,2018(2): 100;102.DOI:10.19373/j.cnki.14-1384/f.2018.02.041.
[4] 杨舒然,杨大进,闫琳,等.火腿肠加工过程中微生物风险研究[J].中国食品卫生杂志,2019,31(1): 59-63.DOI:10.13590/j.cjfh.2019.01.013.
[5] MADOROBA E,MAGWEDERE K,CHAORA N S,et al.Microbial communities of meat and meat products: an exploratory analysis of the product quality and safety at selected enterprises in South Africa[J].Microorganisms,2021,9(3): 507.DOI:10.3390/microorganisms9030507.
[6] SHAHIDI F,PEGG R B.Hexanal as an indictor of meat flavor deterioration[J].Journal of Food Lipids,1994(1): 177-186.DOI:10.1111/j.1745-4522.1994.tb00245.x.
[7] ZHOU Z L,REN F Q,HUANG Q L,et al.Characterization and interactions of spoilage of Pseudomonas fragi C6 and Brochothrix thermosphacta S5 in chilled pork based on LC-MS/MS and screening of potential spoilage biomarkers[J].Food Chemistry,2024,444:138562.DOI:10.1016/j.foodchem.2024.138562.
[8] BORCH E,KANT-MUERMANS M L,BLIXT Y.Bacterial spoilage of meat and cured meat products[J].International Journal of Food Microbiology,1996,33(1): 103-120.DOI:10.1016/0168-1605(96)01135-X.
[9] HU Y Y,TIAN Y,ZHU J M,et al.Technological characterization and flavor-producing potential of lactic acid bacteria isolated from traditional dry fermented sausages in northeast China[J].Food Microbiology,2022,106: 104059.DOI:10.1016/j.fm.2022.104059.
[10] VON HOLY A,CLOETE T E,HOLZAPFEL W H.Quantification and characterization of microbial populations associated with spoiled,vacuum-packed Vienna sausages[J].Food Microbiology,1991,8(2):95-104.DOI:10.1016/0740-0020(91)90002-J.
[11] HOLLEY R A.Asymmetric distribution and growth of bacteria in sliced vacuum-packaged ham and Bologna[J].Journal of Food Protection,1997,60(5): 510-519.DOI:10.4315/0362-028X-60.5.510.
[12] DALGAARD P.Qualitative and quantitative characterization of spoilage bacteria from packed fish[J].International Journal of Food Microbiology,1995,26(3): 319-333.DOI:10.1016/0168-1605(94)00137-U.
[13] JUÁREZ-CASTELÁN C,GARCÍA-CANO I,ESCOBAR-ZEPEDA A,et al.Evaluation of the bacterial diversity of Spanish-type chorizo during the ripening process using high-throughput sequencing and physicochemical characterization[J].Meat Science,2019,150: 7-13.DOI:10.1016/j.meatsci.2018.09.001.
[14] LI X F,XIONG Q,XU B C,et al.Bacterial community dynamics during different stages of processing of smoked bacon using the 16S rRNA gene amplicon analysis[J].International Journal of Food Microbiology,2021,351: 109076.DOI:10.1016/j.ijfoodmicro.2021.109076.
[15]RUAN J G,XU J B,WU Z C,et al.Effect of partial replacement of NaCl by KCl and calcium ascorbate on the dynamics of bacterial community during storage of bacon based on 16S rRNA gene amplicon sequencing[J].LWT-Food Science and Technology,2023,184: 115013.DOI:10.1016/j.lwt.2023.115013.
[16] POŁKA J,REBECCHI A,PISACANE V,et al.Bacterial diversity in typical Italian salami at different ripening stages as revealed by highthroughput sequencing of 16S rRNA amplicons[J].Food Microbiology,2015,46: 342-356.DOI:10.1016/j.fm.2014.08.023.
[17] TIAN X J,WU W,YU Q Q,et al.Bacterial diversity analysis of pork longissimus lumborum following long term ohmic cooking and water bath cooking by amplicon sequencing of 16S rRNA gene[J].Meat Science,2017,123: 97-104.DOI:10.1016/j.meatsci.2016.09.007.
[18] SAMELIS J,KAKOURI A,REMENTZIS J.Selective effect of the product type and the packaging conditions on the species of lactic acid bacteria dominating the spoilage microbial association of cooked meats at 4 ℃[J].Food Microbiology,2000,17(3): 329-340.DOI:10.1006/fmic.1999.0316.
[19] KAUR M,SHANG H,TAMPLIN M,et al.Culture-dependent and culture-independent assessment of spoilage community growth on VP lamb meat from packaging to past end of shelf-life[J].Food Microbiology,2017,68: 71-80.DOI:10.1016/j.fm.2017.06.015.
[20] GONG Y,MA N,TANG H.Analysis of microbial community diversity and physicochemical factors in pit mud of different ages based on high-throughput sequencing[J].Canadian Journal of Microbiology,2022,68(11): 674-686.DOI:10.1139/cjm-2022-0125.
[21] 肖香.肴肉微生物多样性与特定腐败菌控制机制研究[D].镇江: 江苏大学,2013: 29-43.DOI:10.7666/d.Y2290049.
[22] 叶可萍,刘佳,刘梅,等.气调包装酱卤鸭翅贮藏过程中菌群结构分析[J].食品科学,2015,36(14): 201-205.DOI:10.7506/spkx1002-6630-201514039.
[23] 赵睿,邵长春,高世功,等.高通量测序分析不同腌腊肉制品细菌多样性[J].食品科学,2020,41(20): 90-96.DOI:10.7506/spkx1002-6630-20200416-210.
[24] 丁瑞雪,耿丽娟,张铁华,等.基于下一代测序技术分析巴氏杀菌乳中残留细菌在贮藏期间的动态变化[J].食品科学,2019,40(14): 77-83.DOI:10.7506/spkx1002-6630-20180825-276.
[25] ZHANG Y T,YAO Y J,GAO L F,et al.Characterization of a microbial community developing during refrigerated storage of vacuum packed Yao meat,a Chinese traditional food[J].LWT-Food Science and Technology,2018,90: 562-569.DOI:10.1016/j.lwt.2018.01.005.
[26] 张莉,马云昊,王颖,等.冷藏过程中气调包装烧鸡的理化特性及腐败菌分析[J].食品科学,2023,44(15): 188-195.DOI:10.7506/spkx1002-6630-20220914-122.
[27] STELLATO G,LA STORIA A,DE FILIPPIS F,et al.Overlap of spoilage-associated microbiota between meat and the meat processing environment in small-scale and large-scale retail distributions[J].Applied and Environmental Microbiology,2016,82: 4045-4054.DOI:10.1128/AEM.00793-16.
[28] PATOWARY R,DEKA H.Chapter 17: Paenibacillus[M]//AMARESAN N,KUMAR M S,ANNAPURNA K,et al.Beneficial microbes in agro-ecology: bacteria and fungi.Salt lake city: Academic Press,2020: 339-361.
[29] ASWANI R,NEJUMAL K K,SEBASTIAN K S,et al.Plant protection mediated through an array of metabolites produced by Pantoea dispersa isolated from pitcher plant[J].Applied Biochemistry and Biotechnology,2023,195(3): 1607-1629.DOI:10.1007/s12010-022-04179-x.
[30] YANG W T,YI Y J,XIA B.Unveiling the duality of Pantoea dispersa:a mini review[J].Science of the Total Environment,2023,873:162320.DOI:10.1016/j.scitotenv.2023.162320.
[31] 胡萍,徐幸莲,周光宏,等.真空包装烟熏火腿切片贮藏过程中微生物区系的动态变化[J].贵州农业科学,2010,38(8): 197-200.DOI:10.3969/j.issn.1001-3601.2010.08.065.
[32] 全拓.肉制品中主要微生物的检测与研究[D].重庆: 西南大学,2012: 19-33.
[33] TOHYA M,WATANABE S,TERAMOTO K,et al.Pseudomonas juntendi sp.nov.,isolated from patients in Japan and Myanmar[J].International Journal of Systematic and Evolutionary Microbiology,2019,69(11): 3377-3384.DOI:10.1099/ijsem.0.003623.