羊肉风味独特、营养丰富,在肉类贸易市场中占有重要位置[1]。阿勒泰羊为新疆维吾尔自治区阿勒泰地区特产,以体格大、肉脂生产性能高而著称,是我国国家地理标志产品。低温冷链运输能有效抑制肉类微生物生长,降低酶活性,减缓肉类变质速率,是羊肉的主要运输方式之一[2]。然而,阿勒泰地处我国西北边垂,由于特殊的地理位置,阿勒泰羊肉运输时间一般较长,过程中易发生温度波动,从而影响羊肉食用品质[3-4]。脂质是羊肉中主要的营养成分之一,与肉品风味、质地、多汁性等品质相关[5-6]。冻结和解冻过程会促进肉品脂质氧化[7],而脂质氧化产生的初级氧化产物进一步分解为二次氧化产物,形成一系列挥发性有机化合物,如醛类、醇类、酮类和呋喃类[8],这些挥发性代谢物产生的气味是影响肉类和肉制品风味的重要因素[9]。因此,为防止肉制品变质及减少变质所带来的危害,抑制肌肉中脂肪氧化十分重要。
现有研究表明,在肉制品中添加抗氧化剂能有效缓解脂肪氧化,是改善肉质的有效方法之一[10-11]。目前,食品中最常用的合成抗氧化剂是酚类抗氧化剂,而其中丁基羟基苯甲醚、丁基羟基甲苯、叔丁基对苯二酚和没食子酸丙酯的使用较为普遍[11]。随着合成抗氧化剂使用增加,其潜在的安全性风险受到广泛关注[12],大剂量使用合成抗氧化剂可能会对人体造成极大危害,如损伤DNA、诱导癌症和促进肿瘤等[13]。相比于人工合成抗氧化剂,天然抗氧化剂安全性较高且抗氧化能力较强[10],近年来得到更广泛的关注[10,14]。天然抗氧化剂是一种主要来源于植物、具有抗氧化活性的物质,主要为多酚类物质,几乎存在于植物的所有部分,包括木材、树皮、茎、叶、果实、根、花、花粉和种子,其中最常见的天然抗氧化剂有黄酮类化合物、肉桂酸衍生物、香豆素、生育酚和多功能有机酸[10]。葡萄籽含有较高水平的酚类物质(如酚酸、类黄酮和单宁),葡萄籽提取物(grape seed extract,GSE)是从葡萄籽中提取分离得到的一类多酚类物质,具有较好的抗菌和抗氧化活性[15-16]。由于GSE具有来源稳定、生产工艺成熟、安全性较高和水溶性等特点,在肉品保鲜研究中表现出良好的应用效果。刘以娟[17]将GSE用于猪肉保鲜,发现添加0.05%(m/m)GSE能有效抑制冷却猪肉中脂肪和蛋白质的氧化,减缓肉色褐变;Mielnik等[18]发现添加0.4~1.6 g/kg的GSE能有效减缓火鸡肉冷冻过程中的脂质氧化;赛麦提·艾则孜[19]发现加入0.15% GSE可以抑制风干羊肉蛋白质和脂肪氧化,并改变挥发性风味物质组成。
目前,现有研究主要通过测定脂质和蛋白质的氧化产物来评估反复冻融过程中肉质的变化或抗氧化剂对肉质的改善效果,如酸值、过氧化值和羰基值等理化指标,而对该过程中肉品风味的变化及GSE的改善效果了解尚不清晰。代谢组学可对生物体内尽可能多的代谢物进行定性及定量分析,从而寻找出品质差异相关的特征化合物[20]。其中,基于气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)的代谢组学技术适用于醛类、烃类和酯类等挥发性物质的检测,能检测到痕量的代谢产物,且配备有特征标记物鉴定的全面数据库,在食品风味分析中成为使用最广泛的分析平台之一[21],近年来逐渐在肉和肉制品的质量评价体系中占据重要地位。其中,顶空固相微萃取(headspace solid phase microextraction,HS-SPME)是色谱分析中常用的样品前处理方法,集取样、分析物的分离和富集步骤于一体[21],常结合GC-MS用于分析不同条件下肉类和肉制品气味改变原因[22]。
本研究考察GSE对反复冻融阿勒泰羊肉理化指标的影响,并采用基于GC-MS的代谢组学策略,探究羊肉冻融过程中挥发性化合物的变化。研究结果有助于阐明GSE对羊肉品质和风味的改善效果,为GSE在肉品保鲜中的应用提供理论支持。
1 材料与方法
1.1 材料与试剂
GSE(纯度≥99%)陕西朗德生物科技有限公司;三氯乙酸、乙二胺四乙酸二钠、硫代巴比妥酸(thiobarbituric acid,TBA)、氧化镁、1,1,3,3-四乙氧基丙烷(均为分析纯)国药集团化学试剂有限公司;氯化钠(色谱纯)上海麦克林生化科技股份有限公司;2-甲基-3-庚酮(色谱纯)德国Dr.Ehrenstorfer公司;C7~C30正构烷烃(色谱纯)美国Sigma公司。
1.2 仪器与设备
BC/BD-320HED冰柜 青岛海尔特种电冰柜有限公司;KMF720恒温恒湿培养箱 宾德环境试验设备(上海)有限公司;NR60CP+手提式多功能色差仪 深圳市三恩驰科技有限公司;205-pH酸碱度/温度测量仪 德图仪器国际贸易(上海)有限公司;Multiskan GO酶标仪、TRACETM1310 Q Exactive GC GC-MS系统 美国Thermo Fisher Scientific公司;NY-SFJ-10手持高速匀浆机常州恩培仪器制造有限公司;CTX质构分析仪 美国AMETEK Brookfield公司;Kjeltec 8420全自动凯氏定氮仪丹麦Foss公司;DVB/CAR/PDMS萃取头(50/30 μm)美国Supelco公司。
1.3 方法
1.3.1 阿勒泰羊肉冻融处理
选用新疆阿勒泰地区布尔津县6 只阿勒泰羊(6 月龄,公),屠宰后将背最长肌剔除脂肪组织、筋膜,切分成5 cm×5 cm×1.5 cm左右的块状,每块50 g左右。配制0.5 g/100 mL GSE水溶液,于电动喷壶中分装。喷洒GSE水溶液的羊肉为GSE组,喷洒蒸馏水的羊肉为空白组。在羊肉表面均匀喷洒GSE水溶液或蒸馏水后,将肉样放置在0~4 ℃恒温恒湿培养箱中。水分沥干至无水滴滴落,随后对肉样进行真空包装,置于-18 ℃冰箱中冷冻24 h后取出,4 ℃冷藏解冻12 h,此为1 次冻融处理[23],分别将羊肉冻融0、1、3、5、7 次,并进行后续分析测定。
1.3.2 阿勒泰羊肉肉色测定
参考戚军[24]的方法进行测定。肉样于空气中暴露20 min,然后用色差仪在羊肉表面随机取3 个位置进行测定,避开羊肉表面颜色不均位置,分别记录亮度值(L*)、红度值(a*)和黄度值(b*)。
1.3.3 阿勒泰羊肉肌红蛋白氧化状态测定
参考Krzywicki[25]的方法进行测定。取羊肉样品5.00 g,加入20 mL磷酸钠缓冲液(0.04 mol/L、pH 6.8),室温下(20 ℃)匀浆25 s后于4 ℃冰箱中放置1 h,随后离心30 min(15 ℃、950×g)。经滤纸过滤后用上述磷酸钠缓冲液补足至25 mL,涡旋15 s,测定其在525、545、565、572 nm波长处的吸光度。脱氧肌红蛋白、氧合肌红蛋白和高铁肌红蛋白相对含量按式(1)~(3)计算:

1.3.4 阿勒泰羊肉pH值测定
参考GB 5009.237—2016《食品pH值的测定》。
1.3.5 阿勒泰羊肉剪切力测定
参考NY/T 1180—2006《肉嫩度的测定 剪切力测定法》。
1.3.6 阿勒泰羊肉硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值测定
参考Su Liuyu等[26]的方法并做适当修改。取出解冻后的肉样3.00 g,加入15 mL 7.5 g/100 mL三氯乙酸(含0.1 g/100 mL乙二胺四乙酸二钠),于冰面上用均质机匀浆30 s,随后离心10 min(4 ℃、19 802×g),滤纸过滤,吸取2 mL滤液,加入等体积0.02 mol/L TBA溶液,另取2 mL三氯乙酸和TBA混合液作为空白样品;涡旋3 s,置于90 ℃水浴锅中反应30 min;冷却至室温,测定样品在532 nm波长处的吸光度,由1,1,3,3-四氧基丙烷建立标准曲线。TBARS值以丙二醛质量计,按式(4)计算:
式中:ρ为试样中丙二醛质量浓度/(μg/mL);V为试样溶液定容体积/mL;m为样品质量/g。
1.3.7 阿勒泰羊肉总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量测定
参考GB 5009.228—2016《食品中挥发性盐基氮的测定》,使用自动凯氏定氮仪法进行测定。
1.3.8 阿勒泰羊肉中挥发性化合物测定
1.3.8.1 前处理方法
参考Song Xuechao等[27]的方法,并稍作修改。于绞肉机中将羊肉搅碎,取2 g羊肉糜,放入20 mL顶空样品瓶中,加入10 µL 2-甲基-3-庚酮(0.01 μg/μL),再加入4 mL饱和氯化钠溶液促进组分挥发,均质1 min。密封样品瓶,置于40 ℃平衡15 min;随后将老化后的萃取头插入样品瓶,40 ℃顶空吸附30 min,接着将萃取头插入GC-MS进样口(250 ℃)解吸5 min。为防止样品污染,2 个样品检测之间将萃取头于250 ℃老化2 min。
1.3.8.2 GC-MS分析条件
GC条件[27]:TG -5MS石英毛细管柱(60 m×0.25 mm,0.25 μm);载气为高纯氦气,流速1.2 mL/min;采用分流进样模式,进样比15∶1;进样口温度250℃;烘箱温度设置如下:初始40 ℃,5 min;以5 ℃/min的速率升至110 ℃;10 ℃/min升至250 ℃,保持5 min;总运行时间为38 min。
MS条件[28]:电子电离源,电压70 eV;离子源温度280 ℃;传输线温度250 ℃;扫描质量范围m/z 33~350,全扫描模式;质量分辨率200 m/z。
1.3.8.3 挥发性风味物质分析
使用Xcalibur软件(美国Thermo Fisher Scientific公司)记录和分析实验色谱及光谱图,TraceFinder 4.1软件(美国Thermo Fisher Scientific公司)的Deconvolution插件进行自动解卷积、峰对齐和峰面积计算,结合NIST14谱库对化合物进行定性和半定量分析。
1.3.8.4 相对气味活度值(relative odor activity value,ROAV)计算
采用ROAV评估单个挥发性成分对样品整体气味的贡献[29]。挥发性物质的阈值和气味描述来源于https://www.vcfonline.nl/VcfCompounds.cfm及https://www.flavornet.org[30]。ROAV按式(5)计算:
其中:Ci为目标挥发性化合物含量/(μg/g);Ti为目标挥发性化合物气味阈值/(μg/g);Cmax为气味活度值最大的挥发性化合物含量/(μg/g);Tmax为气味活度值最大的挥发性化合物气味阈值/(μg/g)。
1.4 数据处理
各实验重复3 次,结果以平均值±标准差表示。采用Microsoft Excel 2019软件对数据进行处理及分析。采用SPSS 27.01软件(IBM,Chicago,IL,USA)中的ANOVA进行方差分析,采用独立样本t检验和Duncan多重检验进行差异显著性分析,显著性定义为P<0.05。使用R语言工具包(Version 4.1.2)进行热图绘制。
2 结果与分析
2.1 冻融对阿勒泰羊肉颜色和肌红蛋白相对含量的影响
如表1所示,在空白组和GSE组中,随着冻融次数的增多,羊肉L*呈下降趋势,a*、b*呈先上升后下降的趋势。在空白组中,与未冻融羊肉相比,冻融7 次后羊肉L*显著下降(P<0.05);在GSE组中,与未冻融羊肉相比,冻融1 次后羊肉L*显著下降(P<0.05)。与空白组相比,在未冻融前添加GSE后能显著提高羊肉L*(P<0.05),在冻融过程中仅发现冻融5 次时空白组L*显著高于GSE组(P<0.05),而2 组羊肉的a*和b*在冻融过程中均无显著差异。L*的变化可能与羊肉在冻融过程中的汁液损失有关,汁液损失增加,肉表面反射的光减少,进而导致肉的L*减小[24]。a*变化的原因可能是冻融过程中汁液损失的逐渐增多,导致色素相关物质流出[31];或者与肌红蛋白组成有关,表现为高铁肌红蛋白中还原酶活力受到抑制,使高铁肌红蛋白无法转化为氧合肌红蛋白而大量积累,导致肉色暗沉[32]。b*的变化可能与羊肉脂肪氧化有关,脂肪氧化产物与磷脂头部基团或蛋白质中的氨基酸发生非酶褐变[24],导致b*发生变化。与空白组相比,添加GSE后并不改变羊肉L*、a*和b*在冻融前后的变化趋势;由于GSE呈水溶性,在冻融过程中可能被肉流失的汁液稀释和溶解,使得GSE难以维持肉色稳定性。
表1 反复冻融过程中阿勒泰羊肉L*、a*、b*和肌红蛋白氧化状态的变化
Table 1 Changes of L*,a*,b* values and myoglobin oxidation state of Altay mutton during repeated freeze-thaw process
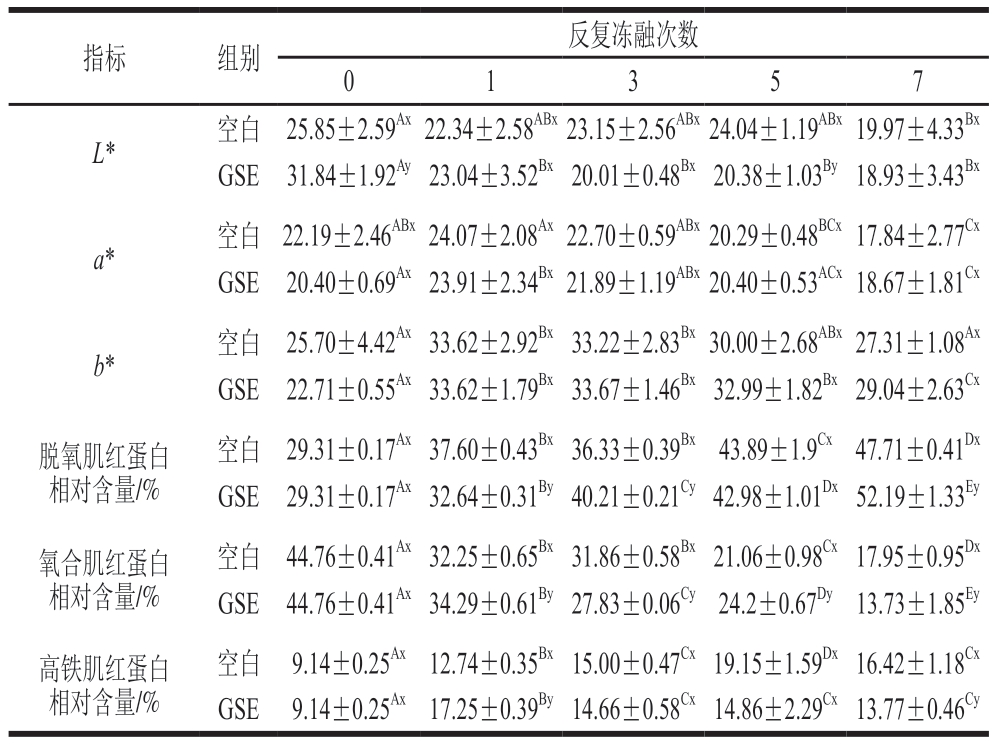
注:同行大写字母不同表示同组不同冻融次数间差异显著(P<0.05);同列小写字母不同表示相同冻融次数组间差异显著(P<0.05)。表2同。
脱氧肌红蛋白、氧合肌红蛋白和高铁肌红蛋白分别呈紫色、鲜红色和褐色,其含量与羊肉色泽相关。随着冻融次数增多,3 组羊肉的脱氧肌红蛋白相对含量呈上升趋势,氧合肌红蛋白相对含量呈下降趋势,高铁肌红蛋白相对含量呈先上升后下降趋势,与张朵朵等[23]的研究结果类似。反复冻融促进了肌红蛋白氧化,在该过程中氧合肌红蛋白被氧化为高铁肌红蛋白,从而导致肉色变化[25]。与空白组相比,添加GSE不改变冻融前后肌红蛋白相对含量的变化趋势,仅改变同一冻融次数下不同肌红蛋白之间的相对含量。
2.2 冻融对阿勒泰羊肉pH值和剪切力的影响
由图1可知,随着冻融次数的增多,羊肉pH值呈降低趋势,与周昱宇等[33]的研究结果相符。冻融1 次时,与空白组相比,添加GSE能显著减缓pH值降低(P<0.05),但在超过1 次后其效果不显著。曲宝宝[34]发现,牛肉馅在-18 ℃条件下贮藏45 d后,添加GSE的牛肉馅pH值显著高于未添加GSE的牛肉馅,但超过45 d后差异不显著。pH值变化与脂肪酸的生成或细菌代谢过程有关[34],以上过程中产生的酸性物质可能是羊肉pH值下降的原因。
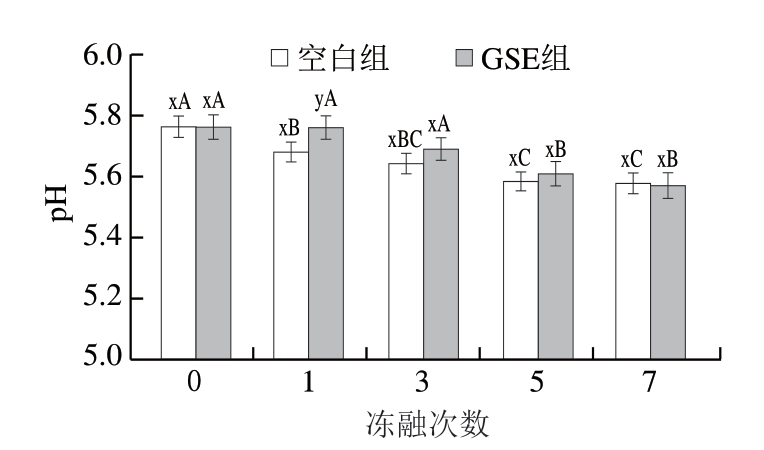
图1 反复冻融对阿勒泰羊肉pH值的影响
Fig.1 Effect of repeated freeze-thaw on pH of Altay mutton
大写字母不同表示同组不同冻融次数间差异显著(P<0.05);小写字母不同表示相同冻融次数组间差异显著(P<0.05)。图2~4同。
嫩度是羊肉的重要品质属性,也是影响消费者购买欲的重要指标,可以通过剪切力大小来表征,剪切力越小,则嫩度越大[35]。由图2可知,随着冻融次数的增多,羊肉的剪切力呈降低的趋势,剪切力下降表明羊肉的肌原纤维在反复冻融过程中受到破坏[23],使得肌肉组织容易被切割而变软。冻融1 次时,与空白组相比,添加GSE能显著延缓剪切力下降(P<0.05),但在超过1 次后其效果不显著。
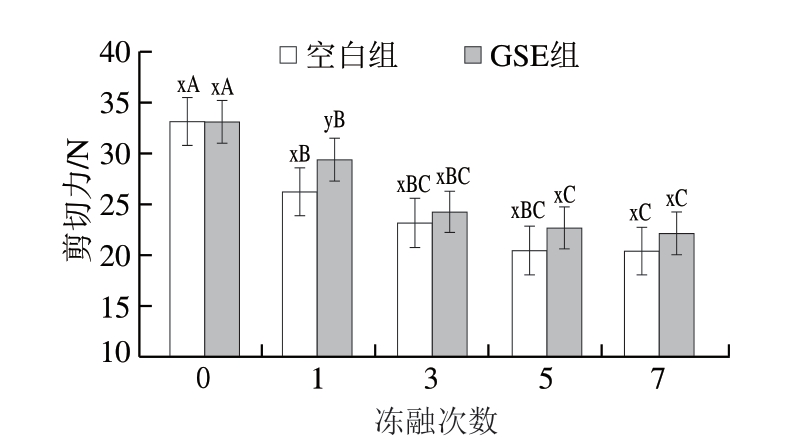
图2 反复冻融对阿勒泰羊肉剪切力的影响
Fig.2 Effect of repeated freeze-thaw on shear force of Altay mutton
2.3 冻融对阿勒泰羊肉TBARS值和TVB-N含量的影响
TBARS值表示羊肉中丙二醛含量,丙二醛是多不饱和脂肪酸二次脂质氧化过程中产生的最重要的醛类物质之一,与肉类风味相关,少量时会产生腐臭气味[8]。以往研究将TBARS值2.0~2.5 mg/kg作为肉类和肉制品有无氧化酸败的公认限值[35]。由图3可知,随着冻融次数的增加,2 组羊肉TBARS值均呈上升趋势,且与初始状态相比,冻融7 次的羊肉TBARS值均显著升高(P<0.05)。空白组样品冻融1 次后的TBARS值即超过2 mg/kg,表明反复冻融促进了羊肉的脂质氧化,产生较多丙二醛。相比于空白组,添加GSE能显著减少羊肉冻融过程中丙二醛的产生,且GSE组的TBARS值始终小于2 mg/kg,表明GSE具有良好的抗氧化效果。
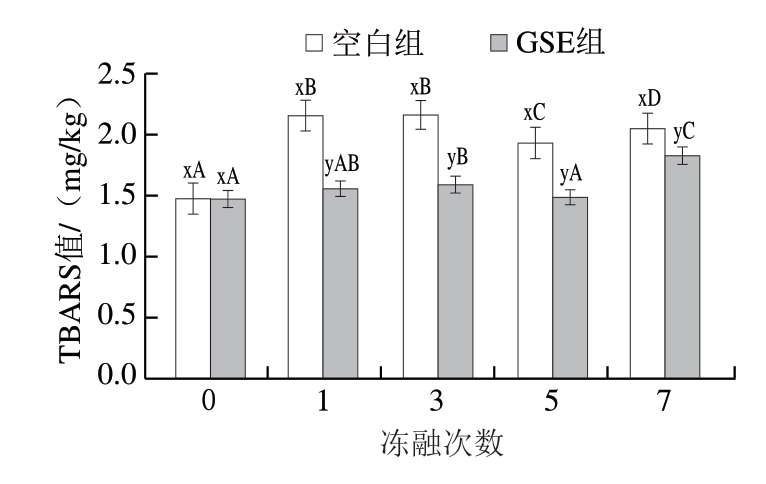
图3 反复冻融对阿勒泰羊肉TBARS值的影响
Fig.3 Effect of repeated freeze-thaw on TBARS value of Altay mutton
TVB-N可由微生物和酶分解蛋白质产生[36],与肉品品质相关。由图4可知,与初始相比,2 组冻融1 次后的羊肉中TVB-N含量均显著上升(P<0.05);此外,与空白组相比,添加GSE能显著减少冻融1 次后羊肉的TVB-N含量(P<0.05)。随着冻融次数的增加,TVB-N含量呈下降趋势,且添加GSE不改变该变化趋势。经多次冻融后的羊肉中TVB-N含量始终低于GB 2707—2016《鲜(冻)畜、禽产品》中规定的15 mg/100 g,表明羊肉变质程度较难通过单一的TVB-N含量可接受阈值判断[37]。TVB-N含量变化与pH值、TVB-N前体浓度或微生物群组成相关[37],冻融过程中pH值下降、TVB-N前体物质的消耗或微生物组成改变可能导致TVB-N含量减少,其中GSE对该过程的影响尚不明确。
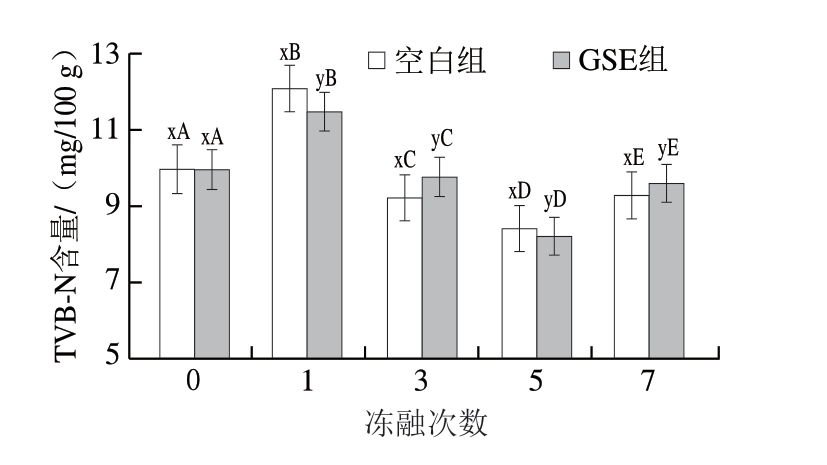
图4 反复冻融对阿勒泰羊肉TVB-N含量的影响
Fig.4 Effect of repeated freeze-thaw on TVB-N content of Altay mutton
2.4 冻融对阿勒泰羊肉挥发性化合物的影响
2.4.1 挥发性化合物含量的变化
在阿勒泰羊肉中鉴定并半定量了39 种挥发性化合物,分别为醛类(8 种)、醇类(8 种)、烯烃类(3 种)、烷烃类(3 种)、酮类(5 种)、酯类(3 种)、酸类(2 种)、呋喃类(2 种)、含硫化合物(1 种)、卤素(1 种)和苯类化合物(3 种)。由图5可知,随着冻融次数增加,羊肉中总挥发性化合物含量呈现先升高后下降的趋势。含硫化合物、醛类、醇类、酮类和酸类挥发性化合物含量呈先升高后下降的趋势,这些物质与羊肉风味密切相关[38-39],其含量变化可能与羊肉脂质氧化速率有关。其中含硫化合物的含量最高,其次是醛类和醇类。Heck等[40]同样发现,在脂质氧化产生的挥发性化合物中,醛类含量最高。Song Xuechao等[27]也观察到部分醛类物质含量在肉贮藏过程中呈下降趋势,该现象可能与基质和挥发性物质相互作用(如醛与蛋白质的胺基和巯基之间的相互作用)增强了风味的保留,进而降低挥发性物质顶空浓度[9]有关,也可能是由于羊肉在多次冻融过程中促进醛类化合物氧化生成酸类或还原生成醇类物质[41]。
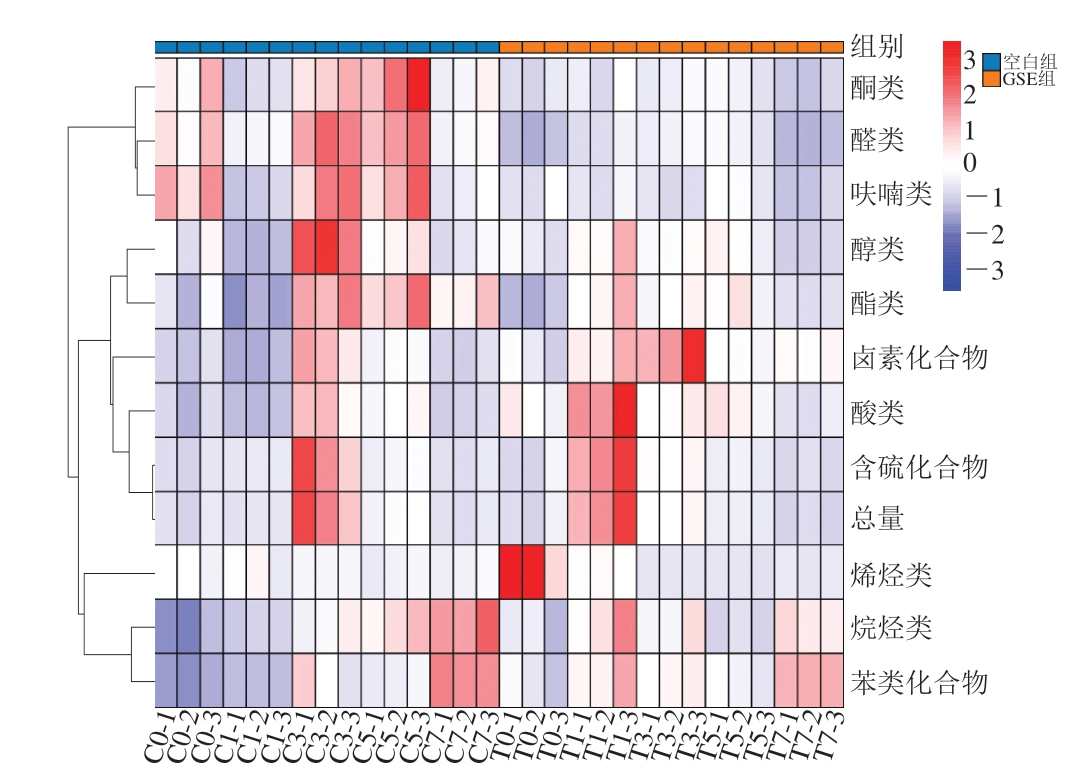
图5 反复冻融对阿勒泰羊肉挥发性化合物的影响
Fig.5 Effects of repeated freeze-thaw process on volatile compounds in Altay mutton
C0~C7、T0~C7分别表示空白组、GSE组冻融循环0、1、3、5、7 次。
随着冻融次数增加,含硫化合物、呋喃类、酸类和含卤化合物含量也呈先上升后下降的趋势。烷烃类、酯类和苯类化合物含量在反复冻融过程中呈上升趋势,而烯烃类含量无明显变化,它们都可能来自脂质氧化[39]。含硫化合物的来源可能是含硫氨基酸的酶促蛋白水解[41]或硫胺素降解[42]。Sam等[43]发现,脂质氧化发生在冷冻贮藏早期,呋喃和酸类物质含量在牛肉的冷冻贮藏过程中逐渐下降。相较于恒温条件,反复冻融促进了脂质氧化,加速了挥发性化合物的产生和转化。添加GSE能抑制羊肉由反复冻融引起的脂质氧化,从而减少醛类、酮类、呋喃类、酯类和烷烃类挥发性化合物含量,并加快含硫化合物、醇类、酸类、含卤化合物和苯类化合物的产生和转化。
2.4.2 挥发性化合物含量变化对阿勒泰羊肉风味的影响
挥发性化合物对羊肉风味的影响不仅取决于其含量,也与该化合物本身的气味阈值有关。其中ROAV=0.1的组分为重要风味化合物,ROAV<0.1的组分是对整体风味影响较小的化合物[29]。由表2可知,通过计算挥发性化合物的ROAV,共计找到10 个挥发性化合物对羊肉风味有主要贡献,其中包含己醛、1-辛烯-3-醇、(E,E)-2,4-十烯醛、(E,Z)-2,4-十烯醛、(E)-2-辛醛、辛醛、戊醛、3-辛酮、二硫化碳和2-戊基呋喃。在空白组中,以上挥发性化合物含量总体呈先增加后减少的趋势。其中醛类化合物的风味特征是水果和脂肪味,当它们的含量较高时会产生难闻的气味[43],醛类的产生与甘油三酯的水解和脂肪酸、氨基酸的代谢有关[44],也可被氧化成酸类或还原成醇类等挥发性物质[45]。由表2可知,有6 种醛类化合物对羊肉风味有主要贡献。与空白组相比,添加GSE可减少反复冻融过程中己醛、(E,E)-2,4-十烯醛、(E,Z)-2,4-十烯醛、(E)-2-辛醛、辛醛和戊醛的产生,从而改善羊肉风味。
表2 反复冻融对阿勒泰羊肉中主要挥发性风味成分的影响
Table 2 Effects of repeated freeze-thaw on main volatile flavor components in Altay mutton
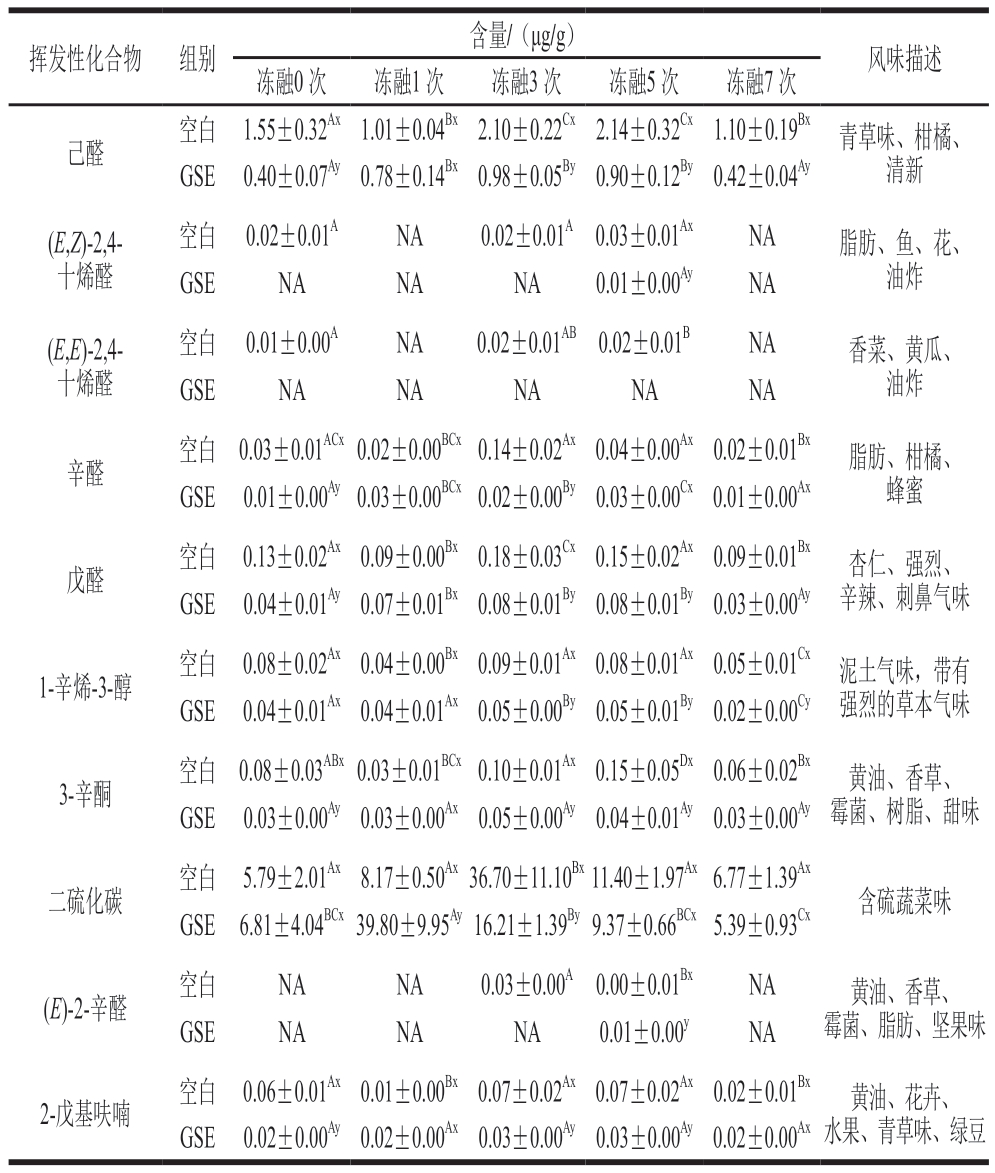
注:NA.未检出。
肉类中醇类的产生主要与蛋白质水解、葡萄糖和氨基酸代谢、甲酮还原、脂质氧化产物醛的还原和微生物代谢有关[41]。1-辛烯-3-醇来源于不饱和脂肪酸的氧化,能使肉产生难闻的气味[45]。3-辛酮和2-戊基呋喃也可来源于不饱和脂肪酸的氧化[46-47],它们的含量在反复冻融过程中呈先升高后下降的趋势。Xu Le等[9]观察到,在羊肉冷藏7 d过程中,1-辛烯-3-醇和2-戊基呋喃含量也呈先升高后下降的趋势;Sam等[43]观察到2-戊基呋喃含量在牛肉的长时间冷冻贮藏中显著减少,这些挥发性化合物含量的变化可能受到肉中脂肪氧化速率影响[42],并使羊肉的风味在冻融后发生改变。冻融3 次后,与空白组相比,添加GSE能显著减少羊肉中1-辛烯-3-醇、3-辛酮和2-戊基呋喃的生成(P<0.05),可能是因为GSE抑制了不饱和脂肪酸的氧化[8]。二硫化碳具有含硫蔬菜的风味特征[45],是羊肉中常见且重要的化合物,其来源可能是含硫氨基酸的酶促蛋白水解[44,48]。在冻融过程中,二硫化碳含量呈先上升后下降的趋势,与空白组相比,添加GSE不能减少二硫化碳总生成量,可能是GSE对含硫氨基酸的蛋白水解抑制效果较差。综上,反复冻融主要引起醛类、醇类、酮类、呋喃类和含硫化合物含量的变化,进而改变羊肉风味;添加GSE主要抑制了醛类、醇类、酮类和呋喃类化合物的产生,从而改善羊肉的风味。
3 结论
反复冻融会降低阿勒泰羊肉的感官品质和营养品质。在反复冻融过程中,羊肉颜色发生劣变,pH值和剪切力下降,脂肪氧化加剧,产生以己醛、1-辛烯-3-醇、(E,E)-2,4-十烯醛、(E,Z)-2,4-十烯醛、(E)-2-辛醛、辛醛、戊醛、3-辛酮、二硫化碳和2-戊基呋喃为主要代表的挥发性风味物质,从而使羊肉的风味发生劣变。将0.5 g/100 mL GSE水溶液喷洒在阿勒泰羊肉表面,对羊肉的颜色、剪切力等指标无明显影响,但可减缓羊肉在反复冻融过程中pH值的下降。在冻融过程中,与空白组相比,添加GSE能显著减小TBARS值(P<0.05),并明显减少羊肉在反复冻融过程中因脂质氧化产生的醛类、酮类、醇类和呋喃类挥发性化合物,从而改善羊肉风味。综上,喷洒0.5 g/100 mL GSE可以有效改善羊肉因反复冻融造成的风味改变和营养损失。本研究结果有助于深入理解羊肉在冻融过程中风味的变化,为GSE用于肉品贮藏和加工提供一定的理论参考和技术支撑。
[1] 帕提姑·阿布都克热.新疆地方绵羊品种肌纤维特性与产肉量及肉品质的相关性研究[D].乌鲁木齐: 新疆农业大学,2015: 1-2.
[2] FRELKA J C,PHINNEY D M,YANG X,et al.Assessment of chicken breast meat quality after freeze/thaw abuse using magnetic resonance imaging techniques[J].Journal of the Science of Food and Agriculture,2019,99(2): 844-853.DOI:10.1002/jsfa.9254.
[3] REN Q S,FANG K,YANG X T,et al.Ensuring the quality of meat in cold chain logistics: a comprehensive review[J].Trends in Food Science and Technology,2022,119: 133-151.DOI:10.1016/j.tifs.2021.12.006.
[4] 张立国,程国辉.我国农产品物流研究进展[J].江苏农业科学,2017,45(8): 1-5.DOI:10.15889/j.issn.1002-1302.2017.08.001.
[5] SUN N,CHEN J,WANG D,et al.Advance in food-derived phospholipids: sources,molecular species and structure as well as their biological activities[J].Trends in Food Science and Technology,2018,80: 199-211.DOI:10.1016/j.tifs.2018.08.010.
[6] ZHANG M,SU R,CORAZZIN M,et al.Lipid transformation during postmortem chilled aging in Mongolian sheep using lipidomics[J].Food Chemistry,2023,405: 134882.DOI:10.1016/j.foodchem.2022.134882.
[7] LEYGONIE C,BRITZ T J,HOFFMAN L C.Impact of freezing and thawing on the quality of meat: review[J].Meat Science,2012,91(2):93-98.DOI:10.1016/j.meatsci.2012.01.013.
[8] DOMÍNGUEZ R,PATEIRO M,GAGAOUA M,et al.A comprehensive review on lipid oxidation in meat and meat products[J].Antioxidants,2019,8(10): 429.DOI:10.3390/antiox8100429.
[9] XU L,LIU C Y,LI S B,et al.Association of lipidome evolution with the corresponding volatile characteristics of postmortem lamb during chilled storage[J].Food Research International,2023,169: 112916.DOI:10.1016/j.foodres.2023.112916.
[10] HADIDI M,AGHAHABAEI F,MORENO A,et al.Plant by-product antioxidants: control of protein-lipid oxidation in meat and meat products[J].LWT-Food Science and Technology,2022,169: 114003.DOI:10.1016/j.lwt.2022.114003.
[11] XU X Q,LIU A M,HU S Y,et al.Synthetic phenolic antioxidants:metabolism,hazards and mechanism of action[J].Food Chemistry,2021,353: 129488.DOI:10.1016/j.foodchem.2021.129488.
[12] JI X,LIANG J,WANG Y,et al.Synthetic antioxidants as contaminants of emerging concern in indoor environments: knowns and unknowns[J].Environmental Science and Technology,2023,57:21550-21557.DOI:10.1021/acs.est.3c06487.
[13] RIBEIRO S J,SANTOS C M J M,SILVA R K L,et al.Natural antioxidants used in meat products: a brief review[J].Meat Science,2018,148: 181-188.DOI:10.1016/j.meatsci.2018.10.016.
[14] STOIA M,OANCEA S.Low-molecular-weight synthetic antioxidants:classification,pharmacological profile,effectiveness and trends[J].Antioxidants,2022,11(4): 638.DOI:10.3390/antiox11040638.
[15] NOWSHEHRI A J,BHAT A Z,SHAH Y M.Blessings in disguise:bio-functional benefits of grape seed extracts[J].Food Research International,2015,77: 333-348.DOI:10.1016/j.foodres.2015.08.026.
[16] RABABAH T M,HETTIARACHCHY N S,HORAX R.Total phenolics and antioxidant activities of fenugreek,green tea,black tea,grape seed,ginger,rosemary,gotu kola,and ginkgo extracts,vitamin E,and tert-butylhydroquinone[J].Journal of Agricultural and Food Chemistry,2004,52(16): 5183-5186.DOI:10.1021/jf049645z.
[17] 刘以娟.葡萄籽提取物对冷却猪肉抗脂质氧化和护色效果研究[D].广州: 暨南大学,2012: 34-36.
[18] MIELNIK M B,OLSEN E,VOGT G,et al.Grape seed extract as antioxidant in cooked,cold stored turkey meat[J].LWT-Food Science and Technology,2006,39(3): 191-198.DOI:10.1016/j.lwt.2005.02.003.
[19] 赛麦提·艾则孜.葡萄籽提取物和石榴皮提取物对风干羊肉品质影响研究[D].乌鲁木齐: 新疆农业大学,2022: 36-44.
[20] UTPOTT M,RODRIGUES E,DE OLIVEIRA RIOS A,et al.Metabolomics: an analytical technique for food processing evaluation[J].Food Chemistry,2022,366: 130685.DOI:10.1016/j.foodchem.2021.130685.
[21] BEALE D J,PINU F R,KOUREMENOS K A,et al.Review of recent developments in GC-MS approaches to metabolomics-based research[J].Metabolomics,2018,14(11): 1-31.DOI:10.1007/s11306-018-1449-2.
[22] GRABEŽ V,BJELANOVIĆ M,ROHLOF J,et al.The relationship between volatile compounds,metabolites and sensory attributes: a case study using lamb and sheep meat[J].Small Ruminant Research,2019,181: 12-20.DOI:10.1016/j.smallrumres.2019.09.022.
[23] 张朵朵,刘永峰,古明辉,等.猕猴桃多酚在羊肉反复冻融过程中的改善肉质和延缓氧化作用[J].食品科学,2022,43(16): 36-45.DOI:10.7506/spkx1002-6630-20211009-074.
[24] 戚军.冻融对羊肉品质的影响[D].南京: 南京农业大学,2009: 23-24.
[25] KRZYWICKI K.The determination of haem pigments in meat[J].Meat Science,1982,7(1): 29-36.DOI:10.1016/0309-1740(82)90095-X.
[26]SU L Y,ZHAO J L,XIA J L,et al.Protecting meat color: the interplay of betanin red and myoglobin through antioxidation and coloration[J].Food Chemistry,2024,442(2): 138410.DOI:10.1016/j.foodchem.2024.138410.
[27] SONG X C,CAMELLAS E,NER C.Screening of volatile decay markers of minced pork by headspace-solid phase microextractiongas chromatography-mass spectrometry and chemometrics[J].Food Chemistry,2021,342: 128341.DOI:10.1016/j.foodchem.2020.128341.
[28] HU Q,ZHANG J K,HE L,et al.New insight into the evolution of volatile profiles in four vegetable oils with different saturations during thermal processing by integrated volatolomics and lipidomics analysis[J].Food Chemistry,2023,403: 134342.DOI:10.1016/j.foodchem.2022.134342.
[29] ZHANG H,HUANG D,PU D,et al.Multivariate relationships among sensory attributes and volatile components in commercial dry porcini mushrooms (Boletus edulis)[J].Food Research International,2020,133: 109112.DOI:10.1016/j.foodres.2020.109112.
[30] ACREE T,ARN H.Flavornet and human odor space[DB/OL].(2004-06-25)[2024-02-04].http://www.flavornet.org/index.html.
[31] QI J,LI C B,CHEN Y J,et al.Changes in meat quality of ovine longissimus dorsi muscle in response to repeated freeze and thaw[J].Meat Science,2012,92(4): 619-626.DOI:10.1016/j.meatsci.2012.06.009.
[32] LEDWARD D A.Post-slaughter influences on the formation of metmyoglobin in muscles[J].Meat Science,1985(15): 149-171.DOI:10.1016/0309-1740(85)90034-8.
[33] 周昱宇,毛云,王立娜,等.冻融次数对藏羊肉品质特性的影响[J].食品工业科技,2022,43(11): 342-349.DOI:10.13386/j.issn1002-0306.2021080348.
[34] 曲宝宝.应用茶多酚和葡萄籽提取物提高速冻水饺牛肉馅品质的技术研究[D].泰安: 山东农业大学,2020: 24.
[35] LIANG J F,YANG Q Y,ZHU M,et al.AMP-activated protein kinase(AMPK) α2 subunit mediates glycolysis in postmortem skeletal muscle[J].Meat Science,2013,95(3): 536-541.DOI:10.1016/j.meatsci.2013.05.025.
[36] SUN Y,JIA Y,SONG M,et al.Effects of radio frequency thawing on the quality characteristics of frozen mutton[J].Food and Bioproducts Processing,2023,139: 24-33.DOI:10.1016/j.fbp.2023.02.007.
[37] BEKHIT A E D A,HOLMAN B W B,GITERU S G,et al.Total volatile basic nitrogen (TVB-N) and its role in meat spoilage: a review[J].Trends in Food Science and Technology,2021,109: 280-302.DOI:10.1016/j.tifs.2021.01.006.
[38] ZHANG Y M,HOLMAN B W B,PONNAMPALAM E N,et al.Understanding beef flavour and overall liking traits using two different methods for determination of thiobarbituric acid reactive substance(TBARS)[J].Meat Science,2019,149: 114-119.DOI:10.1016/j.meatsci.2018.11.018.
[39] MOTTRAM D S.Flavour formation in meat and meat products: a review[J].Food Chemistry,1998,62: 415-424.DOI:10.1016/S0308-8146(98)00076-4.
[40] HECK R T,FAGUNDES M B,CICHOSKI A J,et al.Volatile compounds and sensory profile of burgers with 50% fat replacement by microparticles of chia oil enriched with rosemary[J].Meat Science,2019,148: 164-170.DOI:10.1016/j.meatsci.2018.10.017.
[41] CASABURI A,PIOMBINO P,NYCHAS G,et al.Bacterial populations and the volatilome associated to meat spoilage[J].Food Microbiology,2015,45: 83-102.DOI:10.1016/j.fm.2014.02.002.
[42] BLEICHER J,EBNER E E,BAK K H.Formation and analysis of volatile and odor compounds in meat: a review[J].Molecules,2022,27(19): 6703.DOI:10.3390/molecules27196703.
[43] SAM A,CONG L,XU B C.Effect of frozen storage on the lipid oxidation,protein oxidation,and flavor profile of marinated raw beef meat[J].Food Chemistry,2022,376: 131881.DOI:10.1016/j.foodchem.2021.131881.
[44] WEN X Y,ZHANG D Q,LI X,et al.Dynamic changes of bacteria and screening of potential spoilage markers of lamb in aerobic and vacuum packaging[J].Food Microbiology,2022,104: 103996.DOI:10.1016/j.fm.2022.103996.
[45] SARAIVA C,OLIVEIRA I,SILVA J A,et al.Implementation of multivariate techniques for the selection of volatile compounds as indicators of sensory quality of raw beef[J].Journal of Food Science and Technology,2015,52: 3887-3898.DOI:10.1007/s13197-014-1447-y.
[46] NIEMINEN T T,DALGAARD P,BJORKRÖTH J.Volatile organic compounds and Photobacterium phosphoreum associated with spoilage of modified-atmosphere-packaged raw pork[J].International Journal of Food Microbiology,2016,218: 86-95.DOI:10.1016/j.ijfoodmicro.2015.11.003.
[47] FRANKEL E N.Volatile lipid oxidation products[J].Progress in Lipid Research,1983,22(1): 1-33.DOI:10.1016/0163-7827(83)90002-4.
[48] ECHEGARAY N,DOMÍNGUEZ R,CADAVEZ V A P,et al.Influence of feeding system on Longissimus thoracis et lumborum volatile compounds of an Iberian local lamb breed[J].Small Ruminant Research,2021: 106417.DOI:10.1016/j.smallrumres.2021.106417.