畜禽血液外泌体功能及其资源开发研究进展
徐荣鹭,麦籍文,石雨薇,曹锦轩,张 婵,杨鑫垚,王雪儿,吴世翔,王 颖*
(北京工商大学食品与健康学院,老年营养与健康教育部重点实验室,北京 100048)
摘 要:我国畜禽血液资源十分丰富,目前血液蛋白精深加工、血液蛋白活性肽酶解、氯化血红素制备等工作已取得明显成效。近年来,血液外泌体作为一类新型功能性成分,已被证明具有多种功能活性,在食品营养补充剂方面具有极强的开发潜力。然而,血液外泌体的基础研究还处于起步阶段。为了未来更好地对血液外泌体进行有效资源开发,本文对其结构与化学组成进行概述,回顾血液外泌体功能活性的近年研究进展,综述不同提取、保存方法对血液外泌体活性的影响,对血液外泌体未来潜在的生产应用进行展望,旨在为畜禽血液资源挖掘、血液外泌体的进一步开发及应用提供思路。
关键词:畜禽血液;血液深加工;血液外泌体;功能活性;资源挖掘
收稿日期:2023-09-13
基金项目:“十四五”国家重点研发计划重点专项(2023YFF1103900);国家自然科学基金面上项目(32372248);北京工商大学大学生创新训练项目(X202410011012);北京市教学发展研究课题项目(GJ2023016);北京工商大学教改项目(jg235108)
第一作者简介:徐荣鹭(2004—)(ORCID: 0009-0007-6502-5881),女,本科生,研究方向为食品科学。E-mail: 3112834183@qq.com
*通信作者简介:王颖(1987—)(ORCID: 0000-0003-3385-956X),女,副教授,博士,研究方向为畜产品加工。E-mail: wang-ying@btbu.edu.cn
Progress on the Function and Resource Development of Livestock and Poultry Blood Exosomes
XU Ronglu, MAI Jiwen, SHI Yuwei, CAO Jinxuan, ZHANG Chan, YANG Xinyao, WANG Xue’er, WU Shixiang, WANG Ying*
(Key Laboratory of Geriatric Nutrition and Health, Ministry of Education, College of Food and Health,Beijing Technology and Business University, Beijing 100048, China)
Abstract: There are abundant blood resources of livestock and poultry in our country. At present, remarkable results have been achieved in the deep processing of blood proteins, the enzymatic hydrolysis of blood proteins for the production of active peptides, and the preparation of hemin chloride. In recent years, blood exosomes, as a new class of functional ingredients, have been shown to have a variety of functional activities, and have great potential in the development of nutritional food supplements. However, basic research on blood exosomes is still in its infancy. In order to develop blood exosomes effectively in the future, this paper summarizes the structure and chemical composition of blood exosomes,reviews the recent progress research on the functional activities of blood exosomes and the effects of different extraction and preservation methods on them, and discusses future prospects for the production and application of blood exosomes.This paper aims to provide ideas for the mining of livestock and poultry blood resources and the further development and application of blood exosomes.
Keywords: animal blood; deep processing of blood; blood exosomes; functional activities; resource development
DOI: 10.7506/rlyj1001-8123-20230913-083
中图分类号:TS251.2
文献标志码:A
文章编号:1001-8123(2024)03-0070-08
引文格式:
徐荣鹭, 麦籍文, 石雨薇, 等. 畜禽血液外泌体功能及其资源开发研究进展[J]. 肉类研究, 2024, 38(3): 70-77.DOI:10.7506/rlyj1001-8123-20230913-083. http://www.rlyj.net.cn
XU Ronglu, MAI Jiwen, SHI Yuwei, et al. Progress on the function and resource development of livestock and poultry blood exosomes[J]. Meat Research, 2024, 38(3): 70-77. (in Chinese with English abstract)DOI:10.7506/rlyj1001-8123-20230913-083.http://www.rlyj.net.cn
我国畜禽总产量连年居世界第一,畜禽加工产生的血液资源十分丰富,因其含有丰富的蛋白质、氨基酸及其他活性物质,在食品工业具有广阔的应用前景。我国畜禽血液的初级利用仍以传统血豆腐、血球粉、血液粉等加工形式为主、利用率和产业化程度较低[1]。近年来,通过大力挖掘畜禽血液功能因子,血液加工已向系列化、多样化和高附加值方向发展,如畜禽血液中提取的部分酶类、维生素、激素及活性肽等已在食品、化妆品中及临床有较广泛的应用。
近年来,为了更好地利用血液蛋白资源,在提高血液凝胶强度和挖掘血液蛋白自身特性方面,科研人员进行了各种尝试。有研究表明,外源添加亚麻籽胶和瓜尔豆胶[2]、瓜尔豆胶与魔芋胶复配联合超声处理[3]、超声波破壁[4]及高压脉冲电场处理[5]等均对血液凝胶强度具有显著增强作用。以分离的猪血红血球为铁强化原料制备得到的血红蛋白微胶囊化明胶软糖具有良好的色泽和风味,口感细腻、有良好的弹性和韧性[6]。采用冷冻沉淀法分离纯化猪血中的纤维蛋白原,利用其黏合特性可用于对碎牛肉和碎干腌火腿进行重组,制备得到重组牛排和重组干腌火腿[7]。
除了对完整血液蛋白的开发利用以外,近年来,科学家们在对血液蛋白酶解产物和活性肽的制备与应用方面也开展了大量工作。血液蛋白经酶解处理后得到多种小肽混合物,具有良好消化吸收性,同时还具有抗氧化性、血管紧张素转化酶抑制活性、增强肌原纤维凝胶和保水性等功能特性,可作为营养补充剂、凝胶强化剂和营养保健品[8-9]。以血液资源制备氯化血红素作为铁补充剂,具有良好的应用潜力。提取氯化血红素的主要方法有血粉法、醋酸钠法、羧甲基纤维素钠法等,其中血粉法制备的氯化血红素产量最高[10]。氯化血红素是一类具有过氧化物酶催化功能的蛋白质辅基,其生物利用度较高,目前在食品、医药、保健领域被广泛应用,可作为人工合成色素、抗贫血药、细胞抗氧化剂等[11]。有研究者发现,将氯化血红素作为人工合成色素使用可以获得较高的营养价值,有效预防缺铁性贫血[12]。此外,氯化血红素还能改善脊髓损伤的恢复速度,促进脊髓修复[11]。进一步研究表明,氯化血红素诱导的血红素加氧酶具有抑制COVID-19炎症的作用,可能为新冠病毒的潜在治疗药物[13]。然而,局限于氯化血红素特殊腥臭味,目前以氯化血红素为铁强化剂的功能性食品较少,对氯化血红素的包埋和产品开发工作有待进一步开展。
除上述功能活性成分外,血液外泌体作为一类新型功能性成分,近年来被证明具有保护心血管、增强免疫力、治疗重症COVID-19、缓解关节炎、缓解肠壁损伤等多种作用。目前,国内外关于血液外泌体的功能研究多样,血液外泌体在食品营养补充剂方面具有极强的开发潜力。然而,血液外泌体的基础研究还处于起步阶段。本文对血液外泌体的化学组成、功能活性及提取稳态方法进行概述,对其未来潜在的生产应用进行展望,旨在为畜禽血液资源挖掘、血液外泌体的进一步开发及应用提供思路。
1 血液外泌体结构与组分研究进展
1.1 血液外泌体定义及结构
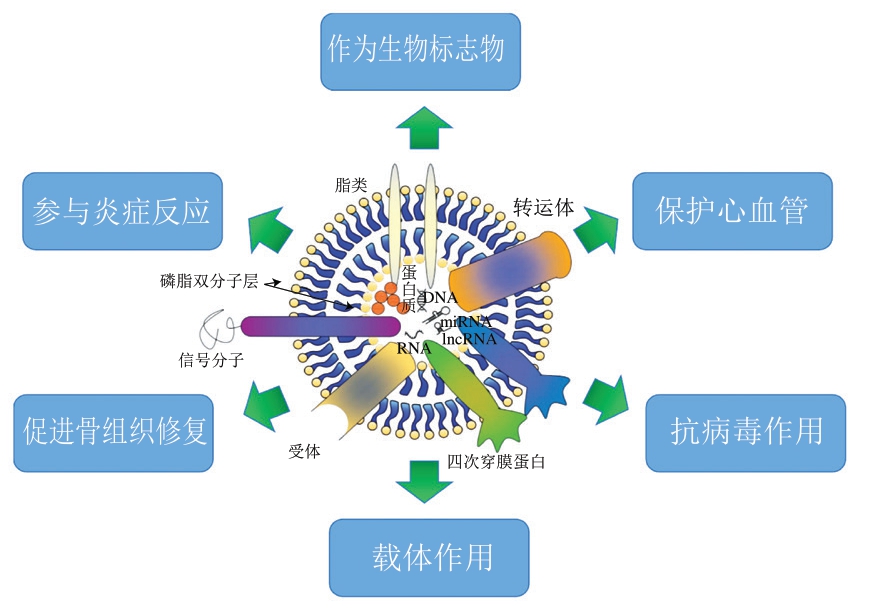
真核细胞释放不同类型的细胞外囊泡,包括外泌体、胞外体和微泡。外泌体可由大多数类型细胞释放,细胞内溶酶体微粒内陷形成多囊泡体,与质膜融合后向胞外分泌外泌体[14],广泛分布于血液、乳汁、尿液、脑脊液等体液中。血液外泌体是血液中各种细胞分泌产生的一种亚细胞成分,含量为1.10~1.18 g/mL[14],直径为30~150 nm,具有磷脂双分子层膜结构,以维持外泌体囊泡的完整性和稳定性,并保护其内容物不被降解[15]。外泌体膜表面带有负电荷,携带细胞特异性的活性成分,在细胞间信息传导过程中发挥重要作用[16]。
1.2 血液外泌体组成
血液外泌体化学组成与其功能活性如表1所示。血液外泌体包含多种类型的活性分子,这些活性分子可以转移到细胞基质中,介导多效性生物学功能,如免疫反应、抗原呈递、癌症反应、细胞通讯以及RNA和蛋白质的转移等[24]。外泌体中常见的蛋白质有膜转运和融合相关蛋白(如细胞程序性死亡配体1(programmed cell deathligand 1,PD-L1)、线粒体融合蛋白2(mitofusin 2,MFN2))、分泌蛋白(如富亮氨酸α-2-糖蛋白1(leucine-rich α-2-glycoprotein 1,LRG1))、蛋白激酶(如局部黏着斑激酶(focal adhesion kinase,FAK)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK))、干扰素诱导跨膜蛋白(interferon-induced transmembrane protein,IFITM)、脂多糖结合蛋白(lipopolysaccharide binding protein,LBP)、细胞外膜蛋白(如纤连蛋白(fibronectin,FN))、四次穿膜蛋白家族(如CD63、CD81、CD151、CD171、TSPAN8)等[25]。四次穿膜蛋白通常用作外泌体标记物。血液外泌体中除含有外泌体普遍存在的这些蛋白外,还包括一些血液中特有的细胞因子,如血小板来源的血友病因子及整合蛋白CD41a等,这些蛋白常在临床中作为肿瘤及相关疾病诊断的重要依据[26]。
表1 血液外泌体化学组成与其功能活性
Table 1 Chemical composition of blood exosomes and their functional activities

活性组分种类功能参考文献PD-L1抑制T细胞活性,促进鳞状细胞癌进展[17]DEP作为肝细胞癌(hepatocellular carcinoma,HCC)的生物标志物[17]LRG1促血管生成标志物的表达及血管生成[17]FAK、MEK1、重组人SH3-结构域GRB2样2蛋白(SH3GL2)、MFN2作为乳腺癌的生物标志物[17]蛋白质IFITM1、IFITM2、IFITM3阻止冠状病毒的进入和复制,抑制甲型流感、马尔堡病毒和人类疱疹病毒第4型病毒等[18]CD63、CD81检测外泌体最常用的表面标记分子[19]三结构域蛋白3(TRIM3)用于胃癌诊断[20]CD151、TSPAN8、CD171、LBP、FN用于识别肺癌患者[17]脂质S1P、棕榈酰肉碱等作为多发性骨髓瘤早期诊断的生物标志物[17]LPC、PC、PE作为肺隐球菌病诊断的重要工具[17]PI、LPS、LPG、LPC作为早期卵巢癌检测的可能生物标志物[17]miRNA miR-620作为诊断和预后生物标志物[17]miR-126促进内皮细胞的增殖、迁移和血管生成[21]miR-3180-3p抑制非小细胞肺癌的增殖、迁移和侵袭[17]miR-218-5p、miR-363-3p改善心肌组织病理变化和心脏功能[22]miR-1246促进神经胶质瘤免疫逃避[17]miR-223、miR-339作为生物标志物预测急性血栓形成[23]miR-4516促进肿瘤进展[17]miR-451、miR-150抑制神经胶质瘤细胞增殖、侵袭和凋亡[17]miR-142-5p、miR-320a、miR-4433b-5p作为乳腺癌的生物标志物[17]miR-125a-5p作为宫颈癌诊断的生物标志物[17]miR-141-3p促进内皮细胞迁移和血管生成[17]Let-7b-3p、miR-139-3p、miR-145-3p、miR150-3p作为生物标志物检测早期结肠癌[17]miR-19b、miR-21、miR-222、miR-92a作为早期检测转移性结直肠癌的液体活检生物标志物[17]ZFAS1增强受体胃癌细胞的迁移和增殖,促进胃癌进展[17]lncRNA lncRNA-H19促进宫颈癌细胞的增殖和球体形成[17]lncRNA-POU3F3诱导神经胶质瘤中人脑微血管内皮细胞的迁移、增殖和血管生成[17]VLDLR促进HCC癌细胞的耐药性[17]
除了蛋白以外,外泌体中也含有不同种类的脂质,如磷脂酰胆碱(phosphatidylcholine,PC)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)、鞘氨醇-1-磷酸(sphingosine-1-phosphate,S1P)、磷脂酰肌醇(phosphatidylinositol,PI)、脂多糖(lipopolysaccharide,LPS)、溶血磷脂酰甘油(lysophosphatidylglycerol,LPG)、溶血磷脂酰胆碱(lysophosphatidylcholine,LPC)等,它们作用于不同的受体细胞,并在疾病诊断治疗方面发挥不同的作用。
血液外泌体中含有大量信使RNA(mRNA)、微小RNA(miRNA)和长链非编码RNA(lncRNA)[27]。目前研究表明,外泌体源性miRNA作为各种疾病诊断和预后判断的新型分子生物标志物具有很大的应用潜能[28]。外周血液中还发现外泌体携带多种运动因子(如miRNA等),在运动的系统性适应中发挥重要的通讯作用[29]。
2 血液外泌体的功能活性研究现状
血液外泌体是血液的重要组成部分之一,携带和传递重要信号分子,调控生物体内多种生理与病理过程,如参与炎症反应,促进骨组织修复、保护心血管及抗病毒等。此外,由于其高敏感性、高特异性和高稳定性,外泌体还可作为不同疾病的生物标志物尤其是用于肿瘤等疾病的诊断,或作为药物递送载体弥补传统药物水溶性差及细胞渗透力低等缺陷[30],对禽畜血液资源的利用和新型食品药品的开发具有重要价值(图1)。
2.1 参与炎症反应
炎症是一种免疫反应,通常被认为是宿主和免疫细胞之间稳态的丧失,并且与许多疾病的发展有关,例如感染、自身免疫、动脉粥样硬化、神经退行性疾病和癌症[15]。有研究报道,免疫细胞分泌到血液中的外泌体不仅调节生物体的生理和病理过程,并介导多种炎症反应[31]。外泌体可通过抑制胶质细胞激活、调节免疫应答等方式减轻炎症反应,并依赖其脂质双层结构和穿越血-脑屏障的优势,作为给药载体应用于癫痫的治疗[32]。研究结果显示,血液外泌体可以传递炎症信号,促进炎症细胞因子的表达,为脑缺血损伤治疗的研究提供了新思路[33]。此外,脐血液外泌体能够增强免疫细胞活性,下调炎症因子,对于改善老年人低度炎症体质、减缓免疫细胞衰老有一定调节作用[34]。
2.2 促进骨组织修复
骨关节炎是一种常见的致残疾病,现已成为困扰全球的卫生健康问题之一,导致巨大的社会经济成本。Torreggiani等[35]研究证明,血液外泌体作用于局部环境的骨髓间充质干细胞和骨前体细胞等修复细胞,促进修复细胞向骨损伤处迁移、细胞增殖和成骨细胞分化,从而达到促进骨组织修复的作用,对骨关节炎具有良好的辅助治疗效果。Tao Shicong等[36]发现,血液外泌体可以促进骨组织的维持和再生,并促进成骨细胞增殖。有研究表明,动物血液外泌体能够促进成骨细胞增殖,从而促进骨形成[37]。Liu Xuchang等[38]报道,富血小板血液来源外泌体可通过控制促炎症因子释放和减轻炎症反应减少软骨组织丢失,从而促进软骨再生,逆转骨关节炎损伤。
2.3 保护心血管
我国正在逐步进入老龄化社会,心血管疾病的发病率逐年上升,近些年研究发现,血液中的外泌体及其内容物可促进血管生成、抗氧化、抑制血栓形成和改善心肌纤维化作用。研究发现,急性冠脉综合征患者的血小板外泌体中含有较高含量的miR-126和血管生成因子,可以促进内皮细胞的增殖、迁移和血管生成[39]。此外,经活血益气处理后的大鼠血液外泌体能促进心梗后血管新生,减少心肌损伤,改善心功能,还可促进内皮细胞增殖、迁移及提高血管成管能力[40]。史斌浩等[41]研究发现,血管内皮细胞来源外泌体可以保护血管免受过氧化氢氧化。内皮祖细胞来源外泌体可以抑制血小板对血管内皮修复的拮抗作用,从而抑制血栓形成。在改善心肌纤维化方面,血液外泌体中miR-218-5p和miR-363-3p可改善大鼠心肌组织病理变化和心脏功能[42]。
2.4 抗病毒
新冠病毒爆发以来,抗病毒药物的研发已达到前所未有的水平。血液外泌体中的miRNA、蛋白质和其他生物分子可以调节宿主细胞的免疫应答,从而发挥抗病毒作用。He Jianguo[43]研究发现,鳜鱼血液外泌体可以结合干扰素诱导的黏病毒抵抗蛋白1,抑制鳜鱼传染性脾肾坏死病毒复制[44]。
2.5 作为生物标志物用于疾病诊断
血液中的外泌体与传统生物标志物相比具有较高稳定性,且参与多种疾病形成,使其可以作为一种疾病诊断的非创伤性液体活检指标[45]。研究显示,血液中的外泌体miRNA和蛋白质是较为常见的标志物,如血液外泌体中的miR-21被证实与多种肿瘤相关,包括胰腺癌、结直肠癌、肝癌、乳腺癌、卵巢癌及食管癌等[46]。目前可用于临床诊断的外泌体蛋白包括用于肺癌诊断的LBP、FN,用于乳腺癌诊断的SH3GL2、MFN2和用于胃癌诊断的TRIM3等。血液外泌体除作为肿瘤生物标志物外,还可作为生物标志物用于肺炎、肺结核、血栓及神经退行性疾病的诊断。有研究发现,来源于新冠病毒康复患者的血液外泌体中含有携带病毒的蛋白,可作为检测新冠病毒感染的潜在生物标志物[47]。此外,动脉粥样硬化病人血液外泌体中miR-223、miR-339和miR-21表达水平明显升高,可作为生物标志物预测急性血栓的形成[48]。中枢神经系统来源的血液外泌体已被证明在各种神经退行性疾病的病理学中起着至关重要的作用,包括阿尔茨海默病、帕金森病、肌萎缩性侧索硬化症、额颞叶痴呆和朊病毒病[49]。
2.6 用作载体
目前,临床上常用的传统药物水溶性、生物相容性及细胞渗透率较低,导致临床应用受限[50]。利用天然外泌体携带核酸、脂质、蛋白质等物质的特性,且能有效降低药物清除率,可将外泌体作为一种负载核酸、化疗药物化学物质、蛋白质类药物的优良载体,用于疫苗制备和靶向药物研发。外泌体作为药物载体,具有免疫源性低、运输效率高、稳定性好、靶向性强及能跨越血脑屏障等独特优势[51]。同时,在疫苗研制方面,外泌体具有易携带更稳定核酸材料的机制,这将为疫苗在体内的传递提供新路径[52]。
2.7 用于新型食品开发
外泌体是一种细胞分泌的小囊泡,内含蛋白质、核酸、脂质等多种生物活性物质,具有多种生物功能活性,包括调节免疫应答、促进细胞再生和修复、抗炎等作用[31]。这些功能活性对于新型食品的开发有重要指导意义,可以应用到食品中以提高其营养价值和功能性。
2.7.1 营养强化
外泌体中含有丰富的生物活性物质,如蛋白质、核酸和脂质[24],可以作为营养强化剂添加到食品中,增加食品的营养价值,帮助改善人体健康。例如,可以将外泌体添加到乳制品、谷物制品、保健品等产品中,以提高其蛋白质和核酸含量。
2.7.2 功能性食品开发
外泌体中的生物活性物质具有调节免疫应答、抗炎、促进细胞再生和修复等作用[31],可以应用到功能性食品开发中。例如,可以将外泌体添加到免疫调节型食品、抗炎食品、抗衰老食品等产品中,满足消费者对健康功能性食品的需求。
2.7.3 食品保鲜
外泌体中的脂质成分具有良好的乳化和抗氧化性质[53],帮助延缓食品氧化进程,延长食品的保质期,同时也有助于保护人体细胞免受氧化损伤。例如,可以将外泌体作为乳化剂添加到乳制品、沙拉酱等产品中,延长其保质期。
2.7.4 食品工艺改进
外泌体中的生物活性物质具有乳化、稳定乳液、增稠等功能,可以应用于食品工艺改进。例如,可以将外泌体作为乳化剂或稳定剂添加到各类食品中,改善其口感和质地。血液外泌体中还含有丰富的蛋白质和氨基酸,可以作为天然的调味料,提升食品的口感和营养价值。
总的来说,血液外泌体作为一种潜在的食品添加剂和功能性成分,可能为食品生产领域带来新的创新和发展机遇,为消费者提供更加健康、营养和更具功能性的食品。然而,在应用过程中需要充分考虑其稳定性、安全性和法规要求等因素,确保产品的质量和安全性。同时,还需要加强对外泌体的研究和开发,提高其提取、纯化和应用技术水平,以更好地发挥其潜在价值。
3 血液外泌体提取方法与活性稳态化研究现状
3.1 血液外泌体提取方法研究现状
不同的生物液体需要适当的样品采集、预处理和处理方法。血液外泌体相对含量较高,提取与稳定性相关的研究较多,然而获得高纯度、结构完整及具有较好生物活性的外泌体仍然是血液外泌体分离难点。目前,最常用的血液外泌体提取方法有超速离心法、超滤法、免疫磁珠法及聚合物沉淀法等,其中超速离心法被认为是普遍适用的方法,其得到的外泌体产物通常能保留较好的形态结构。然而,超速离心法对设备要求较高,且分离时间较长,过程繁琐[54]。当需要进一步纯化时,不能依靠简单的分离方法,因为此类囊泡的物理化学性质(尺寸和密度)和组成特性差异较小。主要采用通过差速离心获得的粗囊泡制剂的密度梯度分选,可以消除污染物质,如较大的蛋白质聚集体和与囊泡非特异性相关的蛋白质[27]。目前正在研究更多的替代提取方法,如微流控法和尺寸排阻色谱法等。上述方法按照目标外泌体的特异性结合位点、形态结构、密度等特殊性状提高了目标外泌体的分离效率、提取纯度及产量,缩短了分离时间。
由于缺少对于血液外泌体分离方法的统一评判标准,在某种程度上制约了分离技术的发展和优化,且不同来源血液样品组分丰富多样且不一,使分离结果易受生物特征物质的影响,目标外泌体的纯度和提取率发生改变,故需要在分离前对血液样品进行分析和比较,最终确定合适的分离方法。
血液外泌体提取方法优缺点如表2所示。
表2 血液外泌体提取方法优缺点对比
Table 2 Comparison of the advantages and disadvantages of the blood exosome extraction methods

提取方法具体原理优点缺点参考文献超速离心法利用不同细胞类型和外泌体的大小和密度差异,通过不同的离心速率将外泌体从细胞培养上清中分离出来形态结构保留较好,提取效率高耗时长、设备要求高[55]聚乙二醇聚沉法通过向含外泌体的样品中添加聚乙二醇,使外泌体在高浓度的聚乙二醇溶液中沉淀析出,从而实现外泌体的分离和提取产量高、成本低、速度快,用于粗提可能会导致外泌体失活或损伤,提取效率相对较低[55]蔗糖密度梯度离心法利用不同密度梯度的蔗糖溶液,使外泌体在不同密度梯度中沉降,从而实现外泌体的分离和提取提取纯度高,适用于对外泌体进行纯化处理操作复杂,需要较长时间,成本较高[56]阴选纯化富集法磷酸盐基团与二氧化锆双配位结合富集时间短,几乎无脂蛋白污染,颗粒浓度高可能存在洗涤液残留[57]尺寸排阻色谱法根据外泌体的大小差异,通过色谱柱将外泌体与其他成分分离,实现外泌体的提取高效、操作简单,耗时短,损害最小,纯度高对色谱柱的要求较高,操作技术要求较严格[58]超滤法利用滤膜孔径选择性分离外泌体和其他细胞碎片效率高,用时少,对活性影响小设备要求高,回收率低[55]免疫磁珠亲和捕获法利用特定的抗体或亲和配体结合外泌体表面标记的蛋白质,将外泌体与磁珠结合,通过磁场分离外泌体纯度较高,特异性强需要具有高亲和力的抗体或亲和配体,成本较高[59]微流化技术利用微流控芯片中的微通道结构,通过流体力学原理从样品中分离提取外泌体操作简便,高通量,适用于快速提取外泌体对微流控芯片的制备和操作要求高,需要专业设备[60]
3.2 血液外泌体保存技术研究现状
畜禽血液外泌体具有作为食品营养补充物质的应用潜力,但其稳定性较差,易引起食品安全问题。外泌体中含有丰富的蛋白质、核酸和其他营养成分,这些营养成分可能会在加工、贮藏或运输过程中发生降解,导致其营养价值下降,食品发生异常变化,产生有害物质或滋生细菌,从而影响食品的安全性。此外,外泌体稳定性差可能影响食品的品质和口感[61]。因此,血液外泌体如何延长活性维持时间和提高保存稳定性成为急需解决的问题。
为了保持血液外泌体的活性和稳定性,国内外近年来一些血液外泌体稳态化研究方法可供参考,包括低温保存、冷冻干燥、膜修饰表面法等,但由于血液外泌体组分复杂,受不同来源和不同分离方法的影响较大,不同保存技术产生的效果存在差异。
3.2.1 低温保存技术
目前对于外泌体保存稳定性和生物活性维持最好的技术是低温保存技术,此技术使用二甲基亚砜、乙二醇和海藻糖等防冻剂作为防冻液剂,将温度降至生化反应所需温度下,以此来保持血液外泌体功能的稳定性[62]。外泌体的保存温度对其稳定性和功能性有重要影响。
在血液外泌体的低温保存法中,一般采用4、-20、-80、-196 ℃等温度保存[62]。4 ℃低温保存法可使外泌体保持较好的稳定性和功能性,延长外泌体的保存时间,适用于短期保存。-20 ℃及-80 ℃低温保存能够有效保护外泌体的稳定性和功能性,外泌体中PC含量增加、PE及PS含量降低;对外泌体大小及数量没有显著影响,蛋白质及miRNA稳定[61]。液氮提供极低温度环境,能够最大限度地保护外泌体的完整性和功能性,适用于长期保存和冷冻保存要求极高的外泌体样品。故4 ℃、-20 ℃低温法可用于血液外泌体的短期保存,-80 ℃低温及液氮保存是较好的长期保持稳定活性的方式。
此外,由于保存血液外泌体技术尚不成熟,部分试验采取低温保存血液、使用时再从中分离血液外泌体的方法维持外泌体的活性。例如,Kalra等[63]研究发现,保存在4、-20、-80 ℃血液中的外泌体在3 个月内是稳定的;Ge Qinyu等[64]研究发现,4 ℃下血液中miRNA可保存2 周,-20 ℃下外泌体miRNA在2 个月内具有良好的稳定性,在-80 ℃下保存时间可达5 年。但也有研究表明,血液中的其他物质会导致外泌体总RNA降解,因此具体的实验方法还需根据提取目标外泌体的不同进行选择。
3.2.2 冷冻干燥技术
冷冻干燥是一种保存血液外泌体的新兴技术,此技术是将血液外泌体中的水分冷却成冰,利用真空直接升华除去水分,从而保持其原有活性,因此适合热敏性血液外泌体保存。冷冻干燥法可添加海藻糖等,作为保护外泌体分子结构的防冻剂[65]。冷冻干燥的外泌体在25 ℃保存可保持活性[62]。该技术是室温保存血液外泌体较为经济、有效的方法,但对于外泌体活性有轻微影响。李洪超等[66]研究发现,外泌体经冻干、再水化处理后仍保持膜完整性。
3.2.3 喷雾干燥技术
喷雾干燥技术相较于冷冻干燥技术更加简单、便捷,其技术方法是将血液外泌体溶液在干燥室中雾化后,利用水分与热空气接触迅速蒸发的原理制得外泌体干粉[67]。喷雾干燥过程中,雾化压力和出口温度是影响外泌体稳定性的重要因素。该技术操作方便、经济,但外泌体稳定性和活性等相较其他方法较差[62]。Xu Jingyi等[68]通过喷雾干燥技术成功制备了外泌体,并很好地维持其生物活性。
3.2.4 膜表面改造技术
外泌体的表面改造是对外泌体磷脂膜的表面工程。通过使用合成脂质体,和外泌体间进行膜融合修饰外泌体表面,嵌入肽或抗体的脂质体或聚乙二醇,利用冻融方法可以改变和优化外泌体表面性质。利用此技术保存可以有效增加外泌体的稳定性[69-70]。王璐等[71]利用表面改造技术,并在外泌体磷脂双分子层上修饰人表皮生长因子受体核酸适配体,使外泌体得以较好保存。总之,畜禽血液外泌体的保存方法仍需深入研究,以充分利用血液外泌体。
不同血液外泌体保存技术优缺点如表3所示。
表3 血液外泌体保存技术优缺点对比
Table 3 Comparison of the advantages and disadvantages of the blood exosome preservation techniques
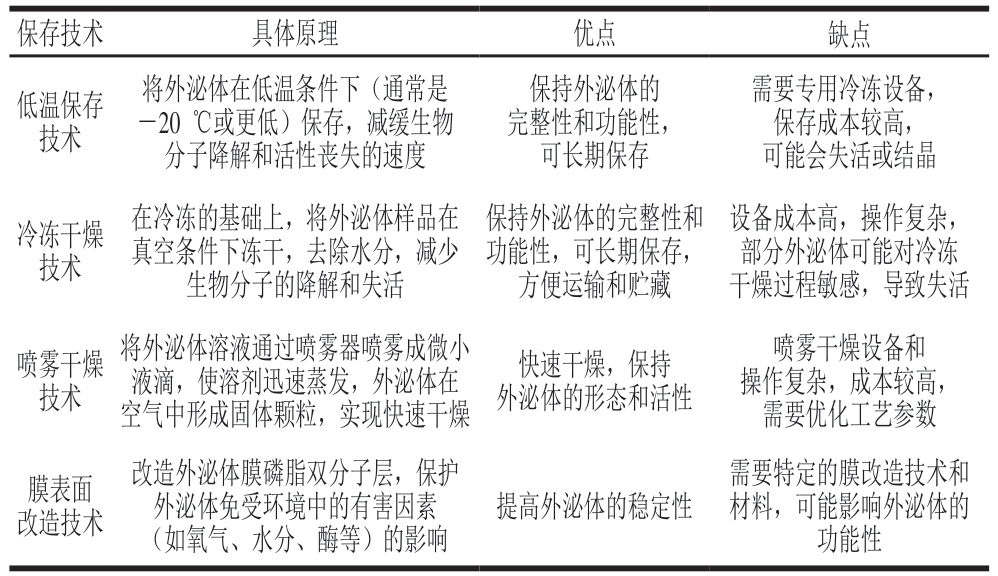
保存技术具体原理优点缺点低温保存技术将外泌体在低温条件下(通常是-20 ℃或更低)保存,减缓生物分子降解和活性丧失的速度保持外泌体的完整性和功能性,可长期保存需要专用冷冻设备,保存成本较高,可能会失活或结晶冷冻干燥技术在冷冻的基础上,将外泌体样品在真空条件下冻干,去除水分,减少生物分子的降解和失活保持外泌体的完整性和功能性,可长期保存,方便运输和贮藏设备成本高,操作复杂,部分外泌体可能对冷冻干燥过程敏感,导致失活喷雾干燥技术将外泌体溶液通过喷雾器喷雾成微小液滴,使溶剂迅速蒸发,外泌体在空气中形成固体颗粒,实现快速干燥快速干燥,保持外泌体的形态和活性喷雾干燥设备和操作复杂,成本较高,需要优化工艺参数膜表面改造技术改造外泌体膜磷脂双分子层,保护外泌体免受环境中的有害因素(如氧气、水分、酶等)的影响提高外泌体的稳定性需要特定的膜改造技术和材料,可能影响外泌体的功能性
4 结 语
血液外泌体作为一类新型功能性成份,含有丰富的生物活性物质,包括蛋白质、核酸、脂质等。已证明外泌体具有多种功能活性,如参与炎症反应,促进骨组织修复、保护心血管、抗病毒、作为运输载体等,对禽畜血液资源的利用和新食品的开发具有重要价值。
通过深入研究畜禽血液外泌体的功能,可以开发出更多高效、低成本的生物活性成分。利用畜禽血液外泌体中的生物活性成分作为食品添加剂,可以开发具有调节免疫系统、促进细胞再生和修复、抗炎、抗衰老等功能的功能性食品,提高食品的营养价值和功能性,生产更加健康、营养的新型食品。此外,血液外泌体中的生物活性分子具有抗菌、抗氧化等功能,可用于延长食品保质期,满足消费者对高品质食品的需求。
畜禽血液外泌体功能研究的不断深入有望推动食品科技的创新发展,为食品行业带来新的技术和产品,推动行业的进步和发展。然而,在应用过程中需要充分考虑血液外泌体的稳定性、安全性和法规要求等因素,确保产品的质量和安全性。同时,还需要加强对血液外泌体的研究和开发,提高其提取、纯化和应用技术水平,更好地发挥其潜在价值。总的来说,血液外泌体作为一种具有多种生物活性的天然物质,在食品行业的应用开发中具有广阔的前景。加强对血液外泌体功能及其在食品行业应用开发的研究将有助于推动食品行业的创新和发展,提供更加健康、更具功能性的食品。
参考文献:
[1] 王玲. 畜禽血液的开发利用与研究进展[J]. 畜牧兽医杂志, 2018,37(5): 42-43.
[2] 孔玲, 曹建宙, 李新林. 添加亚麻籽胶和瓜尔豆胶对鸭血豆腐食用品质的影响研究[J]. 肉类工业, 2022(10): 20-27.
[3] 王鑫, 黄瑾, 吴瑀婕, 等. 瓜尔豆胶与魔芋胶复配联合超声处理改善鸡血豆腐的品质[J]. 食品科学, 2021, 42(23): 145-151.DOI:10.7506/spkx1002-6630-20201015-131.
[4] 李翔, 许彦. 细胞破壁对猪血豆腐质构品质的影响[J]. 河南农业大学学报, 2018, 52(2): 254-293.DOI:10.16445/j.cnki.1000-2340.2018.02.017.
[5] BOULAABA A, EGEN N, KLEIN G. Effect of pulsed electric fields on microbial inactivation and physico-chemical properties of whole porcine blood[J]. Food Science and Technology International, 2013,20(3): 215-225.DOI:10.1177/1082013213482475.
[6] 邵秀芝, 王成忠, 于功明, 等. 微胶囊化血红蛋白凝胶软糖的研究[J].食品科技, 2005(10): 43-47.
[7] 刘兵, 夏秀芳, 孔保华, 等. 猪血制备的纤维蛋白原黏结剂对重组牛肉品质的影响[J]. 食品科学, 2017, 38(13): 125-130.DOI:10.7506/spkx1002-6630-201713021.
[8] 邓惠玲, 刘嘉, 陈光镜, 等. 猪血红蛋白ACE抑制肽的分离和理化性质研究[J]. 食品工业科技, 2013, 34(10): 281-303.DOI:10.13386/j.issn1002-0306.2013.10.063.
[9] NIU H L, CHEN Y C, ZHANG H, et al. Protective effect of porcine plasma protein hydrolysates on the gelation of porcine myofibrillar protein exposed to a hydroxyl radical-generating system[J].International Journal of Biological Macromolecules, 2018, 107: 654-661.DOI:10.1016/j.ijbiomac.2017.09.036.
[10] 郭晓东. 牦牛血液提纯氯化血红素工艺优化及产业化研究[D].兰州: 兰州理工大学, 2023: 1-2.DOI:10.27206/d.cnki.ggsgu.2022.001305.
[11] 高海浩, 尚爱加, 陶本章, 等. 氯化血红素诱导脊髓组织脑红蛋白高表达对脊髓损伤大鼠运动功能的保护作用[J]. 解放军医学院学报,2019, 40(1): 5867.
[12] 李转丽. 氯化血红素对白血病细胞株K562、CEM-C1细胞凋亡、自噬及PI3K/Akt/mTOR信号通路影响的研究[D]. 兰州: 甘肃中医药大学, 2023: 37-44.DOI:10.27026/d.cnki.ggszc.2022.000134.
[13] KIM D H, AHN H S, GO H J, et al. Hemin as a novel candidate for treating COVID-19 via heme oxygenase-1 induction[J]. Scientific Reports, 2021, 11(1): 21462.DOI:10.1038/S41598-021-01054-3.
[14] 卢婉, 杨人强, 王伶. 外泌体的研究进展[J]. 生命的化学, 2013,33(4): 5.DOI:10.13488/j.smhx.2013.04.010.
[15] 梁焕结, 余嘉晗, 杨泽坤, 等. 水牛乳外泌体对高脂饮食诱导的小鼠肝脏脂质代谢紊乱的影响[J]. 食品工业科技, 2024(3): 1-15.DOI:10.13386/j.issn1002-0306.2023070247.
[16] 陈三, 杨润泽, 吴家媛. 经脂多糖和低氧预处理来源的外泌体在组织修复再生中的作用研究进展[J]. 国际口腔医学杂志, 2024, 51(3):256-264.DOI:10.7518/gjkq.2024035
[17] THAKUR A, PARRA D C, MOTALLEBNEJAD P, et al. Exosomes:small vesicles with big roles in cancer, vaccine development, and therapeutics[J]. Bioactive Materials, 2021, 10: 281-294.DOI:10.1016/j.bioactmat.2021.08.029.
[18] ZHU X, HE Z, YUAN J, et al. IFITM3-containing exosome as a novel mediator for anti-viral response in dengue virus infection[J]. Cellular Microbiology, 2015, 17(1): 105-118.DOI:10.1111/cmi.12339.
[19] JØRGENSEN M, BÆK R, PEDERSEN S, et al. Extracellular vesicle(EV) array: microarray capturing of exosomes and other extracellular vesicles for multiplexed phenotyping[J]. Journal of Extracellular Vesicles, 2013, 2: 20920.DOI:10.3402/jev.v2i0.20920.
[20] FU H, YANG H, ZHANG X, et al. Exosomal TRIM3 is a novel marker and therapy target for gastric cancer[J]. Journal of Experimental and Clinical Cancer Research, 2018, 37(1): 162.DOI:10.1186/s13046-018-0825-0.
[21] SUN Y, LIU X, ZHANG D, et al. Platelet-derived exosomes affect the proliferation and migration of human umbilical vein endothelial cells via miR-126[J]. Current Vascular Pharmacology, 2019, 17(4): 379-387.DOI:10.2174/1570161116666180313142139.
[22] 黄智琪, 严钰敏, 郭晶, 等. 环状RNA circ_0036176结合miR-218-5p发挥抑制心肌纤维化的作用[J]. 中山大学学报, 2022, 43(1): 61-69.DOI:10.13471/j.cnki.j.sun.yat-sen.univ(med.sci).2022.0108.
[23] TAN M, YAN H B, LI J N, et al. Thrombin stimulated plateletderived exosomes inhibit platelet-derived growth factor receptor-beta expression in vascular smooth muscle cells[J]. Celllar Physiology and Biochemistry, 2016, 38(6): 2348-2365.DOI:10.1159/000445588.
[24] PEGTEL D M, GOULD S J. Exosomes[J]. Annual Review of Biochemistry, 2019, 88(1): 487-514.DOI:10.1146/annurevbiochem-013118-111902.
[25] LI X, CORBETT A L, TAATIZADEH E, et al. Challenges and opportunities in exosome research: perspectives from biology,engineering, and cancer therapy[J]. APL Bioengineering, 2019, 3(1):011503.DOI:10.1063/1.5087122.
[26] 张敏, 张晨光, 丁卫. 外泌体及其在肿瘤诊疗中的意义[J]. 生理科学进展, 2014, 45(5): 373-377.
[27] RAIMONDO F, MOROSI L, CHINELLO C, et al. Advances in membranous vesicle and exosome proteomics improving biological understanding and biomarker discovery[J]. Proteomics, 2011, 11(4):709-720.DOI:10.1002/pmic.201000422.
[28] 李毅, 唐佩福. 外泌体中Micro-RNA可作为疾病的生物标志物?[J]. 中国组织工程研究, 2016, 20(51): 7738-7745.DOI:10.3969/j.issn.2095-4344.2016.51.021.
[29] 梁晓艳. 长期有氧运动通过外泌体保护阿尔茨海默病中血脑屏障功能的机制研究[D]. 济南: 山东大学, 2024: 25-30.DOI:10.27272/d.cnki.gshdu.2023.000486.
[30] DENG F, MILLER J. A review on protein markers of exosome from different bio-resources and the antibodies used for characterization[J].Journal of Histotechnology, 2019, 42(4): 226-239.DOI:10.1080/01478 885.2019.1646984.
[31] 杨旭东. 巨噬细胞J774A.1外泌体促进结直肠癌细胞系MC38和CT26增殖和迁移[D]. 北京: 北京协和医学院, 2022: 39-49.DOI:10.27648/d.cnki.gzxhu.2021.000741.
[32] 徐圣洁, 吴涛, 郭子正, 等. 外泌体在癫痫炎症反应中的作用[J].中国神经免疫学和神经病学杂志, 2022, 29(5): 414-418.
[33] 周心. 血清外泌体在急性缺血性脑卒中诊断及缺血后炎症应答中的作用研究[D]. 广州: 暨南大学, 2018: 74-116.
[34] 夏威夷. 脐血源外泌体对年老T细胞调节作用的研究[D]. 南京:东南大学, 2019: 9-38.
[35] TORREGGIANI E, PERUT F, RONCUZZI L, et al. Exosomes: novel effectors of human platelet lysate activity[J]. European Cells and Materials, 2014, 28: 137-151.DOI:10.22203/ecm.v028a11.
[36] TAO S C, TING Y, BI-YU R, et al. Exosomes derived from human platelet-rich plasma prevent apoptosis induced by glucocorticoidassociated endoplasmic reticulum stress in rat osteonecrosis of the femoral head via the Akt/Bad/Bcl-2 signal pathway[J]. Theranostics,2017, 7(3): 733-750.DOI:10.7150/thno.17450.
[37] 徐慧君, 张咪, 史东梅, 等. 胎牛血清外泌体对成骨细胞增殖的作用[J].中国组织工程研究, 2020, 24(31): 4961-4965.DOI:10.3969/j.issn.2095-4344.2122.
[38] LIU X C, WANG L B, MA C S, et al. Exosomes derived from plateletrich plasma present a novel potential in alleviating knee osteoarthritis by promoting proliferation and inhibiting apoptosis of chondrocyte via Wnt/β-catenin signaling pathway[J]. Journal of Orthopaedic Surgery and Research, 2019, 14: 470.DOI:10.1186/s13018-019-1529-7.
[39] 何泉, 徐盈, 唐新华, 等. 血管生成素2和miR-126与糖尿病大血管病变的相关性[J]. 中国糖尿病杂志, 2013, 21(11): 976-979.DOI:10.3969/j.issn.1006-6187.2013.11.005.
[40] 高毅洁. 从外泌体角度探讨活血益气方促大鼠心梗后血管新生的作用机制[D]. 北京: 北京中医药大学, 2022: 53-57.DOI:10.26973/d.cnki.gbjzu.2021.000105.
[41] 史斌浩, 王建飞, 汪贵忠, 等. 血管内皮细胞来源外泌体miR-214对H2O2诱导血管内皮细胞损伤的影响[J]. 西部医学, 2023, 35(3): 323-330.
[42] KE X, YANG R, WU F, et al. Exosomal miR-218-5p/miR-363-3p from endothelial progenitor cells ameliorate myocardial infarction by targeting the p53/JMY signaling pathway[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 5529430.DOI:10.1155/2021/5529430.
[43] HE J G. Evidence for a novel antiviral mechanism of teleost fish:serum-derived exosomes inhibit virus replication through incorporating Mx1 protein[J]. International Journal of Molecular Sciences, 2021,22(19): 10346.DOI:10.3390/ijms221910346.
[44] XUN Z H, JIE Y, WEN X H, et al. IFITM3-containing exosome as a novel mediator for anti-viral response in dengue virus infection[J].Cellular Microbiology, 2015, 17(1): 105-118.DOI:10.1111/cmi.12339.
[45] WINSTON C N, GOETZL E J, AKERS J C, et al. Prediction of conversion from mild cognitive impairment to dementia with neuronally derived blood exosome protein profile[J]. Alzheimers and Dementia Diagnosis Assessment and Disease Monitoring, 2016, 3(1):63-72.DOI:10.1016/j.dadm.2016.04.001.
[46] MAHSA S, MOHAMMADREZA S. Exosomal miRNAs as novel cancer biomarkers: challenges and opportunities[J]. Journal of Cellular Physiology, 2018, 233(9): 6370-6380.DOI:10.1002/jcp.26481.
[47] 崔诗雨, 张海峰. 外泌体在新型冠状病毒感染和传播中作用的研究进展[J]. 基础医学与临床, 2023, 43(4): 680-684.DOI:10.16352/j.issn.1001-6325.2023.04.0680.
[48] 陈波, 林学广, 邓颖, 等. 血栓闭塞性脉管炎患者血浆源性外泌体miR-223-5p对人血管平滑肌细胞的影响[J]. 复旦学报, 2022, 49(5):680-685.DOI:10.3969/j.issn.1672-8467.2022.05.007.
[49] DUTTA S. CNS-derived blood exosomes as a promising source of biomarkers: opportunities and challenges[J]. Frontiers in Molecular Neuroence, 2020, 13: 38.DOI:10.3389/fnmol.2020.00038.
[50] 李思迪, 侯信, 亓洪昭, 等. 外泌体: 为高效药物投递策略提供天然的内源性纳米载体[J]. 化学进展, 2016, 28(2): 353-362.DOI:10.7536/PC150915.
[51] HANEY M J, KLYACHKO N L, ZHAO Y, et al. Exosomes as drug delivery vehicles for Parkinson’s disease therapy[J].Journal of Controlled Release, 2015, 207: 18-30.DOI:10.1016/j.jconrel.2015.03.033.
[52] 佟雷, 林懿. 外泌体在肿瘤诊疗中的研究进展[J]. 华侨大学学报(自然科学版), 2023, 44(3): 281-289.
[53] 赵媛, 刘新, 张译丹, 等. 基于串联质量标记的帕金森病血浆及血浆外泌体定量蛋白质组学分析[J]. 色谱, 2023(12): 1073-1083.DOI:10.3724/SP.J.1123.2022.12022.
[54] LI Y, JING Z, JIN L, et al. A Comparison of traditional and novel methods for the separation of exosomes from human samples[J]. BioMed Research International, 2018, 2018: 1-9.DOI:10.1155/2018/3634563.
[55] 陈文生, 赵颖海. 外泌体提取方法及其在人类疾病中的研究进展[J]. 海南医学, 2019, 30(22): 2977-2980.DOI:10.3969/j.issn.1003-6350.2019.22.037.
[56] 邱山桐, 张昊, 沈雅丽, 等. 小鼠血清外泌体不同提取方法的比较[J].甘肃畜牧兽医, 2021, 51(3): 39-42.DOI:10.15979/j.cnki.cn62-1064/s.2021.03.014.
[57] 李雪洁, 付洁, 冀元凯, 等. 血清外泌体的提取方法与鉴定[J].药物分析杂志, 2022, 42(8): 1400-1406.DOI:10.16155/j.0254-1793.2022.08.13.
[58] SIDHOM K, OBI P O, SALEEM A. A review of exosomal isolation methods: is size exclusion chromatography the best option[J].International Journal of Molecular Sciences, 2020, 21(18): 6466.DOI:10.20944/preprints202007.0485.v2.
[59] JEYARAM A, JAY S M. Preservation and storage stability of extracellular vesicles for therapeutic applications[J]. The AAPS Journal, 2017, 20(1): 1.DOI:10.1208/s12248-017-0160-y.
[60] 陈雯雯, 甘忠桥, 秦建华. 微流控技术在外泌体分离分析中的研究进展[J]. 色谱, 2021, 39(9): 968-980.DOI:10.3724/SP.J.1123.2021.07005.
[61] QIN B, ZHANG Q, HU X, et al. How does temperature play a role in the storage of extracellular vesicles?[J]. Journal of Cellular Physiology,2020, 235(11): 7663-7680.DOI:10.1002/jcp.29700.
[62] ZHANG Y, BI J, HUANG J, et al. Exosome: a review of its classification, isolation techniques, storage, diagnostic and targeted therapy applications[J]. International Journal of Nanomedicine, 2020,15: 6917-6934.DOI:10.2147/IJN.S264498.
[63] KALRA H, ADDA C G, LIEM M, et al. Comparative proteomics evaluation of plasma exosome isolation techniques and assessment of the stability of exosomes in normal human blood plasma[J].Proteomics, 2013, 13(22): 3354-3364.DOI:10.1002/pmic.201300282.
[64] GE Q Y, ZHOU Y X, LU J F, et al. miRNA in plasma exosome is stable under different storage conditions[J]. Molecules, 2014, 19:1568.DOI:10.3390/molecules19021568.
[65] 吴颖杰, 耿梦缘, 汪晶, 等. 不同冻干保护剂在外泌体储存中的研究[J].天津医科大学学报, 2022, 28(4): 353-359.
[66] 李洪超, 金银鹏, 王皙, 等. 人脂肪干细胞及外泌体冻干粉的安全性[J].中国组织工程研究, 2018, 22(29): 4593-4600.DOI:10.3969/j.issn.2095-4344.0994.
[67] KESHANI S, DAUD W R, NOUROUZI M M, et al. Spray drying: an overview on wall deposition, process and modeling[J]. Journal of Food Engineering, 2022, 45(1): 152-162.DOI:10.1111/jfpe.13936.
[68] XU J Y, LIN S H, CHEN H Y, et al. Highly active frozen nanovesicles microneedles for senile wound healing via antibacteria,immunotherapy, and skin regeneration[J]. Advanced Healthcare Materials, 2024, 2024: 2304315.DOI:10.1002/adhm.202304315.
[69] SATO Y T, UMEZAKI K, SAWADA S, et al. Engineering hybrid exosomes by membrane fusion with liposomes[J]. Scientific Reports,2016, 6(10): 21933.DOI:10.1038/srep21933.
[70] CHAROENVIRIYAKUL C, TAKAHASHIA Y, NISHIKAWA M, et al.Preservation of exosomes at room temperature using lyophilization[J].International Journal of Pharmaceutics, 2019, 553: 1-7.DOI:10.1016/j.ijpharm.2018.10.032.
[71] 王璐, 陈梦丽, 何芳, 等. 工程化外泌体介导巨噬细胞清除肿瘤外泌体[J]. 中国生物工程杂志, 2022, 42(6): 1-11.DOI:10.13523/j.cb.2201020.