Effect of Vacuum Skin Packaging and High-Oxygen Modified Atmosphere Packaging on the Quality and Microbial Properties of Chilled Pork during Storage
李香远, 费智国, 杨硕, 等. 真空贴体和高氧气调包装对冷鲜猪肉贮藏期品质和微生物的影响[J]. 肉类研究, 2024, 38(3):56-63.DOI:10.7506/rlyj1001-8123-20240304-046. http://www.rlyj.net.cn
LI Xiangyuan, FEI Zhiguo, YANG Shuo, et al. Effect of vacuum skin packaging and high-oxygen modified atmosphere packaging on the quality and microbial properties of chilled pork during storage[J]. Meat Research, 2024, 38(3): 56-63.(in Chinese with English abstract)DOI:10.7506/rlyj1001-8123-20240304-046. http://www.rlyj.net.cn
猪肉是一种富含蛋白质的高品质食物,受到世界各地人们喜爱[1]。中国是世界上最大猪肉生产和消费国,2022年我国猪肉产量达5 541万 t,约占世界猪肉产量的50.4%[2]。猪肉在流通、销售过程中极易腐败变质,给猪肉行业造成巨大的经济损失。因此控制贮藏期间猪肉品质,延长产品货架期,对保证和促进我国生猪产业发展具有重要意义。
肉品腐败是一个复杂的过程,其中微生物是导致食品腐败和变质最主要的因素。我国冷鲜肉制品在贮运和销售过程中常以无包装形式出现,极易受到微生物的污染,使肉制品的货架期、营养价值和食用安全性等受到影响[3]。包装是延长鲜肉保质期的一种常用方法,对冷鲜猪肉进行有效的包装可以降低微生物污染,延长肉品货架期[4]。
近年来,高氧气调包装(high-oxygen modified atmosphere packaging,HiOx-MAP)已在红肉销售过程中广泛应用。Lu Xiao等[5]研究发现,经HiOx-MAP(80%O2/20% CO2)可以增加DFD(dark, firm, dry)牛肉的红度值(a*),改善肉色。Conte-Junior等[6]研究包装中不同氧气含量(100%~50%)对冷藏牛肉糜保质期的影响,结果表明,MAP均能够延缓总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量的增加,延长贮藏时间。体积分数70%~80% O2可以使肉的表层产生氧合肌红蛋白,促进肉的发色。因此,在HiOx-MAP中,肉表面呈现出明亮的樱桃红色,提高了消费者的购买意愿[7]。但是,高氧环境也促进了需氧菌的生长,并增加了脂质氧化程度,对某些感官特性(如嫩度、味道和颜色)产生负面影响[8]。在HiOx-MAP中另外一种关键气体是20%~30% CO2,其可以通过抑制细菌生长来延长肉的货架期。真空贴体包装(vacuum skin packaging,VSP)是在肉表面覆盖一层热封的塑料膜并除去包装内的空气,其无氧环境降低肉类的氧化程度,为零售提供了最长的保质期[9]。但无氧环境也会使肌红蛋白保持还原性的脱氧肌红蛋白状态,使肉色呈深紫色,降低对消费者的吸引力。与此同时,不同包装方法对微生物的生长和演替也会产生很大的影响。
本研究分析VSP与HiOx-MAP对猪肉品质、货架期和微生物特性的影响,此外,利用高通量测序技术将宏基因组的功能分析与猪肉的理化变化相结合,以了解低温条件下肉类微生物变质的潜在机制,从而为猪肉在流通、销售中选择合适的包装、延长货架期、改善品质提供技术指导。
实验原材料:12 条新鲜猪背最长肌,购于山东省某屠宰企业。
蛋白胨(分析纯)、平板计数琼脂(plate count agar,PCA) 北京陆桥技术股份有限公司;氯化钠(分析纯)、氧化镁、硫代巴比妥酸 国药集团化学试剂有限公司;甲基红、溴甲酚绿、硼酸、盐酸(均为分析纯)、DNA提取试剂盒 天津凯通化学试剂有限公司;乙二胺四乙酸(ethlene diamine tetraacetic acid,EDTA) 北京索莱宝科技有限公司;5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB) 上海阿拉丁生化科技股份有限公司。
S210 pH计 瑞士Mettler Toledo公司;SP62便携式色差计 美国爱色丽仪器有限公司;SPX-40智能型生化培养箱 宁波江南仪器厂;K-9860凯氏定氮仪 瑞士Buchi公司;EpochTM 2酶标仪 美国BioTek公司;DT-6D气调包装机、VS-410真空贴体包装机 大江机械设备(中国)有限公司。
1.3.1 实验设计
剔除猪背最长肌上的筋腱和可见脂肪,修整完毕后分割成约1.5 cm厚的猪排(约120 g),分别进行VSP(真空度≥95%;复合阻隔膜,O2透过率≤35 cm3/(m2·24 h),水蒸气透过率≤5 g/(m2·24 h))和HiOx-MAP(70% O2/30% CO2;氧气阻隔膜,O2透过率25 cm3/(m2·24 h),水蒸气透过率10 g/(m2·24 h))。包装结束后置于冷库(0~4 ℃)贮藏0、5、10、15、20、25 d,测定不同包装样品肉色、pH值、氧化指标和微生物等指标。在每个贮藏时间点,每种包装方式取6 块猪排进行平行实验(n=6)。
1.3.2 pH值测定
使用便携式pH计测定不同包装猪排的pH值。每块猪排测定3 次,取平均值。
1.3.3 肉色测定
根据Yang Jun等[10]的方法,使用经黑、白标准板校正的便携式色差计(测量孔径8 mm,光源D65,标准视角10°)测定不同包装猪排的肉色(亮度值(L*)、a*和黄度值(b*))。VSP猪排打开包装室温发色30 min后测定。随机选取样品横截面5 个位置测定表面颜色,测定时避开样品表面的筋腱、脂肪。
1.3.4 脂质氧化测定
参考Siu等[11]的方法并稍作修改。从每块猪排上取1 g肉样,剔除脂肪和筋腱后,与4 mL蒸馏水混合,研磨均质。再加入配制好的4 mL 10 g/100 mL三氯乙酸(trichloroacetic acid,TCA)溶液,涡旋混合均匀,使用定性滤纸过滤,取滤液1 mL,加入250 μL 0.06 mol/L硫代巴比妥酸溶液混合,80 ℃金属浴孵育90 min,流水冷却至室温后,测定样品在532 nm波长处的吸光度,并使用已知浓度的1,1,3,3-四甲氧基丙烷制作标准曲线,浓度为横坐标,吸光度为纵坐标,TBARS值以丙二醛(malondialdehyde,MDA)含量表示,按式(1)计算:
式中:c为MDA浓度/(mol/L);V为样品溶液体积/mL;M为MDA摩尔质量/(g/mol);m为试样质量/g。
1.3.5 蛋白氧化测定
肌原纤维蛋白的提取参考Liu Rui等[12]的方法并稍作修改。称取0.5 g肉样加入5 mL缓冲液(20 mmol/L磷酸盐缓冲液,含0.6 mmol/L NaCl,pH 6.5),研磨后离心10 min(4 ℃、5 000×g)取上清液,用BCA蛋白定量法测定蛋白浓度,用于羰基含量、巯基含量和活性巯基含量计算,结果以蛋白质量计。
羰基含量测定:参考Zhang Wangang等[13]的方法并稍作修改。取两等份50 μL样品,一份加入1 mL 10 mmol/L 2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)溶液,另一份加入1 mL 2 mol/L HCl溶液作为对照,黑暗环境孵育1 h后,分别加入1 mL 20 g/100 mL TCA溶液沉淀蛋白质;12 000×g离心10 min,然后用1 mL乙醇-乙酸乙酯(1∶1,V/V)洗涤3 次,去除DNPH;最后将沉淀溶解于1.5 mL 6.0 mol/L盐酸胍溶液中;于370 nm波长处测定吸光度。
巯基含量测定:参考Fu Qingquan等[14]的方法稍作修改。取0.1 mL蛋白溶液置于离心管中,加入0.9 mL磷酸盐缓冲液(50 mmol/L NaH2PO4、50 mmol/L Na2HPO4、8 mol/L尿素、0.6 mol/L KCl、10 mmol/L EDTA、pH 7.0),再加入0.04 mL 10 mmol/L DTNB溶液,在37 ℃黑暗环境中反应30 min后测定样品在412 nm波长处的吸光度。
活性巯基含量测定和总巯基含量测定类似,使用的磷酸盐缓冲液中不含尿素,在4 ℃黑暗环境中反应1 h,测定样品在412 nm波长处的吸光度。
羰基、巯基含量按式(2)计算:
式中:ΔA为实验组与空白组的吸光度差值;V1为反应液总体积/mL;V2为样品溶液体积/mL;ε为摩尔吸光系数,羰基含量测定中ε为22 000 L/(mol·cm),巯基含量测定中ε为13 600 L/(mol·cm);d为96 孔板孔径;c为蛋白浓度/(mol/L)。
1.3.6 菌落总数测定
参考GB 4789.1—2016《食品安全国家标准 食品微生物检测 总则》及Bhandare等[15]的方法,在无菌环境下,使用无菌手术刀从每块猪排表面随机均匀取10 g肉样,立刻放入无菌拍打袋中,加入90 mL无菌生理盐水(含0.85 g/100 mL氯化钠和0.1 g/100 mL蛋白胨),在室温下放入拍打均质器中拍打90 s。取1 mL菌液采用10 倍稀释系列进行梯度稀释,接种于PCA,37 ℃培养48 h后计算菌落总数,结果表示为lg(CFU/g)。
1.3.7 TVB-N含量测定
参考GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》进行测定。首先,将(10.0±0.1)g切碎的样品放入三角瓶中,加入70 mL蒸馏水,在室温下浸泡30 min。然后在蒸馏管中加入1 g氧化镁混合,并立即置于全自动凯氏定氮仪上,将馏出物收集在含有30 mL 20 g/L硼酸溶液的接收杯中,用0.01 mol/L HCl溶液滴定。TVB-N含量按式(3)计算:
式中:V1为试液消耗盐酸标准滴定溶液体积/mL;V2为试剂空白消耗盐酸标准滴定溶液体积/mL;c为盐酸标准滴定液浓度/(mol/L);14为滴定1.0 mL盐酸标准滴定液(1.000 mol/L)相当的氮含量/(g/mol);m为试样质量/g;100为换算系数。
1.3.8 微生物多样性分析
参考Yang Xiaoyin等[16]的方法,使用ShannuoTM细菌DNA提取试剂盒从不同包装猪排提取总细菌基因组DNA。用特异性引物(341F:5’-CCTAYGGGRBGCASCAG-3’和806R:5’-GGACTACNNGGGTATCTAAT-3’)通过聚合酶链式反应(polymerase chain reaction,PCR)扩增16S rDNA的V3~V4区。反应条件设定为:98 ℃预变性3 min,98 ℃变性45 s,55 ℃退火45 s,72 ℃延伸40 s,30 个循环,最后72 ℃延伸7 min。用2%琼脂糖凝胶电泳检测PCR产物,并用QIAquick凝胶提取试剂盒进行纯化。送至派森诺生物科技股份有限公司,通过Illumina平台对群落DNA片段进行双端测序。
采用SAS 9.0混合模型程序对pH值、肉色、菌落总数等指标数据进行分析。以包装方式、贮藏时间及其交互作用为固定效应,猪肉样品为随机效应。P<0.05认为差异有统计学意义。采用Origin 8.0软件作图。对于测序数据,采用QIIME2软件进行α多样性分析,包括Shannon指数、Chao1指数、ACE指数和操作分类单元(operational taxonomic unit,OTU)数。通过统计软件包R脚本和VennDiagram包生成热图和群落结构成分图。
pH值是影响生鲜肉品质的重要指标之一。由图1可知,不同贮藏时间和不同包装处理间pH值差异显著(P<0.05)。猪肉初始pH值为5.46,贮藏5 d后,2 种包装猪肉的pH值均随贮藏时间延长呈升高趋势。这可能是由于肉类蛋白质被内源酶和微生物分解产生氨和胺类等碱性物质,导致pH值升高[17]。同时HiOx-MAP猪肉pH值整体小于VSP猪肉,可能是由于HiOx-MAP中的CO2溶解到肉中,会与肉中的水和脂肪反应形成碳酸,从而导致猪肉pH值下降[18]。
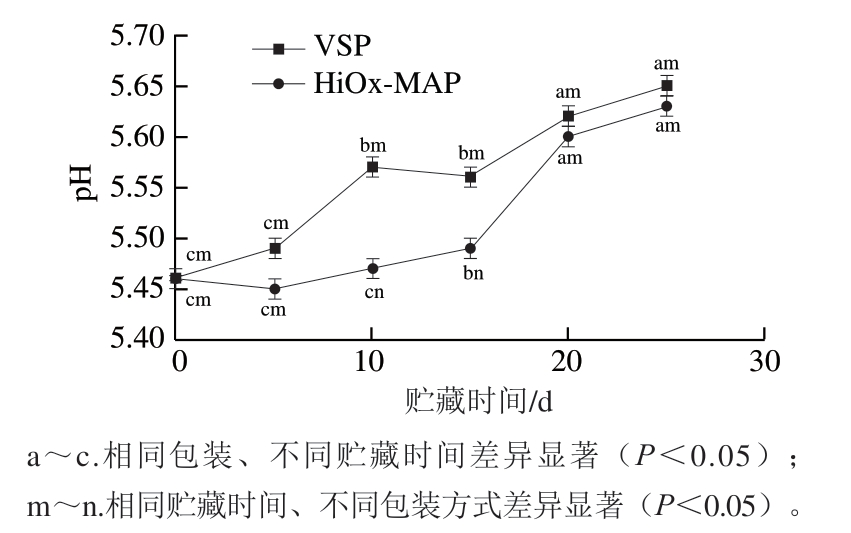
图1 包装方式和贮藏时间对猪肉pH值的影响
Fig. 1 Effect of packaging methods and storage time on the pH of pork
肉的颜色是影响消费者购买决定的最重要感官属性,消费者将鲜红色作为新鲜度和健康度的指标[19]。由表1可知,不同包装猪肉在4 ℃贮藏期间的L*、a*和b*具有显著差异(P<0.05)。猪肉初始L*为45.00,HiOx-MAP和VSP猪肉在整个贮藏期内L*的变化不同,且在整个贮藏过程中HiOx-MAP猪肉的L*高于VSP猪肉。VSP猪肉L*在贮藏前15 d呈上升趋势,在贮藏后期呈下降趋势,而HiOx-MAP猪肉L*在贮藏结束前一直呈上升趋势。L*的增加主要与贮藏过程中不同化学状态肌红蛋白的相对含量和蛋白质变性肉表面渗出的汁液有关。在贮藏前期,猪肉表面附着较多的汁液和蛋白质降解增加了光的散射,会导致L*升高。在贮藏后期,HiOx-MAP由于肌红蛋白氧化导致更高的L*,而VSP猪肉由于脱氧肌红蛋白的形成使肉色呈紫红色,肉的表面逐渐失去光泽,使L*低于HiOx-MAP组[20]。
表1 包装方式和贮藏时间对猪肉色泽的影响
Table 1 Effect of packaging methods and storage time on the color of pork
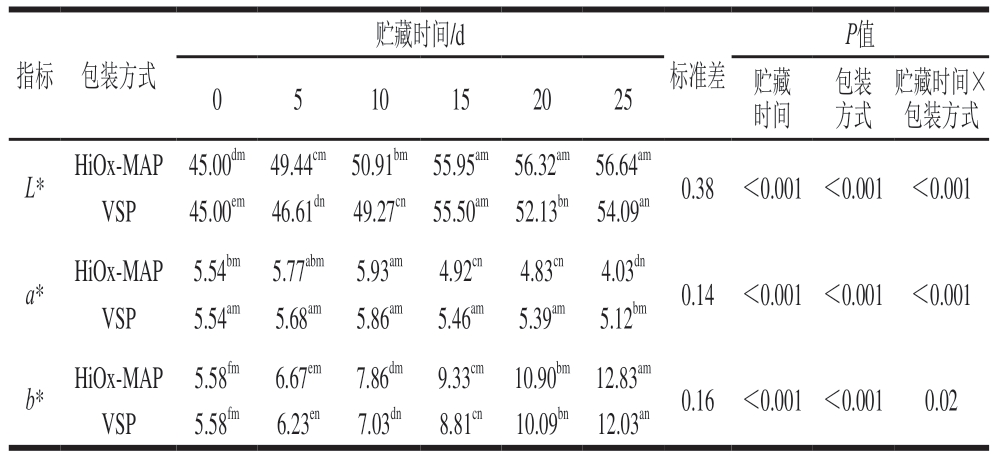
注:a~f.相同包装、不同贮藏时间差异显著(P<0.05);m~n.相同贮藏时间、不同包装方式差异显著(P<0.05)。表2同。
贮藏时间/d P值贮藏时间×包装方式L*HiOx-MAP45.00dm49.44cm50.91bm55.95am56.32am56.64am 0.38<0.001<0.001<0.001 VSP45.00em46.61dn49.27cn55.50am52.13bn54.09an a*HiOx-MAP5.54bm5.77abm5.93am4.92cn4.83cn4.03dn 0.14<0.001<0.001<0.001 VSP5.54am5.68am5.86am5.46am5.39am5.12bm b*HiOx-MAP5.58fm6.67em7.86dm9.33cm10.90bm12.83am 0.16<0.001<0.0010.02 VSP5.58fm6.23en7.03dn8.81cn10.09bn12.03an指标包装方式0510152025贮藏时间标准差包装方式
猪肉初始a*为5.54,HiOx-MAP和VSP猪肉a*在贮藏前10 d增加,并达到最大值,HiOx-MAP猪肉a*高于VSP猪肉,这是由于HiOx-MAP中较高的氧含量(70%)有助于氧合肌红蛋白的形成。随着贮藏时间的延长,2 种包装猪肉的a*逐渐下降,HiOx-MAP猪肉a*下降幅度较快且在15 d后低于VSP猪肉,并且VSP猪肉a*相对平稳。这可能是由于不同包装条件下肉的氧化状态不同,通常a*的降低与高铁肌红蛋白的形成有关[21]。在高氧条件下,好氧微生物的大量繁殖会使包装中肉表面氧分压降低,生成高铁肌红蛋白。同时,HiOx-MAP包装中有高比例的CO2也会降低肉色等感官品质[22]。
猪肉初始b*为5.58,随着贮藏时间的延长,b*逐渐增加,其原因可能是由于脂质与磷脂头部基团或蛋白质中的胺类物质发生反应产生黄色色素。通常认为浅粉色和苍白外观的猪肉与高L*、b*和低a*有关,而鲜红色猪肉与低L*、高a*和b*有关[23]。本研究结果表明,HiOx-MAP在贮藏前期提高了生鲜肉的色泽;但是在贮藏后期,猪肉L*升高,a*降低,色泽稳定性比VSP猪肉差。
本研究结果表明,包装方式×贮藏时间对脂质氧化和蛋白氧化有显著影响(P<0.05)。MDA含量可以反映肉的脂质氧化程度,MDA含量越高表明脂质氧化程度越高,TBARS值为0.5 mg/kg是生肉检测到异味的临界值[24]。蛋白质羰基化是蛋白氧化的显著后果和表现之一。由图2可知,猪肉初始TBARS值为0.23 mg/kg、羰基含量初始值为1.05 nmol/mg。随着贮藏时间的延长,2 种包装猪肉的TBARS值和羰基含量均呈上升趋势,但是VSP组的变化速率较低。贮藏15 d时,HiOx-MAP组TBARS值超过0.5 mg/kg。相较于HiOx-MAP组,VSP对猪肉脂肪氧化表现出非常好的抑制作用,在整个贮藏过程中TBARS值始终低于0.5 mg/kg。羰基的产生是由蛋白质氧化导致的,含量越高导致蛋白质的消化率和氨基酸的利用率越低,对人体健康不利影响越大。HiOx-MAP猪肉羰基含量始终显著高于VSP猪肉(P<0.05),巯基含量也通常用于分析肉中的蛋白氧化,巯基水平越低,肉中的蛋白氧化程度越高。在2 种包装猪肉中,巯基含量随着贮藏时间的延长逐渐下降。但是HiOx-MAP猪肉中巯基含量减少较快,贮藏10 d时显著低于VSP猪肉(P<0.05)。贮藏25 d时,HiOx-MAP和VSP猪肉活性巯基含量分别下降19.55、3.12 nmol/mg,总巯基含量分别下降23.48、14.42 nmol/mg。这说明VSP抑制蛋白氧化的效果更好。
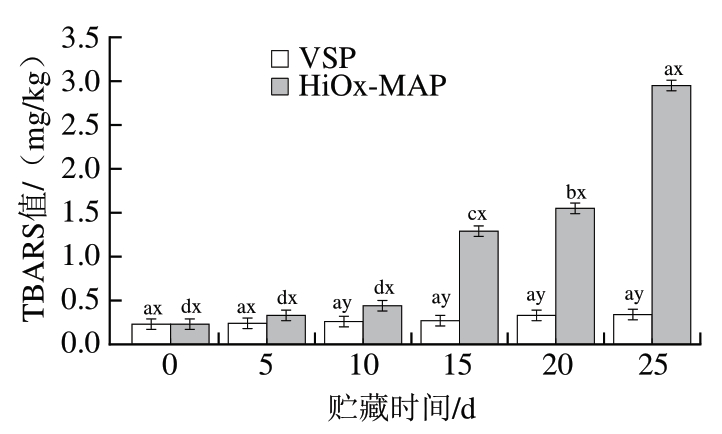
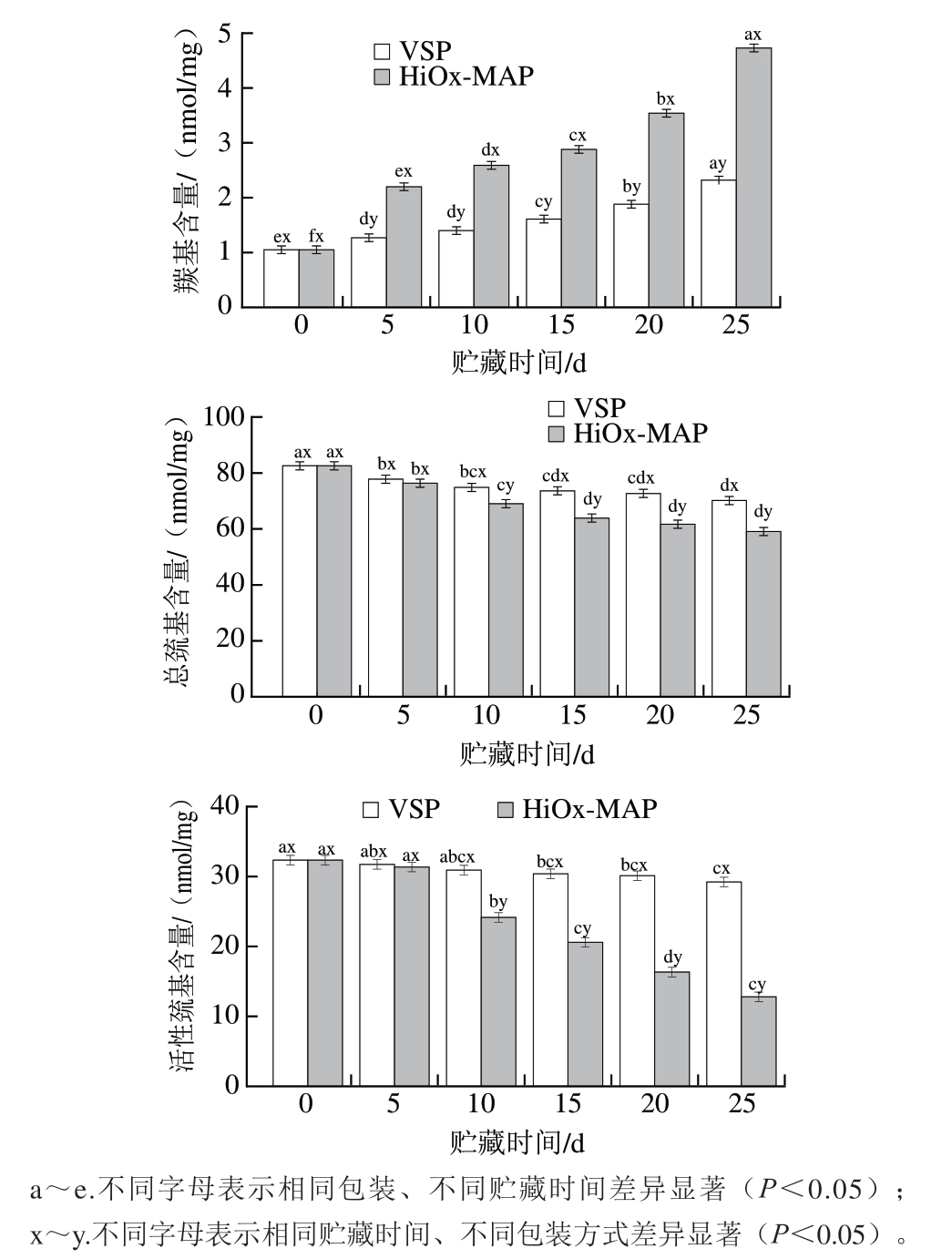
图2 包装方式和贮藏时间对猪肉脂质氧化和蛋白氧化的影响
Fig. 2 Effect of packaging methods and storage time on the lipid and protein oxidation of pork
由表2可知,总体而言,贮藏时间和包装方式对菌落总数影响显著(P<0.05)。样品的初始菌落总数为3.31(lg(CFU/g)),虽然Huang Xiaowei等[25]提出猪肉新鲜度菌落总数的允许限值为7(lg(CFU/g)),但GB/T 9959.2—2008《食品国家标准 分割鲜、冻瘦肉》规定的可接受上限为6(lg(CFU/g))。在本研究中,HiOx-MAP和VSP猪肉的菌落总数均随着贮藏时间的延长而增加,且均在贮藏20 d超过6(lg(CFU/g))。但是在整个贮藏期内VSP猪肉的菌落总数低于HiOx-MAP猪肉(P<0.05),这与Kameník等[9]的研究结果表明VSP抑菌效果优于HiOx-MAP相似。
表2 包装方式和贮藏时间对猪肉菌落总数和TVB-N含量的影响
Table 2 Effect of packaging methods and storage time on the TVC and TVB-N content of pork
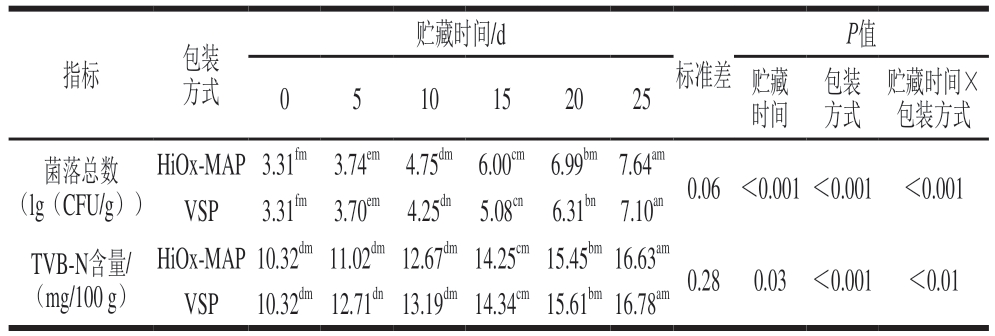
贮藏时间/d P值贮藏时间×包装方式菌落总数(lg(CFU/g))指标包装方式0510152025贮藏时间标准差包装方式HiOx-MAP3.31fm3.74em4.75dm6.00cm6.99bm7.64am 0.06<0.001<0.001<0.001 VSP3.31fm3.70em4.25dn5.08cn6.31bn7.10an TVB-N含量/(mg/100 g)HiOx-MAP10.32dm11.02dm12.67dm14.25cm15.45bm16.63am 0.280.03<0.001<0.01 VSP10.32dm12.71dn13.19dm14.34cm15.61bm16.78am
TVB-N含量广泛作为肉品新鲜度指标,TVB-N含量的增加主要与腐败微生物和内源酶引发的蛋白质降解有关[26]。GB 2707—2016《食品安全国家标准 鲜(冻)畜、禽产品》规定鲜、冻猪肉中TVB-N含量容许上限值为15 mg/100 g。由表2可知,样品的初始TVB-N含量为10.32 mg/100 g。在整个贮藏过程中,HiOx-MAP和VSP猪肉的TVB-N含量均随着贮藏时间的延长而显著增加(P<0.05),均在贮藏20 d时超过15 mg/100 g,2 组间差异不显著。在宰后贮藏过程中,pH值的增加与TVB-N含量有很强的正相关性,肉类中特定腐败微生物对这种相关性的影响较大[27]。
2.6.1 测序数据分析
16S rRNA基因扩增子测序分析提供了VSP和HiOx-MAP猪肉中微生物群落多样性和丰度的清晰视图。由表3可知,2 种包装所有猪肉的覆盖率均高于99%,这表明猪肉中的大多数微生物都被检测到。其中微生物种类与OTU数相关,OTU数越多则表明测序样品中微生物种类越多。Chao1指数越大,表明群落的丰富度越高。本研究发现2 种包装的OTU数和Chao1指数在贮藏后期均显著降低,且HiOx-MAP组高于VSP组,表明微生物多样性随着贮藏时间的延长迅速下降,但HiOx-MAP猪肉的微生物多样性高于VSP猪肉。Shannon指数能反映群落物种多样性。一般来说,肉类中的微生物多样性随着时间的推移而持续下降,最终只有少数物种存活[28]。
表3 包装方式和贮藏时间对猪肉微生物群落物种丰度及多样性的影响
Table 3 Effect of packaging methods and storage time on the species richness and diversity of the bacterial community in pork
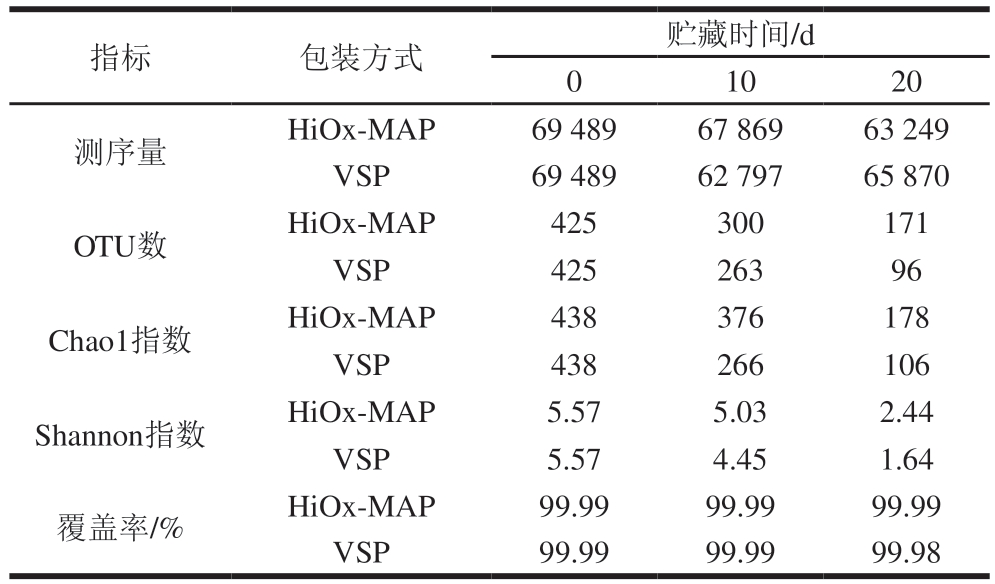
1020测序量HiOx-MAP69 48967 86963 249 VSP69 48962 79765 870 OTU数HiOx-MAP425300171 VSP42526396 Chao1指数HiOx-MAP438376178 VSP438266106 Shannon指数HiOx-MAP5.575.032.44 VSP5.574.451.64覆盖率/%HiOx-MAP99.9999.9999.99 VSP99.9999.9999.98指标包装方式贮藏时间/d 0
2.6.2 包装方式和贮藏时间对猪肉细菌群落组成的影响
由图3可知,在不同的包装方式和贮藏时间下,猪肉微生物组成在门和属水平上发生变化。基于高通量测序结果(图3a),共观察到5 个以上的门,其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和放线菌门(Actinobacteria)是含量最丰富的门,占总细菌群落的95%以上。无论是HiOx-MAP还是VSP猪肉,在贮藏前10 d,最主要的菌群都是变形菌门,但是到贮藏结束时,该菌群被厚壁菌门取代。
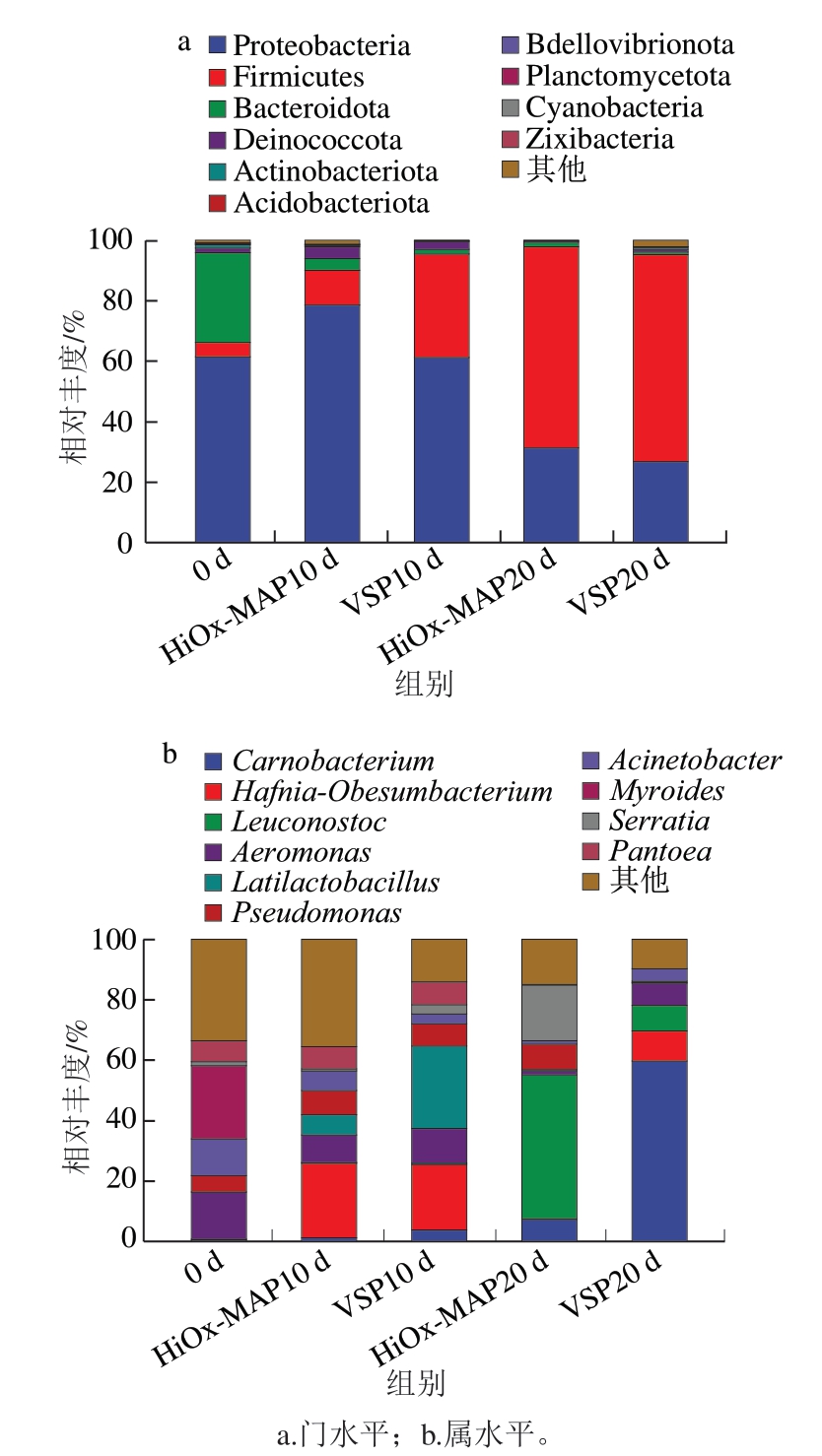
图3 包装方式和贮藏时间对猪肉细菌群落相对丰度的影响
Fig. 3 Effect of packaging methods and storage time on the relative abundance of the bacterial community in pork
在属水平上,相对丰度高于1%的细菌如图3b所示,初始细菌组成以类香菌属(Myroides,24.38%)、不动杆菌属(Acinetobacter,15.6%)、泛菌属(Pantoea,6.99%)和假单胞菌属(Pseudomonas,5.53%)为主。这些细菌主要来源于肉类加工环境,如土壤或水。在贮藏过程中,包装方式影响微生物群落的演替,这是由于细菌的竞争生长所导致的,一些最初的属,如类香菌属、不动杆菌属逐渐减少。
肉食杆菌(Carnobacterium)、乳杆菌、明串珠菌是乳酸菌中常见的分离菌株,是各类包装肉制品中最典型的微生物[29]。在本研究中,肉食杆菌的生长速率是乳酸菌中最快的,VSP猪肉贮藏后期,肉食杆菌成为优势菌。肉食杆菌是一种异源发酵菌,能产生与真空包装(vacuum packaging,VP)肉类腐败有关的丁酸和硫化物[30]。这说明VSP和VP类似,在贮藏后期肉食杆菌具有更大的竞争优势。许多研究表明,贮藏后期的优势细菌是控制肉类变质的关键因素[16]。
不同于VSP,HiOx-MAP猪肉中优势菌群演变更加复杂,这可能是其腐败较快的原因之一。乳酸菌是引起HiOx-MAP猪肉腐败的主要原因之一。在贮藏后期,HiOx-MAP猪肉中明串珠菌属相对丰度达到47.49%、沙雷氏菌属18.54%、假单胞菌属8.49%、肉食杆菌属7.22%,表明氧有利于明串珠菌属形成,该属仅由异发酵物种组成,是肉中不良物质的潜在生产者。这与Jääskeläinen等[31]的研究相似。
由图4可知,HiOx-MAP猪肉的明串珠菌属、沙雷氏菌属、环丝菌属和假单胞菌属聚集在一起,且具有较高OTU相对丰度。然而在VSP猪肉中,肉食杆菌属OTU相对丰度较高,这表明它是VSP猪肉贮藏后期的优势菌群。由热图分析可以看出,贮藏前10 d的所有样本聚类在一起,与贮藏第20天的样本呈现差异性,这表明不同包装猪肉在贮藏过程中的微生物相对丰度发生了变化。
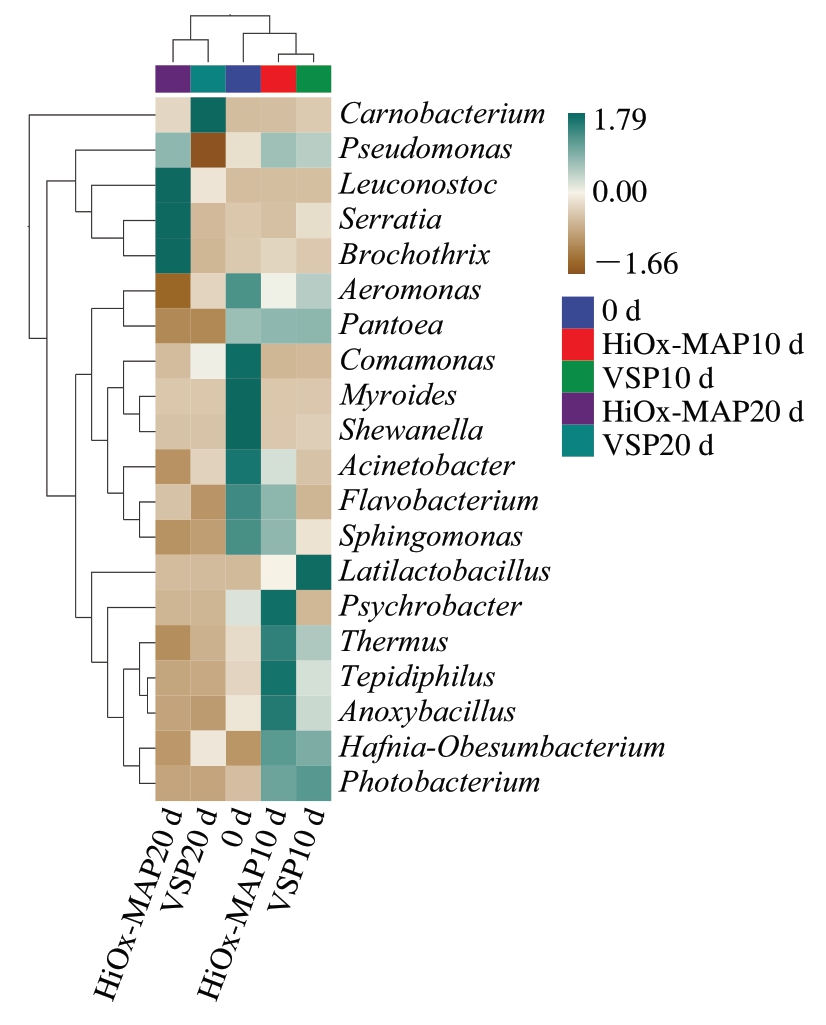
图4 VSP和HiOx-MAP猪肉冷藏过程中细菌群落热图
Fig. 4 Heatmap of bacterial genera in pork packaged under HiOx-MAP or VSP during chilled storage
本研究中HiOx-MAP在贮藏前期对维持猪肉颜色至关重要,但是贮藏15 d起,HiOx-MAP猪肉a*降低,颜色稳定性较差,同时,在整个贮藏期间TBARS值、羰基含量显著高于VSP猪肉(P<0.05),巯基含量显著低于VSP猪肉(P<0.05)。VSP对肉品的氧化有较好的抑制作用。VSP和HiOx-MAP猪肉的微生物货架期均为20~25 d,但是从贮藏10 d开始HiOx-MAP猪肉的菌落总数显著高于VSP猪肉(P<0.05)。随着贮藏时间的延长,HiOx-MAP和VSP猪肉中的优势微生物从贮藏初期的变形菌门被后期的后壁菌门所取代,且2 种包装的微生物多样性均有所下降,但HiOx-MAP猪肉的微生物多样性更加复杂。当菌落总数接近国家标准规定上限时,明串珠菌属和沙雷氏菌属为HiOx-MAP猪肉中优势菌,而肉食杆菌属最终成为VSP猪肉的优势菌。总体而言,在短期贮藏销售(10 d内)时使用HiOx-MAP能够维持猪肉良好的肉色,但VSP能更好抑制猪肉氧化,具有更长的微生物货架期。该研究结果可以为猪肉销售过程中的品质和货架期控制提供一定理论指导和技术支撑。
[1] YAN E F, GUO J X, YIN J D. Nutritional regulation of skeletal muscle energy metabolism, lipid accumulation and meat quality in pigs[J]. Animal Nutrition, 2023, 14(3): 185-192.DOI:10.1016/j.aninu.2023.04.009.
[2] 崔昊, 谢铿铮, 石守定, 等. 2022年世界猪肉市场现状及未来发展趋势[J]. 中国猪业, 2022, 17(5): 13-15; 22.DOI:10.16174/j.issn.1673-4645.2022.05.002.
[3] DING D M, ZHOU C Y, GE X Y, et al. The effect of different degrees of superchilling on shelf life and quality of pork during storage[J].Journal of Food Processing and Preservation, 2020, 44(4): e14394.DOI:10.1111/jfpp.14394.
[4] PANEA B, RIPOLL G. Sex does not affect the colour, shear stress, and lipid oxidation of pork meat, but feed-added plant-derived extracts,storage time and packaging type do[J]. Foods, 2023, 12(8): 1720.DOI:10.3390/foods12081720.
[5] LU X, CORNFORTH D P, CARPENTER C E, et al. Effect of oxygen concentration in modified atmosphere packaging on color changes of the M. longissimus thoraces et lumborum from dark cutting beef carcasses[J]. Meat Science, 2020, 161: 107999.DOI:10.1016/j.meatsci.2019.107999.
[6] CONTE-JUNIOR C A, MONTEIRO M L G, PATRÍCIA R, et al. The effect of different packaging systems on the shelf life of refrigerated ground beef[J]. Foods, 2020, 9(4): 495.DOI:10.3390/foods9040495.
[7] LIANG R R, ZHANG W, MAO Y W, et al. Effects of CO2 on the physicochemical, microbial, and sensory properties of pork patties packaged under optimized O2 levels[J]. Meat Science, 2024, 209:109422.DOI:10.1016/j.meatsci.2023.109422.
[8] LI S J, GUO X X, SHEN Y, et al. Effects of oxygen concentrations in modified atmosphere packaging on pork quality and protein oxidation[J]. Meat Science, 2022, 189: 108826.DOI:10.1016/j.meatsci.2022.108826.
[9] KAMENÍK J, SALÁKOVÁ A, PAVLÍK Z, et al. Vacuum skin packaging and its effect on selected properties of beef and pork meat[J]. European Food Research and Technology, 2014, 239(3):395-402.DOI:10.1007/s00217-014-2233-9.
[10] YANG J, ZHANG Y, SHI H, et al. Influence of low-energy electron beam irradiation on the quality and shelf-life of vacuum-packaged pork stored under chilled and superchilled conditions[J]. Meat Science,2023, 195: 109019.DOI:10.1016/j.meatsci.2022.109019.
[11] SIU G, DRAPER H. A survey of the malonaldehyde content of retail meats and fish[J]. Journal of Food Science, 1978, 43(4): 1147-1149.DOI:10.1111/j.1365-2621.1978.tb15256.x.
[12] LIU R, LONERGAN S, STEADHAM E, et al. Effect of nitric oxide on myofibrillar proteins and the susceptibility to calpain-1 proteolysis[J]. Food Chemistry, 2019, 276: 63-70.DOI:10.1016/j.foodchem.2018.10.005.
[13] ZHANG W G, XIAO S, LEE E J, et al. Consumption of oxidized oil increases oxidative stress in broilers and affects the quality of breast meat[J]. Journal of Agricultural and Food Chemistry, 2011, 59(3): 969-974.DOI:10.1021/jf102918z.
[14] FU Q Q, LIU R, ZHANG W G, et al. Effects of different packaging systems on beef tenderness through protein modifications[J]. Food and Bioprocess Technology, 2015, 8(3): 580-588.DOI:10.1007/s11947-014-1426-3.
[15] BHANDARE S G, SHERIKAR A, PATURKAR A, et al. A comparison of microbial contamination on sheep/goat carcasses in a modern indian abattoir and traditional meat shops[J]. Food Control, 2007, 18(7):854-858.DOI:10.1016/j.foodcont.2006.04.012.
[16] YANG X Y, ZHU L X, ZHANG Y M, et al. Microbial community dynamics analysis by high-throughput sequencing in chilled beef longissimus steaks packaged under modified atmospheres[J]. Meat Science, 2018, 141: 94-102.DOI:10.1016/j.meatsci.2018.03.010.
[17] GAO X G, XIE L, WANG Z Y, et al. Effect of postmortem time on the metmyoglobin reductase activity, oxygen consumption, and colour stability of different lamb muscles[J]. European Food Research and Technology, 2013, 236(4): 579-587.DOI:10.1007/s00217-012-1903-8.
[18] LEYGONIE C, BRITZ T, HOFFMAN L. Protein and lipid oxidative stability of fresh ostrich M. iliofibularis packaged under different modified atmospheric packaging conditions[J]. Food Chemistry, 2011,127(4): 1659-1667.DOI:10.1016/j.foodchem.2011.02.033.
[19] YANG X Y, XU B C, LEI H M, et al. Effects of grape seed extract on meat color and premature browning of meat patties in high-oxygen packaging[J]. Journal of Integrative Agriculture, 2022, 21(8): 2445-2455.DOI:10.1016/s2095-3119(21)63854-6.
[20] JEREMIAH L. Packaging alternatives to deliver fresh meats using short-or long-term distribution[J]. Food Research International, 2001,34(9): 749-772.DOI:10.1016/s0963-9969(01)00096-5.
[21] 张一敏, 朱立贤, 张万刚, 等. 生鲜牛肉中的腐败微生物概述[J].食品科学, 2018, 39(13): 289-296.DOI:10.7506/spkx1002-6630-201813043.
[22] BASSEY A P, CHEN Y, ZHU Z, et al. Assessment of quality characteristics and bacterial community of modified atmosphere packaged chilled pork loins using 16S rRNA amplicon sequencing analysis[J]. Food Research International, 2021, 145: 110412.DOI:10.1016/j.foodres.2021.110412.
[23] BREWER M, MCKEITH F. Consumer-rated quality characteristics as related to purchase intent of fresh pork[J]. Journal of Food Science,1999, 64(1): 171-174.DOI:10.1111/j.1365-2621.1999.tb09885.x
[24] SHEARD P, ENSER M, WOOD J, et al. Shelf life and quality of pork and pork products with raised n-3 PUFA[J]. Meat Science, 2000,55(2): 213-221.DOI:10.1016/s0309-1740(99)00145-x.
[25] HUANG X W, ZOU X B, SHI J Y, et al. Determination of pork spoilage by colorimetric gas sensor array based on natural pigments[J]. Food Chemistry, 2014, 145: 549-554.DOI:10.1016/j.foodchem.2013.08.101.
[26] BASSEY A P, LIU P P, CHEN J, et al. Antibacterial efficacy of phenyllactic acid against Pseudomonas lundensis and Brochothrix thermosphacta and its synergistic application on modified atmosphere/air-packaged fresh pork loins[J]. Food Chemistry, 2024, 430: 137002.DOI:10.1016/j.foodchem.2023.137002.
[27] XU Z Q, WANG Z R, LI J K, et al. The effect of freezing time on the quality of normal and pale, soft and exudative (PSE)-like pork[J]. Meat Science, 2019, 152: 1-7.DOI:10.1016/j.meatsci.2019.02.003.
[28] YANG J, YANG X, LIANG R, et al. The response of bacterial communities to carbon dioxide in high-oxygen modified atmosphere packaged beef steaks during chilled storage[J]. Food Research International, 2022, 151: 110872.DOI:10.1016/j.foodres.2021.110872.
[29] YOUSSEF M K, GILL C O, YANG X. Storage life at 2 ℃ or -1.5 ℃of vacuum-packaged boneless and bone-in cuts from decontaminated beef carcasses[J]. Journal of the Science of Food and Agriculture,2014, 94(15): 3118-3124.DOI:10.1002/jsfa.6659.
[30] CASABURI A, PIOMBINO P, NYCHAS G J, et al. Bacterial populations and the volatilome associated to meat spoilage[J]. Food Microbiology, 2015, 45: 83-102.DOI:10.1016/j.fm.2014.02.002.
[31] JÄÄSKELÄINEN E, HULTMAN J, PARSHINTSEV J, et al.Development of spoilage bacterial community and volatile compounds in chilled beef under vacuum or high oxygen atmospheres[J].International Journal of Food Microbiology, 2016, 223: 25-32.DOI:10.1016/j.ijfoodmicro.2016.01.022.