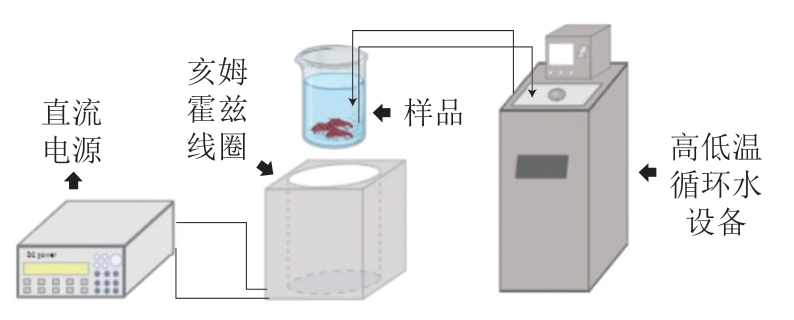
图1 磁场辅助浸渍冷冻示意图
Fig. 1 Schematic diagram of magnetic field-assisted immersion freezing
Effects of Freezing Methods on the Properties and Structure of Myofibrillar Proteins from Crayfish (Procambarus clarkii)
卢曜昆, 李强, 朱雅情, 等. 冷冻方式对小龙虾蛋白性质和结构的影响[J]. 肉类研究, 2024, 38(3): 49-55.DOI:10.7506/rlyj1001-8123-20240220-041. http://www.rlyj.net.cn
LU Yaokun, LI Qiang, ZHU Yaqing, et al. Effects of freezing methods on the properties and structure of myofibrillar proteins from crayfish (Procambarus clarkii)[J]. Meat Research, 2024, 38(3): 49-55. (in Chinese with English abstract)DOI:10.7506/rlyj1001-8123-220240220-041. http://www.rlyj.net.cn
小龙虾学名克氏原螯虾(Procambarus clarkii),在中国淡水虾类的生产养殖中占据重要地位。2022年中国小龙虾养殖产量为289.07万 t,相较于2021年的263.36万 t增长9.76%[1]。随着产量的提升,随之而来的是贮运难题。小龙虾捕捞后不易存活,死亡后的小龙虾在微生物和酶的作用下,组织腐败加快,品质迅速下降,影响食用口感[2]。因此,冻藏成为水产品保鲜的常用方法[3],但常规空气冻结过程中形成的大冰晶会对肌肉组织造成物理损伤,这也对虾肉品质造成不利的影响[4]。冰晶形态与分布主要受冷冻速率的影响,浸渍冷冻相较于传统的空气冷冻是一种更快速的冷冻方式,主要依赖冷冻介质(如乙醇和盐水)与食品表面之间热量的快速交换,这有助于在虾肉冷冻过程中形成体积更小、分布更加均匀的冰晶[5-6]。随着液氮技术的发展,液氮冻结成本下降,液氮冷冻也更多地被用于水产品的冻结贮藏[7]。为了提高冷冻效率、减少食品冷冻过程中大冰晶形成,改善食品品质,各种新型的物理辅助冷冻加工技术也相继出现,例如高压、超声波、微波及静电场等[8]。然而,这些方法对食品本身及所需设备都有一定要求,应用方面存在一定的局限性[9]。
磁场技术作为一种相对环保的技术,近年来受到越来越多的关注,在各领域的应用也越来越广泛[10-12]。研究表明,磁场会影响水的微观结构,进而影响其宏观性质[13];在脉冲电场存在下,静磁场能够使0.9 g/100 mL NaCl溶液相变时间缩短,冰晶形态更加均匀[14]。现如今磁场在食品领域中的应用正逐渐走进人们的视野。例如,在猪肉[15]、鲶鱼[16]、牛肉[17]等食品冷冻或保鲜过程中添加静磁场辅助均能提高其冷冻速率,缩短冻结时间,在节能的同时也能改善其冷冻后的品质。相较于变磁场,静磁场降低了线圈工作时产生的热效应对食品的影响,且需要的能量更少[15]。
本实验室前期已探究了不同类型磁场辅助冷冻对斑点叉尾鮰鱼肉蛋白性质和结构的影响[18]。在此基础上,本研究主要以小龙虾为研究对象,进一步比较一定强度的静磁场辅助浸渍冷冻(static magnetic field-assisted immersion freezing,SMF)与其他3 种常规冷冻(空气冷冻(air freezing,AF)、浸渍冷冻(immersion freezing,IF)及液氮浸渍冷冻(liquid nitrogen freezing,LNF))对小龙虾蛋白性质和结构的影响,验证磁场辅助冷冻对小龙虾肉品质的改善作用,为磁场辅助冷冻在水产品冷冻贮藏中的应用提供理论指导。
本研究使用的所有新鲜小龙虾(体质量(30.00±5.00)g)均购自安徽合肥大润发超市。保活运至实验室后超声清洗20 min,剔除死虾后,将剩余的虾冰冻猝死,去除虾头和虾线,清洗后随机分成4 组,用聚乙烯袋包装,然后放入4 ℃冰箱中,24 h内使用。
无水乙醇、氯化钠、氯化镁、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)、磷酸二氢钠、磷酸氢二钠、溴酚蓝(bromophenol blue,BPB)、考马斯亮蓝G250国药集团化学试剂有限公司;牛血清蛋白标准品(5 mol/L)、双缩脲法蛋白质含量检测试剂盒、总巯基含量检测试剂盒 北京索莱宝科技有限公司;HEPES体系预制胶C621104、5×上样缓冲液(含少量二硫苏糖醇) 生工生物工程(上海)股份有限公司。
CH-Hall一维交直流磁场发生系统 北京翠海佳诚磁电科技有限公司;TMS8005-8R25浸入式高低温恒温循环槽浙江丹府环境科技有限公司;PZ1000多路温度记录仪佛山华知科电子科技有限公司;YC-260L低温冷冻柜安徽中科都菱有限公司;Mastersizer 2000激光粒度分析仪英国Malvern公司;Epoch全波长酶标仪 美国BioTek公司;Nicolet 6700傅里叶变换红外光谱仪 美国Thermoelectric Group公司;F-7100荧光光谱仪 日本日立公司;DSCQ2000差示扫描量热仪 美国TA公司;PowerPac Basic电泳仪 美国Bio-Rad公司;3500凝胶成像仪 上海天能科技有限公司;T8均质机 德国IKA公司。
1.3.1 样品冷冻处理
将4 组小龙虾分别采用-25 ℃冰柜进行AF;使用图1设备进行SMF(4 mT、-25 ℃);不添加磁场直接进行-25 ℃ IF;以及LNF。当样品中心温度达到-18 ℃时,冷冻过程结束,然后将所有小龙虾转移到冰箱((-18.0±0.5) ℃)中保存,待测。分析前,将冷冻小龙虾在4 ℃冰箱中解冻6 h。

图1 磁场辅助浸渍冷冻示意图
Fig. 1 Schematic diagram of magnetic field-assisted immersion freezing
1.3.2 小龙虾肌原纤维蛋白的提取
参考桑燕菲等[19]的方法并略作修改。取5 g小龙虾肉剁碎,与20 mL溶液I(0.1 mol/L NaCl、0.002 mol/L MgCl2、0.001 mol/L EDTA-2Na、0.1 mol/L磷酸盐缓冲液,pH 7.0)混合,10 000 r/min匀浆25 s后,4 ℃、8 000 r/min离心15 min,取沉淀再重复上述操作2 次得粗蛋白。将所得粗蛋白加入20 mL溶液II(0.1 mol/L NaCl、0.1 mol/L磷酸盐缓冲液,pH 6.0),10 000 r/min匀浆25 s后,4 ℃、8 000 r/min离心15 min,取沉淀再加入溶液II重复上述操作2 次。再用适量溶液III(0.6 mol/L NaCl、0.1 mol/L磷酸盐缓冲液,pH 6.0)溶解蛋白,用纱布过滤除杂,滤液即为肌原纤维蛋白溶液。采用双缩脲法测定蛋白质量浓度,以5 mol/L牛血清蛋白溶液为标准品,48 h内用完。
1.3.3 浊度测定
参考严红波等[20]的方法并略作修改。将肌原纤维蛋白溶液质量浓度用适量溶液III调至1 mg/mL,混匀后静置20 min,以溶液III作为空白,于340 nm波长处测定吸光度表示浊度。
1.3.4 粒径和Zeta电位测定
参照Liu Ru等[21]的方法测定蛋白粒径,吸取1 mg/mL肌原纤维蛋白溶液800 μL缓慢注入比色皿中,在25 ℃下用633 nm激光照射测定肌原纤维蛋白颗粒粒径,并用平均直径来表征。将肌原纤维蛋白溶液稀释至0.1 mg/mL,取800 μL注入到U型毛细管样品池中,25 ℃平衡120 s,测定Zeta电位值。每组样品至少重复测定3 次。
1.3.5 总巯基含量测定
称取约0.1 g虾肉,加入1 mL试剂盒内蛋白提取液,冰浴匀浆后于4 ℃、5 000 r/min离心10 min,取上清液,采用试剂盒给定方法测定。
1.3.6 红外光谱测定
将小龙虾肉冻干后碾成粉末,使用红外光谱仪进行扫描。参数设置如下:扫描范围4 000~650 cm-1,分辨率4 cm-1,扫描4 次。使用Peak Fit 4.12软件(美国Systat Software公司)对红外光谱图进行去卷积、曲线拟合及二阶求导,最后通过分析酰胺I带(1 700~1 600 cm-1)计算二级结构相对含量。
1.3.7 表面疏水性测定
参考Chelh等[22]的方法测定肌原纤维蛋白的表面疏水性。将1 mL肌原纤维蛋白溶液(5 mg/mL)与200 μL BPB溶液(1 mg/mL)混合,以20 mmol/L磷酸盐缓冲液(pH 6.0)作为空白组,室温振荡10 min,然后4 000 r/min离心15 min。在595 nm波长处测定上清液的10 倍稀释液的吸光度(A)。表面疏水性用BPB结合量表示,按下式计算:
1.3.8 荧光光谱与紫外吸收光谱测定
荧光光谱检测:参考Li Fangfei等[23]的方法并略作修改。将激发波长设定为295 nm,发射光谱波长范围300~450 nm,狭缝宽度固定为10 nm,测定0.1 mg/mL肌原纤维蛋白溶液的荧光光谱。
紫外吸收光谱检测:将肌原纤维蛋白溶液稀释至1 mg/mL,以溶液III作为对照,扫描波长190~700 nm。
1.3.9 热稳定性测定
使用差示扫描量热法对样品蛋白质的热稳定性进行评估。精确称量15 mg解冻样品,置于铝盘中,压盖密封,升温速率设置为5 ℃/min,从20 ℃升温至90 ℃,以空坩埚作为参比,每个样品重复3 次。
1.3.10 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDSPAGE)分析
参考江杨阳[24]的方法并略作修改。将1 mg/mL肌原纤维蛋白溶液与还原型上样缓冲液(含DTT)按照4∶1(V/V)混合,于沸水中加热10 min,蛋白上样量为10 µL,使用4%~15% HEPES体系预制胶,浓缩胶和分离胶电压分别为100、120 V。电泳完成后对胶片进行染色30 min并脱色过夜,最后在凝胶成像仪上扫描成像。
所有实验均最少重复3 次,实验数据以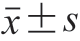 表示。采用SPSS 22.0软件(美国IBM公司)进行单因素方差分析。
表示。采用SPSS 22.0软件(美国IBM公司)进行单因素方差分析。
浊度反映蛋白质的聚集程度[25]。由图2可知,AF组的浊度显著高于其他各组(P<0.05)。这可能是因为AF速率慢,形成的冰晶大而不规则,肌原纤维蛋白变性严重,导致内部基团外露形成聚集,使浊度增加[26]。相较于IF组,SMF组浊度显著降低(P<0.05),这表明溶液中蛋白质分散较为均匀,稳定性较好,说明SMF处理能够抑制蛋白质氧化,减少聚集的形成。
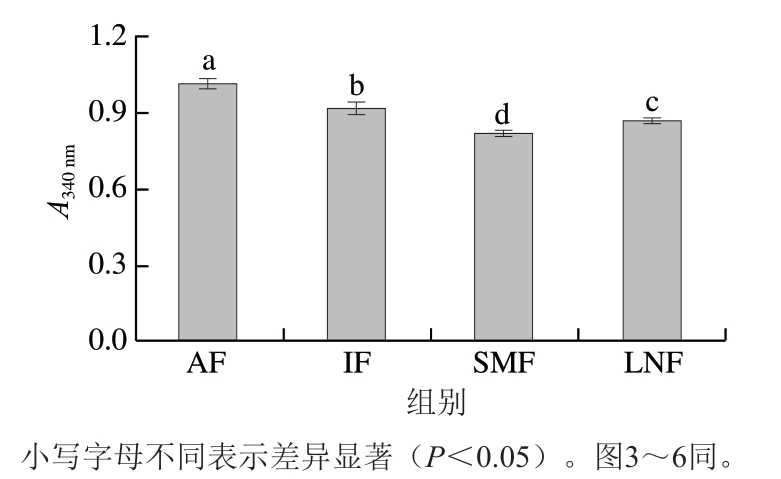
图2 不同冷冻处理小龙虾肌原纤维蛋白的浊度
Fig. 2 Turbidity of crayfish MPs with different freezing treatments
蛋白质粒径与其功能特性密切相关,蛋白质平均粒径越大,表明蛋白质不易分散,溶液稳定性降低[27]。如图3A所示,AF组肌原纤维蛋白粒径最大,这可能是因为慢速冷冻造成肌原纤维蛋白严重变性,内部基团外露发生聚集,从而形成较大粒径的蛋白聚集体[28]。相较于AF组,IF组粒径显著减小(P<0.05),随着冷冻速率的提高,肌原纤维蛋白被破坏的程度更低。在磁场处理后,肌原纤维蛋白聚集和氧化变性程度较小,粒径达到最小值,这可能是因为肌原纤维蛋白表面绝对电荷增加增强了蛋白分子间的静电排斥力,有助于减小蛋白粒径,提高溶液的稳定性[29]。
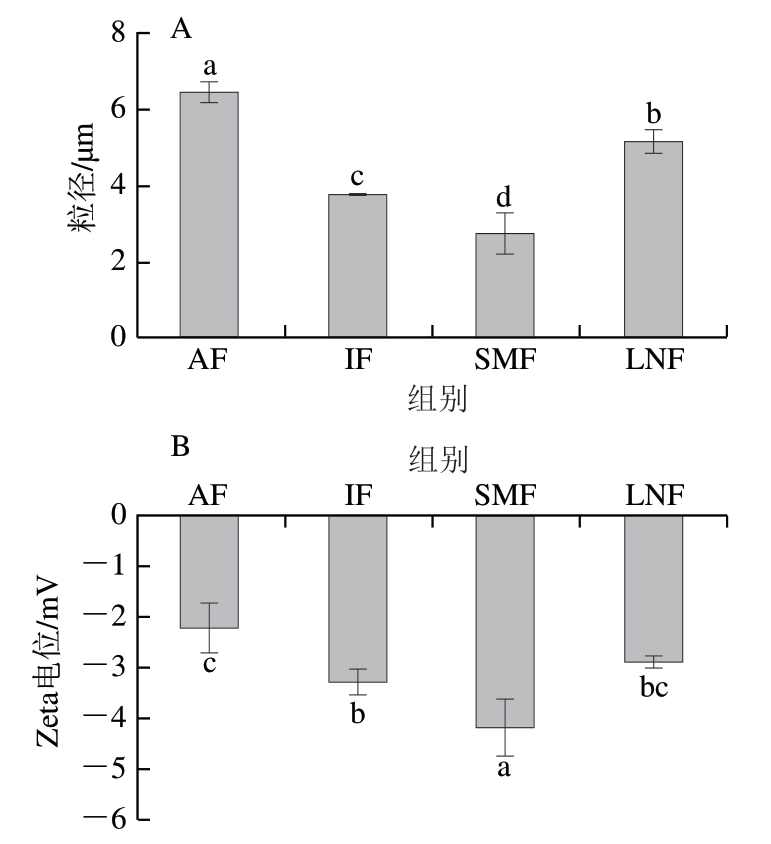
图3 不同冷冻处理小龙虾肌原纤维蛋白的粒径(A)及Zeta电位(B)
Fig. 3 Particle size (A) and zeta potential (B) of MPs from crayfish with different freezing treatments
Zeta电位反映蛋白质系统胶体的稳定性[30]。如图3B所示,经磁场处理后肌原纤维蛋白溶液的Zeta电位绝对值显著高于其他处理组(P<0.05),说明蛋白颗粒表面所带电荷越多,蛋白分子之间的静电斥力增强,溶液中蛋白体系越稳定,有利于维持蛋白整体构象。AF组由于冻结速率过慢而产生的大冰晶对蛋白结构的破坏更加严重,蛋白易聚集,因而表现出最低的Zeta电位绝对值,而LNF组与AF组、IF组之间并无显著性差异,这可能是因为液氮处理后与贮藏温度形成了较大温差,此时虾肉表面温度迅速上升,与中心温度形成温度阶梯,虾肉内外膨胀和收缩速率不一致,造成细肌丝断裂,更严重破坏了肌肉纤维,促进肌原纤维蛋白的聚集并降低表面的相同电荷数,因而Zeta电位绝对值较低[31]且表现出与AF组、IF组相似的Zeta电位值。
总巯基含量包含活性巯基与非活性巯基,能反映蛋白质氧化程度[32]。如图4所示,SMF组总巯基含量为4.04 μmol/g,显著高于其他各组(P<0.05),这可能是因为磁场能有效缩短冷冻时间并形成较小的冰晶,对肌肉组织细胞及蛋白质结构的损害较小,抑制氧化酶的释放和活性氧的形成,通过减缓巯基氧化速率降低肌原纤维蛋白的氧化程度[33]。而AF组总巯基含量最低,这是因为慢速冷冻产生的不规则大冰晶对肌原纤维蛋白造成更大的物理损伤,空间结构因此发生改变,巯基氧化导致形成二硫键等。
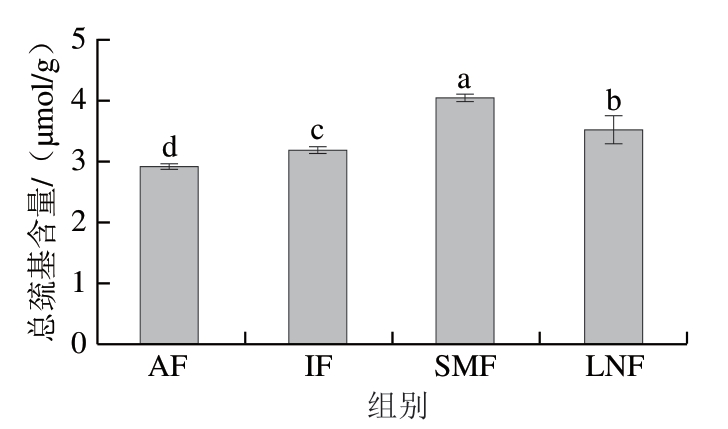
图4 不同冷冻处理小龙虾肌原纤维蛋白的总巯基含量
Fig. 4 Total sulfhydryl content of crayfish MPs with different freezing treatments
如图5A所示,1 600~1 700 cm-1范围内的谱带为酰胺I带,能够反映蛋白质二级结构的相对含量。蛋白质二级结构包含β-折叠(1 600~1 639 cm-1)、无规卷曲(1 640~1 650 cm-1)、α-螺旋(1 651~1 660 cm-1)及β-转角(1 661~1 700 cm-1)。其中,α-螺旋表现为多肽链的—CO和—NH间形成的链内氢键,能够反映蛋白质二级结构的稳定性[34]。如图5B所示,与AF组相比,其他各处理组α-螺旋相对含量显著提高(P<0.05),其中SMF组α-螺旋相对含量最高,为26.58%,这说明磁场处理能够减少冷冻过程中肌原纤维蛋白受到的物理损伤,更好地维持蛋白二级结构的稳定。无规卷曲和β-转角反映蛋白质构象的松散性,而AF组的β-转角和无规卷曲相对含量显著高于其他各组,说明AF后小龙虾肌原纤维蛋白结构变得更加松散且不稳定,易发生聚集。与IF组相比,SMF组β-折叠相对含量显著降低(P<0.05),说明磁场处理能够抑制α-螺旋展开,维持肽链内部氢键的稳定[35],从而抑制α-螺旋结构的解体和转变为β-折叠结构,增强蛋白分子间静电斥力,这与Zeta电位研究结果相似。以上结果表明,快速冷冻能够更好保持肌原纤维蛋白的空间排列,维持肌原纤维蛋白结构的稳定性,磁场处理则进一步减少了肌原纤维蛋白的损伤及二级结构的变化。
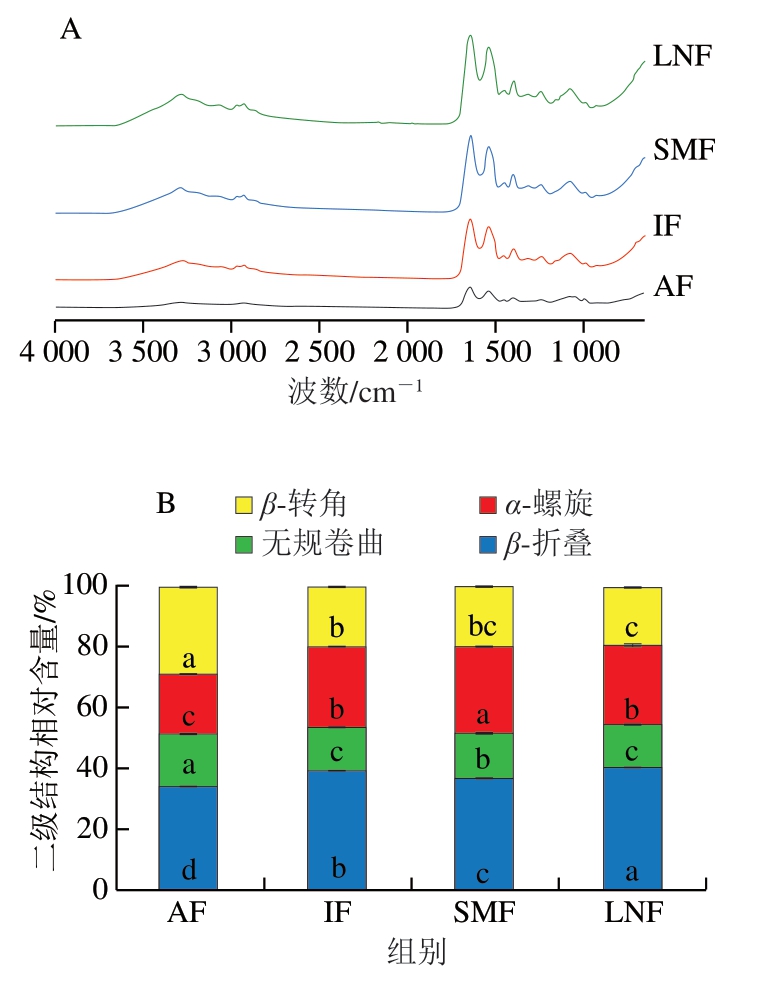
图5 不同冷冻处理小龙虾肌原纤维蛋白的红外光谱(A)和二级结构相对含量(B)
Fig. 5 Infrared spectra (A) and relative contents (B) of secondary structures of crayfish MPs with different freezing treatments
BPB可通过疏水位点与蛋白质分子内部暴露出的疏水基团结合,因此可通过BPB结合量判断蛋白质变性程度[36]。如图6A所示,在4 个处理组中,AF组BPB结合量最高,为118.49 μg,显著高于IF组与SMF组(P<0.05),这说明IF及SMF处理均能有效降低小龙虾肌原纤维蛋白的表面疏水性。与IF组相比,SMF组的表面疏水性显著降低(P<0.05),说明磁场处理能够减少肌原纤维蛋白中疏水性基团的暴露,更好地维持肌原纤维蛋白的结构,这可能是因为磁场处理导致水和肌原纤维蛋白分子的重新定向和有序排列[37]。LNF组并没有表现出较低的表面疏水性,这可能是因为小龙虾肉过于饱满,在低温冷冻过程中由于外壳被快速冷冻,内部肌肉冷冻缺乏膨胀空间而相互挤压,最终造成肌肉纤维严重变形以至断裂,蛋白质空间结构发生改变,内部的疏水基团暴露,导致蛋白表面疏水性增加[38]。
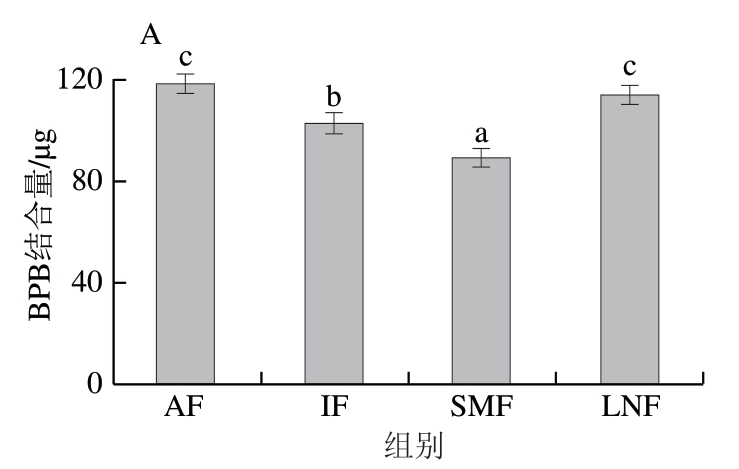
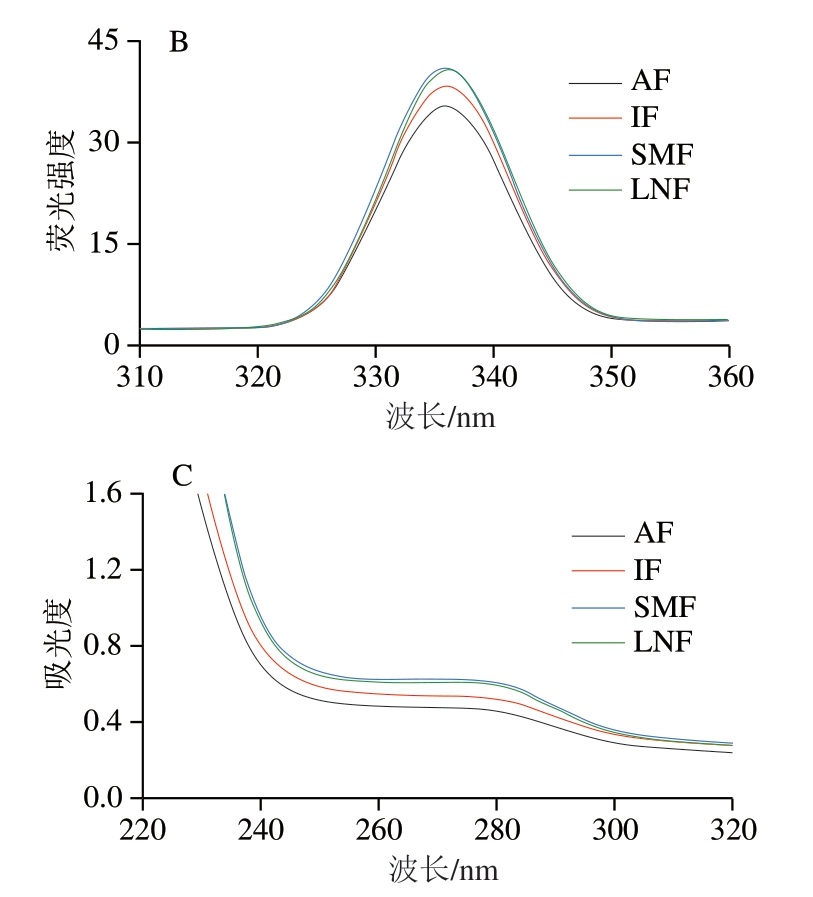
图6 不同冷冻处理小龙虾肌原纤维蛋白的BPB结合量(A)、荧光光谱(B)和紫外吸收光谱(C)
Fig. 6 BPB binding capacity (A), fluorescence spectra (B) and UV (C)spectra of MPs from crayfish with different freezing treatments
荧光强度主要来自芳香族氨基酸(主要是色氨酸)残基侧链基团所发射出的荧光,通过测定色氨酸残基的内源荧光图谱能够有效反映肌原纤维蛋白三级结构的变化[39]。由图6B可知,AF组荧光强度最低,说明缓慢冷冻形成的大而不规则的冰晶破坏了蛋白质三级结构,导致色氨酸向蛋白质分子外侧极性环境移动,荧光强度降低。而SMF与LNF组荧光强度明显高于其他2 组,说明磁场和液氮处理能够抑制肌原纤维蛋白空间结构的展开,这可能是因为SMF及LNF均有助于形成较小的冰晶,从而减轻蛋白质三级结构受到的物理损伤,减少疏水基团的暴露,进而提高蛋白质三级结构稳定性[40]。
芳香族氨基酸残基侧链基团能够吸收紫外光产生相应谱图[41]。如图6C所示,在275 nm附近不同处理组均出现特征峰,说明不同冷冻方式并未改变酪氨酸的微环境。SMF与LNF组的吸收强度差异并不显著,AF及IF组紫外吸收强度均有所下降,这可能是因为其蛋白质结构不稳定,易发生聚集,从而包裹暴露在外的显色氨基酸基团,促使紫外吸收强度降低[42]。而磁场处理则能维持蛋白质的空间结构,提升蛋白质的稳定性,减少聚集的发生,这与红外光谱结果相似。
综合蛋白质表面疏水性、荧光光谱及紫外光谱可知,磁场处理能够更好地维持冷冻过程中肌原纤维蛋白的三级结构。
最大转变温度(Tmax)和变性焓(ΔH)是评价蛋白质热稳定性的重要指标。Tmax和ΔH的值越高,蛋白质的热稳定性越好[43]。Tmax1、ΔH1以及Tmax2、ΔH2分别为肌球蛋白和肌动蛋白的Tmax和ΔH。如表1所示,经SMF处理后冷冻样品的Tmax1和Tmax2分别为47.20、66.99 ℃,显著高于其他处理组,说明磁场处理可以显著提高肌球蛋白和肌动蛋白的热转变温度(P<0.05)。IF和SMF组的ΔH1和ΔH2相较于AF组均显著提升(P<0.05),这表明IF和SMF的小龙虾肌原纤维蛋白变性需要的能量更多。相较于IF,SMF处理后小龙虾肌球蛋白具有更高的ΔH,这说明磁场处理有利于维持蛋白质的空间结构,提升冻结过程中肌原纤维蛋白的热稳定性。这可能是因为磁场处理会使分子内氢键受到影响,水团破碎,自由水簇减小,增加非冻结合水含量[44]。
表1 不同冷冻处理小龙虾肌球蛋白和肌动蛋白的最大转变温度(Tmax)和变性焓(ΔH)
Table 1 Maximum transition temperature (Tmax) and enthalpy of denaturation (ΔH) of myosin and actin in crayfish with different freezing treatments
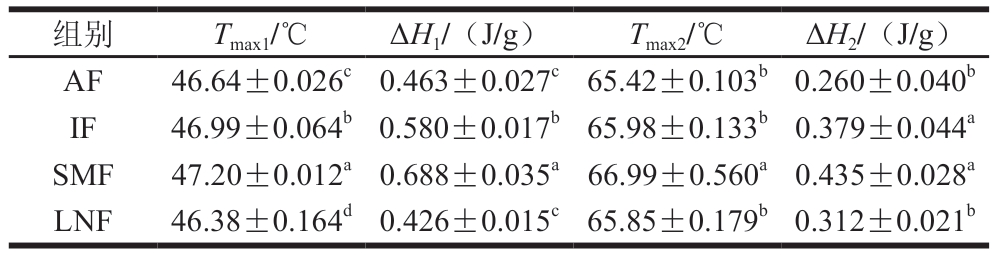
注:同列小写字母不同表示差异显著(P<0.05)。
组别Tmax1/℃ΔH1/(J/g)Tmax2/℃ΔH2/(J/g)AF46.64±0.026c0.463±0.027c65.42±0.103b0.260±0.040b IF46.99±0.064b0.580±0.017b65.98±0.133b0.379±0.044a SMF47.20±0.012a0.688±0.035a66.99±0.560a0.435±0.028a LNF46.38±0.164d0.426±0.015c65.85±0.179b0.312±0.021b
如图7所示,小龙虾肌原纤维蛋白主要以肌球蛋白重链(约245 kDa)、肌动蛋白(约48 kDa)及肌球蛋白轻链(约20 kDa)为主要条带。不同处理组肌原纤维蛋白条带种类基本一致,说明肌原纤维蛋白的一级结构和共价键没有被破坏[45],本研究中不同冷冻处理并不会改变样品中蛋白的种类。从蛋白条带强度上看,肌动蛋白及肌球蛋白轻链并无明显区别,说明不同冷冻处理对小龙虾肌原纤维蛋白的影响主要体现在对肌球蛋白重链的影响。而经SMF处理的样品肌球蛋白重链强度明显增强,由于蛋白质总量一定,说明磁场处理能够有效防止冷冻过程中降解或聚集。而蛋白质氧化会造成肌原纤维蛋白的降解[46],这与总巯基含量的研究结果一致。
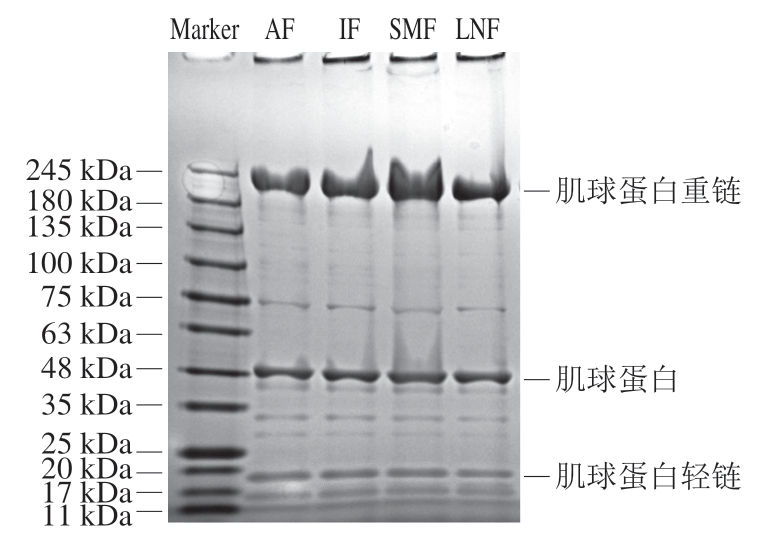
图7 不同冷冻处理小龙虾肌原纤维蛋白的SDS-PAGE图谱
Fig. 7 SDS-PAGE profiles of MPs from crayfish with different freezing treatments
研究冷冻方式对小龙虾蛋白性质与结构的影响,发现SMF能够减少冷冻过程中蛋白结构的破坏,维持蛋白性质和结构的稳定性。相较于AF与LNF,IF能够显著减小肌原纤维蛋白粒径(P<0.05),降低蛋白分子的表面疏水性,增强分子间的静电斥力,抑制蛋白分子聚集。与IF相比,SMF处理后肌原纤维蛋白浊度显著下降(P<0.05),且具有最高的总巯基含量,说明SMF能够减少冷冻过程中蛋白损伤,抑制其氧化、变性和聚集。另外,红外光谱、荧光光谱及紫外吸收光谱结果表明,SMF处理能够抑制α-螺旋的展开和蛋白内部基团的暴露,维持良好的蛋白质二、三级结构。差示扫描量热分析和SDS-PAGE结果也表明,相较于其他3 种冷冻方式,SMF能够抑制肌球蛋白的降解,维持其良好的热稳定性,更有利于保持冷冻过程中蛋白质空间结构的完整性。
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023: 25-26.
[2] 吴明, 黄晓红, 杨勇, 等. 肉类低温保鲜技术研究进展[J]. 肉类研究,2021, 35(5): 60-69.DOI:10.7506/rlyj1001-8123-20210203-029.
[3] 朱士臣, 陈小草, 柯志刚, 等. 低温等离子体技术及其在水产品加工中的应用[J]. 中国食品学报, 2021, 21(10): 305-314.DOI:10.16429/j.1009-7848.2021.10.033.
[4] 袁琳娜, 李洪军, 王兆明, 等. 新型冷冻和解冻技术在肉类食品中的应用研究进展[J]. 食品与发酵工业, 2019, 45(2): 220-227.DOI:10.13995/j.cnki.11-1802/ts.017211.
[5] LUCAS T, RAOULT-WACK A L. Immersion chilling and freezing in aqueous refrigerating media: review and future trends[J]. International Journal of Refrigeration, 1998, 21(6): 419-429.DOI:10.1016/S0140-7007(98)00014-0.
[6] HOU Q, CHENG Y P, KANG D C, et al. Quality changes of pork during frozen storage: comparison of immersion solution freezing and air blast freezing[J]. International Journal of Food Science and Technology, 2020, 55(1): 109-118.DOI:10.1111/ijfs.14257.
[7] 薛长湖, 李兆杰. 我国水产品加工和流通产业科技现状与发展趋势[J]. 水产学报, 2023, 47(11): 215-224.DOI:10.11964/jfc.20231014197.
[8] KÖPRÜALAN AYDIN Ö, YÜKSEL SARIOĞLU H, DIRIM S N,et al. Recent advances for rapid freezing and thawing methods of foods[J]. Food Engineering Reviews, 2023, 15(4): 667-690.DOI:10.1007/s12393-023-09356-0.
[9] WU X F, ZHANG M, ADHIKARI B, et al. Recent developments in novel freezing and thawing technologies applied to foods[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(17): 3620-3631.DOI:10.1080/10408398.2015.1132670.
[10] MIÑANO H L A, SILVA A C DE S, SOUTO S, et al. Magnetic fields in food processing perspectives, applications and action models[J].Processes, 2020, 8(7): 814.DOI:10.3390/pr8070814.
[11] OTERO L, RODRÍGUEZ A C, PÉREZ-MATEOS M, et al. Effects of magnetic fields on freezing: application to biological products:magnetic freezing of biological products[J]. Comprehensive Reviews in Food Science and Food Safety, 2016, 15(3): 646-667.DOI:10.1111/1541-4337.12202.
[12] LI W, MA H L, HE R H, et al. Prospects and application of ultrasound and magnetic fields in the fermentation of rare edible fungi[J]. Ultrasonics Sonochemistry, 2021, 76: 105613.DOI:10.1016/j.ultsonch.2021.105613.
[13] PANG X F, DENG B. The changes of macroscopic features and microscopic structures of water under influence of magnetic field[J].Physica B: Condensed Matter, 2008, 403(19/20): 3571-3577.DOI:10.1016/j.physb.2008.05.032.
[14] MOK J H, CHOI W, PARK S H, et al. Emerging pulsed electric field(PEF) and static magnetic field (SMF) combination technology for food freezing[J]. International Journal of Refrigeration, 2015, 50: 137-145.DOI:10.1016/j.ijrefrig.2014.10.025.
[15] TANG J Y, SHAO S Q, TIAN C Q. Effects of the magnetic field on the freezing parameters of the pork[J]. International Journal of Refrigeration, 2019, 107: 31-38.DOI:10.1016/j.ijrefrig.2019.07.019.
[16] LENG D M, ZHANG H N, TIAN C Q, et al. The effect of magnetic field on the quality of channel catfish under two different freezing temperatures[J]. International Journal of Refrigeration, 2022, 140: 49-56.DOI:10.1016/j.ijrefrig.2022.05.008.
[17] LIN H X, ZHAO S S, HAN X H, et al. Effect of static magnetic field extended supercooling preservation on beef quality[J]. Food Chemistry, 2022, 370: 131264.DOI:10.1016/j.foodchem.2021.131264.
[18] YANG B, YANG L, XU R H, et al. Effects of static magnetic field(SMF) and alternating magnetic field (AMF) assisted freezing on the microstructure and protein properties of channel catfish (Ictalurus punctatus) fillet[J]. Food Chemistry, 2024, 434: 137509.DOI:10.1016/j.foodchem.2023.137509.
[19] 桑燕菲, 杨立, 钱鑫萍, 等. 小龙虾冻藏期间的品质变化[J].现代食品科技, 2022, 39(2): 243-252.DOI:10.13982/j.mfst.1673-9078.2023.2.0329.
[20] 严红波, 沈春蕾, 张宾, 等. 南美白对虾肉糜冻藏过程中蛋白质功能特性变化[J]. 食品与发酵工业, 2020, 46(24): 37-42; 57.DOI:10.13995/j.cnki.11-1802/ts.024776.
[21] LIU R, LIU Q, XIONG S B, et al. Effects of high intensity unltrasound on structural and physicochemical properties of myosin from silver carp[J]. Ultrasonics Sonochemistry, 2016, 37: 150-157.DOI:10.1016/j.ultsonch.2016.12.039.
[22] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683.DOI:10.1016/j.meatsci.2006.05.019.
[23] LI F F, DU X, REN Y, et al. Impact of ice structuring protein on myofibrillar protein aggregation behaviour and structural property of quick-frozen patty during frozen storage[J]. International Journal of Biological Macromolecules, 2021, 178: 136-142.DOI:10.1016/j.ijbiomac.2021.02.158.
[24] 江杨阳. 小龙虾低温贮藏品质变化规律及其腐败菌鉴定[D]. 杭州:浙江大学, 2019: 15-16.
[25] 白银, 高悦, 王中江, 等. 射流空化对大豆分离蛋白的理化性质及结构的影响[J]. 食品科学, 2020, 41(7): 110-116.DOI:10.7506/spkx1002-6630-20190304-028.
[26] 高赛, 杨欣宇, 刘寅初, 等. 低温保鲜对水产品蛋白质品质的影响及其调控技术研究进展[J]. 食品研究与开发, 2023, 44(2): 212-217.DOI:10.12161/j.issn.1005-6521.2023.02.031.
[27] 陆今明, 彭松林, 杨凯麟, 等. 超声波辅助pH偏移处理对猪肝蛋白结构及乳化特性的影响[J]. 食品研究与开发, 2023, 44(5): 89-96.DOI:10.12161/j.issn.1005-6521.2023.05.014.
[28] 张亚瑾, 焦阳. 冷冻和解冻技术在水产品中的应用研究进展[J].食品与机械, 2021, 37(1): 215-221; 236.DOI:10.13652/j.issn.1003-5788.2021.01.036.
[29] 徐永霞, 赫雪丽, 尹一鸣, 等. 酵母β-葡聚糖与肌球蛋白互作及对蛋白质风味吸附特性的影响[J]. 中国食品学报, 2022, 22(10): 108-115.DOI:10.16429/j.1009-7848.2022.10.012.
[30] BELICIU C M, MORARU C I. The effect of protein concentration and heat treatment temperature on micellar casein-soy protein mixtures[J].Food Hydrocolloids, 2011, 25(6): 1448-1460.DOI:10.1016/j.foodhyd.2011.01.011.
[31] ZHANG Z Y, REGENSTEIN J M, ZHOU P, et al. Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel[J]. Ultrasonics Sonochemistry, 2017,34: 960-967.DOI:10.1016/j.ultsonch.2016.08.008.
[32] 杨玉玲, 周磊, 游远, 等. 氧化对肌原纤维蛋白热诱导凝胶质构特性及保水性的影响[J]. 中国农业科学, 2018, 51(18): 3570-3581.DOI:10.3864/j.issn.0578-1752.2018.18.013.
[33] LU N, MA J, SUN D W. Enhancing physical and chemical quality attributes of frozen meat and meat products: mechanisms, techniques and applications[J]. Trends in Food Science and Technology, 2022,124: 63-85.DOI:10.1016/j.tifs.2022.04.004.
[34] THANONKAEW A, BENJAKUL S, VISESSANGUAN W. The effect of metal ions on lipid oxidation, colour and physicochemical properties of cuttlefish (Sepia pharaonis) subjected to multiple freezethaw cycles[J]. Food Chemistry, 2006, 95(4): 591-599.DOI:10.1016/j.foodchem.2005.01.040.
[35] EMAMDADI N, GHOLIZADEH M, HOUSAINDOKHT M R.Investigation of static magnetic field effect on horseradish peroxidase enzyme activity and stability in enzymatic oxidation process[J].International Journal of Biological Macromolecules, 2021, 170: 189-195.DOI:10.1016/j.ijbiomac.2020.12.034.
[36] 李彩璐, 沈建, 欧阳杰, 等. 鲜活小龙虾超高压剥壳预处理工艺比较及其对虾仁品质的影响[J]. 渔业现代化, 2023, 50(3): 104-112.DOI:10.3969/j.issn.1007-9580.2023.03.013.
[37] ZHOU H L, JIN Y M, HONG T T, et al. Effect of static magnetic field on the quality of frozen bread dough[J]. LWT-Food Science and Technology, 2022, 154: 112670.DOI:10.1016/j.lwt.2021.112670.
[38] SOYER A, ÖZALP B, DALMIŞ Ü, et al. Effects of freezing temperature and duration of frozen storage on lipid and protein oxidation in chicken meat[J]. Food Chemistry, 2010, 120(4): 1025-1030.DOI:10.1016/j.foodchem.2009.11.042.
[39] 王守业, 徐小龙, 刘清亮, 等. 荧光光谱在蛋白质分子构象研究中的应用[J]. 化学进展, 2001, 13(4): 257.DOI:10.3321/j.issn:1005-281X.2001.04.003.
[40] 丛海花, 逯晓燕, 周倩, 等. 褐藻寡糖结合低磁场冷冻对鲢肌原纤维蛋白结构和性质的影响[J]. 南方水产科学, 2023, 19(3): 110-118.DOI:10.12131/20220245.
[41] 汪少芸, 李晓贞, 陈旭, 等. 鱼源抗冻多肽对鱼糜肌原纤维蛋白的冻融保护作用[J]. 广东海洋大学学报, 2023, 43(1): 78-86.DOI:10.3969/j.issn.1673-9159.2023.01.010.
[42] LÜ M W, WANG X K, WALAYAT N, et al. Role of ovalbumin/β-cyclodextrin in improving structural and gelling properties of Culter alburnus myofibrillar proteins during frozen storage[J]. Applied Sciences, 2021, 11(24): 11815.DOI:10.3390/app112411815.
[43] CAO M J, CAO A L, WANG J, et al. Effect of magnetic nanoparticles plus microwave or far-infrared thawing on protein conformation changes and moisture migration of red seabream (Pagrus major)fillets[J]. Food Chemistry, 2018, 266: 498-550.DOI:10.1016/j.foodchem.2018.06.057.
[44] KAUR M, KUMAR M. An innovation in magnetic field assisted freezing of perishable fruits and vegetables: a review[J]. Food Reviews International, 2020, 36(8): 761-780.DOI:10.1080/87559129.2019.1683746.
[45] ZHANG Z Y, YANG Y L, ZHOU P, et al. Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J]. Food Chemistry, 2017, 217: 678-686.DOI:10.1016/j.foodchem.2016.09.040.
[46] 赵亚南, 张牧焓, 王道营, 等. 氯化钠对鸡肉冷藏过程中肌原纤维蛋白氧化的影响[J]. 肉类研究, 2020, 34(8): 1-7.DOI:10.7506/rlyj1001-8123-20200518-126.