表1 干腌腊肉发酵工艺参数
Table 1 Fermentation parameters for dry-cured bacon
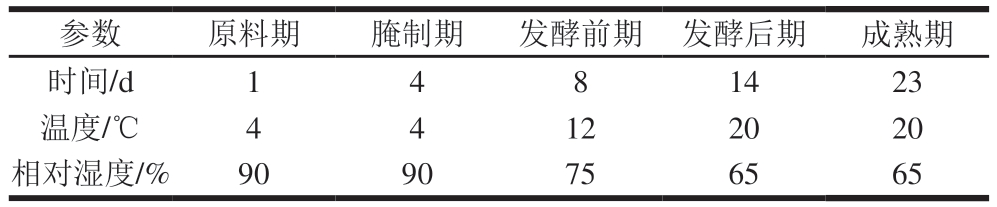
参数原料期腌制期发酵前期发酵后期成熟期时间/d1481423温度/℃44122020相对湿度/%9090756565
HS-SPME-GC × GC-TOFMS Analysis of Volatile Flavor Compounds in Traditional Dry-Cured Bacon during Processing
董亚云, 张迎阳, 杨天志, 等. 基于HS-SPME-GC × GC-TOFMS技术分析传统干腌腊肉加工过程中的挥发性有机物[J].肉类研究, 2024, 38(3): 30-38.DOI:10.7506/rlyj1001-8123-20240318-056. http://www.rlyj.net.cn
DONG Yayun, ZHANG Yingyang, YANG Tianzhi, et al. HS-SPME-GC × GC-TOFMS analysis of volatile flavor compounds in traditional dry-cured bacon during processing[J]. Meat Research, 2024, 38(3): 30-38. (in Chinese with English abstract)DOI:10.7506/rlyj1001-8123-20240318-056. http://www.rlyj.net.cn
干腌腊肉是我国传统特色肉制品之一,以其特有的色、香、味而深受广大消费者的喜爱[1]。随着现代生活节奏的加快和食品加工技术的进步,腌制腊肉的制作工艺也在不断创新和改进,以适应更广泛消费者的口味和健康需求。尽管如此,传统的腌制技术仍然被许多生产者和家庭珍视。作为连接过去和现在的文化纽带,传统干腌腊肉不仅是一种美食,更是中国丰富食文化和地方传统的重要体现。
干腌腊肉加工涉及腌制、发酵和风干成熟等关键环节,腌制过程中盐分的渗透为肉品内部的物理和化学性质变化奠定了基础。发酵过程进一步促进了肉品中水分的蒸发,且蛋白质和脂肪不断变化增强了肉品的质地和风味物质浓度,成熟阶段肉品中的蛋白质和脂肪进一步分解,形成具有特定风味的小分子化合物[2]。每一个加工环节都对肉品的物理和化学特性产生影响,从而在加工过程中引起颜色、风味、质地等多方面的变化,这些变化不仅影响肉制品的外观,而且是品质变化和风味形成的关键[3]。风味是食品重要的感官特征,仪器分析方法不断改进,以更全面、更精确地识别挥发物[4]。目前,挥发性物质的研究主要采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术、GC-嗅闻联用技术、电子鼻技术等,这些方法检测食品中挥发性化合物的风味特征普遍应用于肉类、水果和酒[5]。宋永等[6]利用GC-MS检测哈尔滨风干肠时发现其关键风味化合物是己酸乙酯、乙醇、己醛和丁酸乙酯。付浩华等[7]利用GC-MS技术研究腊肉风味物质,结果表明,腊肉中主要风味物质为酮类、醛类、醇类和酯类。毛永强等[8]通过固相微萃取-GC-MS技术对传统陇西腊肉制作过程中的挥发性风味物质进行检测分析,并结合相对气味活度值(relative odor activity value,ROAV)探讨腊肉制作过程中的关键风味物质,结果显示,醛类、酮类、酯类物质对风味贡献最大,己酸乙酯、茴香醚、己醛、3-甲基丁醛、(E)-2-辛烯醛和芳樟醇为主要风味贡献物质。
传统一维GC靠一根分析柱分离样本中的挥发性化合物,分离度和分析时间与柱长密切相关,对于一些痕量化合物难以达到较低检测下限,复杂化合物也很难进一步分离,使用一维GC分析食品挥发性组分时容易出现化合物共馏出现象,具有分辨率低、灵敏度低和峰容量低等缺点[9]。全二维GC平台是在传统一维GC基础上发展起来的一种快速检测挥发性物质的先进技术,由2 根极性不同的色谱柱(1D色谱柱和2D色谱柱)串联而成,中间部分为调制器。由于样品中化合物间范德华力的差异,1D色谱柱可用于分离不同沸点的复杂化合物,未完全分离的化合物(总馏出物)被调制器富集并以窄周期脉冲的形式释放到2D色谱柱中,从而显著提高GC分离度和峰容量,非常有利于较低浓度化合物的检出[10]。
本实验研究传统干腌腊肉加工过程中理化性质变化,并利用顶空固相微萃取结合全二维GC-飞行时间质谱(headspace solid-phase microextraction combinedcomprehensive two dimensional GC-time of flight mass spectrometry,HS-SPME-GC×GC-TOFMS)技术研究干腌腊肉加工过程中风味物质变化,对不同加工阶段干腌腊肉中挥发性物质进行深入评估,以揭示干腌腊肉加工过程中的关键风味物质,为了解和优化传统腊肉生产工艺提供一定科学依据。
猪后腿肉 正大食品(徐州)有限公司。
正己烷(色谱纯) 永华公司;氘代正己醇-D13(纯度98.5%) 加拿大C/D/N Isotopes公司;正构烷烃(1 000 mg/L) 美国Sigma公司;乙醇、氢氧化钠、盐酸(均为分析纯) 上海国药集团化学试剂有限公司。
HWS-150恒温恒湿培养箱 绍兴市苏珀仪器有限公司;Reglus-8100场发射扫描电子显微镜(scanning electron microscope,SEM) 日本日立公司;AVANCE III 400M核磁共振波谱仪 瑞士布鲁克公司;涂有二乙烯基苯/羧烯/聚二甲基硅氧烷的SPME萃取头美国Supelco公司;8890A气相色谱仪 美国Agilent公司;Pegasus BT 4D质谱仪 美国LECO公司。
GC×GC-TOFMS色谱系统由Agilent 8890A气相色谱仪、双级喷射调制器和分流/不分流进样模块组成,质谱系统为高分辨TOF质谱检测仪,分离系统包括DB-Heavy Wax一维色谱柱(30 m×250 μm,0.5 μm,美国Agilent公司)和Rxi-5Sil MS二维色谱柱(2 m×150 μm,0.15 μm,美国Restek公司)。
1.3.1 干腌腊肉样品制备
将新鲜猪肉修整成形状、大小相同的肉块,在加工过程中按照表1的发酵工艺参数进行加工,食盐添加量为4%(以猪肉质量计)。以原料期(0 d)、腌制期(1~5 d)、发酵前期(5~13 d)、发酵后期(13~27 d)及成熟期(27~50 d)5 个加工阶段的腊肉为研究对象,每个加工阶段结束时随机选取3 块样品,相同部位取样后于-20 ℃保存备用。
表1 干腌腊肉发酵工艺参数
Table 1 Fermentation parameters for dry-cured bacon

参数原料期腌制期发酵前期发酵后期成熟期时间/d1481423温度/℃44122020相对湿度/%9090756565
1.3.2 干腌腊肉水分含量测定
参照GB/T 9695.15—2008《肉与肉制品 水分含量测定》[11]。
1.3.3 干腌腊肉水分迁移测定
参考Zou Yunhe等[12]的方法,并适当修改,采用低场核磁共振测定横向弛豫时间(T2)。将干腌腊肉样品切成1 cm×1 cm×2 cm的块状,吸干表面水分后置于低场核磁射频线圈中心位置,由CPMG脉冲序列执行,序列参数为:主频12 MHz、采样带宽250 kHz、重复采样等待时间3 500 ms,射频延时0.8 ms、模拟增益10、数字增益3、累加次数4 次。采用Peakfit 4.12软件对采集的幅值衰减数据进行多指数拟合分析,得到T21(结合水)、T22(不易流动水)和T23(自由水)的分布。
1.3.4 干腌腊肉pH值测定
采用Liu Shixin等[13]的方法,并适当改进。准确称取10 g干腌腊肉样品于烧杯中,加入30 mL蒸馏水后以12 000 r/min匀浆60 s,测定匀浆液pH值。
1.3.5 干腌腊肉色度测定
干腌腊肉样品上随机取3 个点利用色差计测定,重复3 次,取平均值为最终测定色度值[14]。按式(1)计算总色差值(ΔE):
式中:L*为亮度值;a*为红度值;b*为黄度值。
1.3.6 干腌腊肉微观结构观察
依据Lan Weiqing等[15]的方法,采用SEM观察干腌腊肉样品的肌肉纤维。将干腌腊肉切成0.8 cm×0.8 cm×0.5 cm的块状,用体积分数2.5%戊二醛固定液将样本固定12 h,固定结束用0.1 mol/L pH 7.0的磷酸盐缓冲液漂洗样本3 次,然后用梯度乙醇溶液(体积分数分别为30%、50%、70%、80%、90%和95%)对样本进行脱水处理,时间15 min,最后用无水乙醇冲洗样本2 次,放置过夜。测定前将样品喷金60 s,镀膜进行观察。
1.3.7 挥发性有机物(volatile organic compounds,VOCs)提取与鉴定
1.3.7.1 VOCs提取
溶液配制:移取适量标准品氘代正己醇-D13,用体积分数50%乙醇溶液溶解,配制成10 mg/L单标溶液,稀释至1 mg/L,保存于4 ℃冰箱中。移取适量1 000 mg/L正构烷烃标准品,用正己烷逐级稀释,配制成1 mg/L溶液,保存于4 ℃冰箱中。
使用液氮快速冷冻干腌腊肉样品5 min,样本转移至打碎机,进行3 min打碎处理。取1 g处理后的样本置于顶空进样瓶中,并向其中加入10 μL上述配制好的单标溶液;加入内标的样品80 ℃孵育10 min。在吸附样本前需先将SPME萃取头在270 ℃预老化10 min。预老化完成后,将SPME萃取头放入孵育室,在80 ℃对样本进行40 min吸附。吸附完成后,将SPME萃取头移至GC进样口,250 ℃脱吸附5 min。完成进样后,SPME萃取头再次在270 ℃老化10 min。最后在顶空进样瓶中加入10 μL正构烷烃,进行孵育和提取进样[16]。
1.3.7.2 GC-MS检测
高纯氦气作为载气,恒定流速为1.0 mL/min。DB-Heavy Wax一维色谱柱:初始温度为50 ℃,保持2 min;以4 ℃/min升至220 ℃,保持13 min。Rxi-5Sil MS二维色谱柱的升温程序比一维色谱柱高5 ℃,调制器温度始终高于二维色谱柱柱温15 ℃,调制周期为5.0 s;进样口温度为250 ℃。MS条件:传输线温度250 ℃,离子源温度250 ℃,采集速率200 spectra/s,70 eV电子电离源,检测器电压2 020 V,质谱扫描范围m/z 35~550[17]。
定性分析:利用NIST20数据库,使用ChromaTOF软件进行数据分析后得到各样本物质名称、保留时间、数据库保留指数(retention index,RI)及样本峰面积等信息[18]。
定量分析:对峰面积进行总峰面积归一化,比较样品测定结果[19]。
采用ROAV评价VOCs风味贡献值[20],计算公式如式(2)所示:
式中:Ci为每种VOC的相对含量/%;Ti为每种VOC相应的感官阈值/(μg/L);Cstan为香气阈值最低的VOC的相对含量/%;Tstan为香气阈值最低的VOC的感官阈值/(μg/L)。
实验重复测定3 次,结果以平均值±标准差表示,利用Excel 2010和Origin 2021软件进行数据处理和绘图。
由图1可知,随着加工阶段的深入,干腌腊肉各时期水分含量整体呈现持续降低的趋势。在原料期水分质量分数最高(75.31%),腌制期水分含量开始减少,腌制过程中盐会通过渗透作用进入肉组织内部,并且盐分子会在肉制品表面形成高浓度区域,此时水分子会向高浓度区域移动,导致水分子从肉内部向外部渗透[21]。在发酵阶段水分下降速率更高,这是由于盐分子继续渗透,同时此阶段温度上升,且发酵时间较长,一些水分通过蒸发的方式消失[22]。在发酵期到成熟期,温度由12 ℃升高到20 ℃,受其影响水分含量继续下降,最终在成熟期干腌腊肉中水分质量分数达到最低值40.75%。
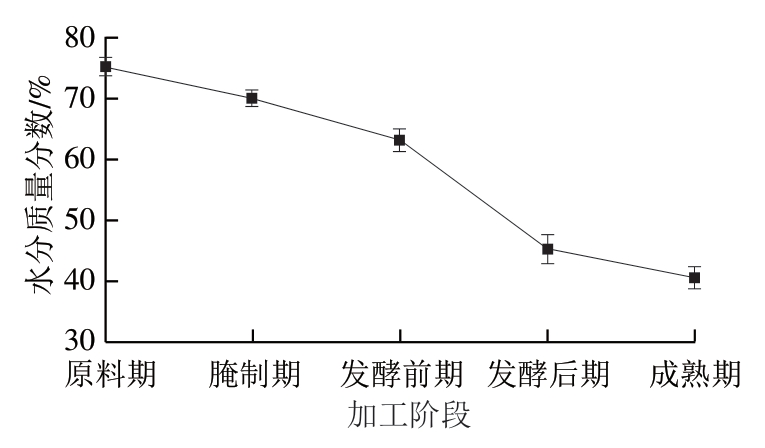
图1 干腌腊肉加工过程中水分质量分数变化
Fig. 1 Changes in moisture content during traditional dry-cured bacon processing
利用水分分布表征水分子的动态行为,干腌腊肉加工过程中不同阶段水分状态的T2图谱如图2所示,图中显示出多个峰值,根据弛豫时间从左至右依次为T21(结合水)、T22(不易流动水)和T23(自由水)[12]。驰豫曲线峰面积与氢质子含量成正比,即峰面积越大,对应水分子含量越高[23]。由图2可知,各时期干腌腊肉中水分子均主要以不易流动水形式存在。整个加工过程中T22信号值变化较大,T21和T23呈现缓慢下降趋势,说明整个干腌腊肉加工过程中以不易流动水的蒸发为主。由于结合水与肌肉蛋白表面极性基团紧密结合[24],因此T21下降可能是由于蛋白质空间构象发生变化,改变了结合水和不易流动水与蛋白质的结合能力。
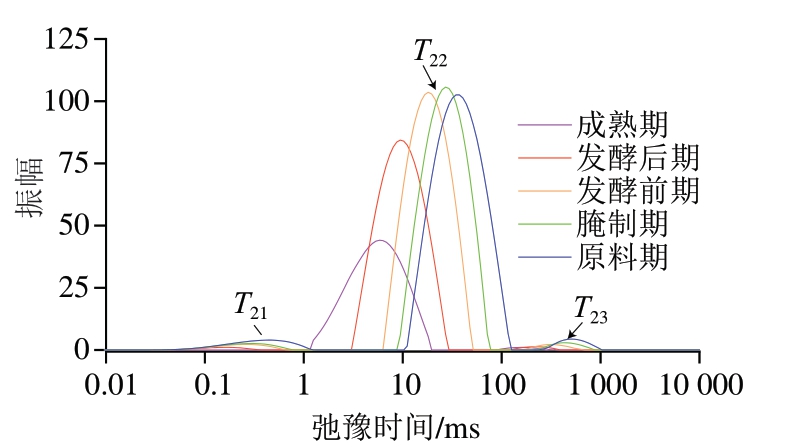
图2 干腌腊肉加工过程中水分分布变化
Fig. 2 Changes in moisture distribution during traditional dry-cured bacon processing
由图3可知,pH值从腌制期开始呈现上升趋势,最终上升到6.18。干腌腊肉腌制过程中,在蛋白酶作用下肉中的蛋白质发生水解产生碱性氨基酸和挥发性盐基氮等,导致pH值升高。Kęska等[25]研究发现,游离氨基酸在干腌腊肉中可以作为缓冲剂,将腊肉pH值维持在6.0左右。
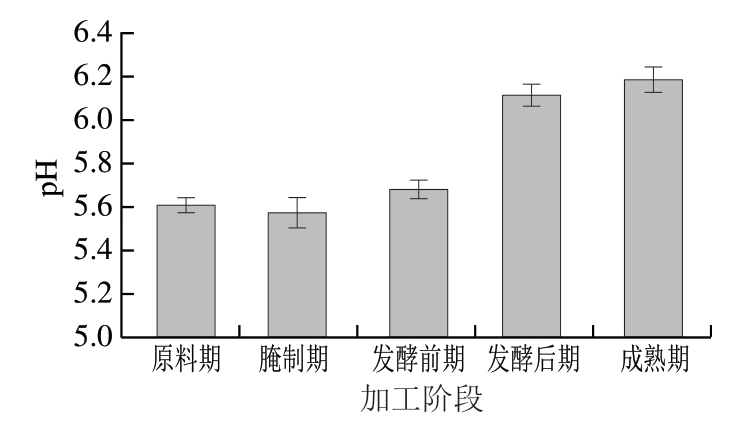
图3 干腌腊肉加工过程中pH值变化
Fig. 3 Changes in pH during the processing of dry-cured bacon
由表2可知,整个加工过程中肉样L*持续下降,从原料期的48.20±0.73下降到成熟期的30.70±0.94,表明肉样颜色持续变深。水分含量下降会导致L*下降,同时食盐分子不断渗透和脂肪氧化加剧也会导致肉样整体L*下降,使肉质颜色变深。a*变化呈先降低后升高趋势,原料期a*最高,为11.61±0.58,从原料期至发酵后期a*不断下降至6.81±0.34,而后从发酵后期至成熟期a*回升至8.38±0.81,这与伏慧慧等[26]研究干腌牛肉加工过程中的颜色变化趋势一致,a*下降与蛋白质水解和水分含量下降密切相关。肌肉在酸性环境下产生的一氧化氮与肌红蛋白发生螯合作用,形成亚硝基肌红蛋白,这一过程会使肉制品的a*逐渐增加[27]。b*前期变化幅度较小,在发酵后期至成熟期间迅速上升,在水分含量较低的环境下,脂肪与蛋白质加剧氧化和水解,脂肪氧化产物与磷脂或蛋白质中的胺发生非酶促褐变反应,从而产生黄色色素[28]。各加工阶段ΔE随时间延长呈降低趋势,在发酵前期到发酵后期这一阶段下降最明显,发酵后期和成熟期趋于平缓。
表2 不同加工阶段干腌腊肉色度变化
Table 2 Color changes of dry-cured bacon at different processing stages
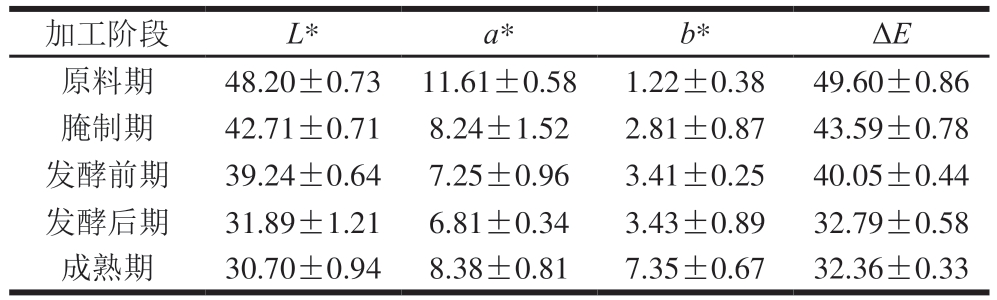
加工阶段L*a*b*ΔE原料期48.20±0.7311.61±0.581.22±0.3849.60±0.86腌制期42.71±0.718.24±1.522.81±0.8743.59±0.78发酵前期39.24±0.647.25±0.963.41±0.2540.05±0.44发酵后期31.89±1.216.81±0.343.43±0.8932.79±0.58成熟期30.70±0.948.38±0.817.35±0.6732.36±0.33
SEM可以用来揭示干腌腊肉加工过程中肌肉纤维的微观结构变化,由图4可知,在原料期,干腌腊肉的肌肉纤维结构规整、平行排列,原因可能是这一时期样品中水分含量较高,纤维之间界限明显。腌制期干腌腊肉肌肉纤维依旧排列规整;从发酵期开始至成熟期结束,肌肉纤维之间的紧密度增加,此外,随着时间延长,成熟期结束后肌肉纤维光滑度下降、边缘变得粗糙。在加工过程中肌肉纤维发生一系列生化变化,包括肌肉收缩、肌肉中蛋白质降解及蛋白质结构改变,这些变化均影响其结构特性[29]。

图4 干腌腊肉加工过程中肌肉纤维SEM图
Fig. 4 Scanning electron microscopic images of muscle fibers during the processing of dry-cured meat
干腌腊肉加工过程中各阶段总离子流色谱图中,颜色及峰高可反映离子响应强度,颜色越红,表明响应强度越高。通过二维保留时间可以看出各加工阶段的共馏物,由图5可知,从原料期到成熟期有一些挥发性风味物质始终存在。随着腌制时间的延长,色谱图中出现的峰越来越密集,表明风味离子数目随着加工阶段深入而增加;从发酵后期开始谱图上红色变多,表明风味物质的响应强度变高。
图5 各加工阶段干腌腊肉总离子流色谱图
Fig. 5 Total ion current chromatogram for each processing stage
利用PubChem数据库和NIST20数据库对下机原始数据进行风味物质注释、除杂后即得到风味物质鉴定信息。由图6a可知,原料期鉴定出的具有CAS注释的VOCs为686 种、腌制期940 种、发酵前期868 种、发酵后期822 种、成熟期949 种。各阶段VOCs重叠数Venn图中,每个颜色圈代表每个时期鉴定出的VOCs,重叠部分代表各时期共同鉴定到的VOCs,非重叠部分代表相应样本组鉴定到的特异性VOCs。由图6b可知,5 个时期鉴定到224 种共有VOCs。
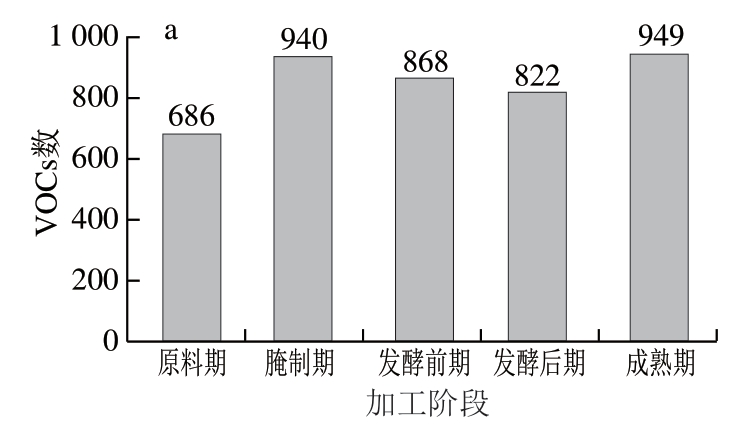
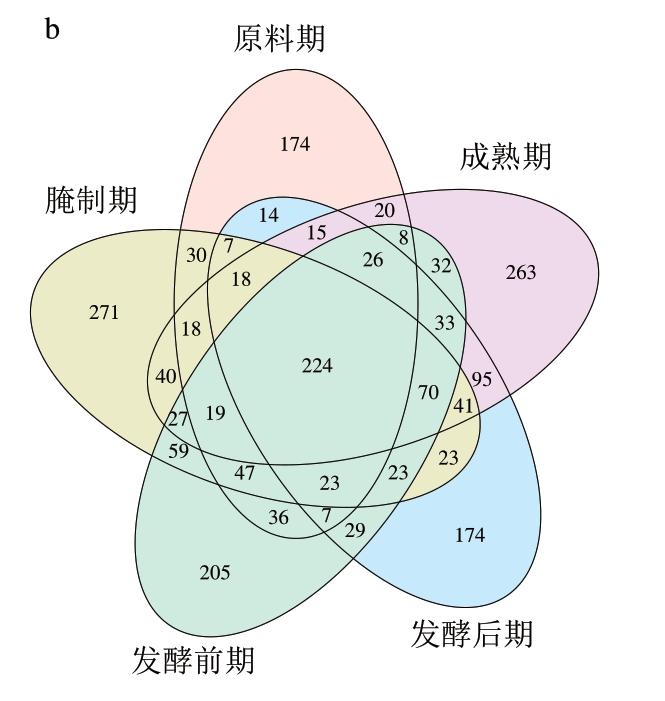
图6 干腌腊肉各加工阶段VOCs数(a)和Venn图(b)
Fig. 6 Number (a) and Venn diagram (b) of VOCs in dry-cured bacon at each processing stage
采用PubChem数据库及Classyfire软件对检测到的VOCs进行种类注释分析,并分析各种类数量和相对含量。由图7和表3可知,VOCs主要分为醇类、醛类、酯类、杂环化合物、烃类、酮类和其他。除去其他,各时期烃类物质数量最多,共908 种,其次是杂环化合物(共522 种)、酯类(366 种)、醇类(共336 种)、酮类(共332 种)和醛类(共180 种)。
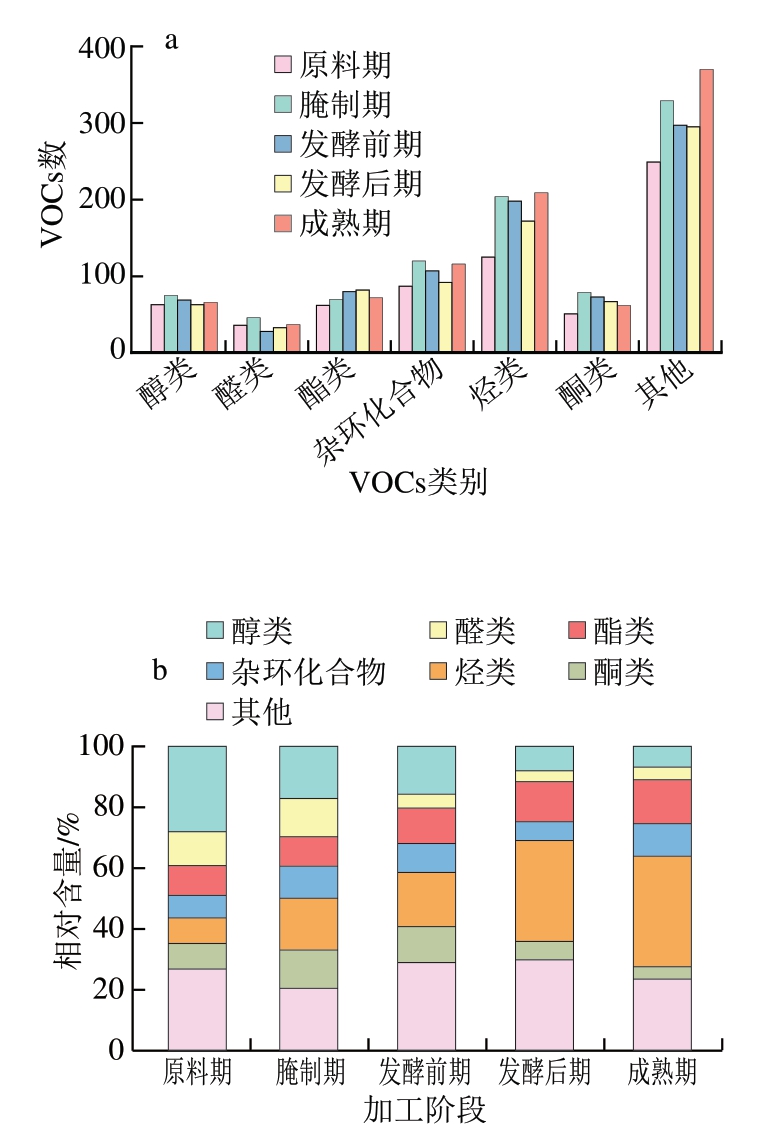
图7 干腌腊肉各加工阶段VOCs类别(a)和相对含量(b)变化
Fig. 7 Variations in the types (a) and relative contents (b) of VOCs in dry-cured bacon during processing
表3 干腌腊肉各加工阶段VOCs鉴定值
Table 3 Relative contents of volatile organic compounds in dry-cured bacon at different processing stages
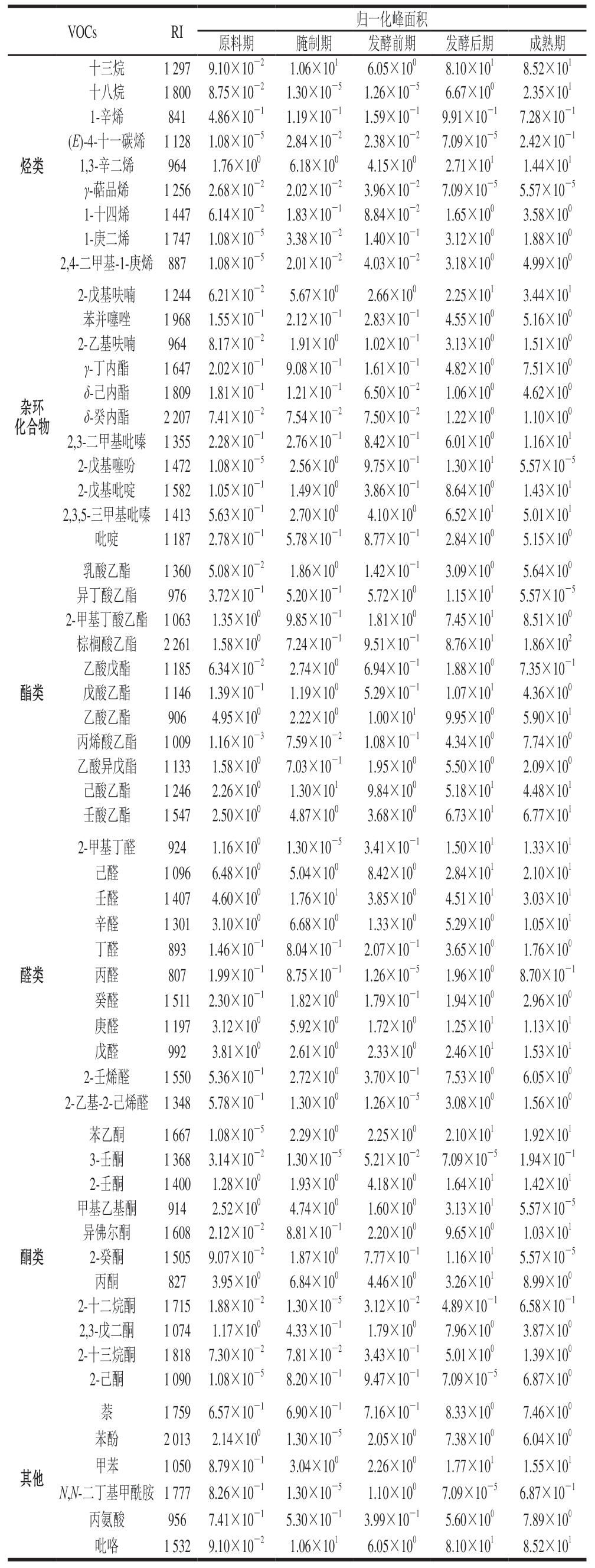
VOCsRI归一化峰面积原料期腌制期发酵前期发酵后期成熟期烃类十三烷1 2979.10×10-21.06×1016.05×1008.10×1018.52×101十八烷1 8008.75×10-21.30×10-51.26×10-56.67×1002.35×101 1-辛烯8414.86×10-11.19×10-11.59×10-19.91×10-17.28×10-1(E)-4-十一碳烯1 1281.08×10-52.84×10-22.38×10-27.09×10-52.42×10-1 1,3-辛二烯9641.76×1006.18×1004.15×1002.71×1011.44×101 γ-萜品烯1 2562.68×10-22.02×10-23.96×10-27.09×10-55.57×10-5 1-十四烯1 4476.14×10-21.83×10-18.84×10-21.65×1003.58×100 1-庚二烯1 7471.08×10-53.38×10-21.40×10-13.12×1001.88×100 2,4-二甲基-1-庚烯8871.08×10-52.01×10-24.03×10-23.18×1004.99×100杂环化合物酯类醛类2-戊基呋喃1 2446.21×10-25.67×1002.66×1002.25×1013.44×101苯并噻唑1 9681.55×10-12.12×10-12.83×10-14.55×1005.16×100 2-乙基呋喃9648.17×10-21.91×1001.02×10-13.13×1001.51×100 γ-丁内酯1 6472.02×10-19.08×10-11.61×10-14.82×1007.51×100 δ-己内酯1 8091.81×10-11.21×10-16.50×10-21.06×1004.62×100 δ-癸内酯2 2077.41×10-27.54×10-27.50×10-21.22×1001.10×100 2,3-二甲基吡嗪1 3552.28×10-12.76×10-18.42×10-16.01×1001.16×101 2-戊基噻吩1 4721.08×10-52.56×1009.75×10-11.30×1015.57×10-5 2-戊基吡啶1 5821.05×10-11.49×1003.86×10-18.64×1001.43×101 2,3,5-三甲基吡嗪1 4135.63×10-12.70×1004.10×1006.52×1015.01×101吡啶1 1872.78×10-15.78×10-18.77×10-12.84×1005.15×100乳酸乙酯1 3605.08×10-21.86×1001.42×10-13.09×1005.64×100异丁酸乙酯9763.72×10-15.20×10-15.72×1001.15×1015.57×10-5 2-甲基丁酸乙酯1 0631.35×1009.85×10-11.81×1007.45×1018.51×100棕榈酸乙酯2 2611.58×1007.24×10-19.51×10-18.76×1011.86×102乙酸戊酯1 1856.34×10-22.74×1006.94×10-11.88×1007.35×10-1戊酸乙酯1 1461.39×10-11.19×1005.29×10-11.07×1014.36×100乙酸乙酯9064.95×1002.22×1001.00×1019.95×1005.90×101丙烯酸乙酯1 0091.16×10-37.59×10-21.08×10-14.34×1007.74×100乙酸异戊酯1 1331.58×1007.03×10-11.95×1005.50×1002.09×100己酸乙酯1 2462.26×1001.30×1019.84×1005.18×1014.48×101壬酸乙酯1 5472.50×1004.87×1003.68×1006.73×1016.77×101 2-甲基丁醛9241.16×1001.30×10-53.41×10-11.50×1011.33×101己醛1 0966.48×1005.04×1008.42×1002.84×1012.10×101壬醛1 4074.60×1001.76×1013.85×1004.51×1013.03×101辛醛1 3013.10×1006.68×1001.33×1005.29×1001.05×101丁醛8931.46×10-18.04×10-12.07×10-13.65×1001.76×100丙醛8071.99×10-18.75×10-11.26×10-51.96×1008.70×10-1癸醛1 5112.30×10-11.82×1001.79×10-11.94×1002.96×100庚醛1 1973.12×1005.92×1001.72×1001.25×1011.13×101戊醛9923.81×1002.61×1002.33×1002.46×1011.53×101 2-壬烯醛1 5505.36×10-12.72×1003.70×10-17.53×1006.05×100 2-乙基-2-己烯醛1 3485.78×10-11.30×1001.26×10-53.08×1001.56×100酮类苯乙酮1 6671.08×10-52.29×1002.25×1002.10×1011.92×101 3-壬酮1 3683.14×10-21.30×10-55.21×10-27.09×10-51.94×10-1 2-壬酮1 4001.28×1001.93×1004.18×1001.64×1011.42×101甲基乙基酮9142.52×1004.74×1001.60×1003.13×1015.57×10-5异佛尔酮1 6082.12×10-28.81×10-12.20×1009.65×1001.03×101 2-癸酮1 5059.07×10-21.87×1007.77×10-11.16×1015.57×10-5丙酮8273.95×1006.84×1004.46×1003.26×1018.99×100 2-十二烷酮1 7151.88×10-21.30×10-53.12×10-24.89×10-16.58×10-1 2,3-戊二酮1 0741.17×1004.33×10-11.79×1007.96×1003.87×100 2-十三烷酮1 8187.30×10-27.81×10-23.43×10-15.01×1001.39×100 2-己酮1 0901.08×10-58.20×10-19.47×10-17.09×10-56.87×100其他萘1 7596.57×10-16.90×10-17.16×10-18.33×1007.46×100苯酚2 0132.14×1001.30×10-52.05×1007.38×1006.04×100甲苯1 0508.79×10-13.04×1002.26×1001.77×1011.55×101 N,N-二丁基甲酰胺1 7778.26×10-11.30×10-51.10×1007.09×10-56.87×10-1丙氨酸9567.41×10-15.30×10-13.99×10-15.60×1007.89×100吡咯1 5329.10×10-21.06×1016.05×1008.10×1018.52×101
烃类物质原料期有125 种、腌制期204 种、发酵前期198 种、发酵后期172 种、成熟期209 种,在整个加工阶段烃类风味物质数量波动变化,然而烃类物质含量随加工阶段深入有所增加,原料中烃类物质相对含量为8.41%,在成熟期时增加至36.40%(图6b)。不饱和烃是较强的增味剂,芳香烃具有明显气味,可能是由带芳香基的游离氨基酸氧化产生[30]。
杂环化合物在各加工阶段的数量均较多,但杂环化合物的相对含量较低,且随加工时期变化相对含量变化幅度也较小(图6b)。杂环化合物在香味贡献中具有重要作用,气味特征较明显,香气感觉阈值极低,很容易被人觉察[31]。杂环化合物因其独特的结构而具有特定的香味特性,其结构中的杂原子(如氮、氧、硫)能显著影响其香味特性,这些原子改变了化合物的电子分布和分子间相互作用,从而影响它们与嗅觉受体的结合方式[32]。如表3所示,在发酵后期和成熟期检出较高含量呈水果味和甜味的2-戊基噻吩和呈绿豆味、蔬菜味的2-戊基呋喃。
由图6b可知,酯类物质相对含量随加工深入呈上升趋势,而醇类物质相对含量随加工阶段深入呈下降趋势,从原料期28.16%下降至成熟期的7.17%。这是由于发酵过程中温度升高促进蛋白质降解和酯化反应进行,产生的酸类物质可以和醇类结合生成酯,且自然发生的酶促反应也会促进酯类风味物质的形成[33]。成熟腊肉中检出的风味物质有呈果味的乳酸乙酯、戊酸乙酯、活性2-甲基丁酸乙酯、呈甜味的乙酸乙酯等,以及呈香脂、奶油味的棕榈酸乙酯等。
醛、酮类物质各时期的数量和相对含量均不高,脂肪氧化过程主要产生短链醛和酮类化合物。从腌制期开始,上述2 类物质相对含量随加工阶段深入均呈下降趋势,虽然数量和相对含量不高,但其阈值较低,使得腊肉风味丰富。成熟期检出2-甲基丁醛、3-甲基丁醛、丙醛等典型的由蛋白质降解直接产生的醛类风味物质[34]。亮氨酸在高温下经历化学反应,特别是亮氨酸在美拉德反应中可以生成具有烘烤、坚果和焦糖香味特征的2-甲基丁醛,以及具有坚果和奶油香气的3-甲基丁醛,丙醛则由丙氨酸在热降解过程中产生,具有浓烈的果味和坚果味。
其他类别中检测到的VOCs包括苯环型化合物、糖类多酮类化合物、有机含氮化合物、脂质和类脂分子等,腌制过程中肉中蛋白质的降解会释放出含有苯环的氨基酸,如苯丙氨酸。苯丙氨酸在后续的加工过程中可以进一步转化为含苯环的风味化合物[35]。美拉德反应中还原糖和氨基酸反应产生各种含氮化合物,如吡咯、噻唑等一系列复杂的风味化合物,甘氨酸、组氨酸等氨基酸可以通过热降解或酶促反应生成含氮风味物质[36]。
常用ROAV法评价样品的风味,一般ROAV越大说明该物质对风味的贡献越大[37]。表4为各加工阶段贡献度排名前5的风味物质及其各时期ROAV。2,3-丁二酮、2-甲基丁醛、庚醛和2-辛烯醛在整个加工过程中风味贡献较大,为影响干腌腊肉加工过程中肉风味的关键化合物。
表4 干腌腊肉各加工阶段VOCs的ROAV
Table 4 ROAV of VOCs in dry-cured bacon at different processing stages
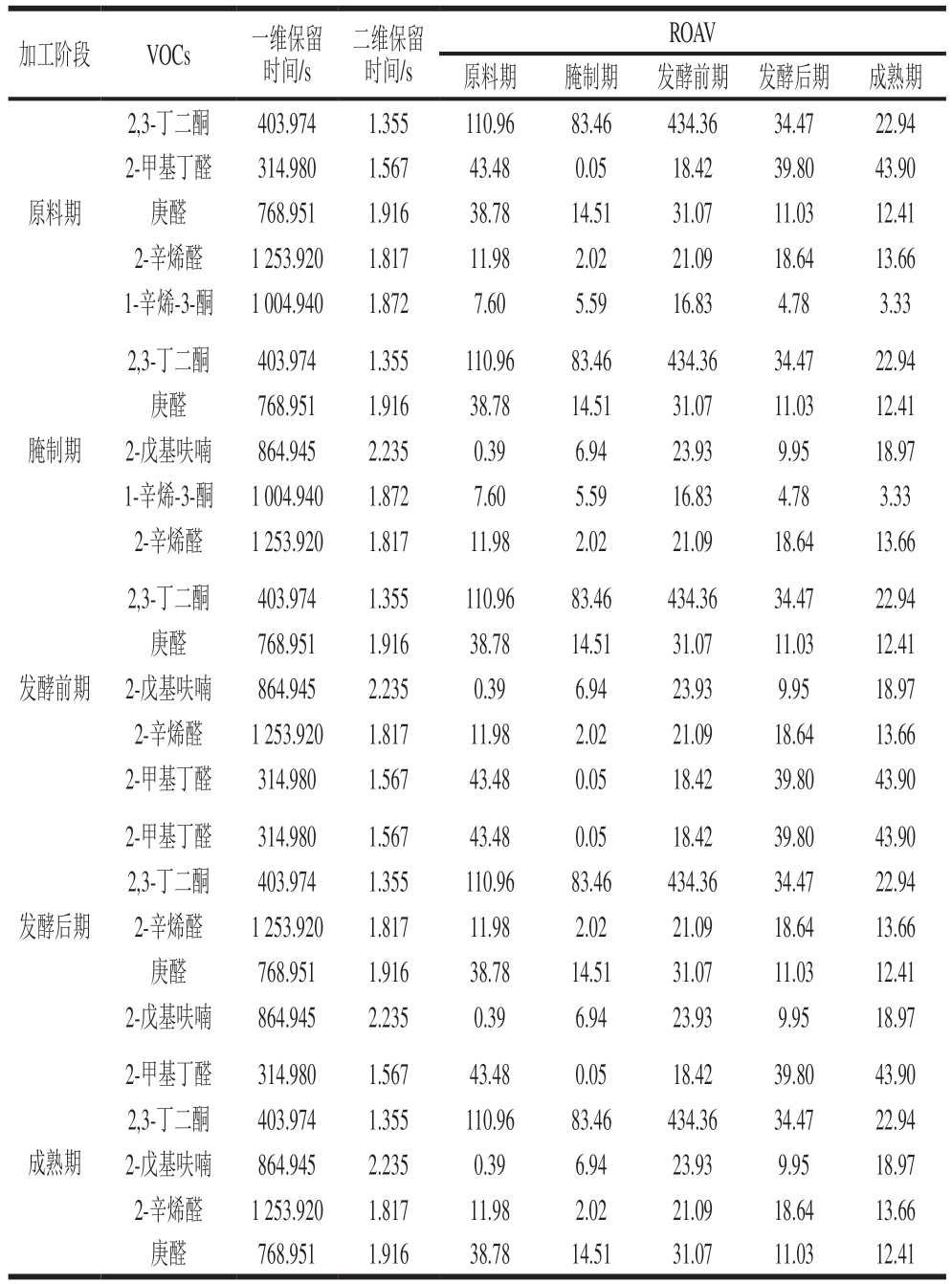
加工阶段VOCs 一维保留时间/s二维保留时间/s ROAV原料期腌制期发酵前期发酵后期成熟期原料期2,3-丁二酮403.9741.355110.9683.46434.3634.4722.94 2-甲基丁醛314.9801.56743.480.0518.4239.8043.90庚醛768.9511.91638.7814.5131.0711.0312.41 2-辛烯醛1 253.9201.81711.982.0221.0918.6413.66 1-辛烯-3-酮1 004.9401.8727.605.5916.834.783.33腌制期2,3-丁二酮403.9741.355110.9683.46434.3634.4722.94庚醛768.9511.91638.7814.5131.0711.0312.41 2-戊基呋喃864.9452.2350.396.9423.939.9518.97 1-辛烯-3-酮1 004.9401.8727.605.5916.834.783.33 2-辛烯醛1 253.9201.81711.982.0221.0918.6413.66发酵前期2,3-丁二酮403.9741.355110.9683.46434.3634.4722.94庚醛768.9511.91638.7814.5131.0711.0312.41 2-戊基呋喃864.9452.2350.396.9423.939.9518.97 2-辛烯醛1 253.9201.81711.982.0221.0918.6413.66 2-甲基丁醛314.9801.56743.480.0518.4239.8043.90发酵后期2-甲基丁醛314.9801.56743.480.0518.4239.8043.90 2,3-丁二酮403.9741.355110.9683.46434.3634.4722.94 2-辛烯醛1 253.9201.81711.982.0221.0918.6413.66庚醛768.9511.91638.7814.5131.0711.0312.41 2-戊基呋喃864.9452.2350.396.9423.939.9518.97成熟期2-甲基丁醛314.9801.56743.480.0518.4239.8043.90 2,3-丁二酮403.9741.355110.9683.46434.3634.4722.94 2-戊基呋喃864.9452.2350.396.9423.939.9518.97 2-辛烯醛1 253.9201.81711.982.0221.0918.6413.66庚醛768.9511.91638.7814.5131.0711.0312.41
产品的风味是由可识别的味觉和嗅觉特性及不能单独识别特性的复合体2 部分组成,因此采用FlavorDB数据库[38]对物质的感官风味进行分析。绘制成品腊肉的感官风味特征分析图,折线表示对应风味物质频次等级。由图8可知,甜味属性在雷达图上得分最高,显示为4.5 级,表明腊肉具有显著的甜味特征,这是由于在腌制过程中糖类与肉类蛋白质反应形成风味物质,以及酯、醛、酮等物质协同作用,增强了甜味感知;此外,水果味属性也相对较高,达到3.5 级,醛类(如庚醛、戊醛、丙醛等)、酯类(如异丁酸乙酯、戊酸乙酯、乙酸异戊酯等)和酮类(如2-壬酮、丙酮等)化合物相互作用会使食品呈现出甜味及类似水果的感官风味特征[37]。草本、蜡质属性得分为2 级,说明这些风味特征存在但不是最突出的特点,蜡质风味与腊肉在腌制或贮藏过程中脂肪氧化产物有关[39]。由此可见,脂肪氧化、蛋白质降解、美拉德反应等多途径共同作用形成了腊肉特有的复杂风味特征。
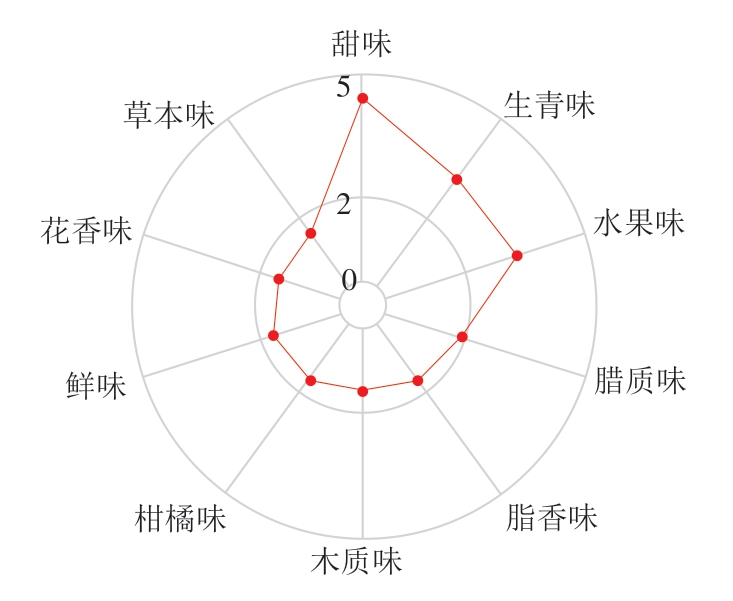
图8 干腌腊肉成品感官风味雷达图
Fig. 8 Radar chart of sensory flavor of dry-cured bacon
本研究对干腌腊肉各加工阶段的理化指标和VOCs进行动态监测,结果发现,干腌腊肉加工过程中水分含量持续下降,水分分布变化以不易流动水蒸发为主,肉样的pH值为酸性且颜色持续变深,肌肉纤维的微观结构变化表明肉质紧密度不断增加,肌肉纤维光滑度下降。GC×GC-TOFMS技术分析发现,腊肉中VOCs为醇类、醛类、酯类、杂环化合物、烃类及酮类。2,3-丁二酮、2-甲基丁醛、庚醛和2-辛烯醛在整个加工过程中风味贡献较大。主体风味物质的相互作用使腊肉产生甜味及类似水果的感官风味特征,使得腊肉的整体风味更加柔和。本研究结果对提升腊肉产品质量和优化风味有重要意义,也对传统食品的创新与发展具有一定参考意义。
[1] WU C F, LYU W T, HONG Q H, et al. Gut microbiota influence lipid metabolism of skeletal muscle in pigs[J]. Frontiers in Nutrition, 2021,8: 675445.DOI:10.3389/fnut.2021.675445.
[2] JUNG U, KIM M, WANG T, et al. Identification of candidate proteins regulated by long-term caloric restriction and feed efficiency in longissimus dorsi muscle in Korean native steer[J]. Journal of Animal Science and Technology, 2022, 64(2): 330-342.DOI:10.5187/jast.2022.e19.
[3] ZHOU C Y, WU J Q, TANG C B, et al. Comparing the proteomic profile of proteins and the sensory characteristics in Jinhua ham with different processing procedures[J]. Food Control, 2019, 106: 106694.DOI:10.1016/j.foodcont.2019.06.020.
[4] RAZA A, SONG H, BEGUM N, et al. Direct classification of volatile organic compounds in heat-treated glutathione-enriched yeast extract by headspace-gas chromatography-ion mobility spectrometry (HSGC-IMS)[J]. Food Analytical Methods, 2020, 13: 2279-2289.DOI:10.1007/s12161-020-01847-8.
[5] CHEN M J, CHEN T, QI X P, et al. Analyzing changes of volatile components in dried pork slice by gas chromatography-ion mobility spectroscopy[J]. CyTA-Journal of Food, 2020, 18(1): 328-335.DOI:10.1080/19476337.2020.1752805.
[6] 宋永, 乔娜, 温婷婷, 等. 顶空固相微萃取-气质联用分析哈尔滨风干肠中的挥发性风味化合物[J]. 食品科学, 2013, 34(2): 250-252.
[7] 付浩华, 周兵, 夏启禹, 等. 食盐添加量对腊肉风味及贮藏过程中理化性质的影响[J]. 肉类研究, 2023, 37(9): 39-45.DOI:10.7506/rlyj1001-8123-20230810-074.
[8] 毛永强, 李彦虎, 贠建民, 等. 传统陇西腊肉制作过程中挥发性风味物质变化分析[J]. 食品与发酵工业, 2021, 47(4): 144-152.DOI:10.13995/j.cnki.11-1802/ts.025248.
[9] 刘少璞, 周志磊, 姬中伟, 等. 全二维与一维气相色谱质谱联用技术解析苏派黄酒挥发性组分[J]. 食品与发酵工业, 2022, 48(9): 223-229.DOI:10.13995/j.cnki.11-1802/ts.029100.
[10] WANG X Y, XU R, TONG X, et al. Characterization of different meat flavor compounds in Guangdong small-ear spotted and Yorkshire pork using two-dimensional gas chromatography-time-of-flight mass spectrometry and multi-omics[J]. LWT-Food Science and Technology,2022, 169: 114010.DOI:10.1016/j.lwt.2022.114010.
[11] 国家质量监督检验检疫总局, 中国国家标准化管理委员会. 肉与肉制品 水分含量测定: GB/T 9695.15—2008[S]. 北京: 中国标准出版社, 2009: 3.
[12] ZOU Y H, ZHANG W G, KANG D C, et al. Improvement of tenderness and water holding capacity of spiced beef by the application of ultrasound during cooking[J]. International Journal of Food Science and Technology, 2018, 53(3): 828-836.DOI:10.1111/ijfs.13659.
[13] LIU S X, ZHANG Y W, ZHOU G H, et al. Protein degradation, color and textural properties of low sodium dry cured beef[J]. International Journal of Food Properties, 2019, 22(1): 487-498.DOI:10.1080/10942 912.2019.1591444.
[14] ZHOU C Y, XIA Q, HE J, et al. Insights into ultrasonic treatment on the mechanism of proteolysis and taste improvement of defective drycured ham[J]. Food Chemistry, 2022, 388: 133059.DOI:10.1016/j.foodchem.2022.133059.
[15] LAN W Q, HU X Y, SUN X H, et al. Effect of the number of freezethaw cycles number on the quality of Pacific white shrimp (Litopenaeus vannamei): an emphasis on moisture migration and microstructure by LF-NMR and SEM[J]. Aquaculture and Fisheries, 2020, 5(4): 193-200.DOI:10.1016/j.aaf.2019.05.007.
[16] LI H H, GENG W H, HARUNA S, et al. Identification of characteristic volatiles and metabolomic pathway during pork storage using HSSPME-GC/MS coupled with multivariate analysis[J]. Food Chemistry,2022, 373: 131431.DOI:10.1016/j.foodchem.2021.131431.
[17] SUN C X, WANG R, WANG T Y, et al. Primary evaluation of nine volatile N-nitrosamines in raw red meat from Tianjin, China, by HSSPME-GC-MS[J]. Food Chemistry, 2020, 310: 125945.DOI:10.1016/j.foodchem.2019.125945.
[18] XIA J G, WISHART D. Web-based inference of biological patterns, functions and pathways from metabolomic data using MetaboAnalyst[J]. Nature Protocols, 2011, 6(6): 743-760.DOI:10.1038/nprot.2011.319.
[19] WARWICK B, DAVID B, PAUL B, et al. Procedures for large-scale metabolic profiling of serum and plasma using gas chromatography and liquid chromatography coupled to mass spectrometry[J]. Nature Protocols, 2021, 6(7): 1060-1083.DOI:10.1038/nprot.2011.319.
[20] CHEN Y, TAO X, HU S Q, et al. Effects of phytase/ethanol treatment on aroma characteristics of rapeseed protein isolates[J]. Food Chemistry, 2024, 431: 137119.DOI:10.1016/j.foodchem.2023.137119.
[21] LÜ W Q, LI S J, HAN Q H, et al. Study of the drying process of ginger (Zingiber officinale Roscoe) slices in microwave fluidized bed dryer[J]. Drying Technology, 2016, 34(14): 1690-1699.DOI:10.1080/07373937.2015.1137932.
[22] FRANK D, WATKINS P, BALL A, et al. Impact of brassica and lucerne finishing feeds and intramuscular fat on lamb eating quality and flavor. A cross-cultural study using Chinese and non-Chinese Australian consumers[J]. Journal of Agricultural and Food Chemistry,2016, 64(36): 6856-6868.DOI:10.1021/acs.jafc.6b02018.
[23] 杨子江, 赵娅英, 王桂瑛, 等. 云南5 种火腿水分分布与质构特性研究[J]. 食品安全质量检测学报, 2022, 13(10): 3134-3140.DOI:10.3969/j.issn.2095-0381.2022.10.
[24] LI R, GENG C Z, XIONG Z M, et al. Evaluation of protein degradation and flavor compounds during the processing of Xuan’en ham[J]. Journal of Food Science, 2022, 87(8): 3366-3385.DOI:10.1111/1750-3841.16242.
[25] KĘSKA P, STADNIK J. Taste-active peptides and amino acids of pork meat as components of dry-cured meat products: an in-silico study[J].Journal of Sensory Studies, 2017, 32(6): e12301.DOI:10.1111/joss.12301.
[26] 伏慧慧, 潘丽, 王庆玲. 干腌牛肉加工过程中理化指标变化分析[J]. 新疆职业大学学报, 2023, 31(2): 65-70; 75.DOI:10.3969/j.issn.1009-9549.2023.02.013.
[27] GUO X, WANG Y Q, LU S L, et al. Changes in proteolysis, protein oxidation, flavor, color and texture of dry-cured mutton ham during storage[J]. LWT-Food Science and Technology, 2021, 149: 111860.DOI:10.1016/j.lwt.2021.111860.
[28] 胡越, 刘昊天, 夏秀芳, 等. 直接减盐法对哈尔滨红肠贮藏期间品质的影响[J]. 食品科学, 2023, 44(7): 184-191.DOI:10.7506/spkx1002-6630-20220423-302.
[29] GARCÍA A, CAMBERO M, CASTEJÓN D, et al. Dry cured-ham microestructure: a T2 NMR relaxometry, SEM and uniaxial tensile test combined study[J]. Food Structure, 2019, 19: 100104.DOI:10.1016/j.foostr.2018.100104.
[30] LI L, BELLOCH C, FLORES M. The Maillard reaction as source of meat flavor compounds in dry cured meat model systems under mild temperature conditions[J]. Molecules, 2021, 26(1): 223.DOI:10.3390/molecules26010223.
[31] XU C C, YU H, XIE P, et al. Influence of electrostatic field on the quality attributes and volatile flavor compounds of dry-cured beef during chill storage[J]. Foods, 2020, 9(4): 478.DOI:10.3390/foods9040478.
[32] SHI Y A, LI X, HUANG A X. A metabolomics-based approach investigates volatile flavor formation and characteristic compounds of the Dahe black pig dry-cured ham[J]. Meat Science, 2019, 158:107904.DOI:10.1016/j.meatsci.2019.107904.
[33] MILLER R, LUCKEMEYER T, KERTH C, et al. Descriptive beef flavor and texture attributes relationships with consumer acceptance of US light beef eaters[J]. Meat Science, 2023, 204: 109252.DOI:10.1016/j.meatsci.2023.109252.
[34] LIU S Q, TU Y A, SUN J B, et al. Fermented mixed feed regulates intestinal microbial community and metabolism and alters pork flavor and umami[J]. Meat Science, 2023, 201: 109177.DOI:10.1016/j.meatsci.2023.109177.
[35] LI H B, ZHAO L L, DAI Q Y, et al. Blended cumin/zanthoxylum essential oil improve the antibacterial, fresh-keeping performance and flavor of chilled fresh mutton[J]. Meat Science, 2023, 200: 109173.DOI:10.1016/j.meatsci.2023.109173.
[36] LORIDO L, ESTÉVEZ M, VENTANAS J, et al. Salt and intramuscular fat modulate dynamic perception of flavour and texture in dry-cured hams[J]. Meat Science, 2015, 107: 39-48.DOI:10.1016/j.meatsci.2015.03.025.
[37] ZHU Y F, CHEN J, CHEN X J, et al. Use of relative odor activity value(ROAV) to link aroma profiles to volatile compounds: application to fresh and dried eel (Muraenesox cinereus)[J]. International Journal of Food Properties, 2020, 23(1): 2257-2270.DOI:10.1080/10942912.202 0.1856133.
[38] GARG N, SETHUPATHY A, TUWANI R, et al. FlavorDB: a database of flavor molecules[J]. Nucleic Acids Research, 2018, 46(D1):D1210-D1216.DOI:10.1093/nar/gkx957.
[39] ZHANG J, WANG T, YANG C J, et al. Integrated proteomics and metabolomics analysis revealed the mechanisms underlying the effect of irradiation on the fat quality of Chinese bacon[J]. Food Chemistry,2023, 413: 135385.DOI:10.1016/j.foodchem.2023.135385.