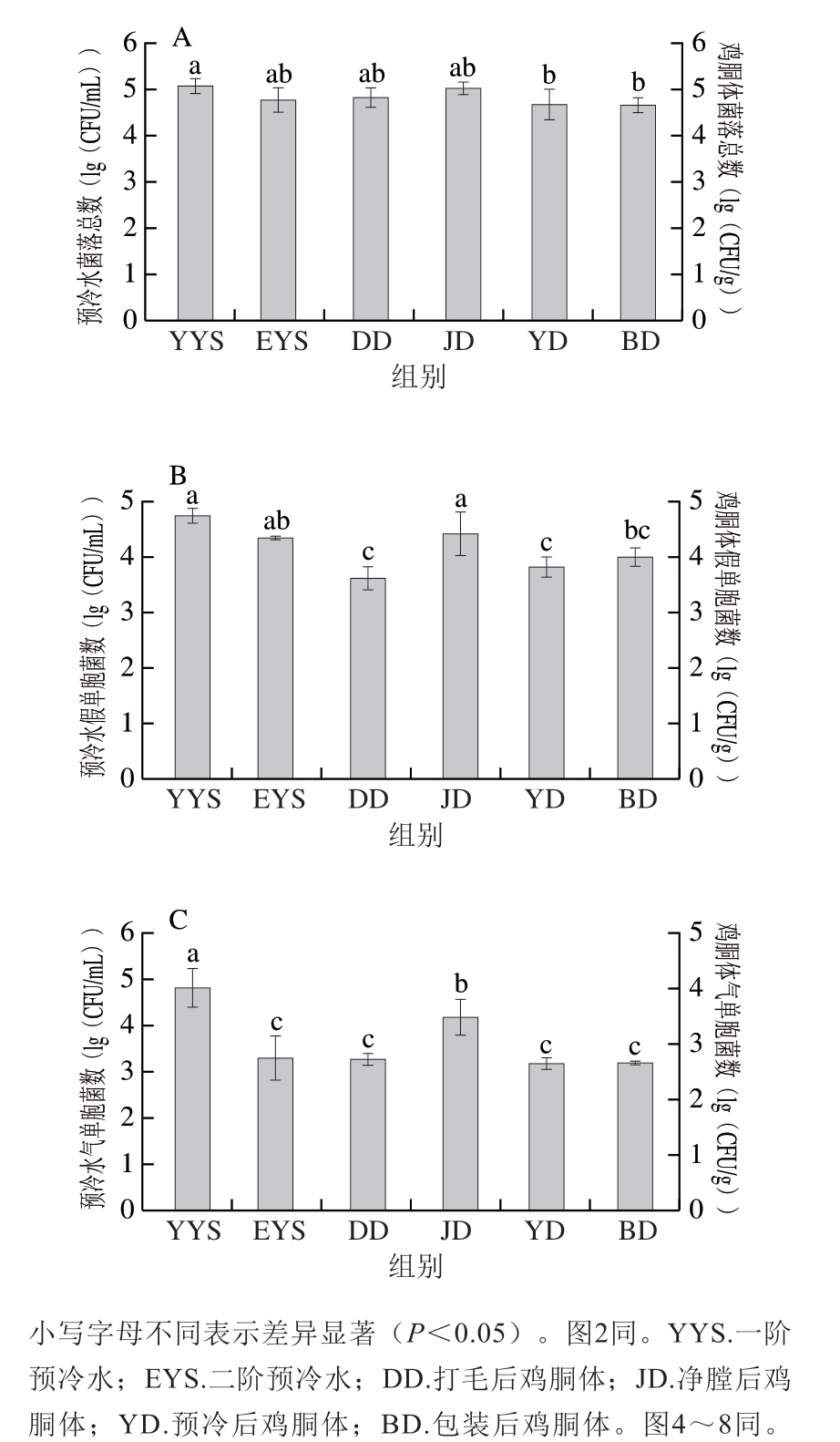
图1 黄羽肉鸡胴体和预冷水菌落总数(A)、假单胞菌数(B)和气单胞菌数(C)
Fig. 1 Total number of bacterial colonies (A), Pseudomonas (B), and Aeromonas (C) on yellow-feathered broiler carcasses and in pre-cooled water
刘芳(1982—)(ORCID: 0000-0002-2302-027X),女,研究员,博士,研究方向为畜禽产品质量安全。E-mail: fangliu82@163.com
王道营(1979—)(OCRID: 0000-0003-1776-5854),男,研究员,博士,研究方向为肉品加工与质量控制。E-mail: wdy0373@aliyun.com
High-Throughput Sequencing Analysis of Bacterial Diversity during the Slaughter Process of Yellow-Feathered Broilers
肖亚培, 王在天, 孙芝兰, 等. 基于高通量测序的黄羽肉鸡屠宰过程中菌群多样性分析[J]. 肉类研究, 2024, 38(3): 1-9.DOI:10.7506/rlyj1001-8123-20240318-057. http://www.rlyj.net.cn
XIAO Yapei, WANG Zaitian, SUN Zhilan, et al. High-throughput sequencing analysis of bacterial diversity during the slaughter process of yellow-feathered broilers[J]. Meat Research, 2024, 38(3): 1-9. (in Chinese with English abstract)DOI:10.7506/rlyj1001-8123-20240318-057. http://www.rlyj.net.cn
鸡肉的营养价值较高,其含有丰富的蛋白质、VC、VE等营养物质,且因其能量、脂肪含量、胆固醇含量较低,以及蛋白质含量较高等而深受广大消费者喜爱[1-2]。经过近几十年的发展,鸡肉逐渐成为世界第一大肉类,同时也是我国第二大肉类[3-4]。2023年我国肉鸡产量为1 430万 t,排名较2022年略有下降,为全球第三,但其产量与2022年持平[5]。目前,我国禽肉消费的主要市场是白羽肉鸡和黄羽肉鸡。较短的生长周期、较高的饲料利用率和先进的育种技术使白羽肉鸡产业成为我国规模化程度最大、生产力最高、实力最强的畜禽养殖业[6-7]。此外,经过数年的发展和其他技术的改进,白羽肉鸡的屠宰已开始采用自动化流水线作业[8]。我国以活禽交易为主流,黄羽肉鸡是其中的传统鸡种,然而随着城市内活禽禁宰等规定的开展,冷鲜禽肉逐渐成为主要烹饪原料[9]。然而,以当前技术水平,黄羽肉鸡不能像白羽肉鸡一样实行自动化流水线屠宰作业。黄羽肉鸡的屠宰加工主要依赖于人工,特别是净膛等一些关键工序。
在标准操作条件下,刚屠宰的肉鸡深层组织是无菌的,但在随后的屠宰、切割、运输和消费过程中,来自各种污染源的微生物会不可避免地侵入屠宰体及其各部位,使肉鸡胴体表面甚至肌肉组织变质[10]。此外,在集中屠宰过程中,进行大量屠宰时,一些屠宰场的环境很容易导致微生物交叉污染[11]。大部分病原微生物的生长繁殖可以通过低温冷藏来控制,但许多腐败微生物为嗜冷菌,可以在冷藏条件下大量生长、繁殖[12]。梁慧等[13]以冰鲜鸡为研究对象,发现其冷藏过程中的主要腐败菌为乳酸菌、葡萄球菌、肠杆菌和假单胞菌;赖宏刚等[14]通过对在4 ℃存放的冷鲜鸡进行菌相分析,得出其主要腐败菌为假单胞菌和乳酸菌;张莉等[15]发现,在4 ℃托盘和真空包装贮藏鸡胸肉的特征腐败菌均为假单胞菌,而25 ℃托盘贮藏的鸡胸肉特征腐败菌则包括肠杆菌、芽孢杆菌、梭菌和肠球菌等。
使用传统方法分析微生物群落结构和多样性的差异需要在分析前分离和鉴定可培养的微生物,因此无法全面评估微生物群落组成[16]。高通量测序技术是DNA测序发展的里程碑式产物[17-19]。由于成本低、通量高、速度快等特点[20],其可以分析整个样本中微生物的种类和相对丰度[21],全面反映微生物群落组成。黄柳娟等[22]利用高通量测序技术分析得出冷鲜鸡肉产品表面和内部组织中细菌菌群的结构及增殖趋势存在差异;同时,桂国弘等[23]通过高通量测序技术对冷鲜鸡冷藏过程中的菌群结构变化进行分析,得出冷鲜鸡肉的腐败变质主要由肉鸡自身携带的微生物在冷藏后期逐渐演替为优势菌群所导致。Wang Ying等[24]结合传统依赖培养和高通量测序技术确定德州烧鸡中的腐败微生物为假交替单胞菌、弯曲乳杆菌、德氏肠球菌和金黄色葡萄球菌等;唐林等[25]通过传统培养方法结合高通量测序技术进一步证明猪胴体分割环节为关键污染环节。关于肉鸡在包装、贮藏等过程中菌群组成的多样性分析研究较多,然而关于其在不同屠宰加工过程中鸡胴体菌群组成及多样性差异的研究较少,因此利用高通量测序技术研究肉鸡屠宰加工过程中的微生物组成及动态变化是揭示冰鲜鸡肉质量安全与腐败菌群的关系,以及保证冰鲜鸡肉品质稳定性的关键。目前,高通量测序技术已广泛应用于医疗、农业和食品行业等多个领域[26]。
本研究采用传统培养与高通量测序技术结合的方法测定黄羽肉鸡打毛、净膛、预冷和包装屠宰过程中各阶段鸡胴体表面及加工环境中预冷水的菌群多样性,研究屠宰至加工不同过程中肉鸡胴体表面及预冷水的细菌及不同屠宰工序优势菌群的消长规律,旨在分析黄羽肉鸡屠宰、加工环节胴体表面的菌群组成,为后续企业对屠宰各工序的优化提供参考依据,同时为冰鲜鸡产品的质量安全提供保障。
黄羽肉鸡取自江苏某冰鲜鸡屠宰加工企业不同屠宰工艺点;菌样从鸡胴体表面、预冷水及加工过程所接触的加工台面及工人手套表面取得。
氯化钠(分析纯) 江苏强盛功能化学股份有限公司;PCA平板计数琼脂培养基 南京翼飞雪生物科技有限公司;假单胞菌CFC选择性培养基、假单胞菌CFC选择性培养基添加剂(冻干)、气单胞菌培养基基础(aeromonas medium base,RYAN)、气单胞菌培养基添加剂(RYAN添加剂) 青岛高科技工业园海博生物技术有限公司。
M124A电子分析天平 意大利BEL公司;SW-CJ-1FD无菌操作台 苏州净化设备有限公司;SPX-250B-Z生化培养箱 上海博讯实业有限公司医疗设备厂;Centrifuge 5810 R离心机、Centrifuge 5424 R离心机德国Eppendorf公司;Unicen MR台式冷冻离心机 德国Hero Lab公司;Direct-Q3纯水/超纯水一体化系统 默克化工技术(上海)有限公司。
1.3.1 样品采集
为分析黄羽肉鸡屠宰过程各工艺点胴体及所接触台面的菌群组成,在各屠宰工艺流程取样(打毛后鸡胴体、净膛后鸡胴体、预冷后鸡胴体及包装后鸡胴体),每个取样点随机选取3 只黄羽肉鸡进行微生物检测。在接触面及预冷水(打毛后台面、净膛台面、包装间转挂台面、预冷前台面、预冷后台面、净膛工人手、预冷后转挂工人手、挂脚环工人手、包装工人手、包装秤、一阶预冷水及二阶预冷水)取样,并进行微生物检测。测定不同工艺点的胴体、接触面和预冷水所取样品的菌落总数、假单胞菌数和气单胞菌数;同时将所有肉鸡胴体的样本及一阶、二阶预冷水样品洗菌后,菌悬液离心获得菌泥,并将其保存于-20 ℃,用于菌群多样性分析。
1.3.2 各屠宰工艺鸡胴体及预冷水测试菌液制备
从不同屠宰工艺流程随机抽取3 只黄羽肉鸡,每只黄羽肉鸡胴体与等质量的无菌生理盐水一起称质量,随后放入无菌匀浆袋中,在室温条件下剧烈振荡10 min,吸取0.5 mL细菌悬浮液,用4.5 mL无菌生理盐水进行10 倍梯度稀释,以稀释后的菌液为实验用菌液。称取一定质量一阶、二阶预冷水与等质量无菌生理盐水放入无菌均质袋中,按同样方法制备稀释菌液。
1.3.3 加工环境表面测试菌液制备
将肉鸡胴体可直接触及表面选为加工环境表面的取样部位,使用无菌棉球在5 cm×5 cm的取样器范围内擦拭取样部位,然后把带有菌落的棉球放入装有225 mL无菌生理盐水的均质袋中。重复取样3 次,摇晃均匀,然后将菌悬液进行10 倍梯度稀释,配制成测试菌液。
1.3.4 菌落总数、假单胞菌数及气单胞菌数的测定
参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》[27]测定菌落总数,对30~300 CFU之间的平板进行计数;参照SN/T 4044—2014《出口肉及肉制品中假单胞菌属的计数方法》[28]测定假单胞菌数,对30~300 CFU之间的平板进行计数;参照SN/T 0751—2010《进出口食品中嗜水气单胞菌检验方法》[29]测定气单胞菌数,对30~300 CFU之间的平板进行计数。
1.3.5 样品菌体的收集
分别取打毛、净膛、预冷和包装4 个屠宰工艺流程的鸡胴体、一阶预冷水及二阶预冷水未稀释的菌悬液,4 ℃、12 000 r/min离心15 min,去除上清液,收集沉淀并保存于-20 ℃冰箱中,各组样品做3 个重复。
1.3.6 聚合酶链式反应(polymerase chain reaction,PCR)扩增及高通量测序
由北京奥维森基因科技有限公司对预先制备好的菌体样品进行测试。首先,对所有菌体样品的16S rDNA V3~V4区域进行PCR扩增,所选取的引物为338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACNNGGG TATCTAAT-3’)。随后,利用Illumina Miseq PE300高通量测序平台对扩增样品进行测序与分析。根据每个样本的数据对序列进行质控与筛选,去除数据中的嵌合体、序列末端质量读数小于20的序列、引物错配和短序列(通常小于150 bp)后得到优化序列,然后进行操作分类单元(operational taxonomic unit,OTU)聚类分析及物种分类学分析。根据OTU聚类结果进行α多样性指数分析及测序深度检测;基于分类学信息,在各个分类水平上进行群落结构统计,并进行主成分分析(principal component analysis,PCA)。
使用SPSS 25.0统计软件中的单因素方差分析进行结果统计。所有分析均使用最小显著性差异方法检验,显著性水平为0.05。所有结果均以平均值±标准差表示。使用Origin Pro 2024和R语言的Venn包、reshape2、ggplot2包等工具对所有数据进行统计分析,并生成Venn图、PCA图和热图。
由图1A可知,在黄羽肉鸡的屠宰过程中,打毛后黄羽肉鸡胴体表面的菌落总数为4.82(lg(CFU/g))、净膛后鸡胴体菌落总数为5.03(lg(CFU/g))。这可能是由净膛过程中一些外源性操作或屠宰过程中的二次污染所造成。经过第1次和第2次预冷洗涤后,鸡胴体菌落总数降至4.68(lg(CFU/g)),表明预冷对减少鸡胴体上的细菌数量有一定的作用。包装后鸡胴体的菌落总数为4.65(lg(CFU/g)),与预冷后鸡胴体菌落总数相当,这可能是由于预冷和包装2 个工艺流程之间没有采取相应措施以减少细菌数量。一阶预冷水和二阶预冷水菌落总数分别为5.07、4.76(lg(CFU/mL)),污染较严重,与未采用较合适的减菌措施有关。通过鸡胴体整体菌落总数的变化看,净膛后未采取合适的减菌措施致使预冷后菌落总数太高,从而导致产品菌落总数偏高。由此可知,净膛和预冷是黄羽肉鸡细菌数量增长的主要污染源,因此应更加关注屠宰过程中以上工序的卫生操作及这些过程中微生物控制情况。

图1 黄羽肉鸡胴体和预冷水菌落总数(A)、假单胞菌数(B)和气单胞菌数(C)
Fig. 1 Total number of bacterial colonies (A), Pseudomonas (B), and Aeromonas (C) on yellow-feathered broiler carcasses and in pre-cooled water
假单胞菌和气单胞菌因耐低温、蛋白酶产量高、易致腐,为冷鲜黄羽肉鸡的主要致腐菌。由图1B可知,成品鸡胴体假单胞菌数为3.98(lg(CFU/g)),一阶、二阶预冷水中假单胞菌数分别达到4.72、4.33(lg(CFU/mL))。由图1C可知,包装后鸡胴体气单胞菌数为3.19(lg(CFU/mL)),一阶、二阶预冷水中气单胞菌数分别为4.81、3.29(lg(CFU/mL)),结果与假单胞菌相似,表明鸡胴体中携带较多假单胞菌和气单胞菌,而目前的屠宰线未起到较好的减菌效果,致使优势菌污染严重,导致产品在后期贮藏过程中易腐败变质。
选择不同的加工台面及工人的手为取样点,由图2A可知,加工台面检测结果显示,预冷前台面菌落总数最高,为4.07(lg(CFU/cm2));预冷后台面次之,为4.05(lg(CFU/cm2))。屠宰加工过程中前区的净膛工人手和转挂工人手菌落总数分别高达4.81、4.49(lg(CFU/cm2)),前区工人手套菌落总数较高,这可能与前区工人手套没有定时消毒有关,同时在现场观察前区出现工人未戴手套、裸手操作的情况。包装车间电子秤、工人手及台面的菌落总数未超过4.00(lg(CFU/cm2)),达到预期效果,这应该与每日班后保持清洁擦拭的习惯有关。由此可以看出,在净膛和预冷这2 个屠宰流程中,净膛工人手、预冷前后台面及转挂工人手是影响黄羽肉鸡菌落总数变化的主要污染源。由图2B、C可知,打毛后台面、预冷后台面、包装间转挂台面中假单胞菌数和气单胞菌数均未超过3.00(lg(CFU/cm2)),表明加工台面清洗达到预期效果。
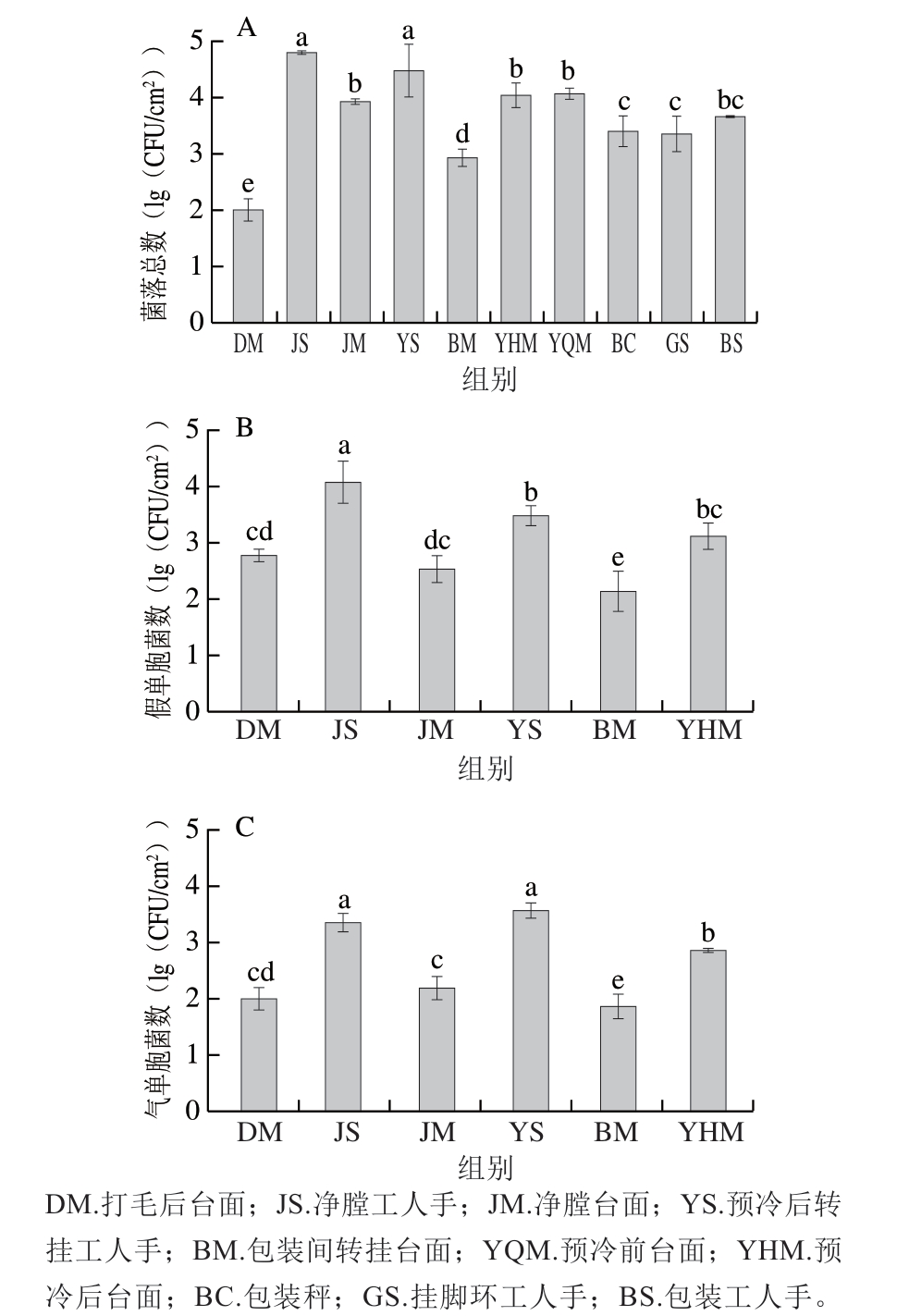
图2 不同加工环境表面菌落总数(A)、假单胞菌数(B)和气单胞菌数(C)
Fig. 2 Total number of bacterial colonies (A), Pseudomonas (B), and Aeromonas (C) on environmental surfaces during broiler processing
2.3.1 测序数据统计与OTU分析
通过Illumina Miseq高通量测序,获得肉鸡屠宰分割过程中各工艺点的胴体和一阶、二阶预冷水总菌数的序列数据,其中18 个样品得到767 个OTU,抽平处理后剩余759 个。此外,在对18 个样本进行进一步优化后,共获得1 060 635 条有效序列,高质量序列主要集中在420~440 bp长度区间内。当样本量逐渐增大到约30 000 个时,稀释曲线(图3A)和Shannon曲线(图3B)开始趋向于平缓,样本中OTU数量也不再增加,表明数据量足以描述样本中的大部分微生物种类[30]。
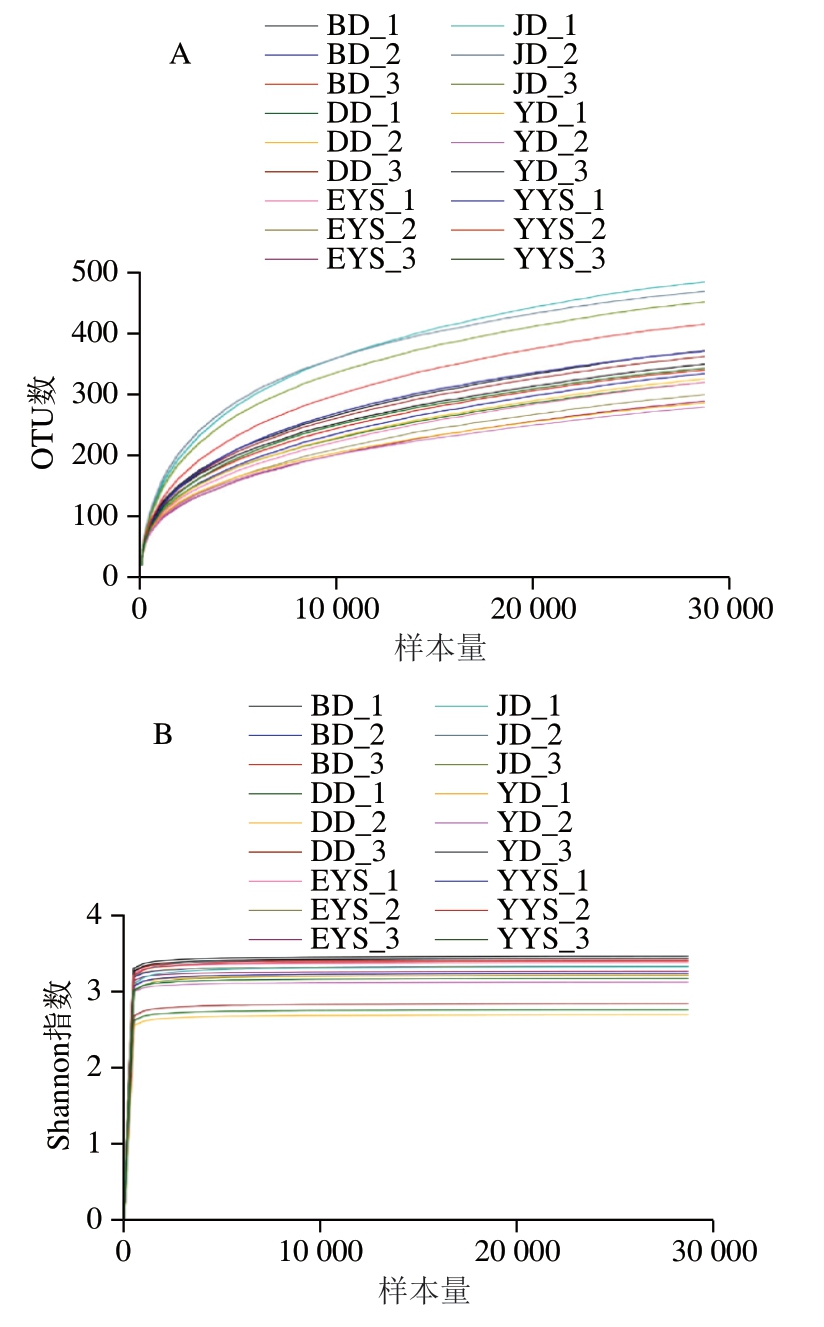
图3 稀释曲线(A)和Shannon-Wiener曲线(B)分析
Fig. 3 Rarefaction curves (A) and Shannon-Wiener curves (B)
由图4A可知,6 组样品共有的OTU为229 个;随后再对所有样本的数据进行重叠,得到花瓣图(图4B)。从这2 个图中可以得出6 组样本之间有相同的菌群结构。
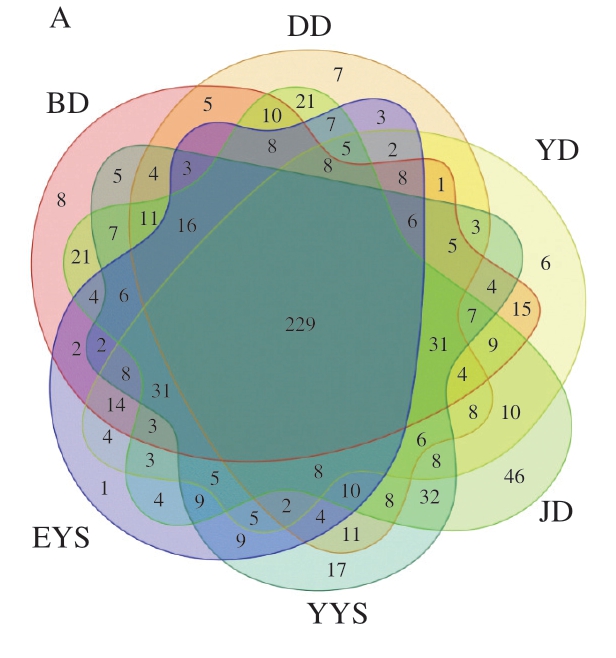
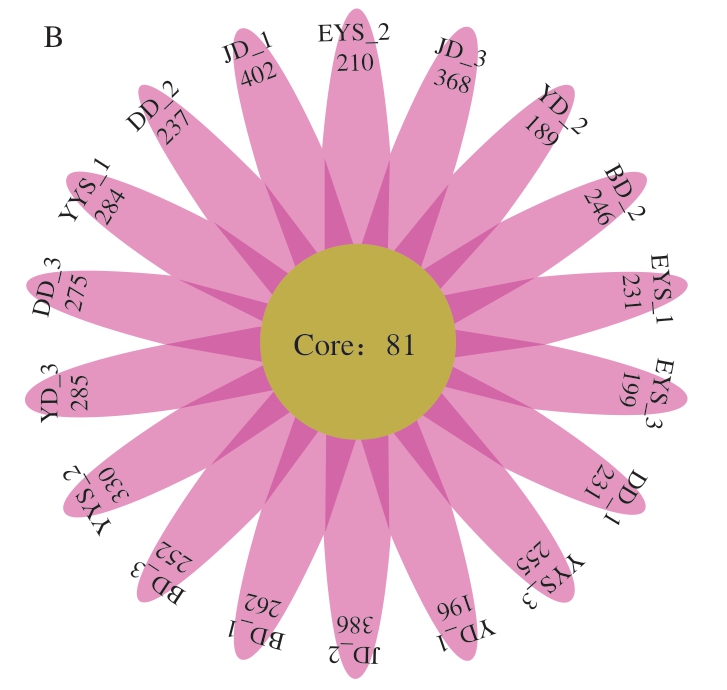
图4 不同工艺流程鸡胴体表面和预冷水OTU的Venn图(A)和花瓣图(B)
Fig. 4 Venn diagram (A) and petal diagram (B) of bacterial OTUs on chicken carcass surface and in pre-cooled water at different processing stages
2.3.2 α多样性指数分析
所测样本的生物多样性、物种丰富度和均匀度及样本测序深度主要体现在α多样性上,主要包含4 个指标[31-32]。其中Chao1指数与群落丰富度呈正相关;测序深度体现在Observed_species指数和PD_whole_tree指数;而Shannon指数则与群落的多样性密切相关,Shannon指数越高,表明群落多样性越大。由图5可知,净膛后鸡胴体样品Chao1指数最高,即细菌群落丰度最高,而其他5 个样本的丰度则相对下降。同样地,Observed_species和PD_whole_tree指数也用于分析样本中微生物群落的丰富度和多样性,由图5B、C可知,净膛后鸡胴体样本的菌群多样性更高,但是这2 个指数反映的测序深度和采样次数密切相关,因此可能会出现结果偏离实际采样样本的情况,从而出现误差。通过Shannon指数可以看出各样本间群落多样性的变化。由图5D可知,样品打毛后鸡胴体的Shannon指数最低,说明屠宰加工初期的鸡胴体表面菌群多样性比较低。但是,随着屠宰加工的进行,净膛后鸡胴体、预冷后鸡胴体、一阶预冷水、二阶预冷水和包装后鸡胴体的Shannon指数均明显增高,特别是包装后鸡胴体的Shannon指数达到最高。结果表明,肉鸡胴体表面的群落多样性很可能会因屠宰分割肉鸡过程中使用的工具及加工方法而增加。
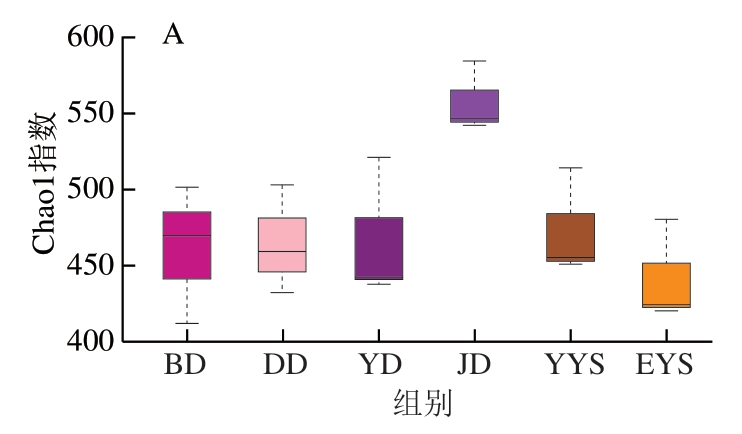
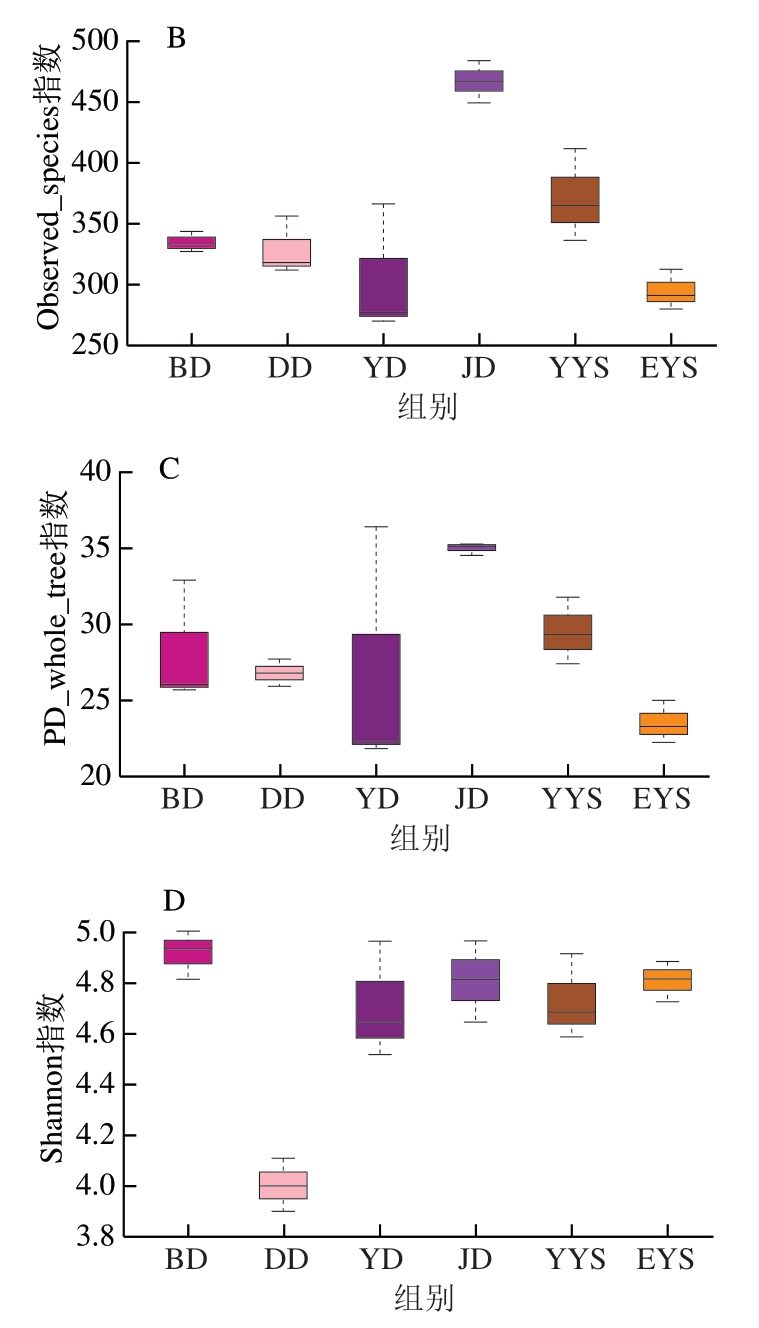
图5 菌群α多样性指数箱式图
Fig. 5 Box plots of α-diversity indexes of microbial community
2.3.3 物种组成和聚类分析
参考肖英平等[33]的方法,使用RDP Classifier算法对每个样本的序列进行比较和分析,并对每个采样点的细菌群落物种信息进行科、属级别的分析。由图6A可知,打毛后鸡胴体、净膛后鸡胴体、预冷后鸡胴体、包装后鸡胴体4 组不同加工过程的鸡胴体样本携带的微生物菌群在科水平上的优势菌群基本相同,其主要组成有莫拉氏菌科(Moraxellaceae)、假单胞菌科(Pseudomonadaceae)、葡萄球菌科(Staphylococcaceae)、乳杆菌科(Lactobacillaceae)、链球菌科(Streptococcaceae)、威克斯氏菌科(Weeksellaceae)和李斯特氏菌科(Listeriaceae)等。而在属水平上,各组样品的优势菌群发生变化。由图6B可知,4 组鸡胴体样本携带的微生物菌群主要有假单胞菌属(Pseudomonas)、巨大球菌属(Macrococcus)、乳杆菌属(Lactobacillus)、嗜冷杆菌属(Psychrobacter)、乳球菌属(Lactococcus)和不动杆菌属(Acinetobacter)等。净膛后鸡胴体与打毛后鸡胴体相比,优势菌群有较大差别,可能是因为净膛时人工操作造成的一些外源性污染。与肉鸡胴体表面菌群相比,预冷水中的菌群多样性差别不大,其主要菌群和胴体表面基本相同,但比例略有不同。此外,不同加工过程中鸡胴体表面的菌群比例也存在差异。预冷前打毛后鸡胴体和净膛后鸡胴体的优势菌有巨大球菌属和乳杆菌属,在经过预冷水后,巨大球菌属和乳杆菌属相对丰度大幅下降,说明预冷水中的消毒剂对它们有一定的减菌效果。YD和BD 2 组胴体的优势菌也发生变化,假单胞菌属的相对丰度明显增高,逐渐演变为最主要的优势菌属。原因可能是假单胞菌是嗜冷菌,其在低温环境下依然可以生长繁殖[34]。
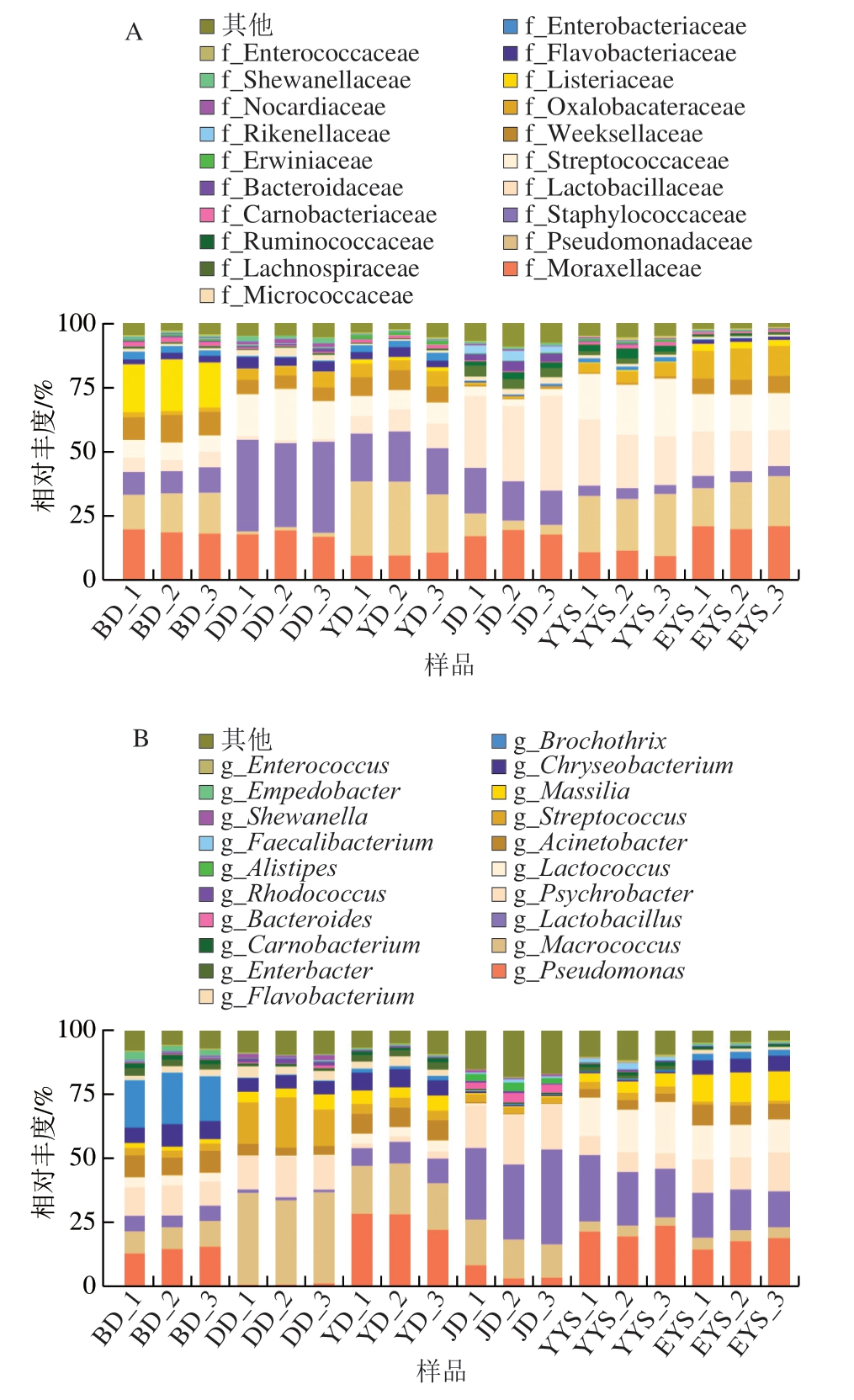
图6 基于科水平(A)和属水平(B)的物种组成分析柱状图
Fig. 6 Bar charts of microbial composition analysis at the family (A) and genus level (B)
2.3.4 样品菌群变化热图分析
样品菌群变化热图显示了对所有样本中的微生物多样性相对丰度的详细分析,图中不同颜色的深浅代表每个物种的聚集状态[35]。如图7所示,6 组样本均出现明显聚集,打毛后鸡胴体中优势菌为嗜冷杆菌属、巨大球菌属和链球菌属(Streptocpccus);净膛后鸡胴体中优势菌为乳杆菌属、巨大球菌属、嗜冷杆菌属和短稳杆菌属(Empedobacter),然而,在后续的预冷加工处理过程中它们的数量明显减少,并且优势种属也发生改变。一阶预冷水和二阶预冷水组样品优势菌均为假单胞菌属、乳杆菌属和乳球菌属,短稳杆菌属在这2 组样品中差异较大,其在样品一阶预冷水中的聚集度明显多于样品二阶预冷水。预冷后鸡胴体主要优势菌为假单胞菌属和巨大球菌属,而包装后鸡胴体主要优势菌为环丝菌属(Brochothrix)和假单胞菌属。这2 组样品,特别是样品预冷后鸡胴体假单胞菌属的相对丰度明显增大,并且通过屠宰加工线可以看出假单胞菌属的丰度整体呈现上升趋势。目前,减少黄羽肉鸡屠宰过程中胴体细菌的主要措施是在预冷水中添加消毒剂,但综合以上检测数据,仅依靠预冷水中的消毒剂不能保障终产品的品质。因此,建议在屠宰过程中增加减菌措施,比如在净膛后增加含次氯酸钠消毒剂的清洗池或者增加一阶预冷水中消毒剂的添加量,以降低预冷后的微生物数量。同时可以配备工人清洗手部的消毒池,定时洗手,以减少二次污染量。
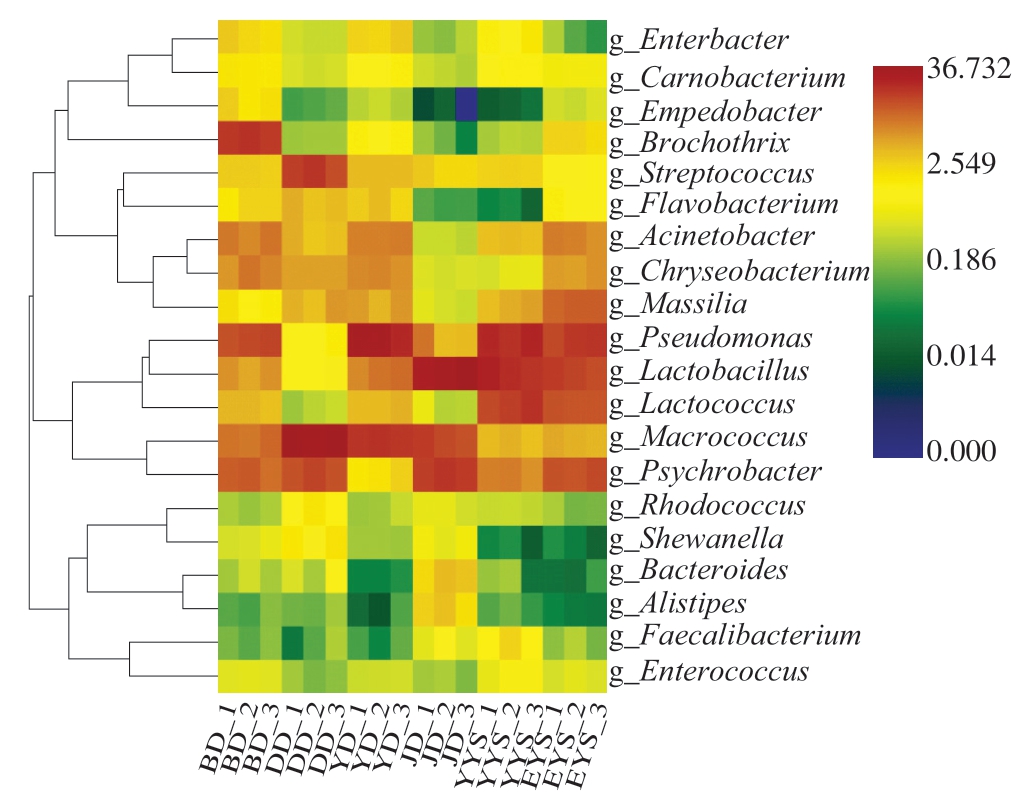
图7 微生物群落属水平变化热图
Fig. 7 Heatmap of genus-level changes in microbial community
2.3.5 冰鲜鸡加工过程中菌群变化的PCA
不同样品中细菌群落的结构组成越相近,样本间的距离就越小[36]。如图8所示,PCA进一步显示6 组样本细菌群落的组成存在显著差异。PC1对样品差异的贡献率为46.62%,PC2为26.15%。在PCA图中,打毛后鸡胴体、净膛后鸡胴体、预冷后鸡胴体、包装后鸡胴体、一阶预冷水和二阶预冷水6 个组别的3 个样品之间的距离均较近,表示各平行样本的组成差异较小。其中,在PC1和PC2方向上,打毛后鸡胴体、净膛后鸡胴体、预冷后鸡胴体、包装后鸡胴体4 个鸡胴体表面取样点中,预冷后鸡胴体和包装后鸡胴体较为接近,表明2 组鸡胴体表面菌群特征在2 个PC水平上较为相近。然而,打毛后鸡胴体与净膛后鸡胴体2 组样本从PCA来看距离较远,说明表面的菌群结构存在较大差异。从打毛后鸡胴体、净膛后鸡胴体、预冷后鸡胴体和包装后鸡胴体4 组样本中的PCA数据可以得出,打毛后鸡胴体、净膛后鸡胴体2 组相比存在较大差异,而预冷后鸡胴体和包装后鸡胴体差异较小,说明打毛、净膛后的鸡胴体菌群差异较大,而预冷后鸡胴体和包装后鸡胴体的菌群结构也发生了较大变化并基本趋于一致。在PCA图上,一阶预冷水与二阶预冷水组间的距离接近,说明菌群特征较接近,2 种水样的整体菌群结构差异不大。
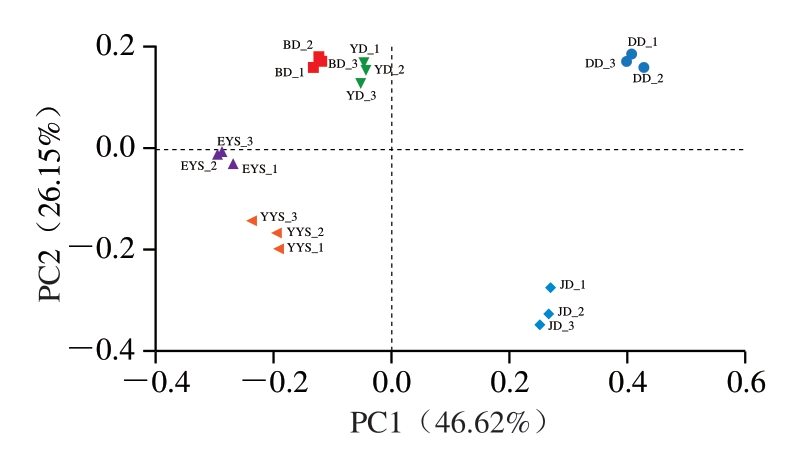
图8 不同工艺流程鸡胴体和预冷水微生物群落属水平PCA图
Fig. 8 PCA plot of variations in microbial community composition at the genus level on chicken carcasses and in pre-cooled water at different processing stages
微生物是影响黄羽肉鸡屠宰至加工整个过程及后期贮藏腐败变质的主要因素[37]。肉鸡除了自身携带的污染物,在整个屠宰加工过程中所有的操作程序及接触面也都可能会成为肉鸡胴体的污染源。因此,通过分析黄羽肉鸡打毛、净膛、预冷和包装等屠宰过程中鸡胴体表面和预冷水的微生物菌群组成,可以为后续企业对屠宰各工序的优化提供一定的参考依据。本研究监测黄羽肉鸡胴体屠宰过程中菌落总数的动态变化,结果表明,随生产时间延长,菌落总数呈增长趋势,相较于工人手、分割台面等部分,鸡胴体和预冷水的菌落总数明显略高。通过高通量测序技术对黄羽肉鸡打毛、净膛、预冷和包装等屠宰过程中鸡胴体表面和预冷水菌群结构及多样性进行分析,得出净膛后鸡胴体样品的细菌群落丰度最高,这是由净膛过程中一些外源性操作或屠宰过程中的二次污染所造成的;包装后鸡胴体样品的菌群多样性最高,主要是因为肉鸡在屠宰和分割等加工过程中所使用的工具和处理方法增加了肉鸡胴体表面微生物群落的多样性。预冷前黄羽肉鸡胴体在属水平上主要优势菌群为乳杆菌属、嗜冷杆菌属和乳球菌属,巨大球菌属和假单胞菌属次之。经预冷后优势菌群丰度减少,而假单胞菌属、巨大球菌属、不动杆菌属等占比增加,逐渐演变为优势菌群。王倩等[38]对冰鲜鸡预冷过程中的微生物菌群多样性进行动态分析得出,经过2 次预冷水后鸡胴体的金黄杆菌属、假单胞菌属和不动杆菌属的丰度增加。刘梦竹等[39]基于16S rRNA研究货架期前后鸡肉细菌群落结构,发现低温贮藏末期的优势腐败菌为假单胞菌属、不动杆菌属和沙雷氏菌属等。麦栩滔等[40]通过对不同包装方式下冰鲜鸡肉的菌群多样性进行研究发现,在贮藏后期优势腐败菌逐渐变为假单胞菌属、环丝菌属和希瓦氏菌属。这些结果与本研究结果相似。
本研究利用传统培养和高通量测序技术分析黄羽肉鸡打毛、净膛、预冷和包装屠宰过程中鸡胴体表面和预冷水的微生物污染情况。研究结果发现,经打毛、净膛和预冷后的鸡胴体菌落总数分别为4.82、5.03、4.68(lg(CFU/g)),说明该屠宰工艺未起到较好的减菌效果,宰后胴体微生物污染严重。通过高通量测序技术对黄羽肉鸡屠宰加工过程中的胴体和预冷水的菌群结构及多样性进行分析,从属水平上看,随着屠宰进行,预冷水中假单胞菌属、乳杆菌属和不动杆菌属等丰度增加;经预冷后乳杆菌属、嗜冷杆菌属和乳球菌属丰度减少,假单胞菌属、巨大球菌属和不动杆菌属等丰度增加,说明预冷工艺对乳杆菌属、嗜冷杆菌属和乳球菌属有较好的减菌效果,但是对假单胞菌属、巨大球菌属和不动杆菌属减菌效果不佳。PCA表明,一阶、二阶预冷水、预冷后鸡胴体及包装后鸡胴体相距较近,差异性不大,但与打毛鸡胴体和净膛后鸡胴体2 组样品有较大差异,说明预冷水中的污染菌组成决定了宰后胴体的污染菌种类。本研究说明不同屠宰流程后黄羽肉鸡胴体污染菌的组成与丰度存在差异,需针对不同屠宰流程特性采取对应的控制手段保障肉鸡制品的质量与安全,同时也为冷鲜鸡肉保鲜技术的开发提供了一定参考。
[1] 金卫东. 肉鸡产业战略发展思考[J]. 中国禽业导刊, 2023, 40(7): 15-18.
[2] WANG X X, WANG Z T, SUN Z L, et al. In vitro and in situ characterization of psychrotrophic spoilage bacteria recovered from chilled chicken[J]. Foods, 2022, 12(1): 95.DOI:10.3390/foods12010095.
[3] 文杰. 中国肉鸡生产现状与展望[J]. 北方牧业, 2022(17): 18.
[4] FERNÁNDEZ-PAN I, CARRIÓN-GRANDA X, MATÉ J I.Antimicrobial efficiency of edible coatings on the preservation of chicken breast fillets[J]. Food Control, 2014, 36(1): 69-75.DOI:10.1016/j.foodcont.2013.07.032.
[5] 张怡, 吴辰, 黄亚州, 等. 2023年全球肉鸡生产、贸易及产业经济发展研究[J]. 中国畜牧杂志, 2024, 60(3): 328-334.DOI:10.19556/j.0258-7033.20240131-11.
[6] 周伟伟, 孔凡春, 柳金圆. 白羽肉鸡加工工厂设计要点分析[J]. 冷藏技术, 2023, 46(3): 49-52.DOI:10.20094/j.issn.1674-0548.2023.03.049.
[7] 辛翔飞, 王潇, 王济民. 肉鸡产业高质量发展: 问题挑战、趋势研判及政策建议[J]. 中国家禽, 2024, 46(1): 1-10.DOI:10.16372/j.issn.1004-6364.2024.01.001.
[8] 雷秋霞, 刘杰, 周艳, 等. 中国特色小型白羽肉鸡产业取得的成就与发展趋势[J]. 中国畜禽种业, 2023, 19(12): 190-197.
[9] 卞欢, 徐为民, 黄志明, 等. 江苏省黄羽肉鸡屠宰行业发展情况调研报告[J]. 中国农村科技, 2021(11): 60-63.DOI:10.3969/j.issn.1005-9768.2021.11.016.
[10] JAMES C, VINCENT C, DE ANDRADE LIMA T I, et al. The primary chilling of poultry carcasses: a review[J]. International Journal of Refrigeration, 2006, 29(6): 847-862.DOI:10.1016/j.ijrefrig.2005.08.003.
[11] 戴宝玲, 肖英平, 孙凤来, 等. 家禽定点屠宰场不同屠宰区域空气的微生物结构[J]. 食品科学, 2018, 39(21): 219-223.DOI:10.7506/spkx1002-6630-201821033.
[12] 曾晓房, 林惠珍, 邝智祥, 等. 冰鲜肉中腐败菌的研究现状[J].安徽农业科学, 2010, 38(34): 19550-19552.DOI:10.3969/j.issn.0517-6611.2010.34.124.
[13] 梁慧, 于立梅, 陈秀兰, 等. 鸡胸肉冷藏过程中腐败菌分析及其品质变化研究[J]. 食品与发酵工业, 2016, 42(10): 184-188.DOI:10.13995/j.cnki.11-1802/ts.201610030.
[14] 赖宏刚, 蒋云升, 张元嵩, 等. 真空包装冷鲜鸡中腐败菌微生物的分离鉴定[J]. 江苏农业科学, 2018, 46(17): 198-201.DOI:10.15889/j.issn.1002-1302.2018.17.053.
[15] 张莉, 尹德凤, 张大文, 等. 不同贮藏条件下鸡胸肉特征腐败菌分析[J]. 食品与机械, 2019, 35(12): 113-118.DOI:10.13652/j.is sn.1003-5788.2019.12.021.
[16] GUPTA R, SRIVASTAVA S. Antifungal effect of antimicrobial peptides (AMPs LR14) derived from Lactobacillus plantarum strain LR/14 and their applications in prevention of grain spoilage[J]. Food Microbiology, 2014, 42: 1-7.DOI:10.1016/j.fm.2014.02.005.
[17] ZHANG Q Q, LI D, ZHANG W, et al. Comparative analysis of the bacterial diversity of Chinese fermented sausages using highthroughput sequencing[J]. LWT-Food Science and Technology, 2021,150: 111975.DOI:10.1016/j.lwt.2021.111975.
[18] JIA S L, HUANG Z, LEI Y T, et al. Application of Illumina-MiSeq high throughput sequencing and culture-dependent techniques for the identification of microbiota of silver carp (Hypophthalmichthys molitrix) treated by tea polyphenols[J]. Food Microbiology, 2018, 76:52-61.DOI:10.1016/j.fm.2018.04.010.
[19] POŁKA J, REBECCHI A, PISACANE V, et al. Bacterial diversity in typical Italian salami at different ripening stages as revealed by highthroughput sequencing of 16S rRNA amplicons[J]. Food Microbiology,2015, 46: 342-356.DOI:10.1016/j.fm.2014.08.023.
[20] 张咚咚, 赵金凤, 谢思源, 等. 基于高通量测序的玉米中微生物多样性分析[J]. 中国食品学报, 2023, 23(10): 305-314.DOI:10.16429/j.1009-7848.2023.10.030.
[21] 甄宗圆, 胡雪洁, 徐留艳, 等. 肉类微生物多样性分析方法的研究进展[J]. 生物加工过程, 2020, 18(3): 381-385.DOI:10.3969/j.issn.1672-3678.2020.03.017.
[22] 黄柳娟, 冯博, 刘海燕, 等. 冷鲜鸡肉表面及内部细菌菌群的多样性分析[J]. 上海农业学报, 2021, 37(1): 104-109.DOI:10.15955/j.issn1000-3924.2021.01.18.
[23] 桂国弘, 杨华, 朱江群, 等. 冷鲜鸡冷藏保存过程中菌群结构变化分析[J]. 浙江农业学报, 2019, 31(1): 47-55.DOI:10.3969/j.issn.1004-1524.2019.01.06.
[24] WANG Y, TANG M, MA Y H, et al. Isolation, identification and spoilage capability of dominant spoilage bacteria on Dezhoubraised chicken with different packaging[J]. LWT-Food Science and Technology, 2023, 182: 114710.DOI:10.1016/j.lwt.2023.114710.
[25] 唐林, 郭柯宇, 赖鲸慧, 等. 屠宰过程中猪胴体表面及环境的细菌菌相分析[J]. 食品科学, 2022, 43(12): 203-209.DOI:10.7506/spkx1002-6630-20210803-025.
[26] VAN RECKEM E, DE VUYST L, WECKX S, et al. Next-generation sequencing to enhance the taxonomic resolution of the microbiological analysis of meat and meat-derived products[J]. Current Opinion in Food Science, 2021, 37(4): 58-65.DOI:10.1016/j.cofs.2020.09.004.
[27] 国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准食品微生物学检验 菌落总数测定: GB 4789.2—2022[S]. 北京: 中国标准出版社, 2022.
[28] 国家质量监督检验检疫总局. 出口肉及肉制品中假单胞菌属的计数方法: SN/T 4044—2014[S]. 北京: 中国标准出版社, 2014.
[29] 国家质量监督检验检疫总局. 进出口食品中嗜水气单胞菌检验方法: SN/T 0751—2010[S]. 北京: 中国标准出版社, 2010.
[30] 邓晓影, 张宾, 汤贺, 等. 基于高通量测序的南美白对虾中微生物群落分析[J]. 食品科学, 2018, 39(24): 149-155.DOI:10.7506/spkx1002-6630-201824023.
[31] 邹毅辉, 陈育青, 黄建军. 基于高通量测序分析覆盆子酵素自然发酵过程中的微生物多样性[J]. 中国食品添加剂, 2023, 34(9): 120-126.DOI:10.19804/j.issn1006-2513.2023.09.016.
[32] 刘亚文, 刘芳, 孙芝兰, 等. 基于传统培养和高通量测序方法分析羊肉加工过程中的菌群多样性[J]. 食品工业科技, 2020, 41(9): 95-101.DOI:10.13386/j.issn1002-0306.2020.09.015.
[33] 肖英平, 何祥祥, 戴宝玲, 等. 采样方法对冷鲜鸡表面细菌DNA提取及高通量测序结果的影响[J]. 食品科学, 2017, 38(24): 260-264.DOI:10.7506/spkx1002-6630-201724042.
[34] MAI X T, WANG W Z, ZHANG X X, et al. Mathematical modeling of the effects of temperature and modified atmosphere packaging on the growth kinetics of Pseudomonas lundensis and Shewanella putrefaciens in chilled chicken[J]. Foods, 2022, 11(18): 2824.DOI:10.3390/foods11182824.
[35] 姜涛, 邹烨, 于纹婧, 等. 不同提取工艺对鸡油理化性质与挥发性风味物质的影响[J]. 食品工业科技, 2024, 45(12): 92-100.DOI:10.13386/j.issn1002-0306.2023080085.
[36] YI Z K, QIU M J, XIAO X N, et al. Quantitative characterization and dynamics of bacterial communities in ready-to-eat chicken using high-throughput sequencing combined with internal standard-based absolute quantification[J]. Food Microbiology, 2024, 118: 104419.DOI:10.1016/j.fm.2023.104419.
[37] FERNANDES R T V, ARRUDA A M V D, COSTA M K D O, et al.Physicochemical and microbiological parameters of frozen and chilled chicken meat[J]. Revista Brasileira de Zootecnia, 2016, 45(7): 417-421.DOI:10.1590/S1806-92902016000700009
[38] 王倩, 唐敏敏, 孙芝兰, 等. 冰鲜鸡预冷过程中微生物菌群多样性动态分析[J]. 食品工业科技, 2021, 42(23): 110-117.DOI:10.13386/j.issn1002-0306.2021030159.
[39] 刘梦竹, 向蓉, 魏琦麟, 等. 不同贮藏温度下稻花鸡肉的品质及细菌组成多样性变化[J]. 现代食品科技, 2023, 39(8): 112-123.DOI:10.13982/j.mfst.1673-9078.2023.8.1034.
[40] 麦栩滔, 王文卓, 郑宇航, 等. 不同包装方式对冷鲜鸡肉微生物菌群多样性的影响[J]. 食品工业科技, 2023, 44(13): 367-374.DOI:10.13386/j.issn1002-0306.2022090004.