肉色一直是评价肉类新鲜度和卫生状况的重要指标,直接影响着人们的购买抉择[1]。DFD(dark, firm,and dry)牛肉是一种极限pH值较高(pH>6.0)、外观呈暗紫红色的“劣质肉”,虽然该类牛肉具有良好的保水性和嫩度,但是颜色发黑、表面干燥且易发生腐败,因而消费者接受度较差[2],这类肉也通常被当作低端肉处理。此外,其熟制后的肉色也存在持续粉色(persistent pinking,PP)现象,即牛肉在熟至中心温度71.1 ℃全熟时,中心肉色仍然呈现熟制不充分的粉红色,这需要更长的熟制时间或者更高的熟制温度才能使其转变成全熟的棕褐色,过度熟制的同时也造成牛肉品质的降低。
诸多宰前因素,包括年龄、品种、性格、屠宰季节、待宰状态、运输时间、运输密度、禁食时间、待宰状态等控制不当,都会导致DFD牛肉的产生[3],虽然各国一直在努力避免DFD牛肉的产生或降低其发生率,但其依旧给全球带来严重的经济损失[4]。据调查,我国DFD牛肉平均发生率为10.07%[5],其中西南地区一些企业的DFD牛肉发生率甚至高达65.15%[6]。在我国产业和消费者层面,目前只是关注到了生鲜DFD肉的肉色问题,而DFD牛肉熟制时的PP现象鲜少被关注。随着我国牛肉西餐消费的兴起,这将是餐饮行业面临的一个技术难题。因此,本文综述生鲜和熟制DFD牛肉肉色的形成原因和影响因素,并进一步总结宰后肉色的控制措施,以期为DFD牛肉的利用和品质提升提供参考。
1 生鲜DFD牛肉肉色的形成原因及分子机制
肌红蛋白是动物宰后肌肉中的主要色素物质,通过吸收一定波长的光,使肉呈现不同颜色。肌红蛋白含量及其氧化还原状态是肉色的主要决定因素,而细胞色素等其他物质的存在对肉色影响较小[7]。肌红蛋白在生鲜肉中主要以氧合肌红蛋白(鲜红色)、脱氧肌红蛋白(紫红色)和高铁肌红蛋白(褐色)这3 种形式存在,一般来说,当pH值较低时,肌红蛋白对氧的亲和力较强;而当pH值较高时,肌红蛋白对氧的亲和力较弱。这是由于pH值的变化会改变肌红蛋白的电荷状态,从而影响氧分子与肌红蛋白的结合能力,因此DFD牛肉中肌红蛋白主要以脱氧肌红蛋白的状态存在[8-9]。另外,宰后较高的极限pH值导致肌肉内线粒体活性、肌肉保水性和肌肉晶格结构等生化和物理因素发生变化,这些变化从不同的方面促进DFD牛肉深紫红色的形成。
1.1 DFD牛肉中糖酵解潜能与肉色的关系
糖酵解过程是肉牛屠宰后使肌肉pH值从7.0左右降低到5.4~5.7的重要途径。动物屠宰放血后,机体逐渐进入缺氧状态,为了维持ATP的平衡,糖酵解途径被激活,肌糖原分解代谢由原来的有氧氧化转化为无氧酵解,产生H+,生成乳酸,降低肌肉pH值。Ijaz等[10]对比典型DFD牛肉(pH>6.09)、非典型DFD牛肉(5.70<pH≤6.09)和正常肉(pH<5.70)贮藏期间糖酵解能力,发现典型DFD牛肉的糖酵解能力显著低于正常牛肉和非典型牛肉。动物应激反应会造成体内血液和激素成分变化,间接导致肌肉糖原含量及葡萄糖、6-磷酸葡萄糖等能量物质含量的降低[11-12],当肌糖原含量低于0.6%时,宰后极限pH值不能下降到正常范围,造成较高的极限pH值[13]。有2 种机制会导致肉牛屠宰后糖酵解停止,一种是贮藏的肌糖原耗尽,另一种是肌肉pH值的下降使糖酵解酶的活性被抑制[14]。
Moeller等[15]报道了糖酵解能力和亮度值(L*)之间的正相关性,并表明糖酵解能力的提升增加了肌肉的酸性、L*和黄度值,从而抑制DFD牛肉的产生。有学者[16]通过体外实验尝试为宰后早期的高pH值肌肉提供过量的糖原,弥补糖原不足导致的糖酵解能力下降,以期降低肌肉pH值,但研究发现该处理并不能使肌肉的pH值降低到正常水平,这也说明了DFD牛肉糖酵解能力的缺失。因此,DFD牛肉较低的糖酵解能力通过影响极限pH值影响DFD牛肉肉色。
1.2 pH值对DFD牛肉线粒体活性的影响
线粒体的代谢活动可以消耗宰后肌肉中的氧气,降低肉中氧气浓度,使肌红蛋白维持在脱氧肌红蛋白状态,导致肉色变暗。氧合肌红蛋白到脱氧肌红蛋白的转化是一个需要线粒体耗氧促进高铁肌红蛋白形成、随后高铁肌红蛋白又在线粒体参与下被还原的过程,这2 个过程都需要足够的线粒体活性发挥作用[17]。DFD牛肉具有较高的pH值和较高的线粒体活性,且线粒体密度和氧气消耗率高于正常肉,这也说明其具有更高的代谢水平,从而促进酶的活性和电子的转移,以及高铁肌红蛋白的还原和氧气消耗。
1.2.1 氧气消耗速率(oxygen consumption rate,OCR)
在DFD牛肉中,高pH值可以防止动物宰后肌肉中线粒体活性的下降,因此,线粒体可以通过较高的OCR降低肉中氧分压,限制对肌红蛋白的供氧量。因为氧合肌红蛋白的形成既依赖于肉表面下氧的扩散量,也依赖于线粒体的OCR,所以与正常pH值的牛肉相比,DFD牛肉的肌红蛋白大多为脱氧肌红蛋白[17]。DFD牛肉较高的耗氧水平主要与其基因上调及多种蛋白酶丰度增加有关。Yu Qianqian等[18]研究发现,以氧化型纤维为主的牛腰大肌中脂肪酸β-氧化酶表达量比以糖酵解型纤维为主的背最长肌更高,说明基因ECHS1的上调使合成ATP时消耗的氧气增加。另外,DFD牛肉结构的紧密性阻止了表面氧气向组织内扩散,使肌肉内部的耗氧竞争更为激烈[19]。因此,DFD牛肉较高的耗氧速率是肌红蛋白主要以脱氧肌红蛋白状态存在的重要因素。
1.2.2 高铁肌红蛋白还原力(metmyoglobin reducing activity,MRA)
肌红蛋白还原活力是肉类在贮藏过程中延长颜色稳定性的重要内在特性。线粒体介导的MRA可以通过4 种不同的途径发生,包括电子传递、无氧环境、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)(还原性辅酶I)-依赖性还原酶活性和非酶介导的MRA。在肌红蛋白-线粒体混合物中加入琥珀酸盐,可通过细胞色素c促进线粒体细胞色素还原酶和细胞色素氧化酶之间电子传递链中有效电子向高铁肌红蛋白的转移,从而增加亚铁肌红蛋白的比例[20]。Tang Jiali等[21]发现,线粒体电子传递链调控的MRA会随着pH值的升高而提高,在pH 7.2、37 ℃时最大,它将电子从电子传递链运输至高铁肌红蛋白,从而将Fe3+还原为Fe2+。同时,Belskie等[22]将NAD+和琥珀酸添加到分离的牛肉线粒体中,通过逆向电子传递促进NADH的形成,又通过NADH-依赖性还原酶减少高铁肌红蛋白含量,转变为携带二价铁的脱氧肌红蛋白。Mohan等[23]报道,苹果酸脱氢酶的存在增加了牛肉还原性辅酶I的形成,增强了细胞的耗氧和高铁肌红蛋白的还原水平。因此,DFD牛肉中较高的线粒体活性导致的MRA也是促进DFD牛肉肉色形成的主要因素。
1.3 DFD牛肉中肌纤维结构与肉色的关系
肉色不仅由肌红蛋白的状态呈现,肌肉的微观结构(肌纤维、细胞骨架及与其他肌浆蛋白的相互作用)也影响肌肉对光线的吸收和散射,进而影响肉的表面色泽[24]。当光射向肉表面时,光在肌纤维间相互反射,在相邻2 条纤维间产生横向的反射周期,而微观结构的变化则会影响其反射周期和散射程度,进而影响肉色[25](图1)。
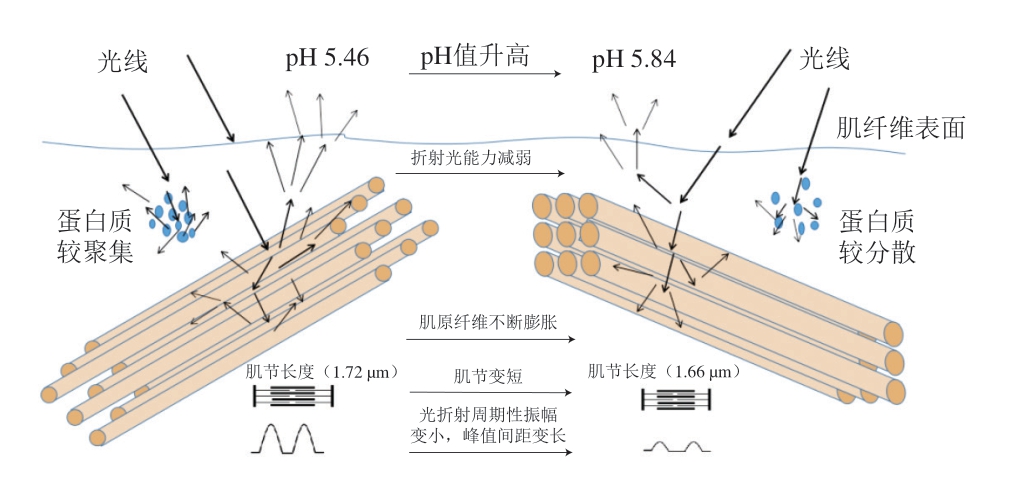
图1 极限pH值的不同对牛肉微观结构的影响
Fig. 1 Effects of different ultimate pH on the microstructure of beef
首先,极限pH值不同导致肌纤维结构和收缩程度存在差异,进而影响肌肉表面的光散射程度。Hughes等[25]发现,在高极限pH值的肉中,肌纤维膨胀,散射周期单元间距增加,这限制了光线的散射,使肉色较暗,而肌纤维周围环境pH值降低可以促进肌纤维的收缩,增加光的散射,从而使肉的亮度提高[26]。其次,DFD肉肌节比正常肉短[27],使A带中粗细肌丝的横向距离更长,导致A带密度减小,光散射程度也随之降低。同时Irving[28]、Hughes[25]等发现,随着pH值的升高,肌丝晶格的横向间距增大,肌节变短,肌浆蛋白活性升高,从而降低光散射。此外,高pH值牛肉的肌纤维微丝上存在一些聚集物,这些聚集物可能是肌联蛋白、伴肌动蛋白和细丝蛋白等细胞骨架蛋白降解的产物,而这些聚集物可能是导致DFD肉中肌纤维Z线不明显、折射率与正常肉存在差异的原因[29-30]。因此在高极限pH值肉中,肌丝晶格间距较大,蛋白密度降低,肌浆蛋白变性不明显,限制了DFD肉散射光线的能力,从而使肉的色泽变暗[25,27]。
1.4 DFD牛肉较高的持水能力与肉色的关系
肌肉的基本构成单元是肌纤维,肉中的大部分水存在于肌原纤维粗丝和细丝间的空间,而肌纤维的内部空间并不恒定,而是随pH值、肌节长度、离子强度、渗透压及肌肉的收缩舒张程度而变化[31]。由于DFD牛肉的极限pH值高于肌肉中主要蛋白质的等电点[32],肌肉中蛋白质不易发生凝聚,所以肌肉中的游离水渗出减少。同时,高pH值导致更宽的纤维间距和更小的肌节空间,使游离水流动性下降,最终造成DFD肉内部较高的持水能力[25,33],而肌肉中持有更多的水分则限制了光的散射,并有助于光线的深层渗透,从而使肉色看起来很暗[34]。肌纤维间存在更多的水分还阻碍氧气向牛肉内部的渗透和肌红蛋白发色,并维持较高的耗氧酶活性,从而使更多肌红蛋白处于脱氧肌红蛋白状态,使DFD肉色呈现暗紫色。
2 生鲜DFD牛肉肉色的改善措施
2.1 保鲜包装对生鲜DFD牛肉肉色的影响
2.1.1 气调包装(modified atmosphere packaging,MAP)MAP技术是将肉密封在装有混合气体的高阻隔材料中,MAP内的气体影响肌红蛋白的氧化还原反应和肉色,同时抑制微生物生长,延缓酶促反应,达到改善肉色和品质的效果。MAP可大致分为高氧MAP(HiOx-MAP,60%~80% O2+20%~40% CO2)、一氧化碳MAP(CO-MAP,0.4% CO+20%~30% CO2+N2)和低氧MAP(Lox-MAP,O2≤30%)。高氧环境促进氧合肌红蛋白的形成,含有80% O2/20% CO2的HiOx-MAP已被证明可以通过增加红度值(a*)和L*有效增强DFD牛肉的表面颜色[35-36]。然而,HiOx-MAP会刺激脂肪和蛋白质氧化,导致过早褐变,影响牛肉的风味、质地和颜色[37]。研究[38]表明,50% O2可以使正常pH值牛肉与80%氧气下贮藏的牛肉具有相似的肉色。Lu Xiao等[39]发现,60% O2和80% O2都能将DFD牛肉的颜色改善到与正常pH值牛肉的初始L*和a*相似的水平,60% O2-MAP牛肉的脂质氧化程度低于80% O2-MAP牛肉。Zhang Yimin等[40]研究发现,HiOx-MAP(80% O2+20% CO2)和CO-MAP(0.4% CO+30% CO2+69.6% N2)对高pH值牛肉肉色有相似的改善作用,均显著提高了牛肉的L*和a*。Mitacek等[41]同样采用0.4% CO-MAP,在货架展示6 d后发现DFD牛肉肉色得到明显改善。CO-MAP改善生鲜肉肉色的机理,一是CO与肌红蛋白结合可以形成鲜红的碳氧肌红蛋白,二是CO作为一种线粒体活性抑制剂,其可以抑制线粒体内膜上的线粒体细胞色素氧化酶活性,从而抑制线粒体呼吸作用,并且可以降低线粒体耗氧量,从而改善DFD牛肉的表面颜色[42]。但是,国内并没有明确规定COMAP的可用范围,因此该包装方法并未普及应用。
2.1.2 新型亚硝酸盐包装
新型亚硝酸盐包装是采用2 层薄膜,将亚硝酸盐包含其中,使其在包装后缓慢释放的包装方式。其作用机理是在接触鲜肉时,亚硝酸盐被还原为一氧化氮,一氧化氮与肌红蛋白上的亚铁血红素结合,从而形成亮红色的一氧化氮肌红蛋白,较高的肌肉pH值也会加速鲜红色一氧化氮肌红蛋白的形成[43]。Ramanathan等[44]研究发现,与普通聚氯乙烯(polyvinyl chloride,PVC)包装的DFD牛排相比,新型亚硝酸盐包装的牛排表面a*更高。同时发现,用迷迭香溶液浸泡牛排再结合亚硝酸盐薄膜包装比单独使用新型亚硝酸盐包装的改善效果更明显,然而3 种处理均未改善DFD牛排的L*。
2.2 乳酸处理对生鲜DFD牛肉肉色的影响
目前在国内,乳酸大多用于宰后胴体喷淋,通过降低胴体表面的pH值降低胴体表面初始菌数,最终延长产品的货架期[45]。另外,将乳酸通过注射的方式处理DFD牛肉,也可以改善其生鲜肉肉色。Apple[46]、Sawyer[47]等发现,注射质量分数为0.35%的乳酸可将DFD牛背最长肌pH值从6.77降低到5.99,并提高牛排表面的L*和a*,成功将DFD牛肉的鲜肉颜色从不受欢迎的深红色改为更吸引人的鲜红色。注射乳酸的作用是降低肉的pH值,从而抑制线粒体活性和改变肌红蛋白状态。同时,乳酸又可以增加乳酸脱氢酶活性,将乳酸转化为丙酮酸,并伴随NADH的再生,从而促进颜色的稳定性[17]。这种通过抑制线粒体活性促进颜色稳定性的协同作用,可能是乳酸改善DFD牛肉肉色的机制。
2.3 宰后成熟对生鲜DFD牛肉肉色的改善
成熟的条件(时间和方法)会影响细胞肌红蛋白氧化还原稳定性,从而影响肉色。同时,成熟也影响肌肉纤维的蛋白质水解,使肌肉保水性下降,进而增加反射率。成熟时间的延长会导致线粒体功能的下降和耗氧量的降低,使背最长肌牛排的肉色随成熟时间的延长而改善[48]。English等[9]发现,延长成熟时间至62 d可以显著提高DFD牛肉的L*。同时,成熟至42 d时,DFD牛肉的色泽有明显改善,但随着成熟时间的延长,发色后的氧合肌红蛋白比例显著减少。Ramanathan等[49]对比高pH值肉和正常pH值肉在PVC、HiOx-MAP和CO-MAP包装下成熟过程中的肉色变化,发现在成熟至21 d时,高pH值牛肉在HiOx-MAP和CO-MAP包装下a*均有所提高,但在PVC包装下a*下降;然而正常pH值牛肉成熟至21 d时,在所有包装下a*均会有不同程度的下降。适当延长成熟时间可以改善DFD牛肉肉色,但是过度延长成熟时间则对零售DFD牛肉的颜色稳定性不利。原因可能是随着成熟时间的延长,线粒体受损导致MRA的下降,使肉色稳定性随之降低[50]。
2.4 冰温对生鲜DFD牛肉肉色的改善
冰温贮藏是指将生鲜食品置于0 ℃以下、冻结点以上的温度范围内,使食品保持低温而不冻结的状态,卢骁[51]研究发现,牛肉的中心温度下降到-1.9~-2.1 ℃时会出现平台期,持续一段时间后温度会继续下降,由此可以确定牛肉的冰点温度处于平台期温度范围内。冰温贮藏会抑制线粒体活性,减少氧气消耗,从而加深氧气的渗透,增加肉表面的氧合肌红蛋白层厚度[52]。研究发现冰温贮藏可以保持高铁肌红蛋白还原酶活力[53],维持NADH含量[54],使肌肉在长期贮藏过程中维持较好的肉色[55]。Small等[56]研究发现,牛肉在-0.5 ℃条件下贮藏26 周后仍能保持新鲜的外观。Yang Xiaoyin等[57]对比在-1.5、4 ℃贮藏条件下12 d贮藏期内DFD牛肉的肉色稳定性,发现-1.5 ℃条件下a*显著高于4 ℃。冷冻条件会使牛肉内部的自由水冻结形成冰晶,这些冰晶会破坏细胞结构,加速肌纤维之间的分离,对肉色造成不利影响[58],而冰温贮藏能更好地维持贮藏期间牛肉的肉色稳定性[59]。
3 影响DFD牛肉PP现象的因素
3.1 DFD牛肉熟制后PP现象
DFD牛肉作为一种“问题肉”,不仅生鲜肉肉色与正常肉有区别,熟制后的中心肉色也与正常熟制牛肉有很大不同,该类肉熟制后肉色经常存在PP现象,即肉类加热至中心熟制温度(71.1 ℃)时,肉色仍然呈现红色或粉色,需要更高的温度或更长的熟制时间才能使其形成正常熟肉色泽的现象[60]。调查[61]认为,有50.1%的消费者会对汉堡肉饼熟制后中心仍存在红色或粉色感到恐惧和恶心,他们认为食用这种外观的肉饼存在被大肠杆菌等致病菌感染的风险。因而消费者往往会选择继续加热熟制,而过度熟制会造成产品嫩度和多汁性等食用品质的劣变。
3.2 影响DFD牛肉PP现象的因素
3.2.1 DFD牛肉肌红蛋白状态与PP现象的关系
熟肉的颜色主要取决于烹调前肌红蛋白的存在形式和热诱导下肌红蛋白变性程度[62]。研究表明,不同状态下肌红蛋白的热稳定性不同,即脱氧肌红蛋白>氧合肌红蛋白>高铁肌红蛋白。脱氧肌红蛋白的热稳定性在3 种肌红蛋白中最高,对热变性的抗性最强,即使在超过71 ℃的温度下,以脱氧肌红蛋白为主的肉饼内部颜色仍会呈现明显的粉红色。高铁肌红蛋白受热变性形成高铁血色原,使肉呈现熟肉的棕褐色,而氧合肌红蛋白和脱氧肌红蛋白热变性后均转化为亚铁血色原(粉色),但随着加热时间的延长,亚铁血色原最终会被氧化成高铁血色原。因此,肉类经充分熟制后会呈现熟肉的棕褐色。DFD牛肉中大量肌红蛋白以脱氧肌红蛋白形式存在,所以加热时肌红蛋白热变性较慢,加热至终点温度时易出现PP现象。
3.2.2 牛肉pH值与PP现象的关系
动物宰后pH值的下降速率和极限pH值不仅对生鲜肉肉色具有重要影响,也对牛肉熟制时3 种肌红蛋白的热稳定性有重要影响[63]。Hunt等[64]发现,高铁肌红蛋白、氧合肌红蛋白和脱氧肌红蛋白的热稳定性均随pH值的升高而增强。Moiseev等[65]也发现,高pH值(pH 6.6)牛肉饼在加热时,肌红蛋白的热变性程度较低,熟制后中心色泽a*大于正常pH值(pH 5.7)牛肉饼。Mancini等[66]在猪肉中也发现类似现象。同时,高pH值通过影响NADH依赖性还原酶和乳酸脱氢酶等与肌红蛋白相关的酶增加MRA,使熟制肉色变红[67]。因此DFD牛肉的高pH值是导致其PP现象的重要因素。
3.2.3 其他促进DFD牛肉PP现象的因素
除原料肉因素外,导致正常牛肉中脱氧肌红蛋白比例升高的其他因素也会使正常牛肉熟制后出现PP现象。真空包装的肉制品在贮藏过程中氧气消耗殆尽,肌红蛋白转变成不易热变性的脱氧肌红蛋白,CO-MAP包装和新型亚硝酸盐薄膜包装下,表面肌红蛋白形成更不易变性的碳氧肌红蛋白和氮氧肌红蛋白,均会导致熟制后出现PP现象[62]。这说明无氧包装条件会增加肉中脱氧肌红蛋白的比例,促进牛肉熟制后PP现象的发生。因而在DFD肉原料本身特点的基础上,无氧包装条件将会进一步促进其熟制后PP现象的出现。乳酸盐等通常会被添加到牛肉中增加保水性,但添加乳酸会导致乳酸脱氢酶活性升高,形成NADH[68],导致线粒体耗氧量增加,脱氧肌红蛋白比例升高。
不同部位的牛肉pH值也有所不同,冈上肌、臂股二头肌和半膜肌等pH值均在6.0左右,而腰大肌的pH值在5.7左右,导致熟制后的a*也不同[69]。其次,不同部位的肌纤维类型和肌红蛋白的含量不同,腰大肌制成的牛肉饼和牛排熟制后的内部颜色比背最长肌制成的肉饼和牛排更红[70-71],腰大肌牛排的I型肌纤维较多,肌红蛋白和线粒体含量明显高于背最长肌和半膜肌,这种肌红蛋白含量的不同也可能是导致不同部位熟制后肉色存在差异的原因之一[72]。
4 DFD牛肉熟制肉色的潜在改善措施
DFD牛肉熟制后的PP现象严重影响消费者的感官判断,降低产品感官品质。由于牛肉熟制前肉中肌红蛋白的化学状态会显著影响熟制后的色泽,一些将DFD牛肉脱氧肌红蛋白转变为氧合肌红蛋白的生鲜肉肉色改善措施可能会改善DFD牛肉熟制后的PP现象。
4.1 MAP
HiOx-MAP通过增加氧合肌红蛋白的比例改善生鲜DFD牛肉肉色,同时氧合肌红蛋白含量的增加增大了DFD牛肉的蛋白热变性程度,其熟制程度随之增加。Bao Yulong等[37]研究发现,当氧气含量从0%增加到80%时,煮熟的牛肉饼内部a*降低。Yang Xiaoyin等[57]在DFD牛肉上也验证了HiOx-MAP改善PP现象的可能性,DFD牛肉在80%氧气HiOx-MAP下贮藏第12天,氧气从四面向肉的内部渗透,形成约6 mm厚的氧合肌红蛋白层,将牛排熟制后,形成氧合肌红蛋白层的部分会变为正常的棕褐色,而牛肉内部未被氧气渗透的部分熟制后依旧呈现鲜红色的状态。
4.2 有机酸盐处理
乳酸和醋酸等常用的有机酸不仅对生鲜DFD肉的肉色有较好的改善效果,而且对DFD牛肉PP现象也具有较好的消除效果。高pH值会增加肌红蛋白的稳定性,而加入有机酸,如pH 2.5的柠檬酸,可以降低其pH值,促进肌红蛋白的热变性,从而降低熟制后的a*[73]。研究发现,对DFD牛排进行质量分数为1.6%的醋酸注射处理,熟制后的中心a*与正常牛排无显著差异。用质量分数为1%~2%的乳酸和醋酸注射DFD牛肉背最长肌切片,均可以有效改善熟制后的PP现象[47,74]。Moiseev等[65]发现,在用DFD牛肉制作的肉饼中添加微胶囊化的乳酸能显著提高肌红蛋白的变性程度,形成可接受的肉色。研究[43]表明,用质量分数为0.5%的葡萄糖酸-δ-内酯进行注射处理可降低DFD牛肉熟制后的内部a*,但对生鲜DFD牛肉肉色没有影响。研究[75]发现,通过注射三聚磷酸钠、氯化钙和柠檬酸钠的有机酸盐复配溶液,可以减少高pH值火鸡鸡胸肉的PP现象,但是该方法是否能改善DFD牛肉熟制肉色的PP现象则还需进一步研究。
4.3 调整熟制速率与保温时间
通常消费者在牛排熟制程度上有多种选择,熟制程度越低,牛排内部颜色越红,且伴有血红色的汁水,温度的升高会降低熟肉内部a*,棕褐色程度和变性肌红蛋白比例增加,红色或粉色程度降低[76-77]。除熟制温度对熟制后的肉色有重要影响外,熟制速率和保温处理也对肌红蛋白的变性速率有重要影响。有研究[78]表明,在65~87 ℃内,快速煎熟的肉饼比慢速煎熟的肉饼内部颜色更红,这可能是因为慢速煎熟的肉饼受热更均匀,导致更多的肌红蛋白变性。另外,快速煎至中心温度为71 ℃或76 ℃的肉饼,在终点温度下保温6 min后,其肌红蛋白变性程度更大,粉红色更少,内部肉色的a*最低[79]。对于pH值更高的DFD牛肉来说,熟制温度达到71.1 ℃后,中心的粉红色区域有时超过肉厚度的一半,是否有更直接、有效的方法改善更高pH值DFD肉严重的PP现象需要进一步研究。
5 结 语
随着消费者对产品品质及健康饮食的要求不断提高,我国DFD牛肉的高发生率已造成大量经济损失,其发生率的控制和宰后生鲜及熟制DFD牛肉肉色的改善已成为牛肉产业亟待解决的问题。在DFD牛肉形成过程中,宰后的糖酵解潜能、肌肉的保水性、肌纤维结构和线粒体活性等多重因素共同作用,造成DFD肉呈暗紫色。通过MAP、有机酸注射、宰后成熟条件的优化和线粒体活性的控制等合理加工处理可以有效改善生鲜DFD牛肉肉色,但不能完全有效改善其熟制肉色。因此,进一步研究DFD牛肉肉色形成机理,结合现代先进技术,开发既能改善生鲜DFD牛肉肉色又能改善其熟制后PP现象的技术将会有效改善DFD牛肉的肉色品质和加工特性。
[1] MANCINI R A, HUNT M C. Current research in meat color[J]. Meat Science, 2005, 71(1): 100-121. DOI:10.1016/j.meatsci.2005.03.003.
[2] CALKINS C R, HODGEN J M. A fresh look at meat flavor[J]. Meat Science, 2007, 77(1): 63-80. DOI:10.1016/j.meatsci.2007.04.016.
[3] 卢骁, 朱立贤, 毛衍伟, 等. DFD牛肉研究进展[J]. 食品科学, 2015,36(19): 271-276. DOI:10.7506/spkx1002-6630-201519049.
[4] PONNAMPALAM E N, HOPKINS D L, BRUCE H, et al. Causes and contributing factors to “dark cutting” meat: current trends and future directions: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2017, 16(3): 400-430. DOI:10.1111/1541-4337.12258.
[5] 赵群. 中国DFD牛肉发生率调研及肉牛宰前管理规范[D]. 泰安:山东农业大学, 2013.
[6] 明丹丹. 重庆地区DFD牛肉高发原因调查及控制技术的研究[D].泰安: 山东农业大学, 2016.
[7] YANG A, BREWSTER M J, LANARI M C, et al. Effect of vitamin E supplementation on α-tocopherol and β-carotene concentrations in tissues from pasture-and grain-fed cattle[J]. Meat Science, 2002, 60:35-40. DOI:10.1016/S0309-1740(01)00102-4.
[8] MAHMOOD S, ROY B C, LARSEN I L, et al. Understanding the quality of typical and atypical dark cutting beef from heifers and steers[J]. Meat Science, 2017, 133: 75-85. DOI:10.1016/j.meatsci.2017.06.010.
[9] ENGLISH A R, WILLS K M, HARSH B N, et al. Effects of aging on the fundamental color chemistry of dark-cutting beef[J]. Journal of Animal Science, 2016, 94(9): 4040-4048. DOI:10.2527/jas.2016-0561.
[10] IJAZ M, LI X, ZHANG D Q, et al. Association between meat color of DFD beef and other quality attributes[J]. Meat Science, 2019, 161:107954. DOI:10.1016/j.meatsci.2019.107954.
[11] HOLDSTOCK J, AALHUS J L, UTTARO B A, et al. The impact of ultimate pH on muscle characteristics and sensory attributes of the longissimus thoracis within the dark cutting (Canada B4) beef carcass grade[J]. Meat Science, 2014, 98(4): 842-849. DOI:10.1016/j.meatsci.2014.07.029.
[12] JEREZ-TIMAURE N, GALLO C, RAMÍREZ-REVECO A, et al.Early differential gene expression in beef longissimus thoracis muscles from carcasses with normal (5.9) ultimate pH[J]. Meat Science, 2019,153: 117-125. DOI:10.1016/j.meatsci.2019.03.013.
[13] MILLER M. Dark, fim and dry beef[R]. USA: National Cattlemen’s Beef Association, 2007.
[14] WULF D M, EMNETT R S, LEHESKA J M, et al. Relationships among glycolytic potential, dark-cutting (dark, firm, and dry) beef, and cooked beef palatability[J]. Journal of Animal Science, 2002, 80(7):1895-1903. DOI:10.2527/2002.8071895x.
[15] MOELLER S J, BAAS T J, LEEDS T D, et al. Rendement Napole gene effects and a comparison of glycolytic potential and DNA genotyping for classification of Rendement Napole status in Hampshire-sired pigs[J]. Journal of Animal Science, 2003, 81(2): 402-410. DOI:10.2527/2003.812402x.
[16] ENGLAND E M, MATARNEH S K, OLIVER E M, et al. Excess glycogen does not resolve high ultimate pH of oxidative muscle[J].Meat Science, 2016, 114: 95-102. DOI:10.1016/j.meatsci.2015.10.010.
[17] MANCINI R A, RAMANATHAN R. Molecular basis of meat color[M]//BISWAS A K, MANDAL P K. Meat quality analysis.Amsterdam: Elsevier, 2020: 117-129. DOI:10.1016/b978-0-12-819233-7.00008-2.
[18] YU Q Q, TIAN X J, SHAO L L, et al. Label-free proteomic strategy to compare the proteome differences between longissimus lumborum and psoas major muscles during early postmortem periods[J]. Food Chemistry, 2018, 269: 427-435. DOI:10.1016/j.foodchem.2018.07.040.
[19] HUGHES J M. The mechanism of colour development in beef muscle: the importance of scattering within the muscle structure[D].Queensland: Griffith University, 2018.
[20] TANG J L, FAUSTMAN C, HOAGLAND T A, et al. Postmortem oxygen consumption by mitochondria and its effects on myoglobin form and stability[J]. Journal of Agricultural and Food Chemistry,2005, 53(4): 1223-1230. DOI:10.1021/jf048646o.
[21] TANG J L, FAUSTMAN C, MANCINI R A, et al. Mitochondrial reduction of metmyoglobin: dependence on the electron transport chain[J]. Journal of Agricultural and Food Chemistry, 2005, 53(13):5449-5455. DOI:10.1021/jf050092h.
[22] BELSKIE K M, VAN BUITEN C B, RAMANATHAN R, et al.Reverse electron transport effects on NADH formation and metmyoglobin reduction[J]. Meat Science, 2015, 105: 89-92.DOI:10.1016/j.meatsci.2015.02.012.
[23] MOHAN A, HUNT M C, MUTHUKRISHNAN S, et al. Myoglobin redox form stabilization by compartmentalized lactate and malate dehydrogenases[J]. Journal of Agricultural & Food Chemistry, 2010,58(11): 7021-1029. DOI:10.1021/jf100714g.
[24] MACDOUGALL D B. Characteristics of the appearance of meat I.The luminous absorption, scatter and internal transmittance of the lean of bacon manufactured from normal and pale pork[J]. Journal of the Science of Food Agriculture, 1970, 21(11): 568-571. DOI:10.1002/jsfa.2740211107.
[25] HUGHES J, CLARKE F, LI Y, et al. Differences in light scattering between pale and dark beef longissimus thoracis muscles are primarily caused by differences in the myofilament lattice, myofibril and muscle fibre transverse spacings[J]. Meat Science, 2019, 149: 96-106.DOI:10.1016/j.meatsci.2018.11.006.
[26] HUGHES J, CLARKE F, PURSLOW P, et al. A high rigor temperature,not sarcomere length, determines light scattering properties and muscle colour in beef M. sternomandibularis meat and muscle fibres[J]. Meat Science, 2018, 145: 1-8. DOI:10.1016/j.meat sci.2018.05.011.
[27] HUGHES J, CLARKE F, PURSLOW P, et al. High pH in beef longissimus thoracis reduces muscle fibre transverse shrinkage and light scattering which contributes to the dark colour[J].Food Research International, 2017, 101: 228-238. DOI:10.1016/j.foodres.2017.09.003.
[28] IRVING T C, SWATLAND H J, MILLMAN B M. X-ray diffraction measurements of myofilament lattice spacing and optical measurements of reflectance and sarcomere length in commercial pork loins[J]. Journal of Animal Science, 1989, 67: 152-156. DOI:10.2527/jas1989.671152x.
[29] LOMIWES D, FAROUK M M, WU G, et al. The development of meat tenderness is likely to be compartmentalised by ultimate pH[J]. Meat Science, 2014, 96(1): 646-651. DOI:10.1016/j.meatsci.2013.08.022.
[30] YU L P, LEE Y B. Effects of postmortem pH and temperature muscle structure and meat tenderness[J]. Journal of Food Science, 1986, 51(3):774-780. DOI:10.1111/j.1365-2621.1986.tb13931.x.
[31] OFFER G, TRINICK J. On the mechanism of water holding in meat:the swelling and shrinking of myofibrils[J]. Meat Science, 1983, 8(4):245-281. DOI:10.1016/0309-1740(83)90013-X.
[32] FRETHEIM K, EGELANDSDAL B, HARBITZ O, et al. Slow lowering of pH induces gel formation of myosin[J]. Food Chemistry,1985, 18(3): 169-178. DOI:10.1016/0308-8146(85)90044-5.
[33] AALHUS J, ROBERTSON W M, YE J. Muscle fiber characteristics and their relation to meat quality[M]//DU P D, MCCORMICK R J.Applied muscle biology and meat science. Boca Raton: CRC Press,2009: 109-126. DOI:10.1201/b15797-9.
[34] HOLMAN B W B, MAO Y W, COOMBS C E O, et al. Relationship between colorimetric (instrumental) evaluation and consumer-defined beef colour acceptability[J]. Meat Science, 2016, 121: 104-106.DOI:10.1016/j.meatsci.2016.05.002.
[35] LÓPEZ-CAMPOS Ó, ZAWADSKI S, LANDRY S, et al. Packaging for retail appearance improvement of dark cutting beef[J]. Meat Science, 2014, 96(1): 121. DOI:10.1016/j.meatsci.2013.05.051.
[36] YANG X Y, WANG J, HOLMAN B W B, et al. Investigation of the physicochemical, bacteriological, and sensory quality of beef steaks held under modified atmosphere packaging and representative of different ultimate pH values[J]. Meat Science, 2020, 174: 108416.DOI:10.1016/j.meatsci.2020.108416.
[37] BAO Y L, PUOLANNE E, ERTBJERG P. Effect of oxygen concentration in modified atmosphere packaging on color and texture of beef patties cooked to different temperatures[J]. Meat Science,2016, 121: 189-195. DOI:10.1016/j.meatsci.2016.06.014.
[38] YANG X Y, NIU L B, ZHU L X, et al. Shelf-life extension of chillstored beef longissimus steaks packaged under modified atmospheres with 50% O2 and 40% CO2[J]. Journal of Food Science, 2016, 81(7):C1692-C1698. DOI:10.1111/1750-3841.13345.
[39] LU X, CORNFORTH D P, CARPENTER C E, et al. Effect of oxygen concentration in modified atmosphere packaging on color changes of the M. longissimus thoraces et lumborum from dark cutting beef carcasses[J]. Meat Science, 2019, 161: 107999. DOI:10.1016/j.meatsci.2019.107999.
[40] ZHANG Y M, QIN L B, MAO Y W, et al. Carbon monoxide packaging shows the same color improvement for dark cutting beef as high oxygen packaging[J]. Meat Science, 2018, 137: 153-159.DOI:10.1016/j.meatsci.2017.11.016.
[41] MITACEK R M, ENGLISH A R, MAFI G G, et al. Modified atmosphere packaging improves surface color of dark-cutting beef[J]. Meat and Muscle Biology, 2018, 2(1): 57-63. DOI:10.22175/mmb2017.04.0023.
[42] COOPER C E, BROWN G C. The inhibition of mitochondrial cytochrome oxidase by the gases carbon monoxide, nitric oxide,hydrogen cyanide and hydrogen sulfide: chemical mechanism and physiological significance[J]. Journal of Bioenergetics Biomembranes,2008, 40(5): 533-539. DOI:10.1007/s10863-008-9166-6.
[43] DENZER M L, MAFI G G, VANOVEREBEKE D L, et al. Effects of glucono δ-lactone enhancement and nitrite-embedded packaging on fresh color, cooked color, and sensory attributes of dark-cutting beef[J]. Applied Food Research, 2022, 2(2): 100189. DOI:10.1016/j.afres.2022.100189.
[44] RAMANATHAN R, MITACEK R M, BILLUPS S D, et al. Novel nitrite-embedded packaging improves surface redness of dark-cutting longissimus steaks[J]. Translational Animal Science, 2018, 2(2): 135-143. DOI:10.1093/tas/txy006.
[45] CARPENTER C E, SMITH J V, BROADBENT J R. Efficacy of washing meat surfaces with 2% levulinic, acetic, or lactic acid for pathogen decontamination and residual growth inhibition[J]. Meat Science, 2011, 88(2): 256-260. DOI:10.1016/j.meatsci.2010.12. 032.
[46] APPLE J K, SAWYER J T, MEULLENET J F, et al. Lactic acid enhancement can improve the fresh and cooked color of darkcutting beef[J]. Journal of Animal Science, 2011, 89(12): 4207-4220.DOI:10.2527/jas.2011-4147.
[47] SAWYER J T, APPLE J K, JOHNSON Z B, et al. Fresh and cooked color of dark-cutting beef can be altered by post-rigor enhancement with lactic acid[J]. Meat Science, 2009, 83(2): 263-270. DOI:10.1016/j.meatsci.2009.05.008.
[48] LEE M S, APPLE J K, YANCEY J W S, et al. Influence of vacuumaging period on bloom development of the beef gluteus medics from top sirloin butts[J]. Meat Science, 2008, 80(3): 592-598. DOI:10.1016/j.meatsci.2008.02.006.
[49] RAMANATHAN R, HUNT M C, ENGLISH A R, et al. Effects of aging, modified atmospheric packaging, and display time on metmyoglobin reducing activity and oxygen consumption of high-pH beef[J]. Meat and Muscle Biology, 2019, 3(1): 276-298.DOI:10.22175/mmb2019.05.0017.
[50] LINDAHL G. Colour stability of steaks from large beef cuts aged under vacuum or high oxygen modified atmosphere[J]. Meat Science,2011, 87(4): 428-435. DOI:10.1016/j.meatsci.2010.10.023.
[51] 卢骁. 微冻贮藏和气调包装对牛肉品质的影响及其机制探究[D].泰安: 山东农业大学, 2020.
[52] MANCINI R A, RAMANAHAN R. Effects of postmortem storage time on color and mitochondria in beef[J]. Meat Science, 2014, 98(1):65-70. DOI:10.1016/j.meatsci.2014.04.007.
[53] BEKHIT A E D, FAUSTMAN C. Metmyoglobin reducing activity[J]. Meat Science, 2005, 71(3): 407-439. DOI:10.1016/j.meatsci.2005.04.032.
[54] LI X, ZHANG Y, LI Z, et al. The effect of temperature in the range of-0.8 to 4 ℃ on lamb meat color stability[J]. Meat Science, 2017, 121:365-374. DOI:10.1016/j.meatsci.2017.07.010.
[55] 张艳. 冰温技术调控羊肉肉色稳定性及蛋白质磷酸化水平的研究[D].西安: 陕西师范大学, 2016.
[56] SMALL A H, JENSON I, KIERMEIER A, et al. Vacuum-packed beef primals with extremely long shelf life have unusual microbiological counts[J]. Journal of Food Protection, 2012, 75(8): 1524-1527.DOI:10.4315/0362-028X.JFP-12-042.
[57] YANG X Y, ZHANG Y, LUO X, et al. Influence of oxygen concentration on the fresh and internal cooked color of modified atmosphere packaged dark-cutting beef stored under chilled and superchilled conditions[J]. Meat Science, 2022, 188: 108773.DOI:10.1016/j.meatsci.2022.108773.
[58] COOMBS C E O, HOLMAN B W B, FRIEND M A, et al. Long-term red meat preservation using chilled and frozen storage combinations:a review[J]. Meat Science, 2016, 125: 84-94. DOI:10.1016/j.meatsci.2016.11.025.
[59] LU X, ZHANG Y, ZHU L, et al. Effect of superchilled storage on shelf life and quality characteristics of M. longissimus lumborum from Chinese Yellow cattle[J]. Meat Science, 2019, 149: 79-84.DOI:10.1016/j.meatsci.2018.11.014.
[60] 梁荣蓉, 张一敏, 毛衍伟, 等. 熟制牛肉肉色问题和影响因素研究进展[J]. 食品科学, 2019, 40(15): 285-292. DOI:10.7506/spkx1002-6630-20180731-376.
[61] OLSEN N V, SCHOLDERER J, LANGSRUD S, et al. Hamburger hazards and emotions[J]. Appetite, 2014, 78: 95-101. DOI:10.1016/j.appet.2014.03.007.
[62] SUMAN S P, NAIR M N, JOSEPH P, et al. Factors influencing internal color of cooked meats[J]. Meat Science, 2016, 120: 133-144.DOI:10.1016/j.meatsci.2016.04.006.
[63] BRISKEY E J, CASSENS R G, TRAUTMAN J C. The physiolocy and biochemistry of muscle as a food[J]. American Journal of the Medical Sciences, 1967, 253(5): 150-151. DOI:10.1097/00000441-196705000-00028.
[64] HUNT M C, SRHEIM O, SLINDE E. Color and heat denaturation of myoglobin forms in ground beef[J]. Journal of Food Science, 1999,64(5): 847-851. DOI:10.1111/j.1365-2621.1999.tb15925.x.
[65] MOISEEV I V, CORNFORTH D P. Treatments for prevention of persistent pinking in dark-cutting beef patties[J]. Journal of Food Science, 1999, 64(4): 738-743. DOI:10.1111/j.1365-2621.1999.tb15122.x.
[66] MANCINI R A, KROPF D H, HUNT M C, et al. Effects of endpoint temperature, pH, and storage time on cooked internal color reversion of pork longissimus chops[J]. Journal of Muscle Foods, 2005, 16(1):16-26. DOI:10.1111/j.1745-4573.2004.07103.x.
[67] DJIMSA B A, ABRAHAM A, MAFI G G, et al. Effects of metmyoglobin reducing activity and thermal stability of NADHdependent reductase and lactate dehydrogenase on premature browning in ground beef[J]. Journal of Food Science, 2017, 82(2): 304-313.DOI:10.1111/1750-3841.13606.
[68] YUAN H K, MELVIN C H, RICHARD A M, et al. Mechanism for lactate-color stabilization in injection-enhanced beef[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7856-7862.DOI:10.1021/jf061225h.
[69] 保善科, 张丽, 孔祥颖, 等. 不同部位高原牦牛肉品质评价[J].畜牧兽医学报, 2015, 46(3): 388-394. DOI:10.11843/j.issn.0366-6964.2015.03.006.
[70] SUMAN S P, FAUSTMAN C, LEE S, et al. Effect of erythorbate,storage and high-oxygen packaging on premature browning in ground beef[J]. Meat Science, 2005, 69(2): 363-369. DOI:10.1016/j.meatsci.2004.08.008.
[71] SUMAN S P, MANCINI R A, RAMANATHAN R, et al. Effect of lactate-enhancement, modified atmosphere packaging, and muscle source on the internal cooked colour of beef steaks[J]. Meat Science,2009, 81(4): 664-670. DOI:10.1016/j.meat sci.2008.11.007.
[72] HWANG Y H, KIM G D, JEONG J Y, et al. The relationship between muscle fiber characteristics and meat quality traits of highly marbled Hanwoo (Korean native cattle) steers[J]. Meat Science, 2010, 86(2):456-461. DOI:10.1016/j.meatsci.2010.05.034.
[73] STACKHOUSE R J, APPLE J K, YANCEY J W, et al. Postrigor citric acid enhancement can alter cooked color but not fresh color of darkcutting beef[J]. Journal of Animal Science, 2016, 94(4): 1738-1754.DOI:10.2527/jas.2015-0181.
[74] GRIFFING D, CHRISTJOHN C, BRATCHER C. Effects of acetic acid on dark cutting beef[J]. Meat Muscle Biology, 2017, 1(3): 31.DOI:10.22175/rmc2017.029.
[75] SAMMEL L M, CLAUS J R. Calcium chloride and tricalcium phosphate effects on the pink color defect in cooked ground and intact turkey breast[J]. Meat Science, 2007, 77(4): 492-498. DOI:10.1016/j.meatsci.2007.04.025.
[76] RYAN S M, SEYFERT M, HUNT M C, et al. Influence of cooking rate,endpoint temperature, post-cook hold time, and myoglobin redox state on internal color development of cooked ground beef patties[J]. Journal of Food Science, 2006, 71: C216-C221. DOI:10.1111/j.1365-2621.2006.tb15620.x.
[77] JOHN L, CORNFORTH D P, CARPENTER C E, et al. Comparison of color and thiobarbituric acid values of cooked hamburger patties after storage of fresh beef chubs in modified atmospheres[J]. Journal of Food Science, 2004, 69(8): C608-C614. DOI:10.1111/j.1365-2621.2004.tb09908.x.
[78] RYAN S M, SEYFERT M, HUNT M C, et al. Color of cooked ground beef patties is affected by cooking rate and post-cooking holding time[J]. Kansas Agricultural Experiment Station Research Reports,2006, 1: 63-65. DOI:10.4148/2378-5977.1577.
[79] DOMINGUEZ-HERNANDEZ E, SALASEVICIENE A, ERTBJERG P.Low-temperature long-time cooking of meat: eating quality and underlying mechanisms[J]. Meat Science, 2018, 143: 104-113.DOI:10.1016/j.meatsci.2018.04.032.