我国是全球肉类产销总量最大的国家,国际肉类组织统计数据显示,我国畜禽肉类生产量约占全世界生产总量的27%,其中羊肉约占总量的26%[1]。羊肉具有高蛋白、低脂肪、富含多种微量元素等优点,因其营养丰富、肉质醇香,常被作为滋补养身的食品[2]。在众多羊肉产品中,羊肉卷作为火锅等的必备食材,市场需求量大,深受消费者青睐。冻藏是羊肉卷在运输与售卖过程中的主要贮藏方式,羊肉卷冻藏品质受冷冻方式和冻结速率影响,而且随着冻藏时间的延长,羊肉卷会出现蛋白变性、脂肪氧化、色泽与风味劣变等现象[3]。其中色泽劣变主要表现为表面氧化变色,即由原本的淡红色逐渐变为黑褐色,影响消费者的购买欲望。因此,探究羊肉卷冻藏期间色泽劣变原因、蛋白氧化与变性情况等对于羊肉卷色泽保鲜具有重要意义。
肌红蛋白作为影响肉品色泽的主要蛋白之一,由多肽链和血红素基团组成,多肽链为一个已知序列的氨基酸残基,具有紧凑的天然折叠状态,血红素的中心铁原子与卟啉环的4 个氮原子结合,肌红蛋白的这种组成结构对肉品色泽具有重要影响[4]。羊肉卷色泽取决于肌肉中肌红蛋白含量和氧化还原状态。肌红蛋白一般有氧合肌红蛋白(oxymyoglobin,OxyMb)、脱氧肌红蛋白(deoxymyoglobin,DeoMb)和高铁肌红蛋白(methemoglobin,MetMb)3 种状态,分别呈现鲜红色、暗红色和褐色,肌红蛋白3 种状态的比例在一定程度上决定肉色[5]。本研究系统分析冻藏(-20 ℃)条件下羊肉卷色泽变化规律,以及脂肪氧化、肌红蛋白氧化与结构变化等,探究羊肉卷色泽劣变原因,以期为肉品色泽保鲜提供理论依据。
1 材料与方法
1.1 材料与试剂
原切羊肉卷(260 g/盒,共计10 盒,配料表中只包含羊肉,执行标准GB 2707—2016《食品安全国家标准 鲜(冻)畜、禽产品》)由安徽惠之园食品有限公司提供。
十二水合磷酸氢二钠、二水合磷酸二氢钠、三氯乙酸、盐酸胍、硫酸铵、乙酸乙酯、牛血清蛋白(bovine serum albumin,BSA)-V、Tris-HCl、尿素、十二烷基硫酸钠、乙二胺四乙酸、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)、2,4-二硝基苯肼(dinitrophenylhydrazine,DNPH)(均为分析纯) 北京索莱宝科技有限公司。
1.2 仪器与设备
YP6001N电子天平、AL-204 Mettler Toledo分析天平上海精密科学仪器有限公司;T6可见分光光度计 北京普析通用仪器有限责任公司;FA25均质机 上海弗鲁克科技发展有限公司;ZE7700色差仪 日本电色工业株式会社;HEM酶标仪 美国伯乐公司;F-7100荧光光谱仪、UH-5300紫外光谱仪 日本日立公司;VERTEX 70傅里叶变换红外(Fourier transform infrared,FTIR)光谱仪 美国铂金埃尔默公司。
1.3 方法
1.3.1 样品处理
原切羊肉卷由薄膜覆盖的透明塑料盒包装,装入预先放置有冰袋的保温箱运回实验室,放入-20 ℃冰箱贮藏,每隔1 个月取出1 盒羊肉卷,每次实验取3 组平行样品,每组样品测定3 次,取平均值。
1.3.2 羊肉卷色泽测定
采用色差仪测定羊肉卷亮度值(L*)、红度值(a*)、黄度值(b*)。测定前,使用配套的黑井和白板校准调零,调整测试口径为6 mm,近似观察角为10°,测定波长范围为400~700 nm,采用白色LED标准光源对羊肉卷样品进行测定,选取肉样表面8 个不同位点,每组样品扫描3 次并取平均值。
1.3.3 肌红蛋白提取
参照Zheng Zhenxiao等[6]的方法并稍作修改,取羊肉卷切碎,准确称取5 g肉样,加入20 mL磷酸盐缓冲液(pH 7,200 mmol/L,4 ℃),10 000 r/min匀浆1 min,4 ℃避光静置1 h,在8 000×g、4 ℃离心10 min,经滤纸过滤得到上清液,即为肌红蛋白粗提物。随后进行硫酸铵(饱和度90%)分馏,将沉淀溶解于适量(能溶解沉淀的最小体积)Tris-HCl缓冲液(5 mmol/L、pH 8.5),4 ℃下透析(截留分子质量8 000~14 000 Da)24 h,期间缓冲液更换10 次,收集样品。
1.3.4 蛋白质量浓度测定
参考孙程涛等[7]的方法并稍作修改。以BSA作为标准品,使用双缩脲法测定蛋白质量浓度。取1 mL 1.3.3节肌红蛋白溶液,加入4 mL双缩脲试剂,混匀并在室温下静置30 min,测定540 nm处的吸光度,根据标准曲线方程(y=0.038 4x+0.046 2(R2=0.999),y为吸光度,x为蛋白质量浓度/(mg/mL))计算肌红蛋白质量浓度,每组样品测定3 次并计算平均值。
1.3.5 肌红蛋白相对含量测定
参考张同刚等[8]的方法,使用分光光度计测定肌红蛋白上清液在525、545、565、572 nm处的吸光度,OxyMb、DeoMb和MetMb相对含量按式(1)~(3)计算:

式中:![]() 。
。
1.3.6 总巯基含量测定
根据Cui Chun等[9]的方法并稍作修改。取4 mL 2 mg/mL肌红蛋白溶液加入4.5 mL缓冲溶液(0.2 mol/L Tris-HCl、8 mol/L尿素、1 g/100 mL十二烷基硫酸钠、3 mmol/L乙二胺四乙酸)中,随后加入0.5 mL Ellman溶液(0.2 mol/L Tris-HCl、2 mmol/L DTNB、pH 8),将混合物在4 ℃下静置反应15 min,取上清液用酶标仪测定412 nm处的吸光度,按式(4)计算总巯基含量:
式中:A412 nm为样品吸光度;d为肌红蛋白稀释倍数;ρp为肌红蛋白质量浓度/(mg/mL);ε为摩尔消光系数(13 600(L/(mol·cm)))。
1.3.7 羰基含量测定
根据Soglia等[10]的方法稍作修改。取1 mL 2 mg/mL肌红蛋白溶液与0.5 mL 10 mmol/L DNPH溶液在室温下反应1 h,每隔15 min振荡一次,随后加入0.5 mL 20 g/100 mL三氯乙酸,混合静置10 min。另一份肌红蛋白溶液加入等体积的2 mol/L HCl代替DNPH溶液作为空白对照组。然后将混合物离心(4 000×g、10 min、4 ℃)并收集沉淀。在沉淀物中加入1 mL乙醇-乙酸乙酯(1∶1,V/V)混合物,洗涤并按上述条件离心,重复3 次,去除过量的DNPH。最后将肌红蛋白沉淀物在37 ℃下溶于3 mL 6 mol/L盐酸胍溶液,静置15 min,用酶标仪测定溶液在370 nm处的吸光度,按式(5)计算羰基含量:
式中:A1为样品吸光度;A0为空白对照组吸光度;ρp为肌红蛋白质量浓度/(mg/mL)。
1.3.8 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值测定
参考GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》中的分光光度法测定羊肉卷TBARS值。
1.3.9 血红素铁卟啉Soret带测定
参考Benjakul等[11]的方法,使用紫外光谱仪测定肌红蛋白溶液的Soret带。测定360~440 nm范围的吸光度,扫描速率1 000 nm/min,以磷酸盐缓冲液(0.04 mol/L、pH 6.8)作为空白对照。
1.3.10 FTIR光谱测定
使用FTIR光谱仪测定肌红蛋白二级结构。分散介质为去离子水,红外光谱扫描范围400~4 000 cm-1,采用Peakfit 4.12软件对1 600~1 700 cm-1之间的数据进行高斯拟合,计算出α-螺旋、β-折叠、β-转角和无规卷曲相对含量[12]。
1.3.11 荧光光谱测定
参考马君燕等[13]的方法,使用荧光光谱仪测定肌红蛋白溶液的荧光光谱。激发波长280 nm,扫描速率1 000 nm/min,狭缝宽度固定为10 nm,扫描200~900 nm范围的发射光谱。所有测定均在室温(20 ℃)下进行。
1.4 数据分析
数据使用SPSS 19.0进行方差分析和邓肯多重范围检验,并使用Origin 2024绘制图表。
2 结果与分析
2.1 冻藏时间对羊肉卷色泽的影响
随着冻藏时间的延长,羊肉卷色泽由鲜红色变为暗褐色,从冻藏2 个月开始表现出明显的色泽劣变。如表1所示,冻藏期间羊肉卷L*呈现下降的趋势,冻藏2~4 个月L*下降显著(P<0.05),这可能是由于羊肉卷肌肉间水分流失,光的反射率随之降低[14]。肉类中黄色素的出现与脂质氧化产物、蛋白质或磷脂头部基团的胺非酶促褐变反应有关[15-16]。羊肉卷b*随着冻藏时间的延长稍有升高,但总体变化表现出稳定趋势,这可能是因为羊肉卷在低温下脂肪氧化缓慢。冻藏前2 个月羊肉卷a*未发生显著变化(P>0.05),随着冻藏时间的延长,冻藏6 个月的a*相较于初始值下降59.8%,冻藏2~5 个月羊肉卷a*显著降低(P<0.05),随后下降趋于缓慢,a*下降的主要原因是肌红蛋白自氧化导致MetMb含量增加。综上所述,冻藏6 个月中,前2 个月羊肉卷色泽几乎无变化,随着冻藏时间的延长,L*和a*显著下降,且在冻藏2~4 月下降趋势明显,之后下降趋于缓慢,b*略有升高并基本保持稳定,这表明羊肉卷色泽稳定性从冻藏2 个月开始发生明显变化,冻藏5 个月时达到基本稳定状态。
表1 冻藏过程中羊肉卷L*、a*、b*变化
Table 1 Changes in L*, a*, and b* of lamb rolls during frozen storage
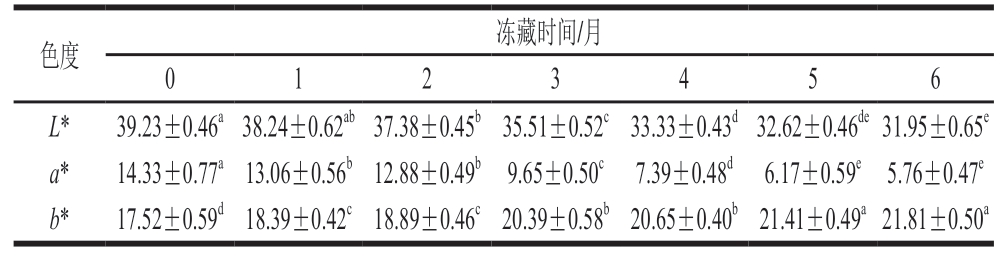
注:同行小写字母不同表示差异显著(P<0.05)。
色度冻藏时间/月0 1 2 3 56 L*39.23±0.46a38.24±0.62ab37.38±0.45b35.51±0.52c33.33±0.43d32.62±0.46de31.95±0.65e a*14.33±0.77a13.06±0.56b12.88±0.49b9.65±0.50c7.39±0.48d6.17±0.59e5.76±0.47e b*17.52±0.59d18.39±0.42c18.89±0.46c20.39±0.58b20.65±0.40b21.41±0.49a21.81±0.50a 4
2.2 冻藏时间对羊肉卷肌红蛋白相对含量的影响
OxyMb、DeoMb和MetMb 3 种状态肌红蛋白的比例在一定程度上决定肉的色泽[17]。如图1所示,随着冻藏时间的延长,羊肉卷OxyMb相对含量呈降低趋势、DeoMb相对含量无显著变化、MetMb相对含量呈升高趋势。具体而言,OxyMb相对含量在冻藏前期基本保持不变,冻藏2 个月后才发生显著降低(P<0.05),在冻藏5~6 个月变化趋于平缓,这可能是由于OxyMb在有氧环境下不可逆地被氧化为MetMb[18];此外,长时间冻藏使羊肉卷pH值发生变化,肌肉细胞环境改变,OxyMb难以形成[19]。MetMb相对含量在冻藏0~2、5~6 个月无显著变化(P>0.05),冻藏2~4 个月显著升高(P<0.05)。冻藏结束时,MetMb相对含量增加至27.1%。随着冻藏时间的延长,OxyMb被氧化为MetMb,但MetMb还原为OxyMb和DeoMb需要一定的条件,如能量、特定环境等[20],MetMb相对含量升高是羊肉卷由鲜红色变为暗褐色的重要原因,这与羊肉卷a*结果相符合。
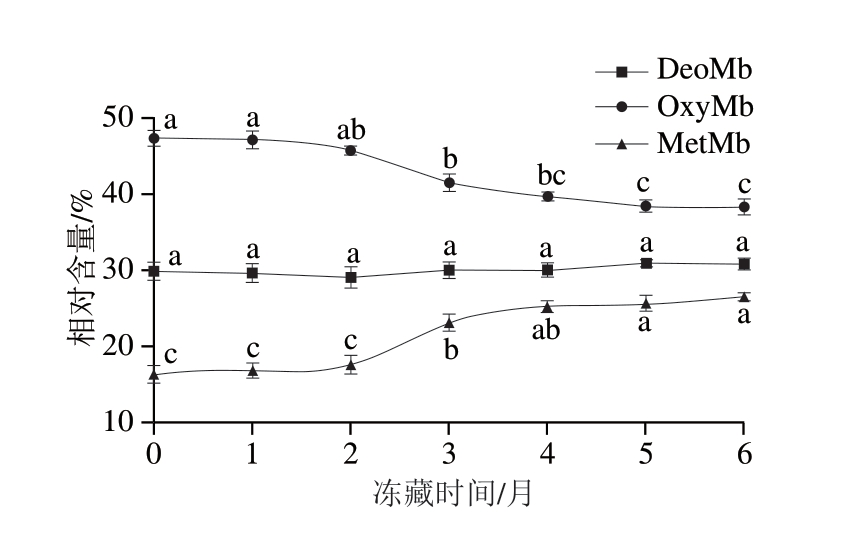
图1 冻藏过程中羊肉卷肌红蛋白相对含量变化
Fig. 1 Change in relative content of myoglobin in lamb rolls during frozen storage
小写字母不同表示不同时间差异显著(P<0.05)。图2~4、6同。
2.3 冻藏时间对羊肉卷总巯基含量的影响
在冻藏期间,羊肉卷中的肌红蛋白易受活性氧攻击,肌红蛋白氧化在肉品色泽劣变过程中起到重要作用,总巯基含量变化可以反映蛋白氧化程度[21]。如图2所示,在冻藏1 个月内,总巯基含量未发生显著变化,随后总巯基含量显著降低(P<0.05),在冻藏5~6 个月变化趋于平缓。整个冻藏期间,总巯基含量从最初的5.11 μmol/mg降低至1.74 μmol/mg,降低65.9%。总巯基含量减少主要是由于蛋白质表面巯基被氧化形成二硫键等氧化衍生物,进而改变肌红蛋白结构,导致肉品色泽劣变等品质劣变问题[22-23]。此外,肌红蛋白氧化与脂肪氧化存在正相关性,脂肪氧化初级和次级产物可加快蛋白氧化速率[24]。
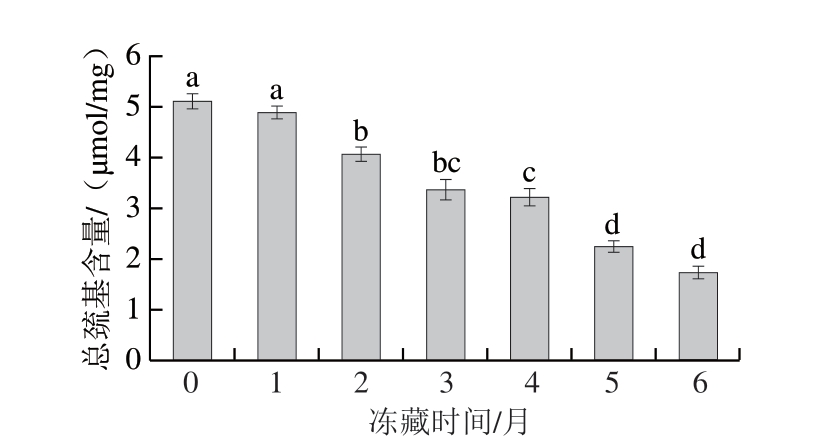
图2 冻藏过程中羊肉卷总巯基含量变化
Fig. 2 Change in total sulfhydryl content of lamb rolls during frozen storage
2.4 冻藏时间对羊肉卷羰基含量的影响
蛋白质羰基化是指肉品脂肪氧化产生的自由基和醛类化合物等与蛋白质中的氨基酸发生反应,蛋白质羰基化反应加剧会导致蛋白质聚集、肽键断裂和氨基酸侧链断裂等,严重影响肉的品质[25]。如图3所示,随着冻藏时间的延长,羊肉卷羰基含量先保持不变,冻藏2~5 个月,羰基含量显著升高(P<0.05),冻藏5 个月后变化趋于稳定。冻藏结束时,羰基含量增加2.15 倍。随着冻藏时间的延长,羊肉卷中的蛋白质和脂肪发生氧化反应,形成醛、酮等羰基化合物,导致羰基含量增加。另外,MetMb相对含量的增加也可促进蛋白羰基化反应的发生,进一步升高羰基含量。
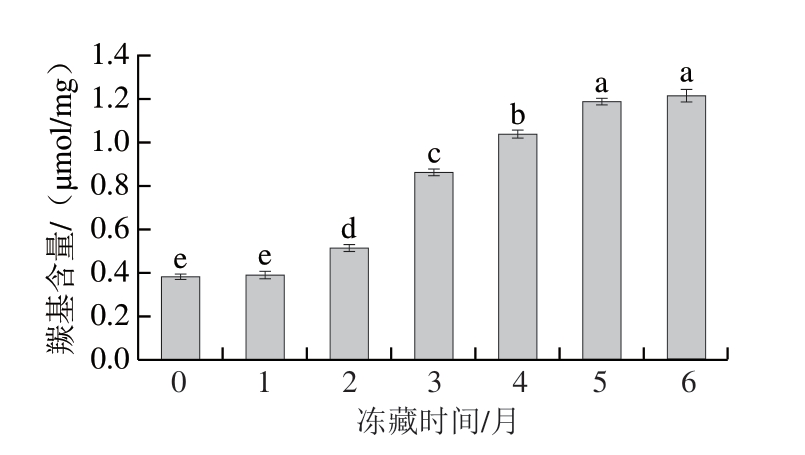
图3 冻藏过程中羊肉卷羰基含量变化
Fig. 3 Change in carbonyl content of lamb rolls during frozen storage
2.5 冻藏时间对羊肉卷TBARS值的影响
TBARS值表示能与硫代巴比妥酸反应的醛类物质的含量,这些醛类物质是脂肪氧化反应过程中产生并积累的次级代谢产物,TBARS值被广泛用于衡量脂肪氧化程度[26]。在冻藏过程中,羊肉卷中的不饱和脂肪酸与氧分子之间发生相互作用,产生不稳定的初级氧化产物,在后续反应中这些初级氧化产物可能进一步分解为更加复杂的次级氧化产物,如丙二醛等。脂肪氧化程度与温度相关,一般情况下,温度越低,脂肪氧化速率越慢[27]。如图4所示,羊肉卷初始TBARS值为0.16 mg/kg,冻藏1 个月时无显著变化,表明此时脂肪氧化水平相对较低。冻藏2~5 个月,TBARS值显著升高(P<0.05),随后增长趋于平缓。整个冻藏期间,TBARS值增加30.6%。TBARS值的升高与肌红蛋白总巯基含量降低在时间上较为一致,这与脂肪氧化导致蛋白质硫醇含量降低有关[28]。值得注意的是,脂肪氧化会导致肉品色泽发生变化,这是因为脂肪氧化产生的初级和次级产物会促进肌红蛋白氧化,脂肪氧化的特定产物如α、β不饱和醛等能够促使OxyMb氧化为MetMb[29],使羊肉卷发生褐变,这与羊肉卷MetMb相对含量变化趋势相符合。
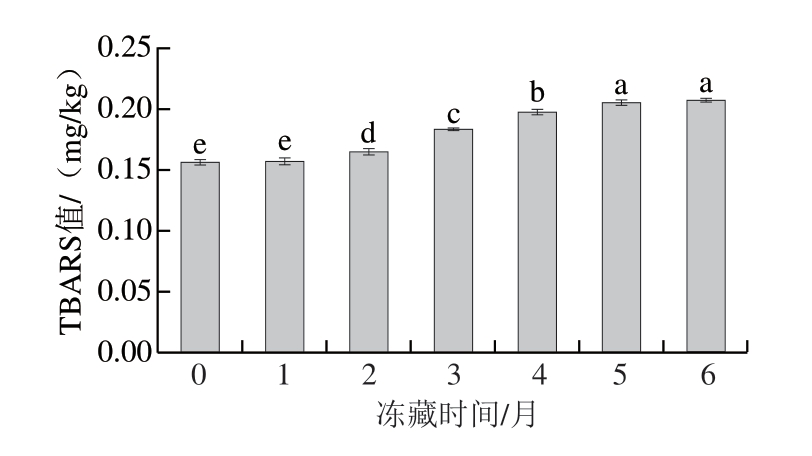
图4 冻藏过程中羊肉卷TBARS值变化
Fig. 4 Change in TBARS value of lamb rolls during frozen storage
2.6 冻藏时间对羊肉卷血红素铁卟啉Soret带的影响
血红素铁卟啉是肌红蛋白和其他血红素蛋白的核心组成部分,是由中心铁离子和4 个卟啉环组成的平面结构,血红素铁卟啉的Soret带可以反映血红素蛋白结构展开情况[30]。如图5所示,血红素铁卟啉的吸收峰在413 nm处,随着冻藏时间的延长,吸收峰强度逐渐降低,在冻藏2~5 个月下降较为明显。吸收峰大幅降低表明血红素蛋白遭到破坏或卟啉从珠蛋白中分离[31],因此,血红素蛋白在冻藏期间可能发生降解,进而影响羊肉卷色泽。此外,在贮藏后期的羊肉卷中观察到Soret带吸收峰由413 nm处向411 nm处发生轻微蓝移,其原因可能是血红素蛋白被氧化,OxyMb转变为MetMb。综上所述,血红素蛋白可能同时发生降解和氧化,进而导致羊肉卷冻藏期间色泽劣变[32]。
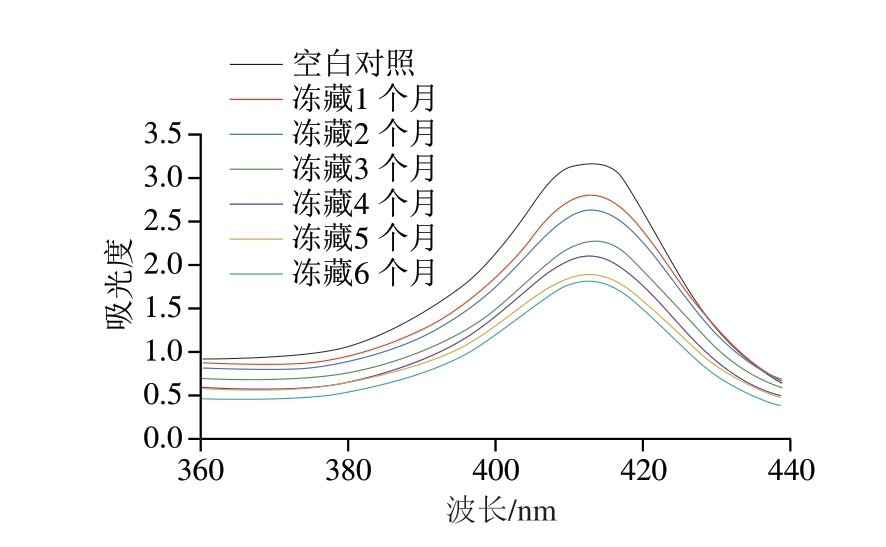
图5 冻藏期间羊肉卷血红素铁卟啉Soret带变化
Fig. 5 Change in Soret band in heme iron porphyrin of lamb rolls during frozen storage
2.7 冻藏时间对羊肉卷肌红蛋白结构的影响
2.7.1 肌红蛋白二级结构变化
红外光谱可以反映蛋白质构象的变化和稳定性,蛋白质二级结构包含多种氢键,其主要由α-螺旋、β-折叠、β-转角和无规卷曲构成[33]。如图6所示,随着冻藏时间的延长,α-螺旋相对含量显著减少(减少至15.03%,P<0.05),这可能是由于冷冻条件下氧气溶解度增加,产生的自由基促进氧化反应的发生,并且在冻藏期间少量微生物和酶也可能分解肌红蛋白,导致肌红蛋白α-螺旋相对含量减少。此外,β-折叠和β-转角相对含量分别增加至39.86%和31.25%,无规卷曲相对含量无显著变化(P>0.05)。综上,肌红蛋白二级结构遭到破坏,蛋白质发生氧化分解,引起结构混乱,进而影响羊肉卷色泽。
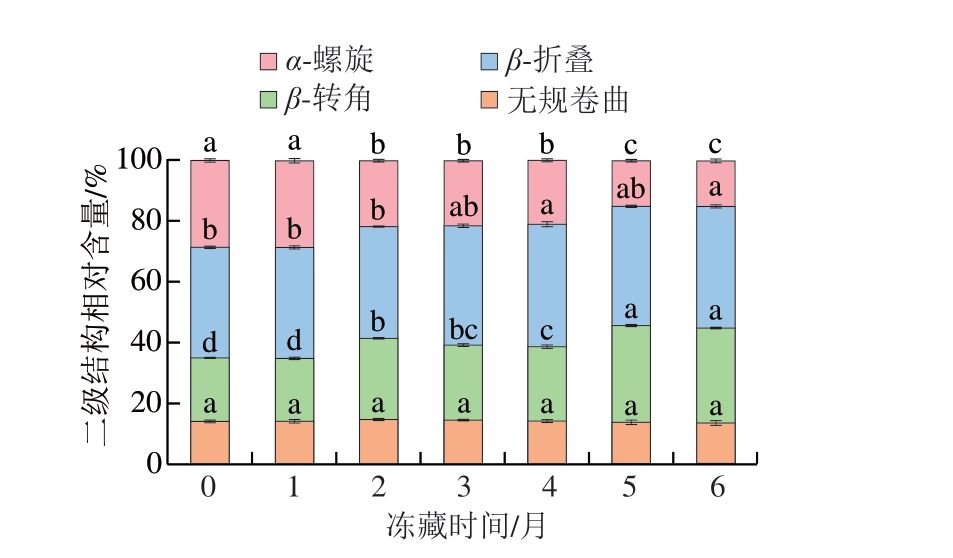
图6 冻藏期间羊肉卷肌红蛋白二级结构变化
Fig. 6 Change in the secondary structure of myoglobin in lamb rolls during frozen storage
2.7.2 肌红蛋白三级结构变化
肌红蛋白由2 个酪氨酸残基和3 个色氨酸残基组成,荧光光谱可以反映肌红蛋白三级结构中酪氨酸和色氨酸周围环境变化[34],其中284 nm处对应酪氨酸残基,325 nm处对应色氨酸残基,565 nm处对应铁卟啉。如图7所示,随着冻藏时间的延长,色氨酸含量明显减少,色氨酸荧光强度的降低反映蛋白质的去折叠状态[35],这是由于蛋白质三级结构在冻藏过程中发生变化导致色氨酸微环境改变,此外,蛋白质中的色氨酸氧化也是导致其荧光强度降低的重要因素[36]。另外,随着冻藏时间的延长,酪氨酸发生氧化,冻藏4 个月后氧化更为明显。波长565 nm处为280 nm激发光照射下血红素铁卟啉的发射峰,酪氨酸和色氨酸在吸收激发态光子后进入激发态,将能量传递给血红素铁卟啉并被其吸收所产生,血红素铁卟啉荧光强度降低表明铁卟啉结构遭到破坏,这可能主要由氧化导致。
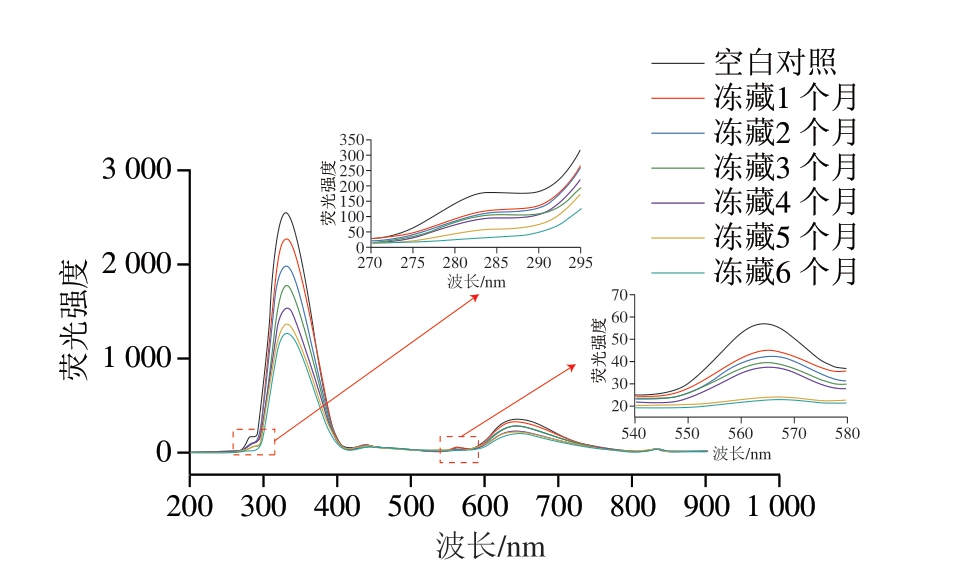
图7 冻藏期间羊肉卷肌红蛋白内源荧光光谱变化
Fig. 7 Change in intrinsic fluorescence spectrum of myoglobin in lamb rolls during frozen storage
3 结论
随着冻藏时间的延长,羊肉卷色泽发生劣变,主要表现为L*和a*减小,b*稍有增大,这种变化在冻藏2 个月开始出现,并在冻藏5 个月趋于稳定。对脂肪氧化及肌红蛋白氧化降解情况进行分析发现,OxyMb相对含量显著降低(P<0.05),MetMb相对含量显著升高(P<0.05),这与羊肉卷由鲜红色变为暗褐色的现象密切相关。总巯基含量显著减少(P<0.05)、羰基含量与TBARS值均显著增加(P<0.05),表明冻藏过程中蛋白质和脂肪均发生不同程度的氧化。荧光光谱和紫外光谱显示肌红蛋白血红素铁卟啉结构遭到破坏,血红素蛋白发生降解,这是导致羊肉卷色泽劣变的重要因素之一,而FTIR光谱表明,随着冻藏时间的延长,肌红蛋白二级结构发生变化,α-螺旋相对含量降低、β-折叠与β-转角相对含量升高,进一步表明肌红蛋白发生氧化和降解。综上所述,本研究揭示了羊肉卷冻藏期间色泽劣变的主要原因,包括肌红蛋白氧化降解、脂肪氧化及其与蛋白氧化的相互作用等,可为羊肉卷和其他肉类产品的贮藏保鲜技术提供理论依据,对改善肉制品工业中色泽劣变问题提供参考。未来可进一步探索更为有效的抗氧化护色措施及贮藏技术,以提升肉制品品质并延长其货架期。
[1] 刘静静, 李志刚, 张旭, 等. 基于聚类-RBF神经网络的家庭冷藏羊肉新鲜度的评价方法[J]. 石河子大学学报(自然科学版), 2020, 38(4):403-408. DOI:10.13880/j.cnki.65-1174/n.2020.21.041.
[2] 刘达玉, 王卫, 孙杰, 等. 四川肉羊产业加工现状和发展趋势[J]. 肉类研究, 2023, 37(1): 58-63. DOI:10.7506/rlyj1001-8123-20220805-090.
[3] 张春晖, 李侠, 李银, 等. 低温高湿变温解冻提高羊肉的品质[J]. 农业工程学报, 2013, 29(6): 267-273. DOI:10.3969/j.issn.1002-6819.2013.06.033.
[4] 刘晓畅, 张寿, 孙宝忠, 等. 牦牛肉品质特性研究进展[J]. 肉类研究,2020, 34(11): 78-83. DOI:10.7506/rlyj1001-8123-20200917-230.
[5] KARAMUCKI T, JAKUBOWSKA M, RYBARCZYK A, et al. The influence of myoglobin on the colour of minced pork loin[J]. Meat Science, 2013, 94(2): 234-238. DOI:10.1016/j.meatsci.2013.01.014.
[6] ZHENG Z X, LIN S S, XUE J, et al. The characterization of myoglobin and myoglobin-induced lipid oxidation in frigate mackerel[J]. Journal of Food Processing and Preservation, 2016, 40(6):1438-1447. DOI:10.1111/jfpp.12729.
[7] 孙程涛, 李健. 双缩脲法测定乳中酪蛋白含量[J]. 中国乳品工业,2000, 28(3): 33-35.
[8] 张同刚, 罗瑞明, 李亚蕾, 等. 基于拉曼光谱法测定冷鲜牛肉中肌红蛋白相对含量[J]. 食品科学, 2018, 39(2): 210-214. DOI:10.7506/spkx1002-6630-201802033.
[9] CUI C, ZHOU X S, ZHAO M M, et al. Effect of thermal treatment on the enzymatic hydrolysis of chicken proteins[J]. Innovative Food Science & Emerging Technologies, 2009, 10(1): 37-41. DOI:10.1016/j.ifset.2008.09.003.
[10] SOGLIA F, PETRACCI M, ERTBJERG P. Novel DNPH-based method for determination of protein carbonylation in muscle and meat[J]. Food Chemistry, 2016, 197: 670-675. DOI:10.1016/j.foodchem.2015.11.038.
[11] BENJAKUL S, BAUER F. Biochemical and physicochemical changes in catfish (Silurus glanis Linne) muscle as influenced by different freeze-thaw cycles[J]. Food Chemistry, 2001, 72(2): 207-217.DOI:10.1016/S0308-8146(00)00222-3.
[12] ZHAO J, CUI J K, CHEN R X, et al. Real-time in-situ quantification of protein secondary structures in aqueous solution based on ATRFTIR subtraction spectrum[J]. Biochemical Engineering Journal, 2021,176: 108225. DOI:10.1016/j.bej.2021.108225.
[13] 马君燕, 郑学仿, 郭明, 等. 荧光法研究光诱导肌红蛋白的去氧过程[J].中国科学(B辑: 化学), 2008, 38(1): 55-59. DOI:10.1360/zb2008-38-1-55.
[14] WANG Z M, TU J C, ZHOU H, et al. A comprehensive insight into the effects of microbial spoilage, myoglobin autoxidation, lipid oxidation,and protein oxidation on the discoloration of rabbit meat during retail display[J]. Meat Science, 2021, 172: 108359. DOI:10.1016/j.meatsci.2020.108359.
[15] WANG Z F, HE Z F, ZHANG D, et al. Effect of multiple freeze-thaw cycles on protein and lipid oxidation in rabbit meat[J]. International Journal of Food Science & Technology, 2021, 56(6): 3004-3015.DOI:10.1111/ijfs.14943.
[16] XIA X F, KONG B H, LIU Q, et al. Physicochemical change and protein oxidation in porcine longissimus dorsi as influenced by different freeze-thaw cycles[J]. Meat Science, 2009, 83(2): 239-245.DOI:10.1016/j.meatsci.2009.05.003.
[17] 王晶, 罗欣, 朱立贤, 等. 不同极限pH值牛肉品质差异及机制的研究进展[J]. 食品科学, 2019, 40(23): 283-288. DOI:10.7506/spkx1002-6630-20181109-109.
[18] 郝丹妮, 屠晓航, 郭诗雨, 等. 宰后肌肉成熟过程中铁死亡的发生及其与生鲜肉品质关系的研究进展[J]. 食品科学, 2024, 45(21): 331-343. DOI:10.7506/spkx1002-6630-20240125-230.
[19] WAGA M, NODAKE K, NAKADE K. The effect of pH and aging on mitochondrial reduction of bovine myoglobin’s affinity for oxygen[J]. Meat Science, 2023, 206: 109345. DOI:10.1016/j.meatsci.2023.109345.
[20] 张萌, 李亚蕾. 宰后贮藏期间氧化磷酸化对秦川牛肉色泽的影响[J].中国食品学报, 2023, 23(10): 249-260. DOI:10.16429/j.1009-7848.2023.10.025.
[21] SOLADOYE O P, JUÁREZ M L, AALHUS J L, et al. Protein oxidation in processed meat: mechanisms and potential implications on human health[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(2): 106-122. DOI:10.1111/1541-4337.12127.
[22] FENG X C, CHEN L, LEI N, et al. Emulsifying properties of oxidatively stressed myofibrillar protein emulsion gels prepared with(-)-epigallocatechin-3-gallate and NaCl[J]. Journal of Agricultural and Food Chemistry, 2017, 65(13): 2816-2826. DOI:10.1021/acs.jafc.6b05517.
[23] FUENTES V, VENTANAS J, MORCUENDE D, et al. Lipid and protein oxidation and sensory properties of vacuum-packaged drycured ham subjected to high hydrostatic pressure[J]. Meat Science,2010, 85(3): 506-514. DOI:10.1016/j.meatsci.2010.02.024.
[24] CHEN Q Q, WANG Z M, LI H L, et al. Effects of chitosan-based packaging film crosslinked with nanoencapsulated star anise essential oil and superchilled storage on the quality of rabbit meat patties[J].International Journal of Biological Macromolecules, 2024, 271:132402. DOI:10.1016/j.ijbiomac.2024.132402.
[25] 高增明, 安宣哲, 王存堂. 洋葱皮乙醇提取物对冷却牛肉颜色、脂质和蛋白质氧化稳定性的影响[J]. 食品工业科技, 2021, 42(18):342-349. DOI:10.13386/j.issn1002-0306.2021010105.
[26] JIAO Y, QUEK S Y, GU M H, et al. Polyphenols from thinned young kiwifruit as natural antioxidant: protective effects on beef oxidation,physicochemical and sensory properties during storage[J]. Food Control, 2020, 108: 106870. DOI:10.1016/j.foodcont.2019.106870.
[27] HOA V B, CHO S H, SEONG P N, et al. The significant influences of pH, temperature and fatty acids on meat myoglobin oxidation: a model study[J]. Journal of Food Science and Technology, 2021, 58(10): 3972-3980. DOI:10.1007/s13197-020-04860-1.
[28] BABAKHANI A, FARVIN K H S, JACOBSEN C. Antioxidative effect of seaweed extracts in chilled storage of minced Atlantic mackerel (Scomber scombrus): effect on lipid and protein oxidation[J].Food and Bioprocess Technology, 2016, 9(2): 352-364. DOI:10.1007/s11947-015-1630-9.
[29] FAUSTMAN C, SUN Q, MANCINI R, et al. Myoglobin and lipid oxidation interactions: mechanistic bases and control[J]. Meat Science,2010, 86(1): 86-94. DOI:10.1016/j.meatsci.2010.04.025.
[30] WANG Z M, HE Z F, GAN X, et al. Interrelationship among ferrous myoglobin, lipid and protein oxidations in rabbit meat during refrigerated and superchilled storage[J]. Meat Science, 2018, 146: 131-139. DOI:10.1016/j.meatsci.2018.08.006.
[31] WONGWICHIAN C, KLOMKLAO S, PANPIPAT W, et al.Interrelationship between myoglobin and lipid oxidations in oxeye scad (Selar boops) muscle during iced storage[J]. Food Chemistry,2015, 174: 279-285. DOI:10.1016/j.foodchem.2014.11.071.
[32] SMULEVICH G, DROGHETTI E, FOCARDI C, et al. A rapid spectroscopic method to detect the fraudulent treatment of tuna fish with carbon monoxide[J]. Food Chemistry, 2007, 101(3): 1071-1077.DOI:10.1016/j.foodchem.2006.03.006.
[33] LIU J, LIU D H, ZHENG A R, et al. Haem-mediated protein oxidation affects water-holding capacity of beef during refrigerated storage[J]. Food Chemistry: X, 2022, 14: 100304. DOI:10.1016/j.fochx.2022.100304.
[34] ZHU Z H, WANG Y Q, KANG Y J, et al. Graphene oxide destabilizes myoglobin and alters its conformation[J]. Carbon, 2017, 114: 449-456.DOI:10.1016/j.carbon.2016.12.053.
[35] WANG Z M, HE Z F, EMARA A M, et al. Effects of malondialdehyde as a byproduct of lipid oxidation on protein oxidation in rabbit meat[J]. Food Chemistry, 2019, 288: 405-412. DOI:10.1016/j.foodchem.2019.02.126.
[36] UTRERA M, MORCUENDE D, ESTéVEZ M. Fat content has a significant impact on protein oxidation occurred during frozen storage of beef patties[J]. LWT-Food Science and Technology, 2014, 56(1):62-68. DOI:10.1016/j.lwt.2013.10.040.