翘嘴鲌(Culter alburnus)属于鲤科,体型瘦长、腹侧银白、背鳍灰黑、背部平直、尾柄较长[1]。鲌鱼鱼肉营养丰富、口感绵滑、蛋白质含量高,具有较高的经济价值。其中肌原纤维蛋白(myofibrillar protein,MP)占鱼肌肉蛋白的60%~70%,是鲌鱼肌肉蛋白的主要组成部分,在鱼肉加工过程中对鲌鱼鱼肉品质起着重要作用[2-3]。
鱼肉加工过程中风味物质保留与肉制品基质大分子密切相关,MP可以有效保留醛类、醇类、酮类、含硫与含氮化合物等挥发性风味物质[4-6],是吸附挥发性风味物质的理想载体。复杂环境因素会导致蛋白质结构改变或变性,其羧基、胺基、硫醇等官能团等被激活,进而吸附挥发性风味物质[7]。而蛋白质结构发生改变的因素可以分为内部因素和外部因素,其中内部因素包括氨基酸残基突变或氨基酸序列发生改变等,Li Zhengyang等[8]将从海洋细菌中发现的脂肪酶CrmE10的5 个酸性氨基酸残基突变为碱性氨基酸残基,pH 10.5时其酶活性提高20%。外部因素是指在不影响氨基酸序列的情况下对更高级结构的改变,常见的外部因素主要有温度、pH值、电场、磁场等。尤娟等[9]发现,外界环境条件(温度、pH值、离子强度或化学试剂等)的变化会导致蛋白质结构改变,使包埋在其内部的基团暴露,在共价键或非共价键相互作用下形成具有更高分子质量的寡聚体或多聚体。肉类的风味能否被人体感知不仅取决于挥发性风味物质的浓度和阈值,还受其在肉类基质中的释放或保留程度影响[10]。先前的大多数研究都集中在探究超声和超高压处理对鱼肉质量和感官特性的影响上,而对于其对鱼肉风味结合能力的影响关注较少,因此本研究从非热处理导致蛋白质结构改变的角度出发,研究其对风味结合能力的影响。
正己醛为无色透明液体,呈生油脂和青草气及苹果香味。1-辛烯-3-醇为无色至淡黄色油状液体,具有蘑菇、薰衣草、玫瑰和干草香气。3-甲基丁醛,又名异戊醛,是一种无色液体,具有类似于香蕉和葡萄香味的特征性气味。本研究选取正己醛、1-辛烯-3-醇、异戊醛3 种翘嘴鲌鱼肉中含量较高的挥发性风味物质[11],探究超声或超高压处理对MP结构的影响,并利用顶空固相微萃取(headspace solid-phase microextraction,HS-SPME)提取上述3 种游离的气味物质,研究超声或超高压处理对3 种挥发性化合物的保留和释放的影响,验证蛋白质结构改变是否会导致风味的变化。本研究有望为鱼肉产品加工过程中鱼肉蛋白质变化对风味的影响提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜翘嘴鲌(体长(15±3)cm,体质量(3.5±0.5)kg) 武汉悦活里生活超市广宏汇商业街店。
氯化钾、氯化钠、尿素、2-硝基苯甲酸、溴酚蓝(均为分析纯) 国药集团化学试剂有限公司;考马斯亮蓝G250(生化试剂) Biosharp生物科技公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、丙烯酰胺、考马斯亮蓝试剂盒 北京索莱宝科技有限公司;正己醛(纯度99%)、异戊醛(纯度98%)、1-辛烯-3-醇(纯度98%)标准品 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
BS-210电子天平 德国Sartorius Instruments有限公司;T18 basic均质机 德国IKA公司;GL-25MS高速冷冻离心机 上海卢湘仪离心机仪器有限公司;UV-3802紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;DF-101s恒温加热磁力搅拌器 武汉科尔仪器设备有限公司;DS-1高速组织捣碎机 上海精科实业有限公司;PB-10 pH计 德国赛多利斯科学仪器有限公司;DVB/CAR/PDMS萃取头(50/30 μm)、57330U SPME萃取手柄美国Supelco公司;7890A/5975C气相色谱-质谱联用仪 美国Agilent公司;DYY-6D电泳仪、WD-9405F摇床北京六一生物科技有限公司;KS-7200DE超声波清洗器昆山洁力美超声仪器有限公司;HPP.L2-600/2超高压设备华泰森淼生物工程技术有限公司。
1.3 方法
1.3.1 样品处理
将新鲜翘嘴鲌鱼宰杀,去头、尾、表皮及内脏,称取鱼肉块(50±1)g放入塑料包装盒中备用。
1.3.2 MP提取及处理
参考Han Zhong等[12]的方法略作修改。称取5 g鱼肉,剁碎制成鱼肉糜于25 mL磷酸盐缓冲液(phosphate buffered saline,PBS)(20 mmol/L磷酸盐、0.6 mol/L NaCl,pH 6.0)中,在冰浴条件下均质1 min(10 000 r/min),离心(10 000 r/min、4 ℃、10 min),弃上清液,沉淀用PBS清洗3 次后加入20 mL PBS,冰浴条件下均质15 s(10 000 r/min),4 ℃下提取2 h后,4 ℃、3 500 r/min离心15 min,所得沉淀于4 ℃用PBS重复清洗3 次后,用4 层纱布过滤去除鱼肉结缔组织,所得滤液即为翘嘴鲌鱼MP溶液,MP质量浓度用考马斯亮蓝试剂盒进行测定,控制MP质量浓度为5 mg/mL。
在旋口瓶中加入10 mL 5 mg/mL MP溶液,同时分别加入正己醛、1-辛烯-3-醇、异戊醛的标准品溶液,使其含量均为5 mg/L,未添加挥发性风味化合物为对照组。设置未处理组:无额外处理;超声处理组:在不同超声功率下(200、300 W)连续超声处理15 min,温度保持在(20±1)℃;超高压处理组:在不同压力条件下(100、250 MPa)保压15 min,温度保持在(20±1)℃;随后将配制好的待测样品密封,在室温下避光平衡15 h,30 ℃ SPME萃取30 min。
1.3.3 MP与风味物质结合能力的测定
使用HS-SPME提取游离的气味物质,气味物质与蛋白质的结合能力以游离气味化合物相对含量表示。气相色谱-质谱条件[11]:萃取头在220 ℃下解吸5 min,不分流进样,载气为氦气,用毛细管柱对风味成分进行分离。升温程序:柱温在35 ℃保持3 min,以3 ℃/min程序升温至40 ℃,再以8 ℃/min升至240 ℃,保持10 min。质谱离子源温度200 ℃,检测电压0.9 kV,扫描质量范围45~600 mAU。采用外标法根据色谱图的出峰时间和峰面积对风味物质进行定量及定性,游离气味化合物相对含量按式(1)计算:
式中:Ac为未加入挥发性化合物的对照组溶液中挥发性化合物的峰面积;As为样品溶液中挥发性化合物的峰面积。
1.3.4 总巯基及游离巯基含量的测定
参考Liu Qian等[13]的方法,用PBS将MP溶液蛋白质量浓度调整为2 mg/mL,取0.5 mL稀释后的MP溶液依次加入2 mL尿素-SDS溶液(含8.0 mol/L尿素、30 g/L SDS、0.1 mol/L磷酸钠缓冲液,pH 7.4)和0.5 mL 10 mmol/L 5,5’-二硫双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid,DTNB)溶液(溶解于0.1 mol/L磷酸钠缓冲液中,pH 7.4),室温下反应15 min,取上清液于412 nm波长处测定吸光度,用PBS代替MP溶液作为空白对照。
游离巯基含量的测定:用PBS将MP溶液蛋白质量浓度调整为2 mg/mL,取0.5 mL稀释后的MP溶液依次加入2 mL SDS溶液(含30 g/L SDS、0.1 mol/L磷酸钠缓冲液,pH 7.4)和0.5 mL 10 mmol/L DTNB溶液(溶解于0.1 mol/L磷酸钠缓冲液中,pH 7.4),室温下反应15 min,取上清液于412 nm波长处测定吸光度,用PBS代替MP溶液作为空白对照。
总巯基及游离巯基含量按式(2)计算:
式中:A412 nm为412 nm波长处的吸光度;n为稀释倍数;ε为摩尔吸光系数(13 600(L/(mol·cm)));ρ为蛋白质量浓度/(mg/mL)。
1.3.5 表面疏水性的测定
参考黄倩等[14]的方法并稍作修改。取1 mL质量浓度为5 mg/mL的MP溶液,加入200 µL 1 mg/mL溴酚蓝溶液,振荡反应30 min后离心(7 200 r/min、5 min),取上清液,蒸馏水稀释10 倍后于595 nm波长处测定吸光度,用0.6 mol/L KCl溶液替代MP溶液作为空白对照。用溴酚蓝结合量表示表面疏水性,按式(3)计算:
式中:A空为空白对照组吸光度;A样为样品组吸光度。
1.3.6 SDS-聚丙烯酰胺凝胶电泳(SDS polyacrylamide gel electrophoresis,SDS-PAGE)
参考Wang Weixin等[15]的方法,利用SDS-PAGE分析蛋白质降解情况。配制浓缩胶(5%)和分离胶(15%),制成电泳胶,待凝固后加电泳缓冲液。取10 μL 5 mg/mL MP溶液与10 μL 5×上样缓冲液混合均匀,沸水浴10 min,2 000 r/min离心1 min后加入点样孔中,并以标准蛋白Marker(11~245 kDa)作为对照,250 V下电泳2 h。待电泳结束取出电泳胶用考马斯亮蓝染色液染色,再用甲醇-冰乙酸脱色液脱色,完全脱色后观察并拍照。
1.3.7 荧光光谱分析
设置荧光光谱激发波长295 nm,发射光谱扫描范围290~440 nm,激发狭缝和发射狭缝宽均为3 nm[16],对5 mg/mL MP溶液进行测定。
1.3.8 紫外吸收光谱分析
参考张海璐等[17]的方法并略作修改。用PBS将MP溶液蛋白质量浓度调整为1 mg/mL,置于紫外分光光度计中测定紫外吸收光谱,扫描波长范围230~425 nm。
1.4 数据处理
每组实验重复3 次,采用Excel 2016软件进行数据处理,结果以平均值±标准差表示。采用Origin 2019软件作图,通过SPSS 17.0软件进行显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 不同超声与超高压处理MP与风味物质结合能力分析
MP与挥发性化合物的结合能力用游离气味化合物相对含量来衡量,相对含量越高,表明顶空瓶中溶液上方气相空间内挥发性物质含量越低,化合物与MP结合能力越强[18]。如图1所示,超声和超高压处理明显改变了MP与挥发性化合物的结合能力。相比于与未处理组,100 MPa处理组MP与正己醛、异戊醛的结合能力明显提高,但压力升高至250 MPa之后,结合能力明显下降。而超声处理对正己醛、异戊醛与MP结合能力影响较小。超声和超高压处理使1-辛烯-3-醇与MP的结合能力明显下降,相比于未处理组,超声和超高压处理使MP与1-辛烯-3-醇的结合能力降低至24%~35%。可能是由于过高的压力导致MP结构发生改变,使MP间的巯基、二硫键等基团断裂,改变蛋白质结构,破坏蛋白质三级结构,提高表面疏水性,改变溶液中化合物的水相-气相分配系数,促使化合物挥发,进而降低结合能力[19]。因此,超声和超高压处理会影响MP的风味结合能力,从而影响鱼肉风味。
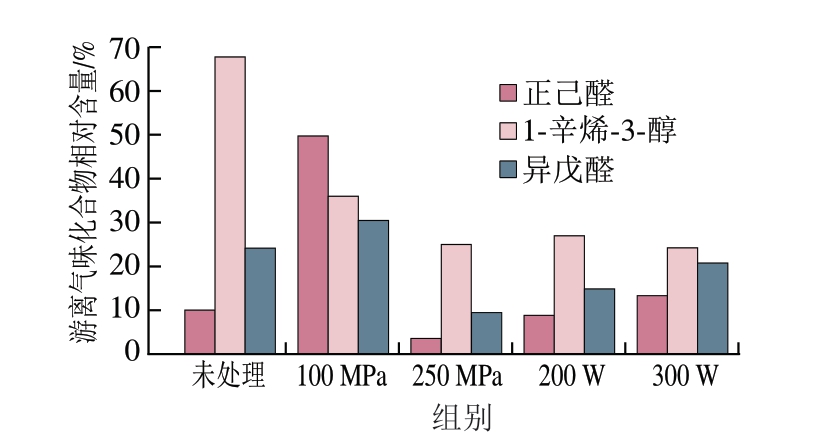
图1 不同超声与超高压处理方式对MP与风味物质结合能力的影响
Fig. 1 Effect of different US and UHP treatments on the flavor-binding capacity of MP
2.2 不同超声与超高压处理MP总巯基及游离巯基含量分析
巯基是形成二硫键的关键官能团,而二硫键是蛋白质分子三级结构的重要作用力,当蛋白质分子受到物理或化学影响时,其中的巯基等基团遭到破坏,导致蛋白质分子间发生交联或聚集,进而使构象发生改变[20-21]。由图2可知,在未添加挥发性风味化合物的对照组中,超声处理及较低压力的超高压处理使鱼肉MP总巯基含量提高,而在250 MPa处理组中总巯基含量明显降低。对于游离巯基来说,在未添加挥发性风味化合物的对照组中,与未处理组相比,超高压处理会使游离巯基含量显著升高(P<0.05),而超声处理对游离巯基含量影响不显著。在加入挥发性物质后,与对照组相比,加入正己醛的100 MPa处理组总巯基含量升高,而250 MPa处理组与超声组的总巯基含量均下降。在对照组中,超高压组的游离巯基含量变化不明显,而超声组会使游离巯基含量略微下降。在加入风味化合物后,相比于未处理组,除加入1-辛烯-3-醇的处理组外,另外2 组100 MPa处理组总巯基含量均显著升高,而250 MPa处理组总巯基含量均显著降低(P<0.05),超声处理组变化不明显,这与风味结合能力的结果相符。巯基含量降低可能是由于较高的压力致使原本蛋白质间的二硫键发生断裂或分子间的巯基流出,蛋白质分子发生重链解折叠,从而使蛋白质构象遭到破坏[22-23]。
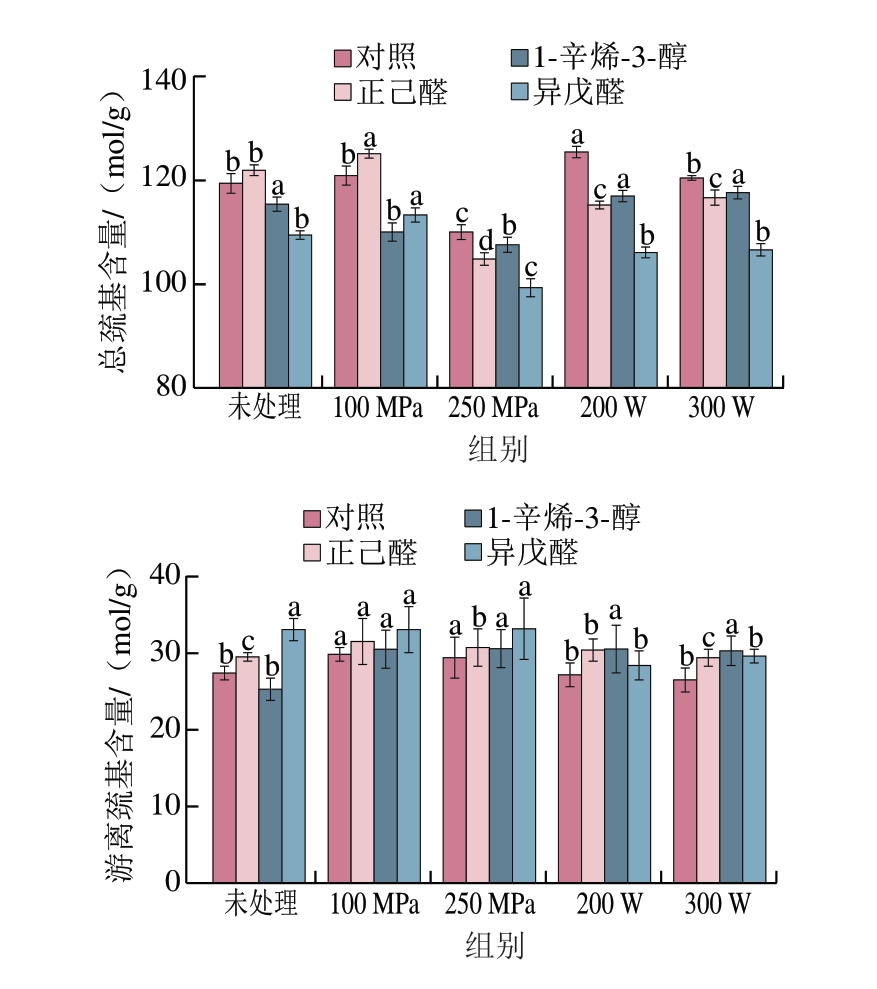
图2 不同超声与超高压处理方式对MP总巯基及游离巯基含量的影响
Fig. 2 Effect of different US and UHP treatments on the total and free sulfhydryl content of MP
小写字母不同表示添加相同风味物质组内差异显著(P<0.05)。图3同。
2.3 不同超声与超高压处理MP表面疏水性分析
表面疏水性可反映蛋白质分子表面疏水氨基酸残基暴露程度,是判断蛋白质构象及功能性质的重要指标[24]。如图3所示,与未处理组相比,超高压处理组的表面疏水性呈先升高后降低的趋势;而超声处理组的表面疏水性略微降低。这与Bao Zhijie等[25]的研究结果相似,这可能是由于较高的压力使原本折叠的蛋白质结构发生伸展,其表面疏水区域随之暴露,使表面疏水性增强;但当外界压力过大时,小聚集体在压力的作用下重新聚集,暴露出的表面疏水基团重新被隐藏在蛋白质分子内部,从而使表面疏水性降低。这可能是由于超声处理的时间过长,蛋白在表面疏水基团的相互作用下重新聚集包埋,使表面疏水性下降[26]。
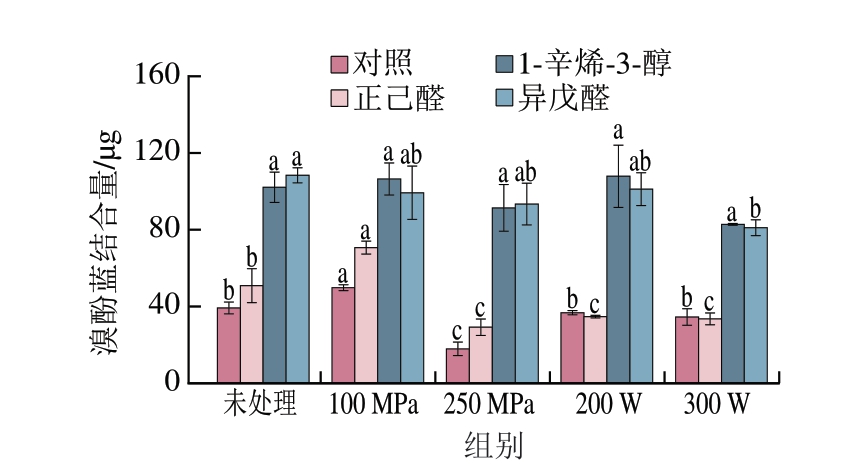
图3 不同超声与超高压处理方式对MP表面疏水性的影响
Fig. 3 Effect of different US and UHP treatments on the surface hydrophobicity of MP
在加入挥发性化合物之后,表面疏水性的变化趋势与挥发性化合物结合能力变化趋势基本一致,除添加异戊醛组外,100 MPa处理组表面疏水性升高,而250 MPa处理组表面疏水性均下降,超声处理组的表面疏水性影响规律不明显,这也验证了MP结构改变与风味结合能力密切相关。与对照组相比,1-辛烯-3-醇和异戊醛的加入使表面疏水性在所有处理组中均大幅提高,正己醛在100 MP超高压处理组中使表面疏水性升高,而在超声处理组中降低。这可能是由于加入的1-辛烯-3-醇和异戊醛与MP的基团发生反应,暴露出更多疏水基团,使表面疏水性升高。这与严浩等[27]在外源蛋白对白鲢鱼糜MP结构及其结合特征腥味物质能力的影响研究中发现的结果相似。
2.4 不同超声与超高压处理MP的SDS-PAGE结果分析
图4呈现较明显的肌球蛋白重链(200 kDa)、肌动蛋白(45 kDa)及肌球蛋白轻链(24、15~17 kDa)条带,所有的处理组较未处理组条带种类均无明显变化,表明超声与超高压处理并没有改变MP的组成。相比于未处理组,超高压处理组肌球蛋白条带颜色差异不大,这与陈晓梅[28]的研究结果一致;而超声处理组的各条带均明显加深,说明超声处理明显加剧蛋白质结构的展开,暴露出更多的基团,促使蛋白质之间发生交联,使得蛋白质结构及质量发生改变。在加入挥发性化合物之后,各处理组条带颜色均变细变浅,这可能是由于挥发性化合物促进二硫键的形成和蛋白质结合。曹云刚[29]研究发现,适当的没食子酸可以促进二硫键的形成,进而促进蛋白的结合。
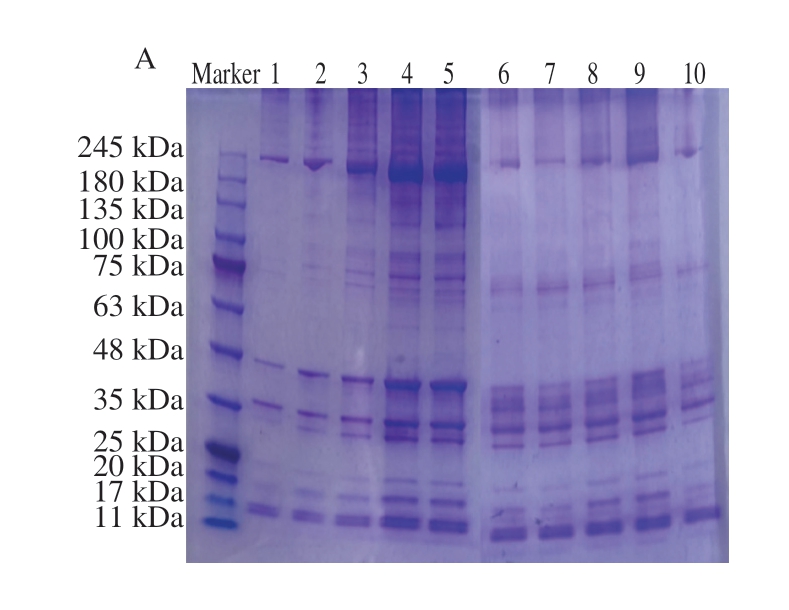
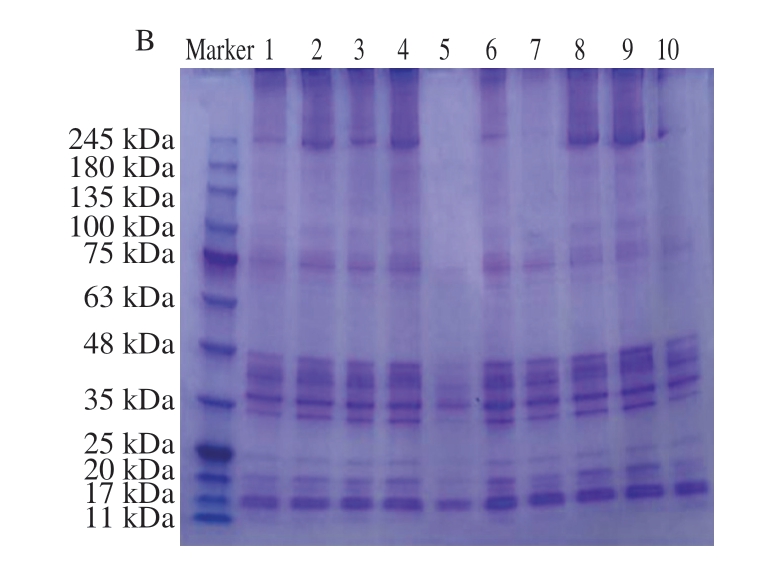
图4 不同超声与超高压处理方式对MP SDS-PAGE图谱的影响
Fig. 4 Effect of different US and UHP treatments on the sodium dodecyl sulfate polyacrylamide gel electrophoresis profile of MP
图A中,泳道1.未处理且未添加挥发性化合物的样品;泳道2~5.依次为经100、250 MPa和200、300 W处理且未添加挥发性化合物的样品;泳道6~10.分别为未处理,经100、250 MPa和200、300 W处理且与异戊醛结合的样品。图B中,泳道1~5.分别为未处理,经100、250 MPa和200、300 W处理且与正己醛结合的样品;泳道6~10.分别为未处理,经100、250 MPa和200、300 W处理且与1-辛烯-3-醇结合的样品。
2.5 不同超声与超高压处理MP的荧光光谱分析
色氨酸与酪氨酸残基的固有荧光性对微环境的荧光能量与极性极其敏感,当微环境发生改变,会使蛋白质荧光发生猝灭或增强,能够反映蛋白质三级结构的构象变化[30]。如图5所示,超声和超高压处理组的最大荧光发射峰较未处理组(333 nm)未发生明显变化,但超声和超高压处理组的MP溶液最大荧光强度明显高于未处理组。其中,250 MPa处理组荧光强度高于100 MPa处理组;而300 W处理组的最大荧光强度高于200 W处理组。荧光发射是被蛋白质折叠所影响的,与未处理组相比,超声与超高压处理后荧光强度增加,且随着压力或功率的增大进一步增加,可能是由于蛋白质的三级结构发生改变,蛋白质分子结构展开,分子间疏水键断裂,更多的疏水基团与埋藏在蛋白质折叠位置的色氨酸与酪氨酸残基暴露,进而促进分子间疏水相互作用和聚集体的形成,导致荧光强度的增加[31]。
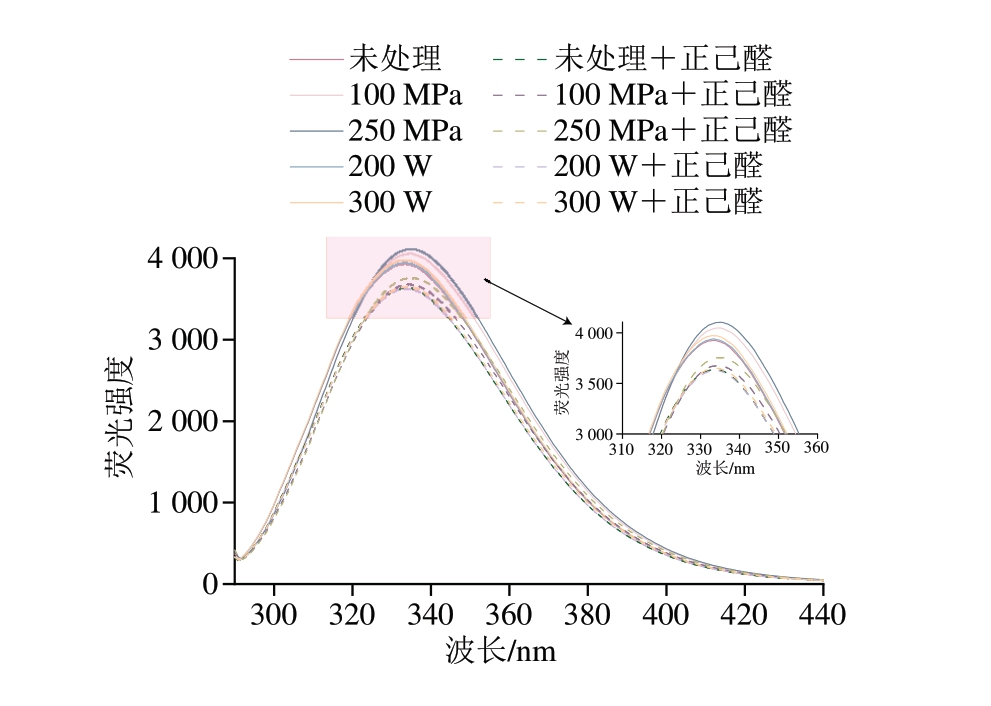
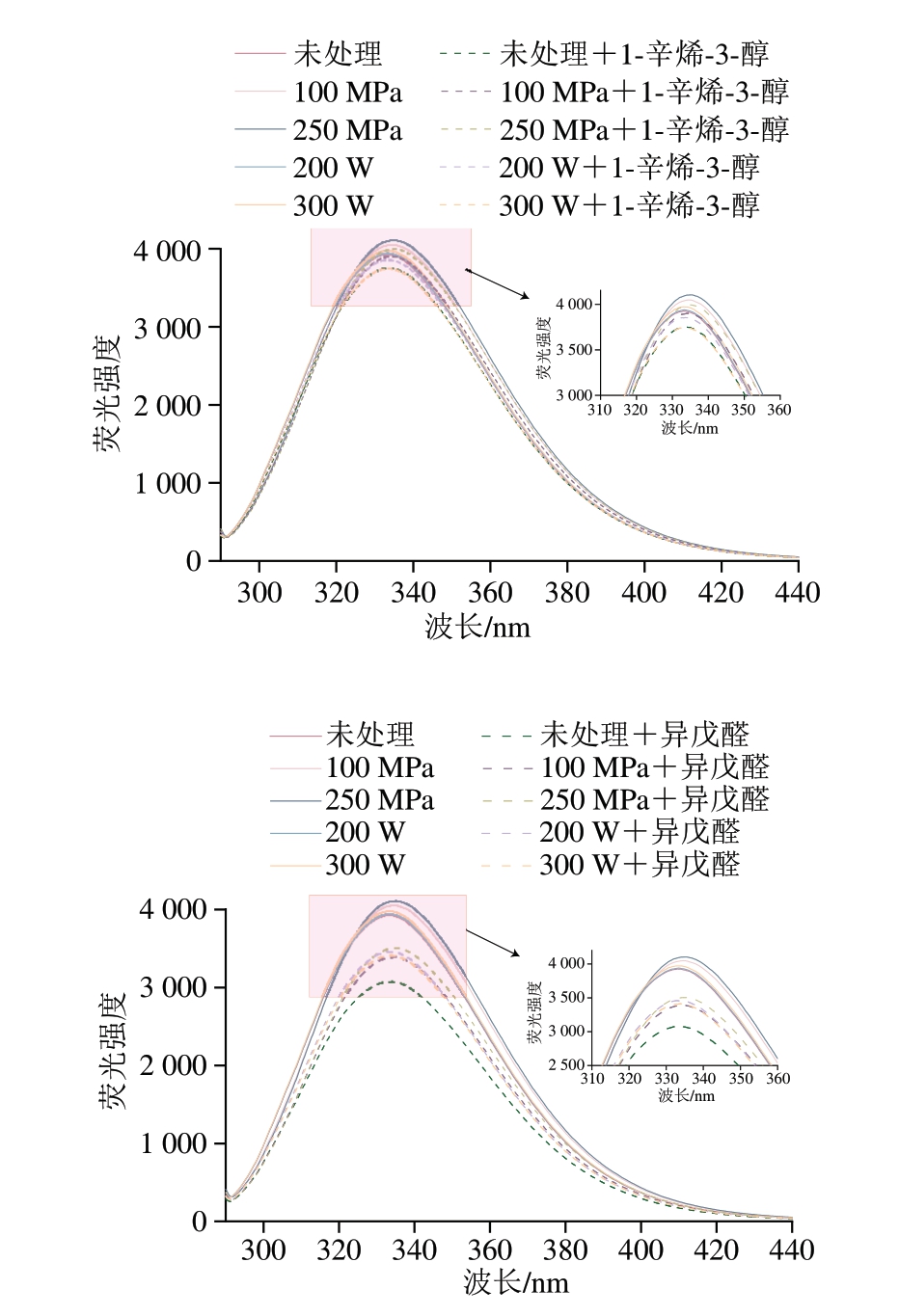
图5 不同超声与超高压处理方式对MP内源性荧光图谱的影响
Fig. 5 Effect of different US and UHP treatments on the intrinsic fluorescence spectrum of MP
在加入挥发性物质之后,所有MP处理组的荧光强度均下降,且加入正己醛与异戊醛的荧光强度下降幅度远超加入1-辛烯-3-醇。荧光猝灭方法通常分为静态猝灭和动态猝灭,静态猝灭是由荧光基团和猝灭剂之间形成基态络合物引起,动态猝灭是由荧光基团和猝灭剂之间的碰撞引起[32]。荧光强度的降低可能是MP结构改变,暴露出的色氨酸与酪氨酸残基与加入的挥发性化合物的醛基等官能团反应造成的。
2.6 不同超声与超高压处理MP的紫外吸收光谱分析
MP中的芳香族氨基酸基团如色氨酸与酪氨酸在紫外环境中拥有较大的吸收区域,氨基酸生色基团的不同使其拥有不同的紫外吸收光谱,因此紫外吸收光谱可以反映出MP中蛋白质构象变化[33]。如图6所示,翘嘴鲌鱼MP溶液的紫外负吸收峰在255 nm处,正吸收峰在276 nm处。对比超高压处理组与未处理组发现,超高压会使MP紫外吸收强度升高,且随着压力升高而增加。这可能是由于适当的压力会使蛋白质空间结构展开,暴露出更多内部疏水氨基酸,从而使蛋白质的紫外吸收强度升高。张凯强等[34]在超高压处理对大豆拉丝蛋白影响的研究中也发现,适当的压力会使蛋白紫外吸收强度升高,而过高的压力和过长的保压时间会使蛋白质紫外吸收强度降低。对比超声处理组与未处理组发现,超声会使MP紫外吸收强度升高,且随着功率升高而增加。这可能是由于超声空化效应破坏了相邻蛋白质的相互作用,使原本隐藏的酪氨酸与色氨酸残基暴露,引起紫外吸收强度的变化[35-36]。
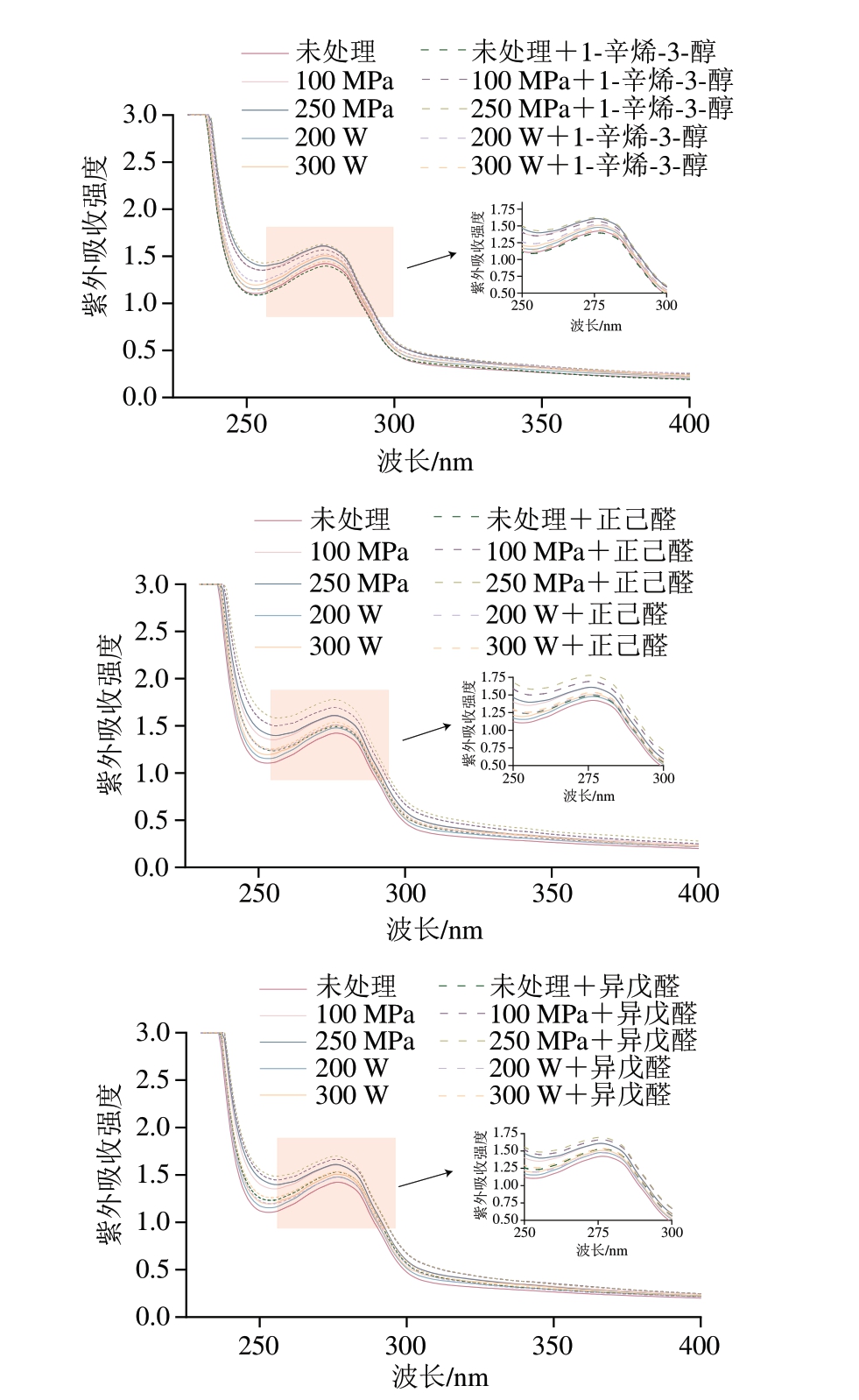
图6 不同超声与超高压处理方式对MP紫外吸收光谱的影响
Fig. 6 Influence of different US and UHP treatments on the UV absorption spectrum of MP
在加入挥发性化合物之后,在相同的处理条件下,加入1-辛烯-3-醇的处理组与对照组相比,所有组别紫外吸收强度均下降;而加入正己醛和异戊醛的处理组与对照组相比,所有组别紫外吸收强度均上升。这可能是由于羟基会与MP中疏水氨基酸位点发生反应,从而减少暴露的疏水氨基酸[37],而1-辛烯-3-醇的羟基与鱼肉MP的氨基酸位点发生反应,减弱了MP的紫外吸收强度。
3 结论
本研究从超声与超高压处理改变翘嘴鲌鱼肉蛋白质结构的角度出发,探究蛋白质结构的改变对鱼肉风味的影响。结果表明,不同处理方式会影响鱼肉MP与风味物质的结合能力,超声处理和超高压处理会使MP与正己醛结合能力大幅升高,使MP与异戊醛结合能力小幅降低,并使MP与1-辛烯-3-醇结合能力降低至24%~35%,其中100 MPa处理对风味结合能力影响最大。超声处理和超高压处理会影响MP的游离巯基、总巯基含量、表面疏水性,相比于未处理组,超声处理和超高压处理后的MP最大荧光强度与紫外吸收强度增加,且在加入挥发性化合物后升高幅度更大,SDS-PAGE结果中超声处理组的条带颜色明显加深。综上所述,超声处理和超高压处理会改变蛋白质结构,且结果与MP和风味结合能力变化相吻合,证明超声与超高压处理会有效改变蛋白质结构,对鱼肉与风味物质结合能力具有有利影响。本实验有望为鱼肉产品加工过程中的风味改善提供理论依据。
[1] ZHANG Z L, XIONG Z Y, LU S F, et al. Effects of oxidative modification on the functional, conformational and gelling properties of myofibrillar proteins from Culter alburnus[J]. International Journal of Biological Macromolecules, 2020, 162: 1442-1452. DOI:10.1016/j.ijbiomac.2020.08.052.
[2] 张仲李. 功能性低聚糖与蛋清蛋白协同作用对冻藏鲌鱼肌原纤维蛋白结构及功能性质的影响机制研究[D]. 武汉: 华中农业大学,2023. DOI:10.27158/d.cnki.ghznu.2023.000056.
[3] YU Y, FAN C X, QI J, et al. Effect of ultrasound treatment on porcine myofibrillar protein binding furan flavor compounds at different salt concentrations[J]. Food Chemistry, 2024, 443: 138427. DOI:10.1016/j.foodchem.2024.138427.
[4] BASSAM S M, NOLETO-DIAS C, FARAG M A. Dissecting grilled red and white meat flavor: its characteristics, production mechanisms,influencing factors and chemical hazards[J]. Food Chemistry, 2022,371: 131139. DOI:10.1016/j.foodchem.2021.131139.
[5] WEI M, LIU X C, XIE P, et al. Characterization of volatile profiles and correlated contributing compounds in pan-fried steaks from different Chinese yellow cattle breeds through GC-Q-orbitrap, E-nose, and sensory evaluation[J]. Molecules, 2022, 27(11): 3593. DOI:10.3390/molecules27113593.
[6] WANG Y Q, SHEN Y Y, WU Y Y, et al. Comparison of the microbial community and flavor compounds in fermented mandarin fish(Siniperca chuatsi): three typical types of Chinese fermented mandarin fish products[J]. Food Research International, 2021, 144(2): 110365.DOI:10.1016/j.foodres.2021.110365.
[7] 戚军. 基于结构蛋白与风味物质结合的黄羽鸡汤风味形成研究[D]. 南京: 南京农业大学, 2018: 20-25. DOI:10.27244/d.cnki.gnjnu.2018.000239.
[8] LI Z Y, LI L, HUO Y Y, et al. Structure-guided protein engineering increases enzymatic activities of the SGNH family esterases[J].Biotechnology for Biofuels and Bioproducts, 2020, 13: 107.DOI:10.1186/s13068-020-01742-8.
[9] 尤娟, 郑文栋, 王敏君, 等. 臭氧氧化对鲢肌球蛋白热聚集的影响[J]. 华中农业大学学报, 2019, 38(6): 1-8. DOI:10.13300/j.cnki.hnlkxb.2019.06.001.
[10] ZHANG J, KANG D, ZHANG W, et al. Recent advantage of interactions of protein-flavor in foods: perspective of theoretical models, protein properties and extrinsic factors[J]. Trends in Food Science & Technology, 2021, 111: 405-425. DOI:10.1016/j.tifs.2021.02.060.
[11] 邱文兴, 杜柳, 易弛, 等. 不同加热方式结合迷迭香对大口黑鲈脂质氧化及其风味的影响[J]. 食品安全质量检测学报, 2023, 14(11): 43-51. DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.11.047.
[12] HAN Z, CAI M J, CHENG J H, et al. Effects of microwave and water bath heating on the interactions between myofibrillar protein from beef and ketone flavour compounds[J]. International Journal of Food Science & Technology, 2019, 54(5): 1787-1793. DOI:10.1111/ijfs.14079.
[13] LIU Q, CHEN Q, KONG B H, et al. The influence of superchilling and cryoprotectants on protein oxidation and structural changes in the myofibrillar proteins of common carp (Cyprinus carpio)surimi[J]. LWT-Food Science and Technology, 2014, 57(2): 603-611.DOI:10.1016/j.lwt.2014.02.023.
[14] 黄倩, 黄兰兰, 陈炼红, 等. 冻融对冷藏藏羊肉保水性及蛋白氧化和溶解特性的影响[J]. 食品工业科技, 2021, 42(19): 21-28.DOI:10.13386/j.issn1002-0306.2020120148.
[15] WANG W X, XIA W S, GAO P, et al. Proteolysis during fermentation of Suanyu as a traditional fermented fish product of China[J].International Journal of Food Properties, 2017, 20(S1): 166-176. DOI:10.1080/10942912.2017.1293089.
[16] 王彦惠, 吴清浊, 孙瑜彤, 等. 热处理对杏仁分离蛋白结构及热稳定性的影响[J]. 食品工业, 2023, 44(12): 140-146.
[17] 张海璐, 黄翔, 杨燃, 等. 氧化对羊肉肌原纤维蛋白分子与理化特性的影响[J]. 食品科学, 2020, 41(23): 8-14. DOI:10.7506/spkx1002-6630-20200615-197.
[18] 李阳. 白鲢鱼肉挥发性物质与鱼肉肌球蛋白结合能力的初步研究[D].武汉: 湖北工业大学, 2015.
[19] PÉREZ-JUAN M, FLORES M, TOLDRÁ F. Binding of aroma compounds by isolated myofibrillar proteins: effect of protein concentration and conformation[J]. Food Chemistry, 2007, 105(3):932-939. DOI:10.1016/j.foodchem.2007.04.051.
[20] LUO X, WANG Q, WU Y Y, et al. Mechanism of effect of heating temperature on functional characteristics of thick egg white[J]. LWTFood Science and Technology, 2022, 154: 112807. DOI:10.1016/j.lwt.2021.112807.
[21] WU M G, CAO Y, LEI S M, et al. Protein structure and sulfhydryl group changes affected by protein gel properties: process of thermalinduced gel formation of myofibrillar protein[J]. International Journal of Food Properties, 2019, 22(1): 1834-1847. DOI:10.1080/10942912.2 019.1656231.
[22] 汪媛. 肌原纤维蛋白-小麦水解蛋白相互作用及其共乳化体系的影响因素研究[D]. 广州: 华南理工大学, 2019. DOI:10.27151/d.cnki.ghnlu.2019.002758.
[23] 雷姝敏. 二硫键在不同蛋白乳化液和乳液蛋白复合凝胶中的作用研究[D]. 扬州: 扬州大学, 2017. DOI:10.7666/d.Y3375419.
[24] BI C H, CHI S Y, ZHOU T, et al. Effect of low-frequency highintensity ultrasound (HIU) on the physicochemical properties of chickpea protein[J]. Food Research International, 2022, 159: 111474.DOI:10.1016/j.foodres.2022.111474.
[25] BAO Z J, ZHAO Y, WANG X Y, et al. Effects of degree of hydrolysis(DH) on the functional properties of egg yolk hydrolysate with alcalase[J]. Journal of Food Science and Technology, 2017, 54(3): 669-678. DOI:10.1007/s13197-017-2504-0.
[26] 李可, 张俊霞, 王欣瑶, 等. 不同超声波功率处理对类PSE鸡肉肌原纤维蛋白结构和乳化稳定性的影响[J]. 食品科学, 2023, 44(13): 23-31. DOI:10.7506/spkx1002-6630-20220624-269.
[27] 严浩, 王玉栋, 钟武, 等. 外源蛋白对白鲢鱼糜肌原纤维蛋白结构及其结合特征腥味物质能力的影响[J]. 食品科学, 2023, 44(2): 64-70.DOI:10.7506/spkx1002-6630-20220309-115.
[28] 陈晓梅. 超高压处理对鲮鱼肉品质及其凝胶特性的研究[D]. 广州:仲恺农业工程学院, 2020. DOI:10.27700/d.cnki.gzcny.2020.000101.
[29] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D]. 无锡: 江南大学, 2016.
[30] JIN J, MA H L, WANG K, et al. Effects of multi-frequency power ultrasound on the enzymolysis and structural characteristics of corn gluten meal[J]. Ultrasonics Sonochemistry, 2015, 24: 55-64.DOI:10.1016/j.ultsonch.2014.12.013.
[31] JAMBRAK A R, MASON T J, LELAS V, et al. Effect of ultrasound treatment on solubility and foaming properties of whey protein suspensions[J]. Journal of Food Engineering, 2008, 86(2): 281-287.DOI:10.1016/j.jfoodeng.2007.10.004.
[32] 聂若彤, 魏相茹, 张德权, 等. 肉制品中蛋白质、脂质及其相互作用吸附挥发性风味物质机理研究进展[J]. 肉类研究, 2023, 37(4): 41-47. DOI:10.7506/rlyj1001-8123-20221128-150.
[33] 何晓叶, 任爽, 郑伊琰, 等. 不同缓冲体系下超高压处理对乳铁蛋白结构及理化性质的影响[J]. 中国食品学报, 2021, 21(5): 174-184.DOI:10.16429/j.1009-7848.2021.05.021.
[34] 张凯强, 何晓叶, 卫姣, 等. 超高压处理对大豆拉丝蛋白特性的影响[J]. 食品工业科技, 2023, 44(11): 103-110. DOI:10.13386/j.issn1002-0306.2022070306.
[35] DING Q Z, ZHANG T, NIU S, et al. Impact of ultrasound pretreatment on hydrolysate and digestion products of grape seed protein[J].Ultrasonics Sonochemistry, 2017, 42: 704-713. DOI:10.1016/j.ultsonch.2017.11.027.
[36] HUANG L R, DING X N, LI Y L, et al. The aggregation, structures and emulsifying properties of soybean protein isolate induced by ultrasound and acid[J]. Food Chemistry, 2019, 279: 114-119.DOI:10.1016/j.foodchem.2018.11.147.
[37] 黄晓冰, 洪鹏志, 周春霞, 等. 不同原淀粉对金线鱼鱼糜凝胶品质的影响及其分子机制[J]. 广东海洋大学学报, 2024, 44(1): 133-141.DOI:10.3969/j.issn.1673-9159.2024.01.016.