生物胺是一类含氮有机化合物的总称[1],相对分子质量较低,是具有脂肪族、芳香族或杂环结构的生物活性有机碱分子[2],主要由相应的氨基酸通过微生物的脱羧作用形成,或由醛、酮类物质在氨基酸转氨酶的作用下产生[3]。微量生物胺是生物体(包括人体)内的正常活性成分,在动植物和微生物活性细胞中发挥重要的生理功能[4-7],但摄入过量生物胺会导致恶心、呕吐、腹泻、心悸、呼吸紊乱等过敏反应,严重时还会危及生命[8],因此生物胺安全监测一直是社会密切关注的问题。生物胺普遍存在于蛋白质和氨基酸含量较高的食品中[9],如水产品、肉类食品、发酵食品等[10],而引起生物胺含量超标有多方面因素,如食品卫生不过关、加工工艺不合格、贮藏方式不当或贮藏条件控制不严格等。生物胺的含量可作为食品新鲜度和腐败度评价的潜在指标[11],研究表明,以鱼类为代表的水产品及其制品被认为是生物胺含量最高的一类食品[12],腐败变质的鱼类产品中,生物胺含量会大幅增加,即使高温处理也只能破坏一小部分[13-14],人们如果食用了这类食品会有发生食物中毒的可能[15]。因此,控制生物胺的含量是确保食品安全的重要途径,建立一种简易、稳定、灵敏的生物胺含量检测方法至关重要。
目前,生物胺的检测方法有气相色谱-串联质谱法[16]、离子色谱法[17-19]、高效液相色谱法[20-24]和高效液相色谱-串联质谱法[25-28]。每种方法各有优缺点,由于大部分生物胺紫外吸收和荧光发射响应较低,需使用衍生化手段增强响应值,常用的衍生试剂有丹磺酰氯(dansyl chloride,Dns-Cl)、邻苯二甲醛、苯甲酰氯和荧光胺等[29]。目前,GB/T 5009.208—2016《食品安全国家标准 食品中生物胺的测定》中生物胺检测方法是利用Dns-Cl进行柱前衍生化处理,多位研究学者也采用此衍生剂对生物胺含量进行研究[30-32],Dns-Cl作为使用最广泛的衍生剂,所得衍生物性质稳定且保存时间长[33-34]。国家标准中液相色谱法的样品前处理较为繁琐,包含正己烷除脂、液-液萃取、衍生后多次氮吹等步骤,涉及有机溶剂较多,对人体危害较大。
大黄鱼是我国东海四大经济鱼类之一,主要产于东海和南海,鲳鱼是一种身体扁平的海水鱼,刺少肉嫩,味道鲜美。市面上销量较高的海水鱼包括大黄鱼和鲳鱼,富含优质蛋白质,具有较高的营养价值,深受消费者喜爱。但水产品在贮藏过程中,若贮藏条件不当,易发生腐败和变质,使蛋白质降解、游离氨基酸流失,导致生物胺大量积累[35],对消费者身体健康造成威胁。导致生物胺含量升高的主要因素有2 个方面:贮藏温度和贮藏时间。在贮藏温度较低的情况下,鱼类水产品不易腐败;但贮藏温度较高且时间较长的情况下,鱼类会发生品质变化,产生生物胺。水产品中的生物胺含量和变化规律一直备受关注。苗麒等[35]对鳊鱼、南美白对虾和花蛤在不同贮藏温度下的生物胺含量变化进行研究,为最佳货架期提供了有效风险监测。罗振玲等[36]测定小黄花鱼中的9 种生物胺含量,为小黄花鱼中生物胺含量的快速测定、新鲜度判断及其加工制品中亚硝胺生成风险研究提供实验基础。其他研究者还对带鱼、桂花鱼、三文鱼、鲱鱼、梭子蟹、鲐、鳀等水产品中的生物胺含量进行研究,而大黄鱼、鲳鱼中生物胺含量的相关研究较少。胡月等[20]考察大黄鱼和黄鲷在-20、4、25 ℃贮藏期间7 种生物胺含量的变化,发现贮藏温度与鱼中生物胺的产生密切相关,朱作艺等[37]采用离子色谱-抑制电导及紫外串联检测分析大黄鱼在不同贮藏温度(0、4、25 ℃)下7 种生物胺含量变化,结果表明,高温会导致生物胺含量急剧累积,大黄鱼新鲜度显著降低,极易腐败。采用高效液相色谱法对大黄鱼和鲳鱼中9 种生物胺含量进行同时测定,所测生物胺种类较多,有一定研究意义。
本研究对高效液相色谱法进行优化,简化前处理步骤,对样品直接提取后衍生,选择高氯酸溶液作为提取液,选择Dns-Cl作为衍生剂,建立大黄鱼和鲳鱼中9 种生物胺含量测定的高效液相色谱法。并研究冷藏时间对大黄鱼和鲳鱼生物胺含量变化的影响,进一步提高鱼类水产品的食用安全性。
1 材料与方法
1.1 材料与试剂
大黄鱼(产地为福建宁德)、鲳鱼(产地为浙江舟山)均购自盒马鲜生。
Dns-Cl(纯度98%)、乙酸铵(纯度≥99%)上海麦克林生化科技有限公司;乙腈、丙酮(均为色谱纯) 上海安谱实验科技股份有限公司;碳酸氢钠、氢氧化钠(均为分析纯) 西陇科学股份有限公司;盐酸、氨水、高氯酸(均为分析纯) 国药集团化学试剂有限公司;9 种生物胺(色胺、2-苯乙胺、腐胺、尸胺、组胺、章鱼胺、酪胺、亚精胺、精胺)标准品(纯度96.8%~99.9%) 上海安谱璀世标准技术服务有限公司。
1.2 仪器与设备
e2695高效液相色谱仪(配备二极管阵列检测器)美国沃特世公司;POWTEQ HM100刀式研磨仪 北京格瑞德曼仪器设备有限公司;DF-101S集热式恒温加热磁力搅拌器 邦西仪器科技(上海)有限公司;3K15台式高速冷冻离心机 德国SIGMA公司;多点涡旋混匀仪上海沪析实业有限公司;BSA224S电子天平 赛多利斯科学仪器(北京)有限公司;单通道微量移液枪 德国普兰德贸易有限公司。
1.3 方法
1.3.1 标准溶液的配制
生物胺单标储备液(10 mg/mL):分别准确称取9 种生物胺标准品100 mg于10 mL容量瓶中,用0.1 mol/L盐酸溶液定容,0~4 ℃冷藏。
生物胺混标储备液(1 mg/mL):分别吸取1.00 mL生物胺单标储备液于同一个10 mL容量瓶中,用0.1 mol/L盐酸溶液定容,0~4 ℃冷藏。
生物胺混标工作液:根据实际情况,用高氯酸溶液(0.6 mol/L)稀释混标储备液,配制成不同质量浓度的混标工作液。
1.3.2 样品前处理
1.3.2.1 样品制备和贮藏
冰鲜的大黄鱼和鲳鱼,除鳞片、去内脏、剥鱼皮、剔鱼骨,取可食部分鱼肉进行研磨粉碎,制成鱼糜,各分装成10 份样品于自封袋中,每份样品约30 g左右,0~4 ℃密封冷藏1、2、3、4、5、10、15、20、25、30 d。
1.3.2.2 提取
50 mL离心管中放入1 颗陶瓷均质子和5 g绞碎的鱼肉,加入10 mL 0.6 mol/L高氯酸溶液,于涡旋混匀仪中涡旋20 min,4 ℃、4 000 r/min离心5 min,收集上清液,重复提取1 次,合并上清液,将上清液收集于25 mL棕色容量瓶中,0.6 mol/L高氯酸溶液定容。
1.3.2.3 衍生
试样的衍生:于5 mL具塞试管中加入1 mL提取液,加入0.2 mL 2 mol/L氢氧化钠溶液、0.3 mL饱和碳酸氢钠溶液、1 mL 10 mg/mL Dns-Cl衍生剂,混匀,盖上塞子,放置于集热式恒温加热磁力搅拌器中,40 ℃避光水浴45 min,结束反应后,加入20 μL氨水,终止衍生,轻微混匀,避光静置30 min,乙腈定容至3 mL刻度,混匀,取1 mL衍生液过0.22 μm滤膜,供高效液相色谱测定。
标准溶液的衍生:于5 mL具塞试管中加入1 mL生物胺混标工作液,其他操作同试样衍生步骤。
1.3.3 高效液相色谱条件
色谱柱型号:Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm);色谱柱温度:40 ℃;进样量:50 μL;检测器:二极管阵列检测器;检测波长:254 nm;流速:0.8 mL/min;流动相A:5 mmol/L乙酸铵,流动相B:乙腈。流动相梯度洗脱程序见表1。
表1 流动相梯度洗脱程序
Table 1 Gradient elution procedure of mobile phase

时间/min流动相A体积分数/%流动相B体积分数/%0.04555 30.0595 35.0595 36.04555 40.04555
1.3.4 高效液相色谱测定
将一系列混合标准工作液衍生液和试样衍生液依次注入高效液相色谱仪中,测得目标化合物的峰面积,以保留时间定性,以混合标准工作液质量浓度作为横坐标,峰面积作为纵坐标绘制标准曲线。根据标准曲线得出试样中目标化合物的含量。样品平行测定3 次。
1.4 数据处理
数据以平均值±标准差表示,使用Origin 2021软件绘制柱状图和折线图。
2 结果与分析
2.1 生物胺标准品的检测结果、线性方程及相关系数
溶液中9 种生物胺出峰时间见表2,9 种生物胺标准品的高效液相色谱图见图1,由于0~10 min为溶剂峰和杂峰,10 min后开始出目标峰,所以色谱图从10 min开始绘制,由图1可知,各峰之间基本达到基线分离,分离效果良好,峰型对称,无拖尾现象。
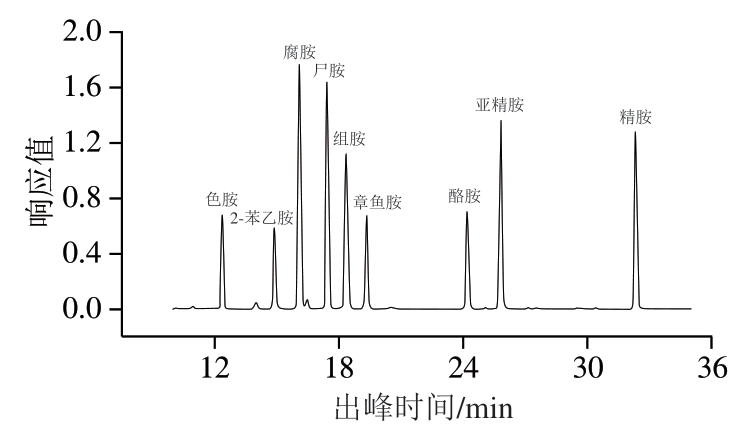
图1 9 种生物胺标准品的高效液相色谱图
Fig. 1 High performance liquid chromatograms of nine biogenic amine standards
表2 标准溶液中9 种生物胺出峰时间
Table 2 Peak times of nine biogenic amines in standard solution min
生物胺色胺2-苯乙胺腐胺尸胺组胺章鱼胺酪胺亚精胺精胺出峰时间12.37814.89416.10117.42618.36919.33924.19725.62132.331
分别配制0.1~80.0 mg/L的生物胺混标溶液进行测定,如表3所示,在0.1~80.0 mg/L范围内,9 种生物胺混合工作液质量浓度与峰面积的线性关系良好,相关系数均大于0.995,满足实验要求。
表3 9 种生物胺的标准曲线
Table 3 Standard curves for nine biogenic amines
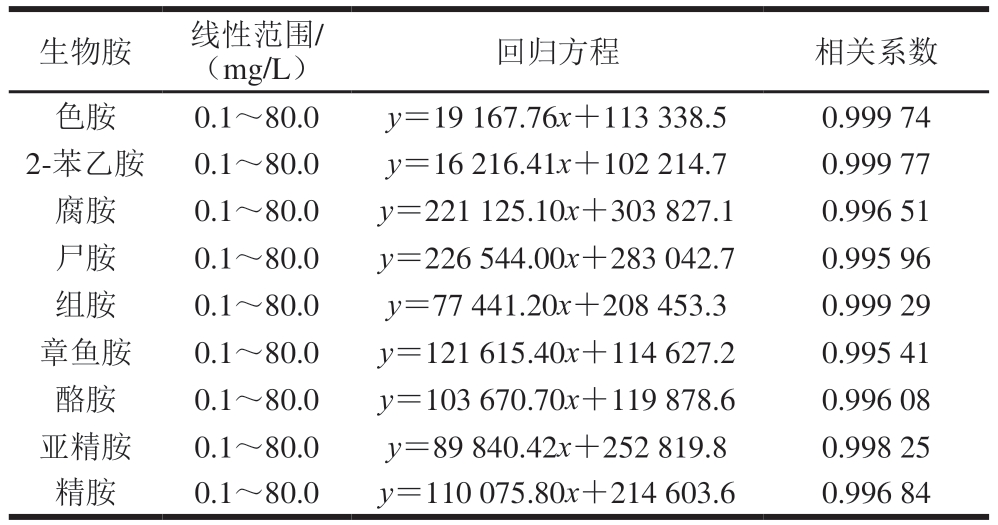
生物胺线性范围/(mg/L)回归方程相关系数色胺0.1~80.0y=19 167.76x+113 338.50.999 74 2-苯乙胺0.1~80.0y=16 216.41x+102 214.70.999 77腐胺0.1~80.0y=221 125.10x+303 827.10.996 51尸胺0.1~80.0y=226 544.00x+283 042.70.995 96组胺0.1~80.0y=77 441.20x+208 453.30.999 29章鱼胺0.1~80.0y=121 615.40x+114 627.20.995 41酪胺0.1~80.0y=103 670.70x+119 878.60.996 08亚精胺0.1~80.0y=89 840.42x+252 819.80.998 25精胺0.1~80.0y=110 075.80x+214 603.60.996 84
2.2 检出限和定量限
向阴性样品中添加不同质量浓度的生物胺混合标准溶液,通过信噪比(RSN)确定生物胺的检出限(RSN=3)和定量限(RSN=10)。在样品中添加0.5 mg/kg的生物胺时,各生物胺峰的RSN均大于3,故将其作为方法检出限。在样品中添加1.0 mg/kg的生物胺时,各生物胺峰的RSN均大于10,故将其作为方法定量限。
2.3 回收率和精密度
选取5.0 g阴性样品,添加不同质量浓度的生物胺混合标准溶液,按照上述实验方法对样品进行前处理和衍生,进样6 次,进行回收率和精密度测定,具体结果见表4,9 种生物胺在4.0、40、80 mg/kg加标水平的平均加标回收率为75.70%~105.40%,相对标准偏差为1.65%~4.41%,方法重复性良好,有较好的精密度,符合该方法对回收率和精密度的要求。
表4 9 种生物胺的加标回收率和精密度(n=6)
Table 4 Recoveries and precision of nine kinds of biogenic amines (n = 6)
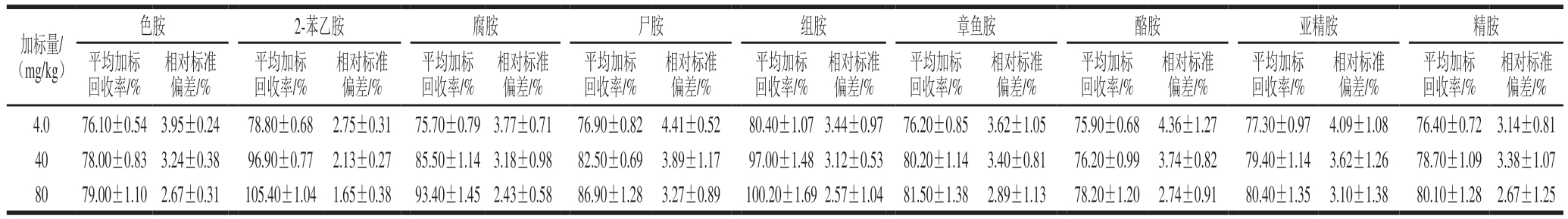
加标量/(mg/kg)相对标准偏差/%4.076.10±0.543.95±0.2478.80±0.68 2.75±0.3175.70±0.793.77±0.7176.90±0.824.41±0.5280.40±1.073.44±0.9776.20±0.853.62±1.0575.90±0.684.36±1.2777.30±0.974.09±1.0876.40±0.723.14±0.81 4078.00±0.833.24±0.3896.90±0.772.13±0.2785.50±1.143.18±0.9882.50±0.693.89±1.1797.00±1.483.12±0.5380.20±1.143.40±0.8176.20±0.993.74±0.8279.40±1.143.62±1.2678.70±1.093.38±1.07 8079.00±1.102.67±0.31105.40±1.041.65±0.3893.40±1.452.43±0.5886.90±1.283.27±0.89100.20±1.692.57±1.0481.50±1.382.89±1.1378.20±1.202.74±0.9180.40±1.353.10±1.3880.10±1.282.67±1.25色胺2-苯乙胺腐胺尸胺组胺章鱼胺酪胺亚精胺精胺平均加标回收率/%相对标准偏差/%平均加标回收率/%相对标准偏差/%平均加标回收率/%相对标准偏差/%平均加标回收率/%相对标准偏差/%平均加标回收率/%相对标准偏差/%平均加标回收率/%相对标准偏差/%平均加标回收率/%相对标准偏差/%平均加标回收率/%相对标准偏差/%平均加标回收率/%
2.4 大黄鱼和鲳鱼冷藏条件下生物胺含量变化
如表5所示,冷藏1 d时,大黄鱼和鲳鱼中未检出生物胺,冷藏30 d时,大黄鱼和鲳鱼中腐胺、尸胺、酪胺、亚精胺和精胺含量均有变化,而色胺、2-苯乙胺、组胺、章鱼胺含量均未检出。
表5 大黄鱼和鲳鱼冷藏1~30 d过程中的生物胺含量变化
Table 5 Changes in biogenic amine contents of large yellow croaker and pomfret cold stored for 1–30 days
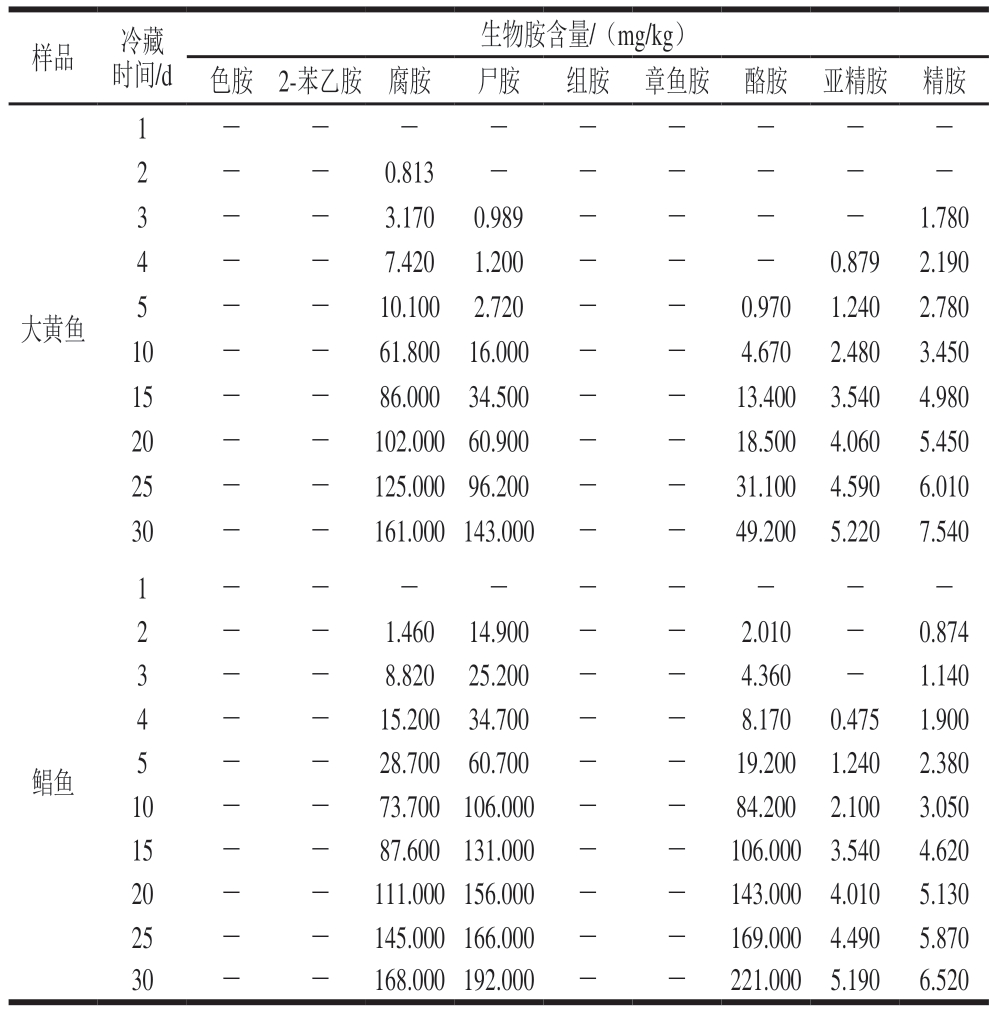
注:-.未检出。
样品冷藏时间/d生物胺含量/(mg/kg)色胺2-苯乙胺腐胺尸胺组胺章鱼胺酪胺亚精胺精胺大黄鱼1---------2--0.813------3--3.1700.989----1.780 4--7.4201.200---0.8792.190 5--10.1002.720--0.9701.2402.780 10--61.80016.000--4.6702.4803.450 15--86.00034.500--13.4003.5404.980 20--102.00060.900--18.5004.0605.450 25--125.00096.200--31.1004.5906.010 30--161.000143.000--49.2005.2207.540 1---------2--1.46014.900--2.010-0.874 3--8.82025.200--4.360-1.140 4--15.20034.700--8.1700.4751.900 5--28.70060.700--19.2001.2402.380 10--73.700106.000--84.2002.1003.050 15--87.600131.000--106.0003.5404.620 20--111.000156.000--143.0004.0105.130 25--145.000166.000--169.0004.4905.870 30--168.000192.000--221.0005.1906.520鲳鱼
针对腐胺、尸胺、酪胺、亚精胺和精胺5 种含量变化明显的生物胺,选取冷藏5、15、30 d样品的生物胺含量进行具体分析,如图2A所示,大黄鱼中的生物胺总含量从17.9 mg/kg增加至366 mg/kg,腐胺、尸胺、酪胺、亚精胺和精胺最终含量分别达到161、143、49.2、5.22、7.54 mg/kg。如图2B所示,鲳鱼中的生物胺总含量从112 mg/kg增加到593 mg/kg,腐胺、尸胺、酪胺、亚精胺和精胺最终含量分别达到168、192、221、5.19、6.52 mg/kg。研究结果表明,大黄鱼和鲳鱼在冷藏30 d过程中,腐胺、尸胺和酪胺的积累量相对较大,而亚精胺和精胺含量则缓慢增加。
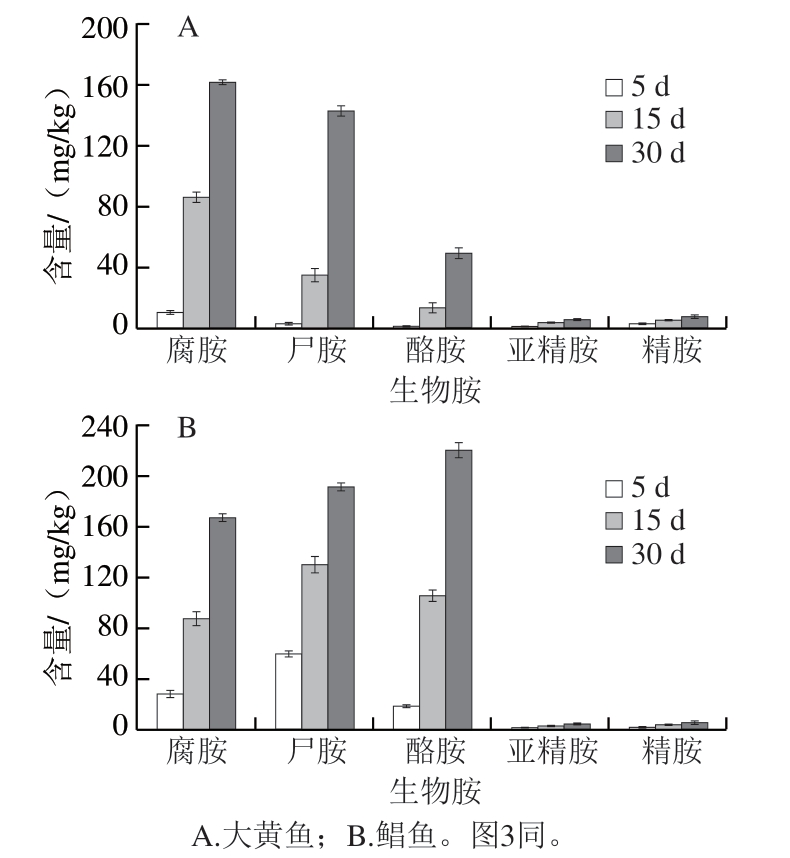
图2 大黄鱼、鲳鱼冷藏5、15、30 d的生物胺含量变化
Fig. 2 Changes in biogenic amine contents in yellow croaker and pomfret cold stored for 5, 15 and 30 days
腐胺、尸胺和酪胺含量增加明显,选取0~4 ℃冷藏1、2、3、4、5、10、15、20、25、30 d的样品,对上述3 种生物胺含量增加幅度进行具体分析,如图3A所示,大黄鱼在0~4 ℃冷藏条件下,第5~10天,腐胺含量从10.1 mg/kg增加到61.8 mg/kg,增加幅度最大,尸胺和酪胺含量增加较平缓,第25~30天,腐胺、尸胺和酪胺含量分别增加36.0、46.8、18.1 mg/kg,3 种生物胺含量增加幅度较大,总的来看,腐胺含量增加161 mg/kg,增加量最大,其次为尸胺。如图3B所示,鲳鱼在0~4 ℃冷藏条件下,第5~10天,腐胺、尸胺和酪胺含量分别增加45.0、45.3、65.0 mg/kg,3 种生物胺含量增加幅度最大,30 d内,酪胺含量增加221 mg/kg,而腐胺和尸胺含量分别增加168、192 mg/kg,相较而言,酪胺含量增加速率快、幅度大。
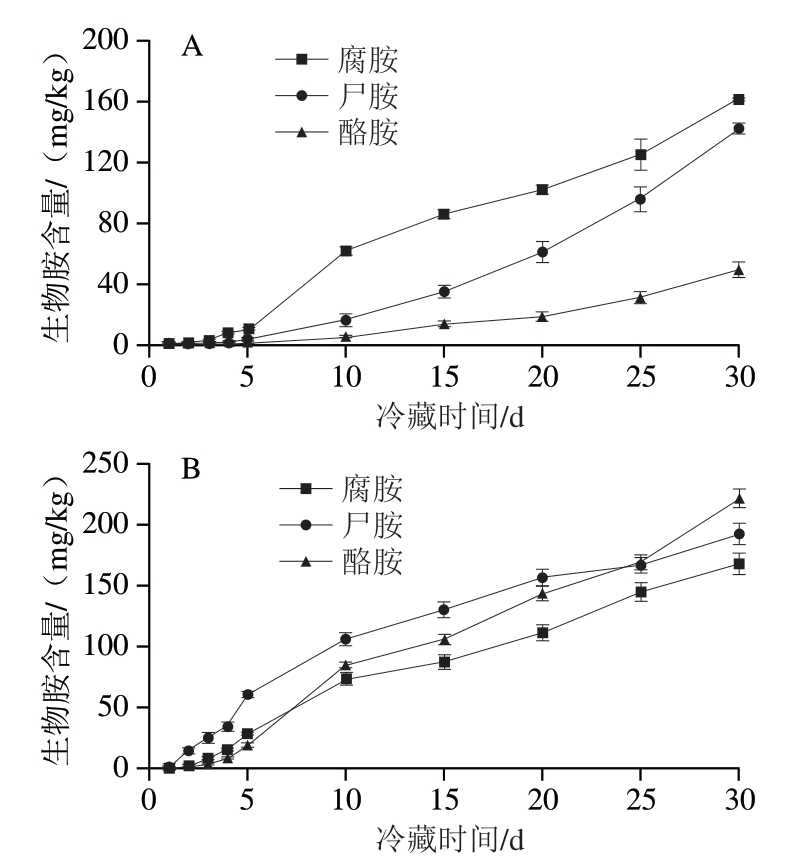
图3 大黄鱼、鲳鱼冷藏1~30 d期间生物胺含量的变化
Fig. 3 Changes in biogenic amine contents in large yellow croaker and pomfret cold stored for 1–30 days
综上所述,在0~4 ℃冷藏条件下,从腐败程度上观察,大黄鱼比鲳鱼更易发生变质,第30天的大黄鱼肉质严重糜烂,散发出严重臭味,而鲳鱼肉质稍软烂,散发出轻微的臭味,因此随着冷藏时间的延长,微生物数量可能也随之快速增长,生物胺总量也相应增加。同一时间段,鲳鱼中生物胺总量均比大黄鱼中生物胺总量高,而大黄鱼中腐胺、尸胺含量变化明显,鲳鱼中酪胺含量变化较明显,这是由于易在鲳鱼冷藏过程中生成的乳酸菌会产生酪胺并积累,并产生酪氨酸脱羧酶从而发生脱羧作用[38]。由此可知,水产品本身的微生物种类很大可能影响生物胺种类的变化,而贮藏条件影响微生物的生长,从而导致生物胺总量随之发生变化。
3 结 论
本研究较国家标准检测方法而言,对样品前处理方式加以精减改进,利用高效液相色谱-二极管阵列检测器建立了一种9 种生物胺含量的检测方法,用0.6 mol/L高氯酸溶液提取样品,提取效果较好,Dns-Cl衍生剂进行柱前衍生,衍生条件易控制,衍生后产物较稳定,生物胺在35 min内得到有效分离且峰形良好。通过线性、检出限、定量限、精密度和回收率的测定,对方法的准确度和可靠度进行验证。结果表明:此方法可将9 种生物胺在35 min内有效分离;9 种生物胺混合标准溶液在0.1~80.0 mg/L范围内,质量浓度与峰面积呈良好的线性关系,相关系数均大于0.995;方法检出限为0.5 mg/kg,定量限为1.0 mg/kg;加标回收率介于75.70%~105.40%之间,相对标准偏差≤5%(n=6)。表明所建立的方法能够对大黄鱼、鲳鱼中9 种生物胺含量进行简便、准确、可靠的分析。用本实验确定好的方法对在0~4 ℃下分别冷藏1、2、3、4、5、10、15、20、25、30 d的大黄鱼、鲳鱼样品进行测定,结果表明,随着冷藏时间的延长,鱼肉新鲜度降低,微生物滋生,易腐败,生物胺总量也随之增加,其中,腐胺、尸胺、酪胺含量增加明显,说明海洋鱼类变质程度和生物胺含量呈正相关,可作为鱼类新鲜度的指标。本研究可以为海洋鱼类中生物胺含量的日常分析提供技术支持。
然而,值得注意的是,本研究中仅对冷藏条件下水产品中生物胺含量变化规律进行探讨,后续可从常温和冷冻贮藏条件对生物胺含量的影响方面进行研究,但影响水产品中生物胺形成的因素除了贮藏条件外,还有微生物和外界环境(pH值、温度、盐含量等),因此后续研究内容中,将从多方面进行分析,对水产品腐败程度的描述加以完善,为水产品的新鲜度提供准确而全面的评价。
[1] 闵盛, 孙群, 汪洋, 等. 高效液相色谱法测定畜禽肉中8 种生物胺含量国家标准方法的改进[J]. 理化检验-化学分册, 2022, 58(5): 607-611. DOI:10.11973/Ihjy-hx202205022.
[2] 郭永辉, 郭佩华, 连雅林, 等. 超高效液相色谱紫外-柱前衍生法测定肉制品中的9 种生物胺[J]. 食品安全质量检测学报, 2021, 12(20):7960-7968. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.20.009.
[3] 曾立威, 蔡翔宇, 吴玉杰, 等. 超高效液相色谱法同时快速测定多种动物源食品中9 种生物胺含量[J]. 食品安全质量检测学报, 2017,8(3): 968-974. DOI:10.19812/j.cnki.jfsq11-5956/ts.2017.03.045.
[4] 宋关梁. 海水鱼优势腐败菌产生物胺能力比较及生物消减技术研究[D]. 大连: 大连海洋大学, 2024. DOI:10.27821/d.cnki.gdlhy.2024.000091.
[5] AKDIS C A, SIMONS F E R. Histamine receptors are hot in immunopharmacology[J]. European Journal of Pharmacology, 2006,533(1/2/3): 69-76. DOI:10.1016/j.ejphar.2005.12.044.
[6] 孙艳妮, 张宁, 王翠玲, 等. 高效液相色谱法鉴别及测定中药吴茱萸中的生物胺[J]. 分析化学, 2014, 42(2): 273-277. DOI:10.3724/SP.J.1096.2014.30930.
[7] ENTSCHLADEN F, DRELL T L, LANG K, et al. Tumour-cell migration, invasion, and metastasis: navigation by neurotransmitters[J].Cancer Control, 2004, 5(4): 254-258. DOI:10.1016/S1470-2045(04)01431-7.
[8] 夏秀东, 单成俊, 李莹, 等. 白鱼腐败菌产生物胺能力分析[J]. 食品科学, 2016, 37(23): 196-204. DOI:10.7506/spkx1002-6630-201623033.
[9] 周凌聿, 林倩妃, 王鸿霖, 等. 水产品中生物胺的检测技术研究进展[J]. 肉类研究, 2022, 36(8): 57-65. DOI:10.7506/rlyj1001-8123-20220406-030.
[10] 刘洋帆, 李绪鹏, 冯阳, 等. 超高效液相色谱-串联质谱法测定鲣鱼中的生物胺[J]. 食品与发酵工业, 2022, 48(20): 225-230.DOI:10.13995/j.cnki.11-1802/ts.029408.
[11] 田颖, 张丽英, 陈义强, 等. 高效液相色谱法同时测定动物源性饲料中9 种生物胺[J]. 中国畜牧杂志, 2023, 59(9): 337-342.DOI:10.19556/j.0258-7033.20220509-06.
[12] 刘景, 任婧, 孙克杰. 食品中生物胺的安全性研究进展[J]. 食品科学,2013, 34(5): 322-326.
[13] 陈树兵, 杨亮, 曹苏仙. 水产品中的生物胺及其检测方法研究进展[J]. 食品研究与开发, 2015, 36(1): 141-144. DOI:10.3969/j.issn.1005-6521.2015.01.036.
[14] 张月美, 包玉龙, 罗永康, 等. 草鱼冷藏过程鱼肉品质与生物胺的变化及热处理对生物胺的影响[J]. 南方水产科学, 2013, 9(4): 56-61.DOI:10.3696/j.issn.2095-0780.2013.04.010.
[15] 李伟, 杨敏. 生物胺对食品质量和安全的影响[J]. 食品安全导刊,2023(11): 32-35. DOI:10.16043/j.cnki.cfs.2023.11.044.
[16] 温永柱, 范文来, 徐岩. GC-MS法定性白酒中的多种生物胺[J]. 酿酒,2013, 140(1): 38-41. DOI:10.3969/j.issn.1002-8110.2013.01.011.
[17] 周勇, 王萍亚, 赵华, 等. 离子色谱法测定冷冻海产品中的生物胺[J].食品工业, 2014, 35(5): 238-241.
[18] BOLYGO E, COOPER P A, JESSOP K M, et al. Determination of histamine in tomatoes by capillary electrophoresis[J]. Journal of AOAC International, 2000, 83(1): 89-94. DOI:10.1021/jf990036e.
[19] 宋卫得, 许美玲, 高尧华. 离子色谱法同时测定果汁中20 种有机胺、生物胺和阳离子[J]. 分析试验室, 2020, 39(5): 590-595.DOI:10.13595/j.cnki.issn1000-0720.2019.081101.
[20] 胡月, 黄志勇. 柱前衍生HPLC同时测定鱼中多种生物胺及其变化规律[J]. 中国食品学报, 2012, 12(11): 142-147. DOI:10.16429/j.1009-7848.2012.11.009.
[21] 翟红蕾, 杨贤庆, 郝淑贤, 等. 生物胺高效液相色谱法测定条件的选择与优化[J]. 食品科学, 2011, 32(18): 180-184.
[22] PROESTOS C, LOUKATOS P, KOMAITIS M. Determination of biogenic amines in wines by HPLC with precolumn dansylation and fluorimetric detection[J]. Food Chemistry, 2008, 106(3): 1218-1224.DOI:10.1016/j.foodchem.2007.06.048.
[23] 杨静, 刘宗科, 邹鹏, 等. 高效液相色谱法检测食品中生物胺的不同离线衍生策略的比较分析[J]. 食品安全质量检测学报, 2021,12(23): 9035-9042. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.23.009.
[24] 张瑀, 王玥. 高效液相色谱法同时测定咸鱼中8 种生物胺[J].中国食品添加剂, 2021, 32(4): 107-111. DOI:10.19804/j.issn1006-2513.2021.04.018.
[25] 林瑶. 超高效液相色谱-串联质谱法同时测定食品中5 种生物胺的方法建立[J]. 预防医学论坛, 2022, 28(11): 834-838. DOI:10.16406/j.pmt.issn.1672-9153.2022.11.08.
[26] 吴玉田, 王颖怡, 张权, 等. 超高效液相色谱-串联质谱法测定冷冻水产品中生物胺[J]. 分析科学报, 2023, 39(6): 737-742. DOI:10.13526/j.issn.1006-6144.2023.06.018.
[27] 邢雪, 盛新颖, 郝玉玲, 等. 液相色谱-串联质谱法测定酿造酱油中12 种生物胺[J]. 食品安全导刊, 2023(17): 80-85. DOI:10.16043/j.cnki.cfs.2023.17.026.
[28] 郭叶弟, 张葆春, 商禹, 等. 白兰地原酒及成品酒中九种生物胺含量分析[J]. 食品与发酵工业, 2024, 50(16): 306-312. DOI:10.13995/j.cnki.11-1802/ts.038224.
[29] 杨贤庆, 翟红蕾, 郝淑贤, 等. 高效液相色谱法测定生物胺衍生条件的优化研究[J]. 南方水产科学, 2012, 8(1): 49-53. DOI:10.3969/j.issn.2095-0780.2012.01.008.
[30] 张文豪, 樊金星, 张叶, 等. 苯甲酰氯衍生-高效液相色谱法测定鱼露中的生物胺[J]. 河南预防医学杂志, 2022, 33(7): 488-491.DOI:10.13515/j.cnki.hnjpm.1006-8414.2022.07.002.
[31] 丁卓平, 刘辰麒, 等. 高效液相色谱法同时测定水产品中10 种生物胺的研究[J]. 分析测试学报, 2006, 25(4): 59-62. DOI:10.3969/j.issn.1004-4957.2006.04.015.
[32] 张阳. 水产品中生物胺含量UPLC检测方法的建立及其变化规律的研究[D]. 南京: 南京农业大学, 2012. DOI:10.7666/d.y2362012.
[33] 吴燕燕, 钱茜茜, 李来好, 等. 3 种添加物对咸鱼加工贮藏过程中生物胺的抑制效果[J]. 食品科学, 2016, 37(18): 190-196. DOI:10.7506/spkx1002-6630-201618031.
[34] KONAKOVSKY V, FOCKE M, HOFFMANN-SOMMERGRUBER K,et al. Levels of histamine and other biogenic amines in highquality red wines[J]. Food Additives & Contaminants: Part A, 2011, 28(4): 408-416. DOI:10.1080/19440049.2010.551421.
[35] 苗麒, 曲映红, 周惠敏, 等. 不同贮藏温度下鳊鱼、南美白对虾和花蛤生物胺的比较分析[J]. 食品与发酵工业, 2024, 50(6): 63-71.DOI:10.13995/j.cnki.11-1802/ts.034530.
[36] 罗振玲, 高海波, 杨挺, 等. 超高效液相色谱-串联质谱法同时测定小黄花鱼中9 种生物胺[J]. 食品工业科技, 2023, 44(5): 251-257.DOI:10.13386/j.issn1002-0306.2022040183.
[37] 朱作艺, 张玉, 王君虹, 等. 不同贮藏条件下大黄鱼生物胺变化[J]. 浙江农业学报, 2018, 30(9): 1592-1598. DOI:10.3969/j.issn.1004-1524.2018.09.21.
[38] HAZARDS E. Scientific opinion on risk based control of biogenic amine formation in fermented foods[J]. EFSA Journal, 2011, 9(10):2939. DOI:10.2903/j.efsa.2011.2393.