牡蛎又称蚝、海蛎子,2022年我国养殖产量达619.95万 t[1],占贝类养殖总产量的39.5%。其中,太平洋牡蛎(Crassostrea gigas)是辽宁、山东等北方沿海地区的主要养殖品种,具有生长速度快、肉质肥美、风味独特等特点,深受消费者喜爱。牡蛎鲜销主要有2 种方式:一种是采捕上岸暂养后批发至当地市场进行销售,另一种是利用牡蛎耐干露特性,净化后冷链运输至范围更广的地区进行销售。牡蛎在冷链贮运过程中受干露、饥饿、缺氧、振荡等胁迫,营养成分和风味会发生变化,导致“活而不鲜”[2]。
近年来,科研人员对活体牡蛎流通过程中的品质变化进行了系列研究。例如,林恒宗等[3]发现,活体牡蛎在低温流通过程中会发生氧化应激,抗氧化酶活力显著升高;闫丽新等[4]发现,牡蛎在贮运过程中会发生滋味变化,且这种变化与呈味氨基酸、有机酸、金属离子等密切相关;罗丽俐等[5]研究发现,牡蛎在无水保活过程中色泽、质构等感官品质会发生劣化,且与蛋白质降解和脂质氧化相关。而目前有关牡蛎活体贮藏过程中脂质组分变化研究较少。脂质是重要的风味前体物质,其氧化分解生成的醛、醇、酮等挥发性物质对风味有重要贡献[6],尤其是牡蛎富含二十碳五烯酸(C20:5 n-3)(eicosapentaenoic acid,EPA)、二十二碳六烯酸(C22:6 n-3)(docosahexaenoic acid,DHA)等多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)[7],更易发生氧化,引起挥发性风味变化。为进一步了解牡蛎冷链贮运中风味变化规律,本研究以活体太平洋牡蛎为研究对象,对其4 ℃贮藏过程中脂质及挥发性物质变化进行研究,以期为活体牡蛎冷链贮运过程中的品质控制提供参考。
1 材料与方法
1.1 材料与试剂
太平洋牡蛎于2023年11月采集自青岛市胶州湾牡蛎养殖场,选取300 只活体牡蛎,将外壳清洗干净后,加冰,置于洁净泡沫箱内,2 h内运至实验室。挑选富有活力、形状完整的活体牡蛎进行实验,牡蛎平均壳长(119.37±2.58)mm,带壳质量(102.5±4.8)g。
氯仿、甲醇、氯化钠、正庚烷、硫氰酸钾、钼酸钠、硫酸联氨、2-硫代巴比妥酸、异丙醇、Triton X-100(均为分析纯) 国药集团化学试剂有限公司;脂肪酸混合标准品、内标十九烷酸甲酯 美国Sigma公司;甘油三酯试剂盒 中生北控生物科技股份有限公司。
1.2 仪器与设备
YC-800低温恒温层析柜 北京亚星仪科科技发展有限公司;OSE手持式匀浆机 天根生化科技(北京)有限公司;N-1001旋转蒸发仪 美国Eyela公司;UV-2802紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;7890A气相色谱-质谱仪 美国Agilent公司;ALPHA 1-2 LD plus冷冻干燥机 德国Martin Christ公司;FlavourSpec®气相色谱-离子迁移谱(gas chromatography-ion mobility spectrometry,GC-IMS)仪德国G.A.S公司。
1.3 方法
1.3.1 样品处理
将牡蛎分装于泡沫保温箱(600 mm×420 mm×315 mm)中,置于4 ℃层析柜中进行贮藏,定期观察活力状态,分别在0、2、4、6 d取样,迅速开壳取肉,用4 ℃预冷的0.9 g/100 mL生理盐水漂洗,吸水纸拭干表面水分,于-80 ℃保存备用。
1.3.2 存活率测定
通过观察牡蛎的闭合情况判断牡蛎是否存活。轻轻敲击双壳张开的牡蛎,若可实现自主闭合,则认为该牡蛎存活状态良好,若长时间无反应,则认为该牡蛎已死亡。将用于存活率检测的牡蛎平均分为2 组,每组58 只,结果以2 组存活率的平均值表示。存活率按下式计算[8]:

1.3.3 总脂含量测定
参照王天雪等[9]的方法略作改动。取牡蛎匀浆10.0 g,加入30 mL氯仿-甲醇(2∶1,V/V),静置过夜,加入其1/5体积的生理盐水,混匀后静置30 min。以无水硫酸钠过滤氯仿层,滤液45 ℃旋蒸,氮气吹干后,准确称量,即为总脂含量(以干基计)。
1.3.4 甘油三酯含量测定
采用0.788 g/mL异丙醇-1.07 g/mL Triton X-100溶液将总脂样品稀释至合适浓度,取10 μL于1.5 mL离心管中,加入1.0 mL工作液,混匀。以纯水为空白管,校准品为校准管,37 ℃保温10 min,505 nm波长处测定吸光度。按照试剂盒说明书计算甘油三酯含量。
1.3.5 磷脂含量测定
参照万楚筠等[10]的方法略作改动。取总脂样品0.1 g,加入20 mL浓硝酸-高氯酸溶液(4∶1,V/V)进行消化,至消化液无色为终点。将消化液用蒸馏水定容至50 mL,准确移取10 mL于50 mL比色管中,加入8 mL 1.5 g/100 mL硫酸联氨溶液与2 mL 2.5 g/100 mL钼酸钠溶液,振荡混匀。沸水浴10 min,取出后冷却至室温。用蒸馏水稀释至50 mL,摇匀,静置10 min,650 nm波长处测定吸光度,计算磷脂含量。
1.3.6 游离脂肪酸组成测定
取总脂样品1.5 g,加入2 mL 2.0 g/100 mL NaOH-甲醇溶液,85 ℃水浴30 min;加入3 mL 14.0 g/100 mL三氟化硼-甲醇溶液,85 ℃水浴30 min;冷却至室温后加入1 mL正己烷,振荡萃取2 min,静置分层;取上层清液100 μL,正己烷定容至1 mL,过0.45 μm滤膜后上机测定。气相色谱-质谱参数设置参照曹荣等[11]的方法。
1.3.7 过氧化值(peroxide value,POV)测定
参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》中滴定法测定POV。
1.3.8 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值测定
参照王善宇等[12]的方法略作改动。取5.0 g牡蛎匀浆于100 mL具塞锥形瓶中,加入50 mL 7.5 g/100 mL三氯乙酸溶液,加塞摇匀,于50 ℃恒温水浴振荡箱振摇30 min,取出冷却至室温,过滤,取5 mL滤液于25 mL具塞比色管,加入5 mL 0.288 g/100 mL 2-硫代巴比妥酸溶液,摇匀,90 ℃水浴30 min,取出冷却至室温。532 nm波长处测定吸光度,结果表示为mg/kg。
1.3.9 挥发性成分测定
取2.0 g牡蛎肉匀浆,放入20 mL顶空进样瓶中,60 ℃平衡20 min后,采用GC-IMS进行检测。通过比对NIST气相保留指数数据库与IMS迁移时间数据库对挥发性物质进行定性分析。
1.4 数据处理
实验重复2 次,每个指标平行测定3 次,结果以平均值±标准差表示。采用SPSS 22.0软件中Duncan多重范围检验法进行数据分析,P<0.05表示差异显著。采用GC-IMS仪器自带LAV软件的Gallery Plot功能绘制样品挥发性成分热图。采用Origin Pro 2024软件对脂质组分与挥发性成分进行Pearson相关性分析,利用Correlation Plot软件绘制相关性分析图。
2 结果与分析
2.1 牡蛎冷藏过程中存活率变化
如图1所示,随冷藏时间的延长,因受到低温、饥饿等多重胁迫,部分牡蛎活力逐渐降低,直至死亡,但总体上牡蛎的抗逆性较强,冷藏6 d后,牡蛎存活率高达86.2%,这与高加龙等[13]的研究结果基本一致。
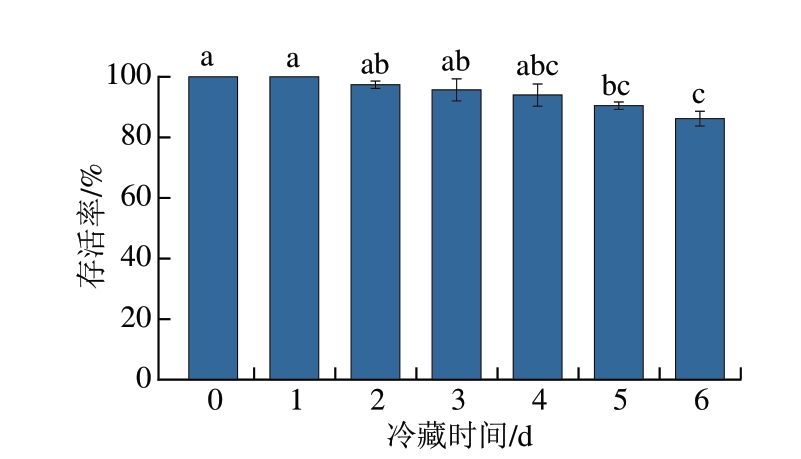
图1 牡蛎冷藏过程中存活率变化
Fig. 1 Changes in survival rate of oysters during cold storage
小写字母不同表示差异显著(P<0.05)。图2、3同。
2.2 牡蛎冷藏过程中总脂含量及主要脂质组分变化
如图2A所示,随冷藏时间的延长,牡蛎总脂含量逐渐降低。冷藏6 d时,总脂质量分数为11.3%,显著低于初始值(13.0%)(P<0.05),表明在不利环境条件下牡蛎会分解体内脂质提供能量,以维持自身生命活动[14]。此外,脂质分解供能的同时生成醇类、醛类、酸类等物质,对牡蛎风味产生影响[15]。
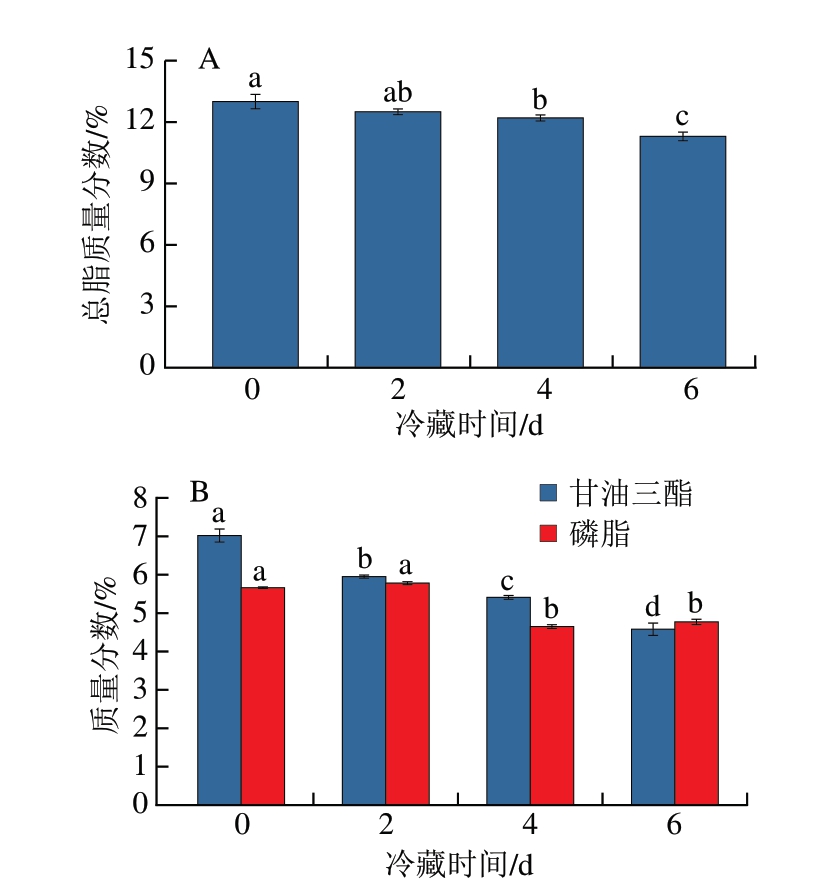
图2 牡蛎冷藏过程中总脂(A)和主要脂质组分(B)含量变化
Fig. 2 Changes in total lipid (A) and main lipid composition (B) of oysters during cold storage
太平洋牡蛎脂质主要由甘油三酯和磷脂组成[16]。由图2B可知,在冷藏过程中,太平洋牡蛎甘油三酯和磷脂含量均呈下降趋势,冷藏6 d时,甘油三酯质量分数由初始的7.02%降至4.58%,磷脂质量分数由5.66%降至4.77%。与磷脂相比,甘油三酯含量降低幅度更大,但磷脂分子中含有亚麻酸(C18:3 n-3)、EPA、DHA等PUFA,易发生氧化反应,生成的初级产物和次级产物不稳定,进而与牡蛎自身的蛋白质、金属离子等反应,影响整体风味[17]。
2.3 牡蛎冷藏过程中游离脂肪酸组成变化
由表1可知,从初始样本中共检出18 种脂肪酸,其中饱和脂肪酸(saturated fatty acid,SFA)6 种,以棕榈酸(C16:0)和硬脂酸(C18:0)为主;单不饱和脂肪酸(monounsaturated fatty acid,MUFA)4 种,以棕榈油酸(C16:1)和油酸(C18:1 n-9)为主;PUFA 8 种,其中EPA和DHA相对含量较高。EPA、DHA是ω-3 PUFA,是人体自身不能合成但又不可缺少的重要营养素,属于人体必需脂肪酸,其不仅具有调节脂质代谢、预防心脑血管疾病等功能[18],也易氧化分解生成醛类等,通常与不愉快气味相关。
表1 牡蛎冷藏过程中游离脂肪酸相对含量变化
Table 1 Relative content changes in free fatty acid of oysters during cold storage %
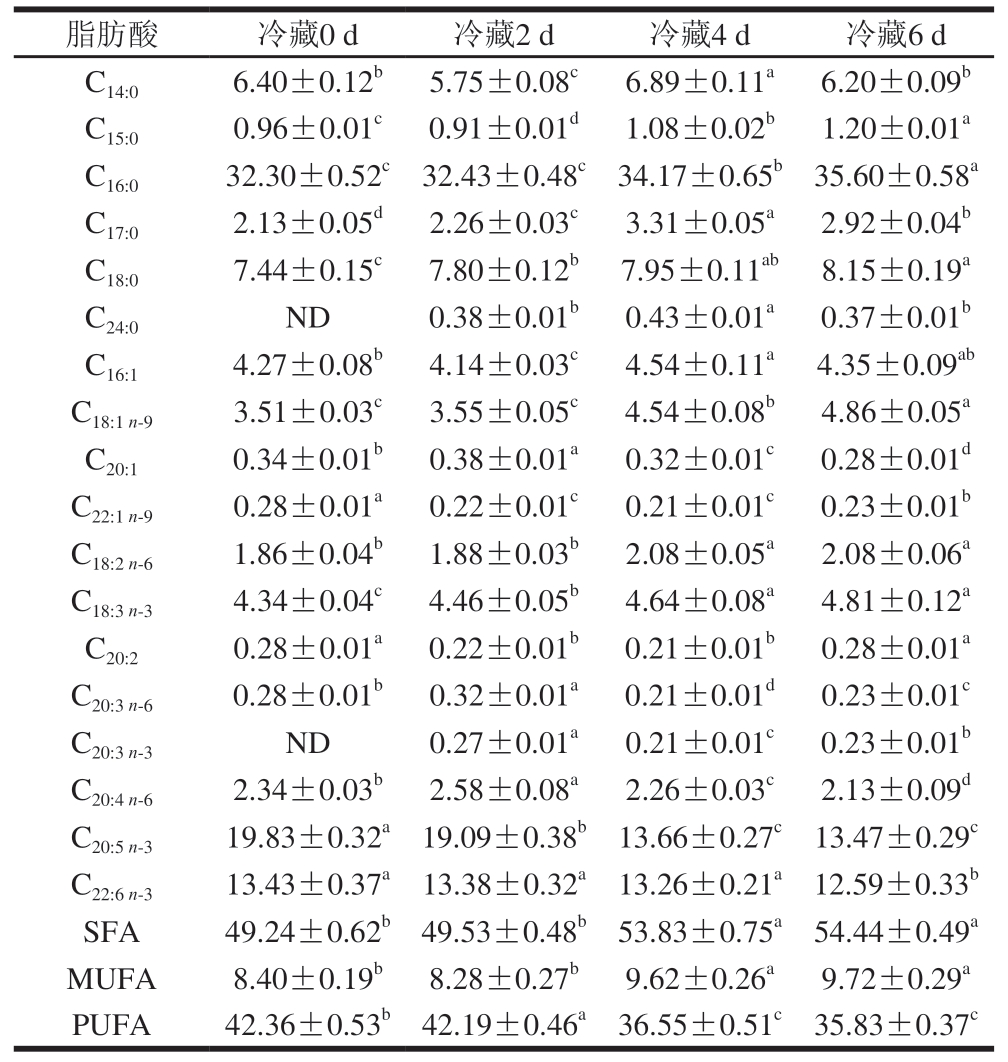
注:同行小写字母不同表示差异显著(P<0.05);ND.未检出。
脂肪酸冷藏0 d冷藏2 d冷藏4 d冷藏6 d C14:06.40±0.12b5.75±0.08c6.89±0.11a6.20±0.09b C15:00.96±0.01c0.91±0.01d1.08±0.02b1.20±0.01a C16:032.30±0.52c32.43±0.48c34.17±0.65b35.60±0.58a C17:02.13±0.05d2.26±0.03c3.31±0.05a2.92±0.04b C18:07.44±0.15c7.80±0.12b7.95±0.11ab8.15±0.19a C24:0ND0.38±0.01b0.43±0.01a0.37±0.01b C16:14.27±0.08b4.14±0.03c4.54±0.11a4.35±0.09ab C18:1 n-93.51±0.03c3.55±0.05c4.54±0.08b4.86±0.05a C20:10.34±0.01b0.38±0.01a0.32±0.01c0.28±0.01d C22:1 n-90.28±0.01a0.22±0.01c0.21±0.01c0.23±0.01b C18:2 n-61.86±0.04b1.88±0.03b2.08±0.05a2.08±0.06a C18:3 n-34.34±0.04c4.46±0.05b4.64±0.08a4.81±0.12a C20:20.28±0.01a0.22±0.01b0.21±0.01b0.28±0.01a C20:3 n-60.28±0.01b0.32±0.01a0.21±0.01d0.23±0.01c C20:3 n-3ND0.27±0.01a0.21±0.01c0.23±0.01b C20:4 n-62.34±0.03b2.58±0.08a2.26±0.03c2.13±0.09d C20:5 n-319.83±0.32a19.09±0.38b13.66±0.27c13.47±0.29c C22:6 n-313.43±0.37a13.38±0.32a13.26±0.21a12.59±0.33b SFA49.24±0.62b49.53±0.48b53.83±0.75a54.44±0.49a MUFA8.40±0.19b8.28±0.27b9.62±0.26a9.72±0.29a PUFA42.36±0.53b42.19±0.46a36.55±0.51c35.83±0.37c
冷藏过程中,牡蛎SFA相对含量显著增加(P<0.05),其中C16:0相对含量为32.30%~35.60%,C18:0相对含量为7.44%~8.15%,这可能与贮藏过程中甘油三酯的降解有关[19]。MUFA相对含量也显著增加(P<0.05),其中C18:1 n-9增加最为明显。PUFA相对含量显著减少(P<0.05),其中EPA由19.83%降至13.47%,进一步证明冷藏过程中牡蛎PUFA更易发生氧化,这与劳邦盛等[20]的研究结果一致。PUFA氧化分解会产生部分短链挥发性成分,引起腥味等不良气味加重[21],其中亚油酸(C18:2 n-6)是己醛、庚醛等直链醛的前体物质,2-己烯醛、2-庚烯醛主要来源于C18:3 n-3,花生四烯酸(C20:4 n-6)是1-辛烯-3-醇的前体物质,EPA降解可生成1-戊烯-3-醇、2,4-庚二烯醛[22],1,5-辛二烯-3-酮是DHA降解的主要产物[23]。
2.4 牡蛎冷藏过程中脂质氧化情况
POV反映脂质氧化初期生成氢过氧化物的量,是评价脂质初级氧化程度的重要指标[24]。由图3A可知,在冷藏过程中,太平洋牡蛎POV呈上升趋势。冷藏6 d时,POV从初始的0.30 g/100 g显著增至0.56 g/100 g(P<0.05)。TBARS值是表征脂质次级氧化程度的重要指标,以丙二醛含量表示[25]。由图3B可知,在贮藏过程中,太平洋牡蛎TBARS值不断升高。冷藏6 d时,TBARS值由初始的0.27 mg/kg显著增至0.51 mg/kg(P<0.05)。通常认为2.0 mg/kg是TBARS值可接受上限值,超过该值的水产品会产生令人厌恶的味道,不适宜再食用[26]。冷藏期间,牡蛎TBARS值远低于2.0 mg/kg,说明活体牡蛎贮藏6 d时脂质氧化程度仍在可接受范围内。
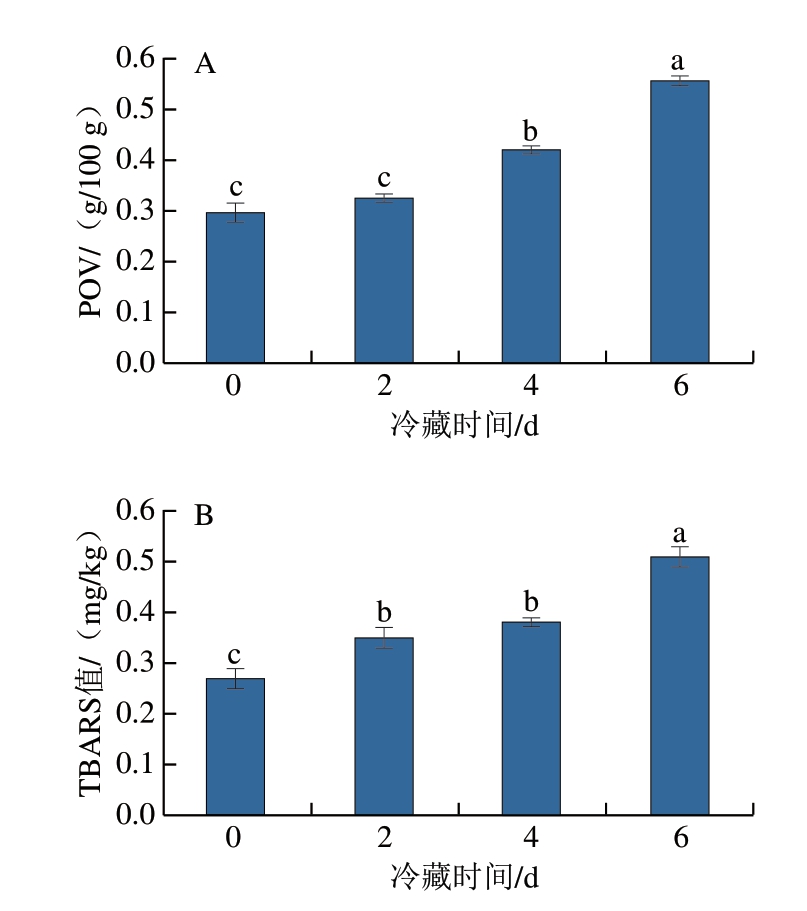
图3 牡蛎冷藏过程中POV(A)和TBARS值(B)变化
Fig. 3 Changes in POV (A) and TBARS value (B) of oysters during cold storage
2.5 牡蛎冷藏过程中挥发性物质变化
如图4所示,从牡蛎中鉴定出59 种挥发性成分,包括醇类15 种、酮类14 种、醛类13 种、酯类5 种、烃类5 种、酸类3 种及其他类化合物4 种。冷藏6 d时,挥发性物质相对含量发生明显变化,表明牡蛎尽管能在低温条件下长时间保持活体状态,但风味已发生较大变化。

图4 牡蛎冷藏过程中挥发性化合物指纹图谱
Fig. 4 Fingerprint of volatile compounds during oyster cold storage
0-1~3.冷藏0 d样品,3 个平行,其余依此类推;M.单体;D.二聚体。
水产品中的醇类来源多样,如脂肪氧化分解、氨基酸降解、醛还原、微生物活动及其他化学反应等[27]。从牡蛎中检出的醇类化合物对气味的贡献不尽相同,其中丁醇、2,3-丁二醇、1-丙醇等饱和醇类气味阈值较高,浓度低时对气味贡献不大,而不饱和醇阈值较低,呈金属味、蘑菇味,对风味有积极贡献[28]。牡蛎贮藏过程中,1-戊醇、1-辛烯-3-醇相对含量明显增加,1-戊醇主要来自C18:2 n-6的氧化分解,具有焦味、肉香味[11],而1-辛烯-3-醇被认为是新鲜牡蛎重要的风味成分[29],主要来源于C20:4 n-6的氧化降解,可赋予样品蘑菇、薰衣草、玫瑰和干草气味[30]。
醛类主要由脂质氧化降解、氨基酸Strecker反应、微生物活动及酶催化反应等生成,对牡蛎气味有重要贡献。庚醛、辛醛、1-己醛、丁醛主要来源于C18:1 n-9、C18:2 n-6、C18:3 n-3和C20:4 n-6等不饱和脂肪酸(unsaturated fatty acid,UFA)分解,其中1-己醛是C18:2 n-6降解产物,高浓度时呈油脂腐败味,低浓度时具有青草和蔬菜气味[31]。(E)-2-戊烯醛、(E)-2-己烯醛、(E)-2-庚烯醛呈油脂、青草香气[32],在牡蛎冷藏过程中,其相对含量减少。3-甲基丁醛、正戊醛相对含量增加,3-甲基丁醛是亮氨酸Strecker降解产物,赋予样品巧克力味和坚果味[33],正戊醛具有杏仁味、水果味和麦芽味,其生成与C18:2 n-6氢过氧化物分解有关[34]。
酮类是UFA氧化及氨基酸降解生成的中间体,可以被进一步还原生成相应的醇或被氧化生成其他化合物[35]。从牡蛎中共检出14 种酮类,其中2-丁酮主要来自于脂肪酸氧化,呈奶油香气[36];1-辛烯-3-酮主要来源于C18:2 n-6和C18:3 n-3氧化,可赋予样品泥土、蘑菇等气味[37],在牡蛎冷藏过程中,其相对含量增加;3-辛酮通常散发花香与果香,可为牡蛎增添愉悦的气味[38],其相对含量明显减少;1-戊烯-3-酮、2-丁酮相对含量明显增加,导致样品出现腐臭味,这是引起牡蛎风味劣变的主要物质之一。
酸类主要由醛的氧化反应或微生物的脱羧作用生成,这些反应可能导致水产品出现轻微酸味,而这种酸味往往与水产品的新鲜度下降或早期腐败有关[39]。牡蛎冷藏过程中酸类化合物变化相对较小,这与牡蛎处于活体状态一致。酯类是醇和酸发生酯化反应的产物,通常具有水果的清香[40]。在冷藏过程中,牡蛎中的乙酸己酯相对含量减少,这在一定程度上降低了牡蛎的愉悦性气味。烃类可能通过脂肪酸烷氧自由基均裂反应生成,但由于其阈值相对较高,因此在风味形成中的直接贡献通常较为有限。另外,烯类进一步氧化可能转化为具有较低阈值的醛类或酮类化合物,被视为重要的潜在风味物质[41]。
综上,太平洋牡蛎活体冷藏过程中挥发性物质发生明显变化,其中1-辛烯-3-醇、3-甲基丁醛、1-辛烯-3-酮相对含量明显增加,(E)-2-戊烯醛、(E)-2-己烯醛、(E)-2-庚烯醛、3-辛酮相对含量明显减少可能是引起牡蛎风味劣变的主要原因。
2.6 Pearson相关性分析
如图5所示,甘油三酯质量分数与C18:0相对含量呈显著负相关(P<0.05),TBARS值与总脂、甘油三酯、磷脂等质量分数呈负相关。牡蛎挥发性物质相对含量与多种游离脂肪酸相对含量具有相关性,3-辛酮相对含量与C20:4 n-6、EPA、DHA等相对含量呈正相关,2-丁酮相对含量与DHA相对含量呈显著负相关(P<0.05)。1-辛烯-3-酮相对含量与C18:3 n-3相对含量呈正相关,通常认为1-辛烯-3-酮来源于C18:2 n-6和C18:3 n-3氧化。1-辛烯-3-醇相对含量与C18:2 n-6、C18:3 n-3相对含量呈正相关,与DHA相对含量呈负相关,1-辛烯-3-醇是不饱和醇,可能由C18:2 n-6、DHA等含有不饱和双键的脂肪酸氧化分解产生。庚醛、1-己醛、正戊醛、丁醛、3-甲基丁醛等相对含量与DHA相对含量呈负相关,(E)-2-戊烯醛、(E)-2-己烯醛、(E)-2-庚烯醛相对含量与C18:2 n-6、C18:3 n-3相对含量呈负相关,这些短链不饱和醛的形成与UFA氧化降解有关。链长、不饱和度和脂肪酸中双键位置决定了氧化过程的特定中间体和最终产物,与SFA相比,UFA更容易通过氧化反应形成多种风味化合物[42]。多种酮类、醇类、醛类物质相对含量与C18:2 n-6、C18:3 n-3、EPA、DHA等PUFA相对含量具有相关性,表明UFA与挥发性物质变化密切相关,对风味形成和劣化有重要贡献。
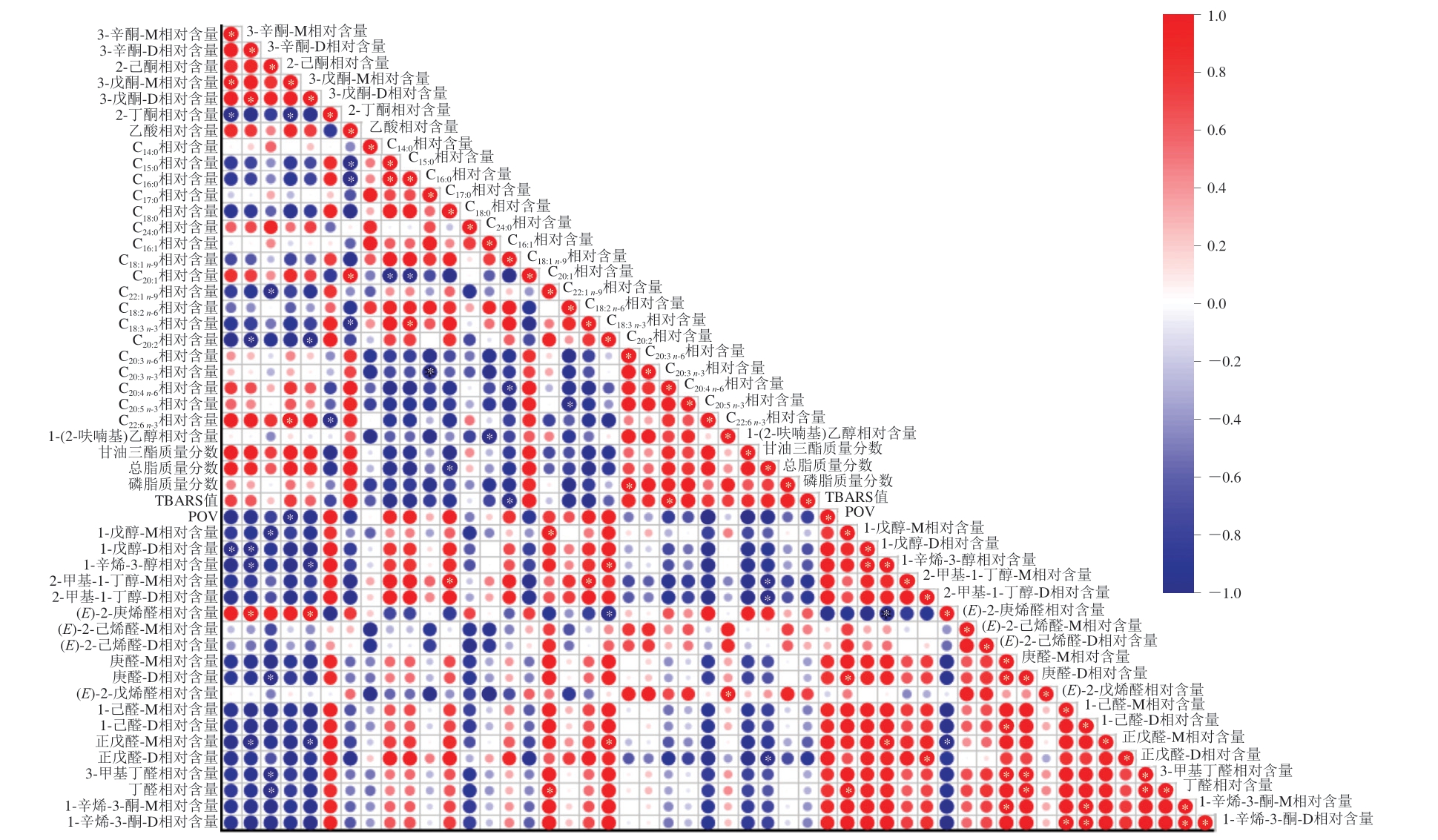
图5 牡蛎冷藏过程中脂质与挥发性物质Pearson相关性分析图
Fig. 5 Pearson correlation analysis between lipids and volatile substances in oyster during storage
圆点越大表示相关性越强;*.显著相关(P<0.05)。
3 结论
太平洋牡蛎抗逆性较强,4 ℃冷藏6 d存活率仍在85%以上。牡蛎冷藏过程中,总脂、甘油三酯和磷脂含量均呈下降趋势,POV与TBARS值明显升高,表明脂质可能是牡蛎维持生命活动的主要能量来源。1-辛烯-3-醇、3-甲基丁醛、1-辛烯-3-酮相对含量增加,(E)-2-戊烯醛、(E)-2-己烯醛、(E)-2-庚烯醛、庚醛、3-辛酮相对含量减少,可能是引起牡蛎气味变化的主要原因,且这些挥发性成分与C18:2 n-6、C18:3 n-3、EPA、DHA等PUFA氧化分解密切相关,表明脂质对活体牡蛎风味形成及冷藏过程中的风味劣化有重要贡献。本研究结果可为活体牡蛎冷链贮运过程品质控制提供参考,但风味包括气味和滋味两方面,活体牡蛎冷藏过程滋味变化需进一步探索。
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会编. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2023.
[2] 费星, 秦小明, 林华娟, 等. 近江牡蛎在净化和生态冰温保活过程中主要营养成分的变化[J]. 食品科技, 2010, 35(3): 68-71.DOI:10.13684/j.cnki.spkj.2010.03.021.
[3] 林恒宗, 高加龙, 梁志源, 等. 冷胁迫方式对太平洋牡蛎无水保活期氧化应激及能量消耗的影响[J]. 广东海洋大学学报, 2022, 42(2):95-103. DOI:10.3969/j.issn.1673-9159.2022.02.012.
[4] 闫丽新, 殷中专, 蔡琰, 等. 牡蛎捕后贮运过程中的活力和呈味特性[J]. 中国食品学报, 2022, 22(12): 224-233. DOI:10.16429/j.1009-7848.2022.12.023.
[5] 罗丽俐, 林恒宗, 梁志源, 等. 冷休眠结合薄膜包裹对太平洋牡蛎生态冰温保活期品质及代谢的影响[J]. 食品工业科技, 2023, 44(3):372-380. DOI:10.13386/j.issn1002-0306.2022050153.
[6] WEN R X, HU Y Y, ZHANG L, et al. Effect of NaCl substitutes on lipid and protein oxidation and flavor development of Harbin dry sausage[J]. Meat Science, 2019, 156: 33-43. DOI:10.1016/j.meatsci.2019.05.011.
[7] HU X P, AN Q D, ZHOU D Y, et al. Lipid profiles in different parts of two species of scallops (Chlamys farreri and Patinopecten yessoensis)[J]. Food Chemistry, 2018, 243: 319-327. DOI:10.1016/j.foodchem.2017.09.151.
[8] GONÇALVES A, PEDRO S, DUARTE A, et al. Effect of enriched oxygen atmosphere storage on the quality of live clams (Ruditapes decussatus)[J]. International Journal of Food Science & Technology,2009, 44(12): 2598-2605. DOI:10.1111/j.1365-2621.2009.02090.x.
[9] 王天雪, 刘淇, 赵玲, 等. 不同干燥方式对仿刺参性腺脂质、营养价值及挥发性物质的影响[J]. 食品科学, 2024, 45(8): 176-184.DOI:10.7506/spkx1002-6630-20230710-122.
[10] 万楚筠, 黄凤洪, 李文林. 抗坏血酸-钼蓝光度法测定油脂中磷脂含量的研究[J]. 中国油脂, 2006, 31(4): 46-49. DOI:10.3321/j.issn:1003-7969.2006.04.013.
[11] 曹荣, 赵玲, 孙慧慧, 等. 南极磷虾(Euphausia superba)与脊尾白虾(Exopalaemon carinicauda)营养学特征分析及鲜味评价[J]. 食品科学, 2018, 39(4): 149-153. DOI:10.7506/spkx1002-6630-201804023.
[12] 王善宇, 赵玲, 孙慧慧, 等. 烹饪方式对凡纳滨对虾(Penaeus vannamei)脂质及挥发性物质的影响[J]. 食品科学, 2023, 44(6): 344-350. DOI:10.7506/spkx1002-6630-20220708-091.
[13] 高加龙, 章超桦, 秦小明, 等. 不同温度无水保活对香港牡蛎微生物和基本营养成分的影响[J]. 广东海洋大学学报, 2020, 40(5): 90-96.DOI:10.3969/j.issn.1673-9159.2020.05.011.
[14] 徐美禄, 冷寒冰, 李亚烜, 等. 捕后干藏-复水处理对太平洋牡蛎活品贮藏稳定性的影响[J]. 大连海洋大学学报, 2019, 34(6): 828-833.DOI:10.16535/j.cnki.dlhyxb.2018-294.
[15] MOOSAVI-NASAB M, MOHAMMADI R, OLIYAEI N.Physicochemical evaluation of sausages prepared by lantern fish(Benthosema pterotum) protein isolate[J]. Food Science & Nutrition,2018, 6(3): 617-626. DOI:10.1002/fsn3.583.
[16] 张智翠. 太平洋牡蛎品质的季节性变化及贮藏过程中的生化变化[D].青岛: 中国海洋大学, 2006.
[17] 施佩影, 李仁伟. 肉制品脂肪氧化控制研究进展[J]. 肉类研究, 2016,30(6): 52-56. DOI:10.15922/j.cnki.rlyj.2016.06.011.
[18] MANSON J E, COOK N R, LEE I M, et al. Marine n-3 fatty acids and prevention of cardiovascular disease and cancer[J]. New England Journal of Medicine, 2019, 380(1): 23-32. DOI:10.1056/NEJMoa1811403.
[19] ZHOU Z, ZHANG Y Y, GAO J X, et al. Metabolomic approaches to analyze the seasonal variations of amino acid, 5’-nucleotide, and lipid profile of clam (Ruditapes philippinarum)[J]. LWT-Food Science and Technology, 2021, 148: 111709. DOI:10.1016/j.lwt.2021.111709.
[20] 劳邦盛, 盛国英, 傅家谟, 等. 牡蛎中脂肪酸在储藏过程中的稳定性[J]. 色谱, 2000, 18(4): 340-342. DOI:10.3321/j.issn:1000-8713.2000.04.016.
[21] 孟楠, 郝丽莉, 王昕岑, 等. 不同温度胁迫条件下太平洋牡蛎挥发性化合物的变化[J]. 现代食品科技, 2024, 40(2): 265-272.DOI:10.13982/j.mfst.1673-9078.2024.2.0276.
[22] 李金林, 万亮, 陈春艳, 等. ω-3 LCPUFAs模拟热加工鱼肉脂肪氧化形成风味物质的研究[J]. 中国食品学报, 2020, 20(6): 95-105.DOI:10.16429/j.1009-7848.2020.06.012.
[23] 汪贻生, 薛长湖, 林洪, 等. 贻贝(Mytilus)在贮藏过程中气味的变化[J].中国水产科学, 1996, 3(1): 79-87.
[24] ZHANG J J, WU D, LIU D H, et al. Effect of cooking styles on the lipid oxidation and fatty acid composition of grass carp(Ctenopharynyodon idellus) fillet[J]. Journal of Food Biochemistry,2013, 37(2): 212-219. DOI:10.1111/j.1745-4514.2011.00626.x.
[25] SEKHON-LOODU S, WARNAKULASURIYA S N, RUPASINGHE H P V, et al. Antioxidant ability of fractionated apple peel phenolics to inhibit fish oil oxidation[J]. Food Chemistry, 2013, 140(1): 189-196.DOI:10.1016/j.foodchem.2013.02.040.
[26] KANG J H, SONG K B. Characterization of Job’s tears (Coix lachryma-jobi L.) starch films incorporated with clove bud essential oil and their antioxidant effects on pork belly during storage[J]. LWTFood Science and Technology, 2019, 111: 711-718. DOI:10.1016/j.lwt.2019.05.102.
[27] MARUŠIĆ RADOVČIĆ N, VIDAČEK S, JANČI T, et al.Characterization of volatile compounds, physico-chemical and sensory characteristics of smoked dry-cured ham[J]. Journal of Food Science and Technology, 2016, 53(11): 4093-4105. DOI:10.1007/s13197-0162418-2.
[28] ALASALVAR C, TAYLOR K D A, SHAHIDI F. Comparison of volatiles of cultured and wild sea bream (Sparus aurata) during storage in ice by dynamic headspace analysis/gas chromatographymass spectrometry[J]. Journal of Agricultural and Food Chemistry,2005, 53(7): 2616-2622. DOI:10.1021/jf0483826.
[29] 袁林, 查锋超, 姚烨, 等. 牡蛎酶解产物与还原糖美拉德反应工艺优化及挥发性风味物质分析[J]. 食品科学, 2015, 36(24): 1-9.DOI:10.7506/spkx1002-6630-201524001.
[30] WANG Z J, LI H Q, CAO W H, et al. Effect of drying process on the formation of the characteristic flavor of oyster (Crassostrea hongkongensis)[J]. Foods, 2023, 12(11): 2136. DOI:10.3390/foods12112136.
[31] 吴燕燕, 曹松敏, 李来好, 等. 比较2 种蓝圆鰺腌干工艺中脂质氧化与挥发性风味物质形成的关系[J]. 食品科学, 2017, 38(6): 165-172.DOI:10.7506/spkx1002-6630-201706026.
[32] ZANG M W, WANG L, ZHANG Z Q, et al. Changes in flavour compound profiles of precooked pork after reheating (warmed-over flavour) using gas chromatography-olfactometry-mass spectrometry with chromatographic feature extraction[J]. International Journal of Food Science & Technology, 2020, 55(3): 978-987. DOI:10.1111/ijfs.14306.
[33] CHEN J H, TAO L, ZHANG T, et al. Effect of four types of thermal processing methods on the aroma profiles of acidity regulator-treated tilapia muscles using E-nose, HS-SPME-GC-MS, and HS-GC-IMS[J].LWT-Food Science and Technology, 2021, 147: 111585. DOI:10.1016/j.lwt.2021.111585.
[34] HU M Y, WANG S Y, LIU Q, et al. Flavor profile of dried shrimp at different processing stages[J]. LWT-Food Science and Technology,2021, 146: 111403. DOI:10.1016/j.lwt.2021.111403.
[35] CHEN C, FAN X K, HU Y Y, et al. Effect of different salt substitutions on the decomposition of lipids and volatile flavor compounds in restructured duck ham[J]. LWT-Food Science and Technology, 2023,176: 114541. DOI:10.1016/j.lwt.2023.114541.
[36] WANG S Y, HU M Y, ZHAO L, et al. Changes in lipid profiles and volatile compounds of shrimp (Penaeus vannamei) submitted to different cooking methods[J]. International Journal of Food Science &Technology, 2022, 57(7): 4234-4244. DOI:10.1111/ijfs.15747.
[37] ERTEN E S, CADWALLADER K R. Identification of predominant aroma components of raw, dry roasted and oil roasted almonds[J]. Food Chemistry, 2017, 217: 244-253. DOI:10.1016/j.foodchem.2016.08.091.
[38] MEHDI M, AL-ALAWI A, THABIT A, et al. Analysis of bioactive chemical compounds of leaves extracts from Tamarindus indica using FT-IR and GC-MS spectroscopy[J]. Asian Journal of Research in Biochemistry, 2021, 8: 22-34. DOI:10.9734/AJRB/2021/v8i130171.
[39] 屠晓航, 李鹏鹏, 卞欢, 等. 不同养殖模式克氏原螯虾肉中挥发性成分的差异研究[J]. 肉类研究, 2023, 37(12): 32-38. DOI:10.7506/rlyj1001-8123-20240111-008.
[40] 石林凡, 李周茹, 任中阳, 等. 贝类腥味物质及形成机理研究进展[J].中国食品学报, 2023, 23(3): 406-415. DOI:10.16429/j.1009-7848.2023.03.040.
[41] 刘奇, 郝淑贤, 李来好, 等. 鲟鱼不同部位挥发性成分分析[J]. 食品科学, 2012, 33(16): 142-145.
[42] FEREIDOON S, ABUL H. Role of lipids in food flavor generation[J].Molecules, 2022, 27(15): 5014. DOI:10.3390/molecules27144014.