木瓜蛋白酶是一种半胱氨酸蛋白酶,也被称为巯基蛋白酶,最早于19世纪从未成熟的番木瓜乳胶中分离获得,是第1种确定晶体结构的蛋白酶[1]。随着生活水平的不断提高,人们对肉类口感的追求也不断提升,目前市场上流通的嫩肉粉的主要成分是木瓜蛋白酶,其能将结缔组织、肌纤维中的胶原蛋白及弹性蛋白分解,使氨基酸间的连接键断裂,破坏肉类结构,使肉质口感细腻、嫩滑[2]。在肉类嫩化和加工过程中,加工手段或加工环境中的一些物理或化学因素会影响木瓜蛋白酶结构,进而影响蛋白酶充分发挥其酶活性,从而影响嫩化效果。如张琼[3]研究超声波功率及时间对木瓜蛋白酶活性的影响,结果表明,随超声波功率增加,木瓜蛋白酶的活力呈先上升后下降趋势。张艳梅等[4]发现,金属Hg2+浓度的增加会破坏木瓜蛋白酶的活性中心,导致酶的催化活性降低。
pH值在食品体系中是一个重要影响因素,也是影响酶活性的主要因素之一。不同pH值条件下酶分子的很多极性基团解离状态不同,各极性基团所带电荷的数量和种类也不相同,因此pH值的变化对酶与底物的亲和力具有影响。除此之外,酶活性中心的空间构象也会受到pH值的影响,从而影响酶的活性。目前有许多学者就pH值对酶的活性影响进行了深入研究。陈维[5]发现,不同的pH值环境对不同生物材料中的过氧化氢酶活性有一定影响,pH值在6.2~8.0范围内时,酶的活性会呈现先上升后下降的趋势。彭青等[6]观察pH 5.8~9.0条件下L1型金属β-内酰胺酶活性的变化,发现其最适pH值为8.2,当pH 5.8时,相对酶活性仅为14.64%。狄荻等[7]发现,菠萝蛋白酶的最适pH值为7左右,偏酸或偏碱都会影响其活性,当pH 11时,其活性几乎完全丧失。虽然目前的实验方法能够评估各种因素对蛋白酶活性的影响,但无法在微观水平上阐明蛋白酶活性变化的根本原因,而分子动力学模拟能进一步分析蛋白酶结构的具体变化。如Li Yinli等[8]利用分子手段探究碱性磷酸酶的结构变化;帅雨桐等[9]模拟不同加热温度对肌动蛋白结构及其对酚类物质吸附的影响;高进[2]模拟高压下木瓜蛋白酶的分子动力学变化规律;黄业传等[10]从分子模拟角度论证高压条件下木瓜蛋白酶活性变化的机理,分子模拟能将蛋白酶内部结构的变化直观地显示出来。虽然部分研究者也探究了不同pH值对木瓜蛋白酶活性的影响,但并未具体研究其分子机制;鉴于木瓜蛋白酶在食品中应用广泛,经常处于不同的pH值体系中,为更好地促进木瓜蛋白酶在食品中的应用,本研究考察5 组不同pH值(4、5、6、7、8)对木瓜蛋白酶活性的影响,并通过分子动力学方法探究其分子机制,同时采用ROSETTA 3.7软件模拟探究不同条件下酶与蛋白结合位点的差异及可能的酶解机制差异。
1 材料与方法
1.1 材料与试剂
木瓜蛋白酶(>200 U/mg)、十二水合磷酸氢二钠、三氯乙酸、L-酪氨酸、干酪素 上海麦克林生化科技有限公司;乙二胺四乙酸二钠 天津市天力化学试剂有限公司;L-半胱氨酸盐酸盐 北京博奥拓达科技有限公司;盐酸 湖南汇虹试剂有限公司;氢氧化钠国药集团化学试剂有限公司;以上试剂均为分析纯。
1.2 仪器与设备
TP-1901紫外分光光度计 北京普析通用仪器有限责任公司;F98荧光分光光度计 上海棱光技术有限公司。
1.3 方法
1.3.1 样品处理
配制不同pH值(4、5、6、7、8)的酶缓冲液:称取0.528 g L-半胱氨酸盐酸盐和0.223 6 g乙二胺四乙酸二钠,用磷酸氢二钠溶液(0.05 mol/L)分别溶解,合并混匀后,用氢氧化钠和盐酸溶液(均为1 mol/L)调节pH值并定容至100 mL。取适量木瓜蛋白酶溶于不同pH值的酶缓冲液(5 mL)中,常温下静置20 min后定容至100 mL,再吸取1 mL至25 mL容量瓶中,加酶缓冲液定容,得到5 组终质量浓度为0.5 mg/mL的不同pH值木瓜蛋白酶溶液。配制完成后测定木瓜蛋白酶活性。
1.3.2 木瓜蛋白酶活性测定
酪氨酸标准溶液的吸光度测定:配制50 μg/mL L-酪氨酸标准溶液,用纯水做空白,于280 nm处测定吸光度(A1)。
木瓜蛋白酶活性测定:取6 支具塞试管并编号(a、b、c、d、e、空白管),分别取1 mL不同pH值木瓜蛋白酶溶液于对应的具塞试管中,再另取1 mL pH 6的木瓜蛋白酶溶液于空白具塞试管中。将6 支具塞试管放置在40 ℃水浴锅中水浴10 min后,在a、b、c、d、e管中迅速加入5 mL 6 mg/mL酪蛋白溶液,摇匀后进行水浴10 min,再向每个管中加入5 mL 65.4 g/L三氯乙酸溶液,摇匀并过滤后,在280 nm处测定滤液吸光度(A2)。空白管中则先加入三氯乙酸溶液5 mL,振荡混匀后水浴10 min,再加入酪蛋白溶液5 mL,摇匀后继续水浴加热10 min,过滤后在280 nm处测定溶液吸光度(A3)。木瓜蛋白酶活性按下式计算:
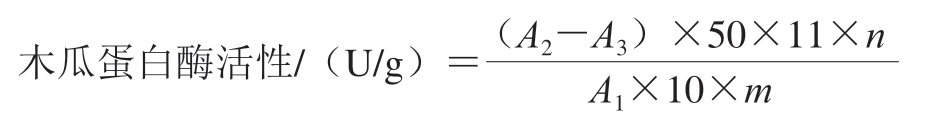
式中:n为酶液的稀释倍数;m为所用木瓜蛋白酶的质量/g。
1.3.3 分子动力学模拟
在RCSB网站上下载木瓜蛋白酶结构(ID号:1ppn),然后使用PyMOL软件手动去除结晶水。采用Gromacs(2019.6)软件[11]进行模拟,选择GROMOS54a7力场[12]和SPC水模型。提前根据蛋白酶氨基酸侧链的pKa和模拟的不同pH值条件关系设定好质子化状态,将其放置于立方体水盒子中,并设置蛋白酶与盒子边缘最短距离为1 nm。通过增补适量的Na+或Cl-使体系达到电中性。使用最速下降法对体系能量进行最小化处理,先在NVT和NPT系统下分别进行400 ps的平衡,然后进行150 ns的分子动力学模拟,模拟步长为2 fs,每10 ps储存1 次数据,每个处理平行模拟3 次[13]。
模拟完毕后,先移除周期性边界,再使用蛋白分子模拟命令分析不同pH值条件下木瓜蛋白酶的均方根误差(root mean square deviation,RMSD)、均方根涨落(root mean square fluctuation,RMSF)、回旋半径(radius of gyration,Rg)、氢键数量、蛋白质二级结构、蛋白溶剂可及表面积。其中分析RMSD时使用全部150 ns的数据,而分析其他指标时只使用结构基本稳定后的数据。分析时每个数据点间隔100 ps。
分子模拟结束后,用ROSETTA软件模拟不同条件下酶与蛋白结合位点的差异,取2 组酶活有较大差异的样本,提取势能最低的结构进行对接,对接底物采用β-酪蛋白。再采用I-TASSER在线服务器构建β-酪蛋白结构,使用ROSETTA 3.7软件进行分子对接。共进行10 次独立对接,每次对接产生一个对接打分。
1.3.4 木瓜蛋白酶内源性荧光光谱测定
将不同pH值(4、5、6、7、8)的木瓜蛋白酶溶液分别放入1.0 cm宽度的石英池中进行荧光光谱分析。荧光光谱条件为激发波长280 nm,扫描波长范围250~320 nm,激发和发射狭缝宽度5 nm[14]。
1.4 数据处理
采用Microsoft Excel 2016软件对数据进行计算和整理;使用PyMOL软件绘制木瓜蛋白酶与底物对接结构图,使用Origin 2018软件绘制其余图,所有测定均进行3 次重复,数据以平均值±标准差表示。
2 结果与分析
2.1 不同pH值对木瓜蛋白酶活性的影响
木瓜蛋白酶的等电点为8.75。如图1所示,随着pH值的增加,木瓜蛋白酶的活性先增大后减小。在pH 7时活性最高,pH 6时次之。pH为4和8时活性与pH 7时相比有显著差异(P<0.05),活性分别下降5.00%、5.35%。朱新儒[15]在双水相萃取木瓜蛋白酶的研究中,发现系统pH值保持在7.0~8.0之间时,木瓜蛋白酶有较高活性。王伟涛[16]认为酸性和碱性环境对酶活性有一定的影响,但影响都在一定范围内;余垒[17]发现随着pH值的升高,木瓜蛋白酶活性保留率、蛋白回收率逐渐提高,纯化因子逐渐增加,但当pH值超过6时,蛋白酶的电荷会随溶液pH值的改变而变化,因为蛋白质的电荷状态会受到pH值及其等电点的影响[18]。因此,偏中性环境更有利于木瓜蛋白酶发挥其催化活性。
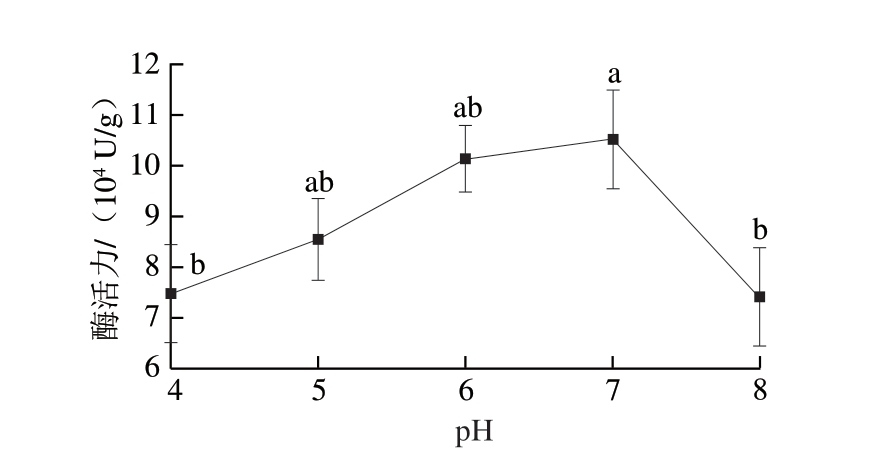
图1 不同pH值条件下的木瓜蛋白酶活性
Fig. 1 Significant variations in papain activity across various pH levels
小写字母不同表示差异显著(P<0.05)。
2.2 不同pH值下木瓜蛋白酶分子动力学模拟结果
2.2.1 RMSD在模拟中的变化
RMSD体现了蛋白质原始构象与在特定时间其结构的平均偏差[19]。如图2所示,5 组RMSD数据在模拟过程中波动幅度不大,均在130 ns后稳定在某一恒定数值附近。130 ns后pH 4~8条件下的RMSD平均值分别为0.29、0.27、0.31、0.26、0.33 nm,其中pH 8时RMSD平均值比pH 7时增加0.07 nm,波动较明显。说明pH值的改变会对木瓜蛋白酶结构稳定性产生影响,但影响不大,该结论与孔庆新等[20]研究结果相似。他们在将β-乳球蛋白与茶多酚表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)结合的分子模拟中发现,结合过程中EGCG只在有限的pH值范围内波动,不会对蛋白质结构造成较大影响。
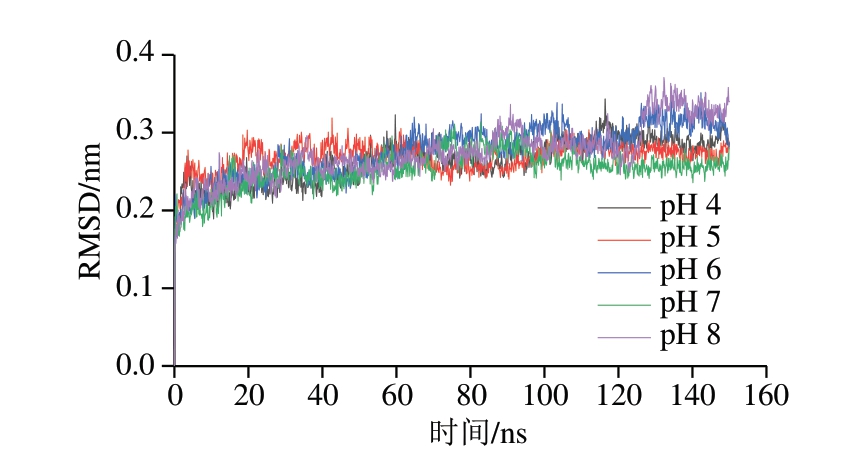
图2 不同pH值对木瓜蛋白酶RMSD的影响
Fig. 2 Effect of different pH on the RMSD of papain
2.2.2 RMSF在模拟中的变化
RMSF反映的是蛋白质各原子坐标与平均位置坐标的涨落情况,能够衡量原子运动幅度大小[21]。经计算,pH 4~8条件下平均RMSF分别为0.149、0.139、0.142、0.136、0.157 nm。总体上随pH值增大,RMSF会略微减小,但在pH 8时波动明显,这与酶活性和RMSD分析结果具有一定相关性。如图3所示,pH 4~8条件下25位残基RMSF分别为0.135、0.119、0.127、0.106、0.151 nm;158号位残基分别为0.125、0.155、0.134、0.138、0.161 nm;159号位残基分别为0.176、0.127、0.146、0.107、0.142 nm。在pH 4时,木瓜蛋白酶活性中心的25位和159位氨基酸残基表现出较大的波动,pH 8时,酶活性中心的25、158、159位氨基酸残基均有较大波动。表明环境偏酸和偏碱可能会导致酶的活性中心结构稳定性下降,这与酶活性结果一致。
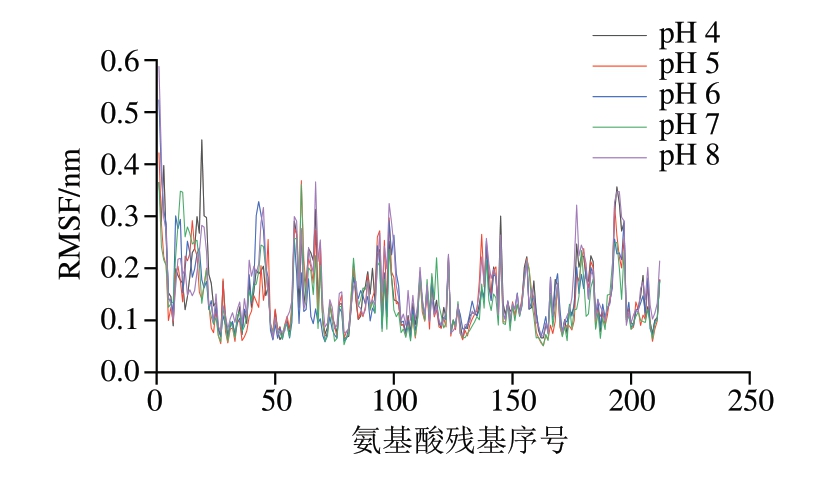
图3 不同pH值对木瓜蛋白酶RMSF的影响
Fig. 3 Effect of different pH on the RMSF of papain
2.2.3 Rg在模拟中的变化
Rg表示蛋白质结构的松紧程度,Rg越小,表明蛋白质结构越致密,Rg越大,则表明蛋白质结构越疏松。由图4可知,所有组均在80 ns后趋于稳定。计算模拟后80 ns的平均Rg,pH 4~8条件下木瓜蛋白酶的平均Rg分别为1.669、1.673、1.676、1.664、1.675 nm。可以看出各组Rg基本一致,无较大波动。pH 7时Rg最小,说明此时木瓜蛋白酶结构较致密,这也与上述RMSD、RMSF分析基本一致。
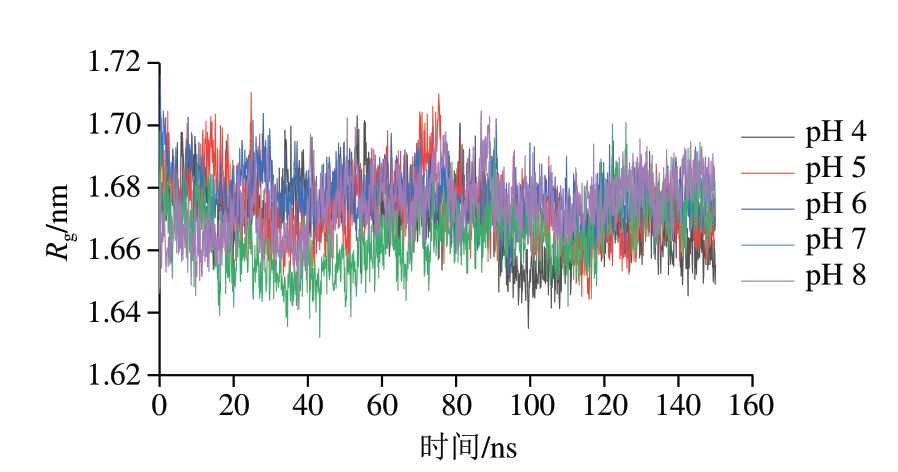
图4 不同pH值对木瓜蛋白酶Rg的影响
Fig. 4 Influence of different pH on the Rg of papain
2.2.4 木瓜蛋白酶蛋白间氢键数量在模拟中的变化
氢键是一种对蛋白结构稳定性具有重要作用的非共价结合力。图5显示,随着pH值的增加,木瓜蛋白酶蛋白间氢键数量逐渐增加。以模拟后50 ns进行计算,在pH 4~8范围内,木瓜蛋白酶平均氢键数量分别为144.6、148.3、151.3、155.6、152.2 个。其中pH 8时的氢键数量比pH 7时减少3.4 个,可能导致部分蛋白结构受损,这可能是木瓜蛋白酶活性随着pH值的上升而逐渐升高、当pH值上升至7后酶活性又降低的主要原因之一。
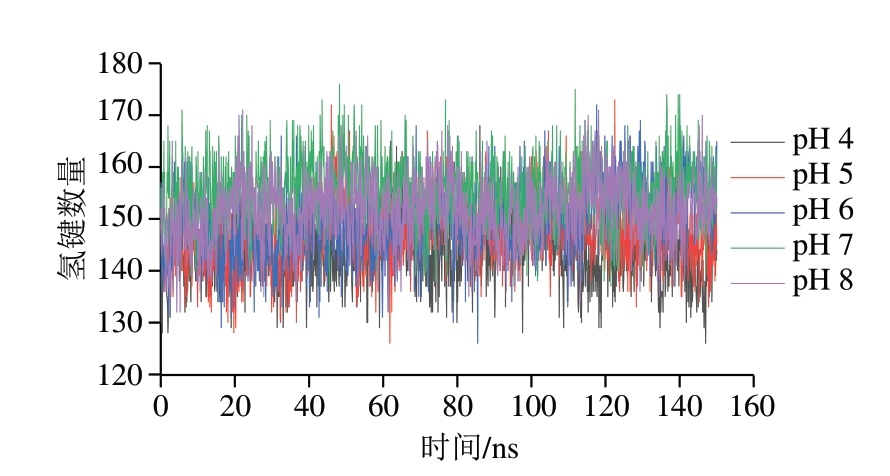
图5 不同pH值对木瓜蛋白酶氢键数量的影响
Fig. 5 Effect of different pH on the number of hydrogen bonds in papain
2.2.5 木瓜蛋白酶蛋白溶剂可及表面积在模拟中的变化
由表1可知,随着pH值的上升,木瓜蛋白酶溶剂总可及表面积和疏水表面积均呈先减小后增大的趋势,其原因可能是过酸或过碱的环境导致木瓜蛋白酶结构疏松,水分子更容易渗透进入木瓜蛋白酶分子内部,从而使更多的疏水区域暴露,这与曾琪等[22]的研究结果相似。在本研究过程中,亲水表面积总是大于疏水表面积,说明木瓜蛋白酶在不同pH值下均为水溶性,这与孔庆新等[20]得到的结论一致。
表1 不同pH值对木瓜蛋白酶溶剂可及表面积的影响
Table 1 Effect of different pH on the solvent accessible surface area of papain
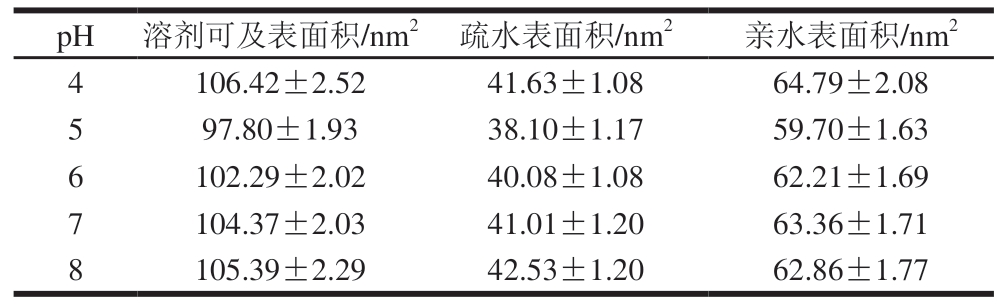
注:数据为100~150 ns模拟中500 个数据的平均值。表2同。
pH溶剂可及表面积/nm2疏水表面积/nm2亲水表面积/nm2 4106.42±2.5241.63±1.0864.79±2.08 597.80±1.9338.10±1.1759.70±1.63 6102.29±2.0240.08±1.0862.21±1.69 7104.37±2.0341.01±1.2063.36±1.71 8105.39±2.2942.53±1.2062.86±1.77
2.2.6 木瓜蛋白酶蛋白二级结构在模拟中的变化
如表2所示,随着pH值的升高,木瓜蛋白酶蛋白的β-折叠数量先增多后减少,在pH 7时β-折叠数量明显高于其他4 个pH条件,可推测β-折叠数量与酶活性有一定的关联性,β-折叠数量越高,酶活性相对越高。而无规卷曲的数量明显先减小后增加,在pH 6时降至最低,pH 7时次之,说明随着pH值的增加,木瓜蛋白酶的二级结构会从无序状态逐渐转变为有序状态,当pH值超过7时,蛋白酶的二级结构又会由有序转变为无序状态。因此可推测偏酸或偏碱的pH值会导致蛋白酶空间结构呈现无规则状态,进而影响其活性。同时随pH值的增加,α-螺旋呈增加趋势,这与前面对蛋白间氢键分析基本一致,因为α-螺旋的稳定与氢键有关[23]。一些学者研究了不同pH值对蛋白二级结构的影响,但结果并不一致。郭洪伟[24]在研究pH值对芽孢皮层裂解酶的活力及结构的影响时发现,体系pH值大于7时,蛋白质大分子因碱性而聚集的现象导致β-折叠结构减少,这与本研究结果相似;而韩玲[25]在pH值对溶菌酶分子机制的研究中发现,随着体系pH值的降低,溶菌酶结构中α-螺旋向β-折叠结构转变的趋势变大,Zhu Junxiang等[26]发现β-乳球蛋白的二级结构在不同pH值条件下无显著变化,Abdollahi等[27]研究β-乳球蛋白与阿魏酸的结合时发现,随着pH值升高,α-螺旋和β-折叠的比例均降低。
表2 不同pH值对木瓜蛋白酶二级结构数量的影响
Table 2 Effects of different pH on the secondary structure of papain
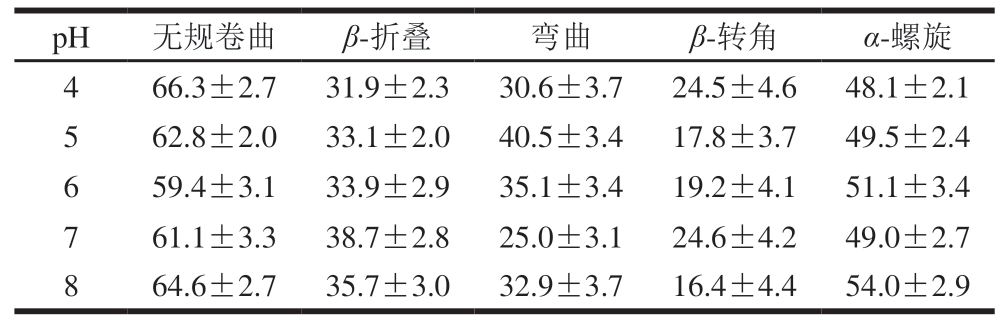
pH无规卷曲β-折叠弯曲β-转角α-螺旋466.3±2.731.9±2.330.6±3.724.5±4.648.1±2.1 562.8±2.033.1±2.040.5±3.417.8±3.749.5±2.4 659.4±3.133.9±2.935.1±3.419.2±4.151.1±3.4 761.1±3.338.7±2.825.0±3.124.6±4.249.0±2.7 864.6±2.735.7±3.032.9±3.716.4±4.454.0±2.9
2.2.7 木瓜蛋白酶蛋白活性中心残基间距离的变化
有研究[28]表明,木瓜蛋白酶活性部位由25位的半胱氨酸(Cys25)、158位的天冬酰胺(Asp158)和159位的组氨酸(His159)3 个氨基酸组成。据2.1节所述,pH 4和7时的木瓜蛋白酶活性差距较大,取这2 组样品结构势能最低时的活性中心残基距离进行对比,pH 4条件下,114 ns结构势能最低,pH 7条件下,110 ns结构势能最低。由表3可知,pH 7条件下,Cys25到Asp158和His159的距离均减小,而Asp158到His159的距离略微增大。由此可推断不同的pH值可能会影响木瓜蛋白酶活性,这种影响可能与活性中心残基之间的距离变化有关,pH值接近中性时,氨基酸之间距离减小会使蛋白酶内部结构更加紧密,从而能够更好地发挥其酶活性。
表3 不同pH值对木瓜蛋白酶活性中心残基间距离的影响
Table 3 Effect of different pH on the distance between active center residues in papain nm
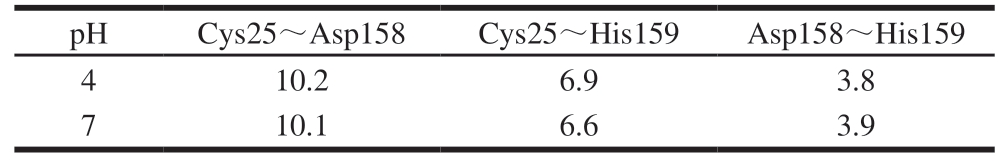
pHCys25~Asp158Cys25~His159Asp158~His159 4 10.26.93.8 7 10.16.63.9
2.2.8 木瓜蛋白酶分子与底物结合分析
10 次独立分子对接的打分中,pH 7条件下的10 次对接打分平均值为-222.140,pH 4条件下的10 次对接打分平均值为-124.155,对接打分越低,表明结合越牢固。结果表明,pH 7条件下的最低能量结构与β-酪蛋白对接,其对接打分明显低于pH 4条件下,说明pH 7条件下木瓜蛋白酶与β-酪蛋白结合更为紧密,提示催化活性更高,这与酶活性的测定结果一致。
由图6可知,pH 4条件下底物与木瓜蛋白酶结合部位有较大空腔,二者结合并不紧密,而pH 7条件下蛋白结合部位基本无缝隙,结合紧密且均匀,这与对接打分结果一致,说明pH 7条件下木瓜蛋白酶催化活性更高,催化效果更好。
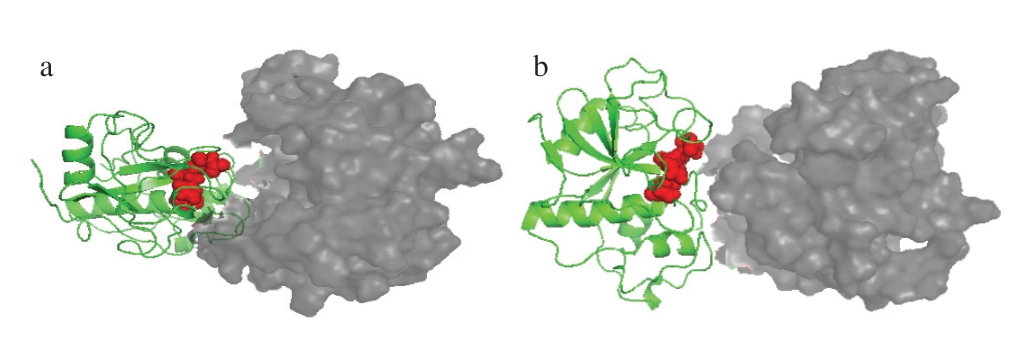
图6 不同pH值条件下木瓜蛋白酶与β-酪蛋白对接结构图
Fig. 6 Docking structure of papain with β-casein at different pH
a. pH 4;b. pH 7。红色部分为木瓜蛋白酶活性中心的3 个氨基酸(Cys25、Asp158、His159)。
2.3 不同pH值条件下木瓜蛋白酶的荧光光谱分析
荧光光谱是研究水溶液中蛋白质分子构象的一种有效方法[29],具有选择性好、灵敏性高的特点。研究[30]表明,蛋白质中能提供荧光的氨基酸主要是酪氨酸、色氨酸和苯丙氨酸,激发波长280 nm下的蛋白质分子荧光光谱图能有效反映蛋白质三级结构的变化情况。由图7可知,随着pH值的增加,木瓜蛋白酶的荧光峰位置基本没有发生蓝移或红移,说明荧光基团在亲水环境中以相对稳定的形式存在[24]。出现波峰的最大激发波长均为281 nm,但荧光强度明显不同。其中pH 8时的荧光强度最强,这可能是由于该pH值下疏水表面积最大,无规卷曲数量相对较多,空间结构松散,从而蛋白链断开或分解,导致游离的荧光氨基酸含量大增[31]。pH 4时荧光强度最低,可能由于是荧光基团过度暴露而发生猝灭[32]。pH 7时的荧光强度位于中间值,说明蛋白空间结构比较紧密,这与Rg、酶蛋白二级结构和活性中心残基距离分析结果一致。
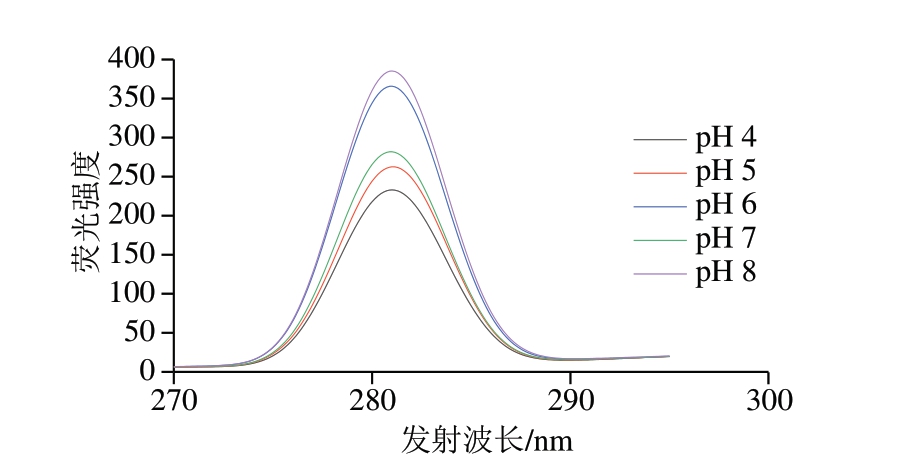
图7 不同pH值对木瓜蛋白酶荧光光谱的影响
Fig. 7 Effect of different pH on the fluorescence spectrum of papain
3 结论
考察5 组pH(4、5、6、7、8)对木瓜蛋白酶活性的影响,发现随着pH值的增加,木瓜蛋白酶的活性先增大后减小,pH 7条件下的木瓜蛋白酶活性最高。分子模拟结果显示,pH 4和8时木瓜蛋白酶活性中心的3 个氨基酸残基有较大波动,此外,在pH 4和8条件下,木瓜蛋白酶结构发生变化,包括氢键的破坏、疏水表面积的改变及β-折叠等二级结构的变化等因素导致活性下降。在pH 7时,木瓜蛋白酶活性中心与β-酪蛋白结合紧密,酶蛋白内部结构更致密,在pH 4时,木瓜蛋白酶活性中心与β-酪蛋白结合部位缝隙较大,且酶蛋白内部结构较松散,因此pH 7时更有利于酶的催化作用。本研究综合实验和分子模拟技术结果,探讨不同pH值对木瓜蛋白酶活性产生的影响,为促进木瓜蛋白酶在食品加工中的应用及提高产品品质提供了一定理论和实践基础。
[1] KAMPHUIS I G, KALK K H, SWARTE M, et al. Structure of papain refined at 1.65 Å resolution[J]. Journal of Molecular Biology, 1984,179(2): 233-256. DOI:10.1016/0022-2836(84)90467-4.
[2] 高进. 木瓜蛋白酶加工过程中的性质及结构研究[D]. 天津: 天津科技大学, 2018.
[3] 张琼. 超声波协同半胱氨酸促进木瓜蛋白酶嫩化肉块的应用研究[D].成都: 成都大学, 2021. DOI:10.27917/d.cnki.gcxdy.2021.000131.
[4] 张艳梅, 曾虹燕, 蔡西玲, 等. 汞离子对木瓜蛋白酶结构的影响及抑制机理的研究[J]. 中国生物工程杂志, 2012, 32(1): 87-91.DOI:10.13523/j.cb.20120112.
[5] 陈维. 探究pH值对3 种生物材料中过氧化氢酶活性的影响[J]. 生物学通报, 2014, 49(6): 53-56.
[6] 彭青, 侯冰, 姚芬, 等. pH值、温度、底物浓度对L1型金属β-内酰胺酶活性的影响[J]. 中国抗生素杂志, 2010, 35(1): 69-71; 76.DOI:10.13461/j.cnki.cja.004517.
[7] 狄荻, 周咏新, 张新烨, 等. 探究影响菠萝蛋白酶活性的条件[J]. 生物学通报, 2020, 55(11): 58-60. DOI:10.3969/j.issn.0006-3193.2020.11.019.
[8] LI Y L, ZHANG S Y, BAO Z J, et al. Exploring the activation mechanism of alcalase activity with pulsed electric field treatment:effects on enzyme activity, spatial conformation, molecular dynamics simulation and molecular docking parameters[J]. Innovative Food Science and Emerging Technologies, 2022, 76: 102918. DOI:10.1016/j.ifset.2022.102918.
[9] 帅雨桐, 黄业传, 何元琪, 等. 分子动力学模拟加热对肌动蛋白结构及酚类物质吸附的影响[J]. 肉类研究, 2021, 35(3): 8-13.DOI:10.7506/rlyj1001-8123-20210309-057.
[10] 黄业传, 张喜才, 曾奕秀, 等. 高压处理对木瓜蛋白酶活性的影响及分子动力学模拟[J]. 食品工业科技, 2023, 44(12): 102-107.DOI:10.13386/j.issn1002-0306.2022090241.
[11] ABRAHAM M J, MURTOLA T, SCHULZ R, et al. GROMACS: high performance molecular simulations through multi-level parallelism from laptops to supercomputers[J]. SoftwareX, 2015, 1/2: 19-25.DOI:10.1016/j.softx.2015.06.001.
[12] SCHMID N, EICHENBERGER A P, CHOUTKO A, et al. Definition and testing of the GROMOS force-field versions 54A7 and 54B7[J].European Biophysics Journal, 2011, 40(7): 843-856. DOI:10.1007/s00249-011-0700-9.
[13] 简清梅, 索化夷, 张喜才, 等. 分子动力学模拟超高压结合热处理对β-乳球蛋白结构的影响[J]. 食品科学, 2021, 42(23): 57-63.DOI:10.7506/spkx1002-6630-20210427-378.
[14] MEHTA S K, BHAWNA, REKHA, et al. The effect of the presence of sodium bis-(2-ethylhexyl) sulfosuccinate (AOT) on the interactions between sodium dodecyl sulfate (SDS) and protein papain[J].Journal of Molecular Liquids, 2017, 248: 751-758. DOI:10.1016/j.molliq.2017.10.083.
[15] 朱新儒. [CnPy]Cl(n=2,4,6)吡啶离子液体的合成及双水相萃取木瓜蛋白酶的研究[D]. 海口: 海南大学, 2019. DOI:10.27073/d.cnki.ghadu.2019.000896.
[16] 王伟涛. 木瓜蛋白酶的双水相萃取研究[D]. 海口: 海南大学, 2014.
[17] 余垒. PEG/无机盐/离子液体、离子液体/无机盐双水相分离纯化木瓜蛋白酶的研究[D]. 海口: 海南大学, 2019. DOI:10.27073/d.cnki.ghadu.2019.000737.
[18] LI F F, LI Q, WU S G, et al. Salting-out extraction of sinomenine from Sinomenium acutum by an alcohol/salt aqueous two-phase system using ionic liquids as additives[J]. Journal of Chemical Technology &Biotechnology, 2018, 93: 1925-1930. DOI:10.1002/jctb.5318.
[19] OCKERMAN H, HARNSAWAS S, YETIM H. Papain in meat is inhibited by potato protein or ascorbic acid[J]. Food Science, 1993, 58:1265-1268. DOI:10.1111/j.1365-2621.1993.tb06162.x.
[20] 孔庆新, 黄业传, 徐伟平, 等. β-乳球蛋白与EGCG结合规律的分子动力学探究[J]. 食品与生物技术学报, 2022, 41(1): 51-59.DOI:10.3969/j.issn.1673-1689.2022.01.007.
[21] 邵冬青, 张群, 姜舟婷. 分子动力学模拟研究温度对蛋白质结构稳定性的影响[J]. 中国计量大学学报, 2022, 33(1): 44-48; 130.DOI:10.3969/j.issn.2096-2835.2022.01.007.
[22] 曾琪, 胡淼, 王欢, 等. pH值处理对黑豆分离蛋白结构、流变特性及乳化性能的影响[J]. 食品科学, 2020, 41(22): 15-21. DOI:10.7506/spkx1002-6630-20190906-080.
[23] MOZHAEV V V, LANGE R, KUDRYASHOVA E V, et al. Application of high hydrostatic pressure for increasing activity and stability of enzymes[J]. Biotechnology & Bioengineering, 1996, 52(2): 320-331.DOI:10.1002/(sici)1097-0290(19961020)52:23.0.CO;2-N.
[24] 郭洪伟. 超高压、pH值对芽孢皮层裂解酶的活力及二、三级结构影响的研究[D]. 银川: 宁夏大学, 2019. DOI:10.27257/d.cnki.gnxhc.2019.000569.
[25] 韩玲. 温度及pH对氯化钠诱导的溶菌酶聚集的影响及其分子机制的研究[D]. 沈阳: 辽宁大学, 2011.
[26] ZHU J X, LI K J, WU H, et al. Multi-spectroscopic, conformational, and computational atomic-level insights into the interaction of β-lactoglobulin with apigenin at different pH levels[J]. Food Hydrocolloids, 2020, 105:105810. DOI:10.1016/j.foodhyd.2020.105810.
[27] ABDOLLAHI K, INCE C, CONDICT L, et al. Combined spectroscopic and molecular docking study on the pH dependence of molecular interactions between β-lactoglobulin and ferulic acid[J]. Food Hydrocolloids, 2019, 101: 105461. DOI:10.1016/j.foodhyd.2019.105461.
[28] DRENTH J, JANSONIUS J N, KOEKOEK R, et al. The structure of papain[J]. Advances in Protein Chemistry, 1971, 25: 79-115.DOI:10.1016/S0065-3233(08)60279-x.
[29] 杨家祥, 张玉慧, 许兴友, 等. 荧光光谱在蛋白质分子构象研究中的应用[J]. 淮海工学院学报(自然科学版), 1999, 8(4): 28-31.
[30] BHUIYA S, CHOWDHURY S, DAS S. Molecular insight into the binding aspects of benzo[c]phenanthridine alkaloid nitidine with bovine hemoglobin: a biophysical exploration[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2019, 223: 117293.DOI:10.1016/j.saa.2019.117293.
[31] 曾新安, 于淑娟, 徐娅莉. 脉冲电场对木瓜蛋白酶影响的荧光光谱分析[J]. 光谱学与光谱分析, 2007, 27(12): 2558-2561. DOI:10.3964/j.issn.1000-0593.2007.12.044.
[32] 郭雁. 驼乳血清白蛋白的分离纯化及其结构与稳定性研究[D]. 呼和浩特: 内蒙古农业大学, 2018.