我国是全球最大的畜禽肉生产和消费大国。2022年,我国畜禽肉消费总量达9 732万 t,人均占有量68.93 kg。肉类食品含有丰富的脂肪、蛋白质、必需氨基酸和微量元素等营养物质,为人体提供充足的热量[1]。然而,这些营养成分的存在极易导致肉及肉制品被食源性致病菌污染,引发人体食源性疾病。目前食源性疾病对国际公共卫生和安全构成威胁。2021年的欧盟报告称,弯曲杆菌造成的食源性疾病的确诊病例为127 840 例,由沙门氏菌(Salmonella)、志贺氏菌(Shigella)、小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)和李斯特氏菌(Listeriosis)造成的病例分别为60 050、6 789、6 084、2 183 例[2]。鸡肉(肉鸡)易被弯曲杆菌和沙门氏菌污染。一项研究表明,美国679 例食源性疾病被诊断与食用受污染的鸡肉有关[3]。另一项研究报告称,2017—2018年,单核细胞增生李斯特氏菌(Listeria monocytogenes)感染造成南非1 060 人患病,216 人死亡,而这一事件的发生与南非最大的食品公司之一的加工肉制品消费有关[4]。此外,加拿大一家肉类加工厂生产的牛肉制品被报道是引发2012年大肠杆菌O157:H7感染暴发的主要原因[5]。在我国,肉及肉制品引发的食源性疾病约占25%[6]。因此,由肉及肉制品中食源性致病菌引发的食源性疾病是亟需解决的公共卫生问题。
据报道,空肠弯曲杆菌(Campylobacter jejuni)[7]、小肠结肠炎耶尔森氏菌[8]、单核细胞增生李斯特氏菌[9]、金黄色葡萄球菌(Staphylococcus aureus)[10]、沙门氏菌[11]和志贺氏菌[12]等是肉及肉制品中常见的食源性致病菌。食用被食源性致病菌污染的肉品后,大部分人群主要表现为胃肠症状,但对于特殊人群会导致神经系统疾病、败血症等,甚至死亡[13]。因此,为更好地预防和控制肉及肉制品中食源性致病菌的感染,首先需要明确整个感染过程中致病菌和肠道上皮细胞之间的关系,这对于建立预防和治疗方案至关重要。近年来,应用体外人源细胞或人体组织构建的肠道模型在研究食源性致病菌方面取得了一定进展。鉴于此,本文在综述肉及肉制品典型食源性致病菌污染现状的基础上,讨论基于体内外模型的食源性致病菌感染方面的研究进展,并着重介绍肠道类器官作为新的模型体系对研究食源性致病菌的应用潜力,分析其存在的主要问题,为研究食源性致病菌的感染机制及建立完善的评价模型提供理论支撑,从而为进一步预防和控制肉及肉制品中食源性致病菌提供参考。
1 肉及肉制品中常见的食源性致病菌
1.1 空肠弯曲杆菌
空肠弯曲杆菌广泛存在于鸟、猪、牛、鸡、狗等多种动物肠道内,是一种微需氧的革兰氏阴性菌,也是引起人类腹泻的主要食源性致病菌之一。一项研究报道,在空肠弯曲杆菌感染中,约80%病例是由于食用了污染空肠弯曲杆菌的肉鸡[14]。空肠弯曲杆菌感染后临床表现为急性水样或血样腹泻及腹部绞痛,并伴有呕吐、发热、脱水等症状,研究显示,500~800 CFU剂量的空肠弯曲杆菌可以引起人体出现临床症状[15]。这是因为空肠弯曲杆菌通过被污染的食物进入宿主体内后迅速在小肠定植,然后通过鞭毛运动黏附并侵入肠道上皮细胞,产生并释放多种毒素引发病变[16]。然而,由于空肠弯曲杆菌的致病基因多种多样且发挥的作用也不同,因此,需要进一步借助肠道模型研究该菌感染机制。
1.2 小肠结肠炎耶尔森氏菌
小肠结肠炎耶尔森氏菌是一种能够在低温环境生长的无荚膜革兰氏阴性菌,广泛分布于动物宿主(尤其是羊和猪)[17]。由于小肠结肠炎耶尔森氏菌具有嗜冷特性,使其成为肉及肉制品和速冻食品中最主要的致病菌之一。据报道,肉制品中小肠结肠炎耶尔森氏菌的污染率为2.1%~27.4%,而在生肉制品中阳性检出率超过30%[8,18]。小肠结肠炎耶尔森氏菌感染机体后,不仅能够引起胃肠道症状,还会引起结节性红斑、耶尔森肝炎,甚至可引发败血症,严重时可导致死亡。由于该菌是一种肠侵入型致病菌,首先入侵肠上皮,然后经过Peyer’s淋巴结,进入吞噬细胞,并能够在其中存活并进行转移[19]。有研究报道称,铁的供应和外源性含铁细胞也可促进肠道外小肠结肠炎耶尔森氏菌感染的发展[20]。
1.3 单核细胞增生李斯特氏菌
单核细胞增生李斯特氏菌是一种革兰氏阳性菌,广泛存在于自然环境中,能够引发严重的食物中毒。该菌具有耐酸碱、耐高盐等特性,在4 ℃条件下仍可生长繁殖,是低温食品威胁人类健康的主要致病菌之一。我国近年来的食品安全风险监测结果表明,该菌在生肉中污染率较高[9]。在重庆市肉及肉制品的食源性致病菌污染监测报告中,单核细胞增生李斯特氏菌在生禽肉、生畜肉、调理肉制品及熟肉制品中检出率分别为16%、10%、4%和3%[21]。机体一旦感染单核细胞增生李斯特氏菌后,会引发胃肠炎、脑膜炎、败血症、流产等,甚至死亡,平均致死率约30%,已超过肉毒梭状芽孢杆菌(Clostridium botulinum)和沙门氏菌[22]。其感染机制也是通过入侵肠道上皮细胞,在细胞内和细胞间扩散,进而进入血液,由血液传送给其他敏感的机体细胞,其感染主要包括4 个阶段:内化、逃避胞液、肌动纤维聚集和细胞传播[20]。
1.4 金黄色葡萄球菌
金黄色葡萄球菌是兼性厌氧的革兰氏阳性球菌,具有耐高温、耐低温、耐高盐等特性,是一种常见的食源性致病菌。据统计,由金黄色葡萄球菌引起的食源性疾病占12.6%,是第三大食源性致病菌[23]。金黄色葡萄球菌感染机体后会产生葡萄球菌性肠毒素、溶血素、杀白细胞毒素等,使机体产生相应的临床症状,如恶心、呕吐、腹泻、慢性阻塞性肺疾病、肺炎、化脓性中耳炎、伪膜性肠炎、心包炎等疾病,甚至出现败血症、脓毒症[24]。由于金黄色葡萄球菌在低温冷冻条件下部分菌株会呈现亚致死状态,导致各类冷冻食品存在被该菌污染的风险。一项研究表明,在市售生鲜肉样品中金黄色葡萄球菌的检出率为37.84%[10]。从菏泽市牡丹区采集的120 份冷冻生猪产品中该菌的检出率为21.7%,纯肉类中检出率为30%,高于排骨类(15%)和内脏类(20%)[25]。
1.5 沙门氏菌
沙门氏菌是一种带鞭毛的革兰氏阴性、不形成孢子的兼性厌氧菌,由沙门氏菌引起的卫生安全问题引发许多国家的关注。每年我国约3亿 人因沙门氏菌患病,约占食源性疾病的70%~80%[26]。家禽、肉类产品和蛋是沙门氏菌病的主要来源。据统计,我国肉类食品沙门氏菌检出率为1.1%~39.5%,在英国和美国肉制品中检出率分别为9.9%和20%~25%[11]。食用沙门氏菌污染的食物后,临床表现主要有恶心、呕吐、腹胀腹泻、发热、不适、败血症等,其感染机制主要是沙门氏菌通过侵入肠道上皮细胞,之后到达肠壁固有层的淋巴结群,进而被巨噬细胞或树突状细胞吞噬并在其中大量繁殖,导致大量病原菌进入血液循环和淋巴循环,在肝脏及脾脏中定植,引发全身系统性感染[27-28]。
1.6 志贺氏菌
志贺氏菌是一类具有传染性的革兰氏阴性菌,分为痢疾志贺氏菌、福氏志贺氏菌、鲍氏志贺氏菌和宋内志贺氏菌,也是引发细菌性痢疾的食源性致病菌[29]。据报道,全球64%的细菌性腹泻疾病是由志贺氏菌感染所致,每年约有1.6亿 人感染,死亡人数高达110万[30]。在食品生产、加工等多个环节均易受到志贺氏菌污染。感染人体后,志贺氏菌会迅速入侵结肠黏膜,通过渗透、复制快速扩散到黏膜上皮细胞之间,诱导炎症反应,进而破环结肠上皮细胞,导致结肠黏膜炎症和溃疡,其临床表现主要为腹痛、腹泻、局部脓血便、神志障碍和休克等症状,严重时可致死亡[31]。
综上,为更好地预防和控制肉中微生物食源性中毒,需要改进对食源性致病菌感染的监测手段,通过建立有效的评价模型解析致病菌毒力因子的作用机制,预测食源性致病菌感染人体的潜力,以期为肉及肉制品中食源性致病菌检测技术的完善提供参考。
2 食源性致病菌感染的评价模型
食物被食源性致病菌污染,经食用后进入人体需要突破肠道屏障。针对食源性致病菌感染,体内动物模型是主要的评价模型。然而,使用动物模型仍存在一定的局限性,如研究结果不完全适用于人体、伦理、成本昂贵等。基于体外肠道模型可以研究食源性致病菌的毒性,通过评估感染细胞的菌株数量,分析菌株的感染进程和毒性强弱以及毒性因子的作用机制,阐明食源性致病菌影响人体健康的危害程度。
2.1 体内动物模型
基于人体肠道内部的复杂性和肠道菌群多样性,体内动物模型在研究食源性致病菌的致病机制、防治食源性致病菌的策略及评估治疗方案的有效性方面具有一定的优势。目前,已成功建立由沙门氏菌诱导肠道损伤的BALB/c小鼠模型[32]、产肠毒素大肠杆菌诱导肠道感染C57BL/6小鼠模型[33]、志贺毒素[34]和金黄色葡萄球菌[35]诱导的非人类灵长类动物模型。啮齿类动物成本低、易饲养,成为致病菌感染模型的首选;但是,由于某些致病菌对普通啮齿类动物的敏感度不高,需要对实验动物进行改造。例如,利用基因敲除技术构建空肠弯曲杆菌感染IL-10―/―小鼠模型,发现空肠弯曲杆菌在该免疫缺陷小鼠体内的定植率很高,具有高致病性,易导致血性炎性腹泻[36]。此外,通过转基因技术在小鼠肠细胞中表达人肠道上皮细胞钙黏蛋白,成功建立单核细胞增生李斯特氏菌感染模型,这种手段能够弥补单核细胞增生李斯特氏菌经口感染建立模型的不足[37]。由此可见,经过基因改造后的啮齿类动物可以更好地模拟食源性致病菌感染。虽然啮齿类动物为探索食源性致病菌感染机制提供了研究模型,但由于食源性致病菌种类较多,不能针对每一种致病菌进行啮齿类动物基因改造。除此之外,由动物实验获得的结果不能完全用于人体,并且“3R”原则(减少、替代、优化)倡导减少实验中使用的动物数量,因此,未来应进一步研发能够替代动物模型的食源性致病菌感染模型。
2.2 细胞模型
相较于动物模型,细胞模型能够简化复杂的生物系统,并且大规模培养。因此,细菌与上皮细胞相互作用的细胞培养模型已成为替代动物模型的首选方案。人结直肠腺癌细胞(Caco-2)、人结肠癌细胞(HT29)及人结肠腺癌细胞(SW480)等人类肠上皮癌细胞系是建立致病菌感染最常用的细胞系。早前的一项研究利用Caco-2细胞模型确证副溶血性弧菌(Vibrio parahaemolyticus)毒素引起生物腹泻的作用机制[38]。研究发现,单核细胞增生李斯特氏菌对SW480细胞的入侵具有高度选择性,该细胞系成为研究单核细胞增生李斯特氏菌感染机制的有效模型[39]。然而,从结构上讲,单层细胞不能解释3D结构和肠上皮的复杂细胞群。鉴于这些缺点,多细胞共培养3D模型被用于反映人体肠道的生理学。例如,与单独的HT29细胞(不产生黏液)相比,其与人组织细胞淋巴瘤细胞U937构建的3D共培养感染模型能抑制沙门氏菌的黏附、侵袭及存活,该结果更接近人体内巨噬细胞保护宿主免受肠道病原体侵害的事实[40]。目前,由于3D培养技术较为复杂且无统一标准,在研究食源性致病菌方面处于起步阶段,在解析致病菌毒性机制方面仍需更多的验证和评估。除此之外,这些构建肠道模型的细胞大都源自肿瘤,与人体原代肠道上皮细胞存在显著差异,不能表征实际的宿主细胞特征。因此,3D细胞模型作为研究食源性致病菌感染的优越性仍需进一步证实。
2.3 肠道类器官
为模拟体内肠道结构和生理特性,食源性疾病模型需要分化的隐窝-绒毛结构。肠道类器官利用从肠道组织中分离的多能干细胞或从肠隐窝分离的成体干细胞,通过3D培养技术生成的具有中空腔、花瓣状结构的细胞团,包含隐窝和绒毛(图1)。
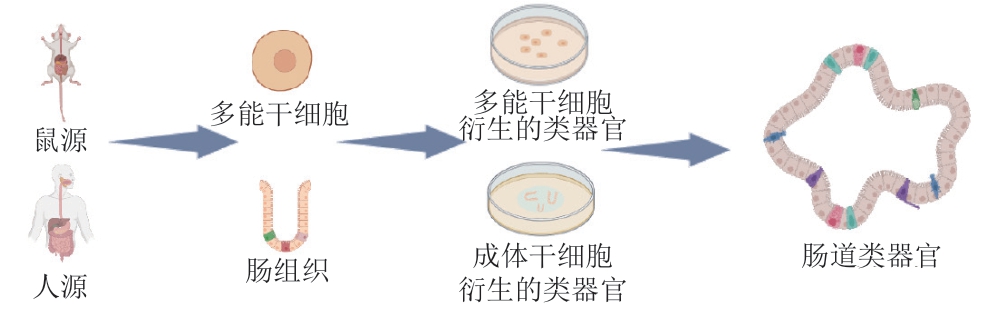
图1 肠道类器官形成示意图
Fig.1 Schematic diagram of the development of intestinal organoids
2009年,Sato等[41]利用小鼠Lgr5+干细胞培养出隐窝-绒毛类器官。传统的细胞模型和类器官模型的比较见表1。与体外细胞模型相比,肠道类器官由于其高度的细胞类型多样性和与具有类似肠道组织的形态学,被广泛应用于疾病建模、药物研发和疾病发生机制的研究。随着肠道类器官的发展,其食源性致病菌感染机制研究取得了一些进展。例如,Geiser等[42]建立了具有高度时间和空间分辨率的肠道类器官感染模型,发现鞭毛运动和III型分泌系统1(type III secretion system 1,TTSS-1)促进鼠伤寒沙门氏菌(Salmonella typhimurium)靶向肠上皮内隔室并突破上皮屏障,通过追踪感染,确定TTSS-1驱动的肠上皮细胞侵袭周期、上皮细胞内复制及感染的上皮细胞排出再现是鼠伤寒沙门氏菌管腔定植的关键机制。相较于基因缺陷的小鼠肠隐窝培养的类器官,正常类器官可通过分泌α-防御素抑制类器官腔内沙门氏菌的生长[43]。此外,利用人源干细胞培养的肠道类器官已成功建立了肠出血性大肠埃希氏菌感染模型[44]和志贺氏菌感染模型[45]。
表1 细胞模型与肠道类器官模型的比较
Table 1 Comparison of cell models versus intestinal organoid models
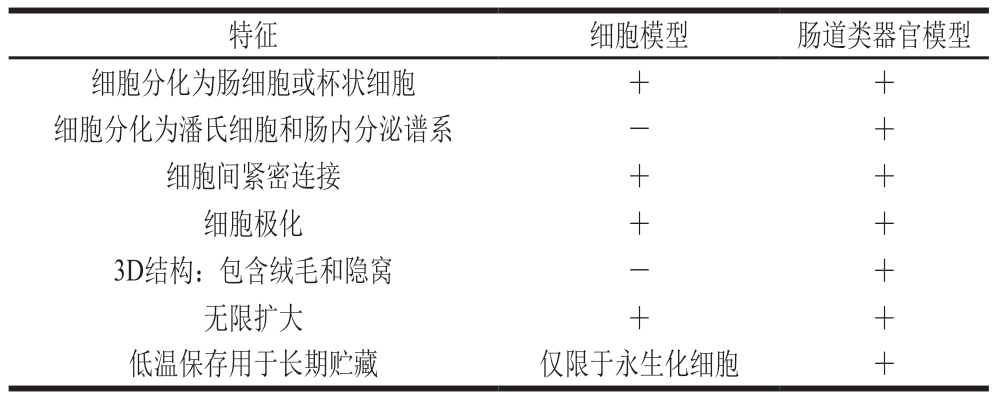
注:+.该模型能够满足列出的特征;-.该模型不能满足列出的特征。
特征细胞模型肠道类器官模型细胞分化为肠细胞或杯状细胞++细胞分化为潘氏细胞和肠内分泌谱系-+细胞间紧密连接++细胞极化++3D结构:包含绒毛和隐窝-+无限扩大++低温保存用于长期贮藏仅限于永生化细胞+
3 肠道类器官在食源性致病菌感染机制方面的应用
肠道类器官具有类似天然肠上皮细胞的遗传特征,能够模拟人体内细胞的状态,再现病原菌与肠道细胞间的相互作用和生物过程。Karve等[46]发现,添加中性粒细胞的肠道类器官可以模拟产志贺毒素大肠杆菌O157:H7感染肠道和先天细胞反应,结果表明,大肠杆菌O157:H7感染能够增加活性氧的产生,上调炎症反应,如白细胞介素(interleukin,IL)-8。此外,Koestler等[45]发现,福氏志贺氏菌优先通过基地外侧表面侵入极化的肠道类器官单层,形成肌动蛋白尾,并且福氏志贺氏菌能够增加肠道类器官促炎信号和氨基酸转运蛋白SLC7A5的表达,证明由于肠道类器官紧密连接的破坏导致福氏志贺氏菌入侵顶端表面,阐明了志贺氏菌的发病机制。已有研究证明了一些致病菌使肠道类器官中组织结构完整性丧失。例如,沙门氏菌[47]、肠出血性大肠杆菌[44,46]或志贺氏菌[45]感染的类器官呈现出明显的肠道组织损伤,并发现其细胞内也携带了这些病原体。
食源性致病菌感染肠道的部位和能力不同。例如,在肠出血性大肠杆菌感染的肠类器官模型中,结肠和空肠环境的类器官顶端表面附着的细菌数量存在差异,该菌优先定植在产生黏液的结肠类器官[44]。志贺氏菌与肠出血性大肠杆菌不同,可以从十二指肠、回肠和结肠侵入肠道[45]。此外,肠道类器官允许被基因编辑,利用基因编辑技术如CRISPR/Cas9有助于将其转化为多功能培养系统,进而评估它们对宿主的感染机制[48-49]。鉴于肠道类器官的特征类似于天然肠上皮细胞的遗传特征,因此也可以用于研究食源性致病菌感染后宿主的免疫反应。Crowley等[50]利用Caspase-1/11缺陷型(Casp1/11―/―)肠类器官模型验证了炎症半胱天冬酶(Caspase-1和Caspase-11)的激活可以促进炎症小体将感染/受损的肠上皮细胞从上皮层排到肠腔中,并且发现在感染早期Caspase-1对肠上皮细胞有保护作用,随着感染的进一步发展,宿主炎症反应上调肠上皮细胞中Caspase-11的表达,这2 种酶的共同作用形成了多层先天防御,从而控制细胞内沙门氏菌负荷,保护宿主免受病原体的攻击。此外,有研究学者还将对肠道稳态至关重要的其他细胞类型与肠道类器官共同培养,用于研究食源性感染后宿主免疫反应。Noel等[51]构建用于研究上皮细胞-巨噬细胞相互作用和对肠道病原体先天免疫反应的巨噬细胞-肠道共培养模型,发现顶端大肠杆菌感染提高了巨噬细胞的黏附性;与无巨噬细胞的肠道类器官相比,该模型中产肠毒素大肠杆菌的菌落形成单位数明显较低,并抑制促炎细胞因子,如IL-8、IL-6和干扰素-γ的分泌。综上,将基因工程和免疫细胞引入肠道类器官模型中可以进一步了解食源性致病菌影响肠道屏障功能和感染机制,以及明确宿主肠道的防御机制。因此,肠道类器官正逐渐成为研究食源性病原菌毒性机制的新工具。
肠道类器官可以模拟肠道复杂的多细胞环境,利用肠道类器官模型可以很好地了解食源性致病菌与高度特化的上皮细胞(即产生黏液的细胞、Paneth细胞和M细胞)的相互作用。尽管肠道类器官已展现出一定的优势,但其还存在一些不足,见表2。特别是,目前培养出的肠类器官,其上皮细胞顶端被封闭在管腔内,造成肠道其他类型细胞和微生物引入受到限制。尽管可以通过显微注射方法[52]将其引入,但这是一项繁琐的技术,并且该方法可能会受到腔内积聚的细胞物质的干扰。2012年,肠器官芯片的开发似乎可以解决这一问题。在芯片上通过将其他多种细胞与肠上皮细胞共培养成类似肠组织结构,并通过微流控技术和微工程技术对肠器官芯片结构不断优化改造,从而最大程度地还原肠道真实结构,更好地反映病理生理变化。例如,利用肠器官芯片构建志贺氏菌感染模型,发现志贺氏菌通过利用微结构和机械力有效地侵入肠道,从而影响肠道微环境[53]。Tovaglieri等[54]将出血性大肠杆菌引入人肠类器官和肠微血管内皮细胞搭建的肠器官芯片后,发现微生物代谢产物能够增加该菌的易感性。此外,利用肠道芯片结合肠道微生物构建的肠侵袭性大肠埃希氏菌感染模型得出与临床表现相似的结论,即益生菌能够抑制大肠埃希氏菌的过度生长并减轻由该菌引发的破坏性损伤[55]。由于肠道益生菌可以驱动肠道屏障的保护机制,基于微生物组分及其微环境之间的串扰作用将肠道微生物引入类器官进行疾病模拟,为开发食源性疾病的新疗法提供仿真度更优的研究平台。
表2 肠道类器官模型研究食源性致病菌的优缺点
Table 2 Advantages and disadvantages of intestinal organoid models to study foodborne pathogens

优势不足模拟内源性组织,包括紧密连接的表达和定位、黏液产生、细胞活力、细胞因子产生缺乏神经支配、免疫细胞、血管和肠道菌群包含完全成熟的杯状细胞、肠细胞、潘氏细胞和肠内分泌细胞缺乏机械应力(蠕动)和腔内及基底外侧流动可以从个体中获得诱导多能干细胞和类器官病原体与上皮细胞顶端很难直接接触大多数现代基因工程工具可以应用于诱导多能干细胞或直接应用于类器官系统不同来源的肠道类器官的大小、形状和生存能力存在异质性
4 结 语
食源性致病菌作为食源性疾病的重要影响因素,可对食品安全造成重大隐患。为深入研究肉及肉制品中食源性致病菌控制方法,需要建立有效的食源性致病菌感染肠道模型。本文首先总结肉及肉制品中常见的食源性致病菌,并讨论常用的肠道感染模型在研究食源性致病菌侵袭肠道方面的研究进展。然而,这些传统的动物模型、细胞模型在研究病原体与宿主相互作用方面存在局限性。类器官作为研究肠道细菌病原体毒力的人类模型,可以模拟肠道复杂的多细胞环境,揭示致病菌与肠道细胞间的相互作用和生物过程。但目前肠道类器官在食源性致病菌感染研究中仍存在一些不足,今后其研发方向和应用应关注以下问题:1)增加模型复杂性,以评估食源性致病菌与其他器官和环境的相互作用。为更好地模拟肠疾病并评估黏膜和上皮-免疫细胞通讯对食源性致病菌的作用,上皮类器官与其他器官特异性元件(如巨噬细胞和T细胞)共培养是有意义的;2)利用肠器官芯片重现食源性致病菌在肠道环境中暴露的机械力,如流动和蠕动。在动态条件下连接流体系统中的多个器官系统充分利用类器官的细胞多样性,通过器官芯片设备可以模拟多器官的复杂性,如肠-脑轴或肠道和肾脏之间的相互作用,深入研究从原发性感染到继发性感染部位的感染进展;3)创建个性化肠道类器官疾病模型。对携带与病原菌感染相关的突变类器官或患者来源的类器官进行基因工程改造,可以进一步揭示遗传特征和食源性疾病易感性之间的潜在联系;4)建立类器官标准化协议,促使实验室和临床更容易采用该模型,并提供更准确的数据。肠道类器官能够制造出仿生效果好、功能完善的肠微生理系统,为研究肉及肉制品中食源性致病菌的控制和预防提供更好的评价模型。
[1]BOHRER B M.Review: nutrient density and nutritional value of meat products and non-meat foods high in protein[J].Trends Food Science and Technology, 2017, 65: 103-112.DOI:10.1016/j.tifs.2017.04.016.
[2]European Food Safety Authority, European Centre for Disease Prevention and Control.The European Union one health 2021 zoonoses report[J].EFSA Journal, 2022, 20(12): e07666.DOI:10.2903/j.efsa.2022.7666.
[3]KARBOWIAK M, SZYMANSKI P, ZIELINSKA D.Synergistic effect of combination of various microbial hurdles in the biopreservation of meat and meat products[J].Foods, 2023, 12(7): 1430.DOI:10.3390/foods12071430.
[4]SMITH A M, TAU N P, SMOUSE S L, et al.Outbreak of listeria monocytogenes in South Africa, 2017-2018: laboratory activities and experiences associated with whole-genome sequencing analysis of isolates[J].Foodborne Pathogens Disease, 2019, 16(7): 524-530.DOI:10.1089/fpd.2018.2586.
[5]WARMATE D, ONARINDE B A.Food safety incidents in the red meat industry: a review of foodborne disease outbreaks linked to the consumption of red meat and its products, 1991 to 2021[J].International Journal of Food Microbiology, 2023, 398: 110240.DOI:10.1016/j.ijfoodmicro.2023.110240.
[6]孙新城, 李侠颖, 许素月, 等.肉与肉制品中食源性致病微生物快速检测技术研究进展[J].食品安全质量检测学报, 2023, 14(7): 32-38.DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.07.021.
[7]田璐, 张宁, 段保宁, 等.我国市场生鲜畜禽肉微生物污染情况分析:基于中国知网数据库[J].山东畜牧兽医, 2022, 43(1): 36-41; 44.
[8]杨卫, 丁业荣, 常宏伟, 等.冷冻冷藏食品小肠结肠炎耶尔森菌病原学检测[J].中国公共卫生, 2017, 33(2): 338-341.DOI:10.11847/zgggws2017-33-02-44.
[9]方林, 炊慧霞, 张秀丽.2016—2021年河南省禹州市主要消费食品中单核细胞增生李斯特氏菌污染监测分析[J].现代疾病预防控制, 2023, 34(6): 481-484.DOI:10.13515/j.cnki.hnjpm.1006-8414.2023.06.019.
[10]宋明辉, 秦峰, 刘浩, 等.市售生鲜肉食品中金黄色葡萄球菌基因分型与毒素基因检测[J].上海预防医学, 2019, 31(6): 461-465.DOI:10.19428/j.cnki.sjpm.2019.19478.
[11]倪皓洁, 周芷卉, 傅玲琳, 等.肉品中食源性致病菌检测技术研究进展[J].肉类研究, 2021, 35(3): 46-52.DOI:10.7506/rlyj1001-8123-20210309-059.
[12]刘红玉, 李岩, 崔洪斌.肉中4 种致病菌的PCR快速检测方法的建立[J].食品科学, 2011, 32(6): 213-216.
[13]ABEBE E, GUGSA G, AHMED M.Review on major food-borne zoonotic bacterial pathogens[J].Journal of Tropical Medicine, 2020,2020: 4674235.DOI:10.1155/2020/4674235.
[14]ANDREOLETTI O, BUDKA H, BUNCIC S, et al.Scientific opinion on quantification of the risk posed by broiler meat to human campylobacteriosis in the EU EFSA panel on biological hazards(BIOHAZ)[J].EFSA Journal, 2010, 8(1): 1437.DOI:10.2903/j.efsa.2010.1437.
[15]BLACK R E, LEVINE M M, CLEMENTS M L, et al.Experimental Campylobacter jejuni infection in humans[J].The Journal of Infectious Disease, 1988, 157(3): 472-479.DOI:10.1093/infdis/157.3.472.
[16]黄亚奇, 熊静禹, 沈达, 等.空肠弯曲杆菌毒力因子及其致病机制研究进展[J].中国家禽, 2019, 41(22): 46-51.DOI:10.16372/j.issn.1004-6364.2019.22.010.
[17]ODYNIEC M, BANCERZ-KISIEL A.Assessment of the role of freeliving and farmed fallow deer (Dama dama) as a potential source of human infection with multiple-drug-resistant strains of Yersinia enterocolitica and Yersinia pseudotuberculosis[J].Pathogens, 2022,11(11): 1266.DOI:10.3390/pathogens11111266.
[18]VERBIKOVA V, BORILOVA G, BABAK V, et al.Prevalence,characterization and antimicrobial susceptibility of Yersinia enterocolitica and other Yersinia species found in fruits and vegetables from the European Union[J].Food Control, 2018, 85: 161-167.DOI:10.1016/j.foodcont.2017.08.038.
[19]郭都.丁香酚抗小肠结肠炎耶尔森氏菌的作用及机制研究[D].杨凌: 西北农林科技大学, 2022.DOI:10.27409/d.cnki.gxbnu.2022.002203.
[20]王如景.三种食源性致病菌多重PCR快速检测方法的研究[D].保定: 河北农业大学, 2012.DOI:10.7666/d.y2143875.
[21]何源, 李志峰, 王红, 等.重庆市市售肉和肉制品食源性致病菌污染状况监测分析[J].中国卫生工程学, 2022, 21(5): 717-720.DOI:10.19937/j.issn.1671-4199.2022.05.005.
[22]MAURY M M, BRACQ-DIEYE H, HUANG L, et al.Hypervirulent Listeria monocytogenes clones’ adaption to mammalian gut accounts for their association with dairy products[J].Nature Communications,2019, 10(1): 2488.DOI:10.1038/s41467-019-11625-8
[23]吴林蔚, 杨祖顺, 汤晓召, 等.2019—2021年云南省市售食品中金黄色葡萄球菌污染情况调查[J].中国国境卫生检疫杂志, 2023, 46(5):424-429.DOI:10.16408/j.1004-9770.2023.05.006.
[24]WANG J, ZHANG H F, YAN J, et al.Literature review on the distribution characteristics and antimicrobial resistance of bacterial pathogens in neonatal sepsis[J].Journal of Maternal-Fetal and Neonatal Medicine, 2020, 35(5): 861-870.DOI:10.1080/14767058.20 20.1732342.
[25]王新华, 孔娜, 闫旭, 等.菏泽市冷冻猪产品中金黄色葡萄球菌的检测[J].山东畜牧兽医, 2023, 44(6): 34-36; 40.DOI:10.3969/j.issn.1007-1733.2023.06.008.
[26]WU L J, LUO Y, SHI G L, et al.Prevalence, clinical characteristics and changes of antibiotic resistance in children with nontyphoidal Salmonella infections from 2009-2018 in Chongqing, China[J].Infection and Drug Resistance, 2021, 14: 1403-1413.DOI:10.2147/IDR.S301318.
[27]宁灿灿.抗鼠伤寒沙门氏菌植物源酚类的筛选及作用机制探讨[D].郑州: 河南农业大学, 2023.DOI:10.27117/d.cnki.ghenu.2023.000639.
[28]AZIMI T, ZAMIRNASTA M, SANI M A, et al.Molecular mechanisms of Salmonella effector proteins: a comprehensive review[J].Infection and Drug Resistance, 2020, 13: 11-26.DOI:10.2147/IDR.S230604.
[29]LEE J, KANG D.Development of an improved selective medium for the detection of Shigella spp.[J].LWT-Food Science and Technology,2016, 65: 311-317.DOI:10.1016/j.lwt.2015.08.028.
[30]MOKHTARI W, NSAIBIA S, MAJOURI D, et al.Detection and characterization of Shigella species isolated from food and human stool samples in Nabeul, Tunisia, by molecular methods and culture techniques[J].Journal of Applied Microbiology, 2012, 113(1): 209-222.DOI:10.1111/j.1365-2672.2012.05324.x.
[31]卢鑫, 王立娟, 郭威, 等.食品中志贺氏菌检测技术研究进展[J].食品工业科技, 2022, 43(1): 410-416.DOI:10.13386/j.issn1002-0306.2020100045.
[32]DONG N, LI X R, XUE C Y, et al.Astragalus polysaccharides attenuated inflammation and balanced the gut microflora in mice challenged with Salmonella typhimurium[J].International Immunopharmacology, 2019, 74: 105681.DOI:10.1016/j.intimp.2019.105681.
[33]王兆雨, 吴晓宇, 裴小琪, 等.生物活性肽对产肠毒素大肠杆菌诱导的小鼠肠道损伤的缓解作用[J].动物营养学报, 2023, 35(7): 4659-4667.DOI:10.12418/CJAN2023.432.
[34]TAYLOR F, TESH V, DEBAULT L, et al.Characterization of the baboon responses to Shiga-like toxin: descriptive study of a new primate model of toxic responses to Stx-1[J].The American Journal of Pathology, 1999, 154(4): 1285-1299.DOI:10.1016/S0002-9440(10)65380-1.
[35]BOLES J W, PITT M, LE CLAIRE R D, et al.Generation of protective immunity by inactivated recombinant staphylococcal enterotoxin B vaccine in nonhuman primates and identification of correlates of immunity[J].Clinical Immunology, 2003, 108(1): 51-59.DOI:10.1016/S1521-6616(03)00066-4.
[36]HEIMESAAT M M, ALUTIS M E, GRUNDMANN U, et al.The role of IL-23, IL-22 and IL-18 in Campylobacter jejuni infection of conventional infant mice[J].European Journal of Microbiology and Immunology, 2016, 6(2): 124-136.DOI:10.1556/1886.2016.00008.
[37]LECUIT M, POURNIN S V, LEFORT J, et al.A transgenic model for listeriosis: role of internalin in crossing the intestinal barrier[J].Science, 2001, 292: 1722-1725.DOI:10.1126/science.1059852.
[38]TAKAHASHI A, IIDA T, NAIM R, et al.Chloride secretion induced by thermostable direct haemolysin of Vibrio parahaemolyticus depends on colonic cell maturation[J].Journal of Medical Microbiology, 2001,50(10): 870-878.DOI:10.1099/0022-1317-50-10-870.
[39]GERARDI G, RIVERO-PÉREZ M D, CAVIA-SAIZ M, et al.Wine pomace product inhibit Listeria monocytogenes invasion of intestinal cell lines Caco-2 and SW-480[J].Foods, 2021, 10(7): 1485.DOI:10.3390/foods10071485.
[40]BARRILA J, YANG J, CRABBÉ A, et al.Three-dimensional organotypic co-culture model of intestinal epithelial cells and macrophages to study Salmonella enterica colonization patterns[J].NPJ Microgravity, 2017, 3: 10.DOI:10.1038/s41526-017-0011-2
[41]SATO T, VRIES R G, SNIPPERT H J, et al.Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J].Nature, 2009, 459(7244): 262-265.DOI:10.1038/nature07935.
[42]GEISER P, MARTINO M L D, VENTAYOL P S, et al.Salmonella enterica serovar typhimurium exploits cycling through epithelial cells to colonize human and murine enteroids[J].mBio, 2021, 12(1):e02684-20.DOI:10.1128/mBio.02684-20.
[43]WILSON S S, TOCCHI A, HOLLY M K, et al.A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions[J].Mucosal Immunology, 2015, 8(2): 352-361.DOI:10.1038/mi.2014.72.
[44]IN J, FOUKLE-ABEL J, ZACHOS N C, et al.Enterohemorrhagic Escherichia coli reduce mucus and intermicrovillar bridges in human stem cell-derived colonoids[J].Cellular and Molecular Gastroenterology and Hepatology, 2016, 2(1): 48-62.DOI:10.1016/j.jcmgh.2015.10.001.
[45]KOESTLER B J, WARD C M, FISHER C R, et al.Human intestinal enteroids as a model system of Shigella pathogenesis[J].Infection and Immunity, 2019, 87: e00733-18.DOI:10.1128/IAI.00733-18.
[46]KARVE S S, PRADHAN S, WARD D V, et al.Intestinal organoids model human responses to infection by commensal and Shiga toxin producing Escherichia coli[J].PLoS ONE, 2017, 12: e0178966.DOI:10.1371/journal.pone.0178966.
[47]HOLLY M K, HAN X, ZHAO E J, et al.Salmonella enterica infection of murine and human enteroid-derived monolayers elicits differential activation of epithelium-intrinsic inflammasomes[J].Infection and Immunity, 2020, 88(7): e00017-20.DOI:10.1128/IAI.00017-20.
[48]ARTEGIANI B, HENDRIKS D, BEUMER J, et al.Fast and efficient generation of knock-in human organoids using homology-independent CRISPR-Cas9 precision genome editing[J].Nature Cell Biology, 2020,22(3): 321-331.DOI:10.1038/s41556-020-0472-5.
[49]ABERLE M R, BURKHART R A, TIRIAC H, et al.Patientderived organoid models help define personalized management of gastrointestinal cancer[J].British Journal of Surgery, 2018, 105(2):E48-E60.DOI:10.1002/bjs.10726.
[50]CROWLEY S M, HAN X, ALLAIRE J M, et al.Intestinal restriction of Salmonella typhimurium requires caspase-1 and caspase-11 epithelial intrinsic inflammasome[J].PLoS Pathogens, 2020, 16(4):e1008498.DOI:10.1371/journal.ppat.1008498.
[51]NOEL G, BAETZ N W, STAAB J F, et al.A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions[J].Scientific Reports, 2017,7: 45270.DOI:10.1038/srep46790.
[52]CO J Y, MARGALEF-CATALÀ M, LI X, et al.Controlling epithelial polarity: a human enteroid model for host-pathogen interactions[J].Cell Reports, 2019, 26: 2509-2520.DOI:10.1016/j.celrep.2019.01.108.
[53]GRASSART A, MALARDÉ V, GOBBA S, et al.Bioengineered human organ-on-chip reveals intestinal microenvironment and mechanical forces impacting shigella infection[J].Cell Host Microbe, 2019, 26(3):435-444.DOI:10.1016/j.chom.2019.08.007.
[54]TOVAGLIERI A, SONTHEIMER-PHELPS A, GEIRNAERT A,et al.Species-specific enhancement of enterohemorrhagic E.coli pathogenesis mediated by microbiome metabolites[J].Microbiome,2019, 7(1): 43.DOI:10.1186/s40168-019-0650-5.
[55]KIM H J, LI H, COLLINS J, et al.Contributions of microbiome and mechanical deformation to intestinal bacterial overgrowth and inflammation in a human gut-on-a-chip[J].Proceedings of the National Academy of Sciences, 2015, 113(1): E7-E15.DOI:10.1073/pnas.1522193112.