甘油二酯(diacylglycerol,DAG)是2 分子脂肪酸结合到甘油的羟基上发生酯化反应的产物,DAG经肠代谢后生成的产物为1-甘油一酯(monoglyceride,MAG)或3-MAG,与甘油三酯(triacylglycerol,TAG)的代谢产物2-MAG相比,1-MAG对TAG再合成酶的亲和力较差,因而不易再合成TAG,避免体内脂堆积[1-2]。DAG具有降血脂、减少脂肪积累、抑制体质量增加的功能,使其作为一种健康的脂质备受青睐。在前期研究中发现,将猪油DAG应用于乳化肠中可以改善乳化肠的保水、保油性,提高其整体感官特性[3]。
猪油具有独特的脂肪香气和滑润口感,但由于热量、胆固醇含量及饱和脂肪酸含量过高,过多食用不利健康;而将猪油改性制备成猪油DAG,在提高猪油的营养和利用价值的同时还能降低资源浪费。近年来,随着预制菜产业的快速兴起,能否将猪油DAG作为烹饪用油应用于预制菜生产中以提高预制菜功能特性是一个有待研究的问题。油脂在加热烹饪过程中会发生降解,产生不同种类的有毒化合物,如不饱和醛和多环芳烃等物质,这些物质的产生不仅取决于加热条件,还取决于油的性质[4]。在前期预实验加热过程中,观察到猪油DAG在加热到90 ℃时会从油脂表面逐渐冒出白色烟气,并闻到“熟油”气味;此后随温度上升,烟气增多并在加热到150 ℃后逐渐趋于饱和,而在实际DAG制备、加热食物或菜品复热时油温也会控制在180 ℃以内[5-6]。
目前关于温度调控对油脂特性影响的研究主要集中在功能性植物油脂,如棕榈油、亚麻籽油、菜籽油等,且多以单一指标如挥发性物质或脂肪酸组分分析为主,而以多指标探究温度对动物功能性油脂食用品质影响的研究较少。因此,本研究以猪油DAG为研究对象,依据预实验结果及烹饪加工实际需要将其加热至95、120、145 ℃,探究不同加热温度对猪油DAG结构性质和挥发性物质的影响,旨在为烹饪温度对猪油DAG特性的影响提供参考,指导油脂加工与消费;同时为油脂健康食用和高值化利用、预制菜加工及开发新的功能性健康食品提供理论依据。
1 材料与方法
1.1 材料与试剂
猪板油购于锦州万达超市。
环己酮、无水乙醇(纯度>99.7%)(均为色谱纯)、正己烷、甲醇钠、氯化钠、丙三醇(均为分析纯)阿拉丁(上海)有限公司;Lipozyme TL IM酶 诺维信(中国)生物技术有限公司。
1.2 仪器与设备
PL602-L/00电子分析天平 梅特勒-托利多仪器(上海)有限公司;7890A-5975C气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪美国Agilent公司;Q2000差示扫描量热仪(differential scanning calorimetry,DSC)、Discovery DHR-1流变仪美国TA公司;IS-50傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国尼高力公司;Ultima LV X射线衍射仪 日本理学公司;DTA TG 60H热重(thermogravimetry,TG)分析仪日本岛津公司。
1.3 方法
1.3.1 样品制备
参考Diao Xiaoqin等[7]的方法。将猪背膘加热熔化得到猪油后,采用甘油解法制备猪油DAG。将猪油DAG置于不锈钢锅中,使用电磁炉分别加热至95、120、145 ℃,加热时长依次为59、120、174 s。保存于4 ℃冰柜中,备用。
1.3.2 FTIR测定
参考Vlachos[8]、Zheng Ling[9]等的方法。使用红外干燥灯干燥溴化钾(KBr)颗粒。称取质量约200 mg的KBr颗粒,磨成细小均匀的粉末。每次压片前将压片机模具台清理干净,KBr粉末在模具台内均匀铺平,将模具台放在压片机上,旋紧螺旋,关紧放气阀,加压至10 MPa,停留90 s后,慢慢打开放气阀,使压力缓慢下降到0 MPa。取出模具内的KBr片,备用。KBr压片应呈薄、透明、均匀状态。选择空气为扫描背景,扫描完成用滴管吸取油样,滴在纯KBr片上,另取一个新KBr片覆盖,放入FTIR仪中进行扫描。光谱扫描范围4 000~500 cm-1、分辨率4 cm-1、每20 s扫描20 次,获得油样的FTIR谱图。
1.3.3 X射线衍射分析
参考Liu Manman等[10]的方法稍作修改,使用X射线衍射仪检测猪油DAG的晶型。在2θ 5~35°内进行扫描,放射源Cu靶管、工作电压36 KV、工作电流20 mA、扫描步长0.02°、扫描速率10°/min。
1.3.4 热力学特性测定
参考Tavernier等[11]的方法,采用DSC对猪油DAG的熔融和结晶性能进行分析。氮气用于吹扫系统,首先进行温度校准,然后称取8.0 mg左右油样,密封在铝坩埚中再放入样品池,空白组为空铝坩埚。测量的样品质量会显著影响热分析峰的形状和重现性,因此应保证样品质量基本相同((8.00±0.01)mg)。为完全破坏晶体,油样加热到80 ℃后平衡5 min。参数设置如下:降温阶段,样品以8 ℃/min的恒定速率从80 ℃冷却至-40 ℃,平衡5 min;升温阶段,样品以8 ℃/min的速率从-40 ℃加热至80 ℃,从而得到样品的熔融和结晶曲线。
1.3.5 流变特性测定
参考孙迪[12]的方法,使用流变仪测定猪油DAG静态流变性质,取适量的猪油DAG置于测试台中心部位。参数设置为:温度25 ℃、模式Flow Sweep、测量板直径40 mm、剪切速率0.1~800.0 s-1。检测数据由流变仪自动处理,然后生成其黏度-剪切速率曲线。
1.3.6 TG分析
参考Hobuss等[13]的实验方法,在TG分析仪上对猪油DAG进行分析。取8~10 mg油样于25~600 ℃加热,升温速率10 ℃/min,氮气流速50 mL/min。
1.3.7 脂肪酸成分分析
参考Li Guanghui等[14]的方法,用脂肪酸甲酯法对猪油DAG的脂肪酸组成进行分析。首先进行样品甲酯化,使用4 mL正己烷溶解200 mg样品,然后加入0.8 mL 2 mol/L甲醇钠溶液,用漩涡振荡器混合1 min,再加入5 mL饱和氯化钠溶液,每隔15 s振摇1 次,沉降10 min后,取1 mL上清液3 000 r/min离心5 min,取上清液过0.22 μm有机滤膜以除去杂质,滤液进行GC-MS分析。将1 μL上清液注入GC系统。
脂肪酸组成具体分析方法如下:HP-5毛细管柱(30 m×0.32 mm,0.25 μm);氢火焰离子化检测器;以氮气为载气、流速1.017 3 mL/min,分流比为20∶1;烘箱温度150 ℃保持4 min,然后以15 ℃/min的速率增加到210 ℃,保持5 min,最后以30 ℃/min的速率增加到230 ℃,保持5 min。总分析时间为25 min。进样器和检测器的温度分别保持在250、300 ℃。用计算机将样品中的脂肪酸与NIST-147谱库进行匹配,选择相似度大于90%的作为鉴别结果。为更好表征猪油DAG特性,以相同处理条件的猪油作为对照组,对比探究猪油DAG脂肪酸组成。
1.3.8 挥发性组分测定
参照史亚静等[15]固相微萃取-GC-MS(solid-phase microextraction-GC-MS,SPME-GC-MS)法测定挥发性组分,具体条件如下:
称取3.000 0 g油样置于螺口样品瓶中,在磁力搅拌器上加热平衡10 min,以5 μL 0.947 g/mL环己酮和5 mL无水乙醇配备内标液,加入7 μL内标液,在50 ℃条件下用SPME探头富集40 min后手动进样,氮气流速50 mL/min。
GC条件:TG-Wax MS极性柱(30 m×0.25 mm,0.25 μm);程序升温:40 ℃保持5 min,4 ℃/min升至120 ℃保持2 min,4 ℃/min升至240 ℃保持2 min,10 ℃/min升至260 ℃保持10 min;萃取头插入GC-MS仪进样器解吸5 min;载气:高纯氮气(纯度>99.99%),流速1.0 mL/min。
MS条件:表面温度260 ℃;传输线温度230 ℃;电压1.2 kV;电子电离离子源温度230 ℃;电子能量70 eV;全扫描模式;扫描范围m/z 40~600;扫描时间2 s。
定性与定量分析:定性分析通过系统自带计算机谱库(NIST/WILEY)进行检索和分析,选择匹配度大于600(总值1 000)的检索结果,确认挥发性化合物的化学成分;定量分析以环己酮作为内标,根据环己酮含量和峰面积,参照史亚静等[15]的方法计算各挥发性物质含量及在总挥发性物质中的相对含量。
为更好表征猪油DAG特性,以相同处理条件的猪油作为对照组,对比探究猪油DAG的挥发性组分。
1.4 数据处理
各指标平行测定3 次后取平均值,结果以平均值±标准差表示。数据处理使用SPSS 27.0软件、绘图使用Origin 2022软件和ChiPlot网站。
2 结果与分析
2.1 猪油DAG FTIR分析
FTIR基于光谱指纹信息,可以提供有关油脂的多种化学信息[16]。FTIR图谱中2 918、2 850 cm-1处的吸收峰分别归属于—CH2的反对称和对称伸缩振动;1 739 cm-1处的吸收峰归属于C=O的伸缩振动;1 466 cm-1处的吸收峰归属于C—H的弯曲振动;1 177 cm-1处的吸收峰归属于C—O—C中C—O的伸缩振动;726 cm-1处有碳骨架振动峰[17]。由图1可知,对比不同加热温度处理下DAG,120、145 ℃处理的样品在726 cm-1处的峰强度明显低于95 ℃组,Aktas等[18]研究发现,700 cm-1左右的碳骨架振动与氧化反应程度有关,并表示可能是丙二醛含量增加造成的。因此,推测峰形改变是因为温度升高导致DAG被氧化,使丙二醛含量增多。Embaby等[19]使用DSC和FTIR研究金莓果渣油和金莓种子油结晶和熔融性能,结果表明,TAG中的脂肪酸结构会影响峰的位置和形状,并指出是由于甘油酯的脂肪酸比例变化导致。经不同温度加热后的DAG脂肪酸含量变化较大,因而DAG的FTIR光谱波动显著,验证了峰形可由脂肪酸影响。此外,红外光谱技术已被广泛用于油脂掺假鉴别[20],也可与化学计量学结合监测和定量表示油脂的过氧化值[21],并可用于定量分析游离脂肪酸含量[22]。刘翠玲等[23]使用红外光谱模型预测食用油的理化指标(酸价、过氧化值),并结合偏最小二乘法建立了定量分析模型,从而为光谱分析模型的应用提供了新思路。
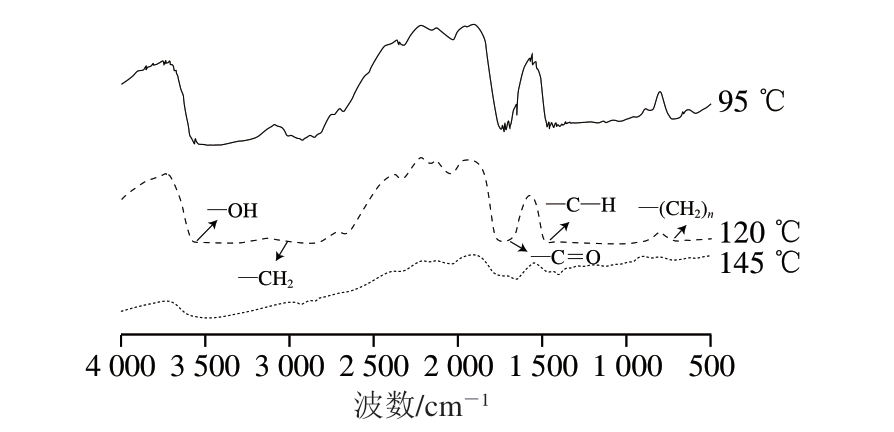
图1 不同加热温度猪油DAG在4 000~500 cm-1的FTIR图谱
Fig.1 FTIR spectra of lard DAG at different temperatures in the range of 4 000–500 cm-1
2.2 猪油DAG晶型分析
油脂晶型主要分为α、β和β’晶型,猪油通常以β晶型为主,β和β’晶型共存[24];而1,2-DAG通常为α和β’晶型,1,3-DAG仅表现为β’晶型。4.60、4.41 Å为β晶型的特征峰,而4.20、3.80 Å是β’晶型的特征峰,由图2可知,DAG在4.41 Å处的特征峰较小,并在3.80 Å检测到了尖锐的特征峰,这表示DAG缺少最稳定的β型,也解释了DAG稳定性不如猪油的原因。3 种加热温度下猪油DAG有相同的特征峰,只是145 ℃下DAG峰更高、峰宽变窄、峰强度变大,可能是此时油脂中β’晶型向β晶型转化;1,3-DAG表现为β晶型,1,2-DAG表现为β’晶型[25],此时1,2-DAG比例下降,导致β’晶型占比降低,因此,峰形变高可能是温度上升导致。β’晶型是由相对较小的晶体颗粒聚集而成,晶体网络结构具有较大的表面积,β’晶型减少会导致大晶体形成(>30 μm),从而在食用时产生砂砾感,此时表明DAG随温度升高逐渐劣化。Li Ziwei等[26]在研究DAG不同碳链长度(C12~C18)与发泡性能之间的稳定机制和联系时发现,不同碳链长度会引起晶型发生改变。因此,推测不同温度对油脂晶型的改变是通过改变脂肪酸组成,特别是链长实现的。李琳等[27]总结晶型改变是由于不对称结构的TAG易形成β’晶型,对称结构则倾向于形成β晶型;晶型转变速率取决于TAG的均一性,也证明了脂肪酸组成是改变晶型的原因。
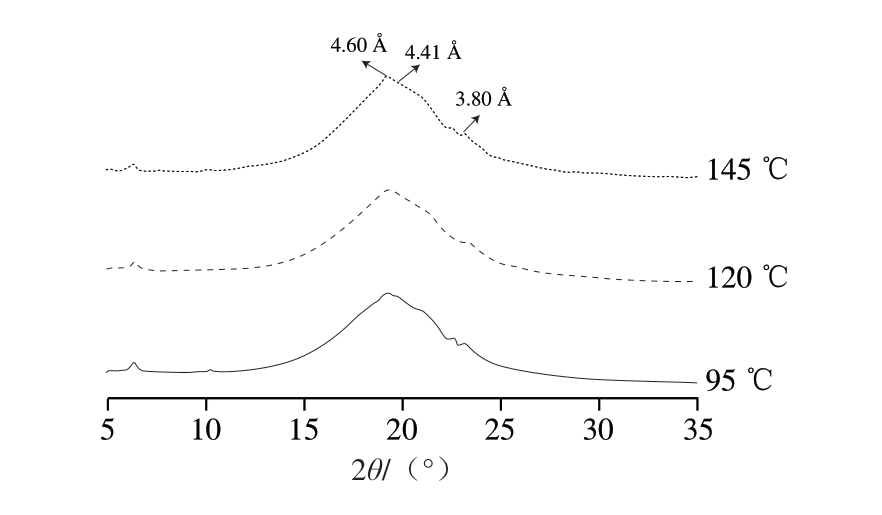
图2 不同加热温度下猪油DAG的X射线衍射图
Fig.2 X-ray diffraction patterns of lard DAG at different temperatures
2.3 猪油DAG融化和结晶特性分析
DSC是重要的热分析技术,可以用来表征油脂热性质。由图3A可知,猪油DAG经95、120 ℃处理的结晶曲线中有4 个峰,而145 ℃的结晶曲线中有3 个峰,造成这种现象的原因可能是脂肪的不同化学成分会影响放热,不同脂肪酸成分的晶型构成存在差异[28]。此外,由于甘油酯种类繁多,导致油脂没有固定融化和结晶温度,因而结晶速度不一致[18]。Silva等[28]向饱和TAG中加入低浓度DAG延迟了结晶发生,向不饱和TAG中加入DAG则加速了结晶过程,这是由于DAG和TAG脂肪酸组成有差异,DAG的加入影响了TAG的多晶型转变;除了脂肪酸成分差异的影响,Chai Xiuhang等[29]在研究时发现,添加DAG可以提高脂肪的熔点和起始结晶温度,并将这种现象出现的原因总结为DAG和TAG之间发生了相互作用。同时本研究在95 ℃处理的DAG中发现了更尖锐的结晶峰,表明此温度下DAG含量更高,而随着温度上升,DAG被破坏或发生氧化劣变,含量降低,从而导致结晶峰降低。
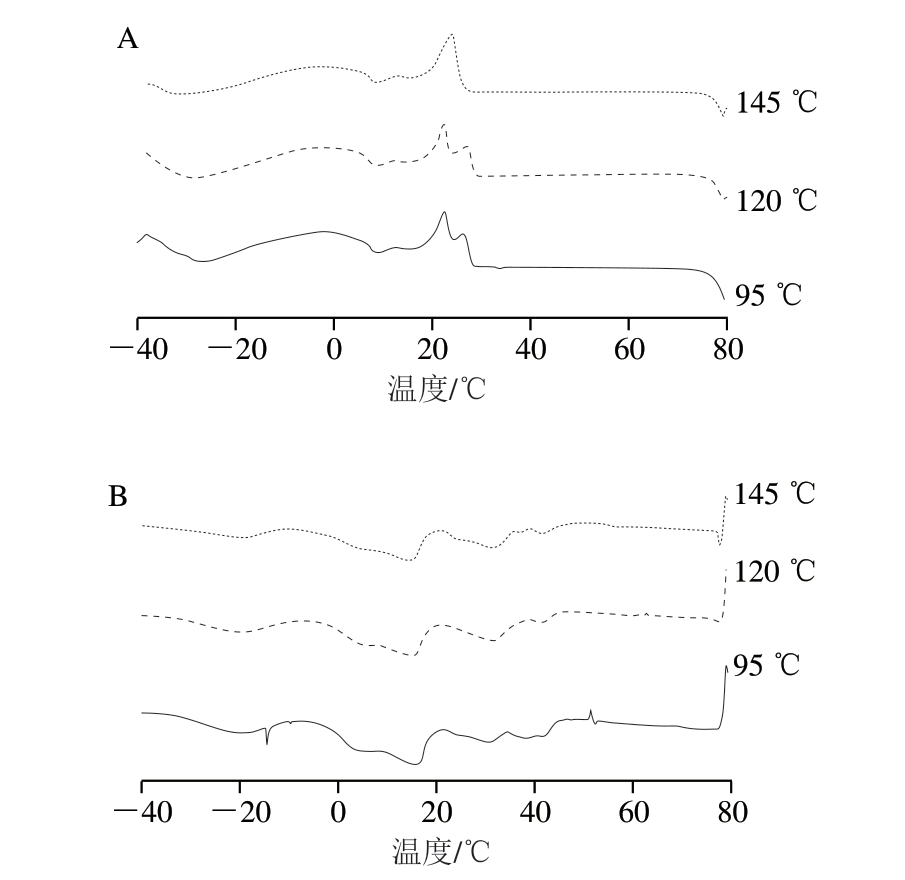
图3 不同加热温度下猪油DAG的结晶(A)及熔融(B)曲线
Fig.3 Crystallization (A) and melting (B) curves of lard DAG at different temperatures
对于熔融曲线(图3B),在145 ℃下处理的DAG比120、95 ℃处理的DAG起始熔点和融化峰更低,这表明随着DAG含量上升,熔点和起始点向较高温度发生移动。Miklos等[30]在研究DAG和TAG的熔融和结晶特性时也发现,随DAG含量上升,起始熔点显著增大,这与本研究结果一致。
2.4 猪油DAG流变特性分析
油脂的流变学特性可直接反映其感官特性和整体接受度,也可以通过测定黏度来分析油脂稳定性随温度变化的趋势。由图4可知,经不同温度加热的油脂表现出一致的流变特性,在未剪切时,145 ℃加热的油脂黏度最大,其次是120 ℃组,95 ℃组的黏度相对最小;在剪切速率0~200 s-1表现出明显的剪切稀化的非牛顿流体流变行为,随着剪切速率增大,流体黏度逐渐减小并趋于稳定,这是因为剪切速率的提高有利于油脂形成一种更加稳定且均匀的流体结构状态。剪切速率在200~800 s-1时,随着剪切速率加快,120、145 ℃时油脂黏度降低明显,95 ℃时油脂黏度最大。通常油脂黏度越高、稳定性越好,因此,过度热加工会降低DAG的流动稳定性,影响油脂品质。这可能和油脂中脂肪酸种类、含量、碳链长度及不饱和程度有关。脂肪酸平均碳链越长,黏度越大;不饱和度越高,黏度越小[31];本研究在脂肪酸组成测定时发现120 ℃处理时DAG的不饱和脂肪酸含量最高,此时黏度最小。苏洪凯等[32]研究温度对植物油黏度和密度的影响时发现,3 种植物油黏度均随温度升高而降低,与本研究得到的结果一致。温度变化对DAG黏度影响较小,Tavernier等[33]研究发现,含有DAG的脂肪具有更强的网络结构,多晶型的存在改变了晶体网络结构,进而影响了流动性,而MAG与TAG的存在则导致脂肪网络结构被削弱。
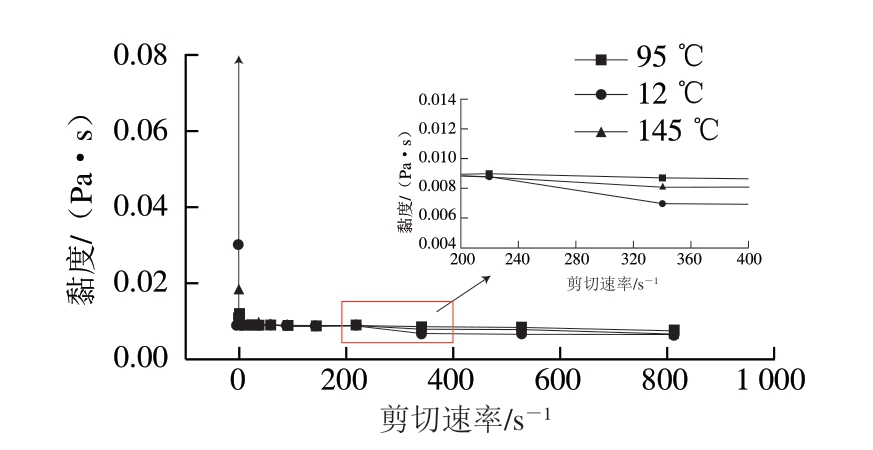
图4 不同加热温度下猪油DAG的黏度随剪切速率变化曲线
Fig.4 Viscosity-shear rate curves of lard DAG at different temperatures
2.5 猪油DAG TG分析
由图5A可知,3 种温度处理的猪油DAG的TG曲线具有相似变化趋势,95 ℃处理的DAG氧化分解温度最高,与其他温度处理的样品相比,此温度下DAG不容易发生热变质。一般来说,油脂中脂肪酸的不饱和程度越高,热稳定性越低。在脂肪酸组成测定时发现,95 ℃处理组的DAG不饱和脂肪酸相对含量为36.2%,低于120 ℃组(51.4%),随着温度升高,145 ℃时不饱和脂肪酸被氧化程度加深,含量逐渐降低。Huang Ying等[34]在研究富含α-亚麻酸和月桂酸的中长链脂质热氧化稳定性时发现,与单一脂质相比,由于加入了α-亚麻酸和月桂酸,中长链脂质对TAG中不饱和脂肪酸的结构产生保护,因而TG更高,热氧化稳定性更好。
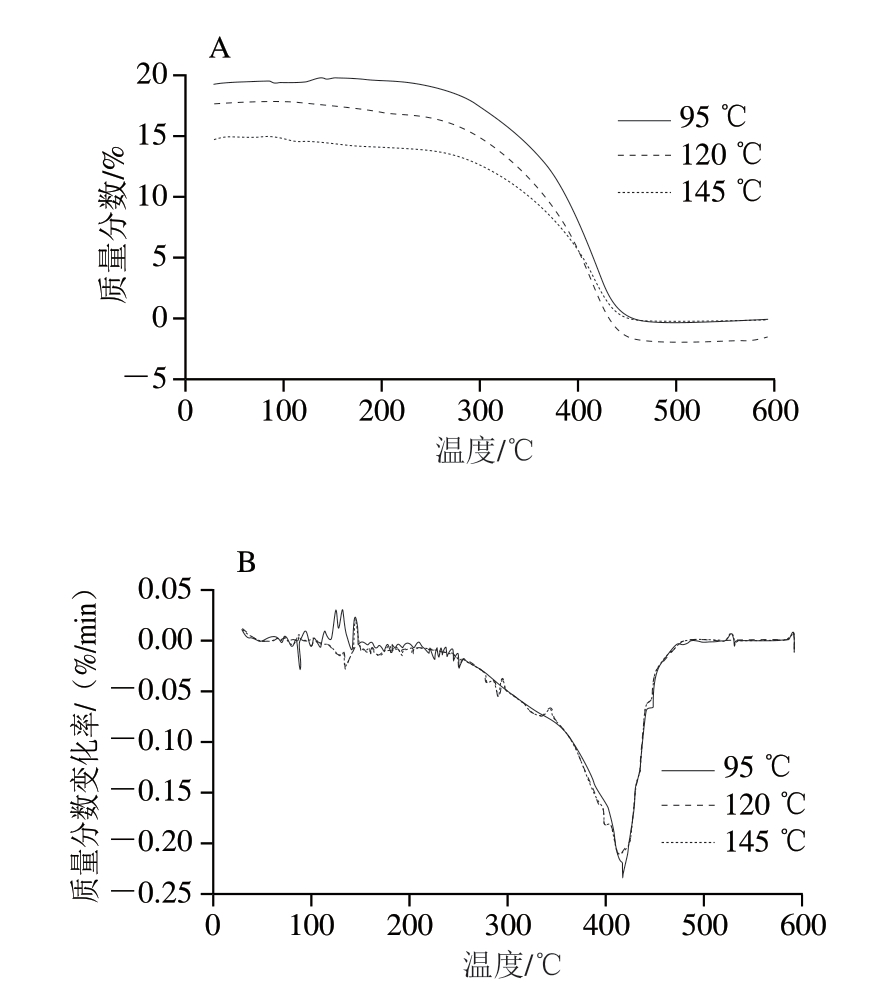
图5 不同加热温度下猪油DAG的TG(A)和DTG(B)曲线
Fig.5 TG (A) and DTG (B) curves of lard DAG at different temperatures
由图5B可知,145 ℃处理组DAG的微商热重(derivative thermogravimetry,DTG)曲线最大质量损失变化速率稍高于120、95 ℃处理组DAG,说明DAG中饱和脂肪酸含量和不饱和脂肪酸含量对热作用有一定影响[21],因此推测温度对DAG的热稳定性、流变特性、结晶及熔融特性的影响均与脂肪酸组成改变有关,本研究中上述指标也与此结论互相印证。Sun Xuelian等[35]研究4 种不同温度下亚麻籽油脂肪酸组成及理化指标时,将醛的形成与不饱和脂肪酸总量联系起来,并提到多不饱和脂肪酸是热氧反应的靶标这一说法。本研究也说明温度、脂肪酸组成特别是饱和度变化是影响DAG理化指标的重要原因。
2.6 不同加热温度下猪油DAG脂肪酸成分分析
热图分析是近年来广泛应用的一种统计方法,可以聚合大量数据,并将结果显示为渐变彩色带,以说明数据的密度和频率。蓝色越深,表示含量越高;红色越深,表示含量越低。
为更好地说明DAG特性差异受脂肪酸构成的影响,选用相同处理的猪油作为对照组,在3 种不同温度下从猪油DAG和对照组中共鉴别出13 种脂肪酸,其中饱和脂肪酸7 种、不饱和脂肪酸6 种,由图6可知,DAG与猪油的脂肪酸组成相似,主要为棕榈酸(C16:0)和硬脂酸(C18:0),此外DAG相较于猪油还含有大量的油酸甲酯(C18:1 n9c)和亚油酸甲酯(C18:2 n6c)。Sun Xuelian等[35]在研究加热对亚麻籽油品质指标的影响时发现,加热过程亚麻籽油的脂肪酸成分随着温度升高而不断变化,棕榈酸和硬脂酸含量上升,油酸和亚油酸含量降低,造成这种现象的原因是不饱和脂肪酸在高温下不稳定、易分解。本研究过程中随温度升高,棕榈酸和硬脂酸含量也呈现上升趋势,而油酸和亚油酸含量也在145 ℃时显著降低。
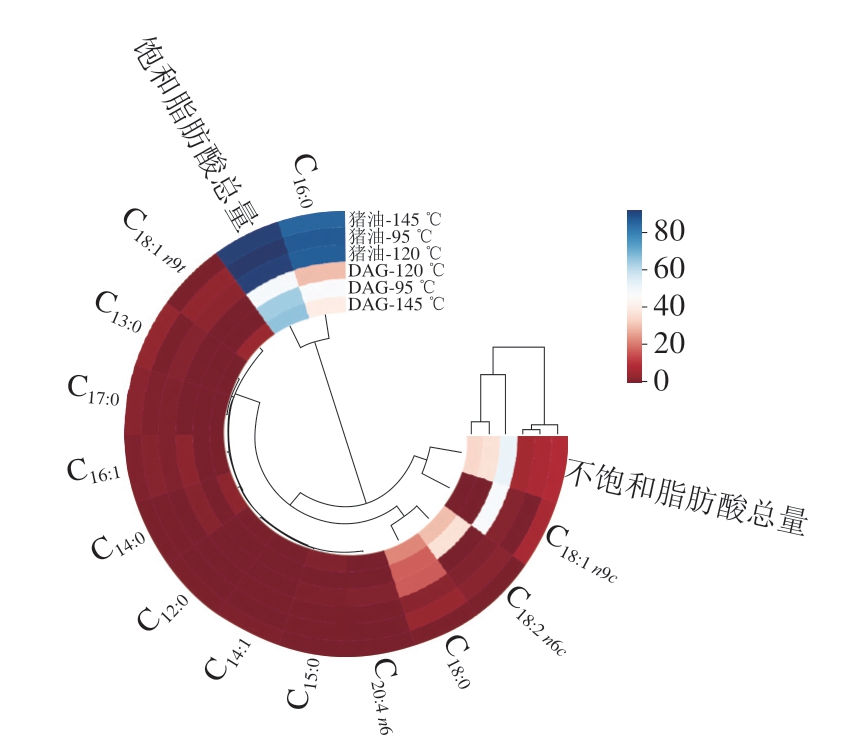
图6 不同加热温度下猪油DAG的脂肪酸组成
Fig.6 Fatty acid composition of lard DAG at different temperatures
DAG与猪油相比,饱和脂肪酸含量更低,不饱和脂肪酸含量更高,表明DAG更健康但也更容易发生氧化。而随着温度升高,DAG的不饱和脂肪酸含量先升高再降低,这可能是由于C16:0和C18:1 n9c等不饱和脂肪酸含量变化所导致,可见120 ℃对这2 种脂肪酸的增加有促进作用,并说明温度升高加快了DAG的不饱和脂肪酸氧化,降低了稳定性。万倪彤等[36]研究富含1,3-DAG猪脂肪的热稳定性时发现,温度升高,多不饱和脂肪酸含量逐渐下降,单不饱和脂肪酸含量在低于180 ℃时逐渐上升,在210 ℃加热达到最大值后开始降低,不饱和脂肪酸含量总体呈现下降趋势,与本研究所得结论相同。
2.7 不同加热温度下猪油DAG挥发性化合物分析
猪油DAG作为猪油的改性脂肪,要保留猪油特色风味才能从感官上被接受,因此同样选用相同处理的猪油作为对照组。由图7可知,3 种不同温度处理得到的猪油主要挥发性物质为烷烃类、醛类、醇类、酸类、酯类、酮类和烯类。95 ℃下猪油样品中共检出61 种挥发性化合物,其中烷烃类物质种类和含量最多。120、145 ℃处理组猪油样品中分别检出64、67 种挥发性化合物,均为醛类物质含量最高。DAG-95 ℃组检出58 种挥发性化合物,其中烃类10 种、醇类7 种、醛类10 种、酯类8 种、酸类6 种、烯类3 种、酮类8 种及其他类6 种,其中含量最高的醛类为壬醛(294.91 ng/g),其次为反-2-癸烯醛(267.73 ng/g);DAG-120 ℃组检出71 种挥发性化合物,包括烃类3 种、醇类9 种、醛类17 种、酯类13 种、酸类7 种、烯类7 种、酮类9 种及其他类6 种,其中含量最高的醛类为顺-2-庚烯醛(2 605.12 ng/g),其次为壬醛(530.03 ng/g)、己醛(255.68 ng/g);DAG-145 ℃组检出95 种挥发性化合物,包括烃类8 种、醇类15 种、醛类18 种、酯类16 种、酸类10 种、烯类8 种、酮类13 种及其他类7 种,其中含量最高的醛类为反-2-癸烯醛(2 513.48 ng/g)、壬醛(804.36 ng/g)。研究结果表明,随着温度上升,DAG和猪油的挥发性化合物种类均增多,DAG挥发性化合物种类呈现更明显的增长趋势,这是由于DAG对温度较为敏感,更容易受到氧化,从而使不饱和脂肪酸生成新物质。
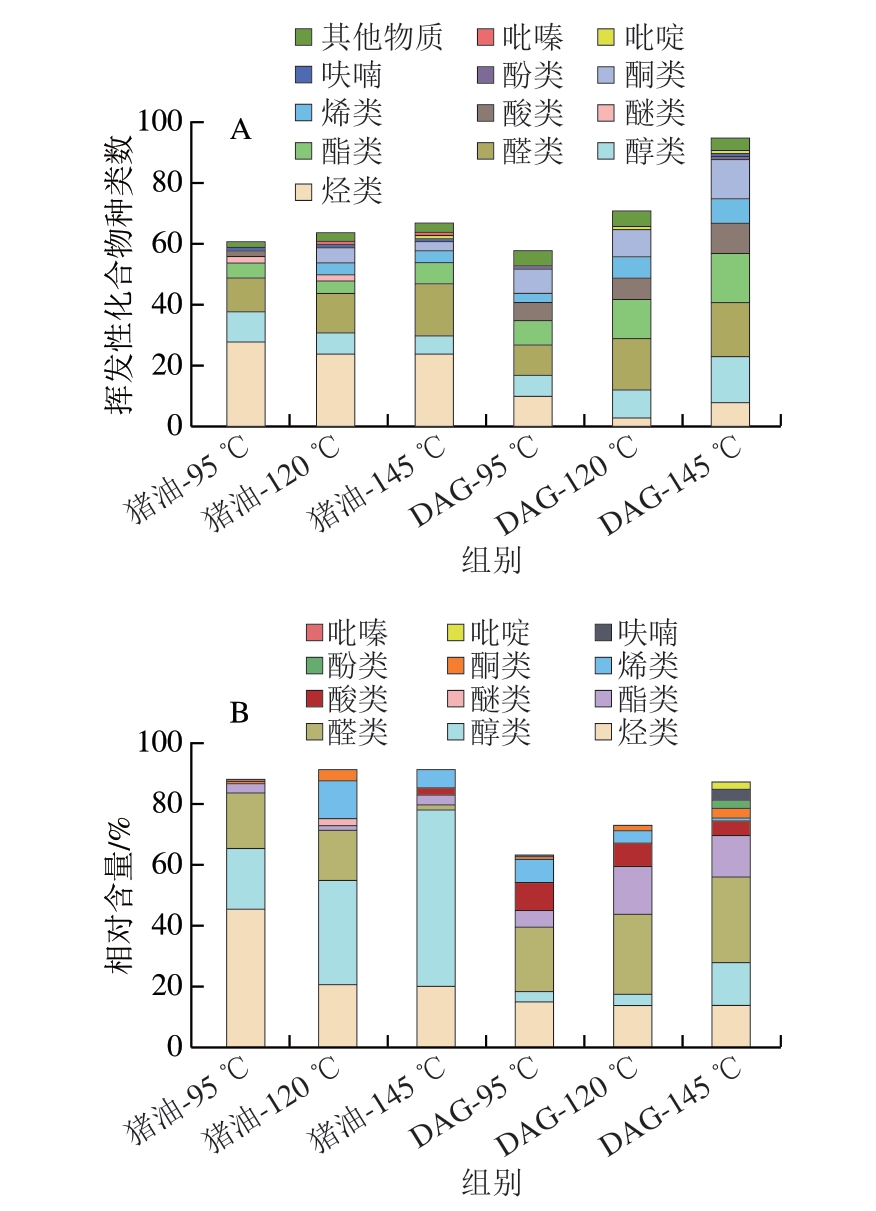
图7 不同加热温度下DAG的挥发性物质种类(A)和相对含量(B)
Fig.7 Types (A) and relative content (B) of volatile substances in DAG at different temperatures
DAG中的醛类、醇类、酯类、酸类、烯类物质种类均随温度上升而增多。其中,随着温度的上升,醛类物质的种类和相对含量均增加,这与吴肖等[37]研究温度调控对猪脂挥发性风味物质变化趋势时所得到醛类丰度随氧化温度的升高而增大这一结果相吻合。史亚静[15]、徐永霞[38]等研究发现,猪板油中含量较高的醛类是顺-2-庚烯醛、壬醛和己醛,而猪油DAG中也检测到了这3 种物质且在醛类中含量较高,证明DAG与猪油具有相似的呈味物质,猪油DAG作为一种健康的替代脂质也具有猪油的独特风味。而醛类物质由于阈值低,含量少量增加便可显著增强DAG香气;此外,另一类重要香气物质醇类也随着温度上升逐渐增多醇类物质可为DAG提供脂香味。醛、醇等香气物质增多是由于温度上升,油脂中的不饱和脂肪酸氧化,从而生成挥发性香气物质。Shahidi等[39]研究表明,多不饱和脂肪酸发生初级氧化后产物易分解生成次级产物产生异味,同时醛类化合物由于较低的气味阈值和较高的浓度,被认为是油脂风味形成的主要化合物。猪油DAG由于不饱和脂肪酸含量更高,因而风味受温度影响比猪油更加明显,并且随温度上升也产生了更多挥发性物质,带来良好脂肪风味的同时也产生一些有异味的物质(胺类和苯类等)。
3 结 论
通过将猪油DAG加热到不同温度,研究温度差异对DAG性质及风味物质的影响。结果表明:FTIR分析表明,加热改变了DAG的官能团结构;晶型分析显示,加热会使DAG由β’晶型向β晶型转化,这意味着随温度升高,DAG稳定性改变;挥发性成分分析表明,加热处理后DAG中醛类、醇类等香味物质的释放增多,随温度升高,DAG中醛类含量增加最为明显,且由于醛类阈值低,有利于促进DAG良好风味形成;流变学特性分析表明,随温度升高,DAG黏度降低;TG分析结果显示,随温度升高,DAG热稳定性降低;3 种加热温度下DAG脂肪酸组成及饱和度具有明显差异,脂肪酸结构会影响峰的确切位置和形状,因而DAG的FTIR光谱波动明显;晶型改变也会受到脂肪酸成分的影响,同时脂肪酸结构不同会形成不同的晶型。120 ℃是猪油DAG较适宜的热加工温度,此温度下加工的猪油DAG不仅产生良好的风味,同时没有被过度氧化,且各理化指标表现良好,因而无论从健康还是风味角度都更适合食用。此外,不同温度加热后的DAG在摄入人体后的消化特性差异有待进一步探索。
[1]XU T C, JIA M.Effect of 1,3-diacylglycerol on cardiometabolic risk[M]//LI D.Advances in dietary lipids and human health.Salt Lake City: Academic Press, 2022: 285-292.DOI:10.1016/B978-0-12-823914-8.00014-8.
[2]BAKALA-N’GOMA J C, COUËDELO L, VAYSSE C, et al.The digestion of diacylglycerol isomers by gastric and pancreatic lipases and its impact on the metabolic pathways for TAG re-synthesis in enterocytes[J].Biochimie, 2022, 203: 106-117.DOI:10.1016/j.biochi.2022.01.003.
[3]DIAO X Q, SUN W T, LIU D Y, et al.Impact of lard-based diacylglycerols on the quality and sensory characteristics of emulsiontype sausage[J].Czech Journal of Food Sciences, 2023, 41(3): 196-203.DOI:10.17221/111/2022-CJFS.
[4]URIARTE P S, GUILLÉN M D.Formation of toxic alkylbenzenes in edible oils submitted to frying temperature: influence of oil composition in main components and heating time[J].Food Research International, 2010, 43(8): 2161-2170.DOI:10.1016/j.foodres.2010.07.022.
[5]DIAO X Q, SUN W T, JIA R X, et al.Preparation and characterization of diacylglycerol via ultrasound-assisted enzymecatalyzed transesterification of lard with glycerol monolaurate[J].Ultrasonics Sonochemistry, 2023, 95: 106354.DOI:10.1016/j.ultsonch.2023.106354.
[6]CIFUENTES-COLLARI C, VALENZUELA-BÁEZ R,GUIL-GUERRERO J L, et al.Lipase-catalyzed synthesis of 1,3-diacylglycerols containing stearidonic, γ-linolenic and α-linolenic acids in a solvent-free system[J].LWT-Food Science and Technology,2022, 170: 114107.DOI:10.1016/j.lwt.2022.114107.
[7]DIAO X Q, GUAN H N, KONG B H, et al.Preparation of diacylglycerol from lard by enzymaticglycerolysis and its compositional characteristics[J].Korean Journal for Food Science of Animal Resources, 2017, 37(6): 813.DOI:10.5851/kosfa.2017.37.6.813.
[8]VLACHOS N, SKOPELITIS Y, PSAROUDAKI M, et al.Applications of Fourier transform-infrared spectroscopy to edible oils[J].Analytica Chimica Acta, 2006, 573: 459-465.DOI:10.1016/j.aca.2006.05.034.
[9]ZHENG L, ZHONG J F, LIU X, et al.Physicochemical properties and intermolecular interactions of a novel diacylglycerol oil oleogel made with ethyl cellulose as affected by γ-oryzanol[J].Food Hydrocolloids,2023, 138: 108484.DOI:10.1016/j.foodhyd.2023.108484.
[10]LIU M M, FU J F, TENG Y L, et al.Fast production of diacylglycerol in a solvent free system via lipase catalyzed esterification using a bubble column reactor[J].Journal of the American Oil Chemists’Society, 2016, 93(5): 637-648.DOI:10.1007/s11746-016-2804-y.
[11]TAVERNIER I, NORTON I T, RIMAUX T, et al.Effect of high cooling and shear rate on the microstructural development of hybrid systems containing diacylglycerols and triacylglycerols of palm origin[J].Journal of Food Engineering, 2019, 246: 141-152.DOI:10.1016/j.jfoodeng.2018.11.009.
[12]孙迪.不同脂肪对肌原纤维蛋白乳化液稳定性及肉糜凝胶特性的影响[D].锦州: 渤海大学, 2019: 9-17.
[13]HOBUSS C B, SILVA F, SANTOS M, et al.Synthesis and characterization of monoacylglycerols through glycerolysis of ethyl esters derived from linseed oil by green processes[J].RSC Advances,2020, 10(4): 2327-2336.DOI:10.1039/c9ra07834g.
[14]LI G H, CHEN J Z, MA X, et al.Enzymatic preparation and facile purification of medium-chain, and medium- and long-chain fatty acid diacylglycerols[J].LWT-Food Science and Technology, 2018, 92:227-233.DOI:10.1016/j.lwt.2018.02.032.
[15]史亚静, 葛柳凤.不同制作工艺对猪油理化与风味品质的影响[J].肉类研究, 2020, 34(4): 40-45.DOI:10.7506/rlyj1001-8123-20191231-315.
[16]MENG X, YIN C, YUAN L, et al.Rapid detection of adulteration of olive oil with soybean oil combined with chemometrics by Fourier transform infrared, visible-near-infrared and excitation-emission matrix fluorescence spectroscopy: a comparative study[J].Food Chemistry, 2023, 405: 134828.DOI:10.1016/j.foodchem.2022.134828.
[17]GUMEL A M, ANNUAR M S M, CHISTI Y.Lipase catalyzed ultrasonic synthesis of poly-4-hydroxybutyrate-co-6-hydroxyhexanoate[J].Ultrasonics Sonochemistry, 2013, 20(3): 937-947.DOI:10.1016/j.ultsonch.2012.09.015.
[18]AKTAS A B, TEMUR G N, OKCU B N.Fourier transform infrared spectroscopy and chemometrics for chemical property prediction of chemically interesterified lipids with butterfat and vegetable oils during storage[J].Journal of Molecular Structure, 2023, 1274: 134503.DOI:10.1016/j.molstruc.2022.134503.
[19]EMBABY H E, MIYAKAWA T, HACHIMURA S, et al.Crystallization and melting properties studied by DSC and FTIR spectroscopy of goldenberry (Physalis peruviana) oil[J].Food Chemistry, 2022, 366:130645.DOI:10.1016/j.foodchem.2021.130645.
[20]HAN J X, SUN R X, ZENG X Y, et al.Rapid classification and quantification of camellia (Camellia oleifera Abel.) oil blended with rapeseed oil using FTIR-ATR spectroscopy[J].Molecules, 2020, 25(9):2036.DOI:10.3390/molecules25092036.
[21]CEBI N, YILMAZ M T, SAGDIC O, et al.Prediction of peroxide value in omega-3 rich microalgae oil by ATR-FTIR spectroscopy combined with chemometrics[J].Food Chemistry, 2017, 225: 188-196.DOI:10.1016/j.foodchem.2017.01.013.
[22]DONG X B, LI Q H, SUN D J, et al.Direct FTIR analysis of free fatty acids in edible oils using disposable polyethylene films[J].Food Analytical Methods, 2015, 8: 857-863.DOI:10.1007/s12161-014-9963-y.
[23]刘翠玲, 周子彦, 李天瑞, 等.迁移学习在食用油光谱模型转移中的应用[J].食品科学技术学报, 2019, 37(4): 95-102.DOI:10.3969/j.issn.2095-6002.2019.04.014.
[24]朱向菊, 裘爱泳.脂肪同质多晶及其研究方法[J].粮食与油脂,2004(12): 10-12.DOI:10.3969/j.issn.1008-9578.2004.12.003.
[25]LIU X, XU W L, WANG W F, et al.Physicochemical properties and feasibility of coconut oil-based diacylglycerol as an alternative fat for healthy non-dairy creamer[J].Food Chemistry: X, 2023, 19: 100749.DOI:10.1016/j.fochx.2023.100749.
[26]LI Z W, LEE Y Y, WANG Y, et al.Interfacial behavior, gelation and foaming properties of diacyglycerols with different acyl chain lengths and isomer ratios[J].Food Chemistry, 2023, 427: 136696.DOI:10.1016/j.foodchem.2023.136696.
[27]李琳, 万力婷, 李冰.塑性脂肪起砂及其控制[J].食品科学技术学报,2016, 34(2): 1-11.DOI:10.3969/j.issn.2095-6002.2016.02.001.
[28]SILVA R C, SOARES F A S D M, MARUYAMA J M, et al.Effect of diacylglycerol addition on crystallization properties of pure triacylglycerols[J].Food Research International, 2014, 55: 436-444.DOI:10.1016/j.foodres.2013.11.037.
[29]CHAI X H, MENG Z, LIU Y F.Crystallization behavior and nanomicro structure of lauric acid-rich fats with and without indigenous diglycerides[J].Food Chemistry, 2021, 365: 130458.DOI:10.1016/j.foodchem.2021.130458.
[30]MIKLOS R, ZHANG H, LAMETSCH R, et al.Physicochemical properties of lard-based diacylglycerols in blends with lard[J].Food Chemistry, 2013, 138(1): 608-614.DOI:10.1016/j.foodchem.2012.10.070.
[31]成实, 王欣, 刘宝林.碳链长度及不饱合度对脂肪酸低场核磁弛豫特性的影响[J].分析化学, 2018, 46(2): 281-287.DOI:10.11895/j.issn.0253-3820.171056.
[32]苏洪凯, 赵俊廷.温度对植物油黏度和密度的影响研究[J].粮食与食品工业, 2018, 25(2): 29-32.DOI:10.3969/j.issn.1672-5026.2018.02.008.
[33]TAVERNIER I, MOENS K, HEYMAN B, et al.Relating crystallization behavior of monoacylglycerols-diacylglycerol mixtures to the strength of their crystalline network in oil[J].Food Research International, 2019, 120: 504-513.DOI:10.1016/j.foodres.2018.10.092.
[34]HUANG Y, LIU W X, LUO X L, et al.Synthesis and characterization of medium-and long-chain structural lipid rich in α-linolenic acid and lauric acid[J].Food Bioscience, 2023, 52: 102363.DOI:10.1016/j.fbio.2023.102363.
[35]SUN X L, WANG Y J, LI H K, et al.Changes in the volatile profile, fatty acid composition and oxidative stability of flaxseed oil during heating at different temperatures[J].LWT-Food Science and Technology, 2021, 151: 112137.DOI:10.1016/j.lwt.2021.112137.
[36]万倪彤, 王志耕, 梅林, 等.富含1,3-DAG猪脂肪的热稳定性分析[J].食品与发酵工业, 2018, 44(6): 67-75.DOI:10.13995/j.cnki.11-1802/ts.015628.
[37]吴肖, 孔令会.不同温度调控氧化猪脂挥发性风味物质分析[J].中国调味品, 2012, 37(8): 90-92.DOI:10.3969/j.issn.1000-9973.2012.08.024.
[38]徐永霞, 陈清婵, 潘思秩, 等.不同来源猪脂挥发性成分比较研究[J].食品科学, 2010, 31(8): 177-180.
[39]SHAHIDI F, HOSSAIN A.Role of lipids in food flavor generation[J].Molecules, 2022, 27(15): 5014.DOI:10.3390/molecules27155014.