肌原纤维蛋白(myofibrillar protein,MP)在鱼类肌肉蛋白中的含量为60%~80%,其结构和功能性质决定了鱼糜制品的品质。MP是盐溶性蛋白,可以溶于较高离子强度溶液中,在低离子强度溶液中的溶解度和稳定性较差[1]。在食品工业中,肉制品通常会添加2%~3%的盐,以提供足够的蛋白质溶解度,获得良好的质地并增强风味。然而,人体摄入过量食盐可能会出现高血压和心血管病等健康问题[2]。近年来,为减少加工食品中的盐分,并弥补低盐对肉制品加工带来的不利影响,对蛋白质定向修饰以改善其功能性质的研究日益受到关注。研究表明,通过使用微波[3]、超声波[4]、超高压[5]、糖基化[6]和磷酸化[7]等方法均可以显著提升低盐肉制品的品质。
磷酸盐可以对蛋白质分子进行磷酸化,磷酸根离子和MP相互作用导致肌动球蛋白解离,改善蛋白质的功能和凝胶特性[8]。焦磷酸钠(tetrasodium pyrophosphate,TSPP)、三聚磷酸钠(sodium tripolyphosphate,STPP)和六偏磷酸钠(sodium hexametaphosphate,SHMP)是肉制品加工中常用的品质改良剂[9]。蛋白质磷酸化是蛋白质翻译后修饰的技术手段之一,能够改变蛋白质的功能特性,如溶解性、乳化性和凝胶性等[10]。戚亭等[11]研究发现,使用STPP磷酸化能够明显改善南极磷虾蛋白的溶解性、吸油性和乳化性。周景丽等[12]采用STPP对虾蛄盐溶蛋白进行磷酸化修饰,能够显著改善虾蛄盐溶性蛋白的功能性质。Cen Shijie等[13]研究发现,TSPP磷酸化能够增加鱼明胶的静电斥力,显著改善鱼明胶的凝胶性能、乳化性能和表观黏度。Zhu Yajun等[14]研究发现,当STPP的添加量为0.6%(m/m)时,蛋白质的磷酸化程度最高,鱼糜蟹肉混合凝胶的凝胶性能最佳。Kaewruang等[15]发现,在pH 9时使用0.25% STPP磷酸化明胶具有最佳的凝胶强度和致密的网状结构。
随着日益增长的低盐饮食健康需求,鱼糜制品中钠盐含量较高的问题受到广泛关注。目前,关于低盐条件下的磷酸盐种类对磷酸化修饰白鲢鱼MP的结构和功能特性研究不足。因此,本研究采用3 种不同的磷酸盐(TSPP、STPP和SHMP)对白鲢鱼MP进行磷酸化修饰,并对MP磷酸化程度进行表征,分析磷酸化MP的溶解度、表面疏水性、乳化特性、微观结构和热稳定性等的变化。旨在提供一种化学磷酸化方法用于改善低盐状态下MP的理化性质,为低盐肉制品的高品质开发提供理论基础。
1 材料与方法
1.1 材料与试剂
白鲢鱼(体质量约2 kg/条) 合肥二十里埠菜市场。
TSPP、STPP、SHMP、1 mol/L Tris-HCl缓冲液(pH 7.4) 北京索莱宝科技有限公司;Bradford蛋白浓度测定试剂盒 上海碧云天生物技术有限公司;Pro-Q Diamond染色剂、Sypro Ruby染色剂 美国Invitrogen有限公司。以上试剂均为分析纯。
1.2 仪器与设备
GL-21M冷冻离心机 湖南湘仪实验室仪器开发有限公司;IKA T8均质机 德国IKA公司;EPOCH酶标仪 美国BioTek Instruments公司;PowerPac Basic电泳仪 美国Bio-Rad公司;Nicolet傅里叶变换红外光谱仪 美国PerkinElmer公司;Amersham Typhoon NIR近红外荧光扫描成像仪 美国GE公司;Dimension Icon原子力显微镜(atomic force microscope,AFM) 德国Bruker公司;TG209F1热重(thermogravimetric,TG)分析仪 德国Netzsch公司。
1.3 方法
1.3.1 MP提取
参照Wang Qian等[16]的方法提取MP并稍作修改。采集新鲜白鲢肉并搅碎,加入4 倍体积的低盐缓冲液(含0.05 mol/L NaCl、20 mmol/L Tris-HCl,pH 7.4),然后在4 500 r/min下离心15 min后弃上清液。重复3 次上述步骤后收集沉淀物,在4 ℃用4 倍体积的高盐缓冲液(含0.6 mol/L NaCl、20 mmol/L Tris-HCl,pH 7.4)溶解,放置4 h后在4 500 r/min下离心15 min。收集上清液后用10 倍体积超纯水沉淀30 min,然后在8 000 r/min下离心20 min,所得沉淀即为MP。MP保存在4 ℃冰箱并在48 h内使用,以上所有步骤均在4 ℃下进行。采用Bradford法测定蛋白质量浓度。
1.3.2 磷酸化MP制备
用pH 7.4、20 mmol/L Tris-HCl缓冲液将MP稀释为10 mg/mL,MP溶液中分别添加TSPP、STPP、SHMP(0.1、0.2、0.3、0.4、0.5 g/100 mL)和NaCl,具体添加量如表1所示。对照组不添加磷酸盐,仅添加1 g/100 mL NaCl,确保所有处理组的Na+浓度均为0.171 mol/L,以消除Na+对MP的影响,然后在4 ℃下磷酸化反应2 h。2、3 g/100 mL NaCl组不添加磷酸盐(Na+浓度分别为0.342、0.513 mol/L),用于表征磷酸化MP的功能特性变化。
表1 各组MP悬浮液NaCl和磷酸盐添加量
Table 1 Addition levels of NaCl and phosphate in each group of MP suspension
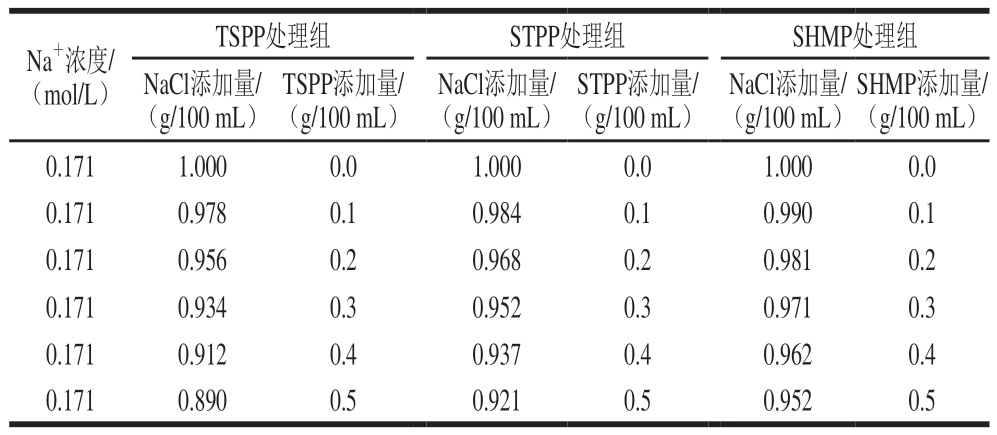
Na+浓度/(mol/L)TSPP处理组STPP处理组SHMP处理组NaCl添加量/(g/100 mL)SHMP添加量/(g/100 mL)0.1711.0000.01.0000.01.0000.0 0.1710.9780.10.9840.10.9900.1 0.1710.9560.20.9680.20.9810.2 0.1710.9340.30.9520.30.9710.3 0.1710.9120.40.9370.40.9620.4 0.1710.8900.50.9210.50.9520.5 TSPP添加量/(g/100 mL)NaCl添加量/(g/100 mL)STPP添加量/(g/100 mL)NaCl添加量/(g/100 mL)
1.3.3 溶解度测定
将MP分散液在4 ℃、8 000×g条件下离心15 min,使用Bradford法测定上清液和原始MP分散液中的蛋白质量浓度。蛋白质溶解度按式(1)计算。
式中:ρ1为上清液蛋白质量浓度/(mg/mL);ρ2为初始分散液蛋白质量浓度/(mg/mL)。
1.3.4 pH值测定
使用pH计测定MP分散液的pH值。
1.3.5 表面疏水性测定
参考王子凌等[17]的方法并稍作修改。将200 μL 1 mg/mL溴酚蓝(bromophenol blue,BPB)加入1 mL MP分散液(5 mg/mL)中,室温避光静置20 min,然后4 000×g离心15 min。取上清液稀释10 倍,在595 nm波长处测定上清液的吸光度。使用pH 7.4、20 mmol/L Tris-HCl缓冲液作为空白对照。表面疏水性用BPB结合量表示,按式(2)计算。
式中:A1为对照组离心后上清液的吸光度;A2为样品离心后上清液的吸光度。
1.3.6 乳化性测定
参考马婕等[18]的方法并稍作修改。取16 mL MP分散液(用20 mmol/L Tris-HCl稀释至2 mg/mL)和4 mL大豆油加入离心管中,在10 000 r/min下匀浆2 min,然后立即从离心管底部吸取50 μL乳液于5 mL 0.1 g/100 mL十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液中,混匀后在500 nm波长处测定吸光度(A0)。10 min后从离心管底部另取50 μL乳液并加入5 mL 0.1 g/100 mL SDS溶液,混匀后在500 nm波长处测定吸光度(A10)。以0.1 g/100 mL SDS溶液进行调零。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)按式(2)~(3)计算。
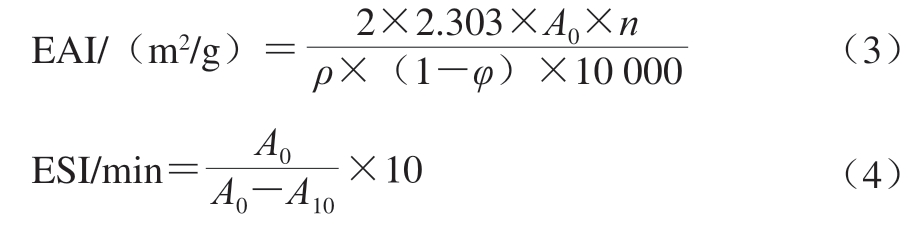
式中:n为稀释倍数;ρ为蛋白质量浓度/(g/mL);φ为油相体积分数/%。
1.3.7 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)与荧光染色
参考方芮等[19]的方法并稍作修改。将MP分散液与5×上样缓冲液按照体积比4∶1混合,沸水浴加热5 min,冷却后离心(12 000×g、3 min),取上清液上样(MP上样量为8 μg)。电泳电压为80 V,直至条带距底部0.5 cm处时结束电泳。电泳结束后,使用固定液(含体积分数50%甲醇、体积分数10%乙酸)固定12 h,结束后用蒸馏水洗胶3 次,每次10 min,用Pro-Q Diamond染液避光染色1.5 h后,避光使用脱色液(含体积分数20%乙腈、50 mmol/L乙酸钠)脱色1 h,然后避光条件下用蒸馏水洗胶4 次,每次5 min。用近红外荧光扫描成像仪进行荧光拍照,参数设置为:激发波长532 nm,发射波长580 nm,电压500 V。
随后使用Sypro Ruby染液避光染色14 h,避光条件下使用脱色液(含体积分数40%甲醇、体积分数7%冰乙酸)脱色1 h,结束后用蒸馏水洗胶3 次,每次10 min。再次使用近红外荧光扫描成像仪进行荧光拍照,参数设置为:激发波长532 nm,发射波长610 nm,电压470 V。
1.3.8 傅里叶变换红外光谱分析
将磷酸化后的MP分散液冷冻干燥后研磨成粉末,使用傅里叶变换红外光谱仪在4 000~650 cm-1范围内测试,分辨率为4 cm-1,扫描4 次。使用PeakFit 4.12软件计算蛋白质二级结构相对含量。
1.3.9 TG分析
将冷冻干燥后的MP放入样品盘中,升温速率为10 ℃/min,升温范围30~600 ℃,氮气作为冷却气体,流速50 mL/min。使用TG分析仪对样品进行TG分析。
1.3.10 AFM观察
参考Mills等[20]的方法并稍作修改。吸取5 μL MP分散液(1 mg/mL)滴在云母片上,室温静置2 min后用超纯水冲洗2 次以去除盐离子,然后用洗耳球吹干云母片表面水分。使用ScanAsyst-Air智能模式成像,扫描面积为2.0 μm×2.0 μm。使用Nanoscope Analysis V1.10软件分析AFM图像。
1.4 数据处理
所有实验均至少重复3 次,数据均以平均值±标准差表示。采用SPSS 22.0软件进行单因素方差分析,当P<0.05时,差异显著,当P>0.05时,差异不显著。
2 结果与分析
2.1 MP的溶解度和pH值分析
如图1所示,1 g/100 mL NaCl组具有最低的溶解度(7.81%),磷酸化改性均能不同程度提高蛋白质的溶解性。随着磷酸化水平的增加,STPP处理组的溶解度显著提升,并且0.2~0.5 g/100 mL STPP处理组的溶解度均显著高于添加2 g/100 mL NaCl组(35.86%)和3 g/100 mL NaCl组(62.81%),0.4 g/100 mL STPP组具有最高的MP溶解度(87.14%)。
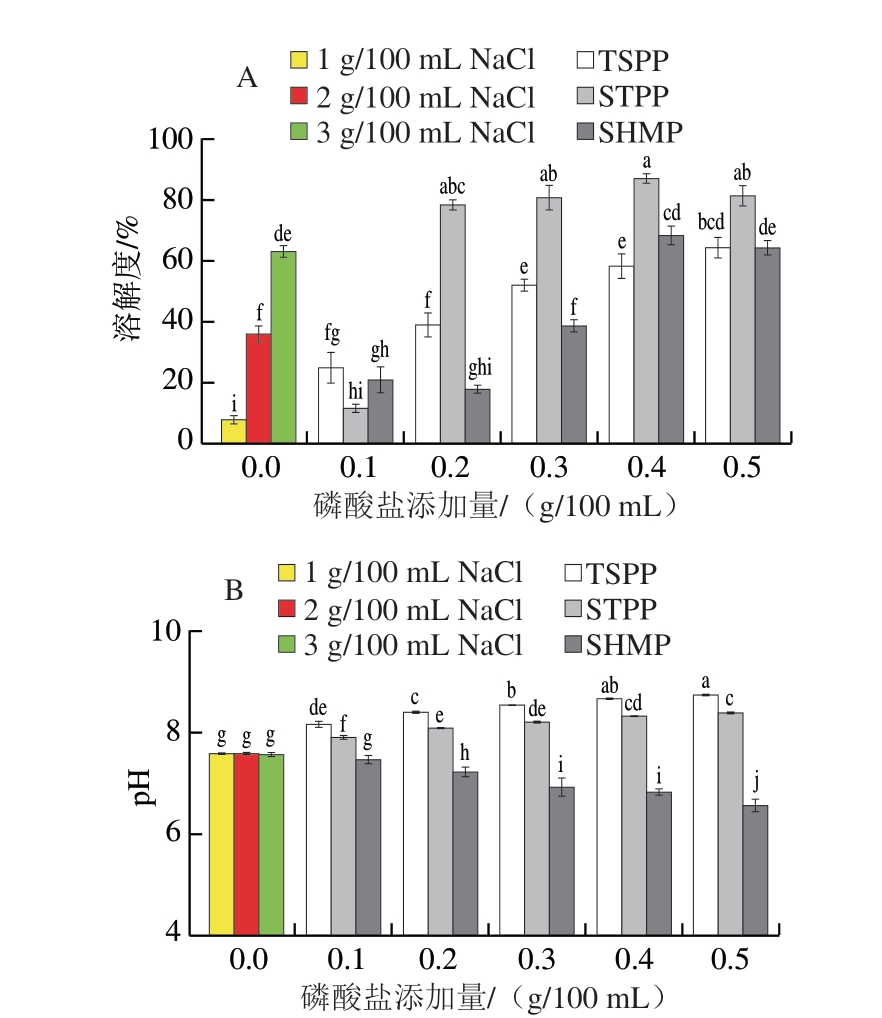
图1 磷酸盐添加量与种类对MP溶解度(A)和pH值(B)的影响
Fig.1 Effects of type and concentration of phosphate on the solubility (A) and pH value (B) of MP
小写字母不同表示差异显著(P<0.05)。下同。
经过TSPP和STPP磷酸化后的蛋白质溶液pH值向碱性偏移,分别为8.14~8.77和7.89~8.40,而SHMP磷酸化后的pH值则向酸性偏移(7.53~6.66),这也导致磷酸盐修饰MP后的溶解度差异[21]。值得注意的是,TSPP和STPP组的pH值较为接近,但溶解度却有显著差异,这可能与磷酸盐的分子结构有关[22]。虽然SHMP修饰的蛋白质溶液pH值呈弱酸性,但在0.5 g/100 mL SHMP处理组与TSPP处理组溶解度无显著差异(P>0.05),分别为64.34%和64.07%。随着MP磷酸化水平的增加,部分磷酸基团附着在蛋白质侧链上,与水分子形成大量氢键;同时磷酸基团增强了蛋白质之间的静电斥力,从而促进蛋白质在溶液中分散[23]。结果表明,0.2~0.5 g/100 mL STPP修饰的MP溶解度优于TSPP和SHMP处理组。
2.2 MP的表面疏水性分析
如图2所示,1、2、3 g/100 mL NaCl组MP的BPB结合量分别为32.43、35.28、39.13 μg,MP的表面疏水性随着NaCl添加量的增加而增加[24],并且3 种磷酸盐均不同程度增强了MP的表面疏水性。随着磷酸化水平的增加,TSPP组的MP表面疏水性逐渐降低,而STPP和SHMP组的表面疏水性呈现增加趋势,且0.4~0.5 g/100 mL STPP更有利于疏水基团的暴露[25]。
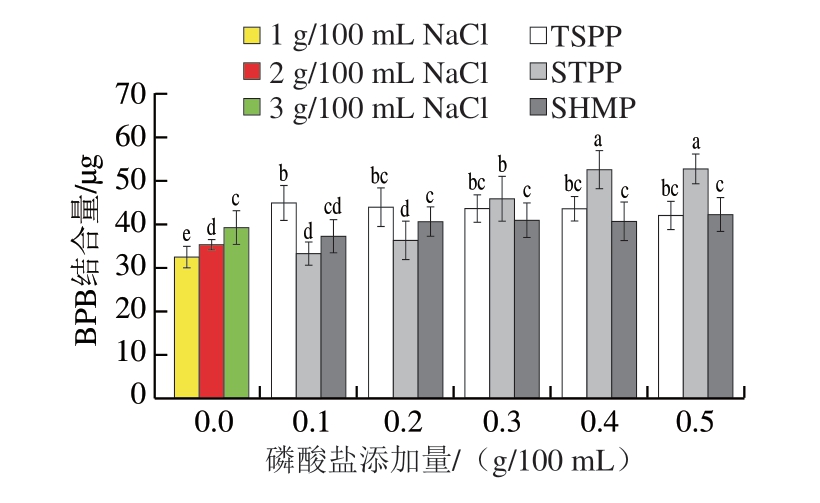
图2 磷酸盐添加量与种类对MP表面疏水性的影响
Fig.2 Effects of type and concentration of phosphate on the surface hydrophobicity of MP
当磷酸盐添加量大于0.3 g/100 mL时,STPP组的表面疏水性显著高于TSPP和SHMP组(P<0.05),且当添加0.5 g/100 mL STPP时,MP的表面疏水性达到最大,为52.73 μg。结果表明,高添加量的STPP更容易引起蛋白质构象变化,使蛋白质分子内部的疏水基团暴露于亲水环境中,从而提高MP的表面疏水性[26]。
2.3 MP的乳化性分析
如图3所示,与未磷酸化处理的MP相比,磷酸化MP的EAI和ESI普遍呈现出随着磷酸盐添加量增加而逐渐增加的趋势,TSPP、STPP和SHMP组的EAI均在0.5 g/100 mL添加量下达到最大值,分别为47.09、53.09、43.13 m2/g,表明磷酸化水平较高的MP能够更快地吸附到油滴表面。
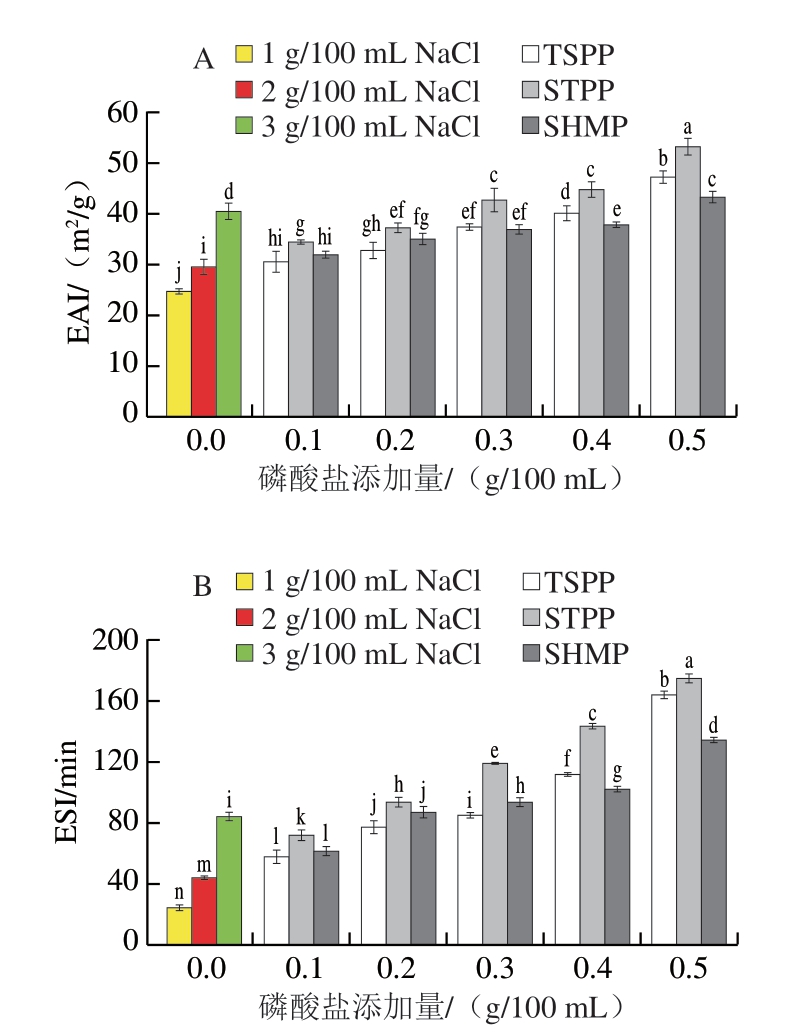
图3 磷酸盐添加量与种类对MP的EAI(A)和ESI(B)的影响
Fig.3 Effects of type and concentration of phosphate on the EAI (A)and ESI (B) of MP
磷酸化MP具有比1 g/100 mL NaCl组更高的ESI,表明磷酸化MP溶解度的提升对乳液的稳定性起重要作用。这是因为随着MP磷酸化水平的升高,MP携带更多的负电荷,静电斥力增加,促进乳化过程中的蛋白质在油-水界面上的重新排列和扩散,从而有助于MP乳化性能的提升[27]。此外,蛋白质的表面疏水性对乳化性起到重要作用,磷酸化MP具有较高的表面疏水性,可以达到更好的亲水亲油平衡,从而促进MP乳化性能的提升[28]。
2.4 MP的SDS-PAGE与磷酸化程度分析
使用Pro-Q Diamond染料染色后,MP中磷酸化蛋白条带如图4A所示,可以清晰观察到4 个蛋白质条带,包括肌球蛋白重链(myosin heavy chain,MHC,220 kDa)、肌动蛋白(actin,AC,43 kDa)、原肌球蛋白(tropomyosin,TM,35 kDa)和肌球蛋白轻链(myosin light chain,MLC,20~25 kDa)。如图4B所示,使用SYPRO Ruby染料染色后可以清晰地观察到MP全蛋白条带。计算磷蛋白条带的光密度值(P)与总蛋白条带的光密度值(T),该条带的光密度值比(P/T)可以表示蛋白质的磷酸化水平[29]。
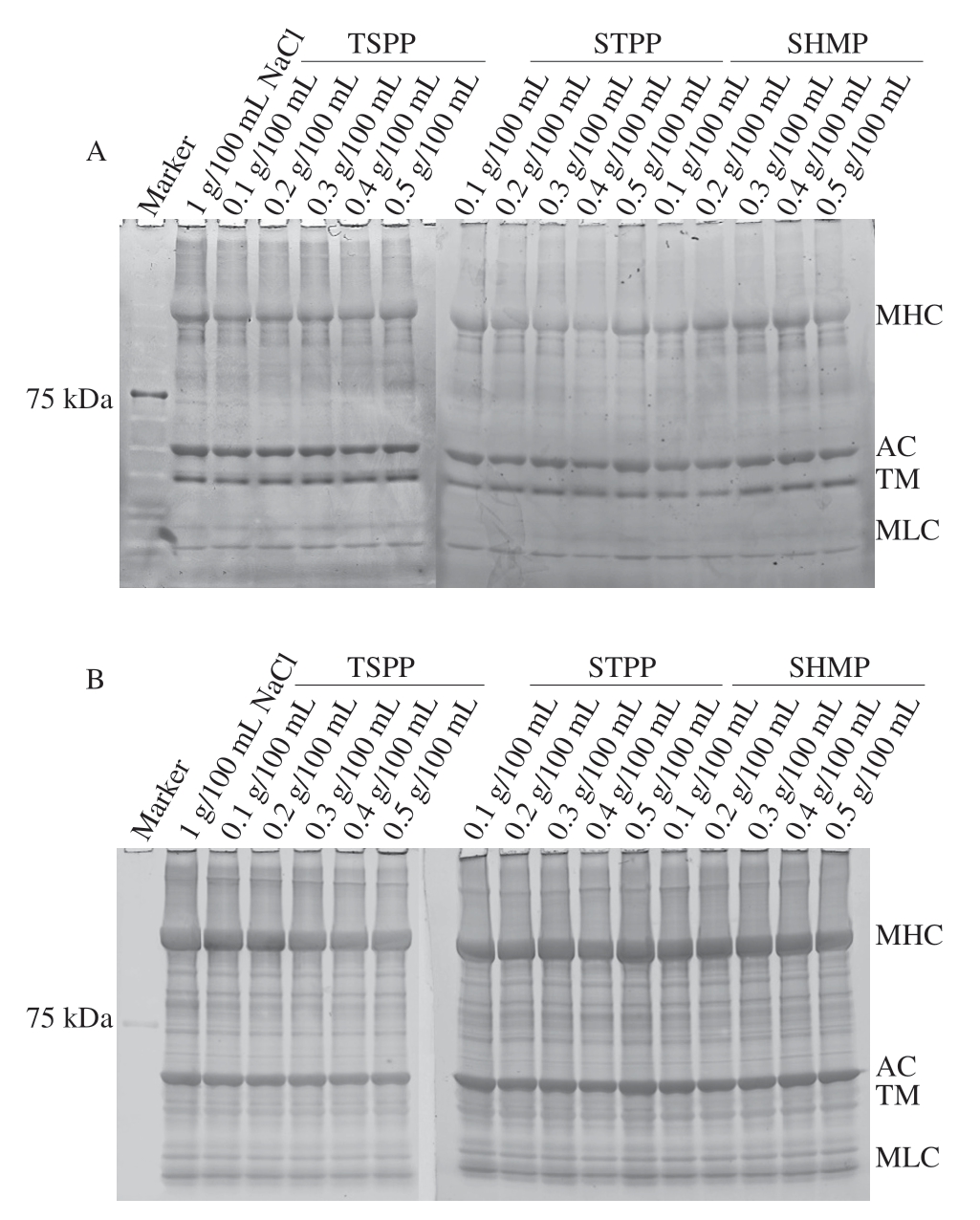
图4 磷酸化MP(A)和肌原纤维全蛋白(B)SDS-PAGE图谱
Fig.4 SDS-PAGE patterns of phosphorylated MP (A) and total MP (B)
采用MP所有条带P/T之和表示MP的总体磷酸化水平。如表2所示,在STPP和SHMP处理组中,蛋白质整体磷酸化水平呈现先上升后下降的趋势。所有处理组的总体磷酸化水平均在0.4 g/100 mL添加量下达到最大,TSPP、STPP和SHMP处理组分别为2.46±0.02、3.29±0.03和3.27±0.04。这些结果表明,随着磷酸盐添加量的增加,MP中引入了更多带负电的磷酸基团。STPP和SHMP对MP的磷酸化程度影响较大,这可能是因为磷酸盐的添加使得磷酸基团与MP特定反应位点的碰撞增加,从而增加MP的磷酸化水平,尚坤等[30]研究多聚磷酸盐磷酸化虾蛄MP的最佳工艺条件中也得到了类似的结果。
表2 3 种磷酸盐对MP整体磷酸化水平的影响
Table 2 Effects of three phosphates on the overall phosphorylation level of MP
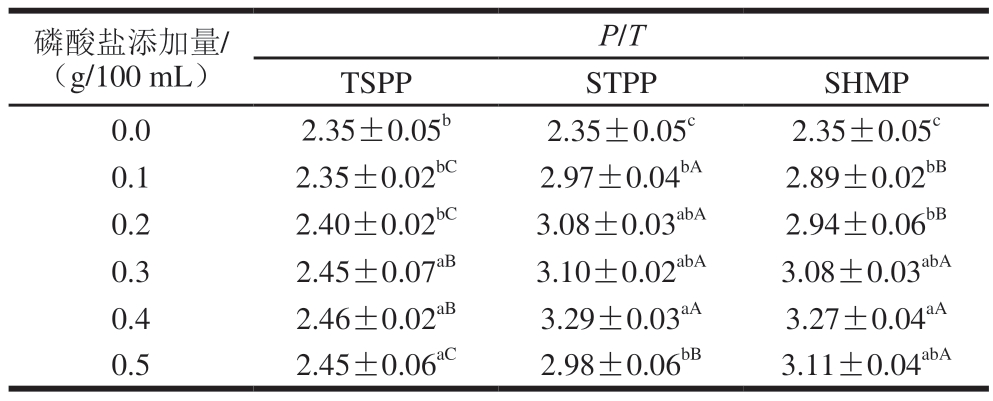
注:同列小写字母不同表示同种磷酸盐不同添加量间差异显著(P<0.05);同行大写字母不同表示同一添加量不同磷酸盐间差异显著(P<0.05)。下同。
P/T TSPPSTPPSHMP 0.02.35±0.05b2.35±0.05c2.35±0.05c 0.12.35±0.02bC2.97±0.04bA2.89±0.02bB 0.22.40±0.02bC3.08±0.03abA2.94±0.06bB 0.32.45±0.07aB3.10±0.02abA3.08±0.03abA 0.42.46±0.02aB3.29±0.03aA3.27±0.04aA 0.52.45±0.06aC2.98±0.06bB3.11±0.04abA磷酸盐添加量/(g/100 mL)
2.5 MP的傅里叶变换红外光谱分析
如图5所示,与1 g/100 mL NaCl组对比,磷酸化MP中出现磷酸基团的特征吸收峰,例如,TSPP组在899 cm-1处的峰,STPP组在890、967 cm-1处的峰和SHMP在877 cm-1处的峰,这些峰被认为归属于P—O伸缩振动[31];TSPP组在1 122 cm-1处的峰,STPP组在1 123、1 224 cm-1处的峰和SHMP组在1 260 cm-1处的峰被认为是由于P=O伸缩振动[32]。Hu Yangyang等[33]研究表明,—OH和—NH2在中性或碱性条件下表现出较高的活性,由此推断磷酸化MP可能形成C—N—P键或C—O—P键。
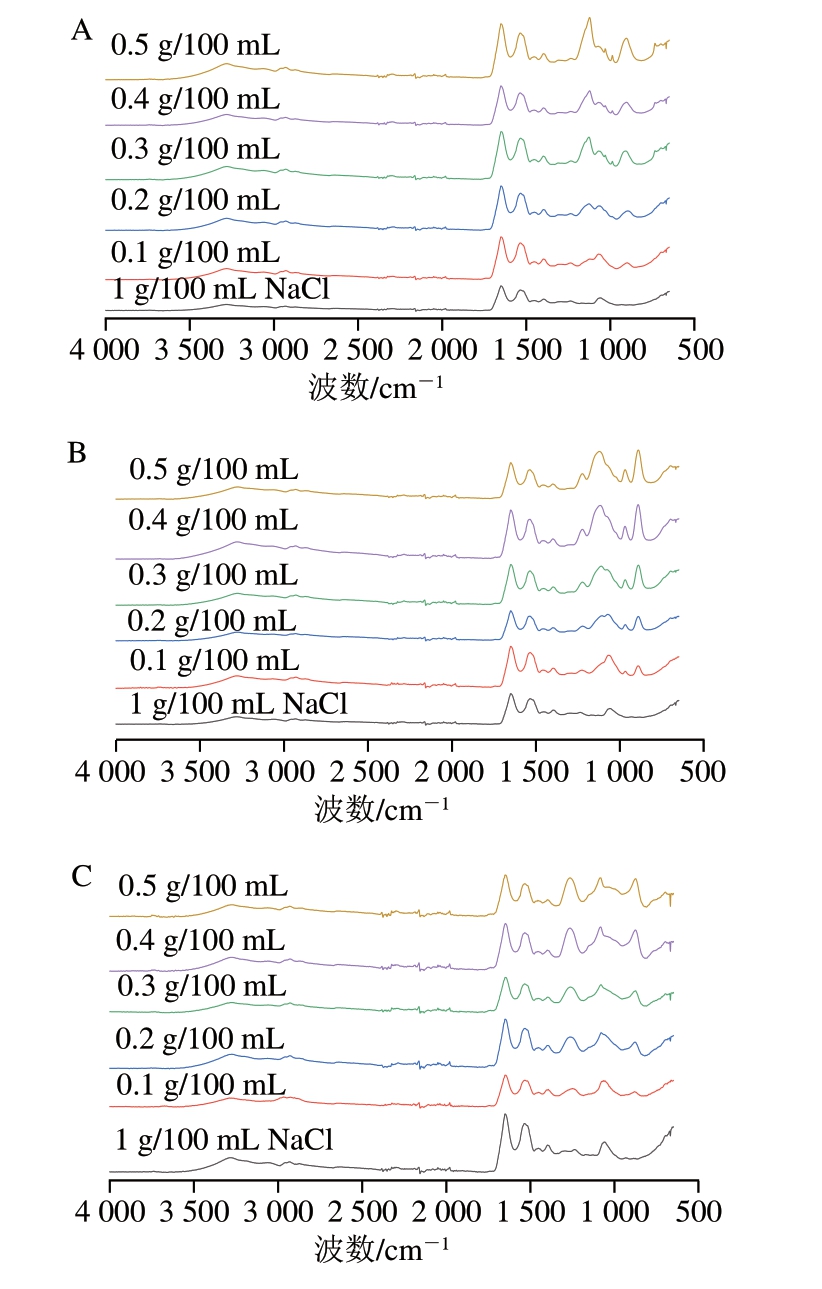
图5 磷酸盐添加量与种类对MP傅里叶变换红外光谱的影响
Fig.5 Effects of type and concentration of phosphate on the Fourier transform infrared spectrum of MP
A.TSPP;B.STPP;C.SHMP。
由表3~5可知,与1 g/100 mL NaCl组相比,磷酸化改性MP的β-折叠相对含量均显著增加(P<0.05),TSPP和STPP组α-螺旋相对含量显著下降(P<0.05),尤其是STPP组。随着磷酸盐添加量的增加,STPP组的无规卷曲和β-转角相对含量呈现上升趋势。而TSPP和SHMP组的β-折叠和α-螺旋相对含量变化幅度相近,这也可能是其在0.5 g/100 mL添加量下2 种磷酸化MP溶解度、表面疏水性和乳化性相似的原因。因此,3 种磷酸盐通过磷酸化修饰MP改变了MP的二级结构,从而导致MP的溶解度、表面疏水性和乳化性改变[34]。
表3 TSPP磷酸化对MP二级结构相对含量的影响
Table 3 Effects of TSPP phosphorylation on the secondary structure of MP%
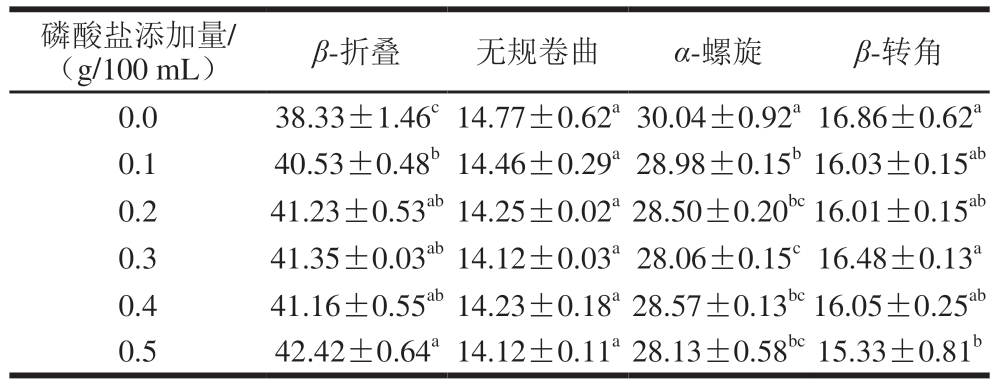
磷酸盐添加量/(g/100 mL)β-折叠无规卷曲α-螺旋β-转角0.038.33±1.46c14.77±0.62a30.04±0.92a16.86±0.62a 0.140.53±0.48b14.46±0.29a28.98±0.15b16.03±0.15ab 0.241.23±0.53ab14.25±0.02a28.50±0.20bc16.01±0.15ab 0.341.35±0.03ab14.12±0.03a28.06±0.15c16.48±0.13a 0.441.16±0.55ab14.23±0.18a28.57±0.13bc16.05±0.25ab 0.542.42±0.64a14.12±0.11a28.13±0.58bc15.33±0.81b
表4 STPP磷酸化对MP二级结构相对含量的影响
Table 4 Effects of STPP phosphorylation on the secondary structure of MP%
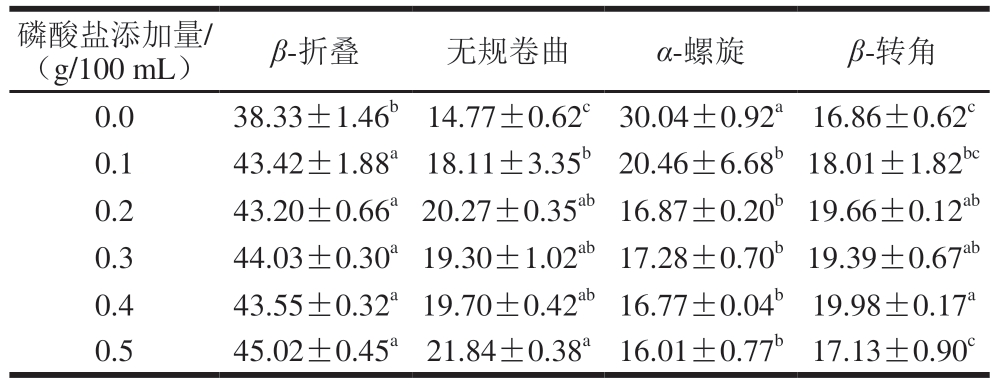
磷酸盐添加量/(g/100 mL)β-折叠无规卷曲α-螺旋β-转角0.038.33±1.46b14.77±0.62c30.04±0.92a16.86±0.62c 0.143.42±1.88a18.11±3.35b20.46±6.68b18.01±1.82bc 0.243.20±0.66a20.27±0.35ab16.87±0.20b19.66±0.12ab 0.344.03±0.30a19.30±1.02ab17.28±0.70b19.39±0.67ab 0.443.55±0.32a19.70±0.42ab16.77±0.04b19.98±0.17a 0.545.02±0.45a21.84±0.38a16.01±0.77b17.13±0.90c
表5 SHMP磷酸化对MP二级结构相对含量的影响
Table 5 Effects of SHMP phosphorylation on the secondary structure of MP%
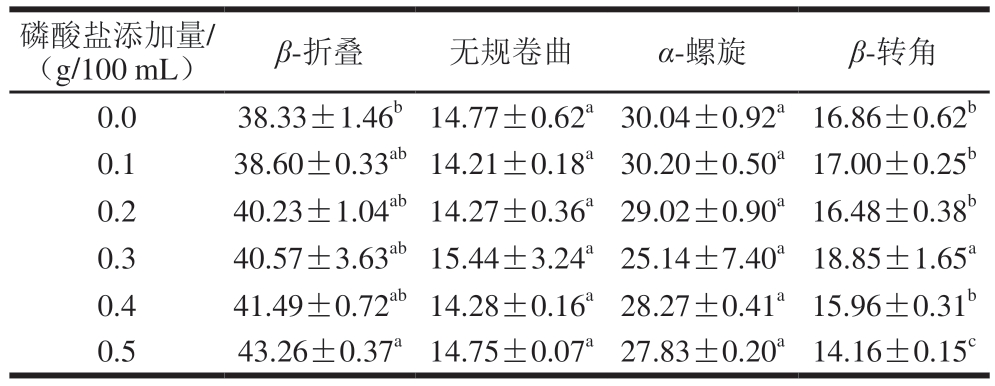
磷酸盐添加量/(g/100 mL)β-折叠无规卷曲α-螺旋β-转角0.038.33±1.46b14.77±0.62a30.04±0.92a16.86±0.62b 0.138.60±0.33ab14.21±0.18a30.20±0.50a17.00±0.25b 0.240.23±1.04ab14.27±0.36a29.02±0.90a16.48±0.38b 0.340.57±3.63ab15.44±3.24a25.14±7.40a18.85±1.65a 0.441.49±0.72ab14.28±0.16a28.27±0.41a15.96±0.31b 0.543.26±0.37a14.75±0.07a27.83±0.20a14.16±0.15c
表6 3 种磷酸盐对MP直径的影响
Table 6 Effects of three phosphates on the particle size of MP nm
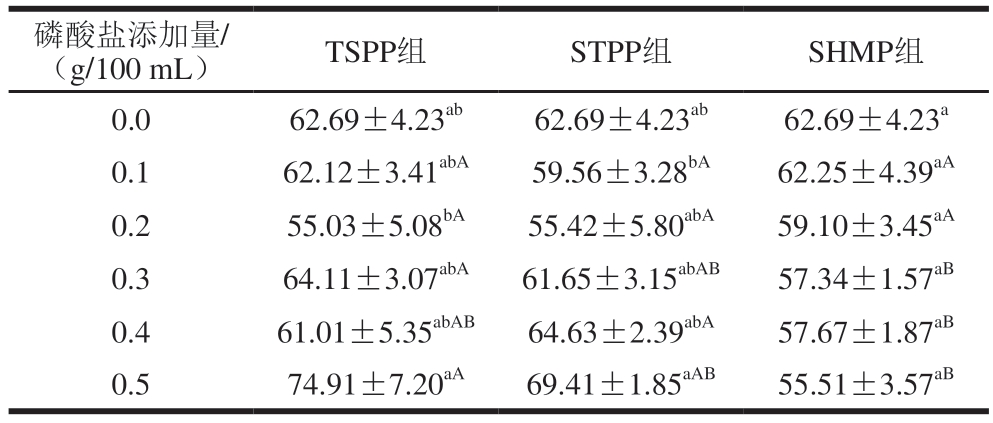
磷酸盐添加量/(g/100 mL)TSPP组STPP组SHMP组0.062.69±4.23ab62.69±4.23ab62.69±4.23a 0.162.12±3.41abA59.56±3.28bA62.25±4.39aA 0.255.03±5.08bA55.42±5.80abA59.10±3.45aA 0.364.11±3.07abA61.65±3.15abAB57.34±1.57aB 0.461.01±5.35abAB64.63±2.39abA57.67±1.87aB 0.574.91±7.20aA69.41±1.85aAB55.51±3.57aB
2.6 MP的TG分析
如图6A~C所示,TSPP和SHMP组的TG曲线与1 g/100 mL NaCl组MP相似,0.1 g/100 mL STPP组的MP在350~600 ℃表现出和1 g/100 mL NaCl组类似的降解曲线,但随着STPP组磷酸化水平的增加,0.2~0.5 g/100 mL STPP组的MP热解速率降低。
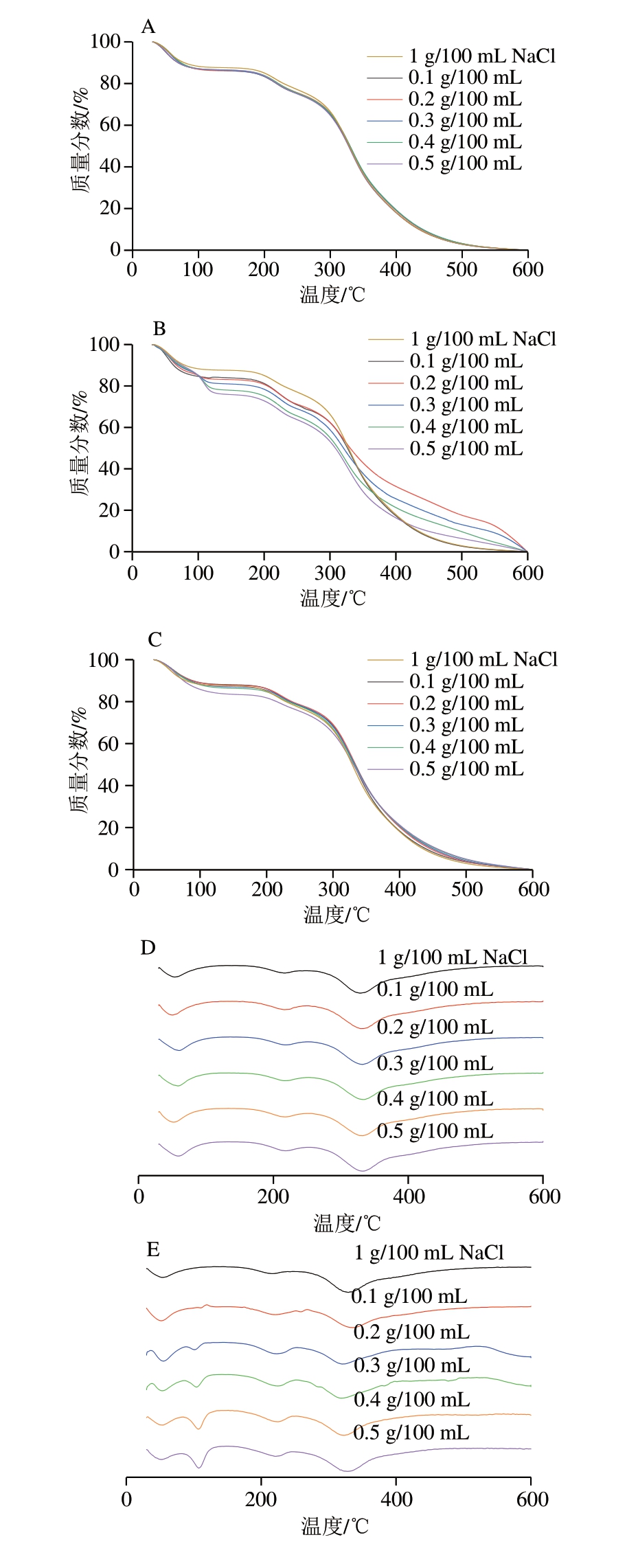
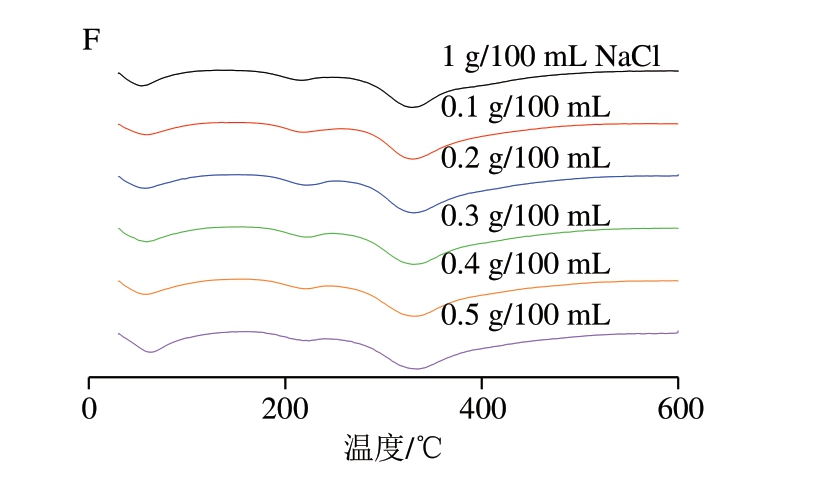
图6 磷酸盐添加量与种类对MP热特性的影响
Fig.6 Effects of type and concentration of phosphate on the thermal characteristics analysis of MP
A~C.TG曲线;D~F.DTG曲线。A、D.TSPP;B、E.STPP;C、F.SHMP。
如图6D~F所示,在30~600 ℃内,微商热重(derivative thermogravimetric,DTG)曲线的吸热峰是蛋白质降解的结果。1 g/100 mL NaCl组的熔融峰温度为328.77 ℃,STPP组的熔融峰温度呈现先降低后升高的趋势,最低为317.9 ℃(0.3 g/100 mL STPP组),最高为335.6 ℃(0.1 g/100 mL STPP组),而TSPP和SHMP组的熔融峰温度均高于1 g/100 mL NaCl组,最高为333.81、333.77 ℃,对应于TG曲线中的第2次质量损失过程。磷酸化MP与1 g/100 mL NaCl组的熔融峰温度无显著差异。总体而言,STPP磷酸化对MP的热降解行为有明显影响,意味着磷酸化修饰可提高MP的热稳定性[35]。
2.7 MP的微观结构
如图7所示,在TSPP和STPP处理组中观察到MP的长丝状结构,同时3 种磷酸盐处理的MP均具有较大且不均匀的球状结构,值得注意的是,SHMP处理组并未发现明显的MP丝状结构。Li Liyuan等[36]研究发现,在pH 7.0时,MP呈现纤维状,pH>7.0时,MP则呈球形,与本研究结果类似。由表7、8可知,TSPP组的MP直径和高度随着磷酸化程度的增加而增大,最大分别为74.91、14.38 nm(0.5 g/100 mL TSPP组)。

图7 3 种磷酸盐修饰MP的AFM图像
Fig.7 AFM images of three phosphate-modified MPs
表7 3 种磷酸盐对MP高度的影响
Table 7 Effects of three phosphates on the height of MP nm
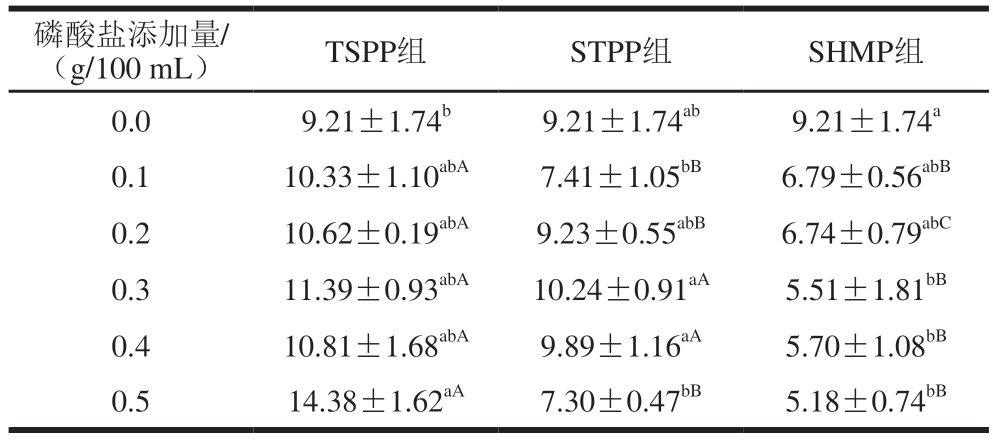
磷酸盐添加量/(g/100 mL)TSPP组STPP组SHMP组0.09.21±1.74b9.21±1.74ab9.21±1.74a 0.110.33±1.10abA7.41±1.05bB6.79±0.56abB 0.210.62±0.19abA9.23±0.55abB6.74±0.79abC 0.311.39±0.93abA10.24±0.91aA5.51±1.81bB 0.410.81±1.68abA9.89±1.16aA5.70±1.08bB 0.514.38±1.62aA7.30±0.47bB5.18±0.74bB
与1 g/100 mL NaCl组相比,STPP处理组观察到边缘不规则的大颗粒MP,说明STPP导致MP出现聚集现象。与TSPP组类似,随着STPP添加量的增加,MP直径呈现变大的趋势,最大为69.41 nm(0.5 g/100 mL STPP组),这可能是因为TSPP组和STPP组的pH值范围较为接近,导致MP微观形貌的变化较为接近[37]。
由表6、7可知,TSPP组的MP直径为55.03~74.91 nm,高度为10.33~14.38 nm,高于STPP组(直径为55.42~69.41 nm,高度为7.30~10.24 nm)和SHMP组(直径为55.51~62.25 nm,高度为5.18~6.79 nm)。与1 g/100 mL NaCl组类似,SHMP组的MP呈现椭圆形。SHMP磷酸化导致MP的展开,可能是因为SHMP组的pH值为7.53~6.66,导致MP颗粒的直径和高度减小。
3 结 论
研究3 种磷酸盐及其添加量对白鲢鱼MP磷酸化的影响,旨在为降低肉制品中NaCl用量的同时调控食品品质提供理论基础。电泳结果表明,3 种磷酸盐均能够提高MP磷酸化水平,且0.4 g/100 mL STPP组的总体磷酸化水平最高。与1 g/100 mL NaCl组相比,3 种磷酸盐均能够提高MP溶解度、表面疏水性、EAI和ESI,且0.4 g/100 mL STPP组具有最高的溶解度和表面疏水性,且0.2~0.5 g/100 mL STPP组的热解速率下降,增强了MP的热稳定性,有利于MP在低盐条件下的加工利用。通过傅里叶变换红外光谱观察到,3 种磷酸盐均能够改变MP结构,磷酸根基团成功引入到MP,发生磷酸化反应,并且磷酸化MP的二级结构中β-折叠相对含量增加。TSPP和STPP磷酸化对MP微观结构的影响类似,均使MP的直径和高度增加,而SHMP磷酸化处理使MP展开更加分散。
[1]DELBARRE-LADRAT C, CHÉRET R, TAYLOR R, et al.Trends in postmortem aging in fish: understanding of proteolysis and disorganization of the myofibrillar structure[J].Critical Reviews in Food Science and Nutrition, 2006, 46(5): 409-421.DOI:10.1080/10408390591000929.
[2]黄诗钰, 施文正, 王锡昌, 等.NaCl对水产制品品质的影响及减盐调控技术研究进展[J].食品科学, 2023, 44(11): 260-268.DOI:10.7506/spkx1002-6630-20220529-347.
[3]陈驰, 唐善虎, 李思宁, 等.微波加热及NaCl添加量对牦牛肉糜凝胶特性和保水性的影响[J].食品科学, 2016, 37(21): 67-72.DOI:10.7506/spkx1002-6630-201621012.
[4]TANG L, YONGSAWATDIGUL J.High-intensity ultrasound improves threadfin bream surimi gelation at low NaCl contents[J].Journal of Food Science, 2021, 86(3): 842-851.DOI:10.1111/1750-3841.15637.
[5]韩格, 秦泽宇, 张欢, 等.超高压技术对低盐肉制品降盐机制及品质改良的研究进展[J].食品科学, 2019, 40(13): 312-319.DOI:10.7506/spkx1002-6630-20180521-303.
[6]刘俊雅, 施文正, 朱学伸.不同还原糖对鲢鱼肉糜凝胶品质的影响[J].肉类研究, 2023, 37(2): 6-11.DOI:10.7506/rlyj1001-8123-20221025-142.
[7]WU Q R, ZANG M W, ZHAO B, et al.Effect of citrus fiber on the phosphate-mediated gel properties of myofibrillar protein and partial replacement of phosphate[J].LWT-Food Science and Technology,2023, 173: 114274.DOI:10.1016/j.lwt.2022.114274.
[8]王文琪, 张雅玮, 李加慧, 等.蛋白质磷酸化对宰后肉品质影响研究进展[J].食品科学, 2023, 44(9): 221-230.DOI:10.7506/spkx1002-6630-20220216-113.
[9]THANGAVELU K P, KERRY J P, TIWARI B K, et al.Novel processing technologies and ingredient strategies for the reduction of phosphate additives in processed meat[J].Trends in Food Science and Technology, 2019, 94: 43-53.DOI:10.1016/j.tifs.2019.10.001.
[10]熊舟翼, 马美湖, 卢素芳, 等.酶法与非酶法磷酸化改性食品蛋白质的研究进展[J].食品工业科技, 2018, 39(21): 310-319.DOI:10.13386/j.issn1002-0306.2018.21.055.
[11]戚亭, 刘宝林, 刘志东, 等.磷酸化改性对南极磷虾蛋白功能特性的影响[J].食品安全质量检测学报, 2018, 9(8): 1829-1833.DOI:10.3969/j.issn.2095-0381.2018.08.017.
[12]周景丽, 张坤生, 任云霞.虾蛄盐溶蛋白磷酸化工艺及其功能性质的研究[J].食品工业科技, 2015, 36(19): 213-218; 223.DOI:10.13386/j.issn1002-0306.2015.19.036.
[13]CEN S E, ZHANG L Y, LIU L W, et al.Phosphorylation modification on functional and structural properties of fish gelatin: the effects of phosphate contents[J].Food Chemistry, 2022, 380: 132209.DOI:10.1016/j.foodchem.2022.132209.
[14]ZHU Y J, NIE Y T, LU Y F, et al.Contribution of phosphorylation modification by sodium tripolyphosphate to the properties of surimicrabmeat mixed gels[J].LWT-Food Science and Technology, 2022,169: 114052.DOI:10.1016/j.lwt.2022.114052.
[15]KAEWRUANG P, BENJAKUL S, PRODPRAN T.Characteristics and gelling property of phosphorylated gelatin from the skin of unicorn leatherjacket[J].Food Chemistry, 2014, 146: 591-596.DOI:10.1016/j.foodchem.2013.09.111.
[16]WANG Q, JIAO X D, YAN B W, et al.Inhibitory effect of microwave heating on cathepsin L-induced degradation of myofibrillar protein gel[J].Food Chemistry, 2021, 357: 129745.DOI:10.1016/j.foodchem.2021.129745.
[17]王子凌, 熊可心, 蒋景淳, 等.高强度超声处理时间对克氏原螯虾肌原纤维蛋白理化性质的影响[J].食品科学, 2023, 44(23): 13-20.DOI:10.7506/spkx1002-6630-20230625-183.
[18]马婕, 杨晓雪, 迟玉杰, 等.超声协同壳聚糖处理对蛋黄液乳化性质及蛋黄蛋白质结构的影响[J].食品科学, 2023, 44(21): 81-89.DOI:10.7506/spkx1002-6630-20230116-131.
[19]方芮, 朱宗帅, 郭秀云, 等.L-赖氨酸对鸡腿肉肌原纤维蛋白磷酸化的影响[J].食品科学, 2020, 41(20): 1-6.DOI:10.7506/spkx1002-6630-20190825-267.
[20]MILLS E N C, HUANG L, NOEL T R, et al.Formation of thermally induced aggregates of the soya globulin β-conglycinin[J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2001, 1547(2): 339-350.DOI:10.1016/s0167-4838(1)00199-6.
[21]CHEN J Y, REN Y X, ZHANG K S, et al.Phosphorylation modification of myofibrillar proteins by sodium pyrophosphate affects emulsion gel formation and oxidative stability under different pH conditions[J].Food and Function, 2019, 10(10): 6568-6581.DOI:10.1039/c9fo01397k.
[22]曾淑薇, 李吉, 熊善柏, 等.磷酸盐对草鱼肌原纤维蛋白结构的影响[J].食品科学, 2014, 35(23): 48-51.DOI:10.7506/spkx1002-6630-201423010.
[23]AI M M, JIANG A M.Phosphorylation modification affects the gelation behavior of alkali-induced duck egg white gels[J].Food Chemistry, 2021,340: 128185.DOI:10.1016/j.foodchem.2020.128185.
[24]郭秀云, 徐双意, 曹思瑜, 等.低盐和高盐条件下L-组氨酸对肌原纤维蛋白结构及体外消化特性的影响[J].肉类研究, 2022, 36(7): 1-6.DOI:10.7506/rlyj1001-8123-20220511-057.
[25]ZHAO Q L, HONG X, FAN L P, et al.Solubility and emulsifying properties of perilla protein isolate: improvement by phosphorylation in the presence of sodium tripolyphosphate and sodium trimetaphosphate[J].Food Chemistry, 2022, 382: 132252.DOI:10.1016/j.foodchem.2022.132252.
[26]LI P S, SUN Z, MA M H, et al.Effect of microwave-assisted phosphorylation modification on the structural and foaming properties of egg white powder[J].LWT-Food Science and Technology, 2018,97: 151-156.DOI:10.1016/j.lwt.2018.06.055.
[27]LI C P, ENOMOTO H, HAYASHI Y, et al.Recent advances in phosphorylation of food proteins: a review[J].LWT-Food Science and Technology, 2010, 43(9): 1295-1300.DOI:10.1016/j.lwt.2010.03.016.
[28]YANG M, ZHANG J, GUO X, et al.Effect of phosphorylation on the structure and emulsification properties of different fish scale gelatins[J].Foods, 2022, 11(6): 804.DOI:10.3390/foods11060804.
[29]ZHANG C X, WANG Z Y, LI Z, et al.Phosphoproteomic profiling of myofibrillar and sarcoplasmic proteins of muscle in response to salting[J].Food Science and Biotechnology, 2016, 25(4): 993-1001.DOI:10.1007/s10068-016-0161-0.
[30]尚坤, 陈金玉, 张坤生, 等.虾蛄肌原纤维蛋白磷酸化工艺及其在虾蛄肉制品中的应用[J].食品工业科技, 2019, 40(8): 12-20.DOI:10.13386/j.issn1002-0306.2019.08.003.
[31]陈玥彤, 张闪闪, 李文意, 等.黑木耳多糖的磷酸化修饰、结构表征及体外降糖活性[J].食品科学, 2022, 43(8): 29-35.DOI:10.7506/spkx1002-6630-20210908-091.
[32]HADIDI M, JAFARZADEH S, IBARZ A.Modified mung bean protein: optimization of microwave-assisted phosphorylation and its functional and structural characterizations[J].LWT-Food Science and Technology, 2021, 151: 112119.DOI:10.1016/j.lwt.2021.112119.
[33]HU Y Y, DU L H, SUN Y Y, et al.Recent developments in phosphorylation modification on food proteins: structure characterization,site identification and function[J].Food Hydrocolloids, 2023, 137:108390.DOI:10.1016/j.foodhyd.2022.108390.
[34]LIU Y H, WANG D Z, WANG J H, et al.Functional properties and structural characteristics of phosphorylated pea protein isolate[J].International Journal of Food Science and Technology, 2020, 55(5):2002-2010.DOI:10.1111/ijfs.14391.
[35]熊舟翼.磷酸化对卵白蛋白分子特性和功能性质的影响及其机制研究[D].武汉: 华中农业大学, 2022: 38-39.DOI:10.27158/d.cnki.ghznu.2017.000052.
[36]LI L Y, ZHAO X, XU X L.Trace the difference driven by unfoldingrefolding pathway of myofibrillar protein: emphasizing the changes on structural and emulsion properties[J].Food Chemistry, 2022, 367:130688.DOI:10.1016/j.foodchem.2021.130688.
[37]HU Y P, ZHANG L, YI Y W, et al.Effects of sodium hexametaphosphate, sodium tripolyphosphate and sodium pyrophosphate on the ultrastructure of beef myofibrillar proteins investigated with atomic force microscopy[J].Food Chemistry, 2021, 338: 128146.DOI:10.1016/j.foodchem.2020.128146.