随着过去几十年社会经济的快速发展,肉制品作为人类不可或缺的重要营养来源物质,因其味道鲜美以及烹饪方式的多元化,在日常饮食中占比逐渐增大。肉制品可以给人类带来充足的营养物质和食欲满足,但同时肉制品在热加工过程中会产生一系列具有致癌可能性的致癌物(杂环胺(heterocyclic amines,HAs)、苯并芘和亚硝胺等),危害人体健康。有研究表明,HAs会增加人体器官癌变的风险,如结肠、乳腺和胰腺等[1-2]。因此,如何抑制肉制品热加工过程中HAs的形成已经成为食品安全领域的研究重点之一。本研究主要对HAs的类别、形成机制、影响因素以及检测方法等研究进展进行概述,有助于建立肉制品行业高效的HAs监控体系,促进肉制品行业的健康发展。
1 HAs简介
1.1 HAs的分类
HAs是由富含蛋白质的食品在热加工过程中形成的一类具有强烈致突变性的食源性致癌物质[3]。其根据化学结构分为氨基咪唑氮杂芳烃类(amino-imidazoazaarenes,AIAs)和氨基咔啉类(amino-carbolines,ACs)。其中AIAs有氨基咪唑喹啉类(IQ型)、氨基咪唑喹喔啉类(IQx型)和氨基咪唑吡啶类(主要为2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP)),热加工温度一般为100~300 ℃;而ACs形成的条件较为苛刻,一般在300 ℃以上由氨基酸降解形成,主要有α-咔啉类、β-咔啉类、γ-咔啉类、δ-咔啉类等[4]。此外,根据化学性质,AIAs又被称为极性HAs,ACs被称为非极性HAs[5]。并且这两类HAs在肉制品中的生成量和致病性也不尽相同,其中AIAs的生成量占主导地位,致癌、致突变性也较ACs更强。
1.2 HAs的生物危害
HAs在人类癌症中的作用是近年来的研究热点。根据流行病学研究,食用含有高含量HAs的肉制品会增加癌症的发生风险[6]。PhIP是肉制品中最丰富的HAs之一,对胰腺、前列腺和乳腺等人体器官,尤其是对结肠具有潜在的致癌和致突变作用。已发表的研究表明,短期暴露于PhIP可通过改变肠道细菌组成及影响脂质代谢途径引起大鼠结肠损伤[7]。Zhao Xinli等[8]也发现,PhIP诱导大鼠结肠组织中DNA损伤和破坏氨基酸代谢平衡,尤其抑制色氨酸、β-丙氨酸和谷胱甘肽的代谢,进而诱发结肠癌。基于大量研究结果,国际癌症研究机构(International Agency for Research on Cancer,IARC)发现几乎所有的HAs都有致癌性[9],并对致癌性进行分类(表1)。在美国,国家毒理学计划也将IQ、MeIQ、MeIQx和PhIP列入其中,预测为人类致癌物[10]。
表1 IARC确定为2A类和2B类致癌物的HAs[9]
Table 1 HAs identified by IARC as Class 2A and 2B carcinogens[9]
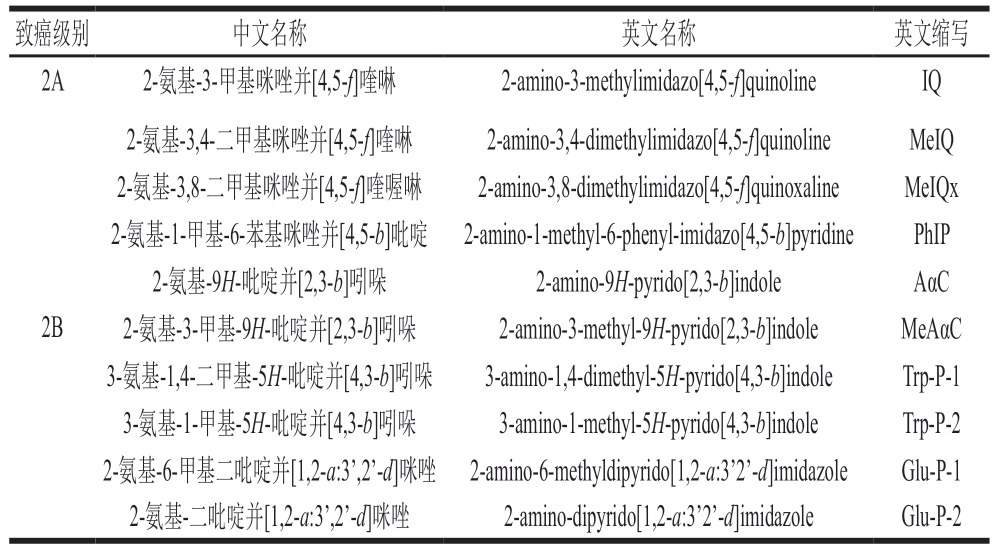
致癌级别中文名称英文名称英文缩写2A2-氨基-3-甲基咪唑并[4,5-f]喹啉2-amino-3-methylimidazo[4,5-f]quinolineIQ 2B 2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉2-amino-3,4-dimethylimidazo[4,5-f]quinolineMeIQ 2-氨基-3,8-二甲基咪唑并[4,5-f]喹喔啉2-amino-3,8-dimethylimidazo[4,5-f]quinoxalineMeIQx 2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶2-amino-1-methyl-6-phenyl-imidazo[4,5-b]pyridinePhIP 2-氨基-9H-吡啶并[2,3-b]吲哚2-amino-9H-pyrido[2,3-b]indoleAαC 2-氨基-3-甲基-9H-吡啶并[2,3-b]吲哚2-amino-3-methyl-9H-pyrido[2,3-b]indoleMeAαC 3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indoleTrp-P-1 3-氨基-1-甲基-5H-吡啶并[4,3-b]吲哚3-amino-1-methyl-5H-pyrido[4,3-b]indoleTrp-P-2 2-氨基-6-甲基二吡啶并[1,2-a:3’,2’-d]咪唑2-amino-6-methyldipyrido[1,2-a:3’2’-d]imidazoleGlu-P-1 2-氨基-二吡啶并[1,2-a:3’,2’-d]咪唑2-amino-dipyrido[1,2-a:3’2’-d]imidazoleGlu-P-2
1.3 HAs的形成机制
HAs的种类较多,形成机制复杂,其中,AIAs类型在肉制品中最丰富,热加工中最容易生成且致癌性较高。因此,下文主要以AIAs类型中的IQ型、IQx型和PhIP为例介绍其形成机制。
IQ型和IQx型的形成与美拉德反应密切相关,其前体物质有肌酸、己糖及氨基酸[11-12]。在100~300 ℃高温下,己糖和氨基酸发生Strecker降解形成吡啶、吡嗪类化合物和醛类(图1A),再与肌酸环化形成的肌酸酐在醇醛缩合反应下形成IQ型和IQx型HAs[9]。此外,IQ和MeIQ还可通过美拉德反应产生的烷基吡啶自由基与肌酸酐反应生成[13]。
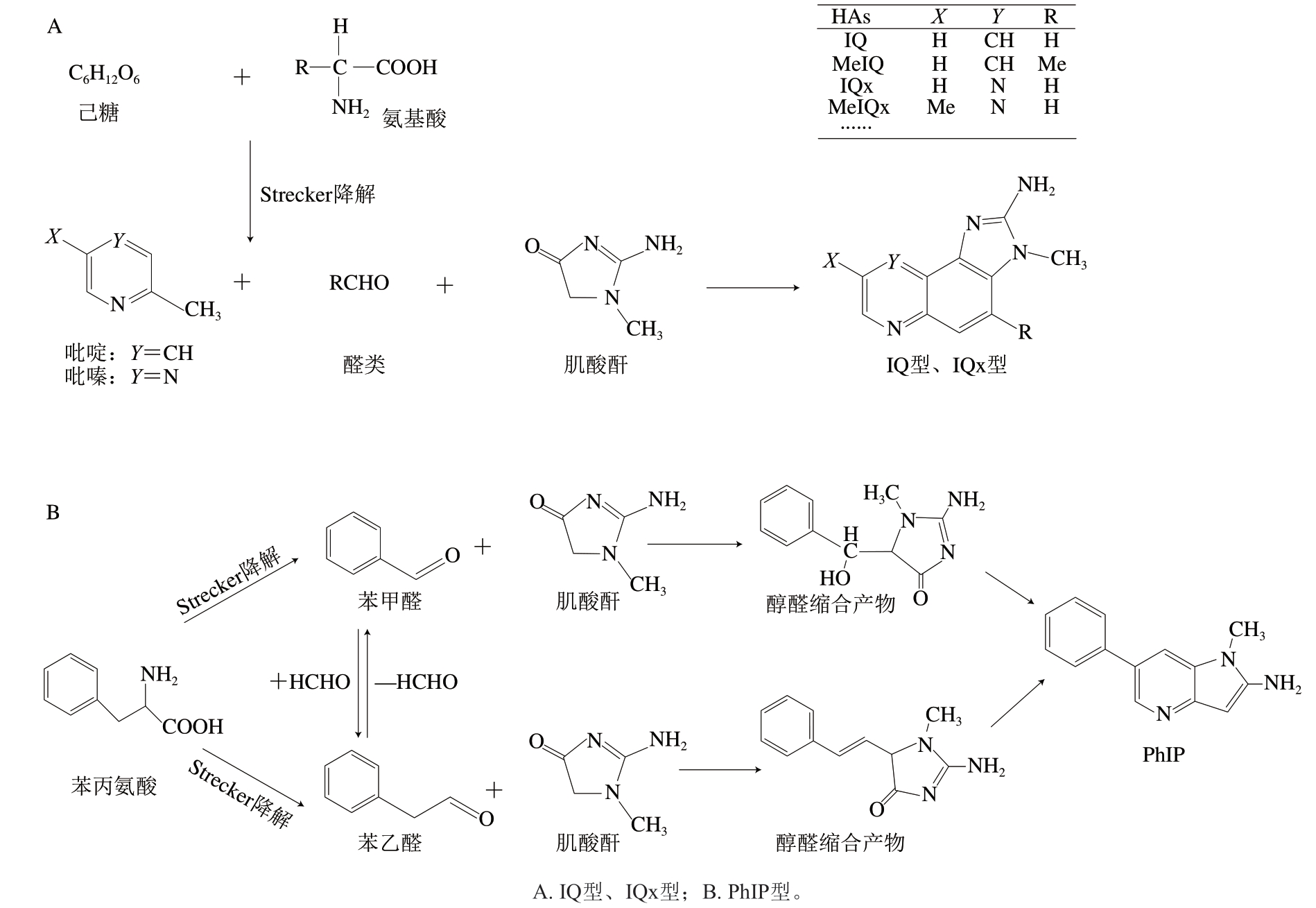
图1 AIAs的形成机制[17-18]
Fig. 1 Formation mechanism of AIAs[17-18]
PhIP作为肉制品热加工中生成量最丰富的AIAs之一,相关报道及研究进展较多,反应机理也相较于其他AIAs更为明确。PhIP形成的重要前体物质为苯丙氨酸和肌酸,关键中间产物是苯乙醛和苯甲醛(图1B)[14-18]。首先,苯丙氨酸通过Strecker降解生成苯乙醛和苯甲醛,肌酸通过环化生成肌酸酐。然后,体系中的肌酸酐和苯乙醛或苯甲醛之间发生醇醛缩合反应脱水后形成稳定的醇醛缩合物,缩合物再经历电子重排、脱水和芳构化等一系列反应生成PhIP。此外,苯甲醛和苯乙醛之间还能发生一定的转换,即苯甲醛可与甲醛发生醛醇缩合反应生成苯乙醛,苯乙醛可通过氧化转化为苯甲醛[17]。
2 前体物质类似物对HAs形成的影响
HAs形成机制中,主要依赖肌肉中丰富的肌酸环化形成的肌酸酐与己糖、氨基酸的Strecker降解产物反应,因此可通过添加这些糖类和氨基酸的类似物,干扰这些前体或中间体的反应,进而抑制HAs的形成。此外,在热加工过程中,脂肪和植物油等油脂也会影响前体物质和中间体的含量,进而影响肉制品中HAs的生成。
2.1 多糖
通过干扰肌酸酐与苯乙醛之间的反应或减缓美拉德反应的进行,添加多糖能抑制HAs的生成,尤其是PhIP的生成。化学模型体系中,添加糯米淀粉和脱支糯米淀粉的短链直链淀粉可显著降低PhIP的生成量,这种下降可能是由于淀粉中的葡萄糖残基与肌酸酐的氨基缩合形成n-糖基共轭物,干扰肌酸酐与苯乙醛的反应,进而抑制PhIP的形成;而对比2 种淀粉,短链直链淀粉的作用更明显,这与糯米淀粉复杂的空间结构可减少葡萄糖羟基与肌酸酐氨基的反应有关[19]。有研究对直接添加不同壳聚糖(1%)制备的鱼片中HAs含量进行调查,结果表明,酸溶性壳聚糖处理的油炸鱼片对HAs的形成具有最高的抑制作用(68.09%);抑制机理可能为:1)壳聚糖在鱼片周围产生一层薄膜,防止热直接接触鱼片表面;2)壳聚糖的螯合特性隔离与美拉德反应相关的酶活性所必需的金属离子,最终使美拉德反应停止或减少[20]。此外,壳聚糖的脱乙酰度(deacetylation degree,DD)对HAs的形成也存在一定的影响,在10 mg添加水平下,壳聚糖(85% DD)同肌酸酐竞争与苯乙醛反应,从而抑制模型体系中PhIP的形成(26.75%),而DD较高(95%)或较低(50%和72%)的壳聚糖对PhIP的抑制作用不明显;在牛肉饼中,较低水平(0.1%~0.3%)的壳聚糖(85% DD)可显著抑制烤牛肉饼中PhIP的形成,其中0.15%壳聚糖可抑制56.21%的PhIP,而较高水平(0.5%~0.6%)的壳聚糖则没有任何抑制作用[21]。
2.2 氨基酸
脯氨酸、组氨酸和色氨酸等氨基酸可抑制PhIP的形成,其机理主要在于清除苯甲醛或苯乙醛。Linghu等[22]发现,加热含有氨基酸的PhIP生产模型体系,色氨酸和赖氨酸等氨基酸可通过有效清除苯乙醛,呈剂量依赖性地降低PhIP水平。Chen Qiaochun等[23]在HAs形成的模型体系和烤牛肉饼中发现,脯氨酸可直接与PhIP的游离环外氨基发生脱水缩合反应,形成PhIP-脯氨酸加合物,进而消除现有的游离PhIP。Deng Peng等[17]研究发现,通过清除苯甲醛和苯乙醛,模型体系中的脯氨酸、组氨酸以剂量依赖性的方式抑制PhIP的形成,在100 mg添加水平下,组氨酸降低了84%的PhIP,而脯氨酸可达到完全抑制;同时在协同作用研究中发现,组氨酸-脯氨酸组合对PhIP形成的抑制效率显著高于单独使用组氨酸和脯氨酸。
此外,直接添加前体物会显著提升HAs的含量,如在多种肉制品加工中为提升产品风味和色泽添加的酱油,富含氨基酸和还原糖等HAs前体物质[24-25]。Hsu等[26]发现,酱油对HAs的形成有很大的贡献,在相同加热条件下,8%酱油和其他调味料处理的炸鸡纤维产生的总HAs含量远高于20%糖和其他调味料处理的炸鸡纤维。还发现未加调味料的鸡肉中总HAs含量为0.188 ng/g,而经过酱油处理后总HAs含量则增加近6 倍[27]。
2.3 油脂
脂肪是肉制品的重要营养成分,可以改善肉制品的感官特性,并且作为一种有效的传热剂将热量传导到肉中,快速达到生成HAs所需的温度。Unal等[28]研究发现,不同动物脂肪类型的使用对Sucuk肉制品(一种传统土耳其肉制品)中总HAs含量有极显著影响。而在另一项研究中,Oz[29]认为,动物脂肪类型对烧烤肉丸中HAs总量无显著影响。Perezc-Baez等[30]发现,牛肉饼中牛肉脂肪含量与总HAs含量呈负线性关系,认为可能是由于脂肪含量增加导致蛋白质水平下降,从而影响前体物质游离氨基酸和肌酸的浓度。而Kang Jiayun等[31]研究影响卤肉中HAs形成的因素时发现,提高脂肪含量会促进HAs的形成,并认为这是由于脂肪会被氧化成自由基而参与美拉德反应,产生一定的吡嗪和吡啶,进而促进HAs的生成。综上,动物脂肪的含量和种类对HAs形成的影响还未有一个明确的观点,除了脂肪含量和类型之外,脂肪对HAs的影响或许也与肉的种类有关。植物油是肉制品加工中常用的原料,对HAs形成的影响具有双重性,一方面,植物油所含有的抗氧化物质可以抑制HAs的形成,另一方面,加热过程所伴随的脂肪酸氧化会形成自由基,进而参与HAs的形成。橄榄油、葵花籽油和葡萄籽油富含生育酚和多酚化合物,Lu Fei等[32]研究发现,橄榄油、葵花籽油和葡萄籽油均可抑制MeIQ的形成,其中葡萄籽油的效果最好,完全抑制了肉饼中MeIQx、PhIP和2-氨基-3,4,8-三甲基咪唑并[4,5-f]喹喔啉(2-amino-3,4,8-trimethylimidazo[4,5-f]quinoxaline,4,8-DiMeIQx)的生成。Pan Teng等[33]发现,在相同温度下,饱和脂肪酸含量较低的大豆油处理过的肉松中9H-吡啶并[2,3-b]吲哚(9H-pyrido[4,3-b]indole,Norharman)、1-甲基-9H-吡啶并[2,3-b]吲哚(1-methyl-9H-pyrido[4,3-b]indole,Harman)、AαC和MeAαC含量显著低于猪油和棕榈油处理过的肉松。Hsu等[26]也发现,在相同的加热条件下,猪油产生的总HAs水平高于大豆油,可能是因为前者含有更多的游离脂肪酸。
3 阻断剂对HAs形成的影响
肉制品热加工过程中添加具有抗氧化作用的阻断剂可抑制高温加热时HAs的形成,主要包括天然抗氧化剂、植物提取物和香辛料。
3.1 天然抗氧化剂
天然抗氧化剂依赖于种类、剂量及反应条件的不同,对HAs的生成可呈现抗氧化和促氧化的双向作用[29,34-35],但依然是抑制HAs生成的一种有效措施,主要通过清除自由基等HAs形成的中间体减少HAs的生成。典型的天然抗氧化剂包括多酚、花青素、类胡萝卜素等。花椒叶富含金丝桃苷和绿原酸等多酚物质,其中金丝桃苷可与苯乙醛之间形成加合物,抑制PhIP的生成,在高剂量时对牛肉饼中PhIP的抑制率达到76.19%,而绿原酸则相反,较高水平下可显著提高PhIP含量(36.19%)[36]。花青素作为一种高效抗氧化剂,在熏鸡腿制作过程中加入可以呈剂量依赖性地抑制PhIP、Harman和Norharman的生成,尤其是抑制PhIP;其中,对PhIP的影响机理主要在于通过捕获苯丙氨酸、肌酸、肌酸酐、葡萄糖、苯乙醛和醛醇缩合产物等前体物质和中间产物[37]。虾青素的添加可影响肉丸中HAs的生成,但效果呈现双重性,在150 ℃烹饪的肉丸中观察到总HAs含量增加94%~244%,而在200 ℃烹饪的肉丸中观察到总HAs含量减少47%~54%[38]。
3.2 植物提取物
一些植物提取物中富含多酚物质和黄酮类化合物,具有良好的抗氧化性能,可通过清除自由基抑制HAs中间产物的生成或减少前体物质的消耗,进而减少HAs的生成[39-40]。例如,生姜提取物可通过对自由基的猝灭,阻断牛肉饼烘焙过程中HAs的生成,抑制率高达79%[39]。柳树皮提取物可通过抑制前体的消耗和防止自由基生成,进而抑制烤制羊肉饼中HAs的生成,特别是极性HAs,抑制率达到56.92%[41]。王未等[40]也发现,花椒叶提取物可显著减少氨基酸、葡萄糖和肌酸等前体的消耗,保护前体物质的损失,最终抑制超过70%的PhIP、IQ和AαC生成。此外,杨桐提取物可通过去除吡嗪、吡啶和羰基等美拉德反应中间产物,阻断鸡肉饼炸制过程中HAs的生成[42]。综上所述,植物提取物可以作为肉制品加工中HAs生成的潜在抑制剂。
3.3 香辛料
香辛料是一类天然植物性原料,常用于肉制品加工中,改善食物的风味和增加食欲。由于其富含酚类、黄酮类、酰胺类等抗氧化性成分,添加到肉制品中可以影响HAs的形成[43]。而不同香辛料的抗氧化成分和含量存在差异,香辛料依赖于种类、剂量及作用肉制品的不同,对HAs的作用效果也呈现抗氧化和促氧化的双重作用。樊贺雨等[44]研究油炸牛肉饼中分别添加6 种传统香辛料对HAs形成的影响,结果发现,这些香辛料均有抑制效果,其中添加1.5%花椒的效果最佳,对HAs抑制率达到77.3%。Yang Diaodiao等[45]研究5 种香辛料对香肠加工的4 个阶段中HAs形成的影响,结果显示,生姜和花椒促进HAs的形成,而大蒜、黑胡椒和辣椒则抑制HAs的形成,且黑胡椒的抑制效果最好。Kang Jiayun等[31]研究香辛料对酱猪肉中HAs形成的影响,结果表明,0.1%的肉桂、甘草、八角、丁香、高良姜对HAs的总含量有一定的抑制作用,其中0.1%丁香具有最强的抑制效果(36.21%),而当添加量为0.05%时,除了丁香和高良姜分别可以抑制25.78%和22.91%的HAs,其他3 种香辛料会促进HAs的形成。
阻断剂对HAs形成的影响部分研究如表2所示。
表2 阻断剂对HAs形成的影响
Table 2 Effects of blockers on HAs formation
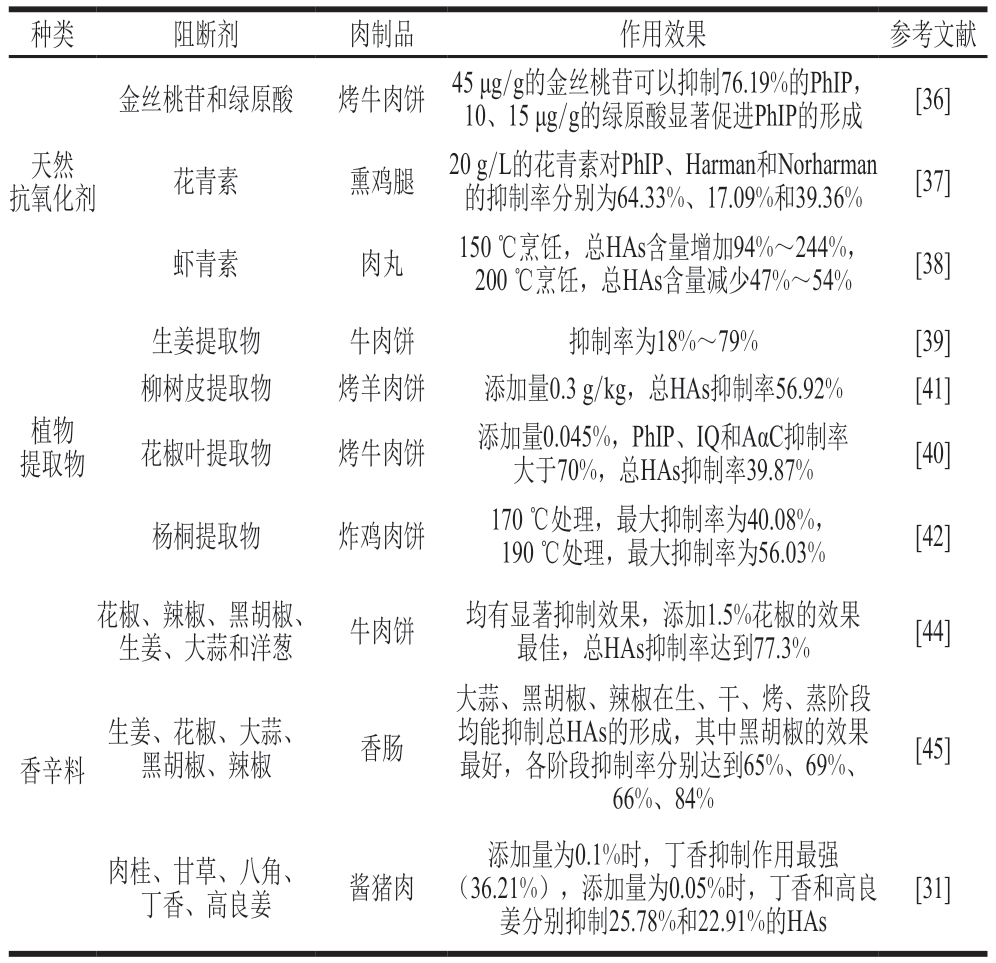
种类阻断剂肉制品作用效果参考文献金丝桃苷和绿原酸烤牛肉饼45 μg/g的金丝桃苷可以抑制76.19%的PhIP,10、15 μg/g的绿原酸显著促进PhIP的形成[36]天然抗氧化剂花青素熏鸡腿20 g/L的花青素对PhIP、Harman和Norharman的抑制率分别为64.33%、17.09%和39.36%[37]虾青素肉丸150 ℃烹饪,总HAs含量增加94%~244%,200 ℃烹饪,总HAs含量减少47%~54%[38]植物提取物生姜提取物牛肉饼抑制率为18%~79%[39]柳树皮提取物烤羊肉饼添加量0.3 g/kg,总HAs抑制率56.92%[41]花椒叶提取物烤牛肉饼添加量0.045%,PhIP、IQ和AαC抑制率大于70%,总HAs抑制率39.87%[40]杨桐提取物炸鸡肉饼170 ℃处理,最大抑制率为40.08%,190 ℃处理,最大抑制率为56.03%[42]花椒、辣椒、黑胡椒、生姜、大蒜和洋葱牛肉饼均有显著抑制效果,添加1.5%花椒的效果最佳,总HAs抑制率达到77.3%[44]香辛料生姜、花椒、大蒜、黑胡椒、辣椒香肠大蒜、黑胡椒、辣椒在生、干、烤、蒸阶段均能抑制总HAs的形成,其中黑胡椒的效果最好,各阶段抑制率分别达到65%、69%、66%、84%[45]肉桂、甘草、八角、丁香、高良姜酱猪肉添加量为0.1%时,丁香抑制作用最强(36.21%),添加量为0.05%时,丁香和高良姜分别抑制25.78%和22.91%的HAs[31]
4 加工因素对HAs形成的影响
4.1 加工方式
炖、蒸和水煮等较温和的加工方式,加热温度较低并且热传递均匀,不利于HAs的生成;而烧烤、油炸和炭烤等较剧烈的加工方式,在较高的加热温度下肉制品表面会急速升温,迅速达到生成HAs所需的温度。水是肉制品在加热过程中的反应和传递介质,高温会引起水分迁移,进而携带前体物质快速运输到肉制品表面,并随着前体物质的集中暴露加速HAs的生成[46]。例如,水煮、烘烤和油炸鱼糜中HAs的种类和生成量依次增加,其中水煮温度较低,鱼糜中形成HAs的前体物质很难获得足够的活化能,使得水煮过程中HAs生成速率和生成量均显著低于其他2 种加工方式[47]。在鸡腿的加工过程中,不同加工工序显著影响HAs的形成,卤煮-油炸>油炸-卤煮>卤煮,这是因为油炸会显著促进肌酸环化形成肌酸酐,进而促进HAs的生成[48]。探究6 种加工方式处理鸭肉时也发现,相对于煎炸、炭烤、油炸和烘烤,微波烹饪和水煮等较温和的加工方式是最合适的处理鸭肉的方法[49]。
4.2 加工条件
温度和时间是影响肉制品热加工中HAs形成的重要因素,肉制品中生成的HAs含量和种类一般与其成正比,这是由于随着温度的升高和时间的延长,由美拉德途径或其他途径生成HAs的反应程度逐渐加剧[50]。Han Tianlong等[51]研究由生肉到烤焦过程中炭烤羊肉的HAs含量变化,结果表明,IQ、PhIP和Norharman最早出现在7 min,并从14 min开始,HAs总量开始呈指数增长,在42 min时达到246.5 ng/g。Pleva等[52]用烧烤的方式在150、180、210 ℃下分别处理无皮鸡胸肉2.5、5、10 min,结果显示,150 ℃处理的鸡胸肉没有检出HAs,210 ℃处理鸡胸肉10 min形成的HAs最多。在肉制品加工中,HAs在生成的同时存在高温降解现象。Ishak等[53]通过建立苯丙氨酸模型体系研究HAs的形成动力学发现,HAs形成的反应速率随加热温度的升高同步增加,其中IQx和MeIQx的含量与时间和温度成正比,并且温度的影响更为显著。而MeIQ和PhIP的形成模式则有所不同,MeIQ在210 ℃加热16 min后,含量显著下降至11.937 µg/g,在270 ℃下加热16 min后,含量则显著下降至4.607 µg/g,这种下降是由于它们在加热过程中的不稳定状态造成的。
5 HAs的定量检测
5.1 常用的定量方法
研究HAs形成机制、影响因素均离不开HAs的检测。但由于大多数HAs在肉制品中微量存在,且受复杂食物基质的干扰,通常难以准确量化[54]。QuEChERS(quick, easy, cheap, effective, rugged, and safe)是一种高效的快速提取纯化方法,广泛用于果蔬、动物粪便和各种食品中多环芳烃的农药残留测定。近年来,与固相萃取及分散液-液微萃取(dispersive liquid-liquid microextraction,DLLME)一样,QuEChERS开始应用于肉制品中HAs的提取和纯化,再结合液相色谱-质谱联用技术来鉴定以及定量肉制品中HAs的含量。其中,Yan Xiaoting等[55]基于四极杆轨道阱质谱和QuEChERS开发了一种准确、快速、灵敏的4 种关键HAs的定性和定量方法,该方法加标回收率为78.1%~97.4%,检出限为0.2~1.2 μg/kg。Hsiao等[56]优化了使用伯仲胺、C18和MgSO4作为基质清除吸附剂从油炸猪肉纤维中提取HAs的QuEChERS方法,结果发现,使用的吸附剂没有足够的能力去除高脂肪肉类基质中的亲脂性物质。增强脂质去除产品(enhanced matrix removal of lipids,EMRLipid)是一种新型的脂质去除吸附剂,Linghu等[57]通过使用EMR-Lipid法结合高效液相色谱-电喷雾串联质谱法(high performance liquid chromatography-electrospray ionization tandem mass spectrometry,LC-ESI-MS/MS)检测牛肉、鸡肉和培根中的HAs含量,结果显示,优化后的EMR-Lipid提取方法可以有效去除高脂肪肉类基质中的亲脂性物质,为高脂肪肉制品中极性HAs提取和检测提供了一个有前途的选择。Jiang Xianqiong等[58]利用金属有机骨架(metal-organic frameworks,MOFs)和聚高内相乳液(polymeric high internal phase emulsions,polyHIPEs)构建成MOFs@polyHIPEs材料,并将其制作成固相萃取柱,通过固相萃取结合液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)实现了烤鱼和炸鸡中亲水HAs的高效富集和分析,结果表明,该方法回收率为81.14%~105.76%,检出限极低,为0.000 2~0.000 4 ng/mL。董浩等[59]建立固相萃取-超高效液相色谱-质谱法测定油煎猪肉饼中HAs的含量,该方法的回收率为64%~91%,检出限为0.02~0.15 μg/kg。Mohammadi等[60]利用DLLME结合高效液相色谱对烤肉中HAs进行富集和分析,结果显示,该方法的检出限为4.8~5.3 ng/g,回收率为89%~97%。
5.2 新型定量方法
目前报道的HAs检测技术大多基于LC-MS技术(图2A),具有较高的灵敏度和选择性等优势,但应用复杂,实验室仪器昂贵,耗时长,难以进行快速现场分析。因此构建一种成本较低、简单、高效的定量方法来快速检测HAs是有必要的。Montes等[61]开发了一种电化学方法测定熟食样品中形成的MeIQx(图2B),该方法首先以离子液体作为萃取相,通过DLLME将分析物与实际样品分离;其次将碳纳米纤维(carbon nanofiber,CNF)、银纳米颗粒(silver nanoparticles,AgNPs)以及全氟磺酸基聚合物(Nafion,Nf)集成在一个坚固的丝网印刷修饰电极上,构成Nf-AgNPs-CNF电极作为纳米探测分析装置,从而建立一种可靠的电化学分析方法,用于食品中MeIQx的差分脉冲伏安法灵敏定量。受“主-客体”相互作用机制的启发,Sun Lili等[62]利用葫芦[7]脲(cucurbit[7]uril,CB[7])的分子空腔和CB[7]与PhIP之间强大的客体识别特性,开发了一种新型荧光定量技术用于检测PhIP(图2C),首先,合成了一种丹磺酰氯(dansyl chloride,DNS-CL)标记的CB[7]荧光探针(CB[7]-DNS-CL),其次用NaIO4将再生纤维素(regenerated cellulose,RC)膜氧化生成醛基,PhIP与醛基通过胺-醛共轭化学反应,从而捕获PhIP,然后用NaBH4处理,进行席夫碱还原,以提高C-N键的稳定性,最后将RC膜浸入CB[7]-DNS-CL染料溶液中,使PhIP与CB[7]-DNS-CL发生主客体相互作用,通过DNS-CL的荧光强度,实现PhIP的快速测量。
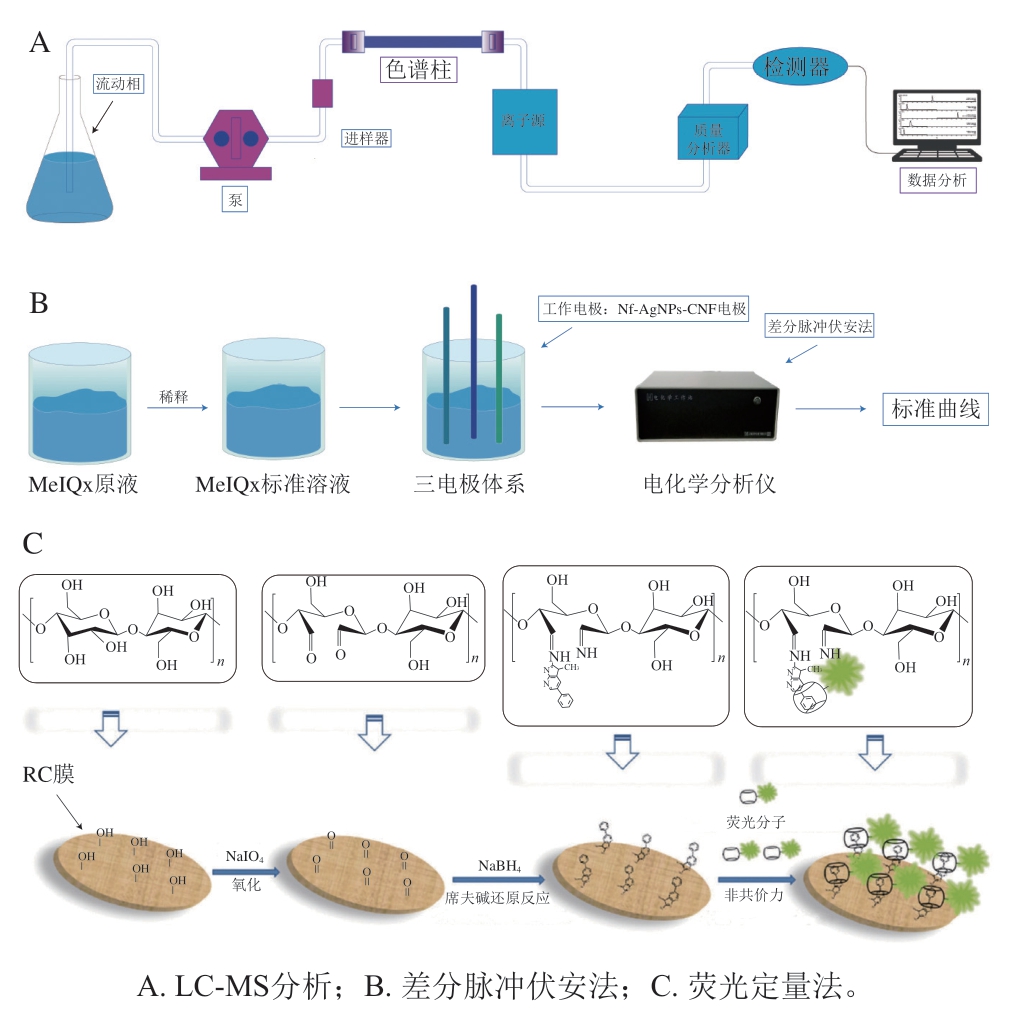
图2 HAs定量检测方法
Fig. 2 Methods for quantitative detection of HAs
肉制品中HAs的前处理方法和检测方法及性能参数如表3所示。
表3 肉制品中HAs的前处理方法和检测方法及性能参数
Table 3 Sample retreatment methods and analytical methods for detection of HAs in meat products and their figures of merit

注:-. 文献未报道。
前处理方法分析方法研究对象分析物检出限回收率/%参考文献QuEChERLC-MS烤猪肉Harman、Norharman、PhIP、MeIQ0.2~1.2 ng/g78.1~97.4[55]EMR-Lipid法LC-ESI-MS/MS牛肉、培根、鸡肉IQx、MeIQx、4,8-DiMeIQx和PhIP 0.03~0.08 ng/g65~111[57]-0.02~0.07 ng/g42~77固相萃取HPLC-MS烤鱼和炸鸡IQ、MeIQx和4,8-DiMeIQx0.000 2~0.000 4 ng/mL81.14~105.76[58]固相萃取UPLC-MS猪肉饼MeAαC、AαC、Harman、Norharman、Trp-P-1和Trp-P-20.02~0.15 ng/g64~91[59]DLLMEHPLC烤肉MeIQ、MeIQx、PhIP和IQ4.8~5.3 ng/g89~97[60]DLLME差分脉冲伏安法肉羹MeIQx5 ng/mL93.6~100.0[61]-荧光定量法-PhIP0.224 ng/g87.6~97.8[62]
6 结 语
熟制的肉制品在提供丰富营养的同时,一些危害物质也在加工过程中悄然产生,HAs作为其中之一,具有强烈的致癌、致突变性,过量摄入会增加人体患癌的风险。自由基、苯乙醛、醇醛缩合物等是HAs形成的关键中间体。而多糖、天然抗氧化物质或含有抗氧化成分的植物提取物等可以抑制、清除或与中间体结合,进而控制肉制品中HAs的含量。此外,在加工过程中,影响HAs形成的关键因素有温度、时间和加工方式,因此,选择较温和的加工方式以及适当降低热处理温度和时间都是减少HAs形成的有效措施。定量检测是研究HAs形成机制、影响因素的重要前提,其中LC-MS技术是实验室使用率最高的方法之一,但实验设备昂贵,耗时长,不利于快速检测,本文介绍了伏安法和荧光定量法2 种不同以往的检测方法,为检测技术的开发提供了一定的参考。HAs的研究历经多年,虽然其研究成果显著,但局限性仍然存在,由于HAs形成途径的复杂性,形成机制和抑制机理尚未全部解析,检测方法也不够简洁、成本仍较高,这些都还有待进一步探索,为寻找更好的HAs减控方法提供更多的理论依据。
[1]HASNOL N D S, JINAP S, SANNY M. Effect of different types of sugars in a marinating formulation on the formation of heterocyclic amines in grilled chicken[J]. Food Chemistry, 2014, 145: 514-521.DOI:10.1016/j.foodchem.2013.08.086.
[2]VIEGAS O, AMARO L F, FERREIRA I M P L V O, et al. Inhibitory effect of antioxidant-rich marinades on the formation of heterocyclic aromatic amines in pan-fried beef[J]. Journal of Agricultural and Food Chemistry, 2012, 60(24): 6235-6240. DOI:10.1021/jf302227b.
[3]陈阳, 陈俏纯, 邓鹏, 等. 苹果与葡萄对烤牛肉饼体外消化过程杂环胺释放的影响[J]. 肉类研究, 2022, 36(9): 7-12. DOI:10.7506/rlyj1001-8123-20220801-088.
[4]杜洪振, 陈倩, 刘骞, 等. 肉制品中杂环胺的形成及其机制[J].中国食品学报, 2020, 20(9): 323-336. DOI:10.16429/j.1009-7848.2020.09.037.
[5]MURKOVIC M. Analysis of heterocyclic aromatic amines[J].Analytical and Bioanalytical Chemistry, 2007, 389(1): 139-146.DOI:10.1007/s00216-007-1306-z.
[6]ADEYEYE S A O, ASHAOLU T J. Heterocyclic amine formation and mitigation in processed meat and meat products: a mini-review[J].Journal of Food Protection, 2021, 84(11): 1868-1877. DOI:10.4315/JFP-20-471.
[7]ZHAO Xiuli, LIU Hengchao, ZHOU Xiaofei, et al. 2-Amino-1-methyl-6-phenylimidazo[4,5-b]pyridine induced colon injury by disrupting the intestinal bacterial composition and lipid metabolic pathways in rats[J]. Journal of Agricultural and Food Chemistry, 2021, 69(1): 437-446. DOI:10.1021/acs.jafc.0c06588.
[8]ZHAO Xiuli, SHAO Zeping, ZHOU Xiaofei, et al. Sub-chronic exposure to PhIP induces oxidative damage and DNA damage, and disrupts the amino acid metabolism in the colons of Wistar rats[J].Food and Chemical Toxicology, 2021, 153: 112249. DOI:10.1016/j.fct.2021.112249.
[9]程轶群, 雷阳, 周兴虎, 等. 传统肉制品中杂环胺研究进展[J]. 食品科学, 2022, 43(5): 316-327. DOI:10.7506/spkx1002-6630-20200927-338.
[10]ALAEJOS M S, AFONSO A M. Factors that affect the content of heterocyclic aromatic amines in foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(2): 52-108. DOI:10.1111/j.1541-4337.2010.00141.x.
[11]KHAN I A, KHAN A, ZOU Y, et al. Heterocyclic amines in cooked meat products, shortcomings during evaluation, factors influencing formation, risk assessment and mitigation strategies[J]. Meat Science,2022, 184: 108693. DOI:10.1016/j.meatsci.2021.108693.
[12]阿丽雅, 温荣欣, 刘馨屿, 等. 肉制品中杂环胺的形成机制及植物提取物对其抑制作用的研究进展[J]. 肉类研究, 2021, 35(5): 70-77.DOI:10.7506/rlyj1001-8123-20210309-058 .
[13]陈敬敬, 韩金花, 张永胜, 等. 肉制品中杂环胺的研究进展[J].中国食品卫生杂志, 2022, 34(1): 168-174. DOI:10.13590/j.cjfh.2022.01.032.
[14]MURKOVIC M. Formation of heterocyclic aromatic amines in model systems[J]. Journal of Chromatography B, 2004, 802(1): 3-10.DOI:10.1016/j.jchromb.2003.09.026.
[15]ZAMORA R, ALCON E, HIDALGO F J. Ammonia and formaldehyde participate in the formation of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) in addition to creati(ni)ne and phenylacetaldehyde[J]. Food Chemistry, 2014, 155: 74-80.DOI:10.1016/j.foodchem.2014.01.039.
[16]ZOCHLING S, MURKOVIC M. Formation of the heterocyclic aromatic amine PhIP: identification of precursors and intermediates[J].Food Chemistry, 2002, 79(1): 125-134. DOI:10.1016/s0308-8146(02)00214-5.
[17]DENG Peng, XUE Chaoyi, HE Zhiyong, et al. Synergistic inhibitory effects of selected amino acids on the formation of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) in both benzaldehydeand phenylacetaldehyde-creatinine model systems[J]. Journal of Agricultural and Food Chemistry, 2022, 70(35): 10858-10871.DOI:10.1021/acs.jafc.2c03122.
[18]GIBIS M. Heterocyclic aromatic amines in cooked meat products:causes, formation, occurrence, and risk assessment[J]. Comprehensive Reviews in Food Science and Food Safety, 2016, 15(2): 269-302.DOI:10.1111/1541-4337.12186.
[19]YU Di, YU Shujuan. Effects of waxy rice starch and short chain amylose (SCA) on the formation of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) in a model system[J]. Food and Function, 2016, 7(3): 1339-1344. DOI:10.1039/c5fo01495f.
[20]MIRSADEGHI H, ALISHAHI A, OJAGH M, et al. The effect of different kinds of chitosans and cooking methods on the formation of heterocyclic aromatic amines in huso (Huso huso) fillet[J]. Journal of Food Processing and Preservation, 2019, 43(12): 14253. DOI:10.1111/jfpp.14253.
[21]ZHAO Yueliang, YANG Hongmei, ZHANG Nana, et al. Effects of the deacetylation degree of chitosan on 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) formation in chemical models and beef patties[J]. Journal of Agricultural and Food Chemistry, 2021,69(46): 13933-13941. DOI:10.1021/acs.jafc.1c05733.
[22]LINGHU Z, KARIM F, SMITH J S. Amino acids inhibitory effects and mechanism on 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine(PhIP) formation in the Maillard reaction model systems[J]. Journal of Food Science, 2017, 82(12): 3037-3045. DOI:10.1111/1750-3841.13959.
[23]CHEN Qiaochun, XUE Chaoyi, CHEN Jing, et al. Simultaneous determination of the PhIP-proline adduct and related precursors by UPLC-MS/MS for confirmation of direct elimination of PhIP by proline[J]. Food Chemistry, 2021, 365: 130484. DOI:10.1016/j.foodchem.2021.130484.
[24]LAI Y W, LEE Y T, CAO H, et al. Extraction of heterocyclic amines and polycyclic aromatic hydrocarbons from pork jerky and the effect of flavoring on formation and inhibition[J]. Food Chemistry, 2023,402: 134291. DOI:10.1016/j.foodchem.2022.134291.
[25]SHAH S A, SELAMAT J, AKANDA M J H, et al. Effects of different types of soy sauce on the formation of heterocyclic amines in roasted chicken[J]. Food Additives and Contaminants: Part A, 2018, 35(5):870-881. DOI:10.1080/19440049.2018.1440639.
[26]HSU K Y, CHEN B H. A comparative study on the formation of heterocyclic amines and cholesterol oxidation products in fried chicken fiber processed under different traditional conditions[J]. LWTFood Science and Technology, 2020, 126: 109300. DOI:10.1016/j.lwt.2020.109300.
[27]HSU K Y, CHEN B H. Analysis and reduction of heterocyclic amines and cholesterol oxidation products in chicken by controlling flavorings and roasting condition[J]. Food Research International, 2020, 131:109004. DOI:10.1016/j.foodres.2020.109004.
[28]UNAL K, KARAKAYA M, OZ F. The effects of different spices and fat types on the formation of heterocyclic aromatic amines in barbecued sucuk[J]. Journal of the Science of Food and Agriculture,2018, 98(2): 719-725. DOI:10.1002/jsfa.8519.
[29]OZ E. The presence of polycyclic aromatic hydrocarbons and heterocyclic aromatic amines in barbecued meatballs formulated with different animal fats[J]. Food Chemistry, 2021, 352: 129378.DOI:10.1016/j.foodchem.2021.129378.
[30]PEREZ-BAEZ A J, VALENZUELA-MELENDRES M, CAMOU J P, et al. Modelling the effects of roselle extract, potato peel flour, and beef fat on the sensory properties and heterocyclic amines formation of beef patties studied by using response surface methodology[J]. Foods,2021, 10(6): 101184. DOI:10.3390/foods10061184.
[31]KANG Jiayun, LI Haibin, HAO Yu, et al. Factors affecting the formation of heterocyclic amines in sauced pork[J]. Journal of Physics:Conference Series, 2021, 2009(1): 012018. DOI:10.1088/1742-6596/2009/1/012018.
[32]LU F, KUHNLE G K, CHENG Q F. Vegetable oil as fat replacer inhibits formation of heterocyclic amines and polycyclic aromatic hydrocarbons in reduced fat pork patties[J]. Food Control, 2017, 81:113-125. DOI:10.1016/j.foodcont.2017.05.043.
[33]PAN Teng, WANG Zhenyu, CHEN Binghuei, et al. Frying oils with lower levels of saturated fatty acids induce less heterocyclic amine formation in meat floss (boiled, shredded and fried pork)[J].International Journal of Food Science and Technology, 2019, 55(2):823-832. DOI:10.1111/ijfs.14368.
[34]OZ F, KAYA M. Heterocyclic aromatic amines in meat[J]. Journal of Food Processing and Preservation, 2011, 35(6): 739-753.DOI:10.1111/j.1745-4549.2011.00524.x.
[35]OZ F, KAYA M. The inhibitory effect of black pepper on formation of heterocyclic aromatic amines in high-fat meatball[J]. Food Control,2011, 22(3/4): 596-600. DOI:10.1016/j.foodcont.2010.10.010.
[36]WANG Wei, REN Xiaopu, BAO Yingjie, et al. Inhibitory effects of hyperoside and quercitrin from Zanthoxylum bungeanum Maxim.leaf on 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine formation by trapping phenylacetaldehyde[J]. European Food Research and Technology, 2021, 248(1): 25-34. DOI:10.1007/s00217-020-03676-9.
[37]ZHANG Lang, HU Yingying, LIU Qian, et al. Cyanidin and rutin inhibit the formation of heterocyclic aromatic amines in chemical modeling systems and smoked chicken drumsticks[J]. Food Chemistry,2023, 398: 133869. DOI:10.1016/j.foodchem.2022.133869.
[38]BINGOL M, BRENNAN C, ZENG M M, et al. Effect of the fortification with astaxanthin on the quality parameters and heterocyclic amines content of meatballs[J]. International Journal of Food Science and Technology, 2022, 57(12): 7653-7665.DOI:10.1111/ijfs.16110.
[39]XU Yang, JIAO Ye, LUO Jie, et al. The influence of deep eutectic solvents extract from ginger on the formation of heterocyclic amines and advanced glycation end products in roast beef patties[J]. Foods,2022, 11(20): 113161. DOI:10.3390/foods11203161.
[40]王未, 任晓镤, 鲍英杰, 等. 花椒叶提取物对烤牛肉饼杂环胺形成的影响[J]. 食品科学, 2021, 42(24): 40-47. DOI:10.7506/spkx1002-6630-20201028-281.
[41]REN Xiaopu, LI Mingyang, WANG Wei, et al. Inhibitory effect of Tamarix ramosissima extract on the formation of heterocyclic amines in roast lamb patties by retarding the consumption of precursors and preventing free radicals[J]. Foods, 2022, 11(7): 111000. DOI:10.3390/foods11071000.
[42]ZHAO Tianpei, XI Jun, ZHANG Chenxia, et al. Using Adinandra nitida leaf extract to prevent heterocyclic amine formation in fried chicken patties[J]. RSC Advances, 2021, 11(12): 6831-6841.DOI:10.1039/d0ra09790j.
[43]曾茂茂, 王俊辉, 陈静, 等. 香辛料的抗氧化活性及对肉制品中杂环胺的影响[J]. 食品与生物技术学报, 2018, 37(1): 1-6.
[44]樊贺雨, 胡晖宇, 李昌, 等. 6 种传统香辛料抑制油炸牛肉饼中杂环胺形成的作用[J]. 食品工业科技, 2022, 43(17): 78-86.DOI:10.13386/j.issn1002-0306.2021110248.
[45]YANG Diaodiao, HE Zhiyong, WANG Zhaojun, et al. Processing stage-guided effects of spices on the formation and accumulation of heterocyclic amines in smoked and cooked sausages[J]. Food Bioscience, 2022, 47: 101776. DOI:10.1016/j.fbio.2022.101776.
[46]WANG Wei, DONG Lu, ZHANG Yan, et al. Reduction of the heterocyclic amines in grilled beef patties through the combination of thermal food processing techniques without destroying the grilling quality characteristics[J]. Foods, 2021, 10(7): 101490. DOI:10.3390/foods10071490.
[47]杨洪生, 徐琦, 张美琴, 等. 不同加工方式下草鱼鱼糜制品中杂环胺生成与变化的研究[J]. 南方水产科学, 2014, 10(3): 73-79.DOI:10.3969/j.issn.2095-0780.2014.03.011.
[48]赵电波, 韩雪, 李可, 等. 不同加工工序对鸡腿品质特性及杂环胺形成的影响[J]. 中国调味品, 2021, 46(9): 22-27. DOI:10.3969/j.issn.1000-9973.2021.09.004.
[49]LIAO Guozhou, WANG Guiying, ZHANG Yingjun, et al. Formation of heterocyclic amines during cooking of duck meat[J]. Food Additives and Contaminants, 2012, 29(11): 1668-1678. DOI:10.1080/19440049.2012.702928.
[50]王惠汀, 孙学颖, 王丹, 等. 肉制品中杂环胺类化合物形成及控制措施的研究进展[J]. 食品研究与开发, 2022, 43(5): 195-203.DOI:10.12161/j.issn.1005-6521.2022.05.029.
[51]HAN Tianlong, WANG Tongtong, HOU Huiwen, et al. Raw to charred: changes of precursors and intermediates and their correlation with heterocyclic amines formation in grilled lamb[J]. Meat Science,2023, 195: 108999. DOI:10.1016/j.meatsci.2022.108999.
[52]PLEVA D, LANYI K, MONORI K D, et al. Heterocyclic amine formation in grilled chicken depending on body parts and treatment conditions[J]. Molecules, 2020, 25(7): 1547. DOI:10.3390/molecules25071547.
[53]ISHAK A A, JINAP S, SUKOR R, et al. Simultaneous kinetics formation of heterocyclic amines and polycyclic aromatic hydrocarbons in phenylalanine model system[J]. Food Chemistry,2022, 384: 132372. DOI:10.1016/j.foodchem.2022.132372.
[54]FU Jingtai, LAI Huasheng, ZHANG Zhoumin, et al. UiO-66 metalorganic frameworks/gold nanoparticles based substrates for SERS analysis of food samples[J]. Analytica Chimica Acta, 2021, 1161:338464. DOI:10.1016/j.aca.2021.338464.
[55]YAN Xiaoting, ZHANG Yuan, YANG Minli, et al. An accurate, rapid,and sensitive method for simultaneous determination of four typical heterocyclic amines in roasted pork patties: application in the study of inhibitory effects of astaxanthin[J]. Journal of Separation Science,2021, 44(9): 1833-1842. DOI:10.1002/jssc.202001229.
[56]HSIAO H Y, CHEN B H, KAO T H. Analysis of heterocyclic amines in meat by the quick, easy, cheap, effective, rugged, and safe method coupled with LC-DAD-MS-MS[J]. Journal of Agricultural and Food Chemistry, 2017, 65(42): 9360-9368. DOI:10.1021/acs.jafc.7b03739.
[57]LINGHU Z, KARIM F, TAGHVAEI M, et al. Determination of heterocyclic amines in meat matrices using enhanced matrix removal-lipid extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Food Science, 2019, 84(7): 1992-2002.DOI:10.1111/1750-3841.14674.
[58]JIANG Xiangqiong, PAN Hong, RUAN Guihua, et al. Wettability tunable metal organic framework functionalized high internal phase emulsion porous monoliths for fast solid-phase extraction and sensitive analysis of hydrophilic heterocyclic amines[J]. Journal of Hazardous Materials, 2022, 431: 128565. DOI:10.1016/j.jhazmat.2022.128565.
[59]董浩, 徐燕, 吴家大, 等. 油煎猪肉饼中6 种氨基咔啉类杂环胺的检测方法及加工条件对其生成的影响[J]. 食品科学, 2022, 43(8): 310-316. DOI:10.7506/spkx1002-6630-20210508-082.
[60]MOHAMMADI A, BARZEGAR F, KAMANKESH M, et al.Heterocyclic aromatic amines in doner kebab: quantitation using an efficient microextraction technique coupled with reversed-phase highperformance liquid chromatography[J]. Food Science and Nutrition,2020, 8(1): 88-96. DOI:10.1002/fsn3.1262.
[61]MONTES C, CONTENTO A M, VILLASENOR M J, et al. A screenprinted electrode modified with silver nanoparticles and carbon nanofibers in a nafion matrix for ionic liquid-based dispersive liquidliquid microextraction and voltammetric assay of heterocyclic amine 8-MeIQx in food[J]. Mikrochim Acta, 2020, 187(3): 190.DOI:10.1007/s00604-020-4138-6.
[62]SUN Lili, WANG Zejiang, HOU Juan, et al. Detection of heterocyclic amine (PhIP) by fluorescently labelled cucurbit[7]uril[J]. Analyst,2022, 147(11): 2477-2483. DOI:10.1039/d2an00495j.