武昌鱼(Megalobrama amblycephala),学名团头鲂,俗称鳊鱼等[1]。武昌鱼是我国所特有的优良淡水鱼类,常用来制作干腌鱼类产品。干腌鱼制品咸香适宜、风味独特,是我国传统的水产加工食品之一[2-3]。干腌鱼的特殊香气形成机理复杂,其气味可以作为区分不同地区干腌鱼的指标。干腌鱼特征香气物质多为醛、醇、酮、呋喃化合物等。己醛、壬醛、辛醛、1-辛烯-3-醇、戊醇被认为是干腌鱼的特征风味物质[4]。香气物质大多是微量或痕量成分,给分析带来了一定的困难,每一种分析方法和分析环境都会对分析结果造成一定的影响。不同的分析条件都有一定的优点和缺陷,不能真实和全面反映样品的香气组成,因此分析与比较不同的挥发性物质分析方法,多种方法相互补充,可以较为真实地反映样品的实际香气组成[5]。
固相微萃取(solid phase microextraction,SPME)属于非溶剂型选择性萃取法,是一种集采样、萃取、浓缩、进样于一体的分析技术。该样品前处理技术简便且环保,灵敏度高,可实现纳克级别的检测。在萃取过程中,探针涂层的种类和性质起重要作用,决定挥发性物质萃取分配系数的大小[6-8]。搅拌棒吸附萃取(stir bar sorptive extraction,SBSE)具有固定相体积大、萃取容量高、无需外加搅拌子、可避免竞争性吸附、能在自身搅拌的同时实现萃取富集等优点,在样品前处理中具有广阔的应用前景[9-10]。动态顶空萃取(dynamic headspace extraction,DHS)从理论上讲是用流动气体将样品中的挥发性成分“吹扫”出来,再用一个捕集器将吹扫出来的有机物吸附,随后经热解吸将样品送入气相色谱仪进行分析[11-12]。
徐永霞等[13]使用3 种不同SPME萃取探针对大菱鲆鱼的挥发性化合物萃取效果进行分析,其中使用二乙烯基苯/羧基/聚二甲基硅氧烷(divinylbenzene/carboxy/polydimethylsiloxane,DVB/CAR/PDMS)萃取头检测出的挥发性物质总峰面积最大且种类最多。杨雪玲等[14]通过不同SPME萃取温度、萃取时间、饱和食盐水与鱼肉的比例和探针解析时间分析最适合加州鲈鱼的挥发性化合物鉴定条件。加工后的干腌水产品气味相较于新鲜水产品更加丰富[15]。目前对于干腌鱼挥发性化合物鉴定的方法建立与优化较为单一,多为不同的萃取方式和萃取温度与时间。分析方法和分析环境均会对分析结果造成影响[16]。对于干腌鱼挥发性化合物的鉴定,萃取时顶空瓶、色谱柱、萃取探针、萃取温度等多方面的优化条件相关报道较少。
本研究为全面分析干腌鱼挥发性风味物质,选用不同涂层的萃取探针、不同萃取方式(SPME、SBSE、DHS)、不同规格顶空瓶、不同萃取温度萃取干腌武昌鱼中易挥发性成分,在DB-WAX、HP-INNOWAX、DB-1 3 个色谱柱上进行气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)分析。根据不同条件下的萃取及分离挥发性物质种类和丰度,筛选并建立合适的分析条件。旨在为干腌鱼风味研究提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜武昌鱼、食盐、白糖、白酒购于湖北省武汉市悦联商业悦活里超市。
1.2 仪器与设备
不同类型涂层纤维的萃取头(50/30 μm DVB/CAR/PDMS,50/30 μm CAR/PDMS)、SPME手柄(57330-U)美国Supelco公司;7890A-5975C GC-MS仪、色谱柱(DB-WAX色谱柱(60 m×0.25 mm,0.25 μm)、HPINNOWAX色谱柱(60 m×0.25 mm,0.25 μm)、DB-1色谱柱(60 m×0.25 mm,0.25 μm)) 美国Agilent公司;DF-4046恒温加热磁力搅拌器 长城科工贸易有限公司;样品顶空瓶(20 mL矮顶空瓶、20 mL高顶空瓶、100 mL顶空瓶)、聚四氟乙烯/硅胶隔垫顶部开口式钳口铝瓶盖(27375) 美国Sigma-Aldrich公司;磁力搅拌转子(1 cm) 上海一恒科学仪器有限公司。
1.3 方法
1.3.1 原料处理
腌制:准确称取整鱼质量2%的食盐、1%的糖和0.5%的白酒(酒精度42%)均匀涂在鱼的全身;将鱼整齐地平铺在不锈钢盆中,放入4 ℃冰箱中腌制;每24 h上下翻动1 次,总共2 d。
干制:腌制后,洗去鱼表面的盐分及液体,用不锈钢钩横向刺穿鱼体使其展平悬挂;将鱼暴露在室外自然环境中进行传统日晒干制,干制时长为每日8∶00—17∶00,共计4 d,其余时间放置于4 ℃的冰箱中直至干制结束,干制时间为2022年2月11—14日,平均温度10.3 ℃,相对湿度57%,风速2.91 m/s。
1.3.2 萃取条件
取干制后鱼背部的肉,剁碎并均匀混合,称取3 g混合的样品于顶空瓶中,然后将顶空瓶进行密封处理。密封好的顶空瓶置于磁力搅拌器中平衡15 min,萃取时间为30 min,探针萃取深度为1 cm。所有萃取条件重复测定3 次,结果取均值。
1.3.3 色谱条件
载气氦气的恒定流速为1.0 mL/min,进样器温度为250 ℃,离子源温度为230 ℃。柱箱程序升温参数如下:烘箱初始温度为40 ℃,不保持,以2 ℃/min的速率升至100 ℃,然后以5 ℃/min的速率升至180 ℃,最后在8 ℃升至250 ℃/min,保持5 min。涂层纤维在进样口250 ℃下解吸5 min,不分流。
1.3.4 质谱条件
电子轰击离子源,电子能量70 eV,四极杆温度150 ℃,传输线温度250 ℃,离子源温度230 ℃,母离子m/z 285,质量扫描范围30~400 u,全扫描模式。
1.3.5 定性与定量分析
依据上述条件对样品进行色谱扫描,质谱通过人工解析与NIST 17谱库中的标准物质谱图进行对比,初步确定检测出的化合物(匹配度>80)。以峰面积表征挥发性化合物的含量,在不同萃取方式中采用内标法半定量挥发性化合物含量。加入50 μL 0.8 μg/mL 2-辛醇到2 g鱼肉样品中作为内标,通过2-辛醇峰面积和含量的比值计算待测挥发物的含量。
1.4 数据处理
结果数据采用Excel计算均值,Origin进行图表绘制。
2 结果与分析
2.1 不同萃取头与萃取温度对干腌鱼中挥发性物质测定的影响
由表1可知,4 种萃取方式共检测到85 种挥发性化合物,其中40、90 ℃下的CAR/PDMS和DVB/CAR/PDMS探针分别萃取到12、35、18、46 种挥发性化合物。在干腌鱼中检测到的挥发性化合物主要以醛、醇、酮类化合物为主。值得注意的是,CAR/PDMS相对DVB/CAR/PDMS萃取探针测得的醛类、酮类和烃类物质较少,醛类和酮类多为不饱和醛和不饱和醇。CAR/PDMS相对DVB/CAR/PDMS萃取头未检测出干腌鱼的典型香气物质1-辛烯-3-醇、2,3-辛二酮、反-2,4-癸二烯醛。这通常根据待测物和分析物的性质,依据“相似相容”的规律,分析物若是极性的,萃取头的涂层(也就是固定相)同为极性的检测效果更好(如聚丙烯酸酯);分析物为非极性的,涂层就应该是非极性的(如PDMS),这样萃取头的萃取效率比较高。检测挥发物或半挥发性混合物沸点较高时,需要加热才能使物质气化在顶部。90 ℃萃取温度相较于40 ℃萃取温度下,醇类、酮类物质减少,醛类、烃类增多,对于DVB/CAR/PDMS萃取头,温度差增加的多为C12~C15的甲基衍生物。这个现象可能是由于温度过高加速氧化自由基断裂,生成了多种醛类和烃类物质。
表1 不同萃取探针在不同温度下对干腌鱼挥发性物质测定的影响
Table 1 Effect of different extraction probes on the determination of volatiles in dried-cured fish at different temperatures
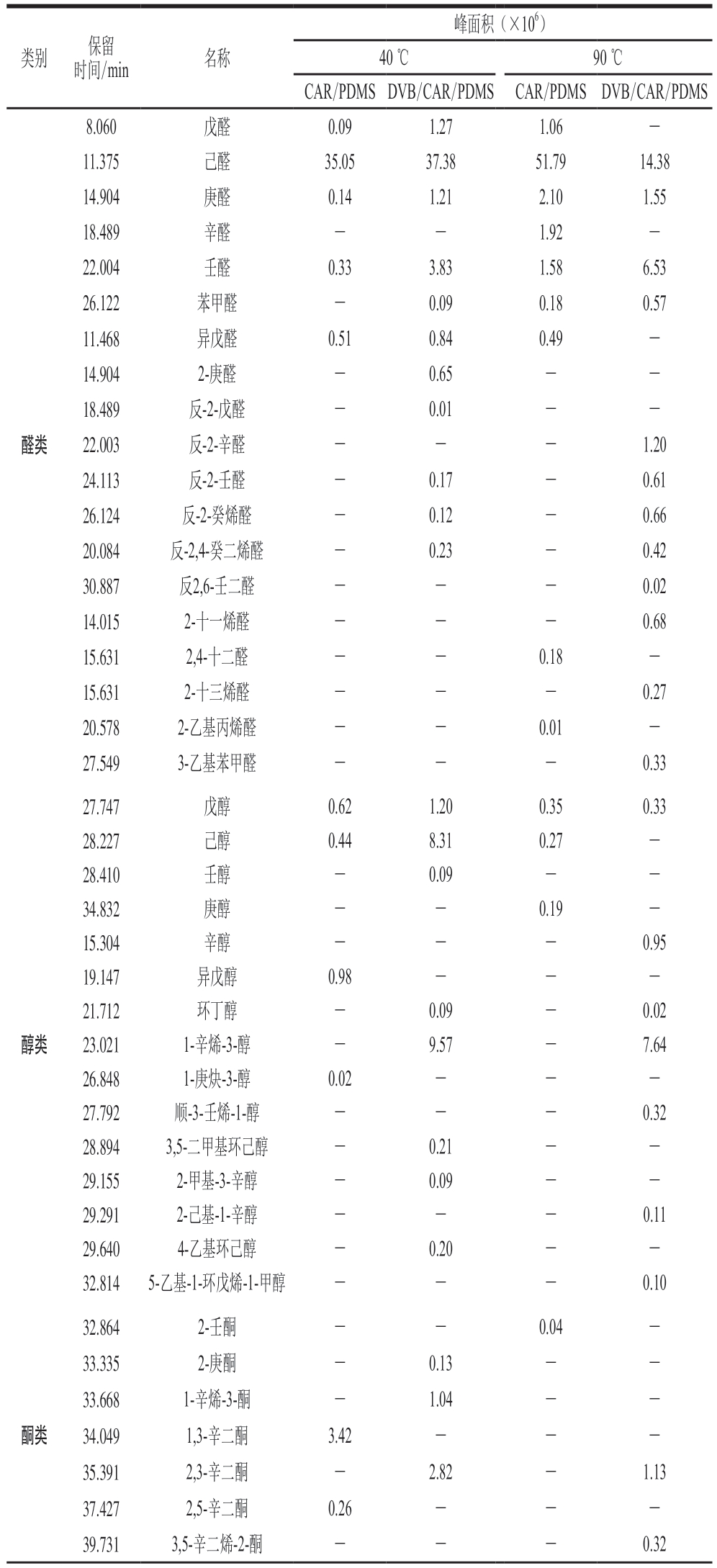
峰面积(×106)40 ℃90 ℃CAR/PDMSDVB/CAR/PDMSCAR/PDMSDVB/CAR/PDMS类别保留时间/min名称醛类8.060戊醛0.091.271.06-11.375己醛35.0537.3851.7914.38 14.904庚醛0.141.212.101.55 18.489辛醛--1.92-22.004壬醛0.333.831.586.53 26.122苯甲醛-0.090.180.57 11.468异戊醛0.510.840.49-14.9042-庚醛-0.65--18.489反-2-戊醛-0.01--22.003反-2-辛醛---1.20 24.113反-2-壬醛-0.17-0.61 26.124反-2-癸烯醛-0.12-0.66 20.084反-2,4-癸二烯醛-0.23-0.42 30.887反2,6-壬二醛---0.02 14.0152-十一烯醛---0.68 15.6312,4-十二醛--0.18-15.6312-十三烯醛---0.27 20.5782-乙基丙烯醛--0.01-27.5493-乙基苯甲醛---0.33醇类27.747戊醇0.621.200.350.33 28.227己醇0.448.310.27-28.410壬醇-0.09--34.832庚醇--0.19-15.304辛醇---0.95 19.147异戊醇0.98---21.712环丁醇-0.09-0.02 23.0211-辛烯-3-醇-9.57-7.64 26.8481-庚炔-3-醇0.02---27.792顺-3-壬烯-1-醇---0.32 28.8943,5-二甲基环己醇-0.21--29.1552-甲基-3-辛醇-0.09--29.2912-己基-1-辛醇---0.11 29.6404-乙基环己醇-0.20--32.8145-乙基-1-环戊烯-1-甲醇---0.10酮类32.8642-壬酮--0.04-33.3352-庚酮-0.13--33.6681-辛烯-3-酮-1.04--34.0491,3-辛二酮3.42---35.3912,3-辛二酮-2.82-1.13 37.4272,5-辛二酮0.26---39.7313,5-辛二烯-2-酮---0.32
续表1
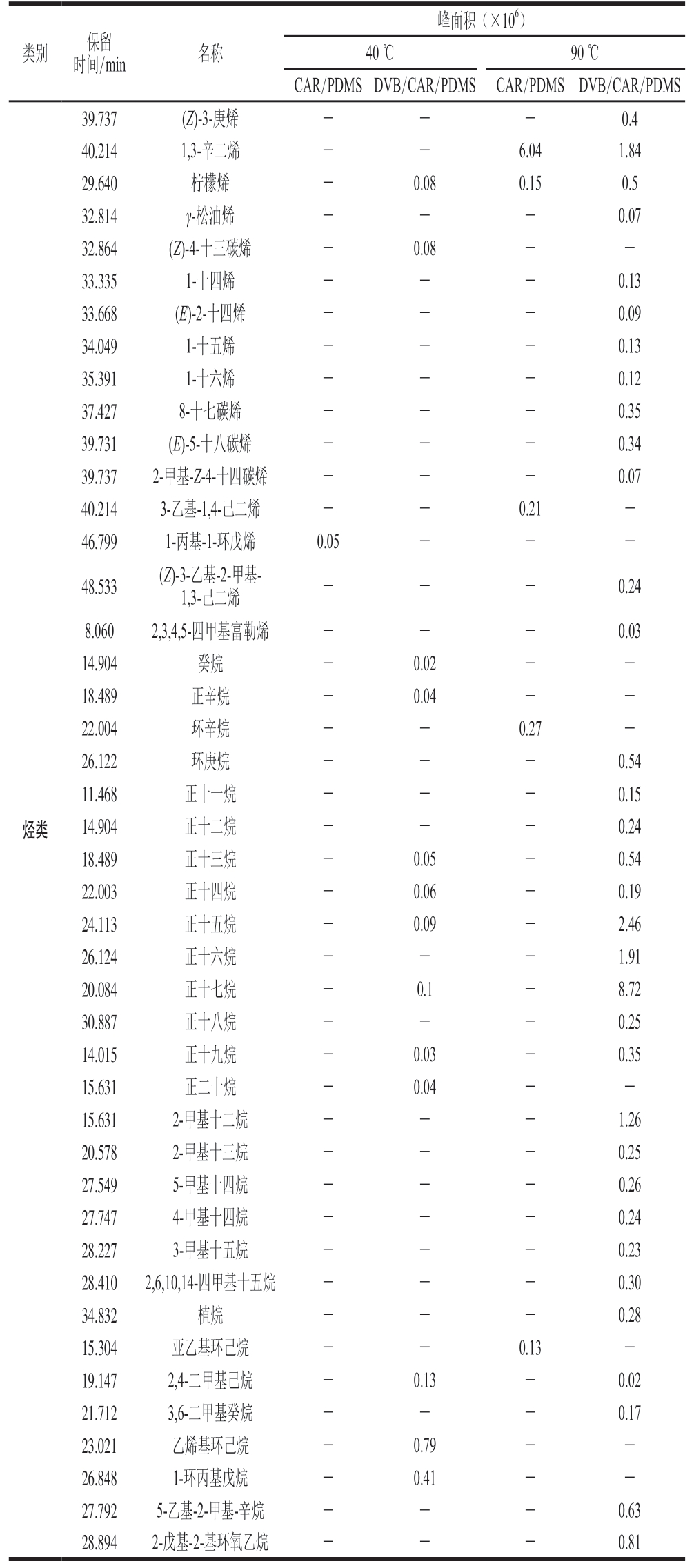
注:-.未检测到。下同。
峰面积(×106)40 ℃90 ℃CAR/PDMSDVB/CAR/PDMSCAR/PDMSDVB/CAR/PDMS类别保留时间/min名称烃类39.737(Z)-3-庚烯---0.4 40.2141,3-辛二烯--6.041.84 29.640柠檬烯-0.080.150.5 32.814γ-松油烯---0.07 32.864(Z)-4-十三碳烯-0.08--33.3351-十四烯---0.13 33.668(E)-2-十四烯---0.09 34.0491-十五烯---0.13 35.3911-十六烯---0.12 37.4278-十七碳烯---0.35 39.731(E)-5-十八碳烯---0.34 39.7372-甲基-Z-4-十四碳烯---0.07 40.2143-乙基-1,4-己二烯--0.21-46.7991-丙基-1-环戊烯0.05---48.533(Z)-3-乙基-2-甲基-1,3-己二烯---0.24 8.0602,3,4,5-四甲基富勒烯---0.03 14.904癸烷-0.02--18.489正辛烷-0.04--22.004环辛烷--0.27-26.122环庚烷---0.54 11.468正十一烷---0.15 14.904正十二烷---0.24 18.489正十三烷-0.05-0.54 22.003正十四烷-0.06-0.19 24.113正十五烷-0.09-2.46 26.124正十六烷---1.91 20.084正十七烷-0.1-8.72 30.887正十八烷---0.25 14.015正十九烷-0.03-0.35 15.631正二十烷-0.04--15.6312-甲基十二烷---1.26 20.5782-甲基十三烷---0.25 27.5495-甲基十四烷---0.26 27.7474-甲基十四烷---0.24 28.2273-甲基十五烷---0.23 28.4102,6,10,14-四甲基十五烷---0.30 34.832植烷---0.28 15.304亚乙基环己烷--0.13-19.1472,4-二甲基己烷-0.13-0.02 21.7123,6-二甲基癸烷---0.17 23.021乙烯基环己烷-0.79--26.8481-环丙基戊烷-0.41--27.7925-乙基-2-甲基-辛烷---0.63 28.8942-戊基-2-基环氧乙烷---0.81
2.2 不同顶空瓶体积对干腌鱼中挥发性物质测定的影响
正确选择合适的顶空瓶是为了达到理想的测定条件与顶空GC状态。由表2可知,3 种顶空瓶分别检测到干腌鱼中挥发性化合物23、13、28 种。其中100 mL顶空瓶检测到的挥发性化合物种类最多,其次是20 mL矮瓶顶空瓶,但在20 mL高顶空瓶中检测到的挥发性化合物丰度均高于100 mL顶空瓶和20 mL矮顶空瓶。这可能是由于顶空样品瓶能够承受来自气体的压力,且不同顶空体积的样品瓶顶空部分压力不同。同时因为分析灵敏度取决于待测组分在顶空气体中的浓度,而不是样品量。固体样品因为样品本身的体积较大,所以在较大的顶空样品瓶中检测效果更好。
表2 不同规格顶空瓶对干腌武昌鱼挥发性物质测定的影响
Table 2 Effects of different HS vials on the identification of volatile compounds in dry-cured fish

类别保留时间/min名称峰面积(×106)20 mL矮顶空瓶20 mL高顶空瓶100 mL顶空瓶醛类11.375己醛121.74336.13283.02 14.904庚醛9.42--18.489壬醛45.3361.87125.24 22.004(E)-14-十六烷烯醛43.80--26.122反-2-辛烯醛-2.24-11.468反-2-十二烯醛--2.68 14.904苯甲醛--10.69 18.489香兰素2.82--醇类22.003正戊醇14.6620.76-24.113正己醇29.6134.8428.80 26.124正辛醇3.38-9.38 20.084环丁醇--0.72 30.8874-壬醇--19.75 14.0152-十五醇20.11--15.6311-辛烯-3-醇90.7699.71133.00 15.6312-乙基己醇--7.76 20.578二乙二醇--6.13 27.5492-亚甲基环戊醇3.35--27.747反-2-辛烯-1-醇5.155.30-28.2271-壬烯-4-醇9.8310.24-28.4104-甲氧基-1-丁醇--1.51 34.8324-氨基-1-戊醇--3.56 15.304(±)-2-二十烷醇18.33--19.147α-松油醇--1.51 21.712薄荷醇--13.99酮类23.0213-羟基-2-丁酮82.34118.3887.70 26.8483,5-辛二烯酮12.41813.2214.06酸类27.792乙酸23.2041.8031.66 28.894异戊酸9.56--29.155己酸17.6016.2228.70 29.291庚酸--2.02 29.640辛酸--5.72 32.814壬酸--4.92 32.864月桂酸4.10-3.71 33.335棕榈酸445.21--33.668硬脂酸1.90--34.049顺-13-十八碳烯酸4.97--其他35.391柠檬烯-24.02-37.427己酸乙烯基酯--16.48 39.731乙酸苯甲酯--1.47 39.737十二烷--38.04 40.214十六烷--4.97 29.640十七烷--8.23
2.3 不同色谱柱对干腌鱼中挥发性物质测定的影响
由表3可知,干腌武昌鱼在3 种色谱柱上共检测出45 种挥发性化合物,在DB-WAX、HP-INNOWAX和DB-1色谱质上分别检测到27、14、24 种挥发性化合物。己醛、壬醛、辛醛、1-辛烯-3-醇、戊醇等干腌鱼特征香气物质在DB-WAX和HP-INNOWAX色谱柱上均检出,且在DB-WAX色谱上有更好的检测效果。DB-1为非极性色谱柱,DB-WAX和HP-INNOWAX为强极性色谱柱,虽然极性并不直接与选择性相关,但是会影响化合物保留及分离。固定相选择性和极性概念通常用来表征色谱柱分离物质的属性。选择性取决于溶质和固定相分子的物理化学相互作用力。极性取决于固定相的结构且对分离有影响[17-19]。选择性可以认为是固定相在区分2 种溶质分子在其化学或物理性质方面的差异能力。如果固定相和溶质间的相互作用力不同,则可分离[20]。所有聚硅氧烷和聚乙二醇固定相之间最主要的相互作用力就是色散力[21]。色散力可以简化为挥发性的概念,简而言之,溶质的挥发性越好,从色谱柱中流出的速度就越快,即保留时间更短[22]。在2 种强极性色谱柱中,有较多的醛类、醇类和酮类物质被分离出,而在DB-1色谱柱中有较多的烷烃类化合物被分离出来。醛、醇、酮为干腌鱼中主要的挥发性风味物质,且有较低的阈值,对干腌鱼整体气味有较大的影响。所以根据结果可以看出,强极性色谱柱更适合用于干腌鱼挥发性化合物的检测中,其中DB-WAX色谱柱分离效果最好。
表3 不同色谱柱对干腌武昌鱼挥发性物质测定的影响
Table 3 Effect of different chromatographic columns on the identification of volatile compounds in dry-cured fish

类别名称峰面积(×106)DB-WAX色谱柱HP-INNOWAX色谱柱DB-1色谱柱醛类己醛1 180.73365.13240.10庚醛80.50-27.18壬醛113.7661.87178.19正辛醛24.55--反-2-辛烯醛8.052.24-3-甲基丁醛59.38--苯甲醛5.94--2-正戊基呋喃34.69-17.56乙醇--105.19醇类正戊醇67.1620.76正己醇204.6034.84104.89正辛醇9.98--壬醇--0.84庚醇9.56--2,3-丁二醇72.02--3-辛醇5.08--1-烯-3-辛醇399.7599.71151.72 1-戊烯-3-醇63.17--反-2-辛烯-1-醇-5.30-2-辛烯-1-醇23.00--1-壬烯-4-醇18.3010.24-3-甲基-1-丁醇97.44-0.56 5-甲基-2-庚醇--4.50 6-甲基-2-庚醇--67.35酮类3-羟基-2-丁酮362.49118.38232.80 2-甲基-3-辛酮362.49--3,5-辛二烯酮5.05813.22-2,5-辛二酮--25.34酸类乙酸-41.80-异戊酸9.7313.82-己酸-16.22-棕榈酸--22.24硬脂酸--23.11顺-13-十八碳烯酸---顺-6-十八碳烯酸--22.48其他柠檬烯47.0224.0247.28己二酸二辛酯67.83--正辛烷52.02-41.56十二烷--8.30十三烷--1.20十四烷6.50--十六烷--4.97十七烷--8.23二十烷--0.80三十一烷--5.66
2.4 不同萃取方式对干腌鱼中挥发性物质测定的影响
由表4可知,DHS萃取到的挥发性化合物种类最多,挥发性物质种类排序为:DHS>SPME>SBSE。如DHS萃取到的C4~C6的醛类物质相比SPME和SBSE种类要多,SPME萃取到的C6~C10的醛类更多,SBSE萃取到的C10~C16的醛类较多。醇类物质的含量DHS>SPME>SBSE,DHS萃取到的醇类化合物高达12 种,主要以饱和醇为主,而SPME萃取到的不饱和醇种类更多,这些不饱和醇多为鱼肉的腥味来源,都有较低的阈值。DHS和SBSE未萃取到酮类物质。SBSE的磁子是一种特殊的以PDMS为外层覆膜的磁性搅拌转子。按照磁子形状不同其吸附体积介于20~130 μL。与之相比,SMPE纤维的吸附体积则仅为0.5 μL,其优势在疏水性有机物方面更加明显。SBSE对样品中挥发性化合物的提取浓度较高于SPME和DHS。但在本研究结果中,SBSE对固体鱼肉样品挥发性化合物种类的萃取效果与SPME和DHS相比较低。SPME和DHS都无溶剂干扰,如图1所示,SBSE萃取时峰较杂。但DHS易受样品基质干扰。所以对于干腌鱼挥发性化合物的测定更适合将多种萃取方式结合使用,更全面地分析其香气成分。
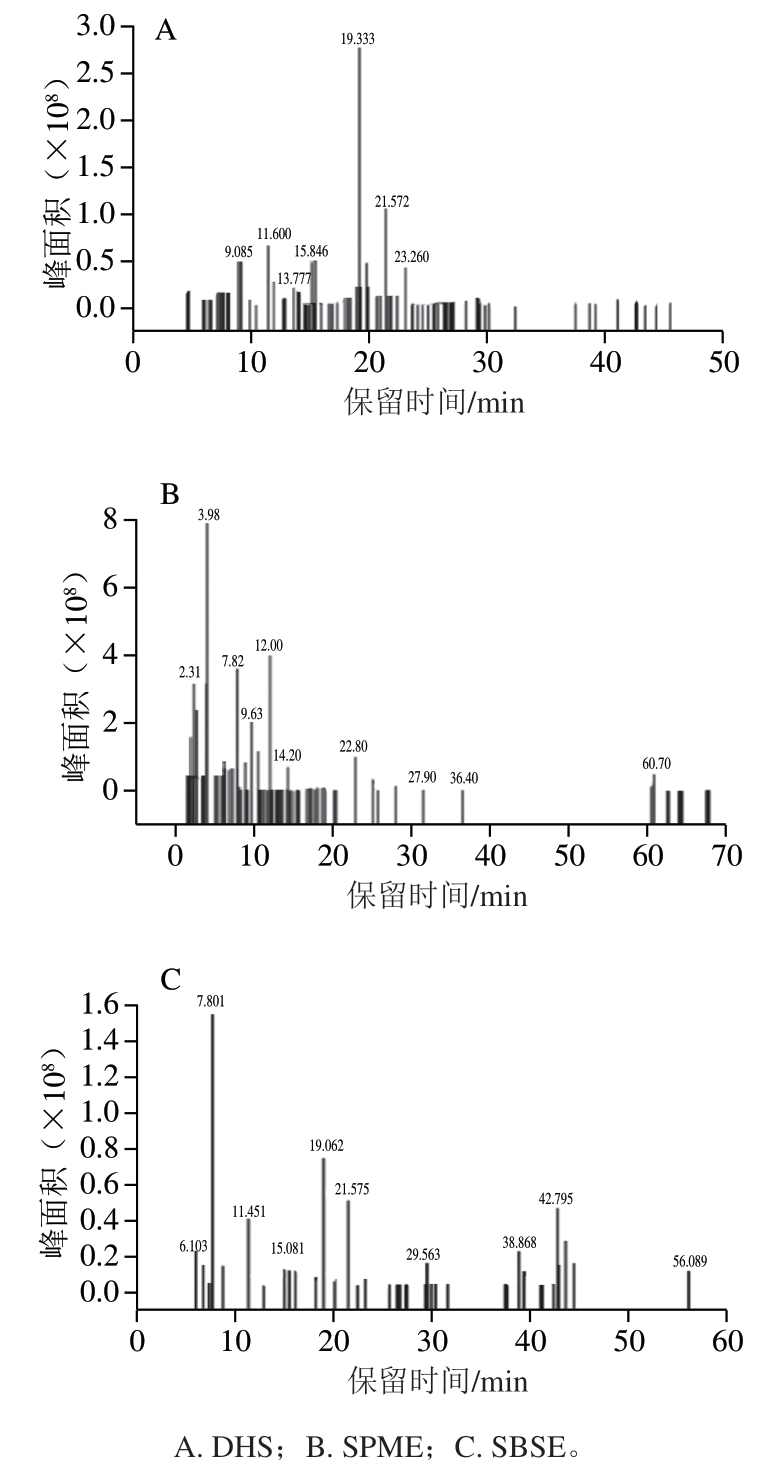
图1 不同萃取方式下干腌武昌鱼离子流图
Fig. 1 Ion current chromatograms of volatile components from drycured fish using different extraction methods
表4 不同萃取方式对干腌武昌鱼挥发性物质鉴定的影响
Table 4 Effects of different extraction methods on the identification of volatile compounds in dry-cured fish
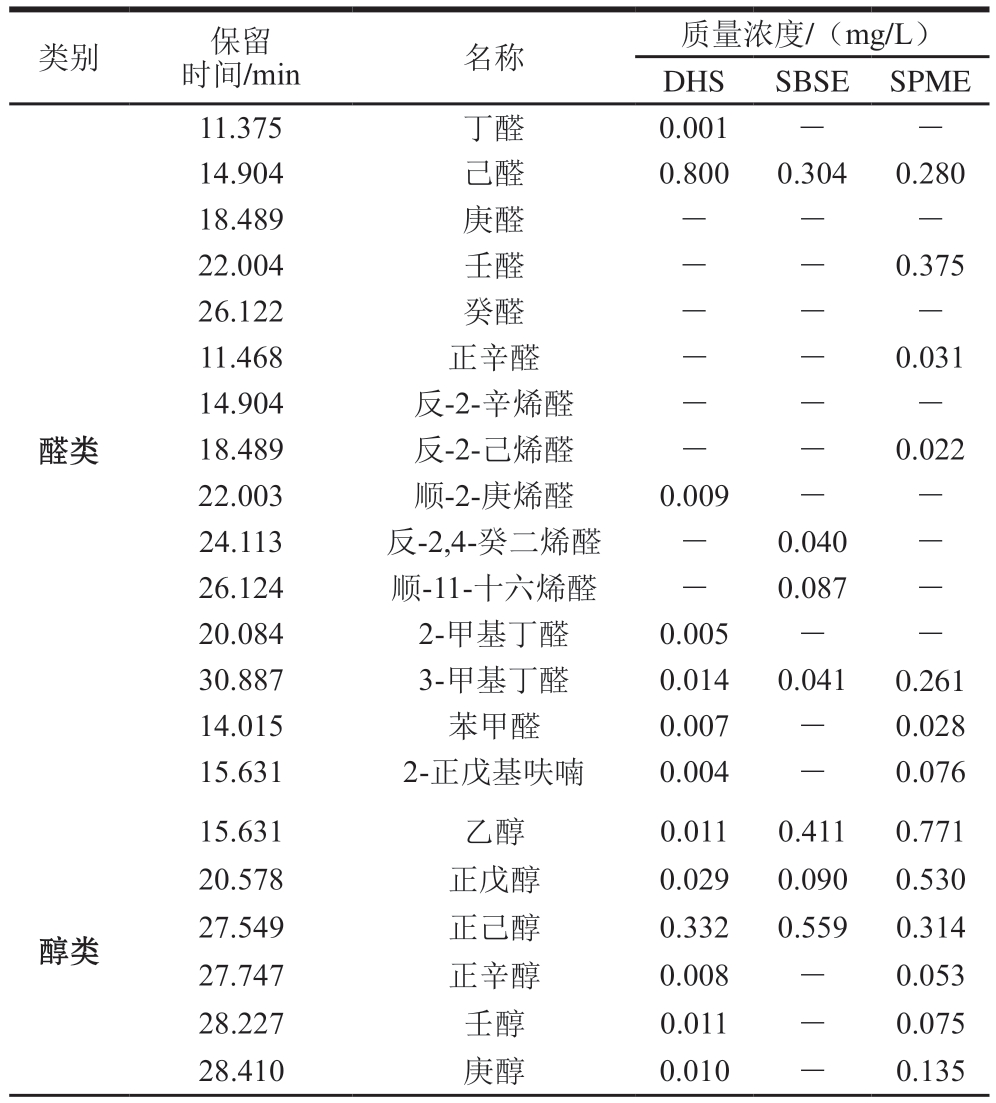
类别保留时间/min名称质量浓度/(mg/L)DHSSBSESPME醛类11.375丁醛0.001--14.904己醛0.8000.3040.280 18.489庚醛---22.004壬醛--0.375 26.122癸醛---11.468正辛醛--0.031 14.904反-2-辛烯醛---18.489反-2-己烯醛--0.022 22.003顺-2-庚烯醛0.009--24.113反-2,4-癸二烯醛-0.040-26.124顺-11-十六烯醛-0.087-20.0842-甲基丁醛0.005--30.8873-甲基丁醛0.0140.0410.261 14.015苯甲醛0.007-0.028 15.6312-正戊基呋喃0.004-0.076醇类15.631乙醇0.0110.4110.771 20.578正戊醇0.0290.0900.530 27.549正己醇0.3320.5590.314 27.747正辛醇0.008-0.053 28.227壬醇0.011-0.075 28.410庚醇0.010-0.135
续表4
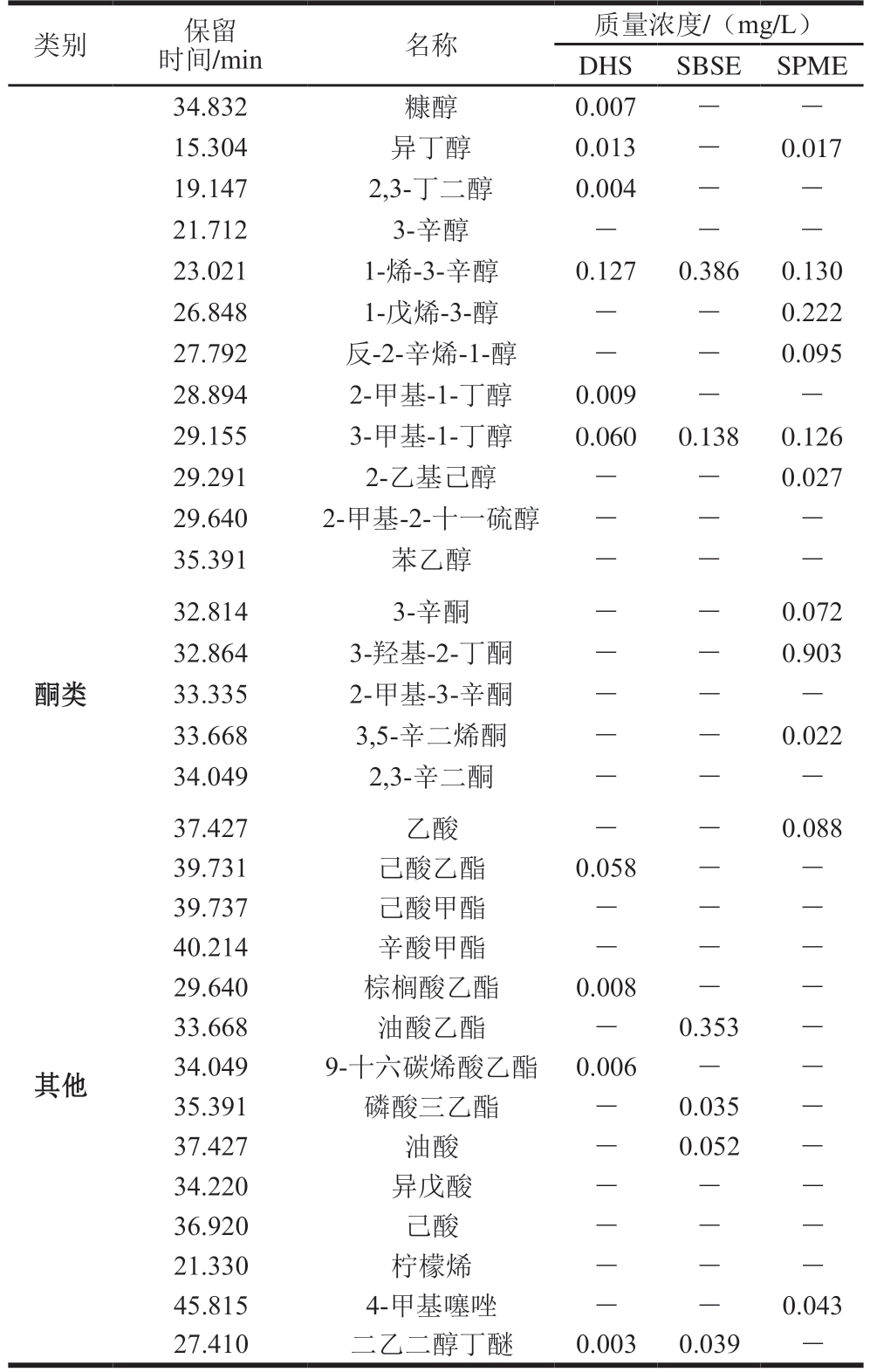
类别保留时间/min名称质量浓度/(mg/L)DHSSBSESPME 34.832糠醇0.007--15.304异丁醇0.013-0.017 19.1472,3-丁二醇0.004--21.7123-辛醇---23.0211-烯-3-辛醇0.1270.3860.130 26.8481-戊烯-3-醇--0.222 27.792反-2-辛烯-1-醇--0.095 28.8942-甲基-1-丁醇0.009--29.1553-甲基-1-丁醇0.0600.1380.126 29.2912-乙基己醇--0.027 29.6402-甲基-2-十一硫醇---35.391苯乙醇---酮类32.8143-辛酮--0.072 32.8643-羟基-2-丁酮--0.903 33.3352-甲基-3-辛酮---33.6683,5-辛二烯酮--0.022 34.0492,3-辛二酮---其他37.427乙酸--0.088 39.731己酸乙酯0.058--39.737己酸甲酯---40.214辛酸甲酯---29.640棕榈酸乙酯0.008--33.668油酸乙酯-0.353-34.0499-十六碳烯酸乙酯0.006--35.391磷酸三乙酯-0.035-37.427油酸-0.052-34.220异戊酸---36.920己酸---21.330柠檬烯---45.8154-甲基噻唑--0.043 27.410二乙二醇丁醚0.0030.039-
醛类被证实是干腌鱼的主要挥发性成分,是干腌鱼的独特风味成分之一。己醛在干腌鱼的总挥发性化合物中含量最高。己醛在这些挥发性醛类中占主导地位[23]。Zardin等[24]给出了相应的解释,称己醛是唯一由亚油酸酯的9-和13-氢过氧化物以及亚油酸酯氧化过程中形成的其他不饱和醛产生的醛类。大部分的线性醛来自于脂肪的氧化反应。在干腌武昌鱼中,壬醛和辛醛含量仅次于己醛,主要来自油酸、亚油酸、亚麻酸和花生四烯酸的分解。3-甲基丁醛主要由亮氨酸和异亮氨酸通过Ehrlich反应(Strecker降解路径)形成,仅在干制后的鱼肉中检出[25]。
干腌鱼肉中存在多种类型的醇类化合物。醇类通常来源于脂质氧化和糖类、氨基酸和羰基化合物的还原[26]。与饱和醇相比,不饱和醇的气味阈值较低,对干腌鱼的整体香气贡献更大[27]。1-辛烯-3-醇通常被描述为泥土味、蘑菇味、草味和鱼腥气味,它是由12-脂氧化酶氧化花生四烯酸形成的,1-戊烯-3-醇可能是由15-脂氧酶对EPA的作用形成的[28]。甲基支链醇可能来源于氨基酸Strecker降解[29]。据报道,1-戊醇和1-己醇在鱼产品的香气中起着重要作用,1-戊醇和1-己醇具有腥味[30]。
酮类化合物是氧化的最终产物之一[31]。干腌鱼的干燥过程会导致脂质降解,促进一些脂肪酮的形成[32]。然而,酮类气味阈值普遍较高,对鱼干的整体香气没有明显贡献[33]。酯类、酸类和杂环类挥发物有助于形成干腌鱼的独特风味。酯类通常由短链游离脂肪酸与醇的酯化作用或甘油三酯与乙醇的酯化作用形成[34]。
3 结 论
本研究通过对比不同萃取温度、SPME萃取探针、顶空瓶、色谱柱和不同萃取方式的分析条件,结合干腌鱼挥发性化合物的种类和峰面积对比干腌鱼的特征风味成分己醛、庚醛、辛醛、壬醛、1-戊烯-3醇、1-戊醇、己醇和1-辛烯-3醇对其分析条件进行优化。结果表明:较高的萃取温度更利于样品中的挥发性和非挥发性化合物被萃取,但同时也存在热反应产生的新挥发性化合物,所以选择萃取温度不易过高;三相SPME探针DVB/CAR/PDMS的萃取效果最好,根据化合物的极性与非极性能更好吸附样品中的挥发性化合物;顶空瓶的选择应当考虑样品的体积,本实验中固体干样的样品更适合于体积较大的顶空瓶,使得在顶空部分挥发性化合物能更好地被萃取;极性色谱柱能更好地分离干腌鱼中的挥发性化合物且有较好的重现性,干腌鱼样品中的主要挥发性风味物质醛、醇和酮能更好地被分理出来,其中DB-WAX色谱柱的检测结果中有较多的醛、醇类化合物,但能更有效检测样品中的挥发性化合物应当考虑结合使用极性色谱柱和非极性色谱柱;SPME、SBSE和DHS 3 种萃取方式萃取的挥发性化合物有显著差异,其中DHS萃取到的干腌鱼挥发性化合物种类最多,SBSE萃取到的挥发性化合物种类最少,SPME萃取挥发性风味物质最高效、快速。SPME和DHS更适用于干腌鱼挥发性化合物的萃取,但在风味分析中也应当结合使用多种萃取方式,更加准确地鉴定样品种的挥发性物质。
[1]林剑军, 赵文红, 刘巧瑜, 等. 脂质水解氧化对干腌鱼制品风味影响的研究进展[J]. 食品工业, 2021, 42(9): 206-210. DOI:10.11869/j.issn.100-8551.2018.07.1417.
[2]陈胜军, 张进伟, 吴燕燕, 等. 腌腊鱼加工技术及质量安全研究进展[J]. 南方水产科学, 2021, 17(1): 113-119. DOI:10.13995/j.cnki.11-1802/ts.023154.
[3]林剑军, 赵文红, 张琳, 等. 干腌马鲛鱼工艺和品质变化的研究[J]. 食品科技, 2021, 46(3): 116-124. DOI:10.13684/j.cnki.spkj.2021.03.021.
[4]张进杰. 中国南方传统腊鱼加工、品质及安全性研究[D]. 杭州:浙江大学, 2012: 18-19.
[5]聂小林. 食品风味分析技术研究进展[J]. 食品安全导刊, 2023(4):156-158. DOI:10.16043/j.cnki.cfs.2023.04.064.
[6]ROSZKOWSKA A, KLEJBOR I, BOGUSIEWICZ J, et al.Monitoring of age- and gender-related alterations of endocannabinoid levels in selected brain regions with the use of SPME probes[J].Metabolomics: Official Journal of the Metabolomic Society, 2023,19(4): 40. DOI:10.1007/S11306-023-02007-9.
[7]ROOSTAIE A, HADDAD R, MOHAMMADIAZAR S. Anilinenaphthylamine copolymer as the solid phase microextraction(SPME) fiber coating for the determination of chlorobenzenes by gas chromatography-mass spectrometry (GC-MS)[J]. Analytical Letters,2023, 56(8): 1338-1350. DOI:10.1080/00032719.2022.2129666.
[8]OMAROVA A, BAIMATOVA N, KAZEMIAN H. MOF-199-based coatings as SPME fiber for measurement of volatile organic compounds in air samples: optimization of in situ deposition parameters[J]. Microchemical Journal, 2023, 185: 108263.DOI:10.1016/j.microc.2022.108263.
[9]MARÍN-SAN R S, CAROT-SIERRA J M, SÁENZ U I, et al.Optimization of stir bar sportive extraction (SBSE) and multi-stir bar sportive extraction (mSBSE) to improve must volatile compounds extraction[J]. LWT-Food Science and Technology, 2022, 172: 114182.DOI:10.1016/j.lwt.2022.114182.
[10]LIU Chen, YANG Ping, WANG Haili, et al. Identification of odor compounds and odor-active compounds of yogurt using DHS, SPME,SAFE, and SBSE/GC-O-MS[J]. LWT-Food Science and Technology,2022, 154: 112689. DOI:10.1016/j.lwt.2021.112689.
[11]ZHAO Mu, LI Hongliang, ZHANG Dongjie, et al. Variation of aroma components of pasteurized yogurt with different process combination before and after aging by DHS/GC-O-MS[J]. Molecules, 2023, 28(4):152-168. DOI:10.3390/molecules28041975.
[12]NOR H K, NHAT L, RICHARD M S. Identification of VOCs from natural rubber by different headspace techniques coupled using GC-MS[J]. Talanta, 2019, 191: 535-544. DOI:10.1016/j.talanta.2018.09.019.
[13]徐永霞, 刘滢, 李学鹏, 等. 固相微萃取-气-质联用法测定大菱鲆鱼肉挥发性成分条件的优化[J]. 中国食品学报, 2014, 14(9): 233-238.DOI:10.16429/j.1009-7848.2014.09.006.
[14]杨雪玲, 王彩霞, 白婵, 等. 加州鲈挥发性物质分析方法的建立与分析[J]. 食品工业科技, 2020, 41(24): 237-244; 297. DOI:10.13386/j.issn1002-0306.2020030118.
[15]邹熙, 丁鹏霞, 李美萍. 不同萃取头及色谱柱对细叶韭花水提液易挥发性成分的影响[J]. 中国食品添加剂, 2023, 34(2): 246-254.DOI:10.19804/j.issn1006-2513.2023.02.031.
[16]张赫宇, 徐瑞, 李勇. 不同萃取头对橘子皮挥发性化合物的研究[J].现代食品, 2022, 28(6): 140-145. DOI:10.16736/j.cnki.cn41-1434/ts.2022.06.039.
[17]谢玉波. 浅析食品风味物质分离分析技术[J]. 科技展望, 2016,26(1): 140. DOI:10.3969/j.issn.1672-8289.2016.01.119.
[18]徐长毫, 曾小文. 不同内径色谱柱对多环芳烃的分离效果研究[J].宜春学院学报, 2022, 44(12): 35-38.
[19]曹玲燕, 杨志勇, 李志军. 在线气相色谱柱柱效判断与自修复装置系统[J]. 电气技术与经济, 2022(6): 101-104; 122. DOI:10.3969/j.issn.1008-6145.2008.06.027.
[20]樊靓. 新型毛细管气相色谱固定相及固相微萃取纤维的研究[D].北京: 北京理工大学, 2014: 23-24.
[21]周伟, 夏超, 于琪琪. 气相色谱柱固定相材料及其在食品检测中的应用[J]. 食品科学, 2014, 35(5): 178-183. DOI:10.3969/j.issn.1671-2226.2015.06.504.
[22]李伟. 两亲性杯芳烃衍生物用作气相色谱固定相的研究[D]. 沈阳:沈阳工业大学, 2022: 45-46.
[23]SHAHIDI F, PEGG R B. Hexanal as an indicator of the flavor deterioration of meat and meat products[M]//Lipids in Food Flavors.1994: 256-279. DOI:10.1111/j.1745-4522.1994.tb00245.x.
[24]ZARDIN E, SILCOCK P, SIEFARTH C, et al. Dynamic changes in the volatiles and sensory properties of chilled milk during exposure to light[J]. International Dairy Journal, 2016, 62: 35-38. DOI:10.1016/j.idairyj.2016.07.005.
[25]LEE J H, MIN D B. Changes of headspace volatiles in milk with riboflavin photosensitization[J]. Journal of Food Science, 2009, 74(7):C563-8. DOI:10.1111/j.1750-3841.2009.01295.x.
[26]DALSGAARD T K, SØRENSEN J, BAKMAN M, et al. Lightinduced protein and lipid oxidation in low-fat cheeses: whey proteins as antioxidants[J]. Dairy Science and Technology, 2011, 91(2): 171-183. DOI:10.1007/s13594-011-0001-1.
[27]TIMM-HEINRICH M, SKALL NIELSEN N, XU X, et al. Oxidative stability of structured lipids containing C18:0, C18:1, C18:2, C18:3 or CLA in sn2-position-as bulk lipids and in milk drinks[J]. Innovative Food Science and Emerging Technologies, 2004, 5(2): 249-261.DOI:10.1016/j.ifset.2003.08.006.
[28]MAZHAR S, KILCAWLEY K N, HILL C, et al. A systems-wide analysis of proteolytic and lipolytic pathways uncovers the flavorforming potential of the gram-positive bacterium Macrococcus comedolytics subsp. comedolytics[J]. Frontiers in Microbiology, 2020,11: 1533. DOI:10.3389/fmicb.2020.01533.
[29]LOPEZ-PEDROUSO M, PEREZ-SANTAESCOLASTICA C,FRANCO D, et al. Molecular insight into taste and aroma of sliced dry-cured ham induced by protein degradation undergone highpressure conditions[J]. Food Research International, 2019, 122: 635-642. DOI:10.1016/j.foodres.2019.01.037.
[30]IGLESIAS J, MEDINA I, BIANCHI F, et al. Study of the volatile compounds useful for the characterization of fresh and frozen-thawed cultured gilthead sea bream fish by solid-phase microextraction gas chromatography-mass spectrometry[J]. Food Chemistry, 2009, 115(4):1473-1478. DOI:10.1016/j.foodchem.2009.01.076.
[31]LI W, CHEN Y P, BLANK I, et al. GC × GC-TOF-MS and GC-IMS based volatile profile characterization of the Chinese dry-cured hams from different regions[J]. Food Research International, 2021, 142:110222. DOI:10.1016/j.foodres.2021.110222.
[32]MORETTI V M, VASCONI M, CAPRINO F, et al. Fatty acid profiles and volatile compounds formation during processing and ripening of a traditional salted dry fish product[J]. Journal of Food Processing and Preservation, 2017, 41(5): 13133. DOI:10.1111/jfpp.13133.
[33]CHANG Hong, WANG Ying, XIA Qiang, et al. Characterization of the physicochemical changes and volatile compound fingerprinting during the chicken sugar-smoking process[J]. Poultry Science, 2021,100(1): 377-387. DOI:10.1016/j.psj.2020.09.059.
[34]IGLESIAS J, MEDINA I. Solid-phase microextraction method for the determination of volatile compounds associated to oxidation of fish muscle[J]. Journal of Chromatography A, 2008, 1192(1): 9-16.DOI:1111.1750/j.3841-2008.00764.x.