四环素类抗生素于20世纪40年代末被发现,在20世纪60—70年代即被广泛应用。四环素类抗生素中四环素(tetracycline,TC)、金霉素(chlorotetracycline,CTC)和土霉素(oxytetracycline,OXY)具有广谱、经济、使用方便等特点,为兽医临床所常用。
TC是一种酸碱两性化合物,分子结构中存在酚羟基、烯醇羟基、二甲氨基等基团(图1)[1],是一种价格低廉、用途广泛的广谱抗生素[2],抗菌能力强、效果好。TC作为常用的兽药,可加速畜禽生长、预防疾病发生,在养殖中被广泛应用[3-4]。然而,TC很难被自然降解[5-6],若未合理应用可能残留在环境和食品中[7-8],通过食物链到达人体,从而对健康构成威胁。例如,TC可能会诱发过敏反应;TC和钙结合生成的黄色复合物会沉积在牙冠上,使牙齿着色,形成四环素牙[9];TC在肝脏中聚集,会影响正常代谢能力[10],严重时会导致癌症。故开发四环素类抗生素检测方法在保障人类健康领域意义重大。
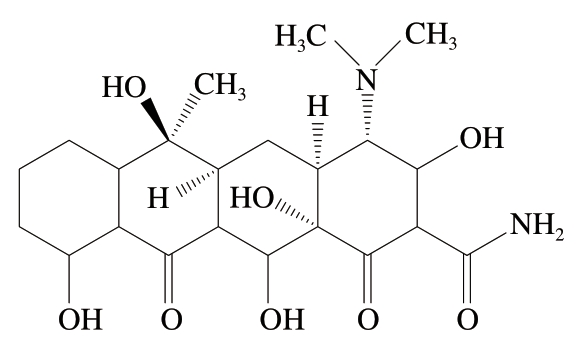
图1 TC分子结构式
Fig. 1 Molecular structure formula of TC
为了遏制四环素类抗生素滥用的现象,2020年我国农业农村部发布公告,禁止把CTC、OXY用作饲料添加剂[11];GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》中明确规定四环素类抗生素在畜产品中使用时应制定最大残留限量。比较分析我国与欧盟和食品中兽药残留分法典委员会(Codex Committee on Residues of Veterinary Drugs in Foods,CCRVDF)等不同标准中不同种类动物源性食品中TC限量,结果发现我国与欧盟标准较为接近,与CCRVDF标准存在较大差异,如表1所示。
表1 不同标准中不同种类动物源性食品中TC限量对比
Table 1 Comparison of limits specified in different standards for TC in different types of animal-derived food μg/kg
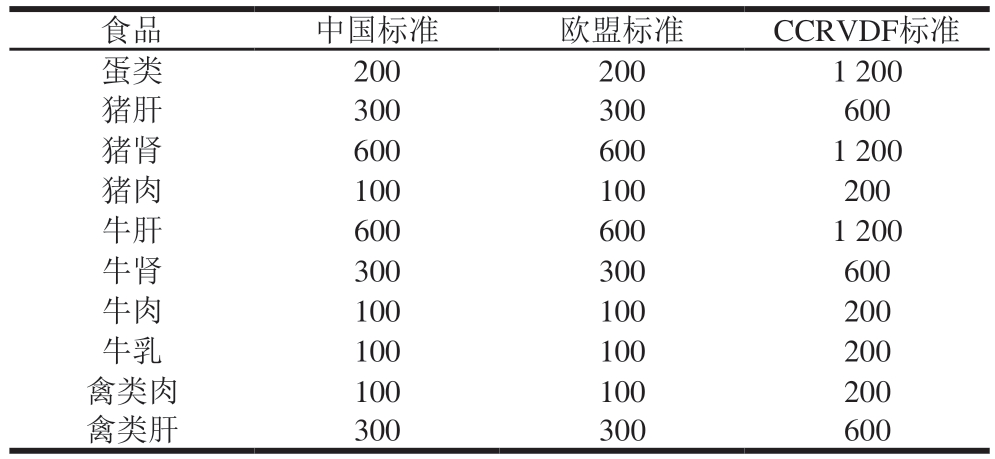
注:数据来源:GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》[12];欧盟《Commission Regulation(EU)2017/880》[13];CCRVDF第11~14次会议报告[14-17]。
食品中国标准欧盟标准CCRVDF标准蛋类2002001 200猪肝300300600猪肾6006001 200猪肉100100200牛肝6006001 200牛肾300300600牛肉100100200牛乳100100200禽类肉100100200禽类肝300300600
目前已开发出TC的多种检测方法。传统TC检测方法有比色法[18]、酶联免疫法[19-20]、微生物法、层析法、薄层色谱法[21]、高效液相色谱法[21-22]、色谱-质谱联用法[23]及毛细管电泳法[24]等,这些方法已十分成熟。其中,比色法和酶联免疫法检测效率高,但灵敏度较低,且需对样品进行预处理[25];微生物法检测成本低、检测范围广,但检测周期长;高效液相色谱法与色谱-质谱联用法选择性强,但检测费时、设备昂贵;毛细管电泳法检测效率高、对样品影响小,但同时也存在体系毒性大等缺点。
为了更高效地检测TC,研究者们开始关注荧光探针技术。荧光探针技术是一种利用探针化合物的光特性检测目标分子的方法,本质是通过体系荧光信号的变化来检测分析物。TC与荧光探针之间存在相互作用,基于不同相互作用可构建出不同检测方法,如荧光增强法、荧光猝灭法及比率荧光法[4]。相较于其他检测方法,荧光检测方法灵敏度高、选择性强、检测时间短。纳米荧光探针的荧光强度高、光稳定性好,具有小直径效应,这些优势有助于其实现对TC的检测。
纳米荧光材料在包括TC在内的兽药残留检测中已有广泛应用。孟丽华等[26]综述2017年前水产品中TC残留的前处理方法及仪器检测方法等研究进展,同时详细介绍TC对渔业环境的影响,为渔业水质中四环素类抗生素残留检测方法的开发及限量标准的制定提供了重要参考。池思婷等[4]综述2020年前基于纳米材料对TC的光学传感检测方法,包括比色法、表面增强拉曼光谱法、荧光检测法、电致化学发光法,并重点讨论了基于荧光分析法检测TC的研究进展,对TC光学传感器的发展方向进行了展望。随着科技的进步,2021—2023年纳米荧光材料得到了快速发展,因此本文对近年来的研究进展进行进一步的补充综述。
本文对常见的纳米荧光探针进行分类,着重概述基于纳米荧光探针的TC快速检测方法及其在食品基质中的应用,并对TC荧光快速检测的发展方向进行展望,以期为建立灵敏、快速的食品体系中TC检测方法提供参考与借鉴。
1 基于量子点(quantum dots,QDs)的检测方法
随着纳米科技的不断发展革新,研究人员相继研发出多种形貌、直径各异的纳米材料,其中,QDs性能优异[27]。QDs又称为半导体纳米晶[28],是粒径为1~10 nm的零维纳米半导体材料,具有与天然原子与分子较为相似的限制电子及电子空穴的特性[29-30]。QDs能够发射特定频率的光,发光频率会受到材料直径的影响,因而通过调节QDs材料的直径就可以控制其发光频率。与其他纳米材料比较而言,QDs具有较高的量子产率、较窄且可调协的光致发光特性[31-32],因而在食品检测领域[33-34]已获得广泛的研究与应用。
1.1 碳量子点(carbon quantum dots,CQDs)
CQDs是一种新型荧光纳米碳材料,平均粒径在10 nm以下[35],在水中均匀分散,表面有丰富的氨基、羧基和羟基。由于CQDs表面富含羰基,当CQDs与TC相互作用时,荧光内滤效应(inner filter effect,IFE)使CQDs的荧光被TC所猝灭,从而导致CQDs内部荧光的变化。IFE是指当荧光体浓度较大或与其他吸光物质共存时,由于荧光体或其他吸光物质对于激发光或发射光的吸收而导致荧光减弱的现象[36]。2004年,在单壁碳纳米管分离纯化过程中,Xu Xiaoyou等[37]发现了CQDs,自此关于CQDs的研究蓬勃发展。作为新型纳米荧光探针,CQDs无光漂白现象,具有优良的光学性能、较低的生物毒性、较长的荧光寿命、优异的生物相容性、较低的制备成本、易于修饰的表面、较高的荧光强度、较强的光稳定性等优点[38-39],在食品检测等领域已得到广泛应用。
曹媛媛等[40]研究发现,在5 min内四环素类抗生素即可猝灭CQDs的荧光,且猝灭率与四环素类抗生素浓度在0.5~30.0 μmol/L和30~90 μmol/L范围内分别呈现较好的线性关系,并得到其检测限(limit of detection,LOD)为0.36 μmol/L。结果显示,食品基质中存在干扰时,CQDs也可以特异性检测四环素类抗生素,其选择性与灵敏度良好。在实际应用方面,在鸡蛋、牛乳、鸡肉等食品基质的加标检测实验中,CQDs显示出回收率较高、重复性良好的优点,另外因其操作简便、环境友好、灵敏度高、选择性好、检测效率高的优势,常作为一种纳米荧光探针被广泛应用。
表面钝化或掺杂亦可以进一步改善CQDs的性能。李义梅等[41]通过一步水热法制备得到氮掺杂碳量子点(nitrogen-doped carbon quantum dots,N-CQDs)。研究表明,在KH2PO4-NaOH缓冲溶液中,N-CQDs发出的荧光可被TC强烈猝灭,且N-CQDs的荧光猝灭强度与TC浓度在1.6~16.0 μmol/L和16~100 μmol/L时均显示出比较理想的线性响应关系,LOD为0.45 μmol/L。该研究构建了一种利用N-CQDs对TC进行快速检测的方法,将该检测方法应用于测定四环素片中的TC含量,得到了理想的回收率,为98.4%~102.0%。Fan Yao等[42]建立了一种基于S,N掺杂碳量子点(sulfur, nitrogen-doped carbon quantum dots,S,N-CQDs)的新型荧光探针,可用于快速检测四环素类抗生素(图2)。通过IFE,QDs荧光可以被四环素类抗生素有效猝灭。在最佳条件下,TC浓度在1.88~60.00 μmol/L与S,N-CQDs荧光强度的变化具有良好的线性关系,LOD为0.56 μmol/L。此外,此检测方法可用于快速、准确地量化牛乳、蜂蜜和自来水中的四环素类抗生素残留量,回收率为93.61%~102.31%。
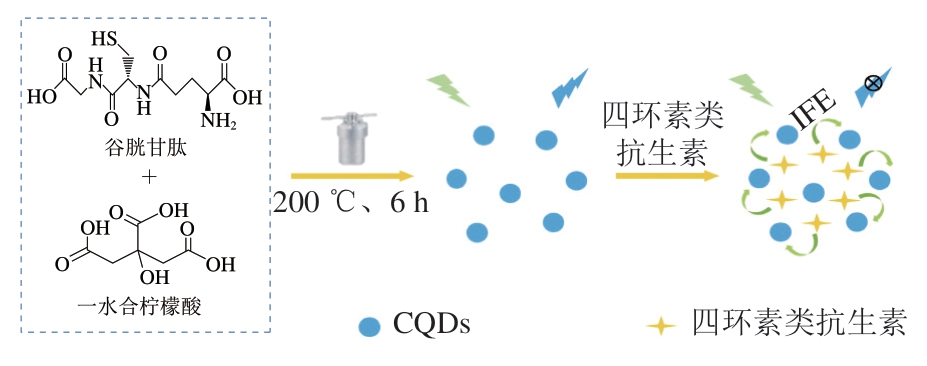
图2 S,N-CQDs合成和反应示意图[42]
Fig. 2 Schematic diagram of the synthesis and reactions of S,N-CQDs[42]
1.2 二硫化钼量子点(molybdenum disulfide quantum dots,MoS2 QDs)
二硫化钼(molybdenum disulfide,MoS2)是一种过渡金属硫族化合物,具有类石墨烯结构,是一种间接带隙材料,具有优异的化学稳定性。单层MoS2由硫-钼-硫3 层原子依靠较弱的范德华力结合,当其尺寸小于10 nm时被称为MoS2 QDs。因MoS2 QDs具有许多与量子约束和边缘效应相关的新光学性质[41],其在荧光检测领域具有一定应用潜力。
Wang Zhuosen等[43]以谷胱甘肽和L-半胱氨酸作为硫前体,通过水热法开发了发光的MoS2 QDs。TC存在时MoS2 QDs的发射强度显著降低,即TC诱导了MoS2 QDs的荧光猝灭,在365 nm波长光激发下人眼可以清楚捕捉到体系荧光的变化。TC浓度1~100 μmol/L时实验得到良好的线性相关性,LOD为7.86 μmol/L。Jia Pei等[44]通过环境水热反应,以钼酸钠(Na2MoO4·2H2O)和谷胱甘肽为前体,制备出发射蓝色荧光的二硫化钼纳米材料(molybdenum disulfide nanoplates,MoS2 NPs),之后基于MoS2 NPs构建了一种检测TC的新型猝灭荧光传感器(图3)。对比已有的报道,该研究提供了一种切实可行的合成途径,所制备的MoS2 NPs分散性好、贮藏稳定性好、量子产率高。在加入TC后,MoS2 NPs有明显的荧光猝灭,这是由于TC和MoS2 NPs之间IFE和光诱导电子转移(photoinduced electron transfer,PET)的协同作用。研究结果表明,MoS2 NPs的荧光比(F0/F)在0~50 μmol/L与TC浓度呈线性关系。该TC检测策略表现出操作简单、LOD低、特异性强、选择性强的优势,基于上述优势,该荧光探针已被很好地应用于检测实际样品,在加标牛乳、乳粉和牛肌肉样品中的LOD低至0.032 μmol/L,回收率为88.46%~108.62%。
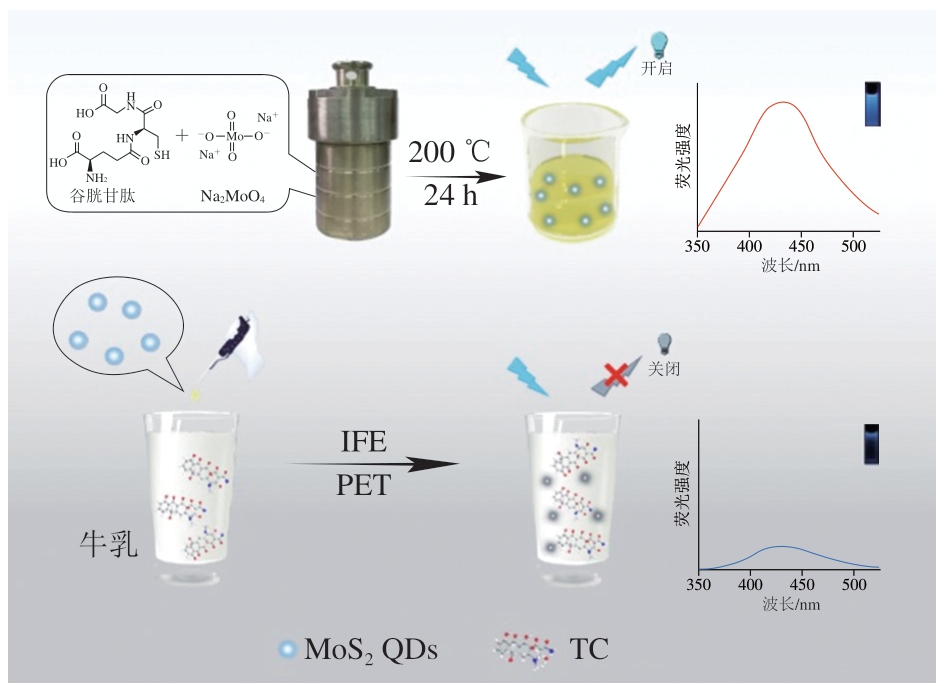
图3 通过水热处理形成MoS2 NPs的过程和检测TC的传感策略的说明[44]
Fig. 3 Illustration of the formation process of MoS2 NPs by hydrothermal treatment and sensing strategy for the detection of TC[44]
Liang Nini等[45]开发了一种用于检测TC的双信号荧光探针,体系重复性和稳定性良好。实验合成了具有蓝色荧光的MoS2 QDs和具有黄色荧光的碲化镉量子点(cadmium telluride quantum dots,CdTe QDs),建立了基于MoS2/CdTe QDs的荧光探针,体系在433 nm和573 nm波长处有2 个荧光发射峰。随着TC的加入,MoS2/CdTe QDs的荧光被PET所猝灭,CdTe QDs的荧光比MoS2 QDs猝灭得更明显。PET是指在光的诱导下,电子进行分子内或分子间转移的现象。当入射光照射探针分子,由于电子从供体转移到激发态荧光团,供体分子不发射或仅发射微弱荧光。当探针与分析物结合后,光诱导的电子转移被阻断,荧光团就会恢复荧光发射。实验在0.1~1.0 μmol/L的TC浓度与体系在573 nm和433 nm波长处的荧光强度比之间建立了校准曲线。此外,该双信号传感器被应用于牛乳样品中,TC检测回收率为95.53%~104.22%,相对标准偏差(relative standard deviation,RSD)<5%,显示出较大的应用潜力。
1.3 硅量子点(silicon quantum dots,SiQDs)
Liu Zhenping等[46]制备了一种基于SiQDs的新型快速灵敏荧光探针,可用于选择性检测TC残留物。实验通过简便的单锅无溶剂法制备了SiQDs。在水溶液中,Cu2+和SiQDs复合,SiQDs的荧光在一定程度上被猝灭。四环素类抗生素可以在早期与Cu2+结合并防止SiQDs荧光猝灭,因此体系可以实现对四环素类抗生素的定量筛选,并且对四环素类抗生素具有高度选择性。以CTC为代表,在优化条件下,CTC浓度在11.32~1 086.72 nmol/L时呈现理想的线性响应,对CTC的LOD为0.92 nmol/L。该探针已被成功地应用于加标蜂蜜样品中CTC和实际蜂蜜样品中四环素类抗生素的测定,结果表明,该探针的选择性、重现性和稳定性良好,可以成为用于四环素类抗生素分析的有前途的传感平台。
1.4 氮化硼量子点(boron nitride quantum dots,BNQDs)
为实现对于四环素类抗生素的检测,贾珮等[47]基于BNQDs和铕离子(Eu3+)构建了一种比率荧光检测体系。比率荧光探针通常有2 个不同的荧光发射波长,以同样环境下测定的2 个波长处荧光强度的比值作为信号参量,通过2 个发射波长的自校准抵消因环境、样品本身及仪器设备等因素引起的数据失真,从而消除背景干扰,减小测试误差,得到更准确的结果[48],这种检测体系即为比率荧光检测体系。贾珮等[47]通过水热法合成BNQDs,合成原料为硼酸和尿素。稀土金属-有机框架中有机配体的生色团通过配体到金属中心的能量传递来调节电子能量跃迁,从而引起强烈的荧光发射,这种现象称之为天线效应(antenna effect,AE)。由于IFE与AE 2 种原理具有协同作用,当向BNQDs-Eu3+的混合体系中加入四环素类抗生素时,BNQDs的蓝色荧光猝灭,而Eu3+的红色荧光增强。该体系对TC、OXY和多西环素(doxycycline,DOX)的LOD分别为0.019、0.104、0.028 μmol/L。将该检测体系应用到牛乳和牛肉等实际样品中,检测性能良好。
1.5 氧化钨量子点(tungsten oxide quantum dots,WxOy QDs)
Wang Xin等[49]通过自下而上的化学合成策略成功制备了新型WxOy QDs荧光纳米探针,该探针在365 nm紫外光下呈现出强烈的蓝色荧光。加入TC后,WxOy QDs的蓝色荧光被猝灭,推测该现象是由于荧光纳米探针与TC分子的萘基骨架之间发生了随机碰撞和相互作用,从而产生了IFE、荧光共振能量转移(fluorescence resonance energy transfer,FRET)效应和PET协同作用。WxOy QDs荧光纳米探针被证实具有毒性低、稳定性高、荧光响应强和水分散性优良的优点,可用于检测食品样品中的TC,其定量限(limit of quantitation,LOQ)和LOD分别为0.064、0.019 μmol/L。与已有研究相比,该方法的LOD较低,检测范围具有可比性,可广泛应用于测定动物源性食品中的TC含量。此外,实验将构建出的探针用于检测牛乳和乳粉中的TC,得到了良好的回收率。
1.6 钙钛矿量子点(perovskite quantum dots,PQDs)
PQDs是一种无机半导体纳米晶体,通常用结构通式ABX3表示,其中,A通常代表一价阳离子(如Cs+、Rb+、CH3NH3+等),B通常代表二价金属阳离子(如Pb2+、Sn2+、Mn2+、Ge2+等),X则通常为负一价卤素离子(如Cl-、Br-、I-等)。作为纳米荧光探针,PQDs具有低LOD、现象易于观察的优点,在食品分析领域具有巨大的应用潜力,近几年已有许多研究人员致力于将其应用到食品分析领域。
Xu Jun等[50]在过氧化物纳米晶体CsPbBr3@Cs4PbBr6中掺入Eu络合物,制备出一种新型荧光传感器,该传感器在复杂体系中对TC的识别能力强,抗干扰能力好。当实际环境中存在残留的TC时,TC可以与Eu结合,通过AE激发616 nm的红色荧光。同时,由于PET效应,钙钛矿本身的荧光也会逐渐减弱。因此,可选择该传感器作为参考信号来实现TC的多色荧光感应。与常见的单一荧光信号分析方法相比,钙钛矿-稀土混合纳米探针具有丰富的荧光颜色变化,可以显著提高视觉评估的分辨率。该研究结果表明,在0~5、5~25 μmol/L的线性区间内,TC的添加量与616、520 nm波长处的荧光特征峰强度比呈现良好的正相关性,LOD为12.1 nmol/L。此外,该研究还进一步设计了一种可实现TC快速视觉检测的便携式可穿戴设备,并将其成功应用于苹果样品检测。
1.7 半导体量子点
Han Lei等[51]设计了一种比率荧光检测方法,使用类石墨相氮化碳(graphitic carbon nitride,g-C3N4)纳米片与Eu3+耦合来检测TC(图4)。在该检测方法中,Eu3+与g-C3N4纳米片都可以与TC发生相互作用,g-C3N4纳米片的蓝色荧光可以基于IFE原理而被TC猝灭,Eu3+的红色荧光可以基于AE原理被TC增强。由TC引起的AE和IFE的协同效应使得检测体系颜色有明显的从蓝到红的转变,对TC浓度显示出0.25~80.00 μmol/L的宽线性范围,LOD为6.5 nmol/L。该方法已成功应用于实际牛乳基质中。鉴于该方法具有易于操作、选择性好、灵敏度高和颜色变化可识别等优点,为对TC进行可视化的检测,该研究开发出一款包括智能手机和基于试纸的检测两方面的医疗点检测系统,这种集成的做法大大提高了检测效率,为TC的现场定性鉴别和半定量检测提供了一种有前景的思路。
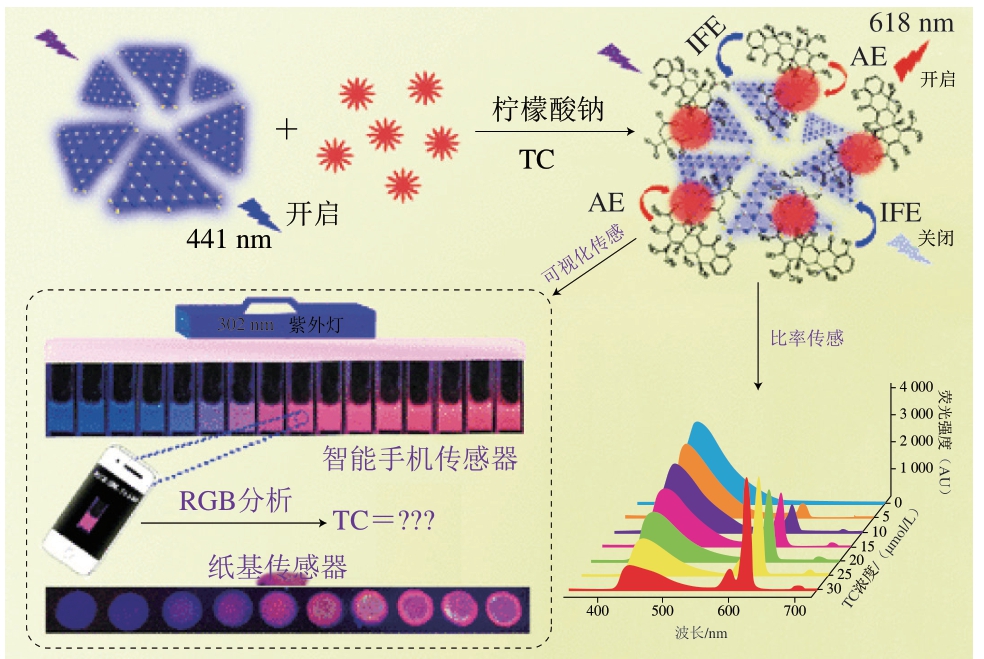
图4 g-C3N4纳米片与Eu3+耦合检测TC[48]
Fig. 4 g-C3N4 nanosheets coupled to Eu3+ for TC detection[48]
以上各种量子点荧光检测体系均实现了水溶液体系中的TC检测,通过肉眼即可观察到体系显著的荧光颜色变化,有效实现了TC检测。但由于QDs本身具有不稳定性[52],因此其检测方法有待于进一步深入研究。大多数QDs已被证实存在干扰时对TC的特异性较强,但也有少数QDs只能对四环素类抗生素中的某些抗生素进行特异性检测。值得一提的是,基于BNQDs的比率荧光检测体系对四环素类抗生素中TC、OXY和DOX具有良好的选择性。因此,综合来看在后续研究中可以进一步思考如何实现不同四环素类抗生素的高选择性检测。
2 基于贵金属纳米团簇的检测方法
贵金属纳米团簇[53]是由少量至数十个金属原子(如Au、Ag或Pt)聚集而成的一种荧光和水溶性较好的分子聚集体,大小和费米波长相近,大多表现出和半导体相似的性质,能产生特殊的能级分离,亦可在某一波长的激发作用下发出荧光。贵金属纳米团簇检测TC的原理为金属荧光增强(metal-enhanced fluorescence,MEF)。MEF是一种荧光基团在金属纳米粒子表面附近发生荧光增强的现象。目前已有许多文献使用金属纳米团簇来进行荧光分析,在这些纳米团簇中,由于金纳米团簇是由几个到几十个金原子组成的,直径较小,一般不超过2 nm,其接近电子在费米能级的德布罗意波长,从而引发强烈的量子直径效应,使其呈现出比较优异的荧光性能[54],从而更容易产生MEF。与传统荧光探针相比,贵金属纳米团簇制备简便,具有特殊的物理与化学性质,可作为荧光探针被广泛用于食品检测,近年来受到广泛关注。
2.1 金纳米团簇(gold nanoclusters,AuNCs)
AuNCs与传统的、大直径且带有等离子体共振效应的金纳米颗粒(aurum nanoparticles,AuNPs)相比,在特定波长光线激发下会发出更强的荧光,表现出更优异的光致发光特性、生物相容性及易修饰表面等,在食品检测领域得到了广泛应用。使用不同制备材料或制备方法可获得不同类型AuNCs,由于AuNCs直径较小,各种类型之间的区别一般表现在荧光特性上。单一AuNCs在实际中的应用受到一定限制,为扩大AuNCs应用领域、丰富AuNCs使用功能,AuNCs也可通过和其他纳米材料组装或缀合来获得性能优异的荧光纳米复合探针[45]。
Albanese等[55]以蛋白质、氨基酸、DNA序列为模板分别合成了具有较好发光性能的AuNCs,再在四环素-铕(europium tetracycline,EuTC)中添加来自不同模板的AuNCs,结果显示,EuTC荧光强度发生了一定增强。为了进一步研究这些分子之间的相互作用对荧光特性的影响,实验利用单链DNA为模板合成AuNCs,并发现其荧光增强效果最明显,由此构建了以EuTC为载体、AuNCs为荧光增强剂的检测体系。利用该荧光增强系统对TC进行分析检测,增强后荧光强度与TC浓度在10 nmol/L~5 μmol/L呈线性关系,LOD达到4 nmol/L。本方法具有灵敏度高、选择性强、检测效率高等特点,已成功应用于牛乳中TC含量的测定。
Yang Xiaoming等[56]在AuNCs和Eu3+-TC复合物(Eu3+-tetracycline complex,Eu3+-TC)基础上建立了一种荧光增强系统。为了探索可能影响该系统的各种条件,采用3 种类型的AuNCs,结果表明,除了DNA置换的AuNCs外,其他AuNCs均不能引起EuTC的荧光增强,这种DNA置换的AuNCs的检测范围为0.01~5.00 μmol/L,LOD为4 nmol/L。此外,该方法已被成功应用于牛乳样品中TC的检测,具有简单、灵敏和低成本的优势。
2.2 银纳米团簇(silver nanoclusters,AgNCs)
因AgNCs具有良好的物理、化学、光学和电学性质,尤其是具有优异的水溶性、光稳定性、生物相容性以及斯托克斯位移大和发射效率高等优点,近年来,其引起了很多研究人员的关注,已成为分析化学领域的研究热点。
聚集诱导发光(aggregation-induced emission,AIE)机制为染料分子在分散态下荧光强度很弱甚至难以观测,而在聚集态下荧光强度却出现明显的增强。AIE是一种与基团聚集有关的光物理现象,在AIE过程中,非发色性发光体通过聚集形成而被诱导发光。AIE原理的应用引发一系列领域的新发展,近年来受到广泛关注,其中传感器研究备受重视[57]。吕玫[58]以N-乙酰基-L-胱氨酸(N-acetyl-L-cysteine,NAC)作为配体,利用加热回流法制备荧光AgNCs,并根据不同传感机制构建TC荧光检测方法。实验以硝酸银(silver nitrate,AgNO3)为原料,NAC为保护性配体和还原剂,通过回流法成功合成了具有AIE性质的银纳米团簇(NAC@AgNCs)。实验基于TC和AgNCs之间的IFE和静电猝灭机理,建立了一种TC检测的灵敏度高、选择性强的方法,检测线性范围为1.12~230.00 μmol/L,LOD为0.47 μmol/L。目前,NAC@AgNCs纳米荧光探针已成功用于检测实际牛乳样品中TC的含量。
2.3 铜纳米团簇(copper nanoclusters,CuNCs)
贵金属纳米团簇具有合成简便、化学性质稳定等优点,已被广泛应用于食品分析检测领域,而CuNCs也是一种发展前景非常广阔的纳米荧光探针。
Guo Yuyu等[59]通过化学还原合成了在抗坏血酸溶液中稳定的CuNCs(ascorbic acid stabilized CuNCs,AACuNCs),结果表明,AA-CuNCs性质稳定,单分散性好、荧光强度强,其荧光可以被TC通过IFE机制选择性有效猝灭,比率荧光值与TC浓度在0.9~70.0 μmol/L和80~150 μmol/L有极好的线性关系。利用AA-CuNCs检测真实水样中的TC,得到的回收率为99.00%~100.23%,证明了AA-CuNCs在检测领域的应用潜力,此方法对于实际样品适用性很高。
包芷君[60]以铜掺杂硫化锌量子点(cuprum@zinc sulphide quantum dots,Cu@ZnS QDs)为比率荧光探针,基于金属离子对Zn原子的强烈配位作用,对TC进行检测。实验采用一步水热合成法获得Cu@ZnS QDs,并将其提纯用作荧光探针;探针于578 nm有一发射峰,添加TC,探针荧光猝灭,520 nm时体系荧光增强,光谱中可见显著蓝移;紫外灯照射下可见探针溶液颜色随TC添加从橙黄色转变为绿色,这一现象可为可视化检测提供基础;基于光谱中强度的变化对荧光强度比和TC浓度进行标准曲线拟合,在0.4~1.8 mmol/L有较好的线性关系,R2=0.981,LOD为61 nmol/L;选择性实验证明仅有四环素类抗生素能和探针发生绿色荧光,并且同一类抗生素间结构存在差异,生成的发射峰也不相同,所以该检测体系具有TC特异性。
CuNCs虽然具有很多优点,如Cu储量比较丰富,廉价易得,所制备的CuNCs种类繁多等,但是其同时具有稳定性较差和易于氧化的缺点,从而制约了CuNCs更加广泛的使用[61]。
2.4 金铜纳米团簇复合探针
Khataee等[62]设计了一种新型的金银铜纳米团簇(aurum copper nanoclusters,AuCuNCs)-金属有机框架(metal organic framework,MOF)(AuCuNCs@MOF)双发射荧光探针,用于TC的比率测定,该探针是封装到沸石咪唑酯骨架8(zeolitic imidazolate framework-8,ZIF-8)中的AuNCs和CuNCs(图5)。在400 nm激发波长下,AuCuNCs@MOF在520 nm和650 nm波长处显示2 个发射峰,分别来自AuNCs和CuNCs。添加TC后,体系在615 nm波长处的红色发射强度显著降低,而在520 nm波长处的绿色发射强度几乎保持不变,肉眼可观察到体系荧光颜色出现从红到绿的明显变化。荧光比对TC浓度的对数在20~650 nmol/L表现出令人满意的线性关系,LOD为4.8 nmol/L。为了研究此方法的适用性,将实验设计的探针应用于检测生牛乳和巴氏杀菌牛乳样品中的TC浓度,获得了很好的结果(回收率为98.0%~101.7%,RSD<0.8%),证实了AuCuNCs@MOF在生物样品分析中的应用前景广阔。
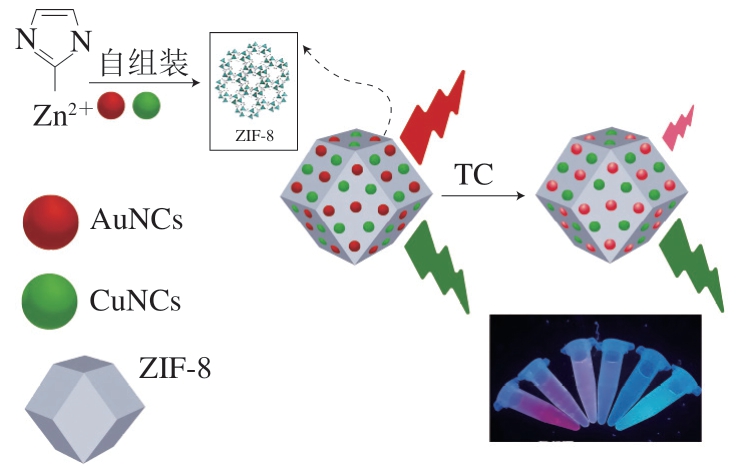
图5 使用AuCuNCs@MOF探针测定TC[59]
Fig. 5 Determination of TC using AuCuNCs@MOF probe[59]
在以上采用贵金属纳米团簇的荧光检测方法当中,TC和纳米团簇之间要经过较长的反应时间才能够实现荧光猝灭效率的最大化,因此进一步降低荧光猝灭的时间和提高检测效率或许是今后该方向上的一个研究热点。基于贵金属纳米团簇的检测方法仅能实现对TC的特异性检测,因此在后续研究中可以对实现多种四环素类抗生素的高选择性进行探索和思考。
3 基于MOFs的检测方法
MOFs是一种金属离子或金属簇以配位键与有机配体结合形成的多孔网状结构杂化材料,它是一种配位实体重复且空隙较大的配位化合物,比表面积较大、孔径易于调节,结构多样且表面修饰效果良好[63-64]。构成这类材料的常见金属有Zn、Cr、Co、Ni、Cu、Ag、Al和碱金属等,与金属配位的配体通常是羧类、唑类、磷酸酯类等有机分子[65]。MOFs作为新兴热门前沿材料,在荧光检测方向有很好的前景。
目前,已有多种成熟的方法可用于合成形貌各异、种类繁多的MOFs,如拉瓦锡材料研究所(Material Institute of Lavoisier,MIL)的MOFs MIL-53、MIL-88和MIL-101[66-68];ZIF类MOFs ZIF-8、ZIF-9和ZIF-67等[69-70];香港科技大学研制的一种经典三维多笼多孔网络结构的MOF:HKUST-1[71];单金属系列的MOFs:Cu-MOFs、Co-MOFs、Fe-MOFs和Ce-MOFs等[72-75];此外,还有其他复合MOFs[76]等。
徐方红[77]建立了一种超灵敏的四环素类抗生素荧光检测方法,通过水热法合成锌基MOFs(zinc-MOFs,Zn-MOFs),发现Zn-MOFs自身不具有荧光发射,当四环素类抗生素添加到Zn-MOF水溶液中后,四环素类抗生素和Zn配位并限制于Zn-MOFs孔道内,产生AIE现象,从而发出明显的黄色荧光。TC、OXY、CTC和地美环素(demecycline,DMCT)均能使Zn-MOFs产生荧光,因此Zn-MOFs可以用于水溶液中四环素类抗生素的荧光检测。在最适条件下进行荧光检测,随着OXY浓度在0~15 μmol/L增加,520 nm波长处出现的发射峰荧光强度也逐渐增加。在0.02~13.00 μmol/L比率荧光强度的变化与OXY的浓度线性关系良好,LOD为0.017 μmol/L,远低于欧盟和美国食品药品监督管理局分别制定的牛乳中四环素类抗生素的最大残留量225 nmol/L和676 nmol/L。该方法为荧光MOFs的制备及水溶液中污染物的检测提供了新思路。与传统猝灭性荧光探针相比,Zn-MOFs荧光探针具有更高的灵敏度、更低的LOD和更宽的线性范围。实际样品实验表明,Zn-MOFs荧光探针对实际样品蜂蜜、牛乳的检测效果与实验室条件对去离子水的检测效果一致,能有效地避免共存离子、有机污染物及其他物质的干扰,从而验证该探针对实际样品检测OXY具有优良选择性和准确可靠性。汪嘉炎等[78]以发光铜基MOFs纳米材料(cuprum-MOFs,Cu-MOFs)为研究对象,构筑了TC检测的新途径,通过水热法一步合成Cu-MOFs探针,添加TC后,IFE使Cu-MOFs荧光猝灭。本方法检测范围为0~60 μmol/L,LOD为33.33 nmol/L,小于中国、美国及欧盟标准。另外,该方法具有良好的选择性,且不受其他常见抗生素及金属离子干扰。在实验当地河水中检测TC,其加标回收率为96.17%~105.02%。
镧系MOFs(lanthanide MOFs,Ln-MOFs)也因其颜色纯度高、斯托克斯位移大、光谱非重叠和发射特征带窄等优势而受到高度重视。同时,Ln-MOFs的孔隙率对抗生素的检测也具有重要意义,因为其产生了高比表面积,富集了痕量的残留分析物,使信号增强、检测灵敏度提高。Li Runxian等[79]开发了一种发光镧系金属有机材料Tb-L1,对TC、CTC、OXY和DOX具有高选择性和灵敏度。由于分析物之间的指纹关系以及镧系元素与配体的发射峰高比具有良好的对应关系,Tb-L1可以有效地将CTC、OXY和DOX与TC区分开。基于IFE效应,Ln-MOFs的H3L1和Tb3+之间的能量转移效率可以调节,Tb-L1探针对检测TC、CTC、OXY和DOX具有高选择性。这些发现预示着Ln-MOFs可以用作一个非常有前途的平台,为开发用于检测抗生素的比率荧光探针提供了动力。Chen Jing等[80]合成了掺杂Eu3+的纳米复合材料与NH2-MIL-53(Al)纳米片(图6),开发了一种具有比率荧光的检测方法。添加TC后,Eu3+作为响应单元与TC配位形成络合物,从而通过AE敏化Eu3+在616 nm波长处的特征发射峰。形成的配合物的紫外-可见吸收光谱与NH2-MIL-53(Al)的荧光光谱存在光谱重叠,说明它们之间可能存在FRET效应,因此NH2-MIL-53(Al)在433 nm波长处的荧光被猝灭。FRET是指当荧光传感器中的能量供体和能量受体足够靠近时,能量供体吸收一定频率的光子后被激发跃迁到高电子能级,返回低电子能级时,通过偶极子相互作用转移到能量受体,并导致能量受体被激发,表现出能量供体的荧光猝灭和能量受体的荧光增强现象[81-84]。Chen Jing等[80]发现,随着TC浓度的增加,体系在433 nm波长处的荧光不断降低,616 nm波长处的荧光增加,因此,可以通过改变荧光信号的比例来达到检测TC的目的。该探针检测TC的线性范围为0.5~60.0 μmol/L,LOD为0.16 μmol/L,为TC的高选择性检测提供了新的思路。为进一步评价荧光探针抗干扰能力以及在实际应用中快速、灵敏检测TC的可行性,该实验还对实际水样进行检测,结果发现,自来水和去离子水的荧光强度比随着TC浓度的增加而逐渐增大,2 种水样中探针荧光强度的比值大致相同,未观察到显著差异,且荧光强度比与TC浓度呈较为优良的线性关系,获得了良好的加标回收率。结果表明,此探针稳定性良好,抗干扰能力强,同时对环境样品TC检测具有准确性和可靠性。
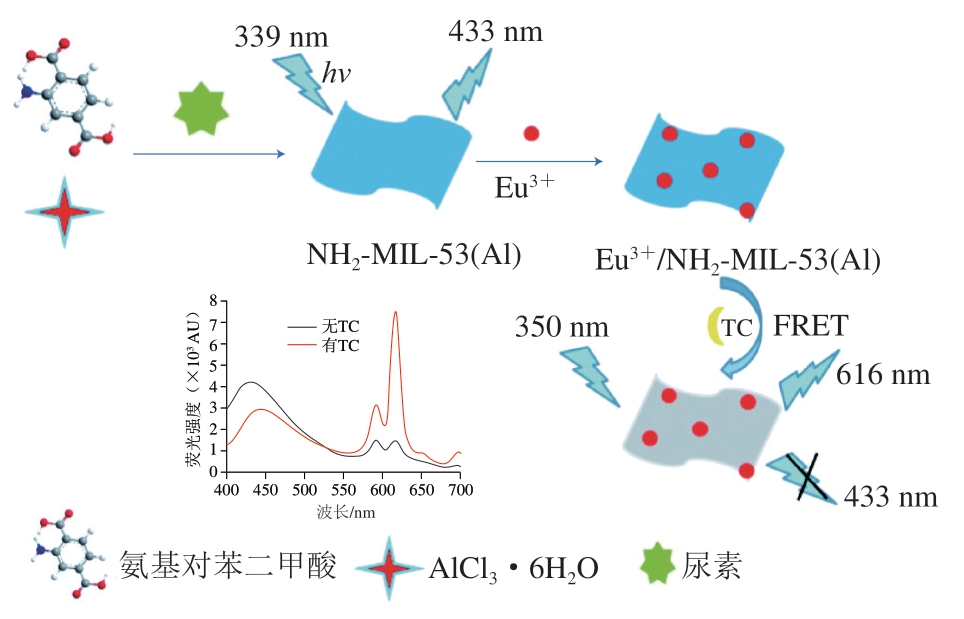
图6 Eu3+/NH2-MIL-53(Al)复合材料的合成及TC检测机理[78]
Fig. 6 Synthesis and TC detection mechanism of Eu3+/NH2-MIL-53(Al)composites[78]
Li Chunhua等[85]将ZIF-8锚定在二维(2D)氨基功能化的铝-金属有机框架(amino-functionalized Al-metal organic framework,NH2-MIL-53(Al))上,构建了双金属有机平台ZIF-8/NH2-MIL-53(Al),用于同时捕捉和荧光感应四环素类抗生素。锚定于二维纳米板中的ZIF-8纳米颗粒直径小、比表面积大,吸附能力增强,对DOX、TC、OXY和CTC的吸附量分别为561、533、526、578 mg/g。值得注意的是,ZIF-8的吡啶N与NH2-MIL-53(Al)表面上丰富的单键—NH2具有协同作用,从而对TC表现出高亲和力,同时还促进PET和IFE,提高了ZIF-8纳米颗粒检测的灵敏度。与NH2-MIL-53(Al)相比,其LOD(TC、DOX、OXY为1.2 μg/L,CTC为2.2 μg/L)至少低10 倍,比已报道的传感器更优。另外,为评估ZIF-8/NH2-MIL-53(Al)的实用性,该纳米探针被用于检测加标牛乳中的四环素类抗生素,在实际应用中RSD≤5%,回收率为93%~105%,呈现出高可靠性和准确性,结果表明,该平台检测四环素类抗生素具有可行性,为开发同时捕获和检测有机污染物的综合系统的新途径提供了思路。
MOF作为一种新型荧光材料,其LOD较低、检测效果较好,但其稳定性易受pH值影响,在实际食品基质的应用中需保证检测体系的pH值较为适宜,后续研究中可以进一步探索如何提高MOF的稳定性。部分基于MOF的检测方法只能特异性地检测TC,但Ln-MOFs和NH2-MIL-53(Al)能通过不同吸附能力等方法实现高选择性检测TC、DOX、OXY和CTC。因此,后续的研究可借鉴相关思路,就如何使各种四环素类抗生素获得高选择性作进一步考虑。
为更直观地对比各探针的检测性能,现将以上检测方法的检出限、检测范围总结为表2,以期为后续基于纳米荧光探针的TC快速检测提供新的思路。由表2可知,各纳米荧光探针均具有较好的检测性能。对于检出限而言,MoS2 QDs+Eu3+、SiQDs、AuNCs、AuCuNCs的检出限最低,为10-3 μmol/L数量级;CQDs及其修饰物、AgNCs、Eu3+/NH2-MIL-53(Al)复合物检出限较高,为1 μmol/L数量级。对于检测范围而言,大多数纳米荧光探针的检测范围为1~100 μmol/L或0.01~10.00 μmol/L数量级,在实际应用中,应选择检测范围适合的探针使用,若需要较精确的检测可选择SiQDs或AuCuNCs@MOF,若需要检测含量较高的TC可选用Cu@ZnS QDs。
表2 不同纳米荧光探针对TC的LOD和检测范围
Table 2 Limits of detection (LOD) and detection ranges of TC by different nanofluorescent probes
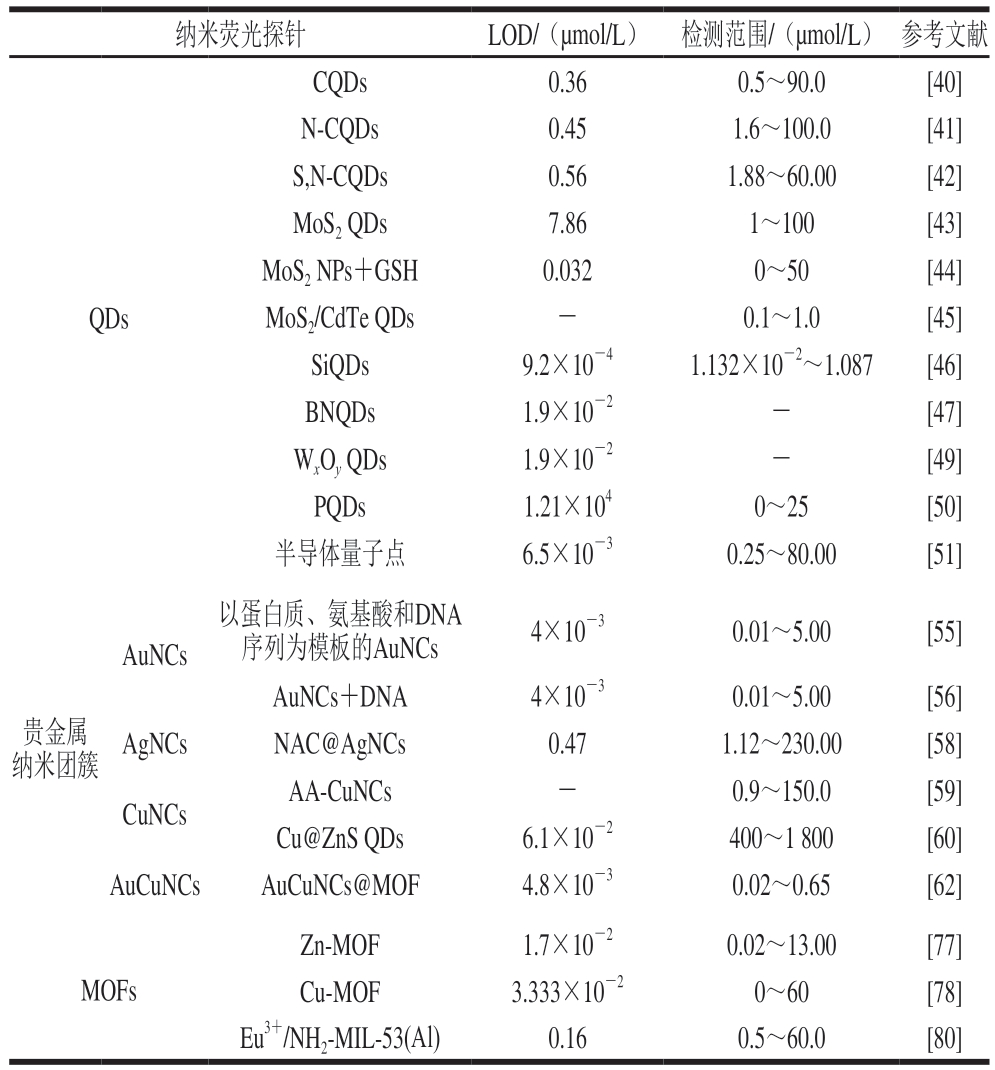
注:-. 暂无数据。
纳米荧光探针LOD/(μmol/L)检测范围/(μmol/L)参考文献QDs CQDs0.360.5~90.0[40]N-CQDs0.451.6~100.0[41]S,N-CQDs0.561.88~60.00[42]MoS2 QDs7.861~100[43]MoS2 NPs+GSH0.0320~50[44]MoS2/CdTe QDs-0.1~1.0[45]SiQDs9.2×10-41.132×10-2~1.087[46]BNQDs1.9×10-2-[47]WxOy QDs1.9×10-2-[49]PQDs1.21×1040~25[50]半导体量子点6.5×10-30.25~80.00[51]AuNCs以蛋白质、氨基酸和DNA序列为模板的AuNCs4×10-30.01~5.00[55]贵金属纳米团簇AuNCs+DNA4×10-30.01~5.00[56]AgNCsNAC@AgNCs0.471.12~230.00[58]CuNCsAA-CuNCs-0.9~150.0[59]Cu@ZnS QDs6.1×10-2400~1 800[60]AuCuNCsAuCuNCs@MOF4.8×10-30.02~0.65[62]Zn-MOF1.7×10-20.02~13.00[77]Cu-MOF3.333×10-20~60[78]Eu3+/NH2-MIL-53(Al)0.160.5~60.0[80]MOFs
4 结 语
TC在动物源性食物中的残留存在诸多潜在危害。目前QDs、贵金属纳米团簇和MOFs等多种材料已被应用于构筑TC荧光传感器,这些材料绝大多数采用水热法、溶剂热法合成,具有特有的小直径效应以及荧光强度较高、光稳定性优异等优点。基于纳米荧光探针的TC快速检测方法LOD最低可达0.92 nmol/L,线性检测范围覆盖0.01~1 800.00 μmol/L,灵敏度较高、选择性较强。此类探针在实验室水溶液体系中性能良好,在实际样本或环境中亦有一定的实用性,已经成功应用于食品、药品、血清和尿液等基质中,并且其抗干扰性良好。由此可见,基于纳米荧光探针的TC快速检测方法已经成为一种灵敏而又简单的理想TC检测方法,大大推动了TC检测的进步。
但是以荧光信号为基础的TC快速检测方法在实践中还存在检测体系费时、复杂等问题,导致其应用受限。因此,食品中TC检测方法的研究可在以下几方面突破:1)构建更快速、低成本、高灵敏度和高选择性的四环素类抗生素荧光检测体系,并且可对真实样品进行实时原位分析;2)TC和探针的结合常数也很少被报道,这可能成为后续研究中评估TC检测特异性和抗干扰能力的一个客观指标;3)将智能手机与新型纳米材料相结合,实现检验可视化,今后可以研发检测前后具有较大色彩变化的多功能环境友好型纳米复合材料,从而解决TC检测灵敏度低、选择性差等问题;4)着手研发便携式暗盒及手机端APP,搭建针对四环素类抗生素进行快速、实时、便携、精准真实检测的应用平台,从而为食品安全及人类健康提供有力保障。
[1]张志旭, 吴根义, 许振成. 粘土矿吸附过程中四环素基团变化研究[J]. 农业环境与发展, 2017(2): 115-120. DOI:10.13254/j.jare.2016.0263.
[2]李振, 殷瑜, 陈代杰. 四环素类抗生素的复苏[J]. 中国抗生素杂志,2021, 46(12): 1084-1089. DOI:10.13461/j.cnki.cja.007168.
[3]袁志军. 分光光度法测定四环素片中四环素的含量探讨[J]. 中国现代药物应用, 2011, 5(5): 101-102. DOI:10.14164/j.cnki.cn11-5581/r.2011.05.233.
[4]池思婷, 荣铭聪, 温远智, 等. 四环素光学传感器研究进展[J]. 分析化学, 2021, 49(6): 963-972. DOI:10.19756/j.issn.0253-3820.201589.
[5]赵永斌. 3 种四环素类抗生素降解菌的筛选及降解特性的研究[D].晋中: 山西农业大学, 2015: 1-3.
[6]FANG Cao, WANG Shenhao, XU Hangbo, et al. Degradation of tetracycline by atmospheric-pressure non-thermal plasma: enhanced performance, degradation mechanism, and toxicity evaluation[J].Science of The Total Environment, 2022, 812: 152455. DOI:10.1016/j.scitotenv.2021.152455.
[7]李会贤, 冯博, 黄柳娟, 等. 市售散装白斩鸡表面四环素耐药菌污染初探[J]. 核农学报, 2022, 36(1): 129-135. DOI:10.11869/j.issn.100-8551.2022.01.0129.
[8]DINH Q T, MUNOZ G, DUY S V, et al. Analysis of sulfonamides,fluoroquinolones, tetracyclines, triphenylmethane dyes and other veterinary drug residues in cultured and wild seafood sold in Montreal,Canada[J]. Journal of Food Composition and Analysis, 2020, 94:103630, DOI:10.1016/j.jfca.2020.103630.
[9]张凌夫. 四环素为何能引起牙齿变色[J]. 农村经济与技术, 1998(2): 49.
[10]李亚琳, 张俊升, 王钦晖. 酶联免疫法测定牛乳中四环素类药物的残留量[J]. 云南畜牧兽医, 2005(2): 27. DOI:10.3969/j.issn.1005-1341.2005.02.016.
[11]苏霞, 王绪根, 李云, 等. 畜禽产品中四环素类抗生素残留检测方法研究进展[J]. 今日畜牧兽医, 2022, 38(7): 8-9. DOI:10.3969/j.issn.1673-4092.2022.07.004.
[12]中华人民共和国农业农村部, 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准 食品中兽药最大残留限量: GB 31650—2019[S]. 北京: 中国标准出版社, 2019.
[13]European Commission. Commission Regulation (EU) 2017/880[S].Brussels: 2017.
[14]邱月明, 郑自强. FAO/WHO食品法典委员会第十一届药残留法典会议简介[J]. 现代商检科技, 1998, 8(6): 61-65.
[15]Joint FAO/WHO Food Standards Programme, Rome (Italy), FAO/WHO Codex Alimentarius Commission, Rome (Italy). Report of the twelfth session of the Codex Committee on residues of veterinary drugs[R]. Washington, D.C., 2000: 28-31.
[16]盛圆贤, 徐士新, 袁宗辉, 等. 动物源性食品安全的国际标准: 第13届国际食品中兽药残留法典委员会会议概况[J]. 中国兽药杂志,2002, 36(5): 11-19. DOI:10.3969/j.issn.1002-1280.2002.05.003.
[17]ESN, FAO/WHO Codex Alimentarius Commission, Rome (Italy),Joint FAO/WHO Food Standards Programme, Rome (Italy). Report of the fourteenth session of the Codex Committee on residues of veterinary drugs in foods[R]. Arlington, Virginia, USA, 2003: 4-7.
[18]NABAVI M, HOUSAINDOKHT M R, BOZORGMEHR M R, et al.Theoretical design and experimental study of new aptamers with the enhanced binding affinity relying on colorimetric assay for tetracycline detection[J]. Journal of Molecular Liquids, 2021, 349: 118196.DOI:10.1016/j.molliq.2021.118196.
[19]WANG Ge, ZHANG Huicai, LIU Jing, et al. A receptor-based chemiluminescence enzyme linked immunosorbent assay for determination of tetracyclines in milk[J]. Analytical Biochemistry,2019, 564/565: 40-46. DOI:10.1016/j.ab.2018.10.017.
[20]赵秋伶, 张振宇, 周广原, 等. 四环素类抗生素酶联适体分析试剂盒的研制[J]. 分析实验室, 2019, 38(1): 107-111. DOI:10.13595/j.cnki.issn1000-0720.2018.041603.
[21]OKA H, IKAI Y, KAWAMURA N, et al. Improvement of chemical analysis of antibiotics: X. Determination of eight tetracyclines using thin-layer and high-performance liquid chromatography[J]. Journal of Chromatography A, 1987, 393(2): 285-296. DOI:10.1016/S0021-9673(01)94225-6.
[22]VURAN B, ULUSOY H I, SARP G, et al. Determination of chloramphenicol and tetracycline residues in milk samples by means of nanofiber coated magnetic particles prior to high-performance liquid chromatography-diode array detection[J]. Talanta, 2021, 230: 122307.DOI:10.1016/j.talanta.2021.122307.
[23]RI H C, PIAO Jishou, CAI Long, et al. A reciprocating magnetic field assisted on-line solid-phase extraction coupled with liquid chromatography-tandem mass spectrometry determination of trace tetracyclines in water[J]. Analytica Chimica Acta, 2021, 1182: 338957.DOI:10.1016/j.aca.2021.338957.
[24]IBARRA L S, RODRIGUEZ J A, MIRANDA J M, et al. Magnetic solid phase extraction based on phenyl silica adsorbent for the determination of tetracyclines in milk samples by capillary electrophoresis[J]. Journal of Chromatography A, 2011, 1218(16):2196-2202. DOI:10.1016/j.chroma.2011.02.046.
[25]李伊宁, 黄昆仑, 姚志轶. 用于叶酸检测的荧光传感器构建及应用研究进展[J]. 食品科学, 2021, 42(9): 214-221. DOI:10.7506/spkx1002-6630-20200407-090.
[26]孟丽华, 史艳伟, 时兵, 等. 四环素类抗生素残留的检测方法及其对渔业环境的影响研究进展[J]. 中国渔业质量与标准, 2017, 7(1): 50-55.DOI:10.3969/j.issn.2095-1833.2017.01.008.
[27]PLESKOVA S, MIKHEEVA E, GORNOSTAEVA E. Using of quantum dots in biology and medicine[J]. Cellular and Molecular Toxicology of Nanoparticles, 2018, 1048: 323-334. DOI:10.1007/978-3-319-72041-8_19.
[28]张争艳, 潘振晓, 钟新华. 量子点敏化太阳电池研究进展[J]. 硅酸盐学报, 2022, 50(2): 331-339. DOI:10.14062/j.issn.0454-5648.20210711.
[29]殷勤红, 王梦桃, 方东, 等. 量子点材料在法医学检验中的应用进展[J]. 分析试验室, 2022, 41(8): 969-976. DOI:10.13595/j.cnki.issn1000-0720.2021.073102.
[30]SAFRANKO S, GOMAN D, STANKOVIC A, et al. An overview of the recent developments in carbon quantum dotspromising nanomaterials for metal ion detection and (bio)molecule sensing[J]. Chemosensors, 2021, 9(6): 138-138. DOI:10.3390/chemosensors9060138.
[31]KONTHOUJAM J S, AHMED T, PRAKALP G, et al. Recent advances in two-dimensional quantum dots and their applications[J].Nanomaterials, 2021, 11(6): 1549-1549. DOI:10.3390/nano11061549.
[32]EL-SHABASY R M, ELSADEK M F, AHMED B M, et al. Recent developments in carbon quantum dots: properties, fabrication techniques, and bio-applications[J]. Processes, 2021, 9(2): 388-388.DOI:10.3390/pr9020388.
[33]ZHUANG Yuerui, LIN Bixia, YU Ying, et al. A ratiometric fluorescent probe based on sulfur quantum dots and calcium ion for sensitive and visual detection of doxycycline in food[J]. Food Chemistry, 2021:356(12): 129720. DOI:10.1016/j.foodchem.2021.129720.
[34]ZHANG Yanpeng, QI Junjie, LI Mengying, et al. Fluorescence probe based on graphene quantum dots for selective, sensitive and visualized detection of formaldehyde in food[J]. Sustainability, 2021, 13(9):5273. DOI:10.3390/su13095273.
[35]齐帆, 任海涛, 黄洁, 等. 碳量子点的制备、性质及应用[J]. 化学研究, 2020, 31(3): 270-277. DOI:10.14002/j.hxya.2020.03.013.
[36]MIAO Hong, WANG Yingyi, YANG Xiaoming, et al. Carbon dots derived from tobacco for visually distinguishing and detecting three kinds of tetracyclines[J]. Nanoscale, 2018, 10(17): 8139-8145.DOI:10.1039/c8nr02405g.
[37]XU Xiaoyou, ROBERT R, GU Yunlong, et al. Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J]. Journal of the American Chemical Society, 2004,126(40): 12736-12737. DOI:10.1021/ja040082h.
[38]岳晓月, 周子君, 伍永梅, 等. 荧光碳量子点在食品分析中的研究进展[J]. 分析化学, 2020, 48(10): 1288-1295. DOI:10.19756/j.issn.0253-3820.201005.
[39]DA SILVA J C G E, GONCALVES H M R. Analytical and bioanalytical applications of carbon dots[J]. Trends in Analytical Chemistry, 2011, 30(8): 1327-1336. DOI:10.1016/j.trac.2011.04.009.
[40]曹媛媛, 王欣然, 白惠颉, 等. 基于甜菜红色素的碳量子点荧光检测动物源食品中的四环素[C]//中国食品科学技术学会第十七届年会摘要集. 西安: 中国食品科学技术学会, 2020: 90-91. DOI:10.26914/c.cnkihy.2020.021760.
[41]李义梅, 陈谦. 基于氮掺杂碳量子点荧光探针检测四环素[J]. 化学研究与应用, 2021, 33(5): 813-818. DOI:10.3969/j.issn.1004-1656.2021.05.005.
[42]FAN Yao, QIAO Wenjun, LONG Wanjun, et al. Detection of tetracycline antibiotics using fluorescent “Turn-off” sensor based on S,N-doped carbon quantum dots[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2022, 274: 121033.DOI:10.1016/j.saa.2022.121033.
[43]WANG Zhuosen, LIN Jintai, GAO Jinwei, et al. Two optically active molybdenum disulfide quantum dots as tetracycline sensors[J].Materials Chemistry and Physics, 2016, 178: 82-87. DOI:10.1016/j.matchemphys.2016.04.073.
[44]JIA Pei, BU Tong, SUN Xinyu, et al. A sensitive and selective approach for detection of tetracyclines using fluorescent molybdenum disulfide nanoplates[J]. Food Chemistry, 2019, 297: 124969.DOI:10.1016/j.foodchem.2019.124969.
[45]LIANG Nini, HU Xuetao, LI Wenting, et al. A dual-signal fluorescent sensor based on MoS2 and CdTe quantum dots for tetracycline detection in milk[J]. Food Chemistry, 2022, 378: 132076.DOI:10.1016/j.foodchem.2022.132076.
[46]LIU Zhenping, HOU Jingzhou, WANG Xianfeng, et al. A novel fluorescence probe for rapid and sensitive detection of tetracyclines residues based on silicon quantum dots[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2020, 240: 118463.DOI:10.1016/j.saa.2020.118463.
[47]贾珮, 杨铠溶, 侯晋杰, 等. 比率型氮化硼量子点-铕荧光传感器检测动物源食品中的四环素[C]//中国食品科学技术学会第十七届年会摘要集. 西安: 中国食品科学技术学会, 2020: 74-75. DOI:10.26914/c.cnkihy.2020.021745.
[48]沈志. 基于碳点/铜团簇构建荧光纳米探针用于环境中的污染物检测[D]. 合肥: 安徽大学, 2019: 13-17.
[49]WANG Xin, LI Longwen, JIANG Hong, et al. Highly selective and sensitive fluorescence detection of tetracyclines based on novel tungsten oxide quantum dots[J]. Food Chemistry, 2022, 374: 131774.DOI:10.1016/j.foodchem.2021.131774.
[50]XU Jun, LI Rui, XU Zhitao, et al. Rapid visualized assessment of tetracycline in actual fruit samples: the combination of perovskite and rare earth complexes[J]. Journal of Luminescence, 2023, 257: 119753.DOI:10.1016/j.jlumin.2023.119753.
[51]HAN Lei, FAN Yuzhu, QING Min, et al. Smartphones and test paperassisted ratiometric fluorescent sensors for semi-quantitative and visual assay of tetracycline based on the target-induced synergistic effect of antenna effect and inner filter effect[J]. ACS Applied Materials and Interfaces, 2020, 12(41): 47099-47107. DOI:10.1021/acsami.0c15482.
[52]王倩. 全无机钙钛矿量子点的缺陷钝化及稳定性研究[D]. 长春: 吉林大学, 2022: 13-24. DOI:10.27162/d.cnki.gjlin.2022.002541.
[53]付婉莹. 金纳米团簇及其复合物在荧光传感方面的应用研究[D].长春: 东北师范大学, 2021: 10-24. DOI:10.27011/d.cnki.gdbsu.2021.000940.
[54]丁婧蕾. 金纳米团簇复合物的荧光性质及其在荧光检测方面的研究[D]. 长春: 东北师范大学, 2022: 9-18. DOI:10.27011/d.cnki.gdbsu.2022.000217.
[55]ALBANSES A, TANG P S, CHAN W C W. The effect of nanoparticle size, shape, and surface chemistry on biological systems[J]. Annual Review of Biomedical Engineering, 2012, 14(1): 1-16. DOI:10.1146/annurev-bioeng-071811-150124.
[56]YANG Xiaoming, ZHU Shanshan, DOU Yao, et al. Novel and remarkable enhanced-fluorescence system based on gold nanoclusters for detection of tetracycline[J]. Talanta, 2014, 122: 36-42.DOI:10.1016/j.talanta.2013.12.008.
[57]徐洪耀, 光善仪, 张胜义, 等. 聚苯乙炔立体结构与光致发光性能关系的研究[J]. 高分子学报, 2001(2): 186-190. DOI:10.3321/j.issn:1000-3304.2001.02.011.
[58]吕玫. 荧光银纳米团簇的制备及其在传感检测中的应用[D]. 太原:山西大学, 2021: 50-66. DOI:10.27284/d.cnki.gsxiu.2021.000096.
[59]GUO Yuyu, CAI Zhifeng. Ascorbic acid stabilized copper nanoclusters as fluorescent probes for selective detection of tetracycline[J].Chemical Physics Letters, 2020, 759: 138048. DOI:10.1016/j.cplett.2020.138048.
[60]包芷君. 基于量子点和纳米团簇的纳米荧光探针构建及其应用研究[D]. 广州: 暨南大学, 2020: 58-71. DOI:10.27167/d.cnki.gjinu.2020.001526.
[61]高雪情. 功能化铜纳米团簇复合材料的合成与应用[D]. 烟台: 烟台大学, 2020: 12-20. DOI:10.27437/d.cnki.gytdu.2020.000104.
[62]KHATAEE A, JALILI R, DASTBORHAN M, et al. Ratiometric visual detection of tetracycline residues in milk by framework-enhanced fluorescence of gold and copper nanoclusters[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2020, 242: 118715.DOI:10.1016/j.saa.2020.118715.
[63]KUSTOV L M, ISAEVA V I, PRECH J, et al. Metal-organic frameworks as materials for applications in sensors[J]. Mendeleev Communications, 2019, 29(4): 361-368. DOI:10.1016/j.mencom.2019.07.001.
[64]ZHAO Huanan, XING Zipeng, SU Siyi, et al. Recent advances in metal organic frame photocatalysts for environment and energy applications[J]. Materials Today, 2020, 21: 100821. DOI:10.1016/j.apmt.2020.100821.
[65]关桦楠, 张悦, 王丹丹, 等. 金属有机框架作为模拟酶在生化分析中的应用进展[J]. 食品工业科技, 2022(3): 422-429. DOI:10.13386/j.issn1002-0306.2021010220.
[66]DONG Wenfei, YANG Liaoyuan, HUANG Yuming. Glycine postsynthetic modification of MIL-53(Fe) metal-organic framework with enhanced and stable peroxidase-like activity for sensitive glucose biosensing[J]. Talanta, 2017, 167: 359-366. DOI:10.1016/j.talanta.2017.02.039.
[67]ZANGO Z U, ABU BAKAR N H H, SAMBUDI N S, et al. Adsorption of chrysene in aqueous solution onto MIL-88(Fe) and NH2-MIL-88(Fe)metal-organic frameworks: kinetics, isotherms, thermodynamics and docking simulation studies[J]. Journal of Environmental Chemical Engineering, 2020, 8(2): 103544. DOI:10.1016/j.jece.2019.103544.
[68]XING Yanyan, SI Huizhong, SUN Duhong, et al. Magnetic Fe3O4@NH2-MIL-101(Fe) nanocomposites with peroxidase-like activity for colorimetric detection of glucose[J]. Microchemical Journal, 2020,156: 104929. DOI:10.1016/j.microc.2020.104929.
[69]YUE Fanfan, HU Ao, LU Xinhuan, et al. Mild-temperature hydrogenation of carbonyls over Co-ZIF-9 derived Co-ZIF-x nanoparticle catalyst[J]. Molecular Catalysis, 2020, 495: 111149.DOI:10.1016/j.mcat.2020.111149.
[70]XU Xinyue, JI Dongqing, ZHANG Yuan, et al. Detection of phenylketonuria markers using a ZIF-67 encapsulated PtPd alloy nanoparticle (PtPd@ZIF-67)-based disposable electrochemical microsensor[J]. ACS Applied Materials and Interfaces, 2019, 11(23):20734-20742. DOI:10.1021/acsami.9b05431.
[71]ZOU Fang, YU Runhan, LI Rongguan, et al. Microwave-assisted synthesis of HKUST-1 and functionalized HKUST-1-@H3PW12O40:selective adsorption of heavy metal ions in water analyzed with synchrotron radiation[J]. Chem Phys Chem, 2013, 14(12): 2825-2832.DOI:10.1002/cphc.201300215.
[72]CHEN Meng, CEN Hongyu, GUO Chengbin, et al. Preparation of Cu-MOFs and its corrosion inhibition effect for carbon steel in hydrochloric acid solution[J]. Journal of Molecular Liquids, 2020, 31:114328. DOI:10.1016/j.molliq.2020.114328.
[73]LI Dejian, ZHANG Sisi, FENG Xuan, et al. A novel peroxidase mimetic Co-MOF enhanced luminol chemiluminescence and its application in glucose sensing[J]. Sensors and Actuators B: Chemical,2019, 296: 126631. DOI:10.1016/j.snb.2019.126631.
[74]WAN Yongjie, WAN Jinquan, MA Yongwen, et al. Sustainable synthesis of modulated Fe-MOFs with enhanced catalyst performance for persulfate to degrade organic pollutants[J]. Science of the Total Environment, 2020, 701: 134806. DOI:10.1016/j.scitotenv.2019.134806.
[75]TAO Xumei, CONG Wenwen, HUANG Liang, et al. CeO2 photocatalysts derived from Ce-MOFs synthesized with DBD plasma method for methyl orange degradation[J]. Journal of Alloys and Compounds, 2019, 805: 1060-1070. DOI:10.1016/j.jallcom.2019.07.179.
[76]SHU Yun, CHEN Jingyuan, XU Ze, et al. Nickel metal-organic framework nanosheet/hemin composite as biomimetic peroxidase for electrocatalytic reduction of H2O2[J]. Journal of Electroanalytical Chemistry, 2019, 845: 137-143. DOI:10.1016/j.jelechem.2019.05.029.
[77]徐方红. MOFs荧光探针的制备及其在分析检测中的应用[D].兰州: 西北师范大学, 2021: 43-57. DOI:10.27410/d.cnki.gxbfu.2021.001196.
[78]汪嘉炎, 李文英. 发光铜基金属有机骨架在四环素类抗生素检测中的应用研究[J]. 聊城大学学报(自然科学版), 2020, 33(6): 95-101.DOI:10.19728/j.issn1672-6634.2020.06.013.
[79]LI Runxian, WANG Wenjing, EL-SAYED M, et al. Ratiometric fluorescence detection of tetracycline antibiotic based on a polynuclear lanthanide metal-organic framework[J]. Sensors and Actuators B:Chemical, 2021, 330: 129314. DOI:10.1016/j.snb.2020.129314.
[80]CHEN Jing, XU Yali, LI Shuying, et al. Ratio fluorescence detection of tetracycline by a Eu3+/NH2-MIL-53(Al) composite[J]. RSC Advances, 2021, 11: 2397-2404. DOI:10.1039/d0ra09185e.
[81]YANG Lei, ZHAO Haitong, LIU Ning, et al. A target analyte induced fluorescence band shift of piperazine modified carbon quantum dots:a specific visual detection method foroxytetracycline[J]. Chemical Communications, 2019, 55(82): 12364-12367.
[82]HELI B, AJJI A. Toward a nanopaper-based and solid phase immunoassay using FRET for the rapid detection of bacteria[J].Scientific Reports, 2020, 10(1): 14367. DOI:10.1038/s41598-020-71285-3.
[83]WANG Shan, FU Jing, ZHANG Fang, et al. Highly selective detection of metronidazole by self-assembly via 0D/2D N-C ODs/g-C3N4 nanocomposites through FRET mechanism[J]. Nanoscale Research Letters, 2020, 15(1): 87. DOI:10.1186/s11671-020-3294-2.
[84]KUMAR A, KUMARI A, MUKHERJEE P, et al. A design of fluorescence-based sensor for the detection of dopamine via FRET as well as live cell imaging[J]. Microchemical Journal, 2020, 159:105590. DOI:10.1016/j.microc.2020.105590.
[85]LI Chunhua, ZHANG Xiaoshuo, WEN Simin, et al. Interface engineering of zeolite imidazolate framework-8 on two-dimensional Al-metal-organic framework nanoplates enhancing performance for simultaneous capture and sensing tetracyclines[J]. Journal of Hazardous Materials, 2020, 395: 122615. DOI:10.1016/j.jhazmat.2020.122615.