鸡肉占据禽肉90%以上的消费市场,是人类主要的肉类来源[1]。全球鸡肉产量及消费量不断升高,已成为发达国家的第一大肉类消费品,约占全球肉类消费总量的28.15%[2]。鸡肉的蛋白质含量高、脂肪含量低、营养丰富、加工方便,是人们膳食中主要的蛋白质来源之一[3],尤其对于发展中国家来说,低廉的价格让更多人选择鸡肉。随着生活水平的提高,人们的饮食消费观念也逐步从对量的要求转变为对质的追求,对鸡肉品质的要求也越来越高。因此,禽肉分割产品的需求量日益增多,产肉量成为现代肉鸡产业的首要选育标准。目前,现代肉鸡的增长率已超过300%,体质量每年增长约3.30%,并且饲料转化率每年下降约2.55%[4]。虽然快速生长使鸡肉的产量大大增加,但是也因此带来了许多肉质问题。如表1所示,随着人类对于鸡肉的加工与选择性的增加,肉鸡的选育拘泥于生长速度与胸肉的产量标准中,21世纪以来各类由此所导致的肌肉异常问题层出不穷。其中较为严重的问题如图1所示,有深度胸肌病变、类PSE(pale, soft, and exudative)肉、木质肉、白纹肉和意大利面状胸肉,目前主流的肌肉疾病主要有类PSE肉、木质肉与白纹肉,这些肌病大部分发生在胸部,虽然在腿部等其他部位也偶有少量发生但对经济损失影响不大,可以忽略不计[5]。另外,在鸡肉的加工中会发现未腌熟制鸡肉制品发生的粉红色变现象,由于其并非是肌病因素所导致的肉色异常,因此在本文并不进行讨论。伴随着消费习惯的改变,异常肉所表现出的劣变性状无法满足消费者的需求,通常要将较为严重的异常肉修剪丢弃而再难利用[6],所以不管对于生产者还是消费者这些问题都是无法忽略的,也让越来越多的学者关注这些问题。几类异常肉质问题并非同时出现,而是在近几十年间逐渐出现在肉鸡养殖与鸡肉加工者视野中,其中一个共通之处就是均与肉鸡的生长速度与胸肉增加量有关。虽然这些问题已得到学界的足够重视,对形成机制与相应的改善策略也做出了一些分析判断,但这些研究相对驳杂参差,对于形成原因与解决措施各执一词,多是对问题原因的一些猜测和推论,所涉及的异常肉问题也较为片面,无法梳理出一条系统性的论断,难以为问题的解决提供足够的帮助。另外,与国外相关研究相比,国内对肉鸡异常肉问题的研究并不多,对国内外目前异常肉问题的相关研究急需进行总结与前瞻,以便为之后的研究提供方向。图2为不同异常肉的形成机制示意图。
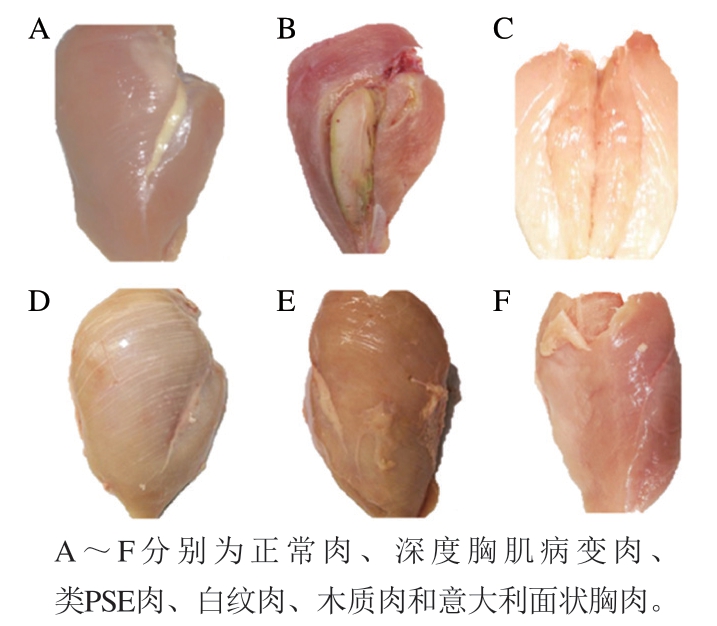
图1 不同异常鸡肉示例
Fig. 1 Pictures of different types of abnormal chicken meat
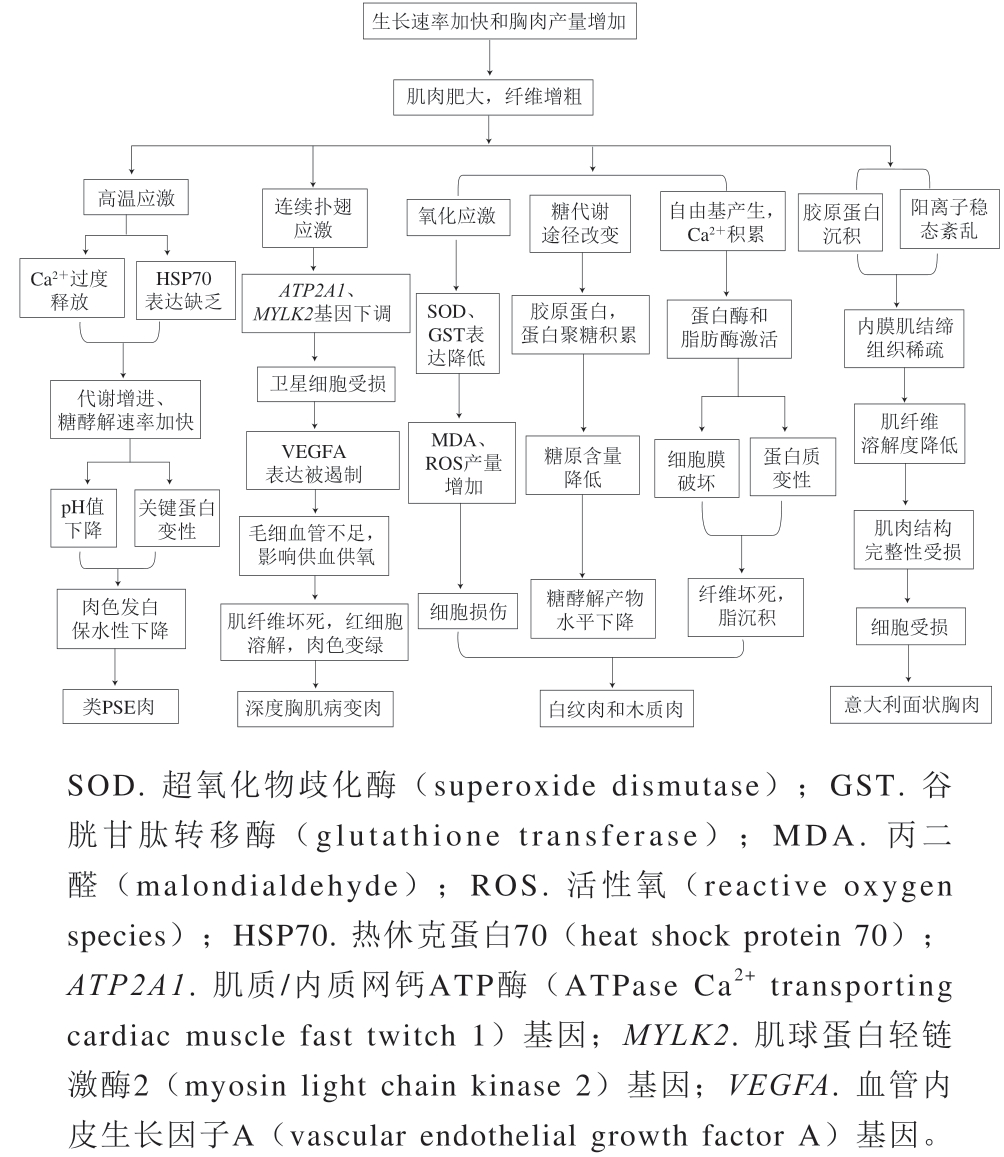
图2 异常肉的形成机制示意图
Fig. 2 Formation mechanism of abnormal chicken meat
表1 上市形式的演变、肉鸡的选择标准与异常鸡肉的关系
Table 1 Evolution of forms of commercial chicken products and relationship between broiler selection criteria and abnormal chicken meat
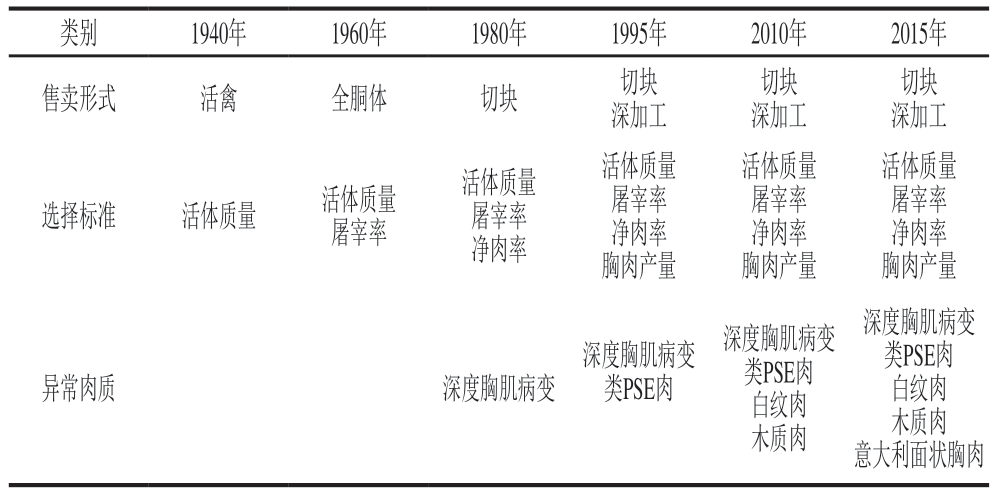
类别1940年1960年1980年1995年2010年2015年售卖形式活禽全胴体切块切块深加工切块深加工切块深加工选择标准活体质量活体质量屠宰率活体质量屠宰率净肉率活体质量屠宰率净肉率胸肉产量活体质量屠宰率净肉率胸肉产量活体质量屠宰率净肉率胸肉产量异常肉质深度胸肌病变深度胸肌病变类PSE肉深度胸肌病变类PSE肉白纹肉木质肉深度胸肌病变类PSE肉白纹肉木质肉意大利面状胸肉
因此,为了给研究者提供关于异常鸡肉形成机制、检测分级、改善利用等方面相关研究的参考,并为异常肉的加工利用提出新的发展思路,本文综述鸡肉中的异常肉问题研究进展,阐明鸡异常肉问题形成原因,找到其中的相通点并提出相应的解决措施和利用手段,对新技术的运用与肉品品质改善结合做出展望,以期为国内外禽类工业中异常肉问题的研究与调控加工提供理论依据和技术支持。
1 深度胸肌病变
1.1 深度胸肌病变肉的形成
深度胸肌病变是一种缺血性坏死肌肉病症,是禽肉中最早被报道的一类肌病,主要在胸小肌中被观察到,而此类异常肉一般都要修剪掉[7]。深度胸肌病变表征为肌肉颜色由出血色逐渐变为绿色,且在分割前很少能被观察到[8],主要诱因是肉鸡受外界刺激引起的快速、连续的翅膀扇动,在胸肌收缩期间血液循环显著增加,而血液中肌红蛋白的供给不足导致缺血[9],最终形成肌体病变。
1.2 深度胸肌病变的研究进展
1.2.1 深度胸肌病变的发生机制
肉鸡体质量的快速增加导致了诸如深度胸肌病变的肌肉退化慢性病,可以观察到深度胸肌病变严重的肉鸡的肌肉纤维肿胀,并在坏死区域有炎症反应[10]。目前的研究结果已证实深度胸肌病变并非细菌性感染而是血液运输不足以提供肌肉收缩所需的能量、氧气和营养所导致[11]。深度胸肌病变肉第1阶段为肌肉急性发炎;第2阶段肌肉呈粉红色,并呈现纤维质地;第3阶段肌肉逐渐退化并出现绿色坏死区域[12]。深度胸肌病变诱导ATP2A1基因的下调,该基因参与了钙离子从细胞质转运到细胞内,肌球蛋白跨桥时肌浆网通过下调MYLK2基因获得相应的特性。卫星细胞促进血管生长的能力,这对于肌肉再生至关重要,由卫星细胞表达的VEGFA基因不仅可以保持毛细血管而且还可以增加数量,以促进更多的氧代谢,但深度胸肌病变诱导遏制VEGFA基因表达,毛细血管保持与生成受阻[13]。而在慢速生长的肉鸡中VEGFA、MYLK2和ATP2A1基因的表达量较高[14]。以上种种因素影响,最终导致了肉鸡出现深度胸肌病变。
1.2.2 深度胸肌病变对鸡肉品质的影响
通过对深度胸肌病变肌肉进行显微观察,发现肌病鸡的胸肌在细胞水平上导致其结构受损,肌膜核微弱染色体缺失,肌肉纤维变性,血管充满溶解的红细胞。肌肉的组织病理学变化导致Z线解体、肌动蛋白丝分解、核和其他细胞器的破坏[15],外观上则表现为肉色逐渐变绿,严重影响消费者的选择。为了满足消费者对健康鸡肉的需求,发生深度胸肌病变的肉与受影响的胸肉需经过更严格的处理程序,使其不影响整体质量[16]。
1.2.3 深度胸肌病变的改善与展望
深度胸肌病变是由多种因素共同引起的肉鸡肌肉病变,既成的病变部位已无法再加工利用。而此类肌肉病变现象是由于肉鸡受刺激而活动增加所导致,因此要考虑减少噪音和外界刺激,以及避免过度的体质量增加,减缓肉鸡生长速度。随着饲养环境的改变,深度胸肌病变发生率逐年降低,近些年鲜有报道,主要异常肉问题是在更为严重的类PSE肉、木质肉与白纹肉方面。但此几类问题均有肉鸡生长速度过快的诱因在其中,因此要从源头控制因生长速度所带来的一系列肉质问题。
2 类PSE肉
2.1 类PSE肉的形成
类PSE肉是发生在肉鸡身上的一类异常肉质问题,表现为鸡胸肉表面颜色苍白、柔软、汁液易流失,影响冷鲜肉的感官品质,降低消费者的购买欲望,作为深加工原料时产品出品率降低,在世界各个国家禽肉产业中普遍发生[17]。美国类PSE肉的发生率可达30%~50%[18],在巴西发生率接近22%[19],在中国类PSE肉的发生率约为23%[20],各国几乎都有类PSE肉的现象发生,发生率多在20%以上,已上升为国际性的禽肉异常肉质问题,也进一步表明其不可忽视性。研究人员普遍认为宰后初期较高的胴体温度,伴随着pH值的快速下降是诱发PSE肉的直接原因[21]。主要由于宰前高温运输应激会引发肉鸡一系列生理生化反应,Ca2+过度释放、分子伴侣HSP70表达缺乏、宰后初期代谢增进、糖酵解速率加快等变化会引起pH值快速下降、蛋白变性,导致肉色发白、保水性变差,最终造成类PSE肉的产生。
2.2 类PSE肉的研究进展
2.2.1 类PSE肉的发生机制
近几十年来,类PSE肉已成为一个令禽肉加工者所困扰的重要问题[22]。随着禽肉产业的发展,对于此问题的研究也趋于成熟。类PSE肉所伴随而来的是肌肉保水性、pH值和颜色的变化,类PSE鸡肉的微观结构相比正常肉肌细胞之间空间增大,微观结构的特点降低了保水性,较低的pH值也引起肌肉保水性降低,这是由于更多的水分从肌肉内迁移到胞外空间[23]。与保水性相似,鸡肉颜色也受肌细胞空间变化的影响,随着肌细胞空间的增大,光的反射增加,肉体表面表现为苍白的浅灰色[24]。因此,在对正常肉与类PSE肉的分类方面,多是应用颜色测定对类PSE肉进行快速、无损检测与分类。鸡肉需求量的日益增长迫使肉鸡品种的选育朝着快速增长和肌肉增生型方向发展,这诱发了一些自发性或特发性异常鸡胸肉的出现,同时应激性肌病的敏感性也相应增加[25]。研究表明,应激是类PSE肉产生的主要原因,应激会刺激动物机体的神经-内分泌系统,影响其免疫力和生理代谢功能,造成宰后初期肌肉生理生化的变化,进而对肉品质产生重要影响。应激所带来的肌体损伤在多种动物身上都有不同程度的呈现,并且家禽更易受到热应激的影响,肌肉内脂肪受热,肉鸡表现出较高的饱和脂肪酸和较低的多不饱和脂肪酸含量,表明其较高的脂质氧化水平和较低的肉类营养价值[26]。在对鸡肉的影响中,应激造成机体能量状态的失衡,加快宰后初期糖酵解速率,导致糖原快速分解和乳酸的大量堆积,影响肉品质;应激造成钙激活酶和组织蛋白酶活性变化,影响关键骨架蛋白的降解,导致嫩度和保水性的变化;应激引起某些关键蛋白发生翻译后修饰,如磷酸化、氧化、亚硝化和乙酰化,影响其在调控宰后肉品质形成过程中所发挥的作用;应激引发钙离子和氧化还原平衡的紊乱,导致细胞凋亡,造成细胞收缩和蛋白降解,进而影响肉品质等[27]。结合以上诱因导致了类PSE肉的产生。
2.2.2 类PSE肉的品质特性变化
与正常肉相比,类PSE肉蛋白溶解性下降,肌球蛋白与肌浆蛋白变性、热稳定性降低,盐水吸收与出品率显著低于正常肉,低pH值是影响类PSE肉出品率的重要因素,升高pH值(至正常肉水平)能改善类PSE肉的保水性,但不能完全恢复,这可能与类PSE肉肌球蛋白与肌浆蛋白的变性密切相关。类PSE肉蛋白的低溶解性限制了蛋白的提取,并且肌球蛋白的变性会对类PSE肉的深加工带来不利影响[28]。在肉制品加工中,类PSE禽肉形成凝胶能力弱,相比正常禽肉显得更加柔软,通过对类PSE肉所形成的肉糜凝胶的特性研究可以得知,其凝胶质构等与凝胶性能相关的指标均显著低于正常肉所形成的肉糜凝胶[29]。从蛋白质功能特性角度来看,类PSE鸡胸肉蛋白质凝胶特性劣变与内在蛋白质发生过度变性相关,主要原因是类PSE肉糜加热形成聚集状凝胶基质,而正常肉糜形成带有许多蛋白质纤丝的良好凝胶网络结构,表明类PSE肉盐溶性蛋白溶出量降低和质构特性变差;类PSE肉糜凝胶的自由水比例增加,蛋白质与水结合能力减弱,表明其凝胶保水性变差;类PSE肉糜蛋白质的β-折叠含量降低,其疏水基团和酪氨酸残基的暴露表明脂肪族氨基酸和色氨酸残基的微环境发生改变,结构的改变进而影响了其溶解性、凝胶质构特性和保水性[30]。可知,类PSE肉对鸡肉与肉糜品质均产生了恶劣的影响。
2.3 类PSE肉的改善
目前对类PSE肉的源头改善措施是通过对基因、宰前因素、击晕方式和冷却机制等因素的控制来解决此类问题带来的肉质劣变现象[31]。但根据鸡肉深加工企业所给出的反馈可知,并不可完全将此问题排除,主要原因还是由于类PSE禽肉蛋白质性质的复杂性较高,因此对于此类问题的研究仍需深入,并从蛋白组学的角度进行问题攻关。而对类PSE肉糜的改善,则主要分为添加辅助成分和新技术处理2 种不同的途径。现已知通过使用特殊的加工工艺,如注射、滚揉与腌制并添加某些不同种类的淀粉、卡拉胶、胶原蛋白、大豆分离蛋白等非肉成分来改善类PSE禽肉深加工制品的质构和保水性有较好的效果[32]。另外,通过添加磷酸盐、碳酸氢钠增加类PSE禽肉的pH值和离子强度来改善类PSE禽肉的加工特性,但调节pH值的方式也难以完全解决类PSE肉糜的加工特性[33],并会影响消费者的口味需求。腌制手段会增加食盐含量,与当代低盐健康饮食需求相悖,非肉成分的过度添加也违反了国家的要求和生产高品质肉制品的要求,虽有效果但并非最好的办法[34]。所以按照目前的趋势,需要采用新技术对类PSE肉糜进行处理改善,Chan[35]、Li Ke[36]等发现,采用高压处理和高强度超声,可以改善类PSE肉糜凝胶功能特性。超高压处理可以提高类PSE鸡肉肉糜凝胶的保水性,并能较好地降低食盐添加量[35],推断这可能主要由于超高压处理可以增加类PSE鸡肉的蛋白质溶解性。另外,也有研究报道,应用高能超声波技术可以改性蛋白质,从而改善类PSE鸡肉的凝胶特性[36]。根据最新的研究动态可知,解决类PSE肉问题的前沿措施是设法恢复类PSE肉的功能,譬如Zhao Xue等[37]的研究已证实,等电点增溶/沉淀可增强类PSE肉的功能,以及通过酶促修饰(如酶促糖基化)也可促使类PSE肉糜获得较低的α-螺旋含量和较高的β-折叠及β-转角含量,提高肌原纤维蛋白的溶解度,达到改善功能性的效果[38]。Dong Ming等[39]利用脉冲电场(pulsed electric field,PEF)技术对所提取的类PSE肉肌原纤维蛋白进行处理,发现PEF处理的样品α-螺旋含量增加,但β-转角和无规卷曲含量减少,总体上会明显改善MP的溶解度、表面疏水性和巯基含量,改变其流变性,诱导低弹性肌原纤维蛋白形成,但当电场强度超过18 kV/cm时,这些性能会有所下降。综上,利用物理、化学和酶促技术可用于通过改变蛋白质分子的理化特性来进行蛋白质修饰,具有很好的应用前景和对未来肉类开发的潜力。探索新颖和安全的加工技术以改善这类有缺陷的肉具有重要意义,然而,这些方法也存在一些缺点,例如,需要专门的设备维护,设备的价格通常非常昂贵,难以进行大规模处理;又或者一些化学成分并不可以充分被添加入食品中,而酶类的价格较高,极大增加了生产者的投入。
3 木质肉与白纹肉
3.1 木质肉与白纹肉的形成
木质肉与白纹肉也是伴随着肉鸡快速生长和高产肉量需求同时出现的一类异常肉问题[40]。木质肉的质感坚硬,胸大肌上部有明显坚硬部分,尾部有脊状突起,常伴有白色条纹和出血斑;白纹肉是肌肉表面出现平行于肌纤维的白色脂肪沉积条纹,这2 种肌肉缺陷问题表现出类似的组织学特征,并且常常共同出现[41]。白纹肉最早于2009年被报道[42],定义为胸肌肉和腿肌肉上出现平行于肌纤维的白色条纹状的脂肪沉积。而木质肉在2014年被正式提出[43],这种缺陷造成胸肉的硬度明显增加,严重的个体表面呈木质纹理状,甚至出现渗血和黏性分泌物。有研究认为,白纹肉与木质化鸡胸肉属于同一种异质肉,白纹肉发生在早期阶段,后期逐渐恶化并发展成为木质化鸡胸肉[44],因此也多放于一起进行研究。数据显示,目前快大型白羽肉鸡品种中严重程度的白纹肉和木质肉的发生率分别在10%和15%左右,并有逐年上升的趋势[45],而在中国木质肉的发生率也已经达到18.33%,所造成的经济损失难以估量[46]。饲喂高能、高蛋白日粮的肉鸡体质量和胸肌质量显著提高,同时木质肉发生率及严重程度也显著升高,表明生长速度越快的肉鸡,其鸡胸肉出现木质化的比例越高,说明生长速度和胸肉产量是关键影响因素[47]。生长速度快、鸡胸肉产量高的肉鸡常伴随着肌纤维直径增大、巨型纤维发生率升高、酵解型肌纤维含量升高等肌纤维结构变化,更容易受到环境影响而产生应激[48]。此外,其肌纤维增粗、毛细血管密度下降,造成氧气和营养物质的供应不足并且影响代谢废物排出,造成氧化应激,并引发炎症和纤维化,进而造成肌肉损伤[49],这些因素共同作用导致了白纹肉与木质肉的产生。
3.2 木质肉与白纹肉的研究进展
3.2.1 木质肉与白纹肉的发生机制
对于木质肉与白纹肉的发生机制着重体现于3 个方面,如图3所示,首先是由于氧化应激会降低SOD和GST的基因表达量和抗氧化酶活性,增加MDA与ROS的产量,导致细胞氧化损伤[50]。肌肉中的血液循环机能不全和氧化应激会破坏蛋白质结构完整性,诱发木质肉的产生,生长速度越快、胸肌产量越高的肉鸡其血管密度越低,单位肌纤维的毛细血管数量和运载能力下降,说明肌肉生长超过机体承受水平,导致血氧供应不足,血管密度降低还会造成代谢废弃物难以及时清除。由于抗氧化酶活性降低,不能及时清除ROS,氧化应激持续损伤细胞蛋白和质膜,导致肌纤维的形态结构发生变化[51],这可能是白纹肉与木质化鸡胸肉产生的重要原因。其次,糖代谢途径的改变诱导胶原蛋白和蛋白聚糖积累,从而导致木质化鸡胸肉中结缔组织增多。木质化鸡胸肉中糖代谢和葡萄糖利用率发生改变,同时木质化鸡胸肉中的糖原含量降低,糖酵解中间产物果糖-6-磷酸、葡萄糖-6-磷酸以及终产物乳酸和丙酮酸的水平下降,表明糖酵解途径受到抑制[52]。另一方面,研究[53-54]表明,白纹肉与木质化鸡胸肉中钠离子和钙离子含量均显著升高,肌纤维中钙离子的积累可能是引起白纹肉与木质化鸡胸肉发生的原因之一,有学者猜测细胞内自由基的产生和钙离子的积累可能激活蛋白酶和脂肪酶,导致细胞膜完整性的破坏和蛋白质变性[55]。这种损伤可能会超过肌肉的再生能力,导致纤维坏死,从而造成纤维化和脂沉积症,与白纹肉与木质化鸡胸肉的组织学变化相符。
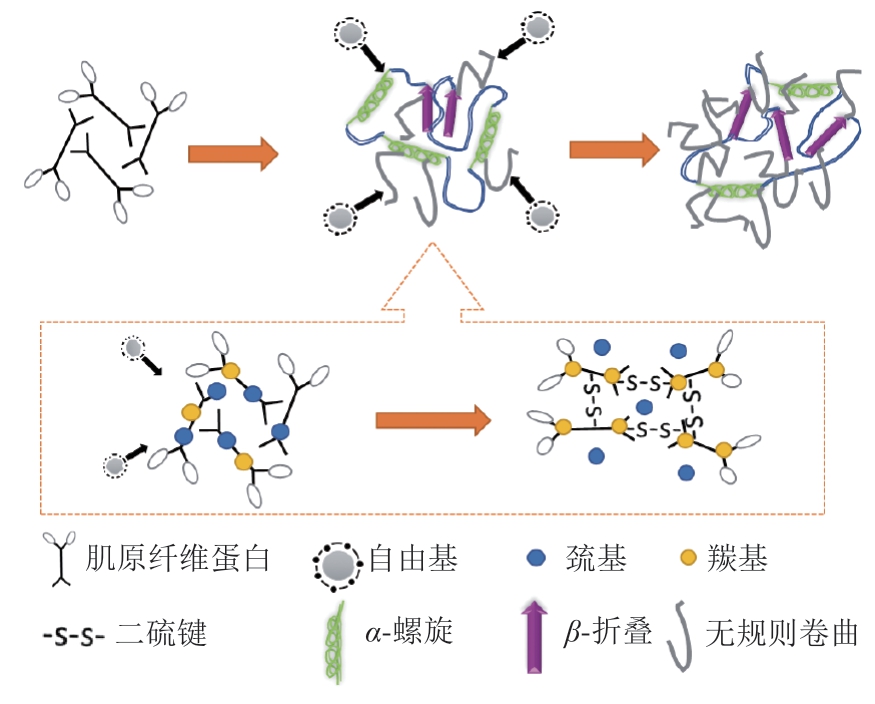
图3 木质化鸡胸肉与白纹肉的形成机制示意图
Fig. 3 Formation mechanism of wooden breast and white striped meat
3.2.2 木质肉与白纹肉的检测与分级
根据鸡胸肉的外观可以对白纹肉评分和分类:正常(0 分),无明显白纹;中等(1 分),出现与肌纤维方向平行的白纹,厚度<1 mm;严重(2 分),出现较多与肌纤维方向平行的白纹,厚度>1 mm;极严重(3 分),出现大量与肌纤维方向平行的白纹,且厚度>3 mm[56]。通过鸡胸肉外观和坚硬程度对木质化鸡胸肉进行评分和分类:正常(0 分),整块鸡胸肉柔软有弹性,无任何坚硬特征;轻度(1 分),鸡胸肉头端和近尾部出现轻微的变化,头端较坚硬;中等(2 分),整块鸡胸肉表现出坚硬特征,但中部至尾部有弹性;严重(3 分),除整体表现出坚硬特征外,鸡胸肉表面伴随着出血和渗透物的出现[57]。总的来说,白纹肉与木质化鸡胸肉的组织学特征相似,都表现出肌纤维变性、萎缩,肌纤维大小不一,出现絮状或空泡,伴随着纤维溶解现象,出现纤维化、脂沉积症和间质性炎症。目前,白纹肉与木质化鸡胸肉主要依靠人工评级,即通过外观进行判断,主观性太大,无法作为一种准确的方法。现阶段对木质化鸡胸肉的分级主要采用硬度指压法,该方法稳定性差、重复性低、评价体系不统一[58]。Traffano-Schiffo等[59]应用配备分光光度计的传感器对鸡胸肉进行检测,证明了通过频射光谱分光光度法测定白纹肉的可行性。Caroline等[60]使用计算机视觉系统(computer vision systems,CVS)并通过线性和非线性算法从近红外(near infrared,NIR)区域获得光谱信息,通过木质肉对鸡进行识别和分类,CVS和NIR光谱可以用作快速、无损的方法,用于对屠宰场中的木质肉识别和分类,并表征了理化和技术参数,支持了决策树建模。Wold等[61]运用NIR光谱法建立了蛋白质回归模型,通过分析鸡胸肉中蛋白含量进而对木质化鸡胸肉进行快速在线检测分级。Garner等[62]应用生物电阻抗分析(bioelectrical impedance analysis,BIA)检测现代肉鸡中患有木质化肌病的肉鸡胸肉,正常肉与木质肉在电抗方面有显著差异,而轻度、中度和重度木质肉类样品之间无显著差异。基于木质肉肌病的存在,BIA可以用于分离木质肉的外、内侧和尾部区域。在近段时间,NIR检测异常肉技术取得了新的进展,Carvalho等[63]使用便携式NIR光谱仪获取光谱信息,并使用连续投影算法-线性判别分析和类比法软独立建模法进行分类模型的构建,以区分正常肌肉和受影响的肌肉。这些研究提供了相对可靠的白纹肉与木质化鸡胸肉的检测分级方法,有助于对这2 种异质肉的进一步研究。
3.2.3 木质肉与白纹肉的品质特性变化
木质肉与白纹肉所呈现出的状态为pH值升高、蛋白质含量下降、水分含量与粗脂肪含量增加、保水性降低、硬度也会增加。pH值与肉色和系水力有较强的相关性,是衡量肉品质的一个重要指标,研究表明,白纹肉与木质化鸡胸肉的pH值显著高于正常肉[64]。一般来说,宰后肌肉的pH值都会有所降低,主要是由于糖原在无氧酵解过程中转变成乳酸,白纹肉与木质化鸡胸肉pH值的升高并不是鸡胸肉宰后代谢异常引起的,而是由于肌肉中糖原含量低和糖酵解潜力不足造成[65]。在肉色方面,白纹肉亮度值(L*)和黄度值(b*)无显著差异,红度值(a*)显著升高,同时有研究发现白纹肉L*、a*、b*均无显著变化[66]。白纹肉与木质化鸡胸肉L*无显著差异,a*、b*显著升高[67],但是不同的测量点其肉色数值差异较大,因此目前无法依靠肉色判断木质化肉。鸡胸肉的硬度可通过挤压力和剪切力来反映,白纹肉与木质化鸡胸肉的生肉实验表明,木质化鸡胸肉的剪切力显著高于正常鸡胸肉,白纹肉与木质化鸡胸肉的挤压力显著高于正常鸡胸肉,且挤压力随木质化等级升高显著增大[68]。Soglia等[69]通过对木质肉的肌节长度观察已验证木质肉的硬度增加与肌纤维的过度收缩无关,这可能与鸡胸肉厚度增加及组织中结缔组织积累有关。Zhang Xue等[70]通过观察宰后一段时间内的蛋白质降解,得出HSP27蛋白的降解与肉的嫩度有密切关系。HSP27蛋白与肉质密切相关[71],在木质肉中发现HSP27蛋白含量很高,因此木质肉的硬度大与其有关。同时Decorin蛋白作为一种胶原交联过程的调节剂,多项研究指出该蛋白的异常高表达引起胶原交联程度升高,导致胶原纤维紧密堆积,最终造成肌肉硬度增加[72]。与正常鸡胸肉相比,白纹肉与木质化鸡胸肉中自由水比例显著升高,木质化鸡胸肉中结合水和不易流动水比例显著下降,因此系水力下降[73]。肌肉中流动水是水分损失的主要来源,流动水比例升高导致系水力下降,木质化鸡胸肉保水性的降低可能与组织中部分肌纤维萎缩变性有关[74]。从营养成分的角度来看,白纹肉与木质化鸡胸肉中水分、粗脂肪和胶原蛋白含量显著增加,粗蛋白、粗灰分含量显著下降。脂肪与结缔组织的增加主要原因是由于肌原纤维的坏死而由其代替,水分含量也由于组织液的增加而升高[75],由此造成的营养价值降低会直接影响消费者的选择。也有学者对木质化鸡胸肉的凝胶品质进行了研究,发现与正常鸡胸肉凝胶相比,木质化鸡胸肉加工得到的凝胶微观结构松散,空隙较大,并且具有较高的α-螺旋含量和较低的β-折叠、β-转角含量[76]。已有报道表明,较高含量的β-折叠有利于形成高品质凝胶[77],木质化肉所加工的凝胶表现出的品质受到严重影响。以上品质变化直接导致了白纹肉与木质化肉的加工性能直线下降,无法得到正常的产品品质与出品率,这也给下游的鸡肉加工者带来了较大的困扰。
3.3 木质肉与白纹肉的改善
近些年来,木质肉与白纹肉的检测与发生机制多有学者深入研究,但是对于这类异常肉的改善仍未有一个良好的解决措施。研究表明,木质肉和白纹肉的产生与肉鸡生长速度过快和氧化应激有关,虽然可以通过降低肉鸡的生长速度一定程度降低白纹肉与木质肉的发生率,但是同时也影响生产性能和生产效率。在饲养方面,Bodle等[78]发现,提高肉鸡日粮中精氨酸和VC水平,或降低日粮氨基酸水平能减少白纹肉和木质肉的发生,提高鸡肉品质和价值。Zampiga等[79]研究表明,提高日粮精氨酸和赖氨酸的比值不会影响肉鸡生长性能,但能减少木质肉和白纹肉的发生率。可能由于精氨酸合成瓜氨酸产生NO,增加血液量,缓解缺血缺氧导致的应激损伤,减少木质肉和白纹肉的发生率。Córdova-Noboa等[80]在肉鸡日粮中添加600 mg/L胍基乙酸,提高了肉鸡生长性能和胸肉产量,减少了木质肉的发生率。以上通过改变饲喂条件的措施确实可以对木质肉与白纹肉发生率的降低有较好的成效,然而均限制了肌肉发育与生长性能,且无法妥善解决这一异常肉问题,因此需要从蛋白组学、代谢组学、基因组学深入研究,通过对基因与代谢的调控来根除此问题。对木质肉与白纹肉的利用也是研究甚少,因此对于既成的木质化肉可以通过改变形态加以利用,以减少损失。相关研究发现,肉糜状态下鸡胸肉的凝胶特性会发生相应改变,对促进木质肉产品的感官提升以及改善产品品质具有一定的作用[81]。孙啸等[82]将木质肉添加到香肠中,达到改善产品质构的效果,并且对于产品的品质并未产生不良影响。Tasoniero等[83]通过刀片嫩化处理木质肉,并将其与正常的鸡胸肉进行比较。结果表明:被处理的木质肉显示出质构改善的品质特征,并且与熟肉相比,生肉拥有更高的硬度和韧性,而熟肉仅在严重级时才显示出更高的硬度;在生肉状态下,刀片嫩化显著降低了生肉的压缩力和剪切力,但木质肉仍比正常胸肉硬;在熟肉状态下,刀片嫩化改善了木质肉的质地,剪切力与正常未处理的胸肉相似;尽管刀片嫩化可能无法完全解决木质肉质地特征异常的问题,但显示出改善木质肉熟肉质构的潜力,并且可以考虑对木质肉进行熟制利用。综上,对于木质肉与白纹肉的研究要从上游源头控制与下游的既成异常肉的改善利用入手,在极大限度降低经济损失的同时尽快解决此问题。
4 意大利面状胸肉
意大利面状胸肉是近年来新出现的一类鸡肉肌病,2015年,由Bilgili[84]进行了正式报道,有时也会伴随木质肉与白纹肉共同发生,由于是新生肌病且目前发生率不高,因此对其研究尚少。该肌病对蛋白质的影响较小,而对肌肉层的影响更显著,主要表现为肌肉完整性受损,内膜肌的结缔组织稀疏,损害纤维束凝聚力并有组织沉积。部分特征与所描述的白纹肉和木质肉重叠;肌肉变性伴有再生、正常组织结构的丧失、纤维坏死和溶解、脂肪组织浸润、炎性细胞浸润和水肿。然而,意大利面状胸肉的一个特殊特征在其他出现的肌病中未被检测到,即肌内膜和肌周结缔组织的逐渐稀少,这会损害纤维束的凝聚力,并伴有疏松结缔组织沉积。肌肉结构完整性受损可归因于这种不成熟新沉积的胶原蛋白,在视觉上影响消费者的选择。Baldi等[85]报道了意大利面状胸肉的质量特征,并将该肌病与白纹肉进行比较。核磁共振弛豫分析显示,意大利面状胸肉样品的表面切片中肌原纤维外水的比例较高,表现为持水性的降低;这些样本中氧化蛋白的浓度也高于正常胸部肌肉,这可能是肉类蛋白的化学状态对其功能的影响。阳离子调节改变在肉鸡骨骼肌损伤发病机制中有重要作用,肌肉中较高的钠水平是导致肌肉纤维中Ca2+摄入不平衡的触发因素,进而通过激活Ca2+依赖性蛋白酶和脂肪酶导致细胞膜完整性的改变[86]。到目前为止,意大利面状胸肉的病因尚不清楚,可能参与缺陷型阳离子调控的病理机制有待进一步研究,主要是阳离子稳态紊乱和细胞损伤之间的联系。在肉的品质方面,意大利面状胸肉会使得肌肉pH值降低、保水性、蛋白溶解性及乳液稳定性也变差,总的来说,意大利面状胸肉功能性质的改变可能是由于蛋白质含量的下降所引起。虽然此类新兴的鸡肉肌病发生率尚不高,但是若不加以控制可能会如木质肉等异常肉一般蔓延开来,带来更大的经济损失。这无疑是对鸡肉加工者的一个挑战,因此需要尽快对此问题开展研究,及时控制此类肌病问题。
表2列举了异常鸡肉的表征。
表2 鸡肉肌病对肌肉及蛋白功能特性的影响
Table 2 Effects of chicken myopathy on muscle and protein functional properties

类别外观表征变化品质特性变化肉糜凝胶品质变化深度胸肌病变肌肉颜色由出血色逐渐变为绿色Z线解体,肌动蛋白丝分解,核和其他细胞器的破坏类PSE肉苍白、柔软、汁液易流失类PSE肉蛋白溶解性下降,肌球蛋白与肌浆蛋白变性、热稳定性降低,pH值降低凝胶能力弱,相比正常禽肉显得更加柔软;盐溶性蛋白的溶解性、凝胶质构特性和保水性变差木质肉凝胶微观结构松散,空隙较大;并且具有较高的α-螺旋含量和较低的β-折叠、β-转角含量白纹肉肌肉表面出现平行于肌纤维的白色脂肪沉积条纹质感坚硬,胸大肌上部有明显坚硬部分,尾部有脊状突起,常伴有白色条纹和出血斑pH值升高、蛋白质含量下降、水分含量与粗脂肪含量增加、保水性降低、硬度也会增加意大利面状胸肉肌肉完整性受损,内膜肌的结缔组织稀疏损害纤维束凝聚力并发现有组织沉积肌肉pH值降低、保水性、蛋白溶解性及乳液稳定性也变差
5 结 语
鸡肉肌病所带来的影响不仅体现在表面的颜色与质地方面,对肌肉蛋白的功能特性也有极为恶劣的影响。不同的肌病问题所带来的品质影响可能不尽相同,但都对肌肉的整体功能产生了一定程度的破坏。快速生长和肉质量增加是近几十年来肉鸡异常肉问题出现的根本原因,基因改造与养殖技术的发展,使得禽肉的生长速度与体质量增速不断提升,相应的一些肌病层出不穷,这是在传统禽类养殖中所未有的,但日渐增长的鸡肉消费量迫使这个问题一再扩大,鸡肉产量基数的不断增长又使得此类问题所造成的损失愈加无法忽视,因此探究异常鸡肉的形成根本原因与进一步的改善利用需要同时进行。其一,源头控制,可从基因组学方向入手,深入研究异常肉的形成机制,通过调控关键基因对纤维型的转化进行选择,由于鸡胸肉中的肌纤维多为Ⅱb型快速酵解型纤维,相比于主要由Ⅰ型慢速氧化型纤维构成的腿肉来说,胸肉的代谢受到纤维类型的阻碍,如可进行调控转化将大大提升胸肉的呼吸代谢作用,促进毛细血管的生长保持,可能会较好地控制由生长速度与体质量增加所带来的各类肌病;再就是遗传学和育种计划对于禽肉的养殖、运输、屠宰环境和条件进行控制,尽可能地减少外界的应激刺激;对于肉鸡亦可通过定向调配饲喂配方来调节生长速度与肌肉形成速率,使得肉鸡可以均匀生长,避免代谢异常所引起的异常肉问题。其二,在既成的异常肉利用方面,不必全部修剪丢弃,可以进行合理分级,这些因肌病引起的异常肉并非细菌感染,对于人类的健康并没有危害,只是影响肉品的感官性质,从而左右消费者的选择。对症状较轻的鸡肉可以通过其他加工技术充分利用,随着新技术的发展,对异常肉的改善会逐渐从部分化强化为全面化,多重技术协调运用达到对鸡肉品质的提升效果,避免原料的浪费,从而挽回经济损失。类似于木质肉类的异常肉可以利用其营养特性与质构的变化作为辅料添加于其他产品中,提高产品的品质与质构,或可利用超微粉碎技术改变异常肉的结构功能等性质,亦或是通过酱卤发酵等工艺手段使之摆脱异常肌病所带来的不利影响。总而言之,对于肉鸡养殖不能仅着眼于生长速度与肌肉产量,需要运用新技术对肉的品质进行调控,减少异常肉问题的发生,从而降低经济损失,在产量足够的同时为消费者提供更优质的肉品,为禽肉养殖与加工者提供帮助。
[1]ZHAO Xue, XING Tong, HAN Minyi, et al. Application of isoelectric solubilization/precipitation processing to improve gelation properties of protein isolated from pale, soft, exudative (PSE)-like chicken breast meat[J]. LWT-Food Science and Technology, 2016, 72: 141-148.DOI:10.1016/j.lwt.2016.04.045.
[2]《新饲料》编辑. 国际贸易争端下的中国肉鸡产业[J]. 饲料与畜牧,2017(19): 5-14.
[3]计红芳, 李莎莎, 张令文, 等. 豌豆蛋白对鸡肉糜热诱导凝胶品质特性与微观结构的影响[J]. 食品科学, 2020, 41(4): 74-79.DOI:10.7506/spkx1002-6630-20181229-359.
[4]BAILEY R A, SOUZA E, AVENDANO S. Character rising the influence of genetics on breast muscle myopathies in broiler chickens[J]. Frontiers in Physiology, 2020, 11: 1041. DOI:10.3389/fphys.2020.01041.
[5]BARBUT S. Recent myopathies in broiler’s breast meat fillets[J].World’s Poultry Science Journal, 2019, 75(4): 559-582. DOI:10.1017/S0043933919000436.
[6]DONG Ming, CHEN Hongqiang, ZHANG Yumei, et al. Processing properties and improvement of pale, soft, and exudative-like chicken meat: a review[J]. Food and Bioprocess Technology, 2020, 13(8):1280-1291. DOI:10.1007/s11947-020-02464-3.
[7]STANGIERSKI J, TOMASZEWSKA-GRAS J, BARANOWSKA H M,et al. The effect of deep pectoral myopathy on the properties of broiler chicken muscles character rised by selected instrumental techniques[J].European Food Research and Technology, 2019, 245(2): 459-467.DOI:10.1007/s00217-018-3177-2.
[8]KIJOWSKI J, KUPISKA E, STANGIERSKI J, et al. Paradigm of deep pectoral myopathy in broiler chickens[J]. World’s Poultry Science Journal, 2014, 70(1): 125-138. DOI:10.1017/S0043933914000117.
[9]OZMEN O. Pathological examination of deep pectoral myopathy in house reared broilers[J]. Kafkas Universitesi Veteriner Fakultesi Dergisi, 2017, 23(5): 831-834. DOI:10.9775/kvfd.2017.17989.
[10]DINEV I, KANAKOV D. Deep pectoral myopathy: prevalence in 7 weeks old broiler chickens in Bulgaria[J]. Revue De Medecine Veterinaire, 2011, 162(6): 279-283.
[11]PASTUSZCZAK-FRAK M, URADZIŃSKI J. Hygienic and technological value of meat of turkey raw meat originating from flocks with green muscle disease[J]. Polish Journal of Veterinary Sciences,2009, 12(2): 243. DOI:10.1371/journal.ppat.1000281.
[12]JACEK K, EMILIA K. Dilemmas of limitation of DMP-type pectoral muscle myopathy in broiler chickens[J]. Zywnosc Nauka Technologia Jakosc, 2013, 20(6): 32-44. DOI:10.15193/zntj/2013/91/032-044.
[13]YALCIN S, AHIN K, TUZCU M, et al. Muscle structure and gene expression in pectoralis major muscle in response to deep pectoral myopathy induction in fast-and slow-growing commercial broilers[J].British Poultry Science, 2019, 60(3): 195-201. DOI:10.1080/00071668.2018.1430351.
[14]KECHUN T, BREEN E C, HANS-PETER G, et al. Capillary regression in vascular endothelial growth factor-deficient skeletal muscle[J]. Physiological Genomics, 2004, 18(1): 63-69. DOI:10.1152/physiolgenomics.00023.2004.
[15]PETRACCI M, MUDALAL S, SOGLIA F, et al. Meat quality in fastgrowing broiler chickens[J]. World’s Poultry Science Journal, 2015,71(2): 363-374. DOI:10.1017/S0043933915000367.
[16]LILBURN M S, GRIFFIN J R, WICK M. From muscle to food:oxidative challenges and developmental anomalies in poultry breast muscle[J]. Poultry Science, 2018, 98(10): 4255-4260. DOI:10.3382/ps/pey409.
[17]ZHAO Xue, BAI Yun, XING Tong, et al. Use of an isoelectric solubilization/precipitation process to modify the functional properties of PSE (pale, soft, exudative)-like chicken meat protein: a mechanistic approach[J]. Food Chemistry, 2018, 248: 201-209. DOI:10.1016/j.foodchem.2017.12.048.
[18]KUTTAPPAN V A, OWENS C M, COON C, et al. Incidence of broiler breast myopathies at 2 different ages and its impact on selected raw meat quality parameters[J]. Poultry Science, 2017, 96(8): 3005-3009. DOI:10.3382/ps/pex072.
[19]CARVALHO R H, SOARES A L, HONORATO D C, et al. The incidence of pale, soft, and exudative (PSE) turkey meat at a Brazilian commercial plant and the functional properties in its meat product[J].LWT-Food Science and Technology, 2014, 59(2): 883-888.DOI:10.1016/j.lwt.2014.07.019.
[20]ZHE Xueshen, XU Xinglian, MIN Huihui, et al. Occurrence and characterization of pale, soft, exudative-like broiler muscle commercially produced in china[J]. Journal of Integrative Agriculture,2012(8): 1384-1390. DOI:10.1016/S2095-3119(12)60137-3.
[21]KIM Y H B, WARNER R D, ROSENVOLD K. Influence of high pre-rigor temperature and fast pH fall on muscle proteins and meat quality: a review[J]. Animal Production Science, 2014, 54(4):375-395. DOI:10.1071/AN13329.
[22]ZHAO Xue, XING Tong, XU Xinglian, et al. Influence of extreme alkaline pH induced unfolding and aggregation on PSE-like chicken protein edible film formation[J]. Food Chemistry, 2020, 319: 126574.DOI:10.1016/j.foodchem.2020.126574.
[23]康壮丽, 赵颖颖, 李可, 等. 类PSE禽肉的品质特征探讨及研究进展[J]. 食品科学, 2017, 38(7): 284-289. DOI:10.7506/spkx1002-6630-201707045.
[24]CARVALHO R H, HONORATO D C B, GUARNIERI P D, et al.In-transit development of color abnormalities in turkey breast meat during winter season[J]. Journal of Animal Science and Technology,2017, 59(1): 4-10. DOI:10.1186/s40781-017-0157-1.
[25]THÉRON L, SAYD T, CHAMBON C, et al. Toward the prediction of PSE-like muscle defect in hams: using chemometrics for the spectral fingerprinting of plasma[J]. Food Control, 2020, 109: 106929.DOI:10.1016/j.foodcont.2019.106929.
[26]HE Jun, XIA Chenlan, HE Yuxin, et al. Proteomic responses to oxidative damage in meat from ducks exposed to heat stress[J]. Food Chemistry, 2019, 295: 129-137. DOI:10.1016/j.foodchem.2019.05.073.
[27]XING Tong, ZHAO Zerun, ZHAO Xue, et al. Phosphoproteome analysis of sarcoplasmic and myofibrillar proteins in stress-induced dysfunctional broiler pectoralis major muscle[J]. Food Chemistry,2020, 319: 126531. DOI:10.1016/j.foodchem.2020.126531.
[28]孙皓, 徐幸莲, 王鹏. 鸡肉类PSE肉与正常肉功能特性比较研究[J].食品科学, 2013, 34(21): 60-63. DOI:10.7506/spkx1002-6630-201321013.
[29]CHAN T Y, OMANA D A, BETTI M. Effect of ultimate pH and freezing on the biochemical properties of proteins in turkey breast meat[J]. Food Chemistry, 2011, 127(1): 109-117. DOI:10.1016/j.foodchem.2010.12.095.
[30]CHEN Hongqiang, WANG Huhu, WANG Mengyao, et al. Chicken breast quality-normal, pale, soft and exudative (PSE) and woodyinfluences the functional properties of meat batters[J]. International Journal of Food Science and Technology, 2018, 53(3): 654-664.DOI:10.1111/ijfs.13640.
[31]XING Tong, XU Xinglian, ZHOU Guanghong, et al. The effect of transportation of broilers during summer on the expression of heat shock protein70, postmortem metabolism and meat quality[J]. Journal of Animal Science, 2015, 93(1): 62-70. DOI:10.2527/jas.2014-7831.
[32]MARIELLE M O, PAULA G, BARROS S, et al. Effects of PSE meat and salt concentration on the technological and sensory characteristics of restructured cooked hams[J]. Meat Science, 2019, 152: 96-103.DOI:10.1016/j.meatsci.2019.02.020.
[33]ZHAO Xue, XING Tong, CHEN Xing, et al. Precipitation and ultimate pH effect on chemical and gelation properties of protein prepared by isoelectric solubilization/precipitation process from pale, soft,exudative (PSE)-like chicken breast meat[J]. Poultry Science, 2017,96(5): 1504-1512. DOI:10.3382/ps/pew412.
[34]SHEARD P R, HUGHES S I, JASPAL M H. Colour, pH and weight changes of PSE, normal and DFD breast fillets from British broilers treated with a phosphate-free, low salt marinade[J]. British Poultry Science, 2012, 53(1): 57-65. DOI:10.1080/00071668.2012.655707.
[35]CHAN J T, OMANA D A, BETTI M. Application of high pressure processing to improve the functional properties of pale, soft, and exudative (PSE)-like turkey meat[J]. Innovative Food Science and Emerging Technologies, 2011, 12(3): 216-225. DOI:10.1016/j.ifset.2011.03.004.
[36]LI Ke, KANG Zhuangli, ZHAO Yingying, et al. Use of high-intensity ultrasound to improve functional properties of batter suspensions prepared from PSE-like chicken breast meat[J]. Food and Bioprocess Technology,2014, 7(12): 3466-3477. DOI:10.1007/s11947-014-1358-y.
[37]ZHAO Xue, XING Tong, WANG Peng, et al. Oxidative stability of isoelectric solubilization/precipitation-isolated PSE-like chicken protein[J]. Food Chemistry, 2019, 283(15): 646-655. DOI:10.1016/j.foodchem.2019.01.035.
[38]XU Yujuan, ZHAO Xue, BIAN Guanglian, et al. Structural and solubility properties of pale, soft and exudative (PSE)-like chicken breast myofibrillar protein: effect of glycosylation[J]. LWTFood Science and Technology, 2018, 95: 209-215. DOI:10.1016/j.lwt.2018.04.051.
[39]DONG Ming, XU Yujuan, ZHANG Yumei, et al. Physicochemical and structural properties of myofibrillar proteins isolated from pale, soft,exudative (PSE)-like chicken breast meat: effects of pulsed electric field (PEF)[J]. Innovative Food Science and Emerging Technologies,2020, 59: 102277. DOI:10.1016/j.ifset.2019.102277.
[40]PRAUD C, JIMENEZ J, PAMPOUILLE E, et al. Molecular phenotyping of white striping and wooden breast myopathies in chicken[J]. Frontiers in Physiology, 2020, 11: 633. DOI:10.3389/fphys.2020.00633.
[41]KUTTAPPAN V A, HARGIS B M, OWENS C M. White striping and woody breast myopathies in the modern poultry industry: a review[J].Poultry Science, 2016, 95(11): 2724-2733. DOI:10.3382/ps/pew216.
[42]HASEGAWA Y, HARA T, KAWASAKI, et al. Effect of wooden breast on postmortem changes in chicken meat[J]. Food Chemistry,2020, 315: 126285. DOI:10.1016/j.foodchem.2020.126285.
[43]BILGILI S F, MELOCHE K J, CAMPASINO A, et al. The influence of carnitine and guanidino acetic acid supplementation of low and high amino acid density diets on Pectoralis major myopathies in broiler chickens[J]. Poultry Science, 2014, 93: 56. DOI:10.1093/jas/skab203.
[44]GRIFFIN J R, MORAES L, WICK M, et al. Onset of white striping and progression into wooden breast as defined by myopathic changes underlying Pectoralis major growth: estimation of growth parameters as predictors for stage of myopathy progression[J]. Avian Pathology,2018, 47(1): 2-13. DOI:10.1080/03079457.2017.1356908.
[45]TIJARE V V, YANG F L, KUTTAPPAN V A, et al. Meat quality of broiler breast fillets with white striping and woody breast muscle myopathies[J]. Poultry Science, 2016, 95(9): 2167-2173. DOI:10.3382/ps/pew129.
[46]XING Tong, ZHAO Xue, ZHANG Lian, et al. Characteristics and incidence of broiler chicken wooden breast meat under commercial conditions in China[J]. Poultry Science, 2019, 99(1): 620-628.DOI:10.3382/ps/pez560.
[47]CRUZ R F, VIEIRA S L, KINDLEIN L, et al. Occurrence of white striping and wooden breast in broilers fed grower and finisher diets with increasing lysine levels[J]. Poultry Science, 2017, 96(2): 501-510.DOI:10.3382/ps/pew310.
[48]ZOTTE A D, TASONIERO G, PUOLANNE E, et al. Effect of“Wooden Breast” appearance on poultry meat quality, histological traits, and lesions characterization[J]. Czech Journal of Animal Science, 2017, 62(2): 51-57. DOI:10.17221/54/2016-CJAS.
[49]SIHVO H K, AIRAS N, LINDÉN J, et al. Pectoral vessel density and early ultrastructural changes in broiler chicken wooden breast myopathy[J]. Journal of Comparative Pathology, 2018, 161: 1-10.DOI:10.1016/j.jcpa.2018.04.002.
[50]王成. 氧化应激影响肉仔鸡肉品质的主要MAPK信号转导通路[D].北京: 中国农业科学院, 2010.
[51]HOSOTANI M, KAWASAKI T, HASEGAWA Y, et al. Physiological and pathological mitochondrial clearance is related to Pectoralis major muscle pathogenesis in broilers with wooden breast syndrome[J]. Frontiers in Physiology, 2020, 11: 579. DOI:10.3389/fphys.2020.00579.
[52]BALDI G, YEN C N, DAUGHTRY M R, et al. Exploring the factors contributing to the high ultimate ph of broiler Pectoralis major muscles affected by wooden breast condition[J]. Frontiers in Physiology, 2020,11: 343-346. DOI:10.3389/fphys.2020.00343.
[53]ZAMBONELLI P, ZAPPATERRA M, SOGLIA F, et al. Detection of differentially expressed genes in broiler Pectoralis major muscle affected by White Striping-Wooden Breast myopathies[J]. Poultry Science, 2016, 95(12): 2771-2785. DOI:10.3382/ps/pew268.
[54]SOGLIA F, MAZZONI M, PETRACCI M. Spotlight on avian pathology: current growth-related breast meat abnormalities in broilers[J]. Avian Pathology, 2019, 48(1): 1-3. DOI:10.1080/0307945 7.2018.1508821.
[55]PAPAH M B, ABASHT B. Dysregulation of lipid metabolism and appearance of slow myofiber-specific isoforms accompany the development of Wooden Breast myopathy in modern broiler chickens[J]. Scientific Reports, 2019, 9(1): 17170. DOI:10.1038/s41598-019-53728-8.
[56]TIJARE V V, YANG F L, KUTTAPPAN V A, et al. Meat quality of broiler breast fillets with white striping and woody breast muscle myopathies[J]. Poultry Science, 2016, 95(9): 2167-2173. DOI:10.3382/ps/pew129.
[57]VELLEMAN S G. Pectoralis major (breast) muscle extracellular matrix fibrillar collagen modifications associated with the wooden breast fibrotic myopathy in broilers[J]. Frontiers in Physiology, 2020,11: 461. DOI:10.3389/fphys.2020.00461.
[58]CAI Ke, SHAO Wen, CHEN Xian, et al. Meat quality traits and proteome profile of woody broiler breast (Pectoralis major) meat[J].Poultry Science, 2017, 97(1): 337-346. DOI:10.3382/ps/pex284.
[59]TRAFFANO-SCHIFFO M V, CASTRO-GIRALDEZ M, COLOM R J,et al. Development of a spectrophotometric system to detect white striping physiopathy in whole chicken carcasses[J]. Sensors, 2017,17(5): 1024. DOI:10.3390/s17051024.
[60]CAROLINE G B, MARTIELLO M S, RAFAEL H D C, et al. Computer vision system and near-infrared spectroscopy for identification and classification of chicken with wooden breast, and physicochemical and technological characterization[J]. Infrared Physics and Technology, 2019,96: 303-310. DOI:10.1016/j.infrared.2018.11.036.
[61]WOLD J P, VEISETHKENT E, HOST V, et al. Rapid on-line detection and grading of wooden breast myopathy in chicken fillets by near-infrared spectroscopy[J]. PLoS ONE, 2017, 12(3): 17-21.DOI:10.1371/journal.pone.0173384.
[62]GARNER L J, MOREY A, SMITH A E, et al. Application of bioelectrical impedance analysis to detect broiler breast filets affected with woody breast myopathy[J]. Frontiers in Physiology, 2020, 11:808-811. DOI:10.3389/fphys.2020.00808.
[63]CARVALHO L M D, MADRUGA M S, MARIO E, et al. Occurrence of wooden breast and white striping in Brazilian slaughtering plants and use of near-infrared spectroscopy and multivariate analysis to identify affected chicken breasts[J]. Journal of Food Science, 2020,85(10): 3102-3112. DOI:10.1111/1750-3841.15465.
[64]BALDI G, SOGLIA F, LAGHI L, et al. Comparison of quality traits among breast meat affected by current muscle abnormalities[J].Food Research International, 2019, 115: 369-376. DOI:10.1016/j.foodres.2018.11.020.
[65]CHAUHAN S S, ENGLAND E M. Postmortem glycolysis and glycogenolysis: insights from species comparisons[J]. Meat Science,2018, 144: 118-126. DOI:10.1016/j.meatsci.2018.06.021.
[66]BALDI G, SOGLIA F, MAZZONI M, et al. Implications of white striping and spaghetti meat abnormalities on meat quality and histological features in broilers[J]. Animal, 2018, 12(1): 164-173.DOI:10.1017/S1751731117001069.
[67]TASONIERO G, CULLERE M, CECCHINATO M, et al.Technological quality, mineral profile, and sensory attributes of broiler chicken breasts affected by white striping and wooden breast myopathies[J]. Poultry Science, 2016, 95(11): 2707-2714.DOI:10.3382/ps/pew215.
[68]TASONIERO G, BOWKER B, ZHUANG H. Texture characteristics of Wooden Breast fillets deboned at different postmortem times[J].Poultry Science, 2020, 99: 4096-4099. DOI:10.1016/j.psj.2020.04.028.
[69]SOGLIA F, PETRACCI M, PUOLANNE E. Sarcomere lengths in wooden breast broiler chickens[J]. Italian Journal of Animal Science,2020, 19(1): 569-573. DOI:10.1080/1828051X.2020.1761271.
[70]ZHANG Xue, ZHAI Wei, LI Shuting, et al. Early postmortem proteome changes in normal and woody broiler breast muscles[J].Journal of Agricultural and Food Chemistry, 2020, 68(39): 11000-11010. DOI:10.1021/acs.jafc.0c03200.
[71]MA D, KIM Y H B. Proteolytic changes of myofibrillar and small heat shock proteins in different bovine muscles during aging: their relevance to tenderness and water-holding capacity[J]. Meat Science,2020, 163: 108090. DOI:10.1016/j.meatsci.2020.108090.
[72]CLARK D L, VELLEMAN S G. Spatial influence on breast muscle morphological structure, myofiber size, and gene expression associated with the wooden breast myopathy in broilers[J]. Poultry Science, 2016,95(12): 2930-2945. DOI:10.3382/ps/pew243.
[73]TASONIERO G, BERTRAM H C, YOUNG J F, et al. Relationship between hardness and myowater properties in Wooden Breast affected chicken meat: a nuclear magnetic resonance study[J]. LWTFood Science and Technology, 2017, 86: 20-24. DOI:10.1016/j.lwt.2017.07.032.
[74]SOGLIA F, LAGHI L, CANONICO L, et al. Functional property issues in broiler breast meat related to emerging muscle abnormalities[J]. Food Research International, 2016, 89(3): 1071-1076. DOI:10.1016/j.foodres.2016.04.042.
[75]PETRACCI M, SOGLIA F, MADRUGA M, et al. Wooden-breast,white striping, and spaghetti meat: causes, consequences and consumer perception of emerging broiler meat abnormalities[J]. Comprehensive Reviews in Food Science and Food Safety, 2019, 18: 565-583.DOI:10.1111/1541-4337.12431.
[76]陈宏强, 王虎虎, 赵雪, 等. 木质化鸡胸肉发生率统计及其肉糜功能特性研究[J]. 食品工业科技, 2017, 38(20): 49-53. DOI:10.13386/j.issn1002-0306.2017.20.010.
[77]LIU Ru, ZHAO Siming, XIE Bijun, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids, 2011, 25(5): 898-906.DOI:10.1016/j.foodhyd.2010.08.016.
[78]BODLE B C, ALVARADO C, SHIRLEY R B, et al. Evaluation of different dietary alterations in their ability to mitigate the incidence and severity of woody breast and white striping in commercial male broilers[J]. Poultry Science, 2018, 97(9): 3298-3310. DOI:10.3382/ps/pey166.
[79]ZAMPIGA M, LAGHI L, PETRACCI M, et al. Effect of different arginine-to-lysine ratios in broiler chicken diets on the occurrence of breast myopathies and meat quality attributes[J]. Poultry Science,2019, 98(6): 1-7. DOI:10.3382/ps/pey608.
[80]CÓRDOVA-NOBOA H A, OVIEDO-RONDÓN E O, SARSOUR A H,et al. Performance, meat quality, and pectoral myopathies of broilers fed either corn or sorghum based diets supplemented with guanidino acetic acid[J]. Poultry Science, 2018, 97(7): 2479-2493. DOI:10.3382/ps/pey096.
[81]CHEN Hongqiang, WANG Huhu, QI Jun, et al. Chicken breast quality-normal, pale, soft and exudative (PSE) and woody-influences the functional properties of meat batters[J]. International Journal of Food Science and Technology, 2017, 53(3): 175. DOI:10.1111/ijfs.13640.
[82]孙啸, 尤金杰, 周頔, 等. 添加木质肉的鸡肉火腿肠品质特性分析[J]. 现代食品科技, 2020, 36(8): 153-159. DOI:10.13982/j.mfst.1673-9078.2020.8.0082.
[83]TASONIERO G, BOWKER B, STELZLENI A, et al. Use of blade tenderization to improve wooden breast meat texture[J]. Poultry Science, 2019, 98(9): 4204-4211. DOI:10.3382/ps/pez163.
[84]BILGILI S F. Worthwhile Operational Guidelines and Suggestion.Broiler chicken myopathies: IV stringy/mushy breast[Z]. 2015.
[85]BALDI G, SOGLIA F, MAZZONI M, et al. Implications of white striping and spaghetti meat abnormalities on meat quality and histological features in broilers[J]. Animal and International Journal of Animal Bioscience, 2017, 12(1): 164-173. DOI:10.1017/S1751731117001069.
[86]TASONIERO G, ZHUANG H, GAMBLE G R, et al. Effect of spaghetti meat abnormality on broiler chicken breast meat composition and technological quality[J]. Poultry Science, 2020, 99(3): 1724-1733.DOI:10.1016/j.psj.2019.10.069.