氧化是食品加工贮藏过程中质量恶化的主要原因之一。对于肉制品,除了脂质氧化外,蛋白质氧化对肉类品质也有重要影响。蛋白质是肉组织的主要成分,决定肉制品的营养、风味、质地、感官、可食和加工及贮藏特性。氧化可导致蛋白质结构和特性的变化,如结构、构象、组成、溶解性、流变性、反应特性及蛋白酶活性,从而影响肉的食用品质和加工特性,以及营养特性和保质期等。由于氧化引起的产品色泽、质地、口感、风味及消化吸收的下降和有害、有毒物的产生,不仅影响消费者的接受度,而且对公众的健康也造成很大的危害,因此蛋白质氧化已成为食品工作者关心的重要课题。
蛋白氧化是指蛋白质发生共价修饰,这种共价修饰发生在活性自由基(包括活性氧(reactive oxygen species,ROS)和活性氮)及其相关氧化产物的作用下产生的直接氧化,以及脂质氧化和肌红蛋白氧化间接导致的蛋白氧化[1]。
ROS是引起肉类蛋白质氧化的主要原因,通常通过修饰蛋白质侧链或攻击蛋白质的多肽骨架引发蛋白质氧化。这些会导致蛋白质生化作用和结构的破坏,致使肉类食品出现一些感官、功能和营养方面的问题。羟自由基(·OH)是ROS的主要来源,也是最活泼的自由基[2]。而芬顿反应(见反应式(1)~(2))是用于产生·OH最重要的途径[3],它包含3 个主要部分:还原形式的过渡金属离子(Fe2+、Cu2+)、H2O2和抗坏血酸。前2 种物质产生反应性中间活性氧(即·OH和铁酰物种),抗坏血酸驱动“氧化还原循环”反应,将反应产生的金属离子的氧化形式还原为还原形式,以保持其形成ROS的能力[4]。在芬顿体系中,·OH氧化造成蛋白质侧链修饰,对蛋白质的功能特性有负面影响,但是在特定条件下又可适当提高[5]。氧化产生的变化将降低肉制品的品质(如风味变差、质地变硬、溶解性降低和产生不适宜的颜色),甚至产生一些有害化合物,不利于人体健康[6]。
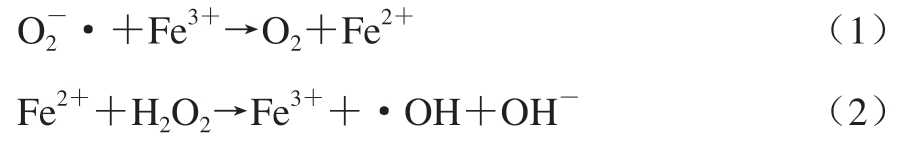
虽然蛋白质氧化已有诸多研究,但关于·OH诱导蛋白质氧化的历程和复杂途径及作用机制尚不清楚。为了更好地阐明·OH对肉类的氧化影响机制,本文对芬顿氧化体系作用下肉类蛋白氧化的最新研究进展进行阐述,并分析芬顿氧化对肉类蛋白结构与功能的影响,同时,探讨氧化对肉类品质和营养价值的影响效果及预防方法,为肉制品抗氧化提供思路,为未来我国肉类加工提供理论支撑。
1 ROS介导的蛋白质氧化
ROS是蛋白质氧化的首要作用物质,直接引发蛋白质氧化的活性自由基包括ROS和活性氮等[7],它们通过夺取氢、供给氧、偶合及裂解等反应途径作用于蛋白质的主肽链骨架或氨基酸侧链,且几乎所有氨基酸侧链都可以与自由基反应。ROS不仅可直接引起蛋白质氧化,还可先诱导脂质氧化和非酶糖基化,并通过活性中间产物间接诱导蛋白质氧化[8]。
图1为ROS(如由水的辐解或金属催化裂解产生)诱导的蛋白质氧化途径。当ROS作用于蛋白质时,会从蛋白质分子中提取氢原子以产生碳中心自由基(C·)(反应c),并引发蛋白氧化链反应,该自由基在氧气存在下转化为烷过氧自由基(RCOO·)(反应d),随后与Fe2+反应,或从另一蛋白质分子中提取氢原子,或与质子化形式的超氧化物自由基反应,生成烷基氢过氧化物(COOH)(反应f、g和h)。COOH进一步与氢过氧自由基(HO2·)或还原形式的铁(Fe2+)进一步反应形成烷氧自由基(CO·)(反应j和k)及其羟基衍生物(—COH)(反应m和n)[4-5]。然而,在没有氧气的情况下,2 个碳中心自由基可以相互反应,生成碳-碳交联衍生物(反应e)。除这些途径外,烷基过氧化物和烷基自由基衍生物可以通过二胺或α-酰胺化途径进行裂解反应(反应i和l)[7]。根据目标物和氧化剂的不同,蛋白质氧化将通过多种机制进行传递和终止,其后果包括巯基的丢失、蛋白质羰基的形成、交联的发生及芳香族氨基酸的修饰等[8]。
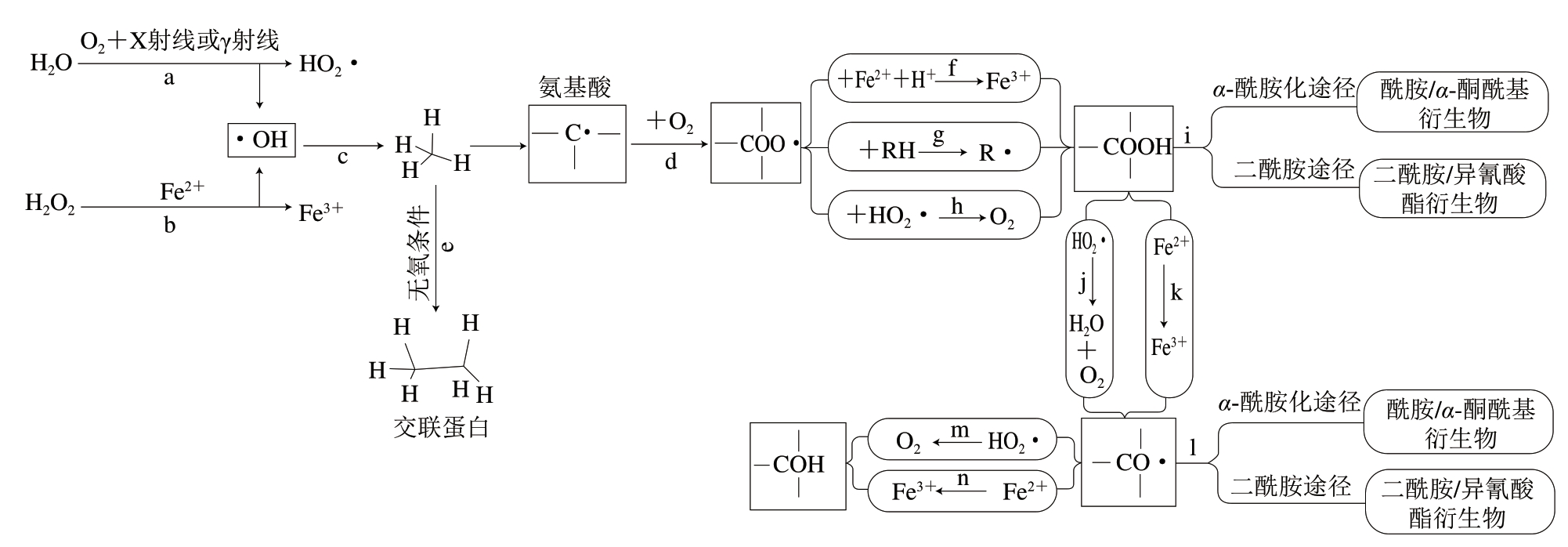
图1 自由基介导的蛋白氧化途径[7]
Fig. 1 Free radical-mediated pathway of protein oxidation[7]
2 芬顿体系氧化作用原理
在肉类食品中有3 个引发系统能够引起蛋白质氧化,包括芬顿系统、肌红蛋白系统和脂质氧化系统。特点为:1)芬顿系统,过渡金属(Fe2+、Cu2+)与H2O2反应可获取高活性·OH;2)肌红蛋白系统,高铁肌红蛋白与H2O2作用形成高铁肌红蛋白自由基;3)脂质氧化系统,脂质通过氧化衍生ROS自由基[9]。这些自由基均可称为蛋白氧化诱发剂[3]。最常用的氧化剂模型系统是芬顿系统,之前的研究表明,与H2O2作用生成的肌红蛋白自由基和脂质衍生的氧化剂系统相比,羟自由基氧化系统(hydroxyl radical-generating system,HRGS)对肌原纤维蛋白(myofibrillar proteins,MP)的氧化影响最为强烈,包括交联和聚集[10]。
·OH是一种天然的强氧化剂[11]。·OH在生物系统中通过氧化代谢自然形成,同时会形成超氧自由基,其作为不需要的副产物可以被超氧化物歧化酶去除,产物H2O2则被过氧化氢酶催化,或者在金属离子的存在下发生芬顿反应生成·OH。在所有产生·OH的途径中,由于反应的选择性,脉冲辐射分解是最重要的途径,它也是研究抗氧化剂与·OH之间反应原理以及测定其反应速率最权威的方法[12],但是其缺点是需要复杂的仪器和成本较高。相比来说,芬顿反应是用于产生·OH来测定抗氧化活性的最重要的化学反应(式(3))。
1931年提出了经典的自由基机制[13]。自发表以来,关于反应机制的讨论一直都有争论。Bray等[14]提出了一种产生铁氧基(FeO2+)的非自由基机制,其中铁处于氧化态+4价(式(4))。这种离子非常活泼,很容易氧化其他化合物。Halliwell等[15]报道,大多数证据表明·OH是主要破坏物质,但在·OH形成的过程中可能会产生其他ROS。因此,他们将经典的芬顿反应进行了拓展(式(5))。
Minero等[16]使用分光光度法和甲基黄作为反应底物证实了这一假设。他们发现·OH和一些其他氧化物质(如高价铁)都在芬顿反应中形成,并且产物的组成及比例取决于反应的pH值。Yamazaki等[17]使用5,5-二甲基-1-吡咯烷N-氧化物作为芬顿反应和紫外线光解产生的·OH的自旋捕获探针获得了类似的结果。
芬顿反应的产物也可用于测定·OH清除活性。例如,Benherlal等[18]使用FeCl2和H2O2作为反应物,进行经典的芬顿反应(式(1))。该反应可以通过螯合剂(如乙二胺四乙酸(ethylenedinitrilotetraacetic acid,EDTA)[19]或二亚乙基三胺五乙酸[20])的存在修饰反应。EDTA也被用作脱氧核糖损伤测定中的螯合剂,用于测定·OH清除活性。Aruoma等[21]研究表明,当去掉EDTA时,反应变得具有“位点特异性”,因为铁离子与脱氧核糖体分子结合,造成“现场”损伤。这种修饰后来被用于鉴定不同化合物螯合金属离子的能力,以减少·OH的产生。除Fe2+外,Fe3+还可用于生成·OH。Fe3+必须首先被还原,然后才能进行芬顿反应(式(1))[22]。使用抗坏血酸盐后,会形成循环(式(6))。
Arimboor等[23]从反应混合物中去掉H2O2,但“铁自氧化”的过程仍会产生·OH。Chen Jiwu等[24]提出的反应机理如式(7)~(8)所示。
式(8)中形成的H 2 O 2 随后经历芬顿反应(式(2))。
研究发现,其他金属(铜或钴)也可以发生芬顿反应,当铜以铜离子(Cu2+)形式添加到芬顿反应混合物中时,由于芬顿反应总是以较低的氧化态(Cu+)开始反应,故它会以与反应式(6)中Fe3+类似的方式被还原[25]。
还有多种方法可以用来测定·OH清除活性。Chen Jiwu[24]、Harris[25]等使用细胞培养物测定。Chen Jiwu等[24]通过酵母培养物中加入抗坏血酸、H2O2和CuSO4反应生成·OH。Harris等[25]使用RAW264.7巨噬细胞样细胞系,该细胞系被脂多糖激活并产生超氧阴离子自由基(![]() 和H2O2。这2 个反应随后形成·OH(式(9))。这种由过渡金属诱导催化的反应通常被称为“超氧化物辅助(或驱动)芬顿反应”。
和H2O2。这2 个反应随后形成·OH(式(9))。这种由过渡金属诱导催化的反应通常被称为“超氧化物辅助(或驱动)芬顿反应”。
Ozgová等[26]使用大鼠肝微粒体研究抗氧化剂对·OH诱导的脂质过氧化的影响,还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)生成系统用于生成·OH、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)、葡萄糖-6-磷酸、MgCl2和葡萄糖-6-磷酸脱氢酶。NADPH随后参与与微粒体获得的细胞色素P-450的反应。Albano等[27]认为,肝微粒体中形成了各种ROS,其中H2O2参与了芬顿反应和·OH的生成。
3 芬顿反应下肉类蛋白质的氧化
由于蛋白质具有许多不同的独特生物学功能,对蛋白质的氧化修饰会导致结构、功能及肉类品质的变化。在不同组成的芬顿反应中,蛋白质对·OH氧化(H2O2浓度为0~20 mmol/L)表现出高敏感性。但是相对于MP,纯化的肌球蛋白对·OH不敏感[28],可能是由于肌球蛋白在S1和S2区域更容易交联产生生物聚合物和蛋白质网络,这对乳化型凝胶肉制品的质地和稳定性至关重要。Li Yangqing等[29]通过向不同浓度的·OH体系中加入MP,发现鲤鱼蛋白氧化对·OH非常敏感,MP中羰基含量增加且疏水性增加,蛋白质功能特性(表面疏水性、水结合能力、弹性)降低。而Lu Han等[5]在加入不同浓度的H2O2后发现温和蛋白质氧化(冷冻贮藏和·OH)可以促进蛋白质凝胶性质。尽管·OH的加入有望促进蛋白的交联,但需要进一步的研究来确定肉类的氧化状态是否可以作为提高肉类质量的有利条件。目前研究的芬顿体系下对蛋白质的氧化主要体现在蛋白质结构、功能及肉类品质的变化上,在蛋白质结构方面涉及到氨基酸侧链的修饰、蛋白质的交联及游离氨基酸的变化。功能上则是对蛋白质的凝胶性、持水力等产生影响。蛋白质的功能特性改变导致肉类品质相应改变,而且肉类嫩度也会在·OH的作用下降低,肌红蛋白氧化后变成褐色的高铁肌红蛋白,导致肉色劣变。
3.1 对蛋白质结构的影响
3.1.1 氨基酸侧链的修饰
蛋白质氧化往往引起氨基酸侧链反应,如产生活性羰基,引起巯基丢失和形成二硫键[30]。蛋白质羰基的变化被广泛用于评估蛋白质氧化,通常采用2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)反应进行评估。羰基可与DNPH反应生成DNPH衍生物,然后通过分光光度法测定生成的腙的量进行量化。羰基化合物的产生是氧化蛋白质最常见的变化。生成蛋白质羰基的4 条主要途径包括:1)直接氧化赖氨酸、苏氨酸、精氨酸和脯氨酸的侧链[31];2)还原糖存在下的非酶糖基化[32];3)通过α-酰胺化途径或通过谷氨酰侧链的氧化裂解肽主链;4)共价结合非蛋白质羰基化合物,如4-羟基-2-壬醛或丙二醛[33]。在这4 种途径中,敏感氨基酸侧链的直接氧化已被证明为蛋白质羰基化的主要途径,也是对蛋白质直接氧化攻击的最有效来源。
蛋白质氧化也会造成巯基的丢失。蛋白质内巯基的含量十分丰富,其主要是多肽中半胱氨酸残基上的巯基基团。巯基和二硫键是蛋白质中反应活性最高的2 种基团,蛋白质中的游离巯基包括2 种,一种是包埋在疏水基团内的巯基,另一种是蛋白质表面的巯基。巯基基团(—SH)与Ellman试剂反应会生成在412 nm波长处有最大吸收峰的黄色物质[34],常用于比色法测定生物样品中巯基的含量。某些有机化合物(尿素和盐酸胍)的高浓度水溶液(4~8 mol/L)可以导致蛋白质分子氢键的断裂,蛋白质结构被破坏,从而导致蛋白质发生不同程度的变性。这些有机化合物的水溶液还可以增大疏水氨基酸残基在水溶液中的溶解度,降低疏水相互作用,从而使包埋于疏水基团内部的巯基暴露,因此可以通过加入尿素或盐酸胍测定总巯基含量[35]。目前针对巯基检测荧光探针的各种方法,原理是利用其特异性小分子只与巯基反应,而与其他基团在相应的条件下不会发生反应。
3.1.2 蛋白质交联
蛋白质的氧化也可使蛋白质产生交联。蛋白质交联的产生有以下3 种原因:1)缺氧情况下,氧化后蛋白质主链形成的以碳为中心的自由基相互作用,在蛋白质分子内部和分子间产生交联[36];2)巯基和酪氨酸残基氧化及亚硝基化会分别产生二硫键和二酪氨酸键,二硫键是导致蛋白质交联的主要原因之一,二酪氨酸键既可以在分子内成键也可以在分子间成键,其中分子间成键是蛋白质聚合的原因之一,这是聚合导致的蛋白质交联[37];3)蛋白质赖氨酸氨基与氧化产生的羰基衍生物反应也能导致蛋白质交联。氧化产生的羰基也会在蛋白质内部或不同蛋白质之间与赖氨酸的氨基反应。猪肉的肌原纤维蛋白在芬顿系统或高价铁催化氧化系统中处理后,二硫键的形成导致肌球蛋白交联位点发生改变,从头部转移至尾部。肌球蛋白重链的交联位点通过二硫键位于肌球蛋白轻链中,而在鸡肉肌原纤维暴露于·OH产生系统后,在肌球蛋白重链中未发现交联[38]。芬顿体系对蛋白质氧化影响的部分研究如表1所示。
表1 芬顿体系对蛋白质氧化影响的部分研究
Table1 Survey of selected research on protein oxidation in the Fenton system
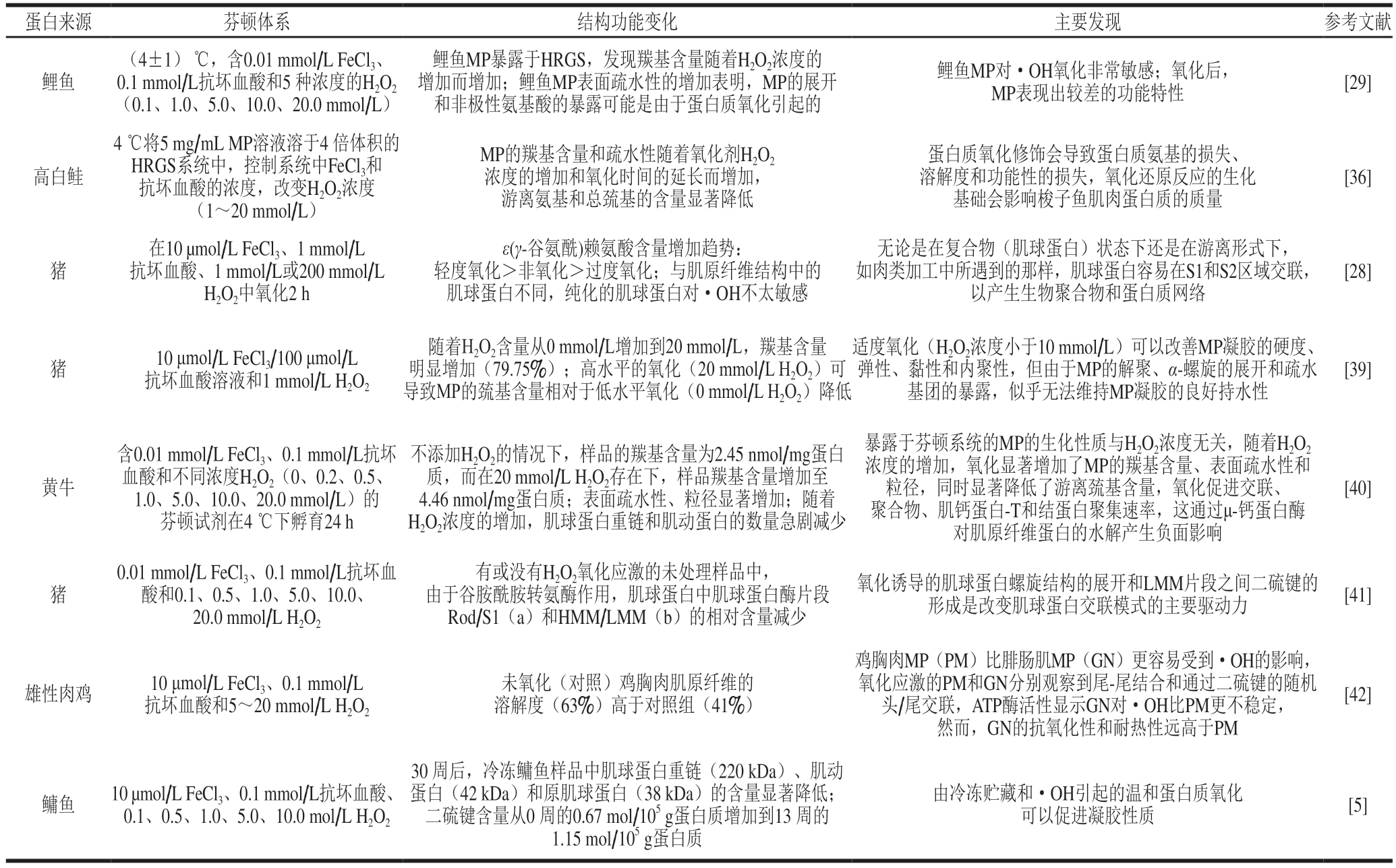
蛋白来源芬顿体系结构功能变化主要发现参考文献鲤鱼(4±1) ℃,含0.01 mmol/L FeCl3、0.1 mmol/L抗坏血酸和5 种浓度的H2O2(0.1、1.0、5.0、10.0、20.0 mmol/L)鲤鱼MP暴露于HRGS,发现羰基含量随着H2O2浓度的增加而增加;鲤鱼MP表面疏水性的增加表明,MP的展开和非极性氨基酸的暴露可能是由于蛋白质氧化引起的鲤鱼MP对·OH氧化非常敏感;氧化后,MP表现出较差的功能特性[29]高白鲑4 ℃将5 mg/mL MP溶液溶于4 倍体积的HRGS系统中,控制系统中FeCl3和抗坏血酸的浓度,改变H2O2浓度(1~20 mmol/L)MP的羰基含量和疏水性随着氧化剂H2O2浓度的增加和氧化时间的延长而增加,游离氨基和总巯基的含量显著降低蛋白质氧化修饰会导致蛋白质氨基的损失、溶解度和功能性的损失,氧化还原反应的生化基础会影响梭子鱼肌肉蛋白质的质量[36]猪在10 μmol/L FeCl3、1 mmol/L抗坏血酸、1 mmol/L或200 mmol/L H2O2中氧化2 h ε(γ-谷氨酰)赖氨酸含量增加趋势:轻度氧化>非氧化>过度氧化;与肌原纤维结构中的肌球蛋白不同,纯化的肌球蛋白对·OH不太敏感无论是在复合物(肌球蛋白)状态下还是在游离形式下,如肉类加工中所遇到的那样,肌球蛋白容易在S1和S2区域交联,以产生生物聚合物和蛋白质网络[28]猪10 μmol/L FeCl3/100 μmol/L抗坏血酸溶液和1 mmol/L H2O2随着H2O2含量从0 mmol/L增加到20 mmol/L,羰基含量明显增加(79.75%);高水平的氧化(20 mmol/L H2O2)可导致MP的巯基含量相对于低水平氧化(0 mmol/L H2O2)降低适度氧化(H2O2浓度小于10 mmol/L)可以改善MP凝胶的硬度、弹性、黏性和内聚性,但由于MP的解聚、α-螺旋的展开和疏水基团的暴露,似乎无法维持MP凝胶的良好持水性[39]黄牛含0.01 mmol/L FeCl3、0.1 mmol/L抗坏血酸和不同浓度H2O2(0、0.2、0.5、1.0、5.0、10.0、20.0 mmol/L)的芬顿试剂在4 ℃下孵育24 h不添加H2O2的情况下,样品的羰基含量为2.45 nmol/mg蛋白质,而在20 mmol/L H2O2存在下,样品羰基含量增加至4.46 nmol/mg蛋白质;表面疏水性、粒径显著增加;随着H2O2浓度的增加,肌球蛋白重链和肌动蛋白的数量急剧减少暴露于芬顿系统的MP的生化性质与H2O2浓度无关,随着H2O2浓度的增加,氧化显著增加了MP的羰基含量、表面疏水性和粒径,同时显著降低了游离巯基含量,氧化促进交联、聚合物、肌钙蛋白-T和结蛋白聚集速率,这通过μ-钙蛋白酶对肌原纤维蛋白的水解产生负面影响[40]猪0.01 mmol/L FeCl3、0.1 mmol/L抗坏血酸和0.1、0.5、1.0、5.0、10.0、20.0 mmol/L H2O2有或没有H2O2氧化应激的未处理样品中,由于谷胺酰胺转氨酶作用,肌球蛋白中肌球蛋白酶片段Rod/S1(a)和HMM/LMM(b)的相对含量减少氧化诱导的肌球蛋白螺旋结构的展开和LMM片段之间二硫键的形成是改变肌球蛋白交联模式的主要驱动力[41]雄性肉鸡10 μmol/L FeCl3、0.1 mmol/L抗坏血酸和5~20 mmol/L H2O2未氧化(对照)鸡胸肉肌原纤维的溶解度(63%)高于对照组(41%)鸡胸肉MP(PM)比腓肠肌MP(GN)更容易受到·OH的影响,氧化应激的PM和GN分别观察到尾-尾结合和通过二硫键的随机头/尾交联,ATP酶活性显示GN对·OH比PM更不稳定,然而,GN的抗氧化性和耐热性远高于PM[42]鳙鱼10 μmol/L FeCl3、0.1 mmol/L抗坏血酸、0.1、0.5、1.0、5.0、10.0 mol/L H2O2 30 周后,冷冻鳙鱼样品中肌球蛋白重链(220 kDa)、肌动蛋白(42 kDa)和原肌球蛋白(38 kDa)的含量显著降低;二硫键含量从0 周的0.67 mol/105 g蛋白质增加到13 周的1.15 mol/105 g蛋白质由冷冻贮藏和·OH引起的温和蛋白质氧化可以促进凝胶性质[5]
3.1.3 游离氨基酸
自由基攻击蛋白质分子的机制会导致蛋白质交联、蛋白质裂解和/或氨基酸侧链的修饰[43],每个反应都会产生特定的氧化衍生物。尽管所有氨基酸都可以被活性氧修饰,但由于半胱氨酸、蛋氨酸中硫基的反应敏感性较高,所以最容易发生氧化变化[7]。半胱氨酸的单电子氧化或双电子氧化可以形成类似的终产物。半胱氨酸与自由基氧化剂的单电子氧化可产生硫基,其有2 个主要途径:与其他硫醇/硫醇盐反应生成二硫化物,或与O2反应生成过氧化硫基。半胱氨酸和氧化剂之间的双电子氧化可导致亚磺酸和磺酸的形成。这些物质不稳定,可通过水解反应生成含氧酸,或通过与另一个硫醇基反应生成二硫键[8]。类似地,蛋氨酸残基很容易被各种氧化剂氧化,蛋氨酸氧化的主要产物是亚砜,它可以进一步氧化为砜。蛋氨酸亚砜可被蛋氨酸亚砜还原酶、巯基乙醇、二硫苏糖醇等还原试剂还原为蛋氨酸[3]。与这2 个氨基酸相比,其他氨基酸氧化需要更加严格的条件。对于芳香族氨基酸,包括组氨酸、苯丙氨酸、色氨酸和酪氨酸,主要反应是芳香族氨基酸残基的添加。蛋白质的氧化导致各种氧化衍生物的产生[44]。蛋白质的主要氧化修饰发生在氨基酸侧链上,包括硫醇氧化、芳香羟基化和羰基的形成[9]。
3.2 对蛋白质功能特性的影响
MP的功能特性是影响肉和肉制品品质的主要因素[5]。研究证明,蛋白质的结构与其功能特性紧密相关,因此肌肉蛋白的氧化通常会伴随着蛋白质溶解度以及凝胶性、乳化性及保水性等功能特性的改变,从而影响肉的嫩度、多汁性以及蛋白质的保水性等功能[40]。蛋白质中的氨基酸经氧化后,其侧链基团的改变会导致蛋白肽链一级结构的变化,而羰基、共价键的形成及肽链的断裂等会进一步改变蛋白质构象,并导致蛋白质二级结构的变化,随之蛋白质的三级结构及四级结构也会发生相应的改变。从营养学角度分析,蛋白的氧化会导致必需氨基酸的损失,同时蛋白结构经氧化导致的分解或重聚均会影响蛋白质的消化性以及肉制品的营养价值[36],近年来,蛋白质氧化对肉制品风味的影响也逐渐引起人们的关注,如通过氧化途径形成的蛋白羰基及席夫碱可能会影响风味的形成,尽管如此,总结近年来的研究可以发现,蛋白质氧化并不一定总是导致蛋白质加工性能及相应功能特性的下降,适度的蛋白质氧化甚至可以改善或提高肌肉蛋白的功能特性。Liu Zelong等[45]报道,在4 ℃与FeCl3/抗坏血酸盐/H2O2孵育后,猪背最长肌显示出较低的持水能力。持水能力和产物产量的变化与蛋白羰基含量的增加以及肌原纤维和肌浆蛋白之间的交联一致。持水能力降低可能是由于氧化肌肉样品中相邻纤维之间的细胞外空间扩大。然而,蛋白质氧化也会对蛋白质功能产生负面影响。当暴露于3 种不同的氧化体系(螯合的3 价铁、H2O2和抗坏血酸)时,切碎的鳕鱼肌肉显示出更好的凝胶化和乳化特性,蛋白氧化后形成的凝胶剪切力和硬度分别增加70%和20%[46]。在牛心制成的肉糜中,3 种水洗处理相比,抗氧化剂洗涤(没食子酸丙酯和α-生育酚)后的肌肉蛋白凝胶形成能力降低,蛋白质羰基含量升高[47]。由于蛋白质氧化而增加的凝胶形成能力可能与多肽之间及蛋白质之间交联的形成有关,这些交联可以降低凝胶网络的迁移率并稳定凝胶基质内的其他非共价键。
蛋白质氧化也可诱导蛋白质聚合和聚集,从而改变其消化率,并对肌肉食品的营养价值产生负面影响[40]。蛋白质氧化可以改变蛋白质内的分子间和分子内相互作用,从而影响它们的构象。由于三级结构的变化,这些变化通常可以增加蛋白质的表面疏水性。此外,蛋白质氧化与二聚体、三聚体和多聚体的形成,以及其他相互间和内部的交联有关,这样的结果可以进一步导致蛋白质聚集[39],从而影响肉的品质。
3.3 对肉类品质的影响
动物屠宰后,维持自身抗氧化防御系统的能力大大降低,自由基不断在体内积累,氧化应激水平增加,从而导致蛋白质氧化,影响蛋白质的特性,包括蛋白质交联、溶解度的变化,进而引起肉的嫩度、持水性、色泽等品质的变化[2]。蛋白质对肉类品质的影响机制见图2。
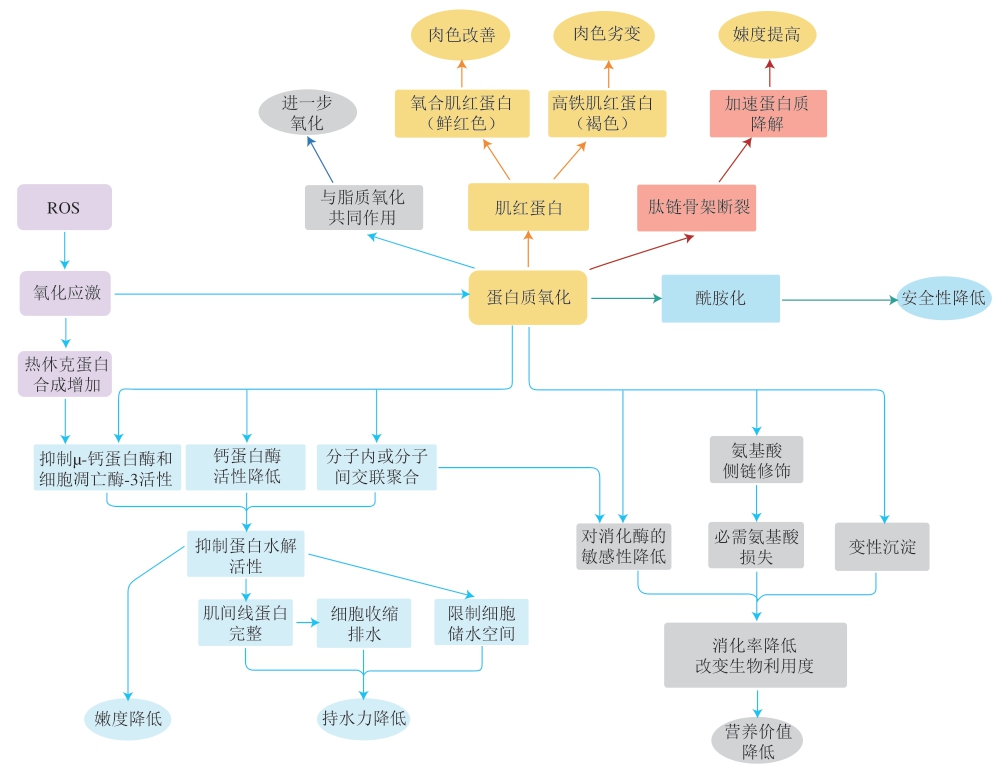
图2 蛋白质对肉类品质的影响机制[48]
Fig. 2 Mechanism by which protein oxidation affects meat quality[48]
蛋白质氧化对肉制品嫩度的作用有两方面:一是减少蛋白质在氧化过程中的水解,这种机制可能是蛋白质氧化过程中参与肉类嫩化的蛋白水解酶的失活和蛋白氧化导致蛋白水解敏感性降低[46],由于μ-钙蛋白酶和m-钙蛋白酶在其活性位点同时含有组氨酸和含巯基的半胱氨酸残基,此类基团的氧化降解可能导致酶失活[49];二是通过二硫键和诱导蛋白交联来影响肉的嫩度,蛋白质交联将增强肌原纤维结构,从而导致肌肉组织的韧性增加[50]。并且肉的功能特性直接影响其质地、风味、嫩度等食用品质[45]。肌肉中含有极不稳定的肌红蛋白,包括氧合肌红蛋白、高铁肌红蛋白及脱氧肌红蛋白,肌红蛋白含量和比例决定肌肉的颜色。高铁肌红蛋白与蛋白氧化密切相关。在低氧条件下,脱氧肌红蛋白和氧合肌红蛋白都容易被氧化为褐色的高铁肌红蛋白,而高铁肌红蛋白还原酶可以持续地将高铁肌红蛋白还原,保持肉颜色的稳定性,在高氧浓度(70%~80%)条件下,使肉表面的肌红蛋白氧合为鲜红的氧合肌红蛋白,有利于改善肉色,在鲜肉的包装中被广泛应用。蛋白质氧化主要通过以下几种途径对肉中蛋白质的营养价值产生影响:一方面,蛋白质氧化会产生羰基化、亚硝基化、羟基化等氨基酸侧链修饰,造成必需氨基酸的损失;另一方面,蛋白质之间的交联聚合反应会使蛋白质对消化酶的敏感性降低,造成蛋白质消化率下降;最后,高水平的氧化还会导致蛋白质变性沉淀,蛋白质的溶解度及生物利用度降低,从而使肉类蛋白质的营养价值降低。此外,蛋白质片段化还会造成α-酰胺化,产生二酰胺,使肉的食用安全性降低,甚至会增加人体细胞毒性和致突变性,危害人体健康[43]。Fu Qingquan等[40]研究发现,蛋白质氧化过程中,对氧化敏感的氨基酸受到氧化修饰,使氨基酸的生物利用度降低,引起蛋白质聚集,导致消化率下降,从而降低肉的营养价值,但轻度水平的氧化可使蛋白质更易被相应的蛋白酶消化。Estévez等[51]研究发现,蛋白质氧化造成的羰基化会导致赖氨酸、苏氨酸和精氨酸等必需氨基酸的不可逆修饰,从而造成必需氨基酸的损失。一般认为,钙蛋白酶系统负责调节宰后肌肉中蛋白质的降解,并且与宰后贮藏期间的肉嫩度和持水量有关,钙蛋白酶系统由m-钙蛋白酶和μ-钙蛋白酶及其抑制剂钙蛋白酶抑制剂组成。钙蛋白酶在钙的存在下自溶,这种自溶表明它们在宰后的肌肉蛋白水解后被激活。由于m-钙蛋白酶和μ-钙蛋白酶均为半胱氨酸蛋白酶,氧化可能会调节它们的蛋白水解活性,从而影响鲜肉质量。Carlin等[52]进一步确定了氧化对纯化的m-钙蛋白酶和μ-钙蛋白酶活性的影响以及μ-钙蛋白酶和钙蛋白酶抑制剂之间的相互作用。结果表明:μ-钙蛋白酶和m-钙蛋白酶的蛋白质水解活性在不同pH值(6.0、6.5、7.5)条件下被H2O2诱导的氧化所抑制,H2O2在pH 6.5和7.5条件下降低了钙蛋白酶抑制剂对钙蛋白酶活性的抑制效果,并允许μ-钙蛋白酶在钙蛋白酶抑制剂存在下降解蛋白。这些研究强有力地表明蛋白质氧化通过介导钙蛋白酶的自溶和蛋白水解活性影响鲜肉品质。
4 对蛋白质氧化的干预和抑制
在工业生产中,通常使用抗氧化剂来减少蛋白质氧化。添加合成抗氧化剂是工业中常用的一种保持肉品品质的方法。人工合成抗氧化剂的毒副作用较大,对人体的器官(肝、脾、肺)均有负面影响[53],由于天然抗氧化剂与合成抗氧化剂相比具有潜在的健康益处,天然抗氧化剂的需求正在增加。天然抗氧化剂广泛分布于植物、动物组织和微生物中。大多数天然抗氧化剂都是从植物中获得的。在肉和肉制品中添加多酚或天然提取物是减少蛋白氧化和变质的一种有效方法。研究表明,天然抗氧化剂能有效增加蛋白质的稳定性,Xu Mingfeng等[54]发现,白藜芦醇在鱼油中能使蛋白质消化率显著增加,白藜芦醇的掺入显著增强了鱼油在氧化应激下的稳定性。杨文平等[55]在冷却猪肉中加入500 mg/kg皮燕麦多酚提取物,发现添加皮燕麦多酚可以在一定程度上减少羰基的形成和防止巯基在冷藏过程中的丢失,有效延缓MP氧化,多酚通过与MP共价交联结合阻碍了氧化剂的作用部位,或者有效清除了活性氧自由基,阻断蛋白质羰基链式反应,抑制羰基的形成。Cheng Shuang等[56]将桑葚多酚加入肉制品中,发现桑葚多酚可以显著延缓羰基的形成,通过增强的离子键和弱化的氢键、疏水键和二硫键来提高蛋白质稳定性。还有研究认为,添加天然抗氧化剂还能有效改善冷冻肉制品质量,通过抑制蛋白质羰基的积累有效延缓蛋白质的氧化,从而减缓冷冻肉类品质的降低[57]。除抗氧化特性外,大多数天然抗氧化剂在肉类中的应用是多功能的,它们在肉类加工和贮藏过程中不仅起到抗氧化作用,还有抑菌防腐、促进有益微生物生长等作用,Khalifah等[58]发现,柠檬草可以提高日本鹌鹑体内乳酸菌的浓度。百里香醇是百里香的主要成分之一,含量高达40%~80%,有助于抗菌和抗氧化活性。Huang Liyuan等[59]发现,应用百里香精油改良剂抑制了熏马肉香肠中有害微生物(肠杆菌科)的生长。因此,这种单萜烯衍生物已被用作食品和医药用途的防腐剂、抗氧化剂和抗菌剂。
与合成抗氧化剂相比,天然提取物可能更容易被消费者和监管机构接受,也更有利于人体健康[60]。因此这些天然抗氧化剂可以用作肉类中的多功能添加剂,尽管已经有很多天然抗氧化剂广泛应用于食品中,但仍有必要研究在肉制品中使用此类天然提取物的安全性和可接受性。
5 结 语
蛋白氧化的机制尚不完全明晰,在芬顿体系中研究蛋白氧化能让蛋白氧化机理研究更加深入。总体来说,蛋白质氧化弊大于利。因此,在肉的生产和加工过程中,应尽量减少自由基对蛋白质氧化的作用,从而减少对肉品质造成的负面影响。然而,关于蛋白质氧化对肉品质影响的机制及蛋白质氧化作用机制的研究依然是一个巨大的挑战。随着对蛋白质氧化研究的深入,降低活性自由基的影响,或者考虑如何利用而不是单纯抑制,可作为未来研究的重点。此外,关于氧化后肉制品加工后的品质也值得进一步研究。
[1] CHENG Shuang, HE Yuxin, ZENG Tao, et al. Heat stress induces various oxidative damages to myofibrillar proteins in ducks[J]. Food Chemistry, 2022, 390: 133209. DOI:10.1016/j.foodchem.2022.133209.
[2] ESTÉVEZ M. Protein carbonyls in meat systems: a review[J]. Meat Science, 2011, 89(3): 259-279. DOI:10.1016/j.meatsci.2011.04.025.
[3] ZHAO Xue, XU Xinglian, ZHOU Guanghong. Covalent chemical modification of myofibrillar proteins to improve their gelation properties: a systematic review[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1): 924-959. DOI:10.1111/1541-4337.12684.
[4] ESTÉVEZ M, VENTANAS S, HEINONEN M. Formation of Strecker aldehydes between protein carbonyls-α-aminoadipic and γ-glutamic semialdehydes- and leucine and isoleucine[J]. Food Chemistry, 2011,128(4): 1051-1057. DOI:10.1016/j.foodchem.2011.04.012.
[5] LU Han, ZHANG Longteng, LI Qingzheng, et al. Comparison of gel properties and biochemical characteristics of myofibrillar protein from bighead carp (Aristichthys nobilis) affected by frozen storage and a hydroxyl radical-generation oxidizing system[J]. Food Chemistry,2017, 223: 96-103. DOI:10.1016/j.foodchem.2016.11.143.
[6] CHENG Jingrong, XU Liang, XIANG Rong, et al. Effects of mulberry polyphenols on oxidation stability of sarcoplasmic and myofibrillar proteins in dried minced pork slices during processing and storage[J]. Meat Science, 2020, 160: 107973. DOI:10.1016/j.meatsci.2019.107973.
[7] SOLADOYE O P, JUAREZ M L, AALHUS J L, et al. Protein oxidation in processed meat: mechanisms and potential implications on human health[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(2): 106-122. DOI:10.1111/1541-4337.12127.
[8] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods: a review[J]. Molecular Nutrition and Food Research,2011, 55(1): 83-95. DOI:10.1002/mnfr.201000453.
[9] STADTMAN E R, LEVINE R L. Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J]. Amino Acids,2003, 25(3/4): 207-218. DOI:10.1007/s00726-003-0011-2.
[10] LIAO Guangming, ZHANG Haiping, JIANG Yiren, et al. Effect of lipoxygenase-catalyzed linoleic acid oxidation on structural and rheological properties of silver carp (Hypophthalmichthys molitrix)myofibrillar protein[J]. LWT-Food Science and Technology, 2022,161: 113388. DOI:10.1016/j.lwt.2022.113388.
[11] LI Xue, DENG Xiaorong, GUO Xin, et al. Two-dimensional gel analysis to investigate the effect of hydroxyl radical oxidation on freshness indicator protein of Coregonus peled during 4 ℃storage[J]. LWT-Food Science and Technology, 2022, 158: 113147.DOI:10.1016/j.lwt.2022.113147.
[12] HALLIWELL B. Antioxidant characterization: methodology and mechanism[J]. Biochemical Pharmacology, 1995, 49(10): 1341-1348.DOI:10.1016/0006-2952(95)00088-H.
[13] BARBUSIŃSKI K. Fenton reaction-controversy concerning the chemistry[J]. Ecological Chemistry and Engineering S, 2009, 16:347-358.
[14] BRAY W C, GORIN M H. Ferryl ion, a compound of tetravalent iron[J]. Journal of the American Chemical Society, 1932, 54(5): 2124-2125. DOI:10.1021/ja01344a505.
[15] HALLIWELL B, GUTTERIDGE J M. Role of free radicals and catalytic metal ions in human disease: an overview[J]. Methods in Enzymology, 1990, 186: 1-85. DOI:10.1016/0076-6879(90)86093-b.
[16] MINERO C, LUCCHIARI M, MAURINO V, et al. A quantitative assessment of the production of OH and additional oxidants in the dark Fenton reaction: Fenton degradation of aromatic amines[J]. RSC Advances, 2013, 3(48): 26443. DOI:10.1039/c3ra44585b.
[17] YAMAZAKI I, PIETTE L H. EPR spin-trapping study on the oxidizing species formed in the reaction of the ferrous ion with hydrogen peroxide[J]. Journal of the American Chemical Society,1991, 113(20): 7588-7593. DOI:10.1021/ja00020a021.
[18] BENHERLAL P S, ARUMUGHAN C. Chemical composition and in vitro antioxidant studies on Syzygium cumini fruit[J]. Journal of the Science of Food and Agriculture, 2007, 87(14): 2560-2569.DOI:10.1002/jsfa.2957.
[19] TAI Chao, GU Xuexin, ZOU Hong, et al. A new simple and sensitive fluorometric method for the determination of hydroxyl radical and its application[J]. Talanta, 2002, 58: 661-667. DOI:10.1016/s0039-9140(02)00370-3.
[20] TSUDA T, SHIGA K, OHSHIMA K, et al. Inhibition of lipid peroxidation and the active oxygen radical scavenging effect of anthocyanin pigments isolated from Phaseolus vulgaris L.[J].Biochemical Pharmacology, 1996, 52(7): 1033-1039.DOI:10.1016/0006-2952(96)00421-2.
[21] ARUOMA O I, GROOTVELD M, HALLIWELL B. The role of iron in ascorbate-dependent deoxyribose degradation: evidence consistent with a site-specific hydroxyl radical generation caused by iron ions bound to the deoxyribose molecule[J]. Journal of Inorganic Biochemistry, 1987, 29(4): 289-299. DOI:10.1016/0162-0134(87)80035-1.
[22] HALLIWELL B, GUTTERIDGE J M C, ARUOMA O I. The deoxyribose method: a simple “test-tube” assay for determination of rate constants for reactions of hydroxyl radicals[J]. Analytical Biochemistry,1987, 165(1): 215-219. DOI:10.1016/0003-2697(87)90222-3.
[23] ARIMBOOR R, ARUMUGHAN C. HPLC-DAD-MS/MS profiling of antioxidant flavonoid glycosides in sea buckthorn (Hippophae rhamnoides L.) seeds[J]. International Journal of Food Sciences and Nutrition, 2012, 63(6): 730-738. DOI:10.3109/09637486.2011.652075.
[24] CHEN Jiwu, ZHU Zhenqin, HU Tianxi, et al. Structure-activity relationship of natural flavonoids in hydroxyl radical-scavenging effects[J]. Acta Pharmacologica Sinica, 2002, 23(7): 667-672.DOI:10.1016/S0024-3205(02)01765-4.
[25] HARRIS G K, QIAN Y, LEONARD S S, et al. Luteolin and chrysin differentially inhibit cyclooxygenase-2 expression and scavenge reactive oxygen species but similarly inhibit prostaglandin-E2 formation in RAW264.7 Cells[J]. The Journal of Nutrition, 2006,136(6): 1517-1521. DOI:10.1093/jn/136.6.1517.
[26] OZGOV Á Š, HEŘM NEK J, GUT I. Different antioxidant effects of polyphenols on lipid peroxidation and hydroxyl radicals in the NADPH-, Fe-ascorbate- and Fe-microsomal systems[J]. Biochemical Pharmacology, 2003, 66(7): 1127-1137. DOI:10.1016/S0006-2952(03)00425-8.
[27] ALBANO E, TOMASI A, GORIA-GATTI L, et al. Free radical metabolism of alcohols by rat liver microsomes[J]. Free Radical Research Communications, 1987, 3(1/5): 243-249.DOI:10.3109/10715768709069789.
[28] LI Chunqiang, XIONG YoulingL.. Mild oxidation promotes myosin S2 cross-linking by microbial transglutaminase[J]. Food Chemistry,2019, 287: 390-397. DOI:10.1016/j.foodchem.2019.02.097.
[29] LI Yangqing, KONG Baohua, XIA Xiufang, et al. Structural changes of the myofibrillar proteins in common carp (Cyprinus carpio) muscle exposed to a hydroxyl radical-generating system[J].Process Biochemistry, 2013, 48(5/6): 863-870. DOI:10.1016/j.procbio.2013.03.015.
[30] ZHENG Yao, ZHANG Long, QIU Zehui, et al. Comparison of oxidation extent, structural characteristics, and oxidation sites of myofibrillar protein affected by hydroxyl radicals and lipid-oxidizing system[J]. Food Chemistry, 2022, 396: 133710. DOI:10.1016/j.foodchem.2022.133710.
[31] REQUENA J R. Glutamic and aminoadipic semialdehydes are the main carbonyl products of metal-catalyzed oxidation of proteins[J].Proceedings of the National Academy of Sciences, 2000, 98(1): 69-74.DOI:10.1073/pnas.011526698.
[32] AKAGAWA M, SASAKI D, KUROTA Y, et al. Formation of alphaaminoadipic and gamma-glutamic semialdehydes in proteins by the Maillard reaction[J]. Annals of the New York Academy of Sciences,2005, 1043: 129-134. DOI:10.1196/annals.1333.016.
[33] FEENEY R E, BLANKENHORN G, DIXON H B F. Carbonyl-amine reactions in protein chemistry[J]. Advances in Protein Chemistry,1975, 29: 135-203. DOI:10.1016/s0065-3233(08)60412-x.
[34] ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77. DOI:10.1016/0003-9861(59)90090-6.
[35] RUSANOV K, RUSANOVA M, ATANASSOV I, et al. Total phenol content, antioxidant activity of hip extracts and genetic diversity in a small population of R. canina L. cv. Plovdiv 1 obtained by seed propagation[J]. Journal of Agricultural Science and Technology, 2015,7(2): 162-166. DOI:10.1016/j.jri.2010.06.042.
[36] DENG Xiaorong, LEI Yongdong, LIU Juan, et al. Biochemical changes of Coregonus peled myofibrillar proteins isolates as affected by HRGS oxidation system[J]. Journal of Food Biochemistry, 2019,43(2): e12710. DOI:10.1111/jfbc.12710.
[37] MA Jibing, WANG Xinyue, LI Qiao, et al. Oxidation of myofibrillar protein and crosslinking behavior during processing of traditional air-dried yak(Bos grunniens) meat in relation to digestibility[J]. LWT-Food Science and Technology, 2021, 142: 110984. DOI:10.1016/j.lwt.2021.110984.
[38] XIONG Y L, BLANCHARD S P, OOIZUMI T, et al. Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J]. Journal of Food Science, 2010, 75(2): 215-221.DOI:10.1111/j.1750-3841.2009.01511.x.
[39] XIA Minqing, CHEN Yinxia, GUO Juanjuan, et al. Effects of oxidative modification on textural properties and gel structure of pork myofibrillar proteins[J]. Food Research International, 2019, 121: 678-683.DOI:10.1016/j.foodres.2018.12.037.
[40] FU Qingquan, LIU Rui, WANG Haiou, et al. Effects of oxidation in vitro on structures and functions of myofibrillar protein from beef muscles[J]. Journal of Agricultural and Food Chemistry, 2019, 67(20):5866-5873. DOI:10.1021/acs.jafc.9b01239.
[41] LI Chunqiang, XIONG YoulingL.. Disruption of secondary structure by oxidative stress alters the cross-linking pattern of myosin by microbial transglutaminase[J]. Meat Science, 2015, 108: 97-105.DOI:10.1016/j.meatsci.2015.05.024.
[42] LIU Changqi, XIONG YoulingL.. Oxidation-initiated myosin subfragment cross-linking and structural instability differences between white and red muscle fiber types[J]. Journal of Food Science,2015, 80(2): C288-297. DOI:10.1111/1750-3841.12749.
[43] DOM NGUEZ R, PATEIRO M, MUNEKATA P E S, et al. Protein oxidation in muscle foods: a comprehensive review[J]. Antioxidants,2021, 11(1): 60. DOI:10.3390/antiox11010060.
[44] ZHANG Wangang, XIAO Shan, AHN D U. Protein oxidation: basic principles and implications for meat quality[J]. Critical Reviews in Food Science and Nutrition, 2013, 53(11): 1191-1201. DOI:10.1080/1 0408398.2011.577540.
[45] LIU Zelong, XIONG Youling, CHEN Jie. Protein oxidation enhances hydration but suppresses water-holding capacity in porcine Longissimus muscle[J]. Journal of Agricultural and Food Chemistry,2010, 58(19): 10697-10704. DOI:10.1021/jf102043k.
[46] SRINIVASAN S, HULTIN H O. Chemical, physical, and functional properties of cod proteins modified by a nonenzymic free-radicalgenerating system[J]. Journal of Agricultural and Food Chemistry,1997, 45: 310-320. DOI:10.1021/jf960367g.
[47] SRINIVASAN S, XIONG Y L, DECKER E A. Inhibition of protein and lipid oxidation in beef heart surimi-like material by antioxidants and combinations of pH, NaCl, and buffer type in the washing media[J]. Journal of Agricultural and Food Chemistry, 1996, 44(1):119-125. DOI:10.1021/jf950385i.
[48] 胡春林, 谢晶. 蛋白质氧化对肉食用品质影响的研究进展[J]. 食品科学, 2021, 42(17): 275-281. DOI:10.7506/spkx1002-6630-20200913-159.
[49] LAMETSCH R, LONERGAN S, HUFF-LONERGAN E. Disulfide bond within μ-calpain active site inhibits activity and autolysis[J].Biochimica et Biophysica Acta, 2008, 1784(9): 1215-1221.DOI:10.1016/j.bbapap.2008.04.018.
[50] MOHAN C, KIM L, HOLLAR N, et al. VivosX, a disulfide crosslinking method to capture site-specific, protein-protein interactions in yeast and human cells[J]. eLife, 2018, 7: e36654.DOI:10.7554/eLife.36654.
[51] ESTEVEZ M, OLLILAINEN V, HEINONEN M. Analysis of protein oxidation markers alpha-aminoadipic and gamma-glutamic semialdehydes in food proteins using liquid chromatography (LC)-electrospray ionization (ESI)-multistage tandem mass spectrometry(MS)[J]. Journal of Agricultural and Food Chemistry, 2009, 57(9):3901-3910. DOI:10.1021/jf804017p.
[52] CARLIN K, HUFFLONERGAN E, ROWE L J, et al. Effect of oxidation, pH, and ionic strength on calpastatin inhibition of μ- and m-calpain[J]. Journal of Animal Science, 2006, 84(4): 925-937.DOI:10.1103/PhysRevLett.38.185.
[53] 励建荣, 王忠强, 仪淑敏, 等. 天然抗氧化剂对鱼糜及鱼糜制品抗氧化能力及品质影响的研究进展[J]. 食品科学, 2021, 42(21): 1-7.DOI:10.7506/spkx1002-6630-20210806-088.
[54] XU Mingfeng, LIAN Zhenghao, CHEN Xiaoqiao, et al. Effects of resveratrol on lipid and protein co-oxidation in fish oil-enriched whey protein isolate emulsions[J]. Food Chemistry, 2021, 365: 130525.DOI:10.1016/j.foodchem.2021.130525.
[55] 杨文平, 郝教敏, 靳明凯, 等. 皮燕麦多酚提取物对冷却猪肉抗蛋白氧化评价[J]. 中国调味品, 2020, 45(6): 1-4; 9.
[56] CHENG Shuang, HE Yuxin, ZENG Tao, et al. Heat stress induces various oxidative damages to myofibrillar proteins in ducks[J]. Food Chemistry, 2022, 390: 133209. DOI:10.1016/j.foodchem.2022.133209.
[57] ZHONG Yuanyuan, HAN Ping, SUN Suling, et al. Effects of apple polyphenols and hydroxypropyl-beta-cyclodextrin inclusion complexes on the oxidation of myofibrillar proteins and microstructures in lamb during frozen storage[J]. Food Chemistry, 2022, 375: 131874.DOI:10.1016/j.foodchem.2021.131874.
[58] KHALIFAH A M, ABDALLA S A, DOSOKY W M, et al. Utilization of lemongrass essential oil supplementation on growth performance,meat quality, blood traits and caecum microflora of growing quails[J].Annals of Agricultural Sciences, 2021, 66(2): 169-175. DOI:10.1016/j.aoas.2021.12.001.
[59] HUANG Liyuan, WANG Yuan, LI Ruiting, et al. Thyme essential oil and sausage diameter effects on biogenic amine formation and microbiological load in smoked horse meat sausage[J]. Food Bioscience, 2021, 40(2): 100885. DOI:10.1016/j.fbio.2021.100885.
[60] BARCENILLA C, DUCIC M, L PEZ M, et al. Application of lactic acid bacteria for the biopreservation of meat products: a systematic review[J]. Meat Science, 2022, 183: 108661. DOI:10.1016/j.meatsci.2021.108661.