质构是肉类及肉制品一个重要的品质属性[1]。猪肉脯有着两千多年的悠久历史,口感独特,韧性十足,营养价值高,便于携带,深受消费者的青睐[2]。随着中国食品电商行业的快速发展,市场对猪肉脯的需求量快速增长。然而,不同工厂的猪肉脯干燥条件不同,且无自动化的生产条件,依靠人工经验生产,导致猪肉脯质构的不稳定[3],由此降低消费者对猪肉脯品质的信任。如何稳定猪肉脯的质构是行业急需解决的一个难题。
猪肉脯质构研究方面,有学者利用微波加热代替传统的烘烤工艺,改善了猪肉脯的硬度和韧性[4];也有学者将复合菌(肉糖葡萄球菌、植物乳杆菌和戊糖片球菌)添加于猪肉脯中,降低了猪肉脯的硬度和咀嚼性[5]。但是,目前尚缺少关于干燥温度条件对猪肉脯质构稳定性的影响研究。而加工温度会影响肉制品的蛋白质微结构和产品含水量,进而影响肉制品的质构[6]。研究提高猪肉脯在不同干燥温度条件下的质构稳定性,对稳定猪肉脯的质构品质具有现实意义。
赖氨酸作为一种人体必需的碱性氨基酸,能有效改善肉制品的质构、保水性、风味和色泽[7],也是被列入GB 2760—2014《食品安全国家标准 食品添加剂使用标准》的一种香料。研究发现,赖氨酸可以促进香肠形成致密、均匀的微观结构,改善香肠的硬度和弹性[8];还可以增加火腿中不宜流动水的含量,提高其保水性和质构[9]。然而,目前应用赖氨酸改善不同热风干燥温度下猪肉脯质构稳定性的研究报道较少。
为此,本研究基于不同热风干燥温度,研究赖氨酸对猪肉脯质构稳定性的影响,并通过测定猪肉脯的微观结构、分子间作用力、蛋白质组成和水分分布等探究其影响机制。
1 材料与方法
1.1 材料与试剂
冷鲜去骨猪后腿肉和猪肥膘(参照国标方法测定,水分含量(74.21±0.13)%、粗蛋白(20.87±0.08)%、粗脂肪(2.36±0.04)%、灰分(2.56±0.04)%)合肥家乐福超市。
赖氨酸(食品级)、红曲红(食品级)、复合磷酸盐(99%,食品级) 浙江一诺生物科技有限公司;鱼露(98.6%,食品级) 日鑫水产有限公司;甘油(99.7%,食品级) 新爱食品科技有限公司;白糖、味精、胡椒粉、鸡蛋 合肥家乐福超市。
β-巯基乙醇、尿素、氯化钠、乙醇(均为分析纯)国药集团化学试剂(上海)有限公司;考马斯亮蓝R 2 5 0(分析纯)、磷酸盐缓冲液(0.0 1 m o l/L NaH2PO4·2H2O-Na2HPO4·12H2O,pH 7.0) 上海阿拉丁生化科技股份有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS,分析纯) 北京索莱宝科技有限公司;BCA蛋白浓度测定试剂盒、4%~15% Bis-Tris标准预制胶 上海生工生物工程有限公司。
1.2 仪器与设备
DGQ-32B不锈钢切片机 浙江应晓工贸有限公司;QSJ-B02R1碎肉机 佛山小熊厨房电器有限公司;KA-6189真空滚揉机 上海双碟厨具有限公司;Varioskan Flash全波长酶标仪 美国Bio-Tek仪器公司;PB-10 pH计 德国赛多利斯公司;DYY-6D电泳仪 北京六一生物仪器科技有限公司;TA-XT plus物性测试仪英国Stable Micro System公司;FDEA-50真空冷冻干燥机北京博医康实验仪器有限公司;Q2000差示扫描量热仪美国TA公司;Frontier傅里叶变换红外光谱仪 美国Perkin Elmer公司;EM30+COXEM扫描电子显微镜库塞姆(中国)有限公司。
1.3 方法
1.3.1 猪肉脯的制备
根据崔萃等[2]的方法,除去猪后腿肉中可见结缔组织和脂肪。用切片机将一部分冷鲜瘦肉切成厚度2.5 mm的猪肉片;将另一部分瘦肉与猪肥膘按质量比3∶2混合,用碎肉机以3 500 r/min斩拌2 次,每次2.5 min且间隔1 min,制成肉糜备用。将100 g复合猪肉(80 g猪肉片、20 g猪肉糜)、22 g白糖、1.2 g味精、5.0 g鱼露、0.15 g复合磷酸盐、0.02 g红曲红、15 g蛋液、1 g甘油、0.2 g胡椒粉、15 g水和一定量的赖氨酸加入到腌制袋中,以12 r/min转速滚揉30 min,然后静置30 min;再将滚揉过的肉片平铺在钢筛上,并用腌制袋中的肉泥填满孔隙。以上操作均在4 ℃条件下进行。将摊筛后的肉片分别在5 种干燥温度条件(55 ℃-5 h、60 ℃-5 h、65 ℃-5 h、70 ℃-5 h和75 ℃-5 h)下干燥,干燥后的样品置于220 ℃烤箱中烘烤2.5 min(每30 s翻面1 次),然后冷却至室温(约25 ℃),并分切成长×宽为5 cm×3 cm的块状,在2 d内完成质构、水分分布和微观结构检测,在25 ℃下真空包装,贮藏5 d内完成pH值、分子间作用力、蛋白质二级结构与组分的检测。设定的赖氨酸添加水平为复合猪肉质量的0%、0.25%、0.50%和0.75%。未添加赖氨酸的5 种干燥温度实验组分别以C55、C60、C65、C70和C75表示,添加复合猪肉质量0.50%赖氨酸的5 种干燥温度实验组分别以L55、L60、L65、L70和L75表示。
1.3.2 质构稳定性测定
参照郑亚东[8]的方法,将制备的猪肉脯分切成块状(1 cm×1 cm),室温下用圆柱形探头(P36/R)进行压缩模式测试,以硬度、弹性、咀嚼性和内聚性反映质构参数。物性仪的检测参数设为:测试前速率0.5 mm/s,测试中速率0.5 mm/s,测试后速率5 mm/s,压缩形变量60%,触发力20 g。
质构参数稳定性:基于给定热风干燥温度范围内各温度条件下猪肉脯质构参数的测定值,以±5 ℃和±10 ℃范围内猪肉脯特定质构参数均值的极差来反映其稳定性,其数值越小,温度变化引起的特定质构参数波动越小,该质构参数的稳定性越佳;反之,则该质构参数的稳定性越差。质构参数测定做10 次平行实验。
在干燥温度55~65、60~70、65~75 ℃(±5 ℃)和55~75 ℃(±10 ℃)变化范围内,相应质构参数均值的极差值分别以R(60±5) ℃、R(65±5) ℃、R(70±5) ℃和R(65±10) ℃表示。
1.3.3 pH值测定
根据郑亚东[8]的方法,将5 g切碎的猪肉脯用50 mL蒸馏水均质30 s(10 000 r/min),随即用pH计测定均质液pH值。做3 次平行实验。
1.3.4 分子间作用力测定
根据Liu Ru等[10]的方法,测定猪肉脯内部5 种分子间作用力(非特异性结合、离子键、氢键、疏水相互作用和二硫键)。准确称取每份1 g切碎后的成品猪肉脯5 份,分别加入10 mL的0.05 mol/L NaCl(S1)、0.6 mol/L NaCl(S2)、0.6 mol/L NaCl+1.5 mol/L尿素(S3)、0.6 mol/L NaCl+8 mol/L尿素(S4)和0.6 mol/L NaCl+8 mol/L尿素+0.5 mol/L β-巯基乙醇(S5),在10 000 r/min下均质1 min后于4 ℃条件下静置1 h,然后4 ℃下10 000 r/min离心10 min,取上清液,过滤后,采用Bradford法测定滤液的蛋白质含量,并计算猪肉脯中的分子间作用力。非特异性结合以溶解于S1中的蛋白质含量表示;离子键作用以溶解于S2与S1的蛋白质含量之差表示;氢键作用以溶解于S3与S2的蛋白质含量之差表示;疏水相互作用以溶解于S4与S3的蛋白质含量之差表示;二硫键以溶解于S5与S4的蛋白质含量之差表示。做3 次平行实验。
1.3.5 蛋白质二级结构测定
根据Liu Ru等[10]的方法,将猪肉脯冻干、粉碎后,用傅里叶变换红外光谱仪测定。参数设置为波数范围4 000~650 cm-1,扫描次数4 次,分辨率4 cm-1。使用PeakFit 4.12软件进行基线校正、高斯去卷积和酰胺I带(1 700~1 600 cm-1)的二阶导数拟合,计算β-折叠、无规则卷曲、β-转角和α-螺旋的相对含量。做3 次平行实验。
1.3.6 蛋白质热特性测定
根据郑亚东[8]的方法,取滚揉腌制后的混合猪肉10 mg,用差示扫描量热仪测定其肌球蛋白和肌动蛋白的变性温度和焓值;使用Universal Analysis 2000分析数据。做3 次平行实验。
1.3.7 微观结构测定
根据Wattanachant等[6]的方法,将成品猪肉脯分切成1 cm×3 mm×2 mm的长条状,使用高分辨率电子显微镜在500 倍放大倍数下观察其微观结构。每个样品获得3 个图像,选取1 张作为展示。
1.3.8 水分分布测定
根据Shi Shuo等[11]的低场核磁共振方法,取1.5 g猪肉脯,选择Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列收集样品的衰减信号。主要参数为:共振频率20 MHz,采样带宽200 kHz,射频延时0.02 ms,重复等待时间4 000 ms,重复累加次数16,回波时间0.2 ms,回波个数8 000。通过Neumai NMR Ver4.0分析应用软件对CPMG序列的自旋-自旋弛豫曲线进行反演,并分析横向弛豫时间(T2)分布。做3 次平行实验。
1.3.9 蛋白组分测定
根据Wattanachant等[6]的方法,将切碎的猪肉脯置于8 倍体积(m/V)的提取液(0.14 mol/L SDS+8 mol/L尿素)中,10 000 r/min均质1 min,接着在4 ℃条件下10 000 r/min离心10 min,纱布过滤后,用BCA蛋白检测试剂盒测定滤液的蛋白质量浓度;用磷酸盐缓冲液将滤液调整到最终蛋白质量浓度1 mg/mL,并与十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)样品缓冲液以4∶1(V/V)的比例混合,在沸水中加热3 min;再将反应物以每道10 μL的上样量加载到4%~15% Bis-Tris标准预制胶上,在80 V下运行20 min后,将电压调整至120 V,待蛋白条带完全分离后,结束电泳;用考马斯亮蓝R250染色后,脱色并拍照获得图像。
1.4 数据处理
采用IBM SPSS 26.0软件(SPSS Inc.,Chicago,Illinois,USA)对数据进行统计分析,结果表示为平均值±标准差,稳定性以相应质构参数均值的极差反映;2 组之间的比较采用t检验法,3 组及以上的组间比较采用Duncan’s多重检验法,均以P<0.05表示差异显著性。采用Origin 2018软件(Northampton,MA,USA)对数据进行绘图分析。
2 结果与分析
2.1 赖氨酸对猪肉脯质构稳定性的影响
由表1可知:对于未添加赖氨酸的实验组,当热风干燥温度从55 ℃提高到75 ℃时,猪肉脯的硬度、内聚性和咀嚼性显著增加(P<0.05),而弹性显著降低(P<0.05),表现出质构参数在干燥温度±10 ℃甚至±5 ℃变化范围内的显著不稳定性;干燥温度越高,温度变化引起的质构参数极差越大,反映其质构越不稳定;而添加0.50%赖氨酸可显著降低高温(70~75 ℃)干燥条件下猪肉脯的硬度和内聚性(P<0.05),显著提高猪肉脯的弹性(P<0.05),且赖氨酸添加量0.50%~0.75%的质构参数无显著差异;显然,添加的赖氨酸可抑制因干燥温度升高所导致的硬度和内聚性的增加程度以及弹性的下降程度,减少猪肉脯硬度、弹性、内聚性和咀嚼性随热风干燥温度变化的极差值,且这种减少程度与赖氨酸添加水平具有正相关关系。由此说明,外源添加赖氨酸可显著改善猪肉脯干制过程中的质构稳定性,且适宜的赖氨酸添加水平为0.50%,其在(60±5) ℃和(65±5) ℃变化范围内(R(60±5) ℃和R(65±5) ℃组)可将咀嚼性的极差值控制在1.4%以内。例如,添加0.50%赖氨酸的R(60±5) ℃组,咀嚼性变化幅度为1.35%;添加0.50%赖氨酸的R(65±5) ℃组,咀嚼性变化幅度为0.71%。因此,后续选择0.50%的添加水平,探究添加赖氨酸影响猪肉脯质构稳定性的机理。
表1 赖氨酸对不同热风干燥温度下猪肉脯质构稳定性的影响
Table1 Effect of lysine on the texture stability of DPS at different air drying temperatures
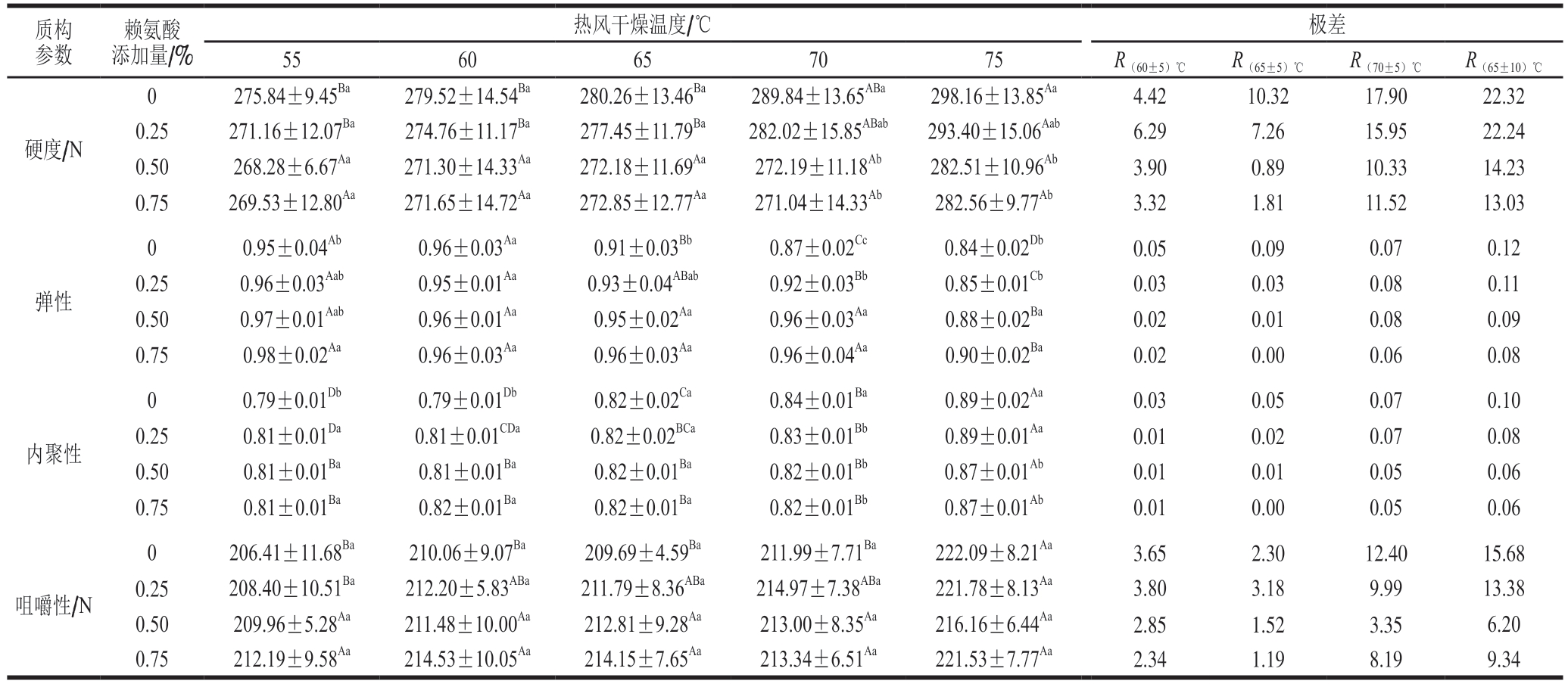
注:同行大写字母不同,表示不同干燥温度间差异显著(P<0.05);同列小写字母不同,表示同一温度、不同添加水平间差异显著(P<0.05)。表2~3、5同。
质构参数赖氨酸添加量/%热风干燥温度/℃极差5560657075R(60±5)℃R(65±5)℃R(70±5)℃R(65±10)℃硬度/N 0275.84±9.45Ba279.52±14.54Ba280.26±13.46Ba289.84±13.65ABa298.16±13.85Aa4.4210.3217.9022.32 0.25271.16±12.07Ba274.76±11.17Ba277.45±11.79Ba282.02±15.85ABab293.40±15.06Aab6.297.2615.9522.24 0.50268.28±6.67Aa271.30±14.33Aa272.18±11.69Aa272.19±11.18Ab282.51±10.96Ab3.900.8910.3314.23 0.75269.53±12.80Aa271.65±14.72Aa272.85±12.77Aa271.04±14.33Ab282.56±9.77Ab3.321.8111.5213.03弹性00.95±0.04Ab0.96±0.03Aa0.91±0.03Bb0.87±0.02Cc0.84±0.02Db0.050.090.070.12 0.250.96±0.03Aab0.95±0.01Aa0.93±0.04ABab0.92±0.03Bb0.85±0.01Cb0.030.030.080.11 0.500.97±0.01Aab0.96±0.01Aa0.95±0.02Aa0.96±0.03Aa0.88±0.02Ba0.020.010.080.09 0.750.98±0.02Aa0.96±0.03Aa0.96±0.03Aa0.96±0.04Aa0.90±0.02Ba0.020.000.060.08内聚性00.79±0.01Db0.79±0.01Db0.82±0.02Ca0.84±0.01Ba0.89±0.02Aa0.030.050.070.10 0.250.81±0.01Da0.81±0.01CDa0.82±0.02BCa0.83±0.01Bb0.89±0.01Aa0.010.020.070.08 0.500.81±0.01Ba0.81±0.01Ba0.82±0.01Ba0.82±0.01Bb0.87±0.01Ab0.010.010.050.06 0.750.81±0.01Ba0.82±0.01Ba0.82±0.01Ba0.82±0.01Bb0.87±0.01Ab0.010.000.050.06咀嚼性/N 0206.41±11.68Ba210.06±9.07Ba209.69±4.59Ba211.99±7.71Ba222.09±8.21Aa3.652.3012.4015.68 0.25208.40±10.51Ba212.20±5.83ABa211.79±8.36ABa214.97±7.38ABa221.78±8.13Aa3.803.189.9913.38 0.50209.96±5.28Aa211.48±10.00Aa212.81±9.28Aa213.00±8.35Aa216.16±6.44Aa2.851.523.356.20 0.75212.19±9.58Aa214.53±10.05Aa214.15±7.65Aa213.34±6.51Aa221.53±7.77Aa2.341.198.199.34
研究表明,肉制品的硬度与其持水能力之间呈明显的负相关[12];蛋白质降解程度和变性程度的增加会导致蛋白凝胶弹性下降[13]。可见,干燥温度的升高会减少猪肉脯中的含水量、增加蛋白质的变性与降解程度,导致猪肉脯硬度的显著增加和弹性的降低(表1中的未添加组),不利于猪肉脯热加工中的质构稳定性。而添加赖氨酸一方面可以通过提高肉制品的保水性[7],降低猪肉脯因干燥温度上升而导致的硬度增加幅度,有利于改善猪肉脯热加工过程中的硬度稳定性;另一方面,外源赖氨酸可通过交联肉蛋白质分子,促进蛋白质热凝胶化过程中密实网络结构的形成[14],有利于改善猪肉脯的弹性和内聚性,促进猪肉脯质构参数的稳定。
2.2 赖氨酸对猪肉脯pH值的影响
肉制品的pH值与其保水能力、质地有显著的相关性[15]。由图1可知:对于未添加赖氨酸的猪肉脯,70、75 ℃的高温干燥组pH值显著低于55、60、65 ℃的低温干燥组(P<0.05);而添加赖氨酸的猪肉脯pH值显著提高,且不随干燥温度的变化而发生显著变化,说明添加的赖氨酸可以通过稳定干燥过程中猪肉脯的pH值而促进猪肉脯质构的稳定。
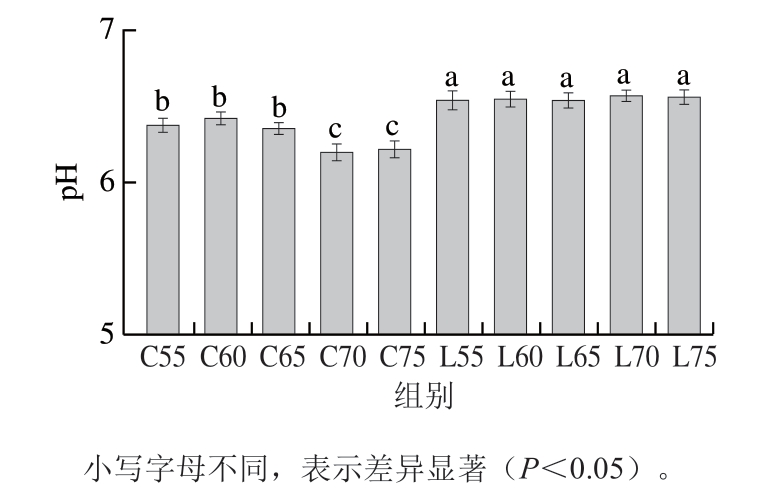
图1 赖氨酸对不同热风干燥温度下猪肉脯p 值的影响
值的影响
Fig. 1 Effect of lysine on the pH value of DPS at different air drying temperatures
高温加热会促进肉制品中蛋白质的水解,产生肽和氨基酸,降低肉制品的pH值[16];高温还可以促进肉制品的脂肪水解成脂肪酸,进一步降低其pH值[17]。赖氨酸是一种碱性氨基酸,可提高猪肉脯的pH值,有利于增强蛋白质的水合作用,改善产品的保水性[14],缓解因干燥温度改变而产生的失水速率变化,促进猪肉脯含水量和质构稳定性的提升。
2.3 赖氨酸对猪肉脯内部分子间作用力的影响
分子间作用力是肉蛋白网络结构形成的重要因素,主要包括非特异性结合、离子键、氢键、疏水作用和二硫键等[18]。由表2可知:在热风干燥温度从55 ℃提高到75 ℃时,未添加赖氨酸的猪肉脯内部非特异性结合、离子键、氢键、疏水作用和二硫键5 种分子间作用力均发生显著降低(P<0.05),且疏水相互作用的含量相对较高,说明它是形成蛋白质凝胶网络结构的主要作用力;而添加0.50%赖氨酸可不同程度地增强猪肉脯内部的5 种分子间作用力,尤其是弥补热风干燥温度上升所引起的非特异性结合、离子键、氢键和疏水相互作用的损失,由此促进了猪肉脯干燥过程的质构稳定。
表2 赖氨酸对不同热风干燥温度下猪肉脯分子间作用力的影响Table 2 Effect of lysine on intermolecular forces in DPS at different air drying temperatures g/L
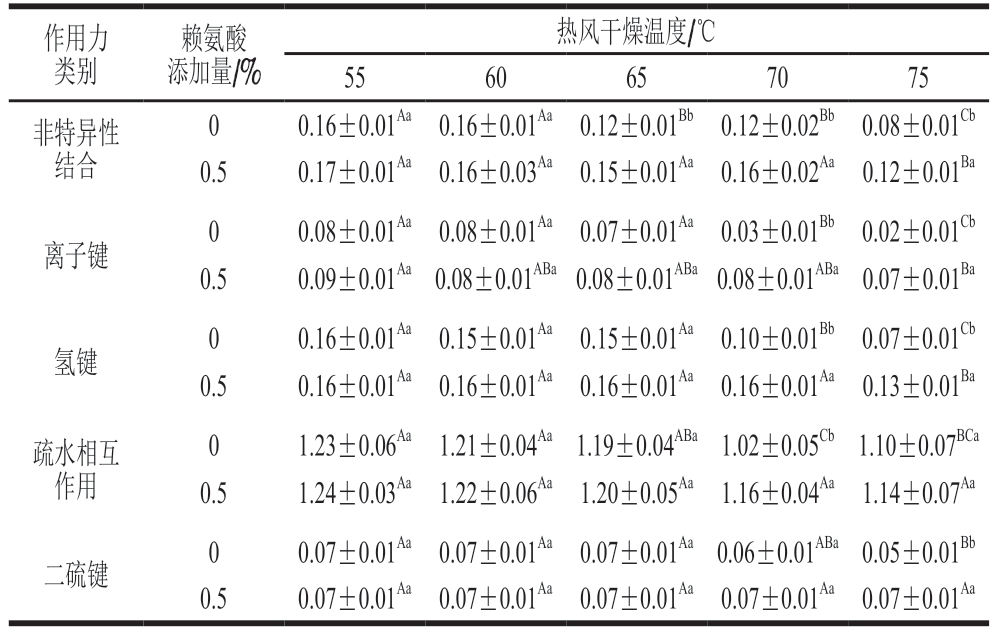
作用力类别赖氨酸添加量/%热风干燥温度/℃5560657075非特异性结合00.16±0.01Aa 0.16±0.01Aa 0.12±0.01Bb 0.12±0.02Bb 0.08±0.01Cb 0.50.17±0.01Aa 0.16±0.03Aa 0.15±0.01Aa 0.16±0.02Aa 0.12±0.01Ba离子键00.08±0.01Aa 0.08±0.01Aa 0.07±0.01Aa 0.03±0.01Bb 0.02±0.01Cb 0.50.09±0.01Aa 0.08±0.01ABa 0.08±0.01ABa 0.08±0.01ABa 0.07±0.01Ba氢键00.16±0.01Aa 0.15±0.01Aa 0.15±0.01Aa 0.10±0.01Bb 0.07±0.01Cb 0.50.16±0.01Aa 0.16±0.01Aa 0.16±0.01Aa 0.16±0.01Aa 0.13±0.01Ba疏水相互作用01.23±0.06Aa 1.21±0.04Aa 1.19±0.04ABa 1.02±0.05Cb 1.10±0.07BCa 0.51.24±0.03Aa 1.22±0.06Aa 1.20±0.05Aa 1.16±0.04Aa 1.14±0.07Aa二硫键00.07±0.01Aa 0.07±0.01Aa 0.07±0.01Aa 0.06±0.01ABa 0.05±0.01Bb 0.50.07±0.01Aa 0.07±0.01Aa 0.07±0.01Aa 0.07±0.01Aa 0.07±0.01Aa
离子键通常由2 个带相反电荷的氨基酸残基相互吸引组成,在维持蛋白质的三级结构和四级结构中起着关键作用;而蛋白质在高温下容易展开和伸展,提高其变性和聚集程度,会破坏离子键[19]。添加的赖氨酸可以抑制肌球蛋白亚基部分的展开,阻碍肌球蛋白的聚集,保护并增加了离子键[20]。氢键是维持蛋白质二级结构的主要作用力,并可促进蛋白质与非共价键的相互交联以及蛋白质与水的相互作用,有利于提高肉制品的保水性[21]。高温会导致氢键断裂[22],而赖氨酸的极性侧链基团可以与水分子形成氢键,弥补高温引起的氢键损失[23],稳定了猪肉脯在干燥温度变化时的氢键作用力,促进了猪肉脯质构的稳定。
2.4 赖氨酸对猪肉脯蛋白质二级结构的影响
由表3可知:热风干燥温度从55 ℃上升到75 ℃时,未添加赖氨酸的猪肉脯中蛋白质的α-螺旋结构相对含量显著减少(P<0.05),且β-转角和无规则卷曲增多;而添加0.50%赖氨酸可显著降低干燥温度提高所引起的α-螺旋结构减少程度(P<0.05),对蛋白质β-折叠、β-转角和无规则卷曲无显著影响。高温会破坏羰基和氨基之间的氢键,导致α-螺旋结构的破坏,使其转变为β-折叠、β-转角和无规则卷曲[24]。本研究中,添加0.50%赖氨酸可能通过增强猪肉脯中的氢键作用力(表2)促进了肉蛋白中α-螺旋结构的生成,减少蛋白质二级结构(α-螺旋)由于干燥温度变化而导致的不稳定,有利于稳定猪肉脯的质构。
表3 赖氨酸对不同热风干燥温度下猪肉脯蛋白质二级结构相对含量的影响
Table3 Effect of lysine on the relative contents of protein secondary structures of DPS at different air drying temperatures%
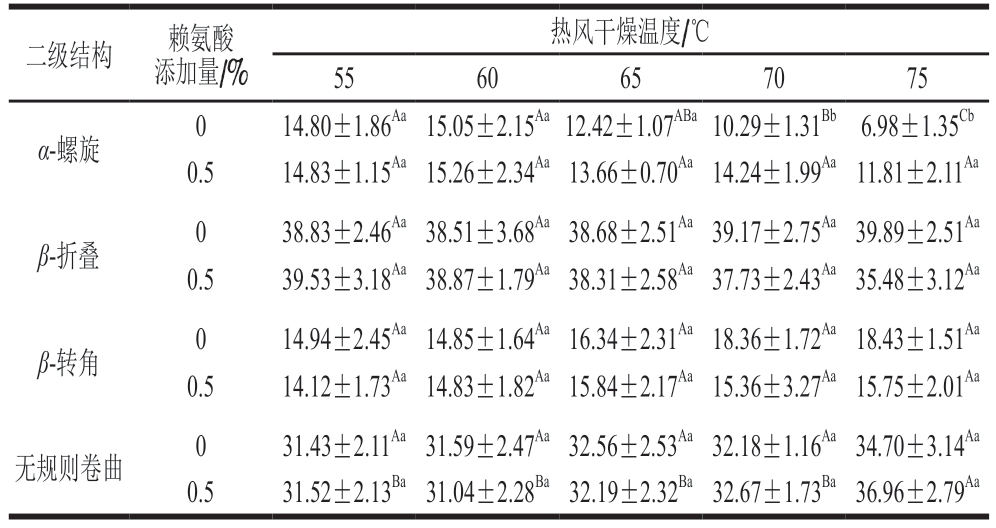
二级结构赖氨酸添加量/%热风干燥温度/℃5560657075 α-螺旋014.80±1.86Aa 15.05±2.15Aa 12.42±1.07ABa 10.29±1.31Bb 6.98±1.35Cb 0.514.83±1.15Aa 15.26±2.34Aa 13.66±0.70Aa 14.24±1.99Aa 11.81±2.11Aa β-折叠038.83±2.46Aa 38.51±3.68Aa 38.68±2.51Aa 39.17±2.75Aa 39.89±2.51Aa 0.539.53±3.18Aa 38.87±1.79Aa 38.31±2.58Aa 37.73±2.43Aa 35.48±3.12Aa β-转角014.94±2.45Aa 14.85±1.64Aa 16.34±2.31Aa 18.36±1.72Aa 18.43±1.51Aa 0.514.12±1.73Aa 14.83±1.82Aa 15.84±2.17Aa 15.36±3.27Aa 15.75±2.01Aa无规则卷曲031.43±2.11Aa 31.59±2.47Aa 32.56±2.53Aa 32.18±1.16Aa 34.70±3.14Aa 0.531.52±2.13Ba 31.04±2.28Ba 32.19±2.32Ba 32.67±1.73Ba 36.96±2.79Aa
2.5 赖氨酸对猪肉脯蛋白质热特性的影响
由表4可知,添加0.25%赖氨酸可显著提高肌球蛋白和肌动蛋白的变性温度(Tmax1和Tmax2)(P<0.05),且2 种蛋白质的变性温度不随赖氨酸添加量的增加而变化。与蛋白变性温度的变化类似,赖氨酸也会显著增加肌球蛋白和肌动蛋白的焓值(ΔH1和ΔH2)(P<0.05),且在赖氨酸添加量0.25%~0.75%时无显著的量效关系。赖氨酸分子结构中的胍基或ε-氨基可与猪肉蛋白质结合,增加蛋白质聚集的活化能,表现出蛋白质变性温度和焓值的增加[25]。就猪肉脯热风干燥和后续烘烤而言,外源赖氨酸对肉蛋白热稳定性的改善也有利于提高猪肉脯质构的稳定性。
表4 赖氨酸对猪肉脯中蛋白质热特性的影响
Table4 Effect of lysine on the protein thermal properties of DPS
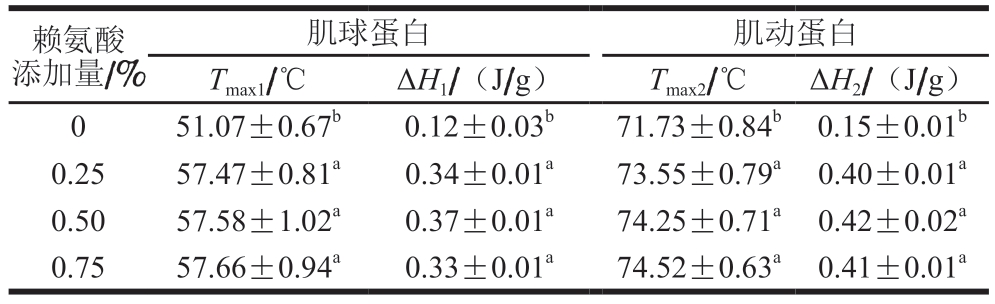
注:同列小写字母不同,表示差异显著(P<0.05)。
赖氨酸添加量/%肌球蛋白肌动蛋白Tmax1/℃ΔH1/(J/g)Tmax2/℃ΔH2/(J/g)051.07±0.67b0.12±0.03b71.73±0.84b 0.15±0.01b 0.2557.47±0.81a0.34±0.01a73.55±0.79a 0.40±0.01a 0.5057.58±1.02a0.37±0.01a74.25±0.71a 0.42±0.02a 0.75 57.66±0.94a0.33±0.01a74.52±0.63a 0.41±0.01a
2.6 赖氨酸对猪肉脯微观结构的影响
由图2可知:未添加赖氨酸的猪肉脯,其横断面上的肌纤维束排列随着干燥温度的升高而趋于杂乱,肌纤维束之间的间隙也逐渐增大;而添加赖氨酸可以缓解干燥温度变化所引起的猪肉脯微观结构的劣变,使得肌纤维束整体排列整齐、分布相对均匀,尤其是在55~65 ℃干燥温度内,猪肉脯的微观结构更加均匀。有研究表明,加热会使构成肌纤维膜的蛋白质变性,导致其空间结构变化,肌纤维的完整性受损,影响其结合水分的能力,增加干制肉的硬度和咀嚼性[26]。由此可见,在干燥温度(60±5) ℃变化范围内,添加的赖氨酸可以通过稳定猪肉脯的微观结构,为猪肉脯质构的稳定提供良好的基础。


图2 赖氨酸对不同热风干燥温度下猪肉脯微观结构的影响
Fig. 2 Effect of lysine on the microstructure of DPS at different air drying temperatures
2.7 赖氨酸对猪肉脯水分分布的影响
水分分布状态对肉制品的质地有重要影响[27]。横向弛豫时间中,T21(0~10 ms)代表与大分子紧密结合的水,T22(10~100 ms)代表不易流动水,T23(100~1 000 ms)代表自由水[28]。横向弛豫时间越短,反映水分子与蛋白质的结合程度越高;反之,则水分子越容易发生相移和流动[11]。由表5可知,热风干燥温度从55 ℃提高至75 ℃时,不添加赖氨酸的猪肉脯横向弛豫时间T2均显著减小(P<0.05),而同一干燥温度下,除了55 ℃组的T22,添加0.50%赖氨酸均可显著增加T21、T22和T23(P<0.05)。干燥温度的升高会促进蛋白质的变性反应,增强水和蛋白质之间的相互作用,降低结合水的弛豫时间(T21)[29];不易流动水则会随着干燥温度的升高流出纤维,转化为自由水[30],进而从表面蒸发到空气中。本研究中,外源赖氨酸可能通过提高猪肉脯内部水分的流动性,减少高温对质构的破坏作用[31],形成对猪肉脯质构的稳定作用。
表5 赖氨酸对不同热风干燥温度下猪肉脯横向弛豫时间(T2)的影响
Table5 Effect of lysine on the transverse relaxation time (T2)proportion of DPS at different air drying temperatures ms
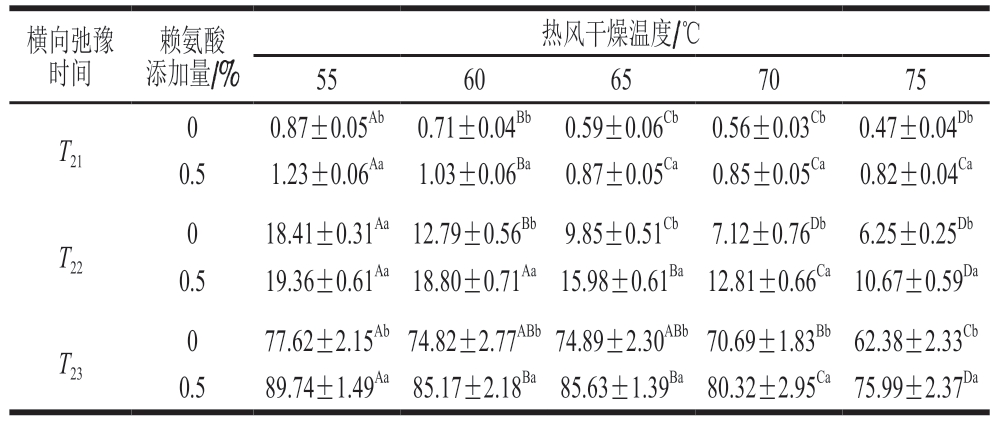
横向弛豫时间赖氨酸添加量/%热风干燥温度/℃5560657075 T21 0 0.87±0.05Ab 0.71±0.04Bb 0.59±0.06Cb 0.56±0.03Cb 0.47±0.04Db 0.5 1.23±0.06Aa 1.03±0.06Ba 0.87±0.05Ca 0.85±0.05Ca 0.82±0.04Ca T22 0 18.41±0.31Aa 12.79±0.56Bb 9.85±0.51Cb 7.12±0.76Db 6.25±0.25Db 0.5 19.36±0.61Aa 18.80±0.71Aa 15.98±0.61Ba 12.81±0.66Ca 10.67±0.59Da T23 0 77.62±2.15Ab 74.82±2.77ABb 74.89±2.30ABb 70.69±1.83Bb 62.38±2.33Cb 0.5 89.74±1.49Aa 85.17±2.18Ba 85.63±1.39Ba 80.32±2.95Ca 75.99±2.37Da
2.8 赖氨酸对猪肉脯SDS-PAGE的影响
由图3可知:随着温度的升高,未添加赖氨酸的猪肉脯肌球蛋白重链条带逐渐变窄,表明升温会促进肌球蛋白的变性反应和蛋白质的降解;而添加赖氨酸会相应增加肌球蛋白重链条带的宽度,说明赖氨酸可以阻滞肌球蛋白的热降解。这种阻滞作用可能是由于赖氨酸通过抑制钙蛋白酶-1的活性进而抑制蛋白质降解的结果[17,32]。肉蛋白降解的程度与质构显著相关[33],赖氨酸通过抑制蛋白降解,有利于稳定猪肉脯的质构。
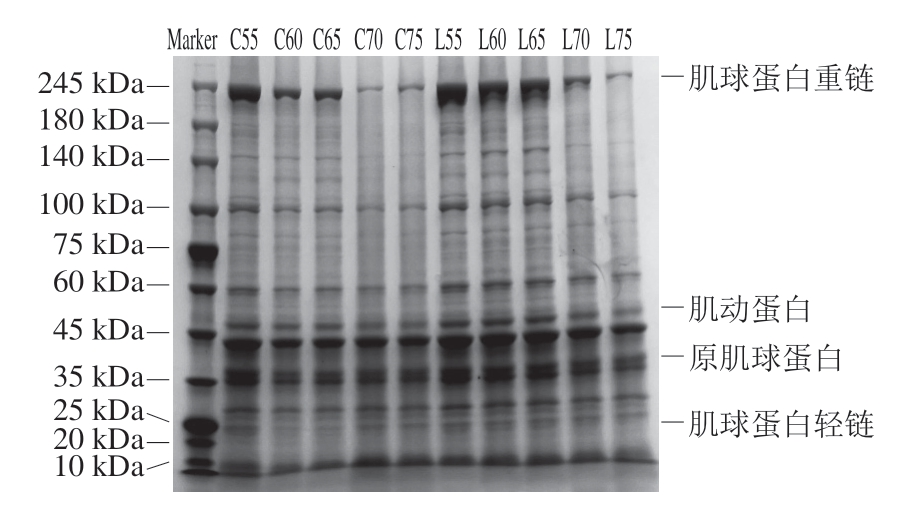
图3 赖氨酸对不同热风干燥温度下猪肉脯SDS-PAG 的影响
的影响
Fig. 3 Effect of lysine on the SDS-PAGE pattern of DPS at different air drying temperatures
3 结 论
添加0.50%赖氨酸可使得55~65 ℃、60~70 ℃组猪肉脯的硬度、弹性、内聚性、咀嚼性4 项质构参数保持不显著变化,且这种保持效应在赖氨酸添加量0.50%与0.75%之间无显著差异;在55~65 ℃或60~70 ℃干燥温度变化内猪肉脯咀嚼性变化的极差均不超过1.4%,说明添加的赖氨酸可显著改善猪肉脯在热风干燥温度(60±5) ℃和(65±5) ℃变化条件下的质构稳定性,且适宜的添加水平为0.50%。其质构稳定效应可能通过外源赖氨酸稳定猪肉脯体系pH值、改善微观结构、提高肉蛋白及其二级结构的热稳定性、增强内部氢键作用力和水分流动性、阻滞肌球蛋白热降解等作用实现。这些结果可为解决传统猪肉脯现代加工中的质构不稳定问题提供一条可行的技术路径,将为猪肉脯在电商业态下的发展提供理论支持。
[1] SZCZESNIAK A S. Texture is a sensory property[J]. Food Quality and Preference, 2002, 13(4): 215-225. DOI:10.1016/S0950-3293(01)00039-8.
[2] 崔萃, 谢婷婷, 周宇, 等. 祁门红茶对传统猪肉脯感官品质及风味的影响[J]. 肉类研究, 2022, 36(5): 54-61. DOI:10.7506/rlyj1001-8123-20220225-010.
[3] 陈明杰. 基于GC-IMS技术的干燥与烘烤工艺对猪肉脯风味影响的研究[D]. 镇江: 江苏大学, 2020: 1-2.
[4] YAN Bowen, JIAO Xidong, YANG Huayu, et al. Microwave heating of dried minced pork slices with different fat content: an assessment of dielectric response and quality properties[J]. Food Science and Technology, 2021, 148: 111729. DOI:10.1016/j.lwt.2021.111729.
[5] 樊明明. 发酵工艺对猪肉脯食用品质影响研究[D]. 无锡: 江南大学,2015: 17.
[6] WATTANACHANT S, BENJAKUL S, LEDWARD D A. Effect of heat treatment on changes in texture, structure and properties of Thai indigenous chicken muscle[J]. Food Chemistry, 2005, 93(2): 337-348.DOI:10.1016/j.foodchem.2004.09.032.
[7] 张道静, 周存六. L-精氨酸和L-赖氨酸在肉及肉制品中的应用研究进展[J]. 肉类研究, 2020, 34(6): 96-102. DOI:10.7506/rlyj1001-8123-20200422-098.
[8] 郑亚东. 赖氨酸、精氨酸改善猪肉肠品质特性的应用研究[D].合肥: 合肥工业大学, 2017: 9-11; 18-21.
[9] 陶硕, 郭秀霞, 辛丘岩, 等. 滚揉时间和添加赖氨酸对低盐蒸煮火腿品质的影响[J]. 肉类研究, 2020, 34(5): 11-17. DOI:10.7506/rlyj1001-8123-20200220-044.
[10] LIU Ru, ZHAO Siming, XIE Bijun, et al. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloids, 2011, 25(5): 898-906. DOI:10.1016/j.foodhyd.2010.08.016.
[11] SHI Shuo, FENG Jia, AN Geer, et al. Dynamics of heat transfer and moisture in beef jerky during hot air drying[J]. Meat Science, 2021,182: 108638. DOI:10.1016/j.meatsci.2021.108638.
[12] JEONG K, HYEONBIN O, SHIN S Y, et al. Effects of sous-vide method at different temperatures, times and vacuum degrees on the quality, structural, and microbiological properties of pork ham[J]. Meat Science, 2018, 143: 1-7. DOI:10.1016/j.meatsci.2018.04.010.
[13] FENG J, XIONG Y L. Interaction and functionality of mixed myofibrillar and enzyme-hydrolyzed soy proteins[J]. Journal of Food Science, 2003, 68(3): 803-809. DOI:10.1111/j.1365-2621.2003.tb08246.x.
[14] SWAN J E, BOLES J A. Processing characteristics of beef roasts made from high and normal pH bull inside rounds[J]. Meat Science, 2002,62(4): 399-403. DOI:10.1016/S0309-1740(02)00028-1.
[15] CHIANG J H, EYRES G T, SILCOCK P J, et al. Changes in the physicochemical properties and flavour compounds of beef bone hydrolysates after Maillard reaction[J]. Food Research International,2019, 123: 642-649. DOI:10.1016/j.foodres.2019.05.024.
[16] JOSEPH J K, AWOSANYA B, ADENIRAN A T, et al. The effects of end-point internal cooking temperatures on the meat quality attributes of selected Nigerian poultry meats[J]. Food Quality and Preference,1997, 8(1): 57-61. DOI:10.1016/S0950-3293(96)00011-0.
[17] 张银银. 外源性L-精氨酸和L-赖氨酸对卤鸡胸肉嫩度的影响及机理研究[D]. 合肥: 合肥工业大学, 2020: 17-21.
[18] ZHANG Ziye, YANG Yulin, TANG Xiaozhi, et al. Effects of ionic strength on chemical forces and functional properties of heat-induced myofibrillar protein gel[J]. Food Science and Technology Research,2015, 21(4): 597-605. DOI:10.3136/fstr.21.597.
[19] ZHOU Xuxia, JIANG Shan, ZHAO Dandan, et al. Changes in physicochemical properties and protein structure of surimi enhanced with camellia tea oil[J]. LWT-Food Science and Technology, 2017, 84:562-571. DOI:10.1016/j.lwt.2017.03.026.
[20] 李诗义. L-精氨酸和L-赖氨酸对鸡肉香肠保水与质构影响机制的研究[D]. 合肥: 合肥工业大学, 2018: 41-43.
[21] YANG H, KHAN M A, YU X, et al. Changes in protein structures to improve the rheology and texture of reduced-fat sausages using high pressure processing[J]. Meat Science, 2016, 121: 79-87. DOI:10.1016/j.meatsci.2016.06.004.
[22] 李杰, 汪之和, 施文正. 鱼糜凝胶形成过程中物理化学变化[J]. 食品科学, 2010, 31(17): 103-106.
[23] WACHIRASIRI K, WANLAPA S, UTTAPAP D, et al. Use of amino acids as a phosphate alternative and their effects on quality of frozen white shrimps (Penaeus vanamei)[J]. LWT-Food Science and Technology, 2016, 69: 303-311. DOI:10.1016/j.lwt.2016.01.065.
[24] NÚÑEZ-FLORES R, CANDO D, BORDERÍAS A J, et al. Importance of salt and temperature in myosin polymerization during surimi gelation[J]. Food Chemistry, 2018, 239: 1226-1234. DOI:10.1016/j.foodchem.2017.07.028.
[25] SCHNEIDER C P, TROUT B L. Investigation of cosolute-protein preferential interaction coefficients: new insight into the mechanism by which arginine inhibits aggregation[J]. The Journal of Physical Chemistry B, 2009, 113(7): 2050-2058. DOI:10.1021/jp808042w.
[26] XIE Xiaolei, WANG Jinzhi, LI Xia, et al. Mathematical modeling on combined mid-infrared and hot air drying of beef meat[J]. Advance Journal of Food Science and Technology, 2015, 8(4): 283-290.DOI:10.19026/ajfst.8.1509.
[27] YU Dawei, FENG Tianyi, JIANG Qixing, et al. The change characteristics in moisture distribution, physical properties and protein denaturation of slightly salted silver carp (Hypophthalmichthys molitrix) fillets during cold/hot air drying processing[J]. Food Science and Technology, 2021, 137: 110466. DOI:10.1016/j.lwt.2020.110466.
[28] PETRACCI M, LAGHI L, ROCCULI P, et al. The use of sodium bicarbonate for marination of broiler breast meat[J]. Poultry Science,2012, 91(2): 526-534. DOI:10.3382/ps.2011-01753.
[29] BERTRAM H C, KARLSSON A H, Andersen H J. The significance of cooling rate on water dynamics in porcine muscle from heterozygote carriers and non-carriers of the halothane gene: a low-field NMR relaxation study[J]. Meat Science, 2003, 65(4): 1281-1291.DOI:10.1016/S0309-1740(03)00038-X.
[30] CHRISTENSEN L, BERTRAM H C, AASLYNG M D, et al. Protein denaturation and water-protein interactions as affected by low temperature long time treatment of porcine Longissimus dorsi[J]. Meat Science, 2011, 88(4): 718-722. DOI:10.1016/j.meatsci.2011.03.002.
[31] HE Shudong, SUN Xianbao, DU Ming, et al. Effects of muscle protein denaturation and water distribution on the quality of false abalone(Volutharpa ampullacea perryi) during wet heating[J]. Journal of Food Process Engineering, 2019, 42(1): e12932. DOI:10.1111/jfpe.12932.
[32] DI LUCCIA A, TREMONTE P, TRANI A, et al. Influence of starter cultures and KCl on some biochemical, microbiological and sensory features of soppressata molisana, an Italian fermented sausage[J].European Food Research and Technology, 2016, 242(6): 855-867.DOI:10.1007/s00217-015-2591-y.
[33] ZHANG D, LI H, EMARA A M, et al. Study on the mechanism of KCl replacement of NaCl on the water retention of salted pork[J]. Food Chemistry, 2020, 332: 127414. DOI:10.1016/j.foodchem.2020.127414.