肉类嫩度是感官特性,通常根据肉在切割时所需的剪切力大小进行定义[1]。合适的嫩度对于肉类消费者而言至关重要,肌肉组织的微观结构赋予肉类独特的质构特性。有关肉类嫩度的研究已经较为成熟,一般认为肌原纤维蛋白的骨架结构[2-4]及结缔组织的强度[5-7]对于肉质有重要贡献。近年来,随着人们对资源/环境可持续性、动物福利等日益关注,植物肉、细胞培养肉等领域的科研和产品开发迅速发展。无论是植物肉、细胞培养肉或者其他形式的人造肉大多追求模拟传统肉制品的感官体验,其中包括肉类独特的质地。然而,当前的人造肉技术均具有一定的局限性,如细胞培养肉得到的往往是分离的肌纤维,缺少其他肉类成分及肉类特殊的层次 结构[8]。为了提高细胞培养肉类咀嚼性等质构特性,往往需要构建细胞生长的支架,而性能优异的支架构建有赖于对肉类质地形成机制的深入了解[9];而植物肉虽然可以较好地模拟纤维状质地,但纤维的粗细、分布不如肉类均匀,并且湿法挤压[10]及3D打印[11]等成型技术的精度也存在限制。因此,了解肉类嫩度形成机理及其调控因素的研究进展,不仅有助于传统肉类行业的发展,对于新兴的人造肉/模拟肉领域也将具有启发意义。
1 肉类嫩度的定义及测定方法
肉制品嫩度是消费者的主观感受,为了相对客观地进行嫩度评价,有学者建议根据将食物咀嚼到可吞咽状态需要的时间长短,将食物分为“嫩”、“有嚼劲”和“难以咀嚼”[12]。除了可以借助感官评价的方式进行衡量,还可以利用仪器测量肉类的机械性能,从而反映嫩度。其中,与嫩度最直接相关的是剪切力的测量,包括Warner-Bratzler剪切力、Allo-Kramer剪切力、Slice剪切力等,三者之间的区别主要是用于剪切肉类的刀刃构造不同[13]。不同方法测得的剪切力与感官嫩度的相关性可能略有差异,如Cavitt等[14]发现,Slice剪切力在预测禽肉嫩度方面优于Allo-Kramer方法。肉品剪切力随剪切距离变化的曲线中通常会出现2 个峰,其中第1个峰的高度对应肌纤维抵抗剪切的能力,而第2个峰对应结缔组织抵抗剪切的能力。除了剪切分析,还可以借助其他机械性能的测试反映肉质嫩度。Warner等[12]指出,硬度及咀嚼性等指标与剪切力呈现良好的相关性,而质地剖面分析也经常用于肉品研究中。与剪切测量中通常出现2 个峰类似,Soglia等[15]对鸡胸肉进行压缩测试,认为压缩比为40%时的应力值对应肌纤维的贡献,而压缩比为80%时对应结缔组织的贡献。肉质嫩度的差异在肌纤维层面上也得到体现,一般而言,肌纤维断裂强度越低,则肉的嫩度越好。Lund等[16]从气调包装的猪肉及牛肉中分离出单根肌纤维进行拉伸测试,结果表明,牛肉纤维断裂强度为500~800 kPa,而猪肉纤维为200~300 kPa,且含有氧气的包装显著增加了牛肉中肌纤维的断裂强度,而在猪肉中未发现差别。
2 肉类嫩度的主要影响因素
影响肉类嫩度的因素主要可分为宰前和宰后两大类,宰前因素涉及动物的品种、生长速率、营养状况等;而宰后因素涉及胴体的冷却和成熟[3]。动物屠宰放血之后短时间内,肌肉的营养及氧气供应停止,无氧状态下糖酵解途径将肌肉内糖原转化为乳酸,导致pH值下降并伴随少量ATP的生成,同时,由于细胞膜破损等原因导致细胞内Ca2+浓度升高。在Ca2+的诱导下,肌肉发生收缩消耗ATP,当ATP和磷酸肌酸等高能磷酸化合物耗尽,肌动球蛋白之间形成不可逆的横桥连接,此时肉进入僵直期(图1)。在随后的成熟过程中,由于自溶酶的作用,肌肉骨架蛋白发生降解[17]。因此,肌肉在宰后成熟过程及后续贮藏加工过程中,其结构会发生一系列的变化,进而影响嫩度。与肉类嫩度最紧密相关的3 个因素包括肌节长度、结缔组织和蛋白酶解。
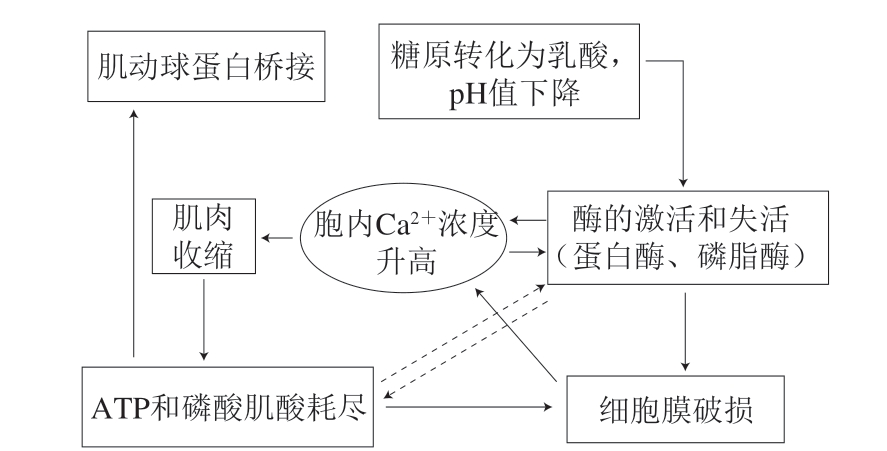
图1 动物屠宰之后短时间内肌肉中的主要理化现象
Fig. 1 Major physicochemical phenomena in postmortem muscle
2.1 肌节长度
肌节是动物活体状态时肌肉收缩的基本单元,生理状态下在Ca2+和ATP等存在时肌节可以在舒张与紧张状态下循环切换。根据肌丝滑动理论,肌节产生的力与其长度有关,肌节长度的改变影响粗细肌丝的重叠区域大小,进而决定肌动球蛋白横桥连接的数量,最终影响张力大小[18]:当肌节长度为3.65 μm时,粗细肌丝没有重叠,肌动球蛋白无法形成横桥连接,张力为0;当肌节开始收缩,粗细肌丝开始重叠,张力增大,直至2.25 μm时张力达到最大值;由于粗丝中心没有横桥连接位点,虽然肌节进一步缩短增大了粗细肌丝的重叠区域,但张力与2.25 μm时相同;随着肌节的进一步缩短,细丝会发生相互碰撞,以及粗丝在Z线阻碍下弯曲变形,这些变化导致张力减小。与活体状态下类似,宰后肉质力学特性也与肌节密切相关[19-23]。Wheeler等[23]选取猪肉中5 种主要部位进行嫩度分析并测定肌节长度,结果显示,当肌节长度为2~3 μm时,嫩度评分与肌节长度呈现良好的正相关;而当肌节长度为1.5~2.0 μm时,感官评定人员针对嫩度的评分差异较大,可能与其他因素,如胶原蛋白含量、骨架蛋白降解程度存在差异等有关。利用肌节长度预测肉的嫩度需要综合考虑其他理化因素,Chun等[24]比较牛肉成熟5、21 d的肌节长度,发现贮藏时间并未对肌节长度造成显著影响,而宰后成熟会影响骨架蛋白的降解,进而嫩化牛肉。
动物宰后其肌节长度受到诸多环境因素的影响,如pH值下降速率、肌肉冷却速率、机械拉伸等[4]。僵直期肌动球蛋白形成不可逆的横桥连接,使得肌节处于一个相对“锁定”的状态,如果在肌节处于收缩状态时进入僵直期往往导致肉质坚韧,因此,实际的肉类生产过程中需要尽量避免肌节收缩的现象,从而提升嫩度,即宰后成熟要充分。宰后肉的冷却过程如果操作不当,可能会造成冷收缩、解冻僵直等现象,从而引起肌节缩短而致肉质坚韧;而僵直之前的肉如果保存在较高温度下(20~40 ℃)同样会使得肌节收缩[4]。Pflanzer等[25]对比慢速冷却和快速冷却对牛后腰肉的影响,发现慢速冷却的牛肉剪切力更低,而肌节长度出现下降的趋势。为了避免收缩现象的发生,往往对僵直前的肉进行电刺激,从而消耗胴体中残存的ATP,并使得pH值迅速下降,从而快速通过冷收缩的“温度-pH值”窗口(温度低于10 ℃,同时pH值在6.0以上)。Abhijith等[26]对原料肉电刺激处理的文献进行荟萃分析,发现电刺激处理组的肉相较对照组具有更长的肌节,并且显著降低了原料肉的剪切力。除了对原料肉进行电刺激之外,还可以将屠宰后的胴体吊挂起来,利用肌肉自身重力拉伸相应部位。Basinger等[27]发现,悬挂法将山羊背最长肌中肌节长度拉伸达10%,而肉的剪切力发生显著下降。温凯欣[28]利用胴体颈臂束缚吊挂技术使牛背最长肌的肌节长度显著增大,而剪切力发生下降。然而,Pen等[29]对牛里脊肉进行拉伸,发现肌肉长度拉长33%却并未影响肌节和剪切力。因此,不同的吊挂/拉伸方式(后腿吊挂、骨盆吊挂等)对不同部位的肌肉嫩化效果不同。Ertbjerg等[4]指出,过度收缩(>40%)可能会使得邻近肌节在Z线附近发生断裂,虽然肌节发生断裂有利于嫩度,但过度收缩往往造成汁液大量流失。
2.2 结缔组织
结缔组织能够在肌肉、肌束及每根肌纤维表面形成膜鞘结构,因此,结缔组织对于肉的嫩度有重要影响。通常认为除了实质性的肌原纤维外,起支撑作用的结缔组织构成了肉的“背景嫩度”。结缔组织的主要成分为胶原蛋白,同时含有一些其他的成分,如弹性蛋白等。胶原蛋白往往以胶原纤维的形式存在,胶原蛋白的三股螺旋结构及分子间交联使得胶原纤维尤其强韧。一般而言,胶原蛋白含量越高,嫩度越差。除了含量之外,胶原蛋白本身的理化性质也对肉质有显著影响。例如,年龄大的动物其肉质较老,而胶原蛋白含量往往无显著差异,甚至年老的动物肌肉胶原含量低于年幼的动物[12],主要原因在于胶原蛋白热稳定性的差异。胶原蛋白的热稳定性一方面与自身的氨基酸组成有关,脯氨酸和羟脯氨酸含量高,通常热稳定性也好[30];另一方面,与胶原蛋白分子内及分子间的交联特性有关。胶原蛋白的交联主要有三大类[31]:1)二硫键,常见于Ⅲ型及Ⅳ型胶原蛋白;2)可还原的二价键,容易被热、pH值、变性剂等破坏,包括羰亚胺和醛亚胺;3)不可还原的三价键,在二价键的基础上进一步演变而成,主要是吡啶烷醇。Archile-Contreras等[32]研究肌肉细胞对氧化的应激反应,结果表明,体内活性氧可能会影响胶原蛋白的代谢,导致胶原蛋白溶解度下降。随着动物年龄的增长,不稳定的二价键在活性氧等作用下逐渐成熟演变为三价键,同时由于胶原蛋白在体内代谢周期相对肌动蛋白、肌球蛋白等更长[33-34],从而有利于胶原蛋白分子间稳定交联的积累。肉品通常是加热后食用,胶原蛋白中热稳定性高的交联及热稳定性差的交联比例对于肉质显得至关重要。如果热稳定的交联少,胶原蛋白更容易转变为明胶,肉在烹煮过程中容易松散;而如果稳定的交联过多,则肉难以咀嚼。低温长时间烹煮有利于嫩化肉类,与其中组织蛋白酶保持活性及胶原蛋白变性有关,二者共同作用下弱化了结缔组织[35]。文献中主要关注的是骨骼肌来源的肉品嫩度,李升升等[36]研究牦牛瘤胃平滑肌中胶原蛋白含量,同样发现随着年龄增加,总胶原蛋白含量、不可溶性胶原蛋白及三价交联键含量显著增加,并伴随着剪切力、硬度和咀嚼性的显著增加。胶原蛋白对肉品嫩度的贡献在一些极端情况下较为有限,例如在发生冷收缩的肉类中,肌节长度对嫩度的影响更大[4]。
在结缔组织中弹性蛋白和蛋白聚糖只占很小的比重,这些物质与胶原蛋白一起共同维持肌肉的结构完整性,从而对肉的嫩度有一定的贡献。弹性蛋白在体内处于收缩状态,能够可逆地进行高度拉伸。弹性蛋白高度疏水,几乎不溶,同时由于其含量低,目前在肉品中的研究尚不多见。Janz等[37]研究外周结缔组织对牛肉半键肌嫩度的影响,发现过于坚韧的肉质与高含量的弹性蛋白有关。Chen Qihe等[38]从杆菌中分离出一种弹性蛋白酶并将其用于牛肉的嫩化处理,结果表明,结缔组织中弹性蛋白被选择性降解,而对应的牛肉嫩度评分也高于对照组,这也支撑了弹性蛋白对肉质嫩度的贡献。蛋白聚糖由核心蛋白与葡萄糖胺聚糖组成,而蛋白聚糖往往又非共价地连接在透明质酸上,形成相对分子质量巨大的组装体。Nishimura[6]提出,蛋白聚糖穿插在胶原纤维网络中,形成完整的细胞外基质,单一胶原纤维的应力可以被周围的组织缓冲;在宰后成熟过程中,蛋白聚糖发生降解,从而造成肌肉结缔组织网络的破坏,单一的胶原纤维失去邻近纤维的支撑,容易破断,因而导致肉的嫩化。
2.3 蛋白酶解
上述提及的肌节长度和结缔组织在肉类成熟过程中变化较小,而细胞骨架蛋白的酶促降解被认为是肌肉成熟过程中嫩度变化的决定因素,因此很多相关的研究都集中在细胞骨架蛋白的降解方面。在宰后成熟过程中,肌肉中部分细胞骨架蛋白,如肌原纤维蛋白中的肌球蛋白、肌动蛋白,以及肌原纤维附着点中肌联蛋白、肌间线蛋白都会发生降解,而可能参与降解过程的内源酶主要包括钙蛋白酶、组织蛋白酶、蛋白酶体和细胞 凋亡酶[39]。钙蛋白酶,尤其是μ型钙蛋白酶被认为是牛肉、猪肉等嫩化的决定性内源酶。在成熟过程中,μ型钙蛋白酶活性显著下降,体外实验也表明,一系列的骨架蛋白,如肌联蛋白、肌间线蛋白等都是μ型钙蛋白酶的良好底物[40]。m型钙蛋白酶相比μ型钙蛋白酶需要更高浓度的钙离子激活,被认为不参与肉的嫩化[37]。近年来,部分研究表明,m型钙蛋白酶也参与了肉的嫩化[41-43]。钙蛋白酶对肉的嫩化作用主要体现在两方面,一是通过降解伴肌球蛋白和伴肌动蛋白而弱化肌丝和Z线的相互作用,进而弱化单一肌原纤维本身的结构强度,二是通过降解肌间线蛋白等连接蛋白,从而破坏肌原纤维与周围的连接[44]。根据Dransfield[45]提出的“基质-纤维相互作用模型”(图2),肌原纤维的弱化和连接蛋白的降解都将有利于嫩度的提升。
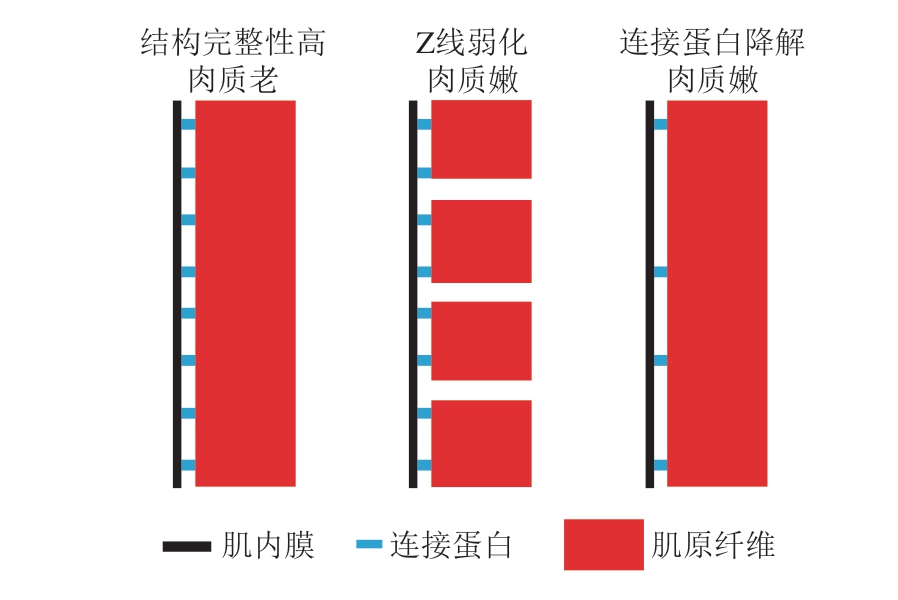
图2 基质-肌原纤维相互作用对肉质影响的示意图[45]
Fig. 2 Schematic illustration of the influence of matrix-myofiber interaction on meat tenderness[45]
Kristensen等[46]研究表明,动物生长速率的差异会影响屠宰后肉的嫩度,生长速率快的猪体内蛋白质代谢潜力(μ型钙蛋白酶相比其抑制剂的比值)增强,而上调的蛋白降解酶活性在宰后持续发挥作用,从而导致肉的嫩化。钙蛋白酶主要游离于肌浆中,集中在肌节Z线和I带附近,而Z线也是肌节断裂现象通常发生的地方。也有部分钙蛋白酶与肌原纤维、线粒体等结合。Lyu等[47]利用肌原纤维与Ca2+孵育,发现Ca2+能够使得钙蛋白酶与肌原纤维紧密结合,而且结合的钙蛋白酶可以保持降解肌原纤维蛋白的活性。钙蛋白酶水解蛋白有赖于其活性中心的半胱氨酸和组氨酸残基,而这2 种氨基酸都容易被氧化。由于氧化环境几乎无所不在,氧化可能导致钙蛋白酶失活,这一点已经在纯化的钙蛋白酶及强氧化环境(辐照)下得到验证[48]。氧化除了可能导致酶失活,也会改变底物蛋白的结构,从而影响其降解性。一般认为轻微程度的氧化促使蛋白质展开,更易被降解,而过度氧化导致蛋白质形成致密的结构,掩盖了酶解位点,进而难以被降解[49]。磷酸化[50]和硝基化[51]是肌肉蛋白质中常见的翻译后修饰类型,二者同样可以调控钙蛋白酶的活力,进而影响肉的嫩度。
3 肉类嫩度的调控
基于以上对影响肉质嫩度主要因素的论述可知,肉的嫩化可以在从农田到餐桌的各个阶段实施,嫩化的机制主要是通过影响肌节长度、结缔组织和蛋白酶解等。
3.1 动物生长阶段肉质嫩度调控
在生长阶段,不同的饲养条件可以显著改变肉质。Kristensen等[46]研究表明,猪的生长速率差异会影响屠宰后肉的嫩度,生长速率快的动物体内蛋白质降解活性增强,并且宰后肉中肌原纤维小片化指数较高。Gómez等[52] 研究生长速率和末期饲料对牛肉品质的影响,结果表明,生长速率的差异对嫩度无显著影响,而生长末期谷饲的牛肉嫩度高于草饲组。相反,Coria等[53]发现,草饲相比谷饲,牛肉中钙蛋白酶活性更高且其抑制剂活性更低,而草饲组的牛肉剪切力也较低。为了提高肉质氧化稳定性,往往在饲料中添加天然抗氧化成分。许多研究表明,抗氧化成分在提高肉质氧化稳定性的同时,往往也会提升肉的嫩度[54-55],一种可能的解释是抗氧化成分可以减缓肌原纤维蛋白之间的交联。
3.2 动物屠宰阶段肉质嫩度调控
在宰后僵直阶段,对肌肉进行冷却/冷冻等后续处理时,最关键的是避免肌节过度收缩造成肉质坚韧。如前所述,可以通过电刺激加速胴体的僵直进程,之后再进行冷加工,从而避免“冷收缩”“解冻僵直”等发生;此外,由于Ca2+泵在低温下失活导致细胞内Ca2+浓度升高,也可以通过调控冷却速率使肉类安全通过冷收缩的“温度-pH值”窗口(保持温度不低于10 ℃直至pH值下降至6.0以下)。通过外力限制肌肉收缩或拉伸肌肉也可以改变肌节长度,进而影响肉的嫩度[27-29];除了肌节长度之外,肌动球蛋白横桥连接的数量也影响肉的力学特性。Liu Jiao等[56]受到部分肌肉在频率为50~100 Hz、振幅为5%~10%的条件下收缩力会下降的启发,利用沿肌纤维长轴方向的振动成功抑制了分离的肌纤维及完整肌肉中肌动球蛋白的横桥连接。因此,对僵直前的肉施加适当的振动处理,可能会达到嫩化肉的效果,但目前有关研究主要集中在肌肉生理学方面。
3.3 肌肉贮藏加工阶段肉质嫩度调控
在宰后成熟阶段,通常可以借助一些物理方法破坏肉的超微结构,从而达到嫩化的目的,包括超高压、冲击波、超声波和共振技术等[57-59]。Peng Yingbo等[59]利用共振技术处理牦牛肉,发现牦牛肉的剪切力相较未处理组降低8%~23%,同时伴随肌节中M带的消失、肌原纤维彼此分离及胶原纤维分离。肉的成熟阶段伴随内源酶对骨架蛋白的降解破坏作用,受此启发,不同的外源酶被添加到肉品中用于提高嫩度,尤其是韧性大的老龄动物肌肉,应用较多的主要是来源于植物(木瓜、菠萝、无花果、猕猴桃、生姜)的酶和来源于微生物的弹性蛋白酶、胶原蛋白酶等[58]。相较于其他肉类嫩化方法主要针对生产者的特点,添加外源蛋白酶为消费者自身调控肉的嫩度提供了途径,但需要注意的是,外源蛋白酶使用不当可能会带来浆糊质地、风味差等缺点。根据不同嫩化技术有利有弊的特点,近年来已经发展出多种嫩化技术联用,以期达到协同增效的目的[60-62]。潘治利等[60] 报道,超声波联合木瓜蛋白酶嫩化与单独使用木瓜蛋白酶或单独进行超声处理相比,使得剪切力分别降低22.48%和19.02%。除了在肉中加入外源蛋白酶,利用盐类或有机酸腌制均有助于肉类嫩度的提升,这些物质的加入提高了离子强度、改变了pH值,一方面可以直接调控内源酶活力,另一方面也可能通过调节肉类的持水性等间接影响嫩度。持水性的提高降低了蛋白纤维的密度,从而提升了肉类嫩度。而高含量的肌间脂肪(如雪花牛肉)同样可以降低蛋白密度,从而对肉品嫩度有促进作用。
4 结 语
本文从肌节长度、结缔组织和蛋白酶解三方面综述了影响肉类嫩度的主要因素,也有一些其他的因素,如肌间脂肪含量、蛋白质变性、持水性等对肉类嫩度有直接或间接影响。目前,肉类嫩度有关研究主要集中在微观结构方面,而对于肉中最主要的化学成分水的关注并不多。水可以充当肌原纤维内及肌纤维之间的塑化剂,肌肉内的水分分布变化可能带来嫩度的变化。肌肉中水对于嫩度的影响尚有待进一步的研究。由于肌肉可以看作是结缔组织、肌纤维等组成的复合材料,这些成分在实际的肉品体系中相互作用,共同决定了肉的嫩度,因此需要综合考虑。此外,通过测定肉类各个结构单元强度等机械性能,有望建立更加准确的肉质预测模型。肉类嫩度形成规律和调控机制也可以为植物肉、细胞培养肉等行业提供参考。
[1] 农业部畜禽产品质量监督检验测试中心, 北京国农工贸发展中心. 肉嫩度的测定 剪切力测定法: NY/T 1180—2006[S]. 北京: 中国农业出版社, 2006.
[2] BAILEY A J. The basis of meat texture[J]. Journal of the Science of Food and Agriculture, 1972, 23(8): 995-1007. DOI:10.1002/jsfa.2740230811.
[3] MALTIN C, BALCERZAK D, TILLEY R, et al. Determinants of meat quality: tenderness[J]. Proceedings of the Nutrition Society, 2003, 62(2): 337-347. DOI:10.1079/PNS2003248.
[4] ERTBJERG P, PUOLANNE E. Muscle structure, sarcomere length and influences on meat quality: a review[J]. Meat Science, 2017, 132: 139-152. DOI:10.1016/j.meatsci.2017.04.261.
[5] 汪洋, 王稳航. 肌内结缔组织与肉嫩度的关联机制及相关肉嫩化技术的研究进展[J]. 食品科学, 2021, 42(11): 332-340. DOI:10.7506/spkx1002-6630-20200427-354.
[6] NISHIMURA T. Role of extracellular matrix in development of skeletal muscle and postmortem aging of meat[J]. Meat Science, 2015, 109: 48-55. DOI:10.1016/j.meatsci.2015.05.015.
[7] PURSLOW P P. New developments on the role of intramuscular connective tissue in meat toughness[J]. Annual Review of Food Science and Technology, 2014, 5: 133-153. DOI:10.1146/annurevfood-030212-182628.
[8] POST M J, LEVENBERG S, KAPLAN D L, et al. Scientific, sustainability and regulatory challenges of cultured meat[J]. Nature Food, 2020, 1: 403-415. DOI:10.1038/s43016-020-0112-z.
[9] SEAH J S H, SINGH S, TAN L P, et al. Scaffolds for the manufacture of cultured meat[J]. Critical Reviews in Biotechnology, 2022, 42(2): 311-323. DOI:10.1080/07388551.2021.1931803.
[10] ZHANG Jinchuang, CHEN Qiongling, KAPLAN D L, et al. Highmoisture extruded protein fiber formation toward plant-based meat substitutes applications: science, technology, and prospect[J]. Trends in Food Science and Technology, 2022, 128: 202-216. DOI:10.1016/j.tifs.2022.08.008.
[11] WEN Yaxin, CHAO C, CHE Q, et al. Development of plant-based meat analogs using 3D printing: status and opportunities[J]. Trends in Food Science and Technology, 2023, 132: 76-92. DOI:10.1016/j.tifs.2022.12.010.
[12] WARNER R, MILLER R, HA M, et al. Meat tenderness: underlying mechanisms, instrumental measurement, and sensory assessment[J]. Meat and Muscle Biology, 2021, 4(2): 17-25. DOI:10.22175/mmb.10489.
[13] American Meat Science Association (AMSA). Research guidelines for cookery, sensory evaluation, and instrumental tenderness measurements of meat[M]. Chicago: American Meat Science Association, 2015: 82-86.
[14] CAVITT L C, YOUM G W, MEULLENET J F, et al. Prediction of poultry meat tenderness using razor blade shear, Allo-Kramer shear, and sarcomere length[J]. Journal of Food Science, 2004, 69(1): SNQ11-SNQ15. DOI:10.1111/j.1365-2621.2004.tb17879.x.
[15] SOGLIA F, GAO J, MAZZONI M, et al. Superficial and deep changes of histology, texture and particle size distribution in broiler wooden breast muscle during refrigerated storage[J]. Poultry Science, 2017, 96(9): 3465-3472. DOI:10.3382/ps/pex115.
[16] LUND M N, CHRISTENSEN M, FREGIL L, et al. Effect of highoxygen atmosphere packaging on mechanical properties of single muscle fibres from bovine and porcine Longissimus dorsi[J]. European Food Research and Technology, 2008, 227(5): 1323-1328. DOI:10.1007/s00217-008-0847-5.
[17] LAWRIE R A, LEDWARD D A. Lawrie’s meat science[M]. Cambridge: Woodhead Publishing, 2017: 139-141.
[18] RANDALL D, BURGGREN W, FRENCH K. Animal physiology: mechanisms and adaptations[M]. New York: WH Freemanand Company, 1988: 357-358.
[19] STARKEY C P, GEESINK G H, COLLINS D, et al. Do sarcomere length, collagen content, pH, intramuscular fat and desmin degradation explain variation in the tenderness of three ovine muscles?[J]. Meat Science, 2016, 113: 51-58. DOI:10.1016/j.meatsci.2015.11.013.
[20] O’NEILL H A, WEBB E C, FRYLINCK L, et al. Effects of short and extended fasting periods and cattle breed on glycogenolysis, sarcomere shortening and Warner-Bratzler shear force[J]. South African Journal of Animal Science, 2018, 48(1): 71-80. DOI:10.4314/sajas.v48i1.9.
[21] HUGHES J M, OISETH S K, PURSLOW P P, et al. A structural approach to understanding the interactions between colour, waterholding capacity and tenderness[J]. Meat Science, 2014, 98(3): 520-532. DOI:10.1016/j.meatsci.2014.05.022.
[22] 杨玉莹, 张一敏, 毛衍伟, 等. 不同部位牦牛肉肌纤维特性与肉品质差异[J]. 食品科学, 2019, 40(21): 72-77. DOI:10.7506/spkx1002-6630-20181025-296.
[23] WHEELER T L, SHACKELFORD S D, KOOHMARAIE M. Variation in proteolysis, sarcomere length, collagen content, and tenderness among major pork muscles[J]. Journal of Animal Science, 2000, 78(4): 958-965. DOI:10.2527/2000.784958x.
[24] CHUN C K Y, WU W, WELTER A A, et al. A preliminary investigation of the contribution of different tenderness factors to beef loin, tri-tip and heel tenderness[J]. Meat Science, 2020, 170: 108247. DOI:10.1016/j.meatsci.2020.108247.
[25] PFLANZER S B, GOMES C L, FELÍCIO P E. Delayed carcass chilling improves tenderness of the beef Gluteus medius muscle[J]. Pesquisa Agropecuária Brasileira, 2019, 54: e00099. DOI:10.1590/S1678-3921.pab2019.v54.00099.
[26] ABHIJITH A, DUNSHEA F R, WARNER R D, et al. A meta-analysis of the effectiveness of high, medium, and low voltage electrical stimulation on the meat quality of small ruminants[J]. Foods, 2020, 9(11): 1587. DOI:10.3390/foods9111587.
[27] BASINGER K L, SHANKS B C, APPLE J K, et al. Application of tension to prerigor goat carcasses to improve cooked meat tenderness[J]. Meat Science, 2019, 147: 1-5. DOI:10.1016/j.meatsci.2018.08.018.
[28] 温凯欣. 胴体颈臂束缚吊挂技术对牛肉品质及关键差异蛋白研究[D]. 北京: 中国农业科学院, 2020. DOI:10.27630/d.cnki.gznky.2020.000312.
[29] PEN S, KIM Y H B, LUC G, et al. Effect of pre rigor stretching on beef tenderness development[J]. Meat Science, 2012, 92(4): 681-686. DOI:10.1016/j.meatsci.2012.06.023.
[30] ZHANG Xiaoxia, XU Songchen, SHEN Lirui, et al. Factors affecting thermal stability of collagen from the aspects of extraction, processing and modification[J]. Journal of Leather Science and Engineering, 2020, 2(1): 1-29. DOI:10.1186/s42825-020-00033-0.
[31] BAILEY A J, LIGHT N D. Connective tissue in meat and meat products[M]. London: Elsevier Applied Science, 1989: 170-194.
[32] ARCHILE-CONTRERAS A C, PURSLOW P P. Oxidative stress may affect meat quality by interfering with collagen turnover by muscle fibroblasts[J]. Food Research International, 2011, 44(2): 582-588. DOI:10.1016/j.foodres.2010.12.002.
[33] OJIMA K. Myosin: formation and maintenance of thick filaments[J]. Animal Science Journal, 2019, 90: 801-807. DOI:10.1111/asj.13226.
[34] RUCKLIDGE G J, MILNE G, MCGAW B A, et al. Turnover rates of different collagen types measured by isotope ratio mass spectrometry[J]. Biochimica et Biophysica Acta, 1992, 1156: 57-61. DOI:10.1016/0304-4165(92) 90095-c.
[35] DOMINGUEZ-HERNANDEZ E, SALASEVICIENE A, ERTBJERG P. Low-temperature long-time cooking of meat: eating quality and underlying mechanisms[J]. Meat Science, 2018, 143: 104-113. DOI:10.1016/j.meatsci.2018.04.032.
[36] 李升升, 余群力. 年龄对牦牛平滑肌胶原蛋白含量和质构特性的影响[J]. 农业工程学报, 2019, 35(13): 306-311. DOI:10.11975/j.issn.1002-6819.2019.13.037.
[37] JANZ J A M, AALHUS J L, PRICE M A. The effect of epimysial connective tissue on factors related to tenderness of beef Semitendinosus[J]. Journal of Muscle Foods, 2006, 17(1): 43-55. DOI:10.1111/j.1745-4573.2006.00033.x.
[38] CHEN Qihe, HE Guoqing, JIAO Yingchun, et al. Effects of elastase from a Bacillus strain on the tenderization of beef meat[J]. Food Chemistry, 2006, 98(4): 624-629. DOI:10.1016/j.foodchem.2005.06.043.
[39] KEMP C M, SENSKY P L, BARDSLEY R G, et al. Tenderness: an enzymatic view[J]. Meat Science, 2010, 84(2): 248-256. DOI:10.1016/j.meatsci.2009.06.008.
[40] KOOHMARAIE M, GEESINK G H. Contribution of postmortem muscle biochemistry to the delivery of consistent meat quality with particular focus on the calpain system[J]. Meat Science, 2006, 74(1): 34-43. DOI:10.1016/j.meatsci.2006.04.025.
[41] POMPONIO L, LAMETSCH R, KARLSSON A H, et al. Evidence for post-mortem m-calpain autolysis in porcine muscle[J]. Meat Science, 2008, 80(3): 761-764. DOI:10.1016/j.meatsci.2008.03.019.
[42] COLLE M J, DOUMIT M E. Effect of extended aging on calpain-1 and -2 activity in beef Longissimus lumborum and Semimembranosus muscles[J]. Meat Science, 2017, 131: 142-145. DOI:10.1016/j.meatsci.2017.05.014.
[43] ZHANG Y, ERTBJERG P. Effects of frozen-then-chilled storage on proteolytic enzyme activity and water-holding capacity of pork loin[J]. Meat Science, 2018, 145: 375-382. DOI:10.1016/j.meatsci.2018.07.017.
[44] 吕东坡, 胡永金, 朱仁俊, 等. 宰后肉的嫩化机制及其影响因素[J]. 食品科学, 2008, 29(8): 704-709.
[45] DRANSFIELD E. When the glue comes unstuck[C]//The 43rd International Congress of Meat Science and Technology. Auckland, New Zealand, 1997: 52-63.
[46] KRISTENSEN L, THERKILDSEN M, RIIS B, et al. Dietaryinduced changes of muscle growth rate in pigs: effects on in vivo and postmortem muscle proteolysis and meat quality[J]. Journal of Animal Science, 2002, 80(11): 2862-2871. DOI:10.2527/2002.80112862x.
[47] LYU J, ERTBJERG P. Ca2+-induced binding of calpain-2 to myofibrils: preliminary results in pork Longissimus thoracis muscle supporting a role on myofibrillar protein degradation[J]. Meat Science, 2021, 172: 108364. DOI:10.1016/j.meatsci.2020.108364.
[48] BAO Y, ERTBJERG P. Effects of protein oxidation on the texture and water-holding of meat: a review[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(22): 3564-3578. DOI:10.1080/10408398. 2018.1498444.
[49] XIONG YoulingL., GUO Anqi. Animal and plant protein oxidation: chemical and functional property significance[J]. Foods, 2020, 10(1): 40. DOI:10.3390/foods10010040.
[50] DU Manting, LI Xin, ZHANG Dequan, et al. Phosphorylation plays positive roles in regulating the inhibitory ability of calpastatin to calpain[J]. International Journal of Food Science and Technology, 2022, 57(1): 370-378. DOI:10.1111/ijfs.15437.
[51] WEN Pengcheng, YANG Qiaoneng, ZHANG Weibing, et al. Comparison of tenderness and calpains activity of yak meat in different ages during postmortem aging[J]. Kafkas Universitesi Veteriner Fakultesi Dergisi, 2020, 26(2): 239-246. DOI:10.9775/kvfd.2019.22854.
[52] GÓMEZ J F M, ANTONELO D S, BELINE M, et al. Feeding strategies impact animal growth and beef color and tenderness[J]. Meat Science, 2022, 183: 108599. DOI:10.1016/j.meatsci.2021.108599.
[53] CORIA M S, PIGHIN D, GRIGIONI G, et al. Feeding strategies and ageing time alter calpain system proteins activities and meat quality of Braford steers[J]. Animal Bioscience, 2022, 35(2): 272-280. DOI:10.5713/ab.21.0227.
[54] ZHANG H, ELLIOTT K E C, DUROJAYE O A, et al. Effects of in ovo injection of L-ascorbic acid on growth performance, carcass composition, plasma antioxidant capacity, and meat quality in broiler chickens[J]. Poultry Science, 2019, 98(9): 3617-3625. DOI:10.3382/ps/pez173.
[55] CORRÊA L B, NETTO A S, CÔNSOLO N R B, et al. Effects of canola oil and antioxidants on performance, serum parameters, carcass traits, and rumen fermentation patterns of Nellore cattle[J]. Animal, 2021, 15(6): 100217. DOI:10.1016/j.animal.2021.100217.
[56] LIU Jiao, ARNER A. Longitudinal vibration interferes with crossbridge attachment and prevents muscle fibre shrinkage under PSElike conditions[J]. Meat Science, 2021, 179: 108558. DOI:10.1016/j.meatsci.2021.108558.
[57] BHAT Z F, MORTON J D, MASON S L, et al. Applied and emerging methods for meat tenderization: a comparative perspective[J]. Comprehensive Reviews in Food Science and Food Safety, 2018, 17(4): 841-859. DOI:10.1111/1541-4337.12356.
[58] 时海波, 诸永志, 方芮, 等. 宰后肉品嫩化技术及其作用机理研究进展[J]. 食品科学, 2020, 41(23): 311-321. DOI:10.7506/spkx1002-6630-20191106-075.
[59] PENG Yingbo, LIU Shujie, ZHANG Yawei, et al. Resonance vibration ameliorating tenderness of yak Longissimus thoracis et lumborum: a novel physical tenderization technology[J]. Meat Science, 2022, 191: 108860. DOI:10.1016/j.meatsci.2022.108860.
[60] 潘治利, 李航天, 雷萌萌, 等. 超声波联合木瓜蛋白酶处理对鸡胸肉嫩度的影响[J]. 食品工业科技, 2021, 42(11): 162-167. DOI:10.13386/j.issn1002-0306.2020080036.
[61] MEHRABANI A, JAVAN A J, HESARINEJAD M A, et al. The combined effect of ultrasound treatment and leek (Allium ampeloprasum) extract on the quality properties of beef[J]. Food Bioscience, 2022, 47: 101622. DOI:10.1016/j.fbio.2022.101622.
[62] 李明奇, 贺稚非, 李少博, 等. 氯化钙-无花果蛋白酶-猕猴桃蛋白酶体系对兔肉肌原纤维蛋白结构的协同作用[J]. 食品科学, 2021, 42(4): 8-14. DOI:10.7506/spkx1002-6630-20191216-163.