随着经济水平的提高和消费结构的转变,全球肉制品市场总量在2021年已突破3.527 亿t,到2025年将有望超过4 亿t,并且在未来20 年里,全球肉类出口总量将同比激增20%[1-2]。与之相对的是,平均每年约有6 亿人因腐败食品而染病,其中约42 万人死亡[3-4]。食品质量安全是关乎民生的大事,其中尤以肉品的质量安全为主,这是由于肉品水分含量大、水分活度(water activity,aw)高(0.985~0.995)、pH值呈中性至酸性,为各类病原体提供了合适的生长环境[5-6]。再加之肉品供应链长(屠宰、后处理、清洗、漂烫、切割、包装、运输和销售等环节),往往存在重金属超标、抗生素和激素违规滥用、动物源性掺假和以次充好等问题,导致肉品安全性较差,相关安全问题频发[7-9]。因此,对肉品新鲜度及各类理化指标进行及时、有效地检测和评估至关重要。
传统肉品检测技术可以分为形态特征观察法和分析化学检测法两大类。形态特征观察法(包括显微镜法和感官检测法)是根据肉品颜色、结构、形貌等组织学特征进行初步评估的技术[10]。该方法早在2008年便被我国国家质量监督检验检疫总局规定为肉品检测的国家标准(GB/T 22210—2008《肉与肉制品感官评定规范》)并广泛使用。此类方法虽然操作简便、成本低,但严重依赖于检测人员的专业能力和个体经验,主观影响较大,无法精准判断肉品质量和状态[11]。分析化学检测法(包括色谱-质谱法、核酸法、免疫法和光谱法等)主要依赖于目标物质的化学成分和组成进行相关检测[12]。这些技术可以得到客观、稳定的结果,但普遍需要依靠实验室内各类台式设备、昂贵的试剂和专业的操作人员,并且样品处理量低、便携性差[13]。这不仅极大限制了对肉品质量的实时评估,消费者和经销商也不能及时获知肉品的贮藏状态和新鲜程度,无法满足日益增加的肉类检测和民众对高质量健康肉品的需求。
近10 年来,材料学、分析化学、计算机科学和人工智能等领域的飞速发展,使得肉品质量安全检测领域涌现了许多新兴智能检测技术,它们在保证小型化、便携化、集成化和高灵敏的基础上,还可向消费者或生产者实时提供肉品状态等信息[14]。作为其中一类新兴集成化技术平台,微流控芯片凭借其内部集成的微通道、微反应器、微泵、微阀等各类功能性微纳米结构单元,自动实现了样品前处理、反应、富集、标记、检测和分离等多种实验室常规操作,如图1所示[15]。不仅具备自动化、小型化、便携化和集成化等诸多优点,还能大大缩短样本的处理时间,提高检测灵敏度,节约了昂贵的试剂与耗材。因此,为了更好地推动和促进肉品质量安全技术的发展和微流控技术的大规模应用,本文首先总结微流控的概念、回顾其发展史和未来的发展趋势。此外,重点总结并汇总了基于微流控的新兴肉品质量检测技术的研究进展、原理、优缺点和应用前景。
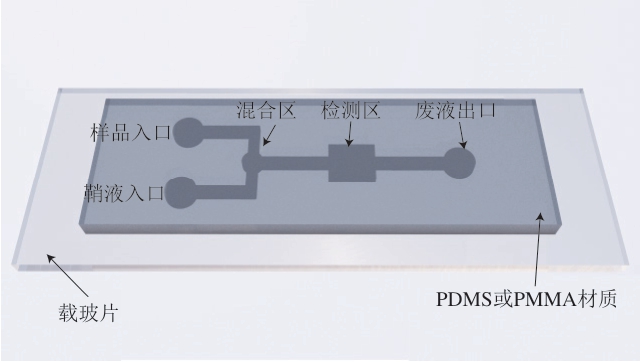
图1 典型的微流控芯片通道结构和功能示意图Fig. 1 Schematic diagram of typical microfluidic chip channel structure and function
PDMS. 聚二甲基硅氧烷(polydimethylsiloxane);PMMA. 聚甲基丙烯酸甲酯(polymethyl methacrylate)。
1 微流控技术
微流控分析技术也被称为芯片实验室或微流控芯片,问世不过30 年,但因发展迅猛,已经吸引了大批科研人员投身其中[16]。微流控芯片是由不同结构和功能的微通道构成,通过研究人员设计的互连微通道网络,使液体按照所需的要求流动,进而在数平方厘米大小的芯片上实现各项实验操作。与传统的台式分析系统相比,微流控技术在保证检测灵敏度的基础上,仅需数毫升或数微升体积的样品和试剂便可完成整个反应,具有更强大的样品处理能力、更好的便携性、更低的成本和更快的检测速度[17]。因此,微流控芯片在很多领域都得到了广泛应用,如癌症早检、化学分析、药物筛选、环境监测等。此外,由于微流控芯片低成本、可便携、速度快等特点,非常适用于食品质量安全方向的大规模检测。基于微流控的食品检测装置和相应的检测原理得到了前所未有的发展,相关研究论文在过去20 年里快速增加(图2)。
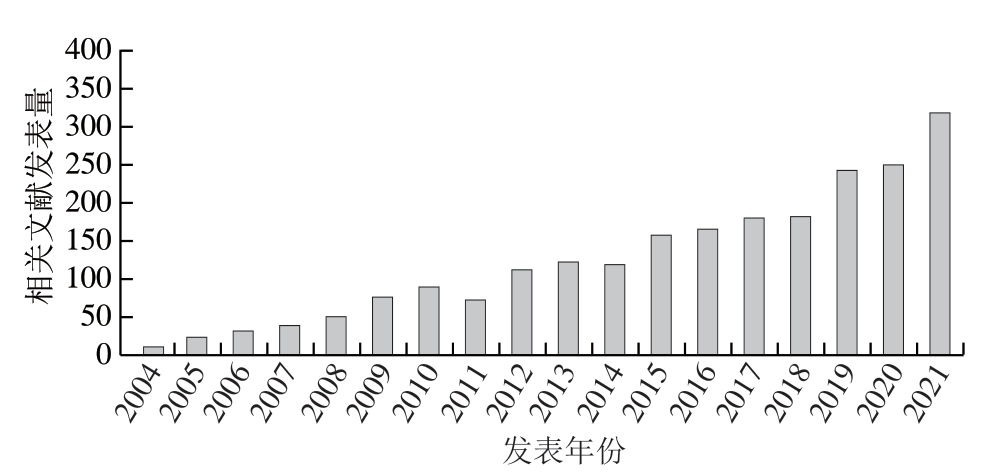
图2 基于微流控技术的食品质量检测相关英文文献发表量
Fig. 2 Number of research papers in English on microfluidics-based food quality detection techniques
数据来源于2022年9月Web of Science数据库。
1.1 微流控技术的发展简史
整个微流控技术的发展历程可以分为3 个阶段,即萌芽期、成长期和蓬勃发展期。萌芽期:微流控这一初级概念始于1950年,当时研究人员正开发能精确控制纳升或皮升液体的方法,为今天高度发达的微纳打印技术和3D打印技术奠定了基础[18]。随后,1979年Terry等[19]利用光刻法和化学刻蚀法在硅晶片上建立了亚毫米级微通道,成功提出了第1台微流控概念上的分析系统。11 年后,瑞典科学家Manz提出“微流控”这一概念,即微全分析系统(micro total analysis systems,µ-TAS)[20]。最初,µ-TAS主要用于生物和化学分析领域,并且普遍采用电泳来操控和驱动微纳米尺度的流体。在该系统中,待测样品的处理、反应、检测和其他操作过程全部集成于微通道内,但当时微流控芯片内部通道结构的设计方法并不明确。1994年,首届µ-TAS国际会议在荷兰举办,这段时期内,µ-TAS与微流控芯片之间并没有明确的定义,二者往往混用[21]。并且,芯片上的成熟操作单元仅有分析和进样等基础操作,集成化程度低,主要用于分析检测等领域。随着片上操作单元的逐渐发展与成熟,微混合、微反应及微分离等操作单元的陆续提出使得微流控芯片的应用范围大幅度拓宽,远远超过了当初µ-TAS所定义的分析范畴。
第2阶段是微流控技术的成长期。1995年,美国加州大学伯利克分校的Woolley等[22]开发出一款基于聚合酶链式反应(polymerase chain reaction,PCR)的微流控装置。同年,第1家商业化微流控企业CaliperLifeSciences在美国成立。3 年后,牛津大学的Whiteside及其团队利用光刻技术成功制造出1 款基于PDMS材质的微流控芯片,有效降低了微流控芯片的制造成本,相关成果已发表在Nature上[23]。此后,各类微流控开发企业如雨后春笋般成立,为了提高企业核心竞争力,微流控领域的专利之战拉开帷幕。2000年,第4届国际µ-TAS大会召开,标志着微流控技术的蓬勃发展。2001年,微流控领域顶级期刊《芯片实验室》(Lab on a Chip)创办。2002年,加州理工大学的Quake及其团队在国际顶尖期刊Science上发表专辑,汇总并介绍了具备上千个微阀和数百个微反应器的集成式微流控芯片,展现了微流控装置从早期的单一电泳分离分析到大规模集成化多功能微流控平台的飞跃[23]。此后2 年,《福布斯》杂志和Busineess 2.0杂志分别给予微流控技术极高的评价,将其称之为“改变世界的七项技术之一”[23]。自此之后,大批高水平研究人员投身于微流控领域。
第3阶段是微流控技术的蓬勃发展期。2006年,国际顶尖杂志Nature发表《芯片实验室》专辑,收录了1 篇概论和6 篇综述,从多个角度详述了微流控芯片的发展历史、现状和未来前景,并将微流控芯片评价为“the technology of the century(本世纪的技术)”[24]。10 年后,我国已将微流控技术列为“十三五”规划纲要中关键性突破技术之一。2020年,在进入微流控技术发展的40 年之际,为了展示该领域的最新研究进展,美国Wiley出版社旗下的高水平杂志Small专门发表了1 本基于微流控技术的专刊Microfluidics—The Fourth Decade,该专刊由22 篇综述文章和17 篇研究论文构成,详细讨论了微流控技术在不同研究方向上的重要进展[23]。2021年,我国国家发改委在《“十四五”生物经济发展规划》中将微流控技术列为未来创新方向的重点规划项目。
1.2 微流控芯片的发展趋势
通过上述发展简史可知,微流控技术一经提出便受到产业界和学术界的极大关注。未来10 年内,随着分析化学、材料学、计算机科学、人工智能和神经形态工程等领域的不断发展,微流控技术会不断与这些新兴学科相互结合,并被应用到不同的研究方法和领域中。对于食品检测或肉品检测领域而言,由于微流控成本低、速度快、处理量大和高便携的优势,研究人员普遍认为微流控技术优于传统的食品理化分析方法。若采用传统肉品检测方法,全部样品需送到一个集中的实验室内,几小时或几天后才可以获知结果,这导致检测期内无法及时评估肉品质量、影响民众安全并造成肉品浪费等问题。通过微流控技术的应用,测试时长可以从几小时缩短至数分钟,试剂消耗量可从毫升降低至微升或纳升,处理量方面,可实现一次性检测上千种复杂样品。随着多学科交叉融合的深入发展,未来微流控芯片一方面会继续向着小型化、便携化发展,结合先进的传感器组件、无处不在的智能手机和无线互联通讯技术等,开发出能够实时监测肉品质量和状态的系统;另一方面,将结合新兴纳米材料或生物信号分子,构建出超灵敏、速度快、可大批量处理的微流控装置。相信微流控技术的大规模产业化将会成为未来的发展趋势。
2 基于微流控的肉品检测技术
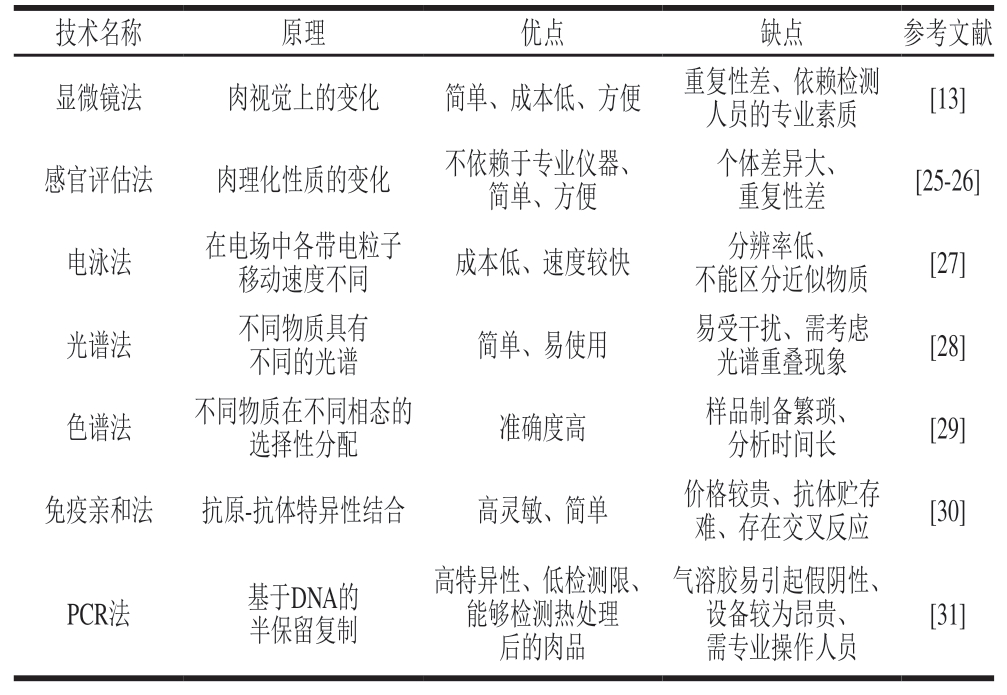
从20世纪初开始,现代肉品质量检测技术的发展历史已超百年,为了更好地推动微流控技术在肉品质量安全领域的研究,本文对重点成果和技术进行回顾与总结。如前所述,用于肉品质量评估的传统技术,虽然应用最为广泛,但依赖专业实验人员、设备和昂贵的试剂,耗时长、便携性差,无法满足与日俱增的肉品安全需求。当前肉品分析与检测技术的优缺点见表1。在过去十几年中,材料学、分析化学和计算机科学的发展,使得肉制品检测领域涌现了许多新兴智能检测技术,如微流控芯片,它们在保证小型化、便携化、集成化和高灵敏的基础上,有些设备还可向消费者或生产者实时提供肉品状态。按照检测对象的不同,可以将微流控肉品检测技术划分为:致病菌检测、重金属检测、抗生素与激素检测、肉品掺假检测和防腐剂检测。通过展示和介绍这些微流控技术的原理、优缺点和实际应用可能面临的阻碍,期望能进一步推动下一代肉类质量评估技术的开发和实际大规模应用。
表1 肉品主要检测技术的优缺点对比
Table 1 Comparison of the advantages and disadvantages of the main meat detection techniques
?
2.1 微生物检测
各类病原体和致病菌等微生物是全球肉品质量安全的最大威胁之一。从生产、加工、运输、贮存到食用的整个肉品供应链中,任何一个环节的处理不当或污染都有可能引起病原微生物的繁殖。这些微生物能够降解肉中的各类营养物质,产生异味和对人体健康有害的醛、酮、胺和吲哚类代谢产物[32]。不仅会造成肉品大规模浪费和经济损失,食用腐败变质肉还会引起人恶心、呕吐和食物中毒等严重的健康问题。在所有病原微生物中,致病性最强的3 种细菌是大肠杆菌、沙门氏菌和单核细胞增生李斯特菌[33]。据调查数据显示,仅肠炎沙门氏菌和鼠伤寒沙门氏菌这2 种病原体所引起的疾病就占全部人类消化系统感染的一半左右[34]。因此,快速检测和量化肉品中存在的病原微生物至关重要。
迄今为止,肉品行业对于微生物的检测仍普遍依赖于传统检测技术,包括平板培养、酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)和PCR等[35]。这些方法是可靠且有效的,构成了世界各国公认的质量监督通用条例和法规,但也存在严重的局限性,作为“金标准”的培养法缺乏快捷性(通常花费数天至数周)、无法检测到肉品中存活但不可培养的病原体、难以准确分析食源性疾病爆发的原因(培养后的病原体进行亚型区分较困难)[36-37]。ELISA等免疫亲和法则是成本较为昂贵、试剂消耗量大且需要专用的酶标仪。对于PCR法来说,尽管单次分析时间为30~90 min,但考虑到复杂的肉品预处理、核酸提取和扩增子分析,整个过程可能需要6~48 h才可全部完成[38]。此外,PCR法也依赖于洁净的操作间、专业技术人员和热循环仪。人力成本的不断增高和COVID-19的出现也进一步凸显了这些技术的缺点。与上述方法相比,微流控装置在分离和检测病原体方面更有潜力,这主要是因为:1)它可以轻易地与各类微功能单元相集成,如免疫磁珠、纳米结构(微柱、微阵列)、电极等,这些微功能单元不仅可以提供新的高灵敏检测方式,还可以提供更多的抗体或适配体结合位点,并能通过微通道的流体力学设计来促进病原体与试剂的碰撞结合概率[39]。一方面提高了检测灵敏度,另一方面不需要培养或富集便可检测到低水平的病原体,便于现场快速筛查与肉类样品结果的及时反馈;2)所需的样品与试剂量少,且部分微流控装置可反复使用,有效降低了检测费用[40];3)微流控装置的全封闭式设计提供了一个相对洁净的反应空间,可避免外界气溶胶进入反应体系所引起的PCR假阳性结果,还降低了样品对周围环境或人员的污染。最近,Tokunaga等[41]基于免疫亲和法与荧光染色技术,构建了一款对鸡肉中鼠伤寒沙门氏菌进行检测的微流控装置。该方法首先利用抗体包被的磁珠分离出鼠伤寒沙门氏菌,随后与荧光标记的检测抗体一同注入微流控芯片中,再使用荧光显微镜进行计数。与传统培养方法所需4~5 d相比,该方法仅需3~4 h便可完成整个检测过程,但其仍依赖于荧光显微镜等台式设备,无法满足食品领域注重便携性的要求;此外,该方法的另一个明显缺点是未能在同一芯片上实现分离、纯化和检测操作,细菌的纯化是在芯片外进行的,这增加了额外的操作步骤,并易污染样品和周围的检测环境。密苏里大学Abdullah等[34]开发了一款基于电阻抗检测原理的集成微流控装置,可在同一芯片上富集、分离和检测鸡肉中存在的大肠杆菌和鼠伤寒沙门氏菌。该方法在检测电极上固定有相应抗体、捕获到靶向细菌后,再利用阻抗变化来评估相应细菌的数量,整个检测过程可在1 h内完成,对大肠杆菌和沙门氏菌的检测浓度分别低至13、10 个/mL。Qi Wuzhen等[42]也建立了一款集混合、分离、标记和检测于一体的微流控装置,用于鸡肉中伤寒沙门氏菌的快速筛检。其先利用免疫磁性纳米珠捕获目标细菌后,再使用金属有机框架化合物来放大生物信号。该生物传感器能够在1 h内完成整个检测过程,检测下限低至14 CFU/mL,有望用于肉品致病菌的快速现场检测。总而言之,通过在微流控这一富有潜力的平台上集成分离、混合和检测等微功能单元,将有望探索出低成本、高灵敏和快捷的现场肉品微生物检测装置。
2.2 重金属检测
全球工业化和信息化水平的飞速发展带来了越来越多的环境问题。由于重金属离子(如Hg2+、Cd2+和Pb2+等)易在生态系统中持续富集和无法生物降解的特性,已经成为食品质量安全领域的首要污染物之一[43-44]。长时间工业污水和废气的随意排放,导致这些重金属离子过量沉积到水生生态系统中,直接污染鱼、虾等水产品,间接影响猪、牛、羊等畜产品。由于这些离子在人体内代谢极慢,长期食用重金属超标的肉品会严重扰乱肝脏、肾脏、心血管系统和免疫系统的正常功能[43]。因此,检测肉品中重金属残留非常重要。
用于重金属检测的传统技术已经较为成熟,包括电感耦合等离子体质谱[45-46]、中子活化分析[47]、X射线荧光光谱[48]、电感耦合等离子体原子/光发射光谱法[49]和原子吸收光谱法[50]等。尽管这些技术提供了足够出色的检测灵敏性、准确性和特异性,但它们不可避免地依赖于昂贵且笨重的设备、训练有素的操作人员和复杂的样品处理、分析程序。特别是在缺乏足够基础设施、技术人员和需要现场快速检测的发展中国家和地区,迫切需要更加简单、经济、便携和一体化的方法[51]。由于上述已经提及的独特优势,微流控技术是低成本、便携化的新兴肉品重金属检测技术之一。Swain等[52]建立了一款基于高灵敏酶纳米探针技术的便携式微流控技术,它可以在20 min内快速检测鱼肉中的汞离子(Hg2+)、铬离子(Cd2+)和铅离子(Pb2+)含量,定量限为0.1~0.5 ng/L,检测限为0.1 ng/L。该技术在保证高灵敏的基础上,可在短时间内完成整个分析实验,具有不错的应用潜力;但该微流控装置是由有机玻璃制备而成,易脆且不够便宜,并且检测结果的定性、定量仍依赖于酶标仪和精密注射泵这种外部设备。基于纸张的微流控装置,即纸基微流控由于极低的成本、无需额外的组件(注射泵等)和肉眼可视的检测结果等优点,在肉品重金属检测、抗生素、掺假检测等方面引起越来越多的关注。Zhang Yali等[53]开发了一款基于荧光标记、适配体修饰的氧化石墨烯传感器的纸基微流控装置,它不仅可以同时检测食品中的Hg2+和Ag2+,还可评估氨基糖苷类抗生素的残留情况,在10 min内对Hg2+和Ag2+的检测限分别可达到40、10 nmol/L,并且制作简单、成本低廉,具有不错的应用前景。
2.3 抗生素与激素检测
长期以来,肉品饲养商和生产商向饲料或饮水中添加生长促进剂或各类抗菌药物(如牛生长激素、β-受体激动剂、诺氟沙星等),以降低牲畜患病率,改善动物的代谢、生长、发育和繁殖[54]。尽管欧盟从2006年便开始禁止畜禽业使用各类抗生素生长促进剂,但在全球绝大多数国家,抗生素生长促进剂的广泛使用使其得以满足肉和乳日益增长的需求。在法律规定的使用量内,正常添加这些非必需化合物能够有效提高畜禽屠宰率、产奶量和瘦肉率,降低发病率[55]。但某些不法经营者往往会过量过度使用这些化合物,以便在更短时间内获得更高的经济效益。长期食用这些不合格肉品,会干扰人体内正常的激素分泌、对肝脏造成损害,并且易诱发癌症[56]。
动物源性食品中抗生素与激素的常规检测方法包括紫外分光光度法、荧光法、高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrometry,HPLC-MS)和ELISA等[57]。这些方法的缺点已经在上文中详述,其仍然无法满足现代化肉品行业对于快捷、低成本和便携等目标的追求。纸基微流控装置所具备的低成本、对试剂/样品要求低、用户友好和快速检测的优势,使其在抗生素和激素检测方面成为众多研究人员和检测机构关注的焦点之一。Chen Xu等[58]报道了一款基于化学发光原理的纸基微流控装置,可以对猪毛样品中的β-受体激动剂进行快速、灵敏的检测。该方法样品和试剂消耗量低,整个检测在数分钟内便可完成,且检测限可达2.0×10-8 mol/L;更重要的是,仅需要简易的荧光发射/接收设备便可进行精准定量,若未来能与智能手机相结合以进一步摆脱对设备的需求,那么在激素检测的现场分析中将有更大的应用前景。Baghban等[59]同样也利用纸基微流控技术结合简单的化学比色原理,构建了一款能够快速检测鸡肉中莱克多巴胺(一种常见的β-受体激动剂)的方法。该方法基于莱克多巴胺与银纳米探针间的颜色变化,通过肉眼即可判断此激素是否超标,而无需任何外部设备。近年来,无论在发达国家还是发展中国家,配备大容量存储器、可充电电池、无线通信模块、高分辨率相机和GPS系统的智能手机越发常见。与实验室设备相比,它们易于使用、人性化、长续航和高便携的特点使得研究人员不断将其与微流控技术相结合,转换成适用于现场检测和及时评估的多功能传感平台。例如,哥伦比亚大学的Trofimchuk等[60]建立了一款利用咖啡环效应和金属化合物比色反应的纸基微流控分析装置,能够在7 min内快速、灵敏地检测鸡肉中存在的诺氟沙星类抗生素。该装置的原理基于诺氟沙星与硝酸铁九水合物间可产生的明显颜色变化,通过智能手机内置软件成像并使用图像分析软件ImageJ®将图片的颜色差异转化为具体的数值以定性及定量该抗生素,其灵敏度为最低可检出肉中残留的5 mg/L诺氟沙星。这种将低成本、高灵敏和集成化的微流控技术与高共享性、小型化和易获得的智能手机设备相结合的新型传感系统在短时间内便实现了与传统HPLC-MS方法相当的检测灵敏度和准确度,证明了其在现场快速检测真实肉类样品中的可行性,将是构建肉品安全快速响应与及时监测环节的重要组成部分之一。
2.4 肉品掺假检测
肉品掺假、以次充好等欺诈现象仍然是非常严重的全球性食品问题,也是消费者、食品监督管理者和肉类行业关注的焦点[29]。市场上肉品掺假是一个比例很高的现象,在美国弗罗里达州市场上调查的902 份样品中,22.9%的熟肉品和15.9%的生肉品存在不同程度动物源性肉品的掺杂;不仅在美国,欧盟2013年也出现过生牛肉中存在马肉成分的大规模肉类掺假事件[61]。尽管肉品掺假不会直接影响食用者的人身安全,但直接损害了消费者的经济利益、降低了民众对肉品行业和食品安全监督管理者的信心、进一步引发了人们对整个食品行业的担忧[62]。
肉品掺假的传统鉴定方法有很多,包括肉切面的物理和感官评估、组织学分析、生化技术(色谱、质谱、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、蛋白质免疫印迹法(Western blotting)等)和光谱法(拉曼光谱、紫外分光光度法、傅里叶变换红外光谱等)[63]。但这些方法也都面临着之前所述的不足,即耗时耗力、需要适当的实验室设备。此外,上述方法均基于不同物种间结构差异、特异性蛋白标志物、氨基酸含量和蛋白质特性来区分肉品真伪;但对于熟制肉来说,蛋白质在高温下的变性会影响感官/组织学评估,且会引起交叉反应,进而影响此类方法的准确性[64]。因此,在肉品掺假鉴定中,PCR是主要的“金标准”技术,其基于靶标DNA或RNA片段的扩增来判断是否含有其他物种的核苷酸片段,在一般加热条件下受影响较小。但PCR技术仍依赖于昂贵且精密的实验室仪器,如热循环仪(实时PCR)或微液滴生成装置与排气装置(数字PCR和数字液滴PCR),这在一定程度上阻碍了该技术在肉品大规模筛检中的应用。针对这一问题,Hu Hezhi等[65]构建了一款易于操作并能够自动去除气泡的微腔室数字PCR微流控系统,其利用预脱气PDMS的负压来自动吸入样品并以便携式加热板供热,无须注射泵和热循环仪这种外部设备。该系统能够对不同质量比的鸡-羊混合肉品进行检测,以判断是否掺假和具体掺假比例,不过其结果分析仍依赖于倒置荧光显微镜、暗室和荧光分析处理软件。针对这一问题,纸基微流控的肉眼可视化、低成本和无需任何台式仪器的优势将是现场肉品掺假鉴定的发展方向之一。例如,Yin Rui等[61]提出了一款基于猪特异性PCR-纸基微流控的检测试纸条,用于快速检测肉品中是否含有猪或猪衍生成分。该试纸条基于PCR扩增和PCR产物在纸带上的免疫亲和检测原理,仅需肉眼在3 min内便可完成整个测试过程,最低可检测肉品中含量为0.01%的猪肉成分,是一种很有前途的肉品掺假检测装置。
2.5 防腐剂检测
为了防止肉品中颜色改变、脂肪氧化和微生物繁殖,人们利用很多保存技术来延长肉品的保质期,其中主要是各类化学防腐剂的使用。亚硝酸钾和亚硝酸钠是肉品行业最重要的防腐添加剂之一,不仅能够阻止血红蛋白和肌动蛋白氧化所导致的变色现象,而且能够抑制细菌和孢子的生长,特别是强毒性的肉毒梭状芽孢杆菌[66]。肉中硝酸盐与亚硝酸盐的传统检测方法主要有毛细管电泳法、离子色谱法、比色法、电化学法和光谱法等[67]。虽然其中的一些技术可以直接检测亚硝酸盐和硝酸盐的含量,但部分技术是利用有害化学试剂(如镉、肼等)将硝酸盐转化为亚硝酸盐后再定量亚硝酸盐,这不仅需要训练有素的操作人员,而且产生的致癌或有害废物也存在污染肉品的风险[68]。因此,光谱法和电化学法这类低毒、灵敏、快捷的检测方法更适合实际现场中对肉中防腐剂进行筛查。最近,光谱法/电化学法与微流控平台相结合的小型化检测系统引起了广泛关注,因为除了最大限度降低试剂和样品的消耗量外,还具有高便携性、低成本和快捷化的特点。Khanfar等[69]制造了一款小型便携式微流控光学检测设备,用于检测肉品中亚硝酸盐含量,其对亚硝酸盐的检测限和定量限分别达到1.24×10-2、4.12×10-2 mg/L。Morsy等[26]提出了一款基于Griess反应的快速、便携式的微流控装置,其在10 min内便可完成整个检测过程,对亚硝酸盐的检测限和定量限分别为0.1、0.4 mg/L。墨尔本大学的Jayawardane等[68]也构建了一款基于Griess反应的低成本、一次性纸基微流控分析装置,在5 min内便可同时检测肉品中含有的硝酸盐和亚硝酸盐。该装置可直接利用Griess反应检测亚硝酸盐;而对于硝酸盐的检测,则是在亲水纸基微通道上沉积金属锌颗粒,将硝酸盐转化为亚硝酸盐后,再使用Griess反应对其进行检测。其对于亚硝酸盐的检测限和定量限分别为1.0、7.8 µmol/L,对硝酸盐则可分别达到19、48 µmol/L。
3 结 语
肉品检测领域与其他食品领域一样,都需要低成本、高灵敏、可便携及适用于大规模检测的技术,以便在有限的时间和环境下尽可能高效地提供可靠的检测结果。虽然,当前微流控技术在肉品检测领域中的应用仍处于实验室或小规模中试阶段,且经过认证的商业化微流控设备数量上依然非常有限,但在灵敏度、便携性、成本和时间效益等方面已经取得了重大进展。对于食品安全监测和执法机构来说,以微流控作为技术平台的肉品检测技术将有望取代传统的筛查方法。在未来,它们的发展应更加关注实际在线检测过程中存在的部分自身缺陷,如:1)肉品进样的复杂性,将肉类样品注入微流控设备前,普遍需要复杂且耗时的预处理(如提取、过滤、离心等),这在一定程度上抵消了微流控本身所带来的便携性和即时性等优势;2)对微流控装置性能和有效性的具体立法或评估标准仍未建立;3)结果的反馈和展现方式有待统一;4)装置重复使用的问题,这会在一定程度上导致检测成本的增加。因此,对于聚焦在微流控肉品检测领域的研究学者来说,应进一步开发一体化装置,即从样品预处理到结果的读取全部集成于一张芯片中,这不仅可以降低操作步骤和难度,也可以避免对检测结果造成干扰。此外,微流控装置应配备统一的结果显示装置,现场工作人员无需任何专家指导便可轻松判断、评估和管理不同样品间的检测结果。基于智能手机的结果显示装置在最近一段时间内变得越来越受重视,未来研究还应该侧重于微流控平台与新一代分子技术、大数据分析和物联网模块相集成,在更高灵敏度和特异性的基础上,还可通过无处不在的通信网络将设备信息、检测结果上传至中央数据库。另一个重要的方面是提高单一设备的使用次数,以节省有限的资源和经费。对于使用光学传感器的设备来说,仅需要保证微通道内残存的试剂不会影响后续样品即可;对于生物传感器或化学传感器来说,则需将靶标物质与检测区域相分离,以实现传感器表面功能性的再生。随着材料学和分析化学的进一步发展,有望开发出可轻松用于肉品大规模检测的理想微流控平台。
[1] Food and Agriculture Organization of the United Nations. Meat market review: emerging trends and outlook[R]. Rome, December 2021.
[2] Food and Agriculture Organization of the United Nations. Meat market review: overview of global meat market developments in 2020[R].Rome, March 2021.
[3] LEYGONIE C, BRITZ T J, HOFFMAN L C. Impact of freezing and thawing on the quality of meat: review[J]. Meat Science, 2012, 91(2):93-98. DOI:10.1016/j.meatsci.2012.01.013.
[4] MUSTAFA F, ANDREESCU S. Chemical and biological sensors for food-quality monitoring and smart packaging[J]. Foods, 2018, 7(10):168. DOI:10.3390/foods7100168.
[5] GHASEMI-VARNAMKHASTI M, APETREI C, LOZANO J, et al.Potential use of electronic noses, electronic tongues and biosensors as multisensor systems for spoilage examination in foods[J]. Trends in Food Science and Technology, 2018, 80: 71-92. DOI:10.1016/j.tifs.2018.07.018.
[6] SANTIESTEBAN-LÓPEZ N A, GÓMEZ-SALAZAR J A, SANTOS E M,et al. Natural antimicrobials: a clean label strategy to improve the shelf life and safety of reformulated meat products[J]. Foods, 2022, 11(17):2613. DOI:10.3390/foods11172613.
[7] PRIYADARSHI R, EZATI P, RHIM J W. Recent advances in intelligent food packaging applications using natural food colorants[J]. ACS Food Science and Technology, 2021, 1(2): 124-138.DOI:10.1021/acsfoodscitech.0c00039.
[8] 曲超, 牛琳茹, 陶翠. 科技发力保证我国肉类食品安全[J]. 中国农村科技, 2019(6): 25-27.
[9] 陈倩, 陈靖. 畜禽类、水产类食品药物残留检测分析与安全对策[J]. 现代食品, 2018(5): 94-98. DOI:10.16736/j.cnki.cn41-1434/ts.2018.05.032.
[10] 王成程, 韩国全, 张琴, 等. 肉及肉制品真伪鉴别技术研究进展[J].食品安全质量检测学报, 2018, 9(22): 5930-5935.
[11] ANDERSEN P V, WOLD J P, GJERLAUG-ENGER E, et al.Predicting post-mortem meat quality in porcine Longissimus lumborum using Raman, near infrared and fluorescence spectroscopy[J]. Meat Science, 2018, 145: 94-100. DOI:10.1016/j.meatsci.2018.06.016.
[12] HAMEED S, XIE L, YING Y. Conventional and emerging detection techniques for pathogenic bacteria in food science: a review[J]. Trends in Food Science and Technology, 2018, 81: 61-73. DOI:10.1016/j.tifs.2018.05.020.
[13] FLAUZINO J M R, ALVES L M, RODOVALHO V R, et al. Application of biosensors for detection of meat species: a short review[J]. Food Control, 2022, 142: 109214. DOI:10.1016/j.foodcont.2022.109214.
[14] YU Shiqin, ZENG Weizhu, XU Sha, et al. Expediting the growth of plant-based meat alternatives by microfluidic technology:identification of the opportunities and challenges[J]. Current Opinion in Biotechnology, 2022, 75: 102720. DOI:10.1016/j.copbio.2022.102720.
[15] KUMAR Y, BANSAL S, JAISWAL P. Loop-mediated isothermal amplification (LAMP): a rapid and sensitive tool for quality assessment of meat products[J]. Comprehensive Reviews in Food Science and Food Safety, 2017, 16(6): 1359-1378. DOI:10.1111/1541-4337.12309.
[16] HSIAO C J, LIN J F, WEN H Y, et al. Enhancement of the stability of chlorophyll using chlorophyll-encapsulated polycaprolactone microparticles based on droplet microfluidics[J]. Food Chemistry,2020, 306: 125300. DOI:10.1016/j.foodchem.2019.125300.
[17] KO C H, LIU C C, CHEN K H, et al. Microfluidic colorimetric analysis system for sodium benzoate detection in foods[J]. Food Chemistry,2021, 345: 128773. DOI:10.1016/j.foodchem.2020.128773.
[18] MARK D, HAEBERLE S, ROTH G, et al. Microfluidic lab-on-a-chip platforms: requirements, characteristics and applications[J]. Chemical Society Reviews, 2010, 39(3): 1153. DOI:10.1039/b820557b.
[19] TERRY S C, JERMAN J H, ANGELL J B. A gas chromatographic air analyzer fabricated on a silicon wafer[J]. IEEE Transactions on Electron Devices, 1979, 26(12): 1880-1886. DOI:10.1109/T-ED.1979.19791.
[20] MANZ A, GRABER N, WIDMER H M. Miniaturized total chemical analysis systems: a novel concept for chemical sensing[J]. Sensors and Actuators B: Chemical, 1990, 1(1/6): 244-248. DOI:10.1016/0925-4005(90)80209-I.
[21] SHARMA B, SHARMA A. Microfluidics: recent advances toward lab-on-chip applications in bioanalysis[J]. Advanced Engineering Materials, 2022, 24(2): 2100738. DOI:10.1002/adem.202100738.
[22] WOOLLEY A T, MATHIES R A. Ultra-high-speed DNA sequencing using capillary electrophoresis chips[J]. Analytical Chemistry, 1995,67(20): 3676-3680. DOI:10.1021/ac00116a010.
[23] WANG Xiaobo, LIU Zixuan, FAN Fangfang, et al. Microfluidic chip and its application in autophagy detection[J]. TrAC Trends in Analytical Chemistry, 2019, 117: 300-315. DOI:10.1016/j.trac.2019.05.043.
[24] WHITESIDES G M. The origins and the future of microfluidics[J].Nature, 2006, 442: 368-373. DOI:10.1038/nature05058.
[25] ZIA Q, ALAWAMI M, MOKHTAR N F K, et al. Current analytical methods for porcine identification in meat and meat products[J]. Food Chemistry, 2020, 324: 126664. DOI:10.1016/j.foodchem.2020.126664.
[26] MORSY M K, MORSY O M, ABD-ELAATY E M, et al.Development and validation of rapid colorimetric detection of nitrite concentration in meat products on a polydimethylsiloxane (PDMS)microfluidic device[J]. Food Analytical Methods, 2022, 15(2):552-564. DOI:10.1007/s12161-021-02139-5.
[27] RÓŻYCKI M, CHMURZYŃSKA E, BILSKA-ZAJĄC E, et al.Isoelectric focusing of proteins in the pH gradient as a tool for identification of species origin of raw meat[J]. Journal of Veterinary Research, 2018, 62(2): 151-159. DOI:10.2478/jvetres-2018-0024.
[28] GAO Fei, XU Lingzhi, ZHANG Yuejing, et al. Analytical Raman spectroscopic study for discriminant analysis of different animalderived feedstuff: understanding the high correlation between Raman spectroscopy and lipid characteristics[J]. Food Chemistry, 2018, 240:989-996. DOI:10.1016/j.foodchem.2017.07.143.
[29] ALIKORD M, MOMTAZ H, KERAMAT J, et al. Species identification and animal authentication in meat products: a review[J].Journal of Food Measurement and Characterization, 2018, 12(1):145-155. DOI:10.1007/s11694-017-9625-z.
[30] MAGIATI M, MYRIDAKI V M, CHRISTOPOULOS T K,et al. Lateral flow test for meat authentication with visual detection[J]. Food Chemistry, 2019, 274: 803-807. DOI:10.1016/j.foodchem.2018.09.063.
[31] DALSECCO L S, PALHARES R M, OLIVEIRA P C, et al. A fast and reliable real-time PCR method for detection of ten animal species in meat products[J]. Journal of Food Science, 2018, 83(2): 258-265.DOI:10.1111/1750-3841.14001.
[32] AMARAL A B, DA SILVA M V, DA SILVA LANNES LANNES S C.Lipid oxidation in meat: mechanisms and protective factors: a review[J]. Food Science and Technology, 2018, 38(Suppl 1): 1-15.DOI:10.1590/fst.32518.
[33] GAO Hongwei, YAN Chunlei, WU Wei, et al. Application of microfluidic chip technology in food safety sensing[J]. Sensors, 2020,20(6): 1792. DOI:10.3390/s20061792.
[34] ABDULLAH A, DASTIDER S G, JASIM I, et al. Microfluidic based impedance biosensor for pathogens detection in food products[J].Electrophoresis, 2019, 40(4): 508-520. DOI:10.1002/elps.201800405.
[35] CARRELL C S, WYDALLIS R M, BONTHA M, et al. Rotary manifold for automating a paper-based Salmonella immunoassay[J].RSC Advances, 2019, 9(50): 29078-29086. DOI:10.1039/C9RA07106G.
[36] WANG Y, SALAZAR J K. Culture-independent rapid detection methods for bacterial pathogens and toxins in food matrices: detection of pathogens in food matrices[J]. Comprehensive Reviews in Food Science and Food Safety, 2016, 15(1): 183-205. DOI:10.1111/1541-4337.12175.
[37] ZHAO Xihong, LIN C W, WANG Jun, et al. Advances in rapid detection methods for foodborne pathogens[J]. Journal of Microbiology and Biotechnology, 2014, 24(3): 297-312. DOI:10.4014/jmb.1310.10013.
[38] POGHOSSIAN A, GEISSLER H, SCHÖNING M J. Rapid methods and sensors for milk quality monitoring and spoilage detection[J].Biosensors and Bioelectronics, 2019, 140: 111272. DOI:10.1016/j.bios.2019.04.040.
[39] CHEN Zhen, CHENG S B, CAO Pan, et al. Detection of exosomes by ZnO nanowires coated three-dimensional scaffold chip device[J].Biosensors and Bioelectronics, 2018, 122: 211-216. DOI:10.1016/j.bios.2018.09.033.
[40] WANG Jie, LI Wei, ZHANG Leicheng, et al. Chemically edited exosomes with dual ligand purified by microfluidic device for active targeted drug delivery to tumor cells[J]. ACS Applied Materials and Interfaces, 2017, 9(33): 27441-27452. DOI:10.1021/acsami.7b06464.
[41] TOKUNAGA Y, WAKABAYASHI Y, YONOGI S, et al. Microfluidic rapid quantification of Salmonella enterica serovar Typhimurium collected from chicken meat using immunomagnetic separation after formaldehyde treatment[J]. International Journal of Food Science and Technology, 2021, 56(10): 5402-5408. DOI:10.1111/ijfs.15251.
[42] QI Wuzhen, ZHENG Lingyan, WANG Sihan, et al. A microfluidic biosensor for rapid and automatic detection of Salmonella using metal-organic framework and Raspberry Pi[J]. Biosensors and Bioelectronics, 2021, 178: 113020. DOI:10.1016/j.bios.2021.113020.
[43] LI Yawen, CHEN Yuzhi, YU Hao, et al. Portable and smart devices for monitoring heavy metal ions integrated with nanomaterials[J]. TrAC Trends in Analytical Chemistry, 2018, 98: 190-200. DOI:10.1016/j.trac.2017.11.011.
[44] BANDARA G C, HEIST C A, REMCHO V T. Chromatographic separation and visual detection on wicking microfluidic devices:quantitation of Cu2+ in surface, ground, and drinking water[J].Analytical Chemistry, 2018, 90(4): 2594-2600. DOI:10.1021/acs.analchem.7b04087.
[45] WU Qi, SHI Jianbo, JI Xiaomeng, et al. Heterogenous internalization of nanoparticles at ultra-trace concentration in environmental individual unicellular organisms unveiled by single-cell mass cytometry[J]. ACS Nano, 2020, 14(10): 12828-12839. DOI:10.1021/acsnano.0c03587.
[46] KONG Linghao, HU Xingyun, PENG Xianjia, et al. Specific H2S release from thiosulfate promoted by UV irradiation for removal of arsenic and heavy metals from strongly acidic wastewater[J].Environmental Science and Technology, 2020, 54(21): 14076-14084.DOI:10.1021/acs.est.0c05166.
[47] WELLER A, ZOK D, REINHARD S, et al. Separation of ultratraces of radiosilver from radiocesium for environmental nuclear forensics[J].Analytical Chemistry, 2020, 92(7): 5249-5257. DOI:10.1021/acs.analchem.9b05776.
[48] TIGHE M, BIELSKI M, WILSON M, et al. A sensitive XRF screening method for lead in drinking water[J]. Analytical Chemistry, 2020,92(7): 4949-4953. DOI:10.1021/acs.analchem.9b05058.
[49] HONG A, TANG Q, KHAN A U, et al. Identification and speciation of nanoscale silver in complex solid matrices by sequential extraction coupled with inductively coupled plasma optical emission spectrometry[J]. Analytical Chemistry, 2021, 93(4): 1962-1968.DOI:10.1021/acs.analchem.0c04741.
[50] DAŞBAŞI T, SAÇMACI Ş, ÜLGEN A, et al. Determination of some metal ions in various meat and baby food samples by atomic spectrometry[J]. Food Chemistry, 2016, 197: 107-113. DOI:10.1016/j.foodchem.2015.10.093.
[51] LIN Y, GRITSENKO D, FENG S, et al. Detection of heavy metal by paper-based microfluidics[J]. Biosensors and Bioelectronics, 2016, 83:256-266. DOI:10.1016/j.bios.2016.04.061.
[52] SWAIN K K, BALASUBRAMANIAM R, BHAND S. A portable microfluidic device-based Fe3O4-urease nanoprobe-enhanced colorimetric sensor for the detection of heavy metals in fish tissue[J].Preparative Biochemistry and Biotechnology, 2020, 50(10): 1000-1013. DOI:10.1080/10826068.2020.1780611.
[53] ZHANG Yali, ZUO Peng, YE B C. A low-cost and simple paperbased microfluidic device for simultaneous multiplex determination of different types of chemical contaminants in food[J]. Biosensors and Bioelectronics, 2015, 68: 14-19. DOI:10.1016/j.bios.2014.12.042.
[54] AROEIRA C N, FEDDERN V, GRESSLER V, et al. A review on growth promoters still allowed in cattle and pig production[J]. Livestock Science,2021, 247: 104464. DOI:10.1016/j.livsci.2021.104464.
[55] EBARB S M, PHELPS K J, DROUILLARD J S, et al. Effects of anabolic implants and ractopamine-HCl on muscle fiber morphometrics, collagen solubility, and tenderness of beef longissimus lumborum steaks[J]. Journal of Animal Science, 2017, 95(3): 1219.DOI:10.2527/jas2016.1263.
[56] QAID M M, ABDOUN K A. Safety and concerns of hormonal application in farm animal production: a review[J]. Journal of Applied Animal Research, 2022, 50(1): 426-439. DOI:10.1080/09712119.2022.2089149.
[57] TROFIMCHUK E, NILGHAZ A, SUN S, et al. Determination of norfloxacin residues in foods by exploiting the coffee-ring effect and paper-based microfluidics device coupling with smartphonebased detection[J]. Journal of Food Science, 2020, 85(3): 736-743.DOI:10.1111/1750-3841.15039.
[58] CHEN Xu, LUO Yong, YUE Xiqing, et al. A novel microfluidic paper-based analytical device based on chemiluminescence for the determination of β-agonists in swine hair[J]. Analytical Methods,2020, 12(18): 2317-2322. DOI:10.1039/C9AY02754H.
[59] BAGHBAN H N, HASANZADEH M, LIU Y, et al. A portable colorimetric chemosensing regime for ractopamine in chicken samples using µPCD decorated by silver nanoprisms[J]. RSC Advances, 2022,12: 25675-25686. DOI:10.1039/D2RA04793D.
[60] TROFIMCHUK E, NILGHAZ A, SUN S, et al. Determination of norfloxacin residues in foods by exploiting the coffee-ring effect and paper-based microfluidics device coupling with smartphonebased detection[J]. Journal of Food Science, 2020, 85(3): 736-743.DOI:10.1111/1750-3841.15039.
[61] YIN Rui, SUN Yajuan, WANG Kangyu, et al. Development of a PCR-based lateral flow strip assay for the simple, rapid, and accurate detection of pork in meat and meat products[J]. Food Chemistry, 2020,318: 126541. DOI:10.1016/j.foodchem.2020.126541.
[62] NALAZEK-RUDNICKA K, KŁOSOWSKA-CHOMICZEWSKA I E,BROCKMEYER J, et al. Relative quantification of pork and beef in meat products using global and species-specific peptide markers for the authentication of meat composition[J]. Food Chemistry, 2022, 389:133066. DOI:10.1016/j.foodchem.2022.133066.
[63] LI Yuncheng, LIU Shuyan, MENG Fanbing, et al. Comparative review and the recent progress in detection technologies of meat product adulteration[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4): 2256-2296. DOI:10.1111/1541-4337.12579.
[64] TORNBERG E. Effects of heat on meat proteins: implications on structure and quality of meat products[J]. Meat Science, 2005, 70(3):493-508. DOI:10.1016/j.meatsci.2004.11.021.
[65] HU Hezhi, CHENG Jingmeng, WEI Chunyang, et al. Pre-degassed microfluidic chamber-based digital PCR device for meat authentication applications[J]. Micromachines, 2021, 12(6): 694. DOI:10.3390/mi12060694.
[66] LI Daoliang, WANG Tan, LI Zhen, et al. Application of graphenebased materials for detection of nitrate and nitrite in water: a review[J].Sensors, 2019, 20(1): 54. DOI:10.3390/s20010054.
[67] IAMMARINO M, MARINO R, ALBENZIO M. How meaty?Detection and quantification of adulterants, foreign proteins and food additives in meat products[J]. International Journal of Food Science and Technology, 2017, 52(4): 851-863. DOI:10.1111/ijfs.13350.
[68] JAYAWARDANE B M, WEI S, MCKELVIE I D, et al. Microfluidic paper-based analytical device for the determination of nitrite and nitrate[J]. Analytical Chemistry, 2014, 86(15): 7274-7279.DOI:10.1021/ac5013249.
[69] KHANFAR M F, ABU EISHEH N J, AL-GHUSSAIN L, et al. Lab on a chip for the colorimetric determination of nitrite in processed meat products in the Jordanian market[J]. Micromachines, 2019, 10(1): 36.DOI:10.3390/mi10010036.