肉类食品是人们不可或缺的食物,补充人体所需的必要元素[1-2]。腐败和病原微生物是肉类和肉制品中的污染物,微生物病原体引起的食源性感染是发病率和死亡率升高的重要原因,对食品质量和安全有相当大的影响,且可能存在于食品产业链各个环节[3-6]。大肠杆菌是人类和动物肠道中作为共生生物最具代表性的革兰氏阴性菌,具有荚膜、脂多糖、外毒素等多种毒性物质,是一种重要的食源性病原体[7-9],但肉类食品极易受到大肠杆菌污染,尤其是生肉类和加工过程中的肉制品为主要污染源[10-11],人体摄入大肠杆菌污染过后的肉类食品可引起不同的疾病综合征,如不同类型的腹泻疾病、伤口感染,甚至会引起免疫性疾病等,极大损害人体健康[12-13]。因此,大肠杆菌的早期和快速检测对于确保肉类食品安全至关重要[14]。
现行检验肉类食品中大肠杆菌的方式仍为以分离培养、生化鉴定为主的传统检测策略,需要大量的时间和经验丰富的人员[15]。这些检验方式不适应新时代快速、精准的检验需求[16-19],势必极大影响食品的安全管理和有效监测。基质辅助激光解吸电离飞行时间质谱(matrix assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF-MS)是快速鉴定新方法,具有前处理简单和高通量的特点,可以实现对未知微生物的快速鉴定、分型、溯源等[20-22],现已广泛应用于临床微生物、食源性致病菌及动物源性致病菌的快速鉴定[23-25]。虽然大肠杆菌可以使用MALDI-TOF-MS快速鉴定[26-28],但此方法的质量控制样品缺失严重限制了我国食品快速检测技术的发展。
本研究通过真空冷冻技术成功研制即用型大肠杆菌质控样品,系统分析该样品均匀性和稳定性。通过优化制备条件,得到存活率最高的质控样品,通过菌落计数和MALDI-TOF-MS检验样品的均匀性和稳定性,旨在作为质控样品用于肉类食品中大肠杆菌快速检测,使MALDI-TOF-MS检验有准则可以依据,提高鉴定的准确性,增加我国自主知识产权的权重,提升食品安全突发事件的处置能力和风险监测预警能力。
1 材料与方法
1.1 材料与试剂
大肠杆菌(CMCC 43201) 中国食品检验研究院。
乙醇、甲酸、乙腈、蔗糖、葡聚糖 天津科密欧化学试剂有限公司;1640细胞培养基 美国Sigma公司;质谱靶板基质液 德国Bruker公司。
1.2 仪器与设备
BHC-300IIA/B3生物安全检验柜 苏州净化仪器设备有限公司;MS3振荡混匀器 美国IKA公司;HVE-50灭菌器 日本Hirayama公司;MIR-254恒温培养箱日本San y o公司;3K15冷冻离心机 德国Si gm a公司;autoflex maX LIN MALDI-TOF-MS仪 德国Bruker公司。
1.3 方法
1.3.1 冻干基质的筛选
冻干基质的种类和各成分之间的比例关系是影响质控样品稳定性最重要的因素之一。将培养好的大肠杆菌依据不同冻干基质种类和比例进行真空冷冻干燥后,通过复溶测定样品冻干存活率,确定最佳冻干基质条件,冻干存活率按下式计算。
选用基质种类分别为1640细胞培养基、蔗糖、葡聚糖、牛血清白蛋白(bovine serum albumin,BSA)、脱脂乳粉,按照不同比例配制不同基质进行研究。
1.3.1.1 脱脂乳粉和蔗糖
分别配制质量浓度为5、10、15 g/100 mL的脱脂乳粉,对应配制不同质量分数的蔗糖(5%、10%、15%、20%)为冻干基质,按照1.3.2节进行样品制备,并使用无菌生理盐水使其复溶,测定存活率,筛选冻干基质。
1.3.1.2 1640细胞培养基
选取1640细胞培养基作为基础原料,其他冻干基质为蔗糖、葡聚糖、BSA。蔗糖质量分数使用1.3.1.1节得到的结果,对葡聚糖(2%、4%、6%、8%、10%)和BSA(1%、3%、5%、10%)的比例进行研究,按照1.3.2方式进行样品制备,并使用无菌生理盐水使其复溶,测定存活率,筛选冻干基质。
1.3.2 大肠杆菌质控样品制备
将大肠杆菌划线接种于PCA平板上,放置于36 ℃培养24 h。用无菌棉签刮取培养好的菌苔,混悬于筛选过后的冻干基质中,使用紫外分光光度计调节菌液浓度,波长650 nm,使其OD650 nm为2.5左右。使用微量移液器吸取100 μL菌悬液快速滴入含有液氮的西林瓶中,将样品迅速转移到真空冷冻干燥机内进行质控样品制备,真空冷冻干燥机预冻程序为-20 ℃、200 min,-40 ℃、200 min;冷冻干燥程序为-35 ℃、360 min、真空度130 mTorr,-30 ℃、360 min、真空度130 mTorr,-25 ℃、480 min、真空度130 mTorr,-20 ℃、480 min、真空度130 mTorr,-10 ℃、480 min、真空度130 mTorr。程序结束时保存为-20 ℃、真空度100 mTorr状态,制备质控样品。
1.3.3 大肠杆菌质控样品均匀性验证
采用简单随机抽样方式验证质控样品均匀性,将制备好的样品进行随机编号,通过选定号码,确定20 个质控样品进行均匀性研究,通过培养计数方式对质控样品进行定量检测验证均匀性。吸取1 mL无菌水分别加入质控样品中,让样品复溶,通过多次稀释后均匀涂布在平板上,同时做2 次平行实验,将平板置于36 ℃培养箱中培养24 h,测定大肠杆菌数量。
1.3.4 大肠杆菌质控样品稳定性验证
1.3.4.1 运输稳定性验证
将制备好的大肠杆菌质控样品分别保存在37 ℃和25 ℃环境中,进行14 d的稳定性研究,分别在0、1、2、3、5、7、14 d进行测定,同时做3 次平行实验。通过数值变化验证样品在较高温度下的运输稳定性,以及能否作为质控样品进行实际发样运输。
1.3.4.2 贮藏稳定性验证
将质控样品分别保存在4 ℃和-20 ℃环境中,进行28 d的稳定性研究。稳定性检验的时间间隔可以按先密后疏的原则安排。在使用期间应有多个时间间隔的监测数据,分别在0、1、3、5、7、14、28 d进行测定,同时做3 次平行实验。通过复苏率验证样品在低温下的贮藏稳定性,以及能否稳定保存。
1.3.4.3 MALDI-TOF-MS稳定性验证
将样品分别在37 ℃和-20 ℃环境中保存28 d后进行MALDI-TOF-MS检验,导入BN软件进行分析整合,研究质控样品MALDI-TOF-MS稳定性。
1.3.5 大肠杆菌质控样品MALDI-TOF-MS检验
制备的质控样品进行MALDI-TOF-MS时可以直接溶解使用,无需再次培养。
1.3.5.1 样品前处理
将密封的质控样品开启,将冻干菌球取出放入离心管内,加入100 μL灭菌水使其复溶,12 500 r/min离心5 min,去除上清液,保留沉淀,重复进行3 次。
1.3.5.2 样品靶板制作
向沉淀中添加50 μL体积分数70%甲酸,充分裂解2 min,添加50 μL乙腈,充分溶解后,以12 500 r/min离心5 min,取1 μL上清液到靶板相应位置,静置,待溶液挥发完成,取1 μL质谱靶板基质液到同样位置,静置,待溶液挥发完成,进行后续MALDI-TOF-MS检验。
1.4 数据处理
使用SPSS软件,采用单因素方差分析方法对质控样品均匀性进行分析。
2 结果与分析
2.1 冻干基质的筛选结果
冻干基质种类繁多,其构成、种类和比例不同均会导致菌株活菌数发生变化。
2.1.1 脱脂乳粉和蔗糖
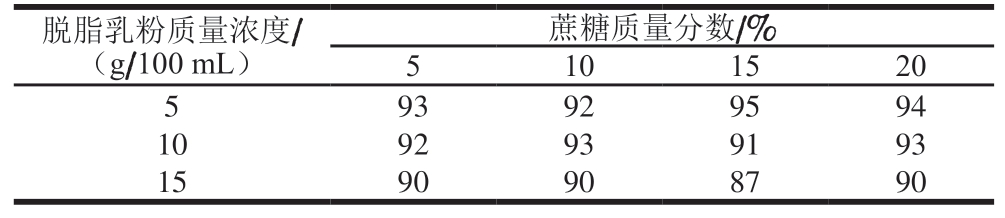
表1 脱脂乳粉和蔗糖作为保护剂的冻干存活率
Table 1 Survival rate of quality control sample prepared using skim milk powder and sucrose as cryoprotectant %
?
由表1可知,5 g/100 mL脱脂乳粉、15%蔗糖保护剂的冻存效果最好,冻干存活率为95%。但在后续MALDITOF-MS检测中,在m/z 2 000~20 000出现了溶剂杂峰,影响对目标菌的检测,因此不能用脱脂乳粉作保护剂。
2.1.2 1640细胞培养基
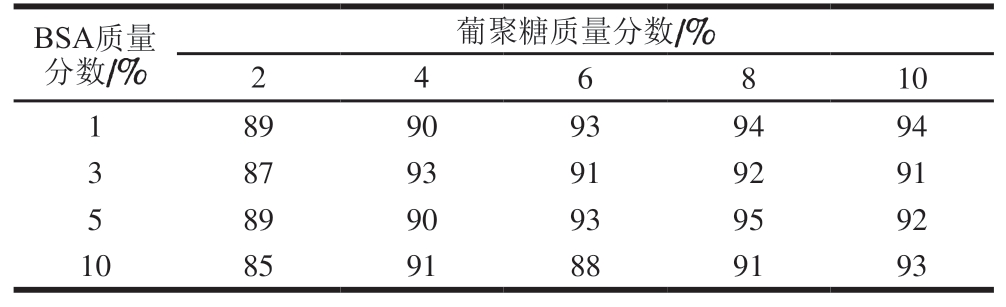
表2 1640细胞培养基作为保护剂的冻干存活率
Table 2 Survival rate of quality control sample prepared using 1640 culture medium containing BSA and dextran as cryoprotectant%
?
因脱脂乳粉无法使用,选取1640细胞培养基作为基础原料。由表2可知,8%葡聚糖(相对分子质量40 000)、5% BSA保护剂的冻存效果最好,冻干存活率为95%。但是加入BSA后,在后续MALDI-TOF-MS检测中也在m/z 2 000~20 000出现了溶剂杂峰,影响对目标菌的检测,所以需要去除BSA。
2.1.3 多次实验验证结果
表3 筛选过后的1640细胞培养基作为保护剂的冻干存活率
Table 3 Survival rate of quality control sample prepared using 1640 culture medium containing 15% sucrose and 8% dextran
?
得到筛选过后的冻干溶剂为1640细胞培养基,其中蔗糖质量分数为15%,葡聚糖质量分数为8%,进行重复实验验证。由表3可知,最高存活率为95%,存活率均在90%以上,在后续MALDI-TOF-MS检测时m/z 2 000~20 000没有出现溶剂杂峰,可以作为冻干菌球的保护剂。
2.2 大肠杆菌质控样品均匀性验证结果
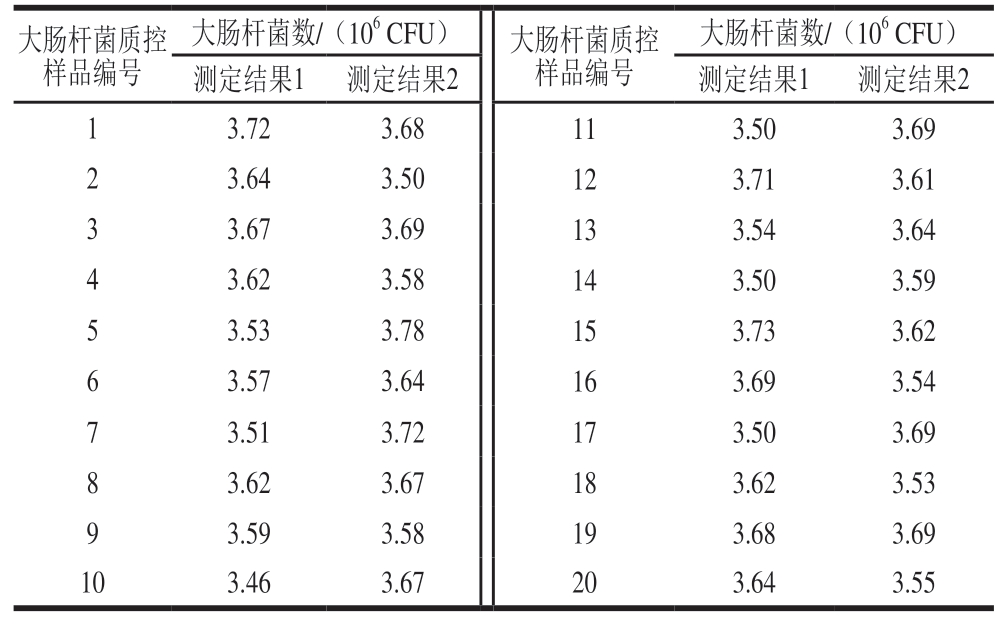
表4 20 瓶大肠杆菌质控样品计数结果
Table 4 Count results of 20 vials of E. coli quality control sample
?
由表4可知,20 瓶大肠杆菌质控样品计数结果较为统一,没有发生较大波动,说明样品均匀性良好。
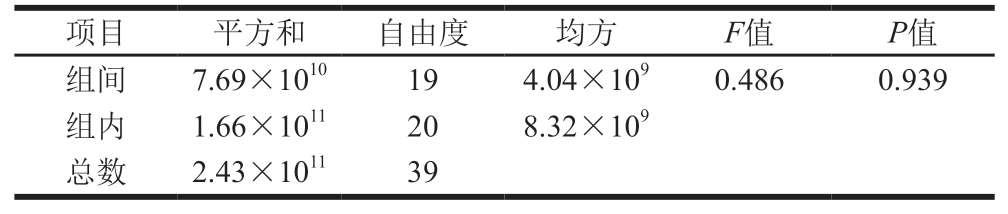
表5 样品的均匀性分析
Table 5 Homogeneity analysis of samples
?
使用SPSS软件,采用单因素方差分析方法,对样品的均匀性进行检验。FINV(0.05,19,20)临界值=2.137,由表5可知,根据SPSS软件计算的F=0.486<FINV(0.05,19,20)临界值,菌株计数稳定,侧面验证定性结果均一,表明该样品均匀性符合要求。
2.3 大肠杆菌质控样品稳定性验证结果
2.3.1 运输稳定性验证结果
表6 大肠杆菌质控样品模拟运输稳定性实验结果
Table 6 Stability evaluation of quality control samples under simulated transport conditions
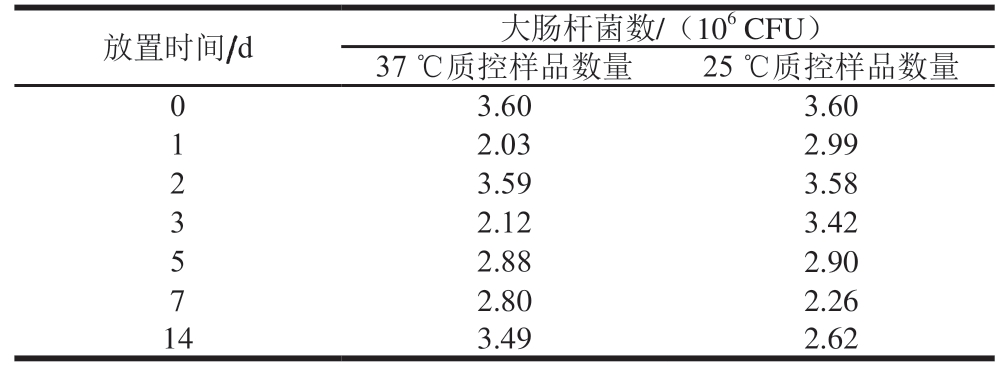
?
由表6可知,质控样品在37 ℃放置14 d后,大肠杆菌计数仍维持在106 CFU,在25 ℃环境下,质控样品计数较37 ℃更加稳定,证明质控样品运输稳定性良好。
2.3.2 贮藏稳定性验证结果
表7 大肠杆菌质控样品贮藏稳定性实验结果
Table 7 Storage stability of quality control samples
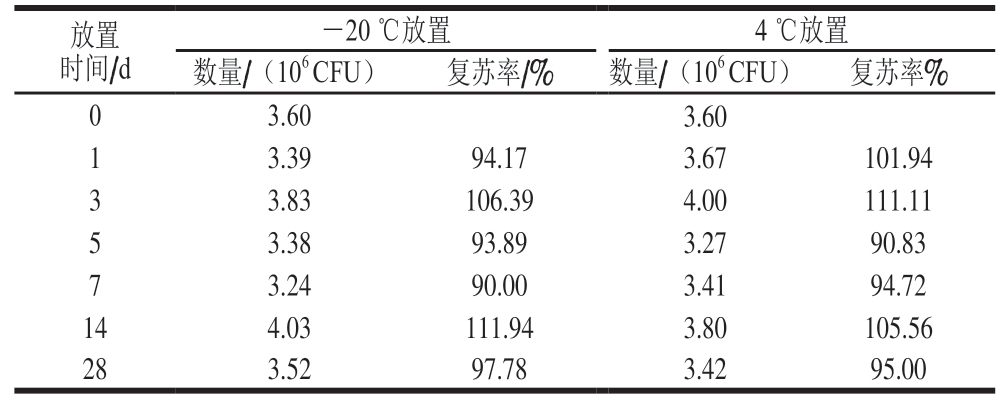
?
由表7可知,质控样品在-20 ℃放置28 d复苏率为97.78%,在4 ℃放置28 d复苏率为95.00%,说明大肠杆菌质控样品贮藏稳定性良好。
2.3.3 MALDI-TOF-MS稳定性验证结果
由图1~2可知,在不同温度条件下用MALDI-TOF-MS检测大肠杆菌质控样品,结果稳定,谱图一致,说明质控样品MALDI-TOF-MS测定稳定性良好,可以作为阳性质控样品在MALDI-TOF-MS检验中使用。
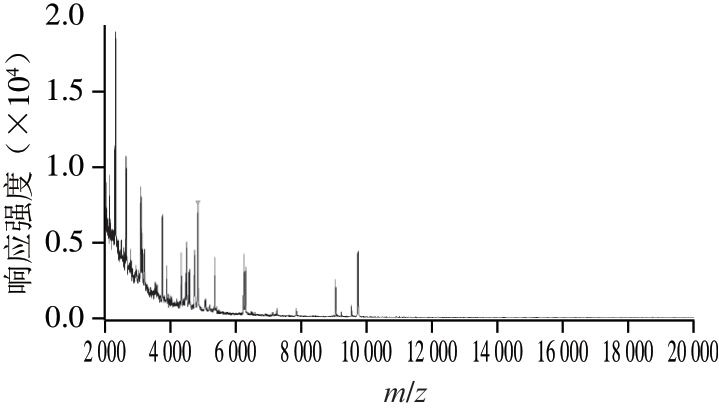
图1 大肠杆菌质控样品在-20 ℃条件下的MALDI-TOF-MS谱图
Fig. 1 Time-of-flight mass spectrum of quality control samples stored at -20 ℃
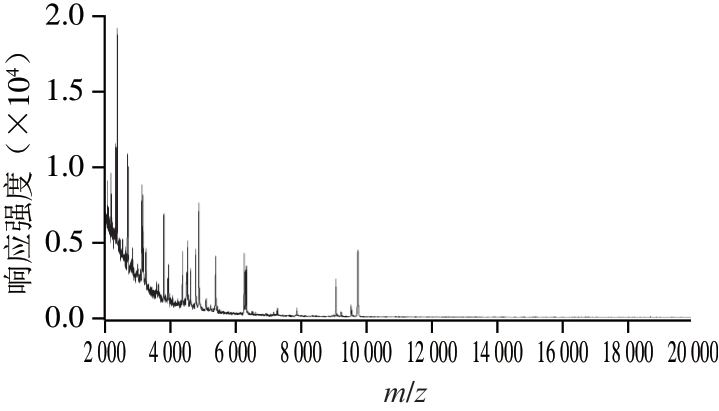
图2 大肠杆菌质控样品在37 ℃条件下的MALDI-TOF-MS谱图
Fig. 2 Time-of-flight mass spectrum of quality control samples stored at 37 ℃
3 结 论
肉类食品中大肠杆菌危害较大,但检验方式多为生化培养,检验时间较长,导致污染控制问题无法有效控制[29-30],不能满足快速检验需求。MALDI-TOF-MS作为精准、高通量检测手段正在逐步应用于日常微生物检测,但因没有相应匹配的质控样品,导致没有方法规范检测数据,严重制约了MALDI-TOF-MS的发展。
本研究通过优化冻干基质条件,成功研制出大肠杆菌即用型质控样品,样品通过直接溶解方式,无需再次培养,可以用于肉类食品中大肠杆菌MALDI-TOF-MS快速检验,并通过样品复溶计数方式验证均匀性和稳定性。实验结果表明:本质控样品F=0.486,小于临界值,证明样品有良好的均匀性,保障了作为质控样品的一致性;37 ℃和25 ℃环境条件下实验结果证明了本样品具有良好的运输稳定性,保证了样品在实际运输过程中不会变质;4 ℃和-20 ℃环境条件下实验结果证明了本样品具有良好的贮藏稳定性,保证了作为质控样品的长期有效性;样品在37 ℃和-20 ℃环境中贮藏28 d后的MALDI-TOF-MS检测结果一致,说明样品能够作为质控样品在MALDI-TOF-MS检验中稳定使用,为MALDITOF-MS技术检验肉类食品中大肠杆菌提供了校检方式,保证了检验数据的稳定、可靠。
[1] 王英. 肉类食品中兽药残留的原因及对策[J]. 食品安全导刊,2021(18): 18-20. DOI:10.16043/j.cnki.cfs.2021.18.012.
[2] 孙孟娇, 王稳航. 肉类食品生物膜的形成机制及预防措施[J].中国食品学报, 2021, 21(4): 375-383. DOI:10.16429/j.1009-7848.2021.04.044.
[3] SILVA B, BERNARDES P C, PINHEIRO P F, et al. Chemical composition, extraction sources and action mechanisms of essential oils: natural preservative and limitations of use in meat products[J]. Meat Science, 2021, 176(3): 108463. DOI:10.1016/j.meatsci.2021.108463.
[4] KARIKARI A B, KPORDZE S W, YAMIK D Y, et al. Ready-toeat food as sources of extended-spectrum β-lactamase-producing Salmonella and E. coli in Tamale, Ghana[J]. Frontiers in Tropical Diseases, 2022, 3: 834048. DOI:10.3389/fitd.2022.834048.
[5] 李丹, 王守伟, 臧明伍, 等. 我国肉类食品安全风险现状与对策[J].肉类研究, 2015, 29(11): 34-38. DOI:10.15922/j.cnki.rlyj.2015.11.008.
[6] ARSLAN S, EYI A. Antimicrobial resistance and esbl prevalence in Escherichia coli from retail meats[J]. Journal of Food Safety, 2011,31(2): 262-267. DOI:10.1111/j.1745-4565.2010.00295.x.
[7] FOKT H, CLETO S, OLIVEIRA H, et al. Bacteriocin production by Escherichia coli during biofilm development[J]. Foods, 2022, 11(17):2652. DOI:10.3390/foods11172652.
[8] QUIÑONES D, AUNG M S, CARMONA Y, et al. High prevalence of CTX-M type extended-spectrum beta-lactamase genes and detection of NDM-1 carbapenemase gene in extraintestinal pathogenic Escherichia coli in Cuba[J]. Pathogens, 2020, 9(1): 65. DOI:10.3390/pathogens9010065.
[9] 徐伟, 陈亚妮, 何珊珊, 等. 奶牛急性大肠杆菌性乳房炎病例[J].中国兽医杂志, 2 0 1 6, 5 2(9): 11 9-1 2 0. D O I:1 0.3 9 6 9/j.issn.0529-6005.2016.09.045.
[10] 王政, 付玉林, 汪洋, 等. 多黏菌素E耐药基因mcr-1在我国养殖场的流行及其传播扩散[J]. 中国抗生素杂志, 2019, 44(2): 191-196.DOI:10.13461/j.cnki.cja.006552.
[11] 李明昊, 刘文双, 李彦, 等. 山东地区零售畜禽生肉源大肠杆菌中CTX-M型超广谱β-内酰胺酶的流行调查[J]. 中国兽医杂志, 2022,58(6): 57-61.
[12] TREIER A, STEPHAN R, STEVENS M J A. et al. High occurrence of Shiga toxin-producing Escherichia coli in raw meat-based diets for companion animals: a public health issue[J]. Microorganisms, 2021,9(8): 1556. DOI:10.3390/microorganisms9081556.
[13] WANG Min, JIANG Min, WANG Zhongxing, et al. Characterization of antimicrobial resistance in chicken-source phylogroup F Escherichia coli: similar populations and resistance spectrums between E. coli recovered from chicken colibacillosis tissues and retail raw meats in Eastern China[J]. Poultry Science, 2021, 100(9): 101370.DOI:10.1016/j.psj.2021.101370.
[14] COSSETTINI A, VIDIC J, MAIFRENI M, et al. Rapid detection of Listeria monocytogenes, Salmonella, Campylobacter spp., and Escherichia coli in food using biosensors[J]. Food Control, 2022, 137:108962. DOI:10.1016/j.foodcont.2022.108962.
[15] SRINIVASAN S Y, GAJBHIYE V, BODAS D. Development of nano-immunosensor with magnetic separation and electrical detection of Escherichia coli using antibody conjugated Fe3O4@Ppy[J].Nanotechnology, 2021, 32(8): 085603. DOI:10.1088/1361-6528/abc8b1.
[16] 农业农村部. 农业农村部关于印发《2019年动物源细菌耐药性监测计划》的通知[EB/OL]. (2019-04-20) [2022-09-19]. http://www.moa.gov.cn/nybgb/2019/201904/201906/t20190607_6316352.htm.
[17] 韩胜涛, 荣扬, 任恩恒, 等. 关于食品微生物检验内容及检测技术的思考[J]. 食品安全导刊, 2021(20): 81; 85. DOI:10.16043/j.cnki.cfs.2021.20.064.
[18] 李志芬, 王峰. 从微生物指标中看我国肉类食品安全问题及解决措施[J]. 中国微生态学杂志, 2013, 25(6): 720-722; 730. DOI:10.13381/j.cnki.cjm.2013.06.008.
[19] 吴彤. 食品质量检验存在的问题与对策[J]. 食品安全导刊, 2016(30): 45.DOI:10.16043/j.cnki.cfs.2016.30.034.
[20] UCHIDA S, UMEMURA H, NAKAYAMA T. Current status of matrixassisted laser desorption /ionization-time-of-flight mass spectrometry(MALDI-TOF MS) in clinical diagnostic microbiology[J]. Molecules,2020, 25(20): 4775. DOI:10.3390/molecules25204775.
[21] WELKER M, VAN BELKUM A, GIRARD V, et al. An update on the routine application of MALDI-TOF MS in clinical microbiology[J].Expert Review of Proteomics, 2019, 16(8): 695-710. DOI:10.1080/147 89450.2019.1645603.
[22] 丁晓妍, 崔明全, 李霆, 等. 基质辅助激光解吸电离飞行时间质谱在动物源细菌耐药性监测中的研究应用[J]. 中国兽药杂志, 2022,56(5): 20-26. DOI:10.11751/ISSN.1002-1280.2022.05.03.
[23] 汤旭, 肖迪, 张慧芳, 等. MALDI-TOF-MS鉴定布鲁氏菌方法建立和评价[J]. 中国人兽共患病学报, 2016, 32(9): 772-778. DOI:10.3969/j.issn.1002-2694.2016.09.002.
[24] 姜彦芬, 王金凤, 孙晓霞, 等. 基质辅助激光解吸电离飞行时间质谱对羊源多杀性巴氏杆菌的快速鉴定[J]. 中国兽医杂志, 2022, 58(1):43-46.
[25] 张秋艳, 唐静, 祝素珍, 等. 基质辅助激光解吸电离飞行时间质谱分析技术在微生物鉴定与分型中的应用[J]. 食品安全质量检测学报, 2021, 12(19): 7549-7555. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.19.007.
[26] DWIVEDI P, PUZON G, TAM M, et al. Metabolic profiling of Escherichia coli by ion mobility-mass spectrometry with MALDI ion source[J]. Journal of Mass Spectrometry, 2010, 45(12):1383-1393.DOI:10.1002/jms.1850.
[27] 闫雯倩, 陈企发, 夏炎. 基质辅助激光解析/电离飞行时间质谱(MALDI-TOF MS)在微生物鉴定中的应用[J]. 化学教育(中英文),2022, 43(10): 7-14. DOI:10.13884/j.1003-3807hxjy.2021040081.
[28] 李滨洲, 陈飞, 郭珍珍, 等. 基质辅助激光解吸电离飞行时间质谱技术分离鉴定生鲜猪肉中沙门氏菌/大肠杆菌类似菌[J].食品安全质量检测学报, 2018, 9(4): 717-722. DOI:10.3969/j.issn.2095-0381.2018.04.006.
[29] 吴萱, 杨璐, 刘艳超, 等. 北京市售鸡肉和猪肉中大肠杆菌污染情况及耐药特征分析[J]. 中国食品卫生杂志, 2022, 34(2): 211-216.DOI:10.13590/j.cjfh.2022.02.004.
[30] KIRK M D, PIRES S M, BLACK R E, et al. World health organization estimates of the global and regional disease burden of 22 foodborne bacterial, protozoal, and viral diseases, 2010: a data synthesis[J].PLoS Medicine, 2015, 12(12): e1001921. DOI:10.1371/journal.pmed.1001921.