N-亚硝胺是一类含有N—N=O官能团化合物的总称,广泛存在于腌制、风干、烘烤等蛋白质含量丰富的肉类加工食品中。常见的挥发性N-亚硝胺类化合物有N-二甲基亚硝胺(N-nitrosodimethylamin,NDMA)、N-二乙基亚硝胺(N-nitrosodiethylamine,NDEA)、N-亚硝基甲基乙基胺(N-nitrosomethylethylamine,N M E A ) 、 N - 亚 硝 基 乙 基 异 丙 基 胺(N-nitrosoisopropylethyl amine,EIPNA)、N-亚硝基二异丙胺(N-nitrosodiisopropylamine,NDIPA)、N-二丙基亚硝胺(N-nitrosodipropylamine,NDPA)、N-亚硝基二异丁胺(N-nitrosodiisobutylamine,NDIBA)、N-二丁胺亚硝胺(N-nitrosodibutylamine,NDBA)、N-亚硝基哌啶(N-nitrosopiperidine,NPIP)、N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)、N-亚硝基吗啉等(N-nitrosomorpholine,NMOR)等,其中NDMA和NDEA毒性最强,国际癌症研究机构将其列为2A类致癌物。许多国家均对食品中N-亚硝胺类化合物的限量作出了要求[1]:美国农业部规定腌肉制品中挥发性N-亚硝胺类化合物总量不得超过10 μg/kg,俄罗斯国家规定中要求生食品和烟熏食品中N-亚硝胺类化合物总量分别不得超过2、4 μg/kg;我国国家标准GB 2762—2017《食品安全国家标准 食品中污染物限量》[2]中规定肉类及肉制品和水产品中NDMA分别不得超过3.0、4.0 μg/kg。
目前针对N-亚硝胺类化合物的检测方法主要有热能分析仪法[3-4]、气相色谱-质谱法[5-7]、液相色谱-串联质谱法[8-11]、气相色谱-串联质谱法[12-17]等。其中热能分析仪虽然对N-亚硝胺类化合物具有较强的特异性,但因仪器价格昂贵、专属性强,普适性和推广性较差;液相色谱-串联质谱法对于非挥发性、相对分子质量较高的N-亚硝胺类化合物具有较强的分析能力;气相色谱-质谱法对NDMA易产生假阳性结果;气相色谱-串联质谱法因其灵敏度和特异性高,近几年已被广泛应用于挥发性N-亚硝胺类化合物的检测。
动物源性食品含有大量的脂肪、蛋白等杂质,基质干扰严重,常用的前处理方法主要包括水蒸气蒸馏萃取法[18]、液-液微萃取法[19]、固相萃取法(solid phase extraction,SPE)[20-23]、QuEChERS[24-28]等。水蒸气蒸馏法虽然能够去除大部分非挥发性杂质,但操作繁琐、耗时长,消耗有机溶剂多,严重影响检测效率。液-液微萃取法因其微量操作,对实验人员技术要求较高,操作不当易造成损失。传统固相萃取需要活化、淋洗、洗脱等多个步骤,QuEChERS需要提取、净化、多步转移,二者操作耗时。Prime HLB固相萃取柱是一种通过式固相萃取柱,不需要活化、清洗或洗脱步骤,样品提取液直接上柱,对蛋白、脂肪、磷脂等具有较强的吸附能力,可实现一步净化,操作较QuEChERS和传统固相萃取法更简单、高效,从而大大缩短了净化时间,对于批量检测可大幅提高前处理的总体效率。目前该方法已被广泛应用于动植物源性食品中农兽药残留的检测[29-31],但用于分析N-亚硝胺类化合物的研究鲜有报道。
本研究考察肉制品和水产品中N-亚硝胺类化合物的提取条件,研究采用Prime HLB固相萃取柱与QuEChERS 2 种净化方式的净化效果,建立以乙腈直接提取、Prime HLB固相萃取柱净化、气相色谱-串联质谱检测动物源性食品中11 种N-亚硝胺类化合物的测定方法。
1 材料与方法
1.1 材料与试剂
火腿、扒鸡、牛肉干、鱿鱼丝、烤鱼片样品均购自当地超市。
NDMA、NMEA、NDEA、EIPNA、NDIPA、NDPA、NDIBA、NDBA、NPIP、NPYR和NMOR 11 种标准品(纯度均大于95%) 北京曼哈格生物科技有限公司;甲醇、乙腈、二氯甲烷(均为色谱纯) 德国Merck公司;无水硫酸镁(分析纯) 上海阿拉丁生化科技股份有限公司;氯化钠(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
Agilent 8890-7000D气相色谱-串联质谱仪、HP-INNOWAX毛细管柱(30 m×0.25 mm,0.25 μm) 美国Agilent公司;3-18K离心机 德国Sigma公司;UMV-2涡旋混合器 山东青云实验耗材有限公司;IQ 7000 Milli-Q超纯水机 美国Millipore公司;SQP-电子天平美国塞多利斯科学仪器有限公司;Oasis Prime HLB固相萃取柱(200 mg/6 mL) 美国沃特世公司;0.22 μm有机微孔滤膜 上海安谱实验科技股份有限公司;QuEChERS净化管(150 mg N-丙基乙二胺(primary secondary amine,PSA)、1.6 g无水硫酸镁、0.4 g氯化钠) 岛津(上海)实验器材有限公司。
1.3 方法
1.3.1 标准溶液的配制
准确称取10 mg(精确至0.01 mg)各N-亚硝胺类化合物标准物质于10 mL容量瓶中,用乙腈溶解并定容至刻度,分别配制成质量浓度为1 mg/mL的标准储备液。移取各标准储备液用乙腈稀释至适当质量浓度,得到N-亚硝胺类化合物混合标准工作液。
1.3.2 样品前处理
1.3.2.1 提取
准确称取粉碎好的样品10 g(精确至0.01 g)于50 mL具塞离心管中,加入10 mL水涡旋2 min,样品分散后,加入10 mL乙腈,涡旋2 min,加入4 g无水硫酸镁和1 g氯化钠,涡旋1 min,8 000 r/min离心5 min,取上清液待净化。
1.3.2.2 净化
Prime HLB固相萃取柱净化:取待净化液2 mL于Prime HLB固相萃取柱中,收集净化滤液,经0.22 μm滤膜过滤,待进样分析。
QuEChERS 净化:将3 m L 待净化液加入到QuEChERS净化管中涡旋1 min,8 000 r/min离心5 min,上清液经0.22 μm滤膜过滤,待进样分析。
1.3.3 模拟阳性样品的制备
将用丙酮稀释的一定质量浓度的N-亚硝胺类化合物混合标准溶液加入到一定量已粉碎的火腿(水分含量67%)、牛肉干(水分含量10%)和鱿鱼丝(水分含量17%)3 种空白样品中,充分混匀,浸泡48 h,然后自然阴干48 h,使溶剂全部挥发,得到添加量约10 μg/kg的模拟阳性样品。
1.3.4 仪器条件
1.3.4.1 色谱条件
HP-INNOWAX毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:初始温度为50 ℃,保持1 min;以10 ℃/min的速率升至120 ℃,保持1 min;再以15 ℃/min的速率升至220 ℃,保持3 min;再以20 ℃/min的速率升至260 ℃,保持12 min。后运行温度270 ℃;后运行时间5 min;进样量1 μL;不分流进样;柱流量1.0 mL/min;载气为氦气;碰撞气为氮气;进样口温度250 ℃;溶剂延迟5 min。
1.3.4.2 质谱条件
离子源:电子轰击离子源;离子电压70 eV;离子源温度230 ℃;四极杆温度150 ℃;传输线温度260 ℃;采集模式为多反应监测模式。质谱参数见表1。
表1 11 种N-亚硝胺类化合物的质谱参数
Table 1 Mass spectral parameters used for analysis of eleven N-nitrosamines
?
样品中N-亚硝胺类化合物的含量按式(1)计算。
式中:X为样品中N-亚硝胺类化合物含量/(μg/kg);ρ为样品溶液中N-亚硝胺类化合物质量浓度/(ng/mL);V为样品溶液体积/mL;m为样品质量/g。
1.3.5 基质效应评价
取空白基质样品,按1.3.2节前处理步骤制备空白基质溶液,分别用空白基质溶液和定容溶剂稀释标准储备液,得到同浓度水平的标准曲线。采用基质匹配标准曲线斜率与溶剂标准曲线斜率的比值定量评价基质效应,按式(2)计算。
基质效应绝对值越大表明基质效应越强,若基质效应>0,表明基质增强效应,若基质效应<0,表明基质抑制效应,-20%~20%表示基质效应影响不明显。
1.4 数据处理
通过与仪器配套的MassHunter色谱数据处理系统完成数据采集与处理,Origin 8.0软件进行绘图。
2 结果与分析
2.1 提取方式的优化
2.1.1 提取方式的选择
肉制品、水产品中的水分含量差异较大,有的样品水分含量较低,若直接用有机溶剂进行提取,不利于目标物的游离。本研究采用Prime HLB固相萃取柱净化方式,对自制的阳性样品进行加水体积(0、5、10、20 mL)和浸泡时间(0、10、20、30、60 min)的参数考察,其他提取条件按照1.3.2.1节所述进行。
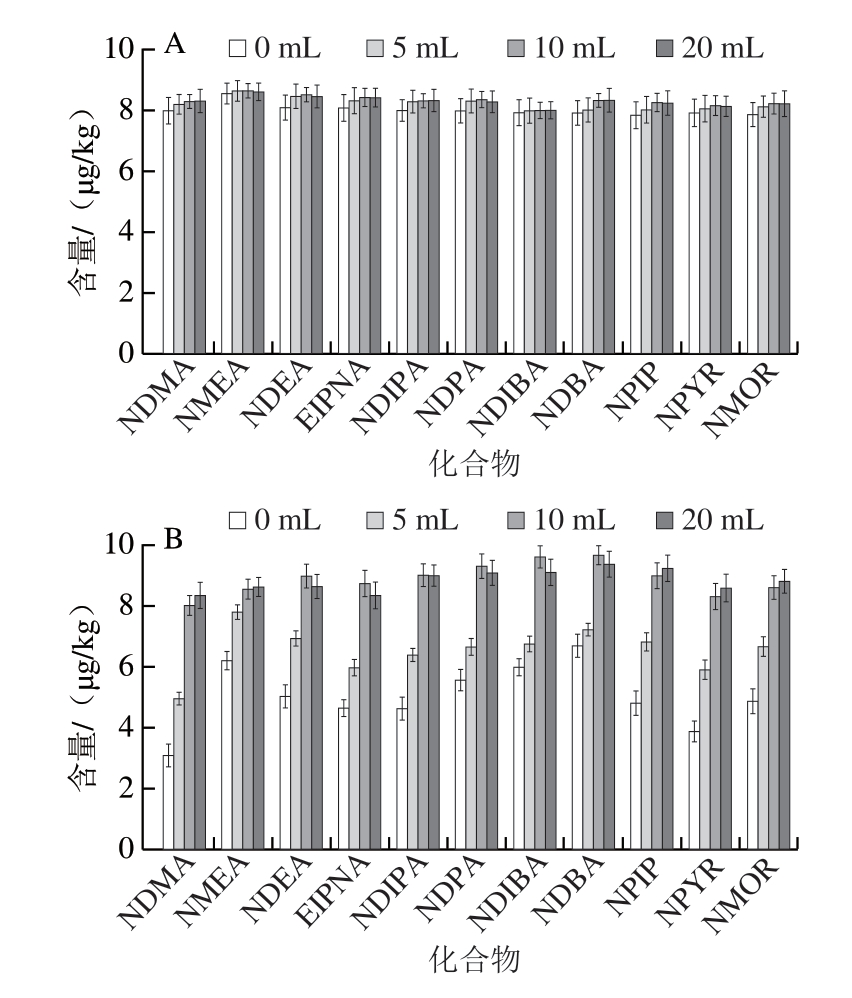
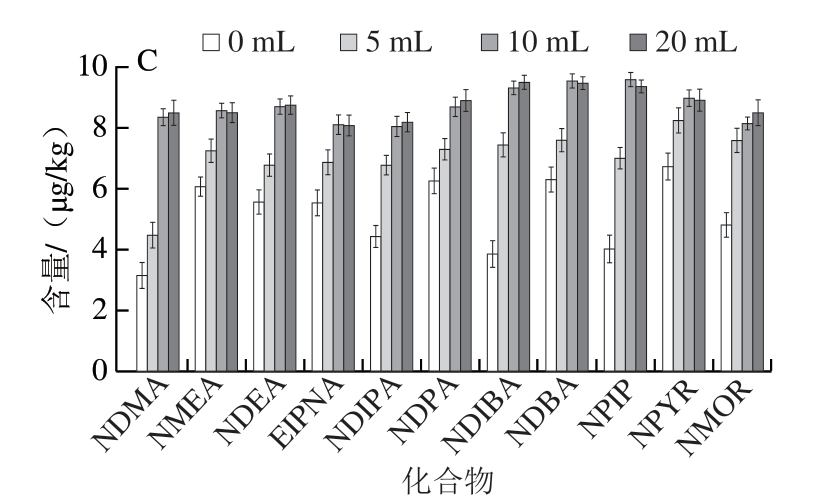
图1 加水体积对阳性样品中N-亚硝胺类化合物提取效果的影响
Fig. 1 Effect of amount of added water on N-nitrosamine contents in positive samples
A. 火腿;B. 牛肉干;C. 鱿鱼丝。
由图1可知:对于水分含量较高的火腿样品,加水体积对样品的提取效率影响较小;而对于水分含量较低的牛肉干、鱿鱼丝样品,加水后提取效率得到明显提高,当加水量为5 mL时,样品不能完全浸润,而随着加水量的进一步增加,检测结果变化很小,因此选择最终加水量为10 mL。加水浸泡时间对阳性样品的提取率和阴性样品加标回收率的影响差异很小,因此选择不浸泡。
2.1.2 提取溶剂的选择
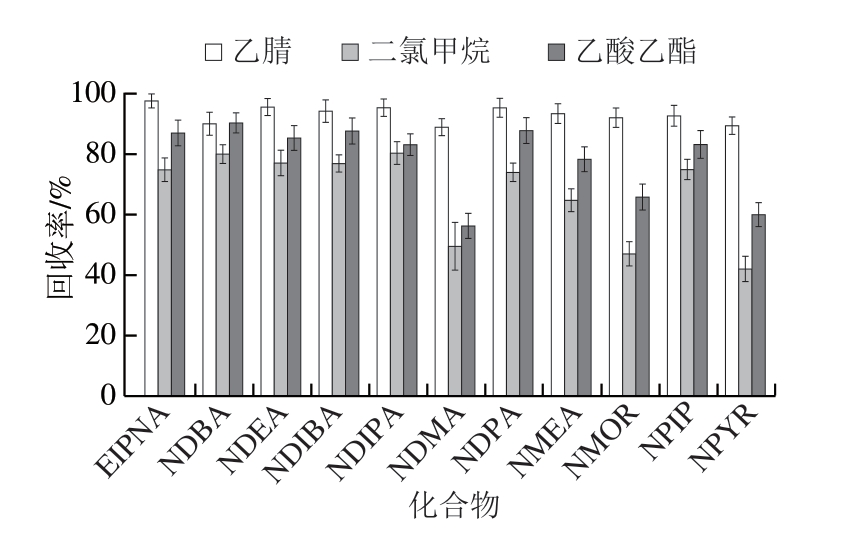
图2 不同提取溶剂对11 种N-亚硝胺类化合物回收率的影响
Fig. 2 Effect of different extraction solvents on the recoveries of 11 N-nitrosamines
11 种N-亚硝胺类化合物的极性较强,多易溶于水、醇、醚等试剂,本研究比较二氯甲烷、乙腈、乙酸乙酯、甲醇4 种提取溶剂的提取效率。实验发现,甲醇作为提取溶剂时,盐析后甲醇与水无法分层;由图2可知:二氯甲烷、乙酸乙酯为提取溶剂时,由于二者的极性较弱,容易提取出更多的油脂,尤其对于油脂含量高的样品,提取过程中易出现严重的乳化现象,对后续净化带来难度;乙腈作为提取溶剂时,11 种N-亚硝胺类化合物的回收率较好,且乙腈同时具有沉淀蛋白的作用,这与戴裕杰等[24]研究结果一致。因此,选择乙腈作为提取溶剂。
2.2 净化方式的优化
2.2.1 净化方式的选择
肉制品、水产品等食品中含有大量的油脂、蛋白质、磷脂、色素等复杂基质,经乙腈提取后直接上机,不仅污染仪器,且呈现较强的基质效应。QuEChERS方法中的PSA和C18可吸附有机酸、脂类和糖类等干扰物,目前已被众多学者应用到N-亚硝胺类化合物的检测中。Prime HLB柱为通过式固相萃取柱,能有效吸附动物源性食品基质中的磷脂、脂肪和蛋白质等干扰物,且无需活化、淋洗、洗脱等步骤,操作更快捷方便。
本研究选取油脂含量不同的空白火腿、扒鸡、鱿鱼丝3 种代表性样品,加入一定质量浓度的N-亚硝胺类化合物标准溶液,比较Prime HLB柱与QuEChERS 2 种净化方式的净化效果,结果显示,QuEChERS净化的回收率为78.7%~98.3%,Prime HLB柱净化的回收率为80.1%~97.4%,均满足要求,但Prime HLB柱的净化操作更简便快速,且基质效应明显低于QuEChERS净化方式(图3),因此在后续实验中选择Prime HLB柱净化。
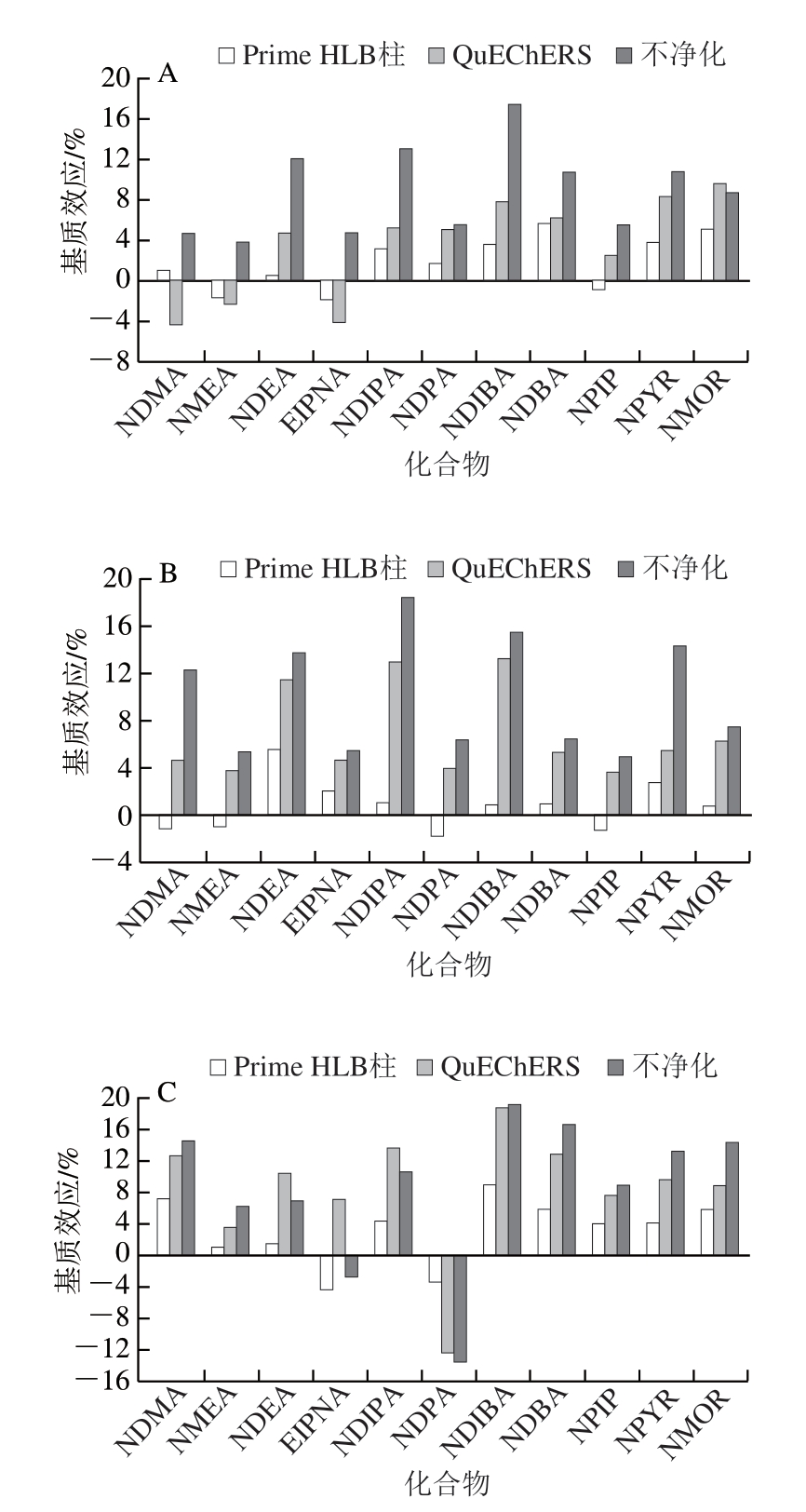
图3 11 种N-亚硝胺类化合物基质效应评价
Fig. 3 Matrix effects in GC-MS/MS analysis of 11 N-nitrosamines
A. 火腿;B. 扒鸡;C. 鱿鱼丝。
2.2.2 SPE上样溶液体积的选择
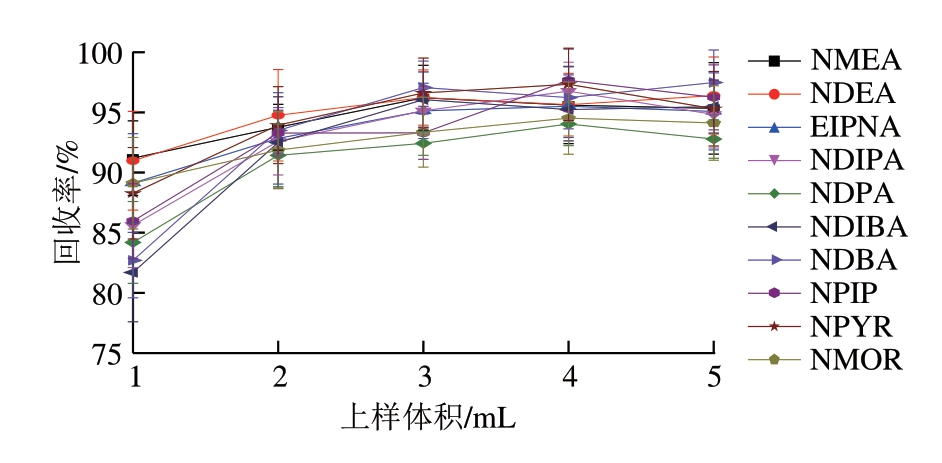
图4 不同上样体积对11 种N-亚硝胺类化合物回收率的影响
Fig. 4 Effect of sample loading volume on the recoveries of 11 N-nitrosamines
比较吸取不同体积(1、2、3、4、5 mL)上清液通过Prime HLB柱的净化效果。由图4可知:上样1 mL时,收集到的流出液中除NDMA、NMEA、NDEA外,其他目标物回收率均低于90%,可能由于小柱对目标物的吸附未达到饱和,造成回收率偏低;上样2、3、4、5 mL时,目标物回收率相差不大。考虑到随着上样体积的增加,对于油脂含量高的样品净化效果可能变差,故最终上样体积选择2 mL。
2.3 色谱、质谱条件的优化
参考朱萌萌等[1 2]的研究结果,本研究选用强极性的聚乙二醇石英毛细管柱H P-I N N O WA X(30 m×0.25 mm,0.25 μm)对肉制品中11 种N-亚硝胺进行分离与分析。通过对升温速率、前级离子、碎片离子的优化,所有分析物获得了良好的分离效果和较高的灵敏度。11 种N-亚硝胺的总离子流色谱图如图5所示。
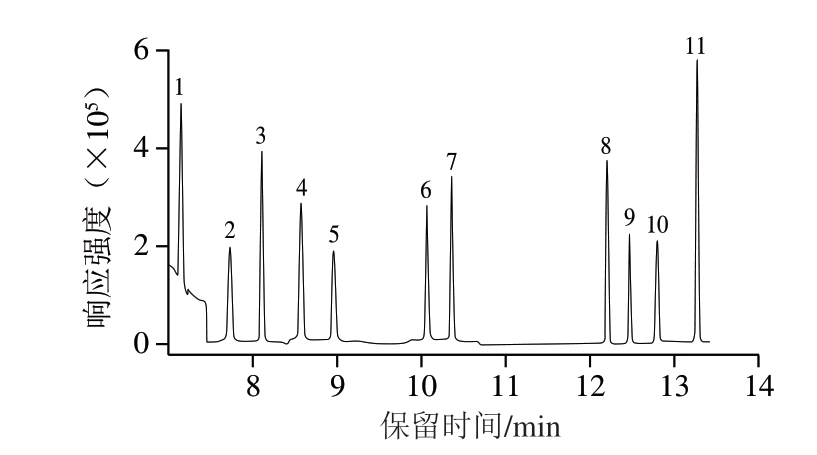
图5 11 种N-亚硝胺标准品(50 ng/mL)色谱图
Fig. 5 Chromatograms of a mixture of 11 N-nitrosamine standards (50 ng/mL)
1. NDMA;2. NMEA;3. NDEA;4. EIPNA;5. NDIPA;6. NDPA;7. NDIBA;8. NDBA;9. NPIP;10. NPYR;11. NMOR。
2.4 基质效应考察
由图3可知:采用Prime HLB柱净化后,不同的N-亚硝胺类化合物在不同动物源性食品中基质效应均小于20%,为-4.4%~8.9%;但不同样品中基质效应仍存在一定的差异。因此本方法采用空白基质匹配校正曲线进行定量,以减少基质干扰对结果的影响。
2.5 方法学评价
2.5.1 线性范围与灵敏度
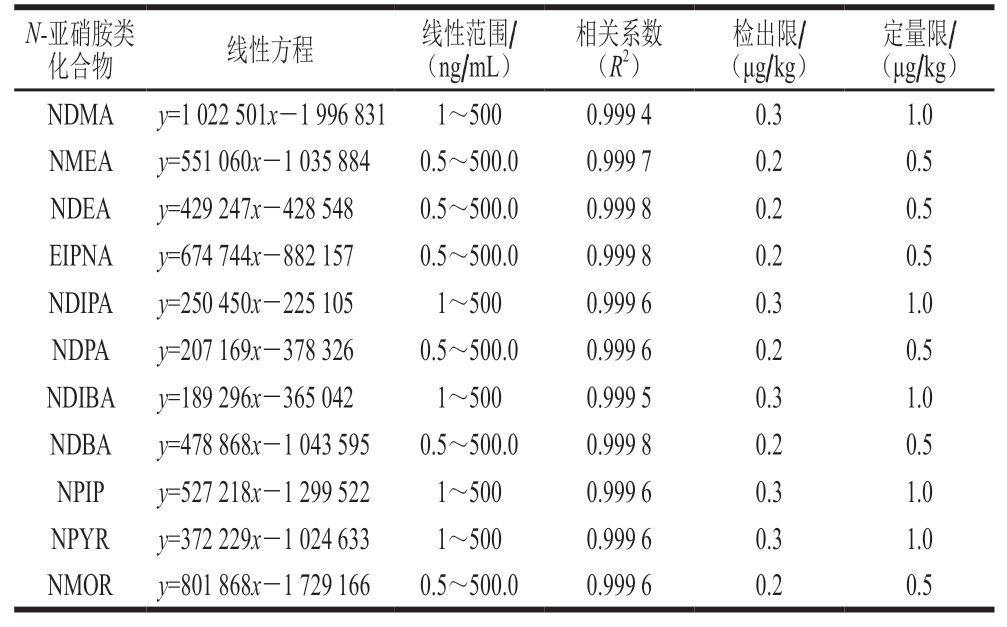
表2 11 种N-亚硝胺类化合物的回归方程、线性范围、相关系数、方法检出限及定量限
Table 2 Calibration equations, linear ranges, correlation coefficients (R2),limits of detection (LOD) and quantitation (LOQ) of 11 N-nitrosamines
?
用空白样品溶液配制质量浓度分别为0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0、200.0、500.0 ng/mL的系列标准工作溶液,以各物质定量离子对的峰面积(y)对其质量浓度(x)作标准曲线,由表2可知,标准曲线线性相关系数(R2)均大于0.999。采用空白基质加标的方法确定方法的检出限和定量限,分别以3 倍信噪比和10 倍信噪比对应的质量浓度作为检出限和定量限,11 种N-亚硝胺类化合物的检出限为0.2~0.3 μg/kg,定量限为0.5~1.0 μg/kg。
2.5.2 方法回收率和精密度
采用基质匹配标准溶液-外标法定量,在火腿、扒鸡、鱿鱼丝基质中添加11 种N-亚硝胺类化合物的标准溶液进行加标回收率实验,加标水平分别为1、4、10 μg/kg,每个水平重复测定6 次,按优化的方法测定11 种N-亚硝胺类化合物的含量。
表3 不同肉制品中11 种N-亚硝胺类化合物加标回收率及RSD(n =6)
Table 3 Recoveries and RSD of 11 N-Nitrosamines in different spiked meat products (n = 6)
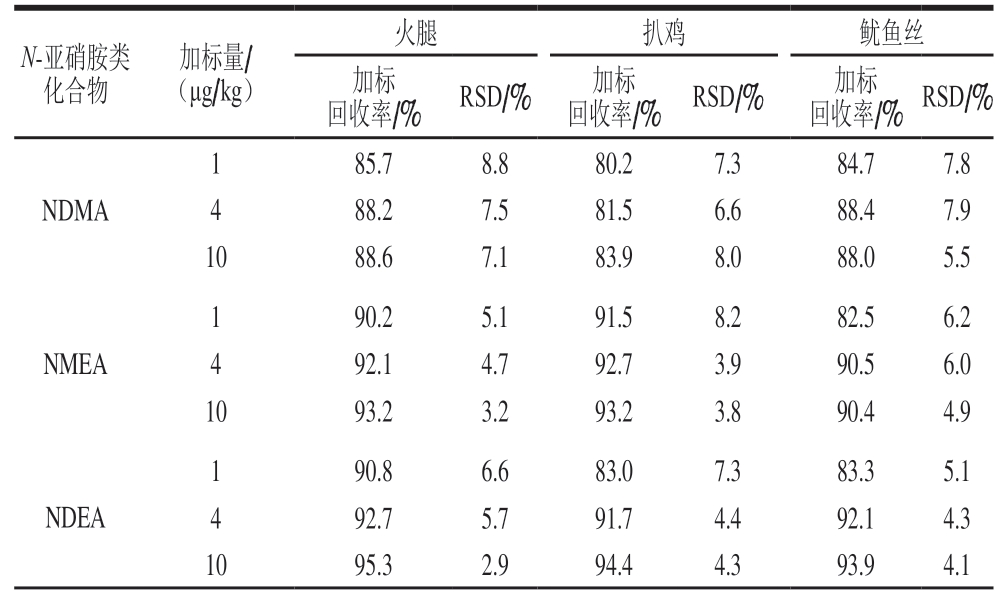
?
续表3
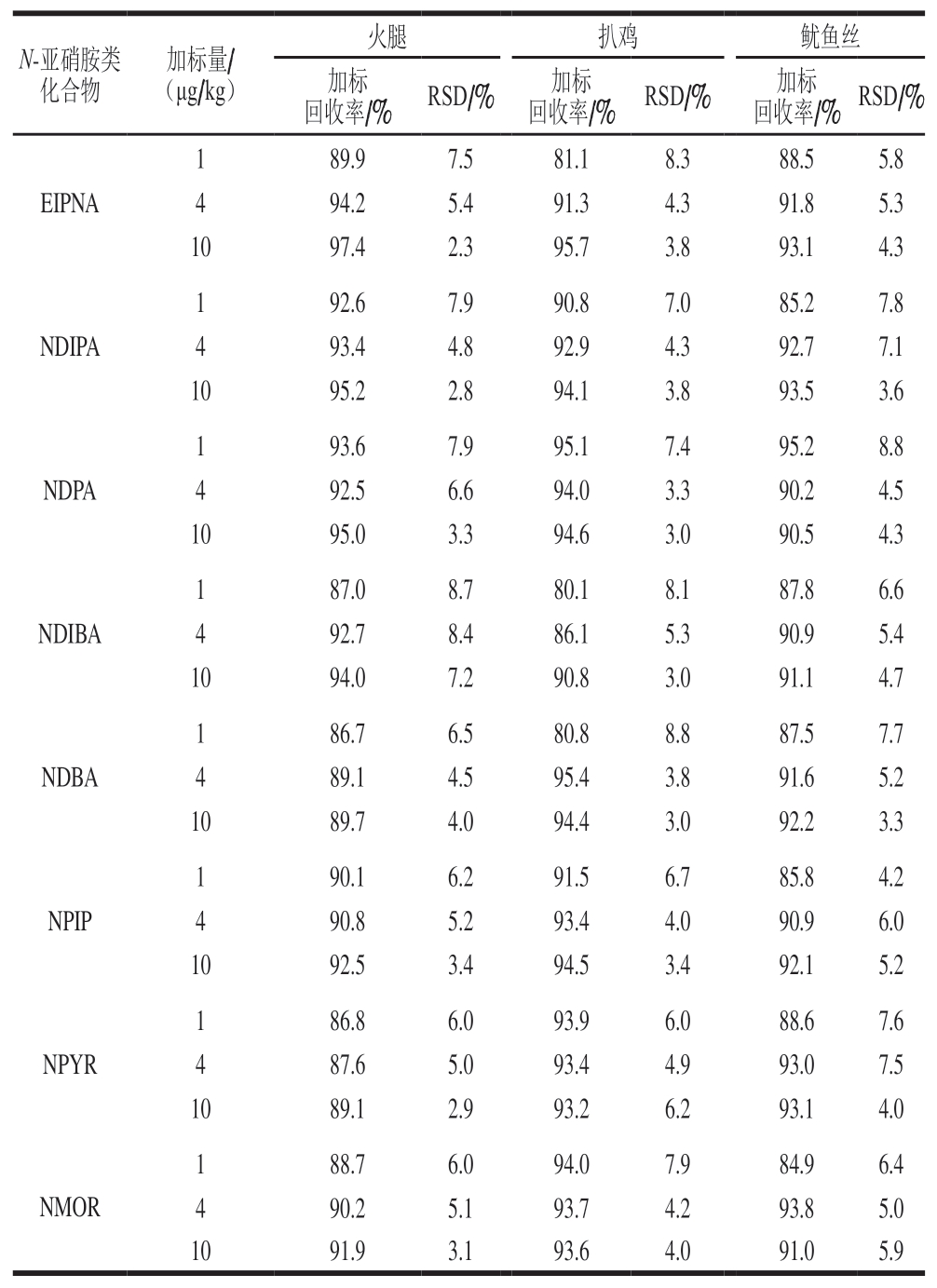
?
由表3可知,所有目标物的加标回收率为80.1%~97.4%,相对标准偏差(relative standard deviation,RSD)为2.3%~8.8%。
2.6 实际样品测定
表4 Prime HLB法与国标法检测结果对比
Table 4 Comparison of results of Prime HLB method with those of national food safety standard method
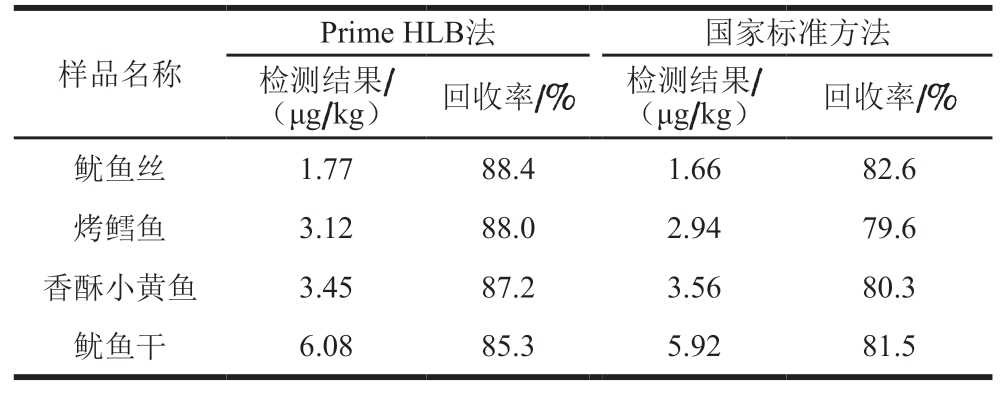
?
采用本研究建立的分析方法对市场上购买的酱卤肉制品、熏煮香肠制品、水产干制品等40 批次样品进行分析,有4 批次水产干制品检出NDMA。取阳性样品,分别采用本方法与GB 5009.26—2016《食品安全国家标准食品中N-亚硝胺类化合物的测定》[32]法进行比对分析,由表4可知,2 种方法检测结果相差不大,但Prime HLB法回收率高于国家标准方法。
3 结 论
本研究应用通过式固相萃取净化技术,建立了气相色谱-串联质谱法测定动物源性食品中11 种N-亚硝胺类化合物的分析方法。Prime HLB柱的提取效率和净化效果均良好,较QuEChERS方法操作更加简单、省时省力,平均提取及净化时间为15 min/样品,较国家标准方法的提取及净化时间缩短90%。该方法大大提升了检测效率,为更快速、准确地检测大批量动物源性食品中N-亚硝胺类化合物的残留测定提供了新的技术手段。
[1] 梁秀清, 杨颖, 张红霞, 等. 肉制品中挥发性N-亚硝胺化合物检测技术研究进展[J]. 肉类研究, 2021, 35(1): 98-104. DOI:10.7506/rlyj1001-8123-20201123-2.
[2] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中污染物限量: GB 2762—2017[S]. 北京:中国标准出版社, 2017: 10-11.
[3] 马兴, 肖亚兵, 陈颖, 等. 快速水蒸气蒸馏-气相色谱热能分析仪法测定肉制品和水产制品中13 种N-亚硝胺[J]. 食品研究与开发, 2020,41(20): 198-203. DOI:10.12161/j.issn.1005-6521.2020.20.033.
[4] DRABIK-MARKIEWICZ G, DEJAEGHER B, MEY D E, et al.Influence of putrescine, cadaverine, spermidine or spermine on the formation of N-nitrosamine in heated cured pork meat[J].Food Chemistry, 2011, 126(4): 1539-1545. DOI:10.1016/j.foodchem.2010.11.149.
[5] 赵华, 王秀元, 王萍亚, 等. 气相色谱-质谱联用法测定腌制水产品中的挥发性N-亚硝胺类化合物[J]. 色谱, 2013, 31(3): 223-227.DOI:10.3724/SP.J.1123.2012.10020.
[6] 何淑娟, 赵丽敏, 李强, 等. 气相色谱-质谱法测定肉制品中的9 种挥发性N-亚硝胺类物质[J]. 肉类研究, 2015, 29(1): 27-30.DOI:10.7506/rlyj1001-8123-2015010.
[7] CAMPILLO N, VIÑAS P, MARTÍNEZ-CASTILLO N, et al.Determination of volatile nitrosamines in meat products by microwaveassisted extraction and dispersive liquid-liquid microextraction coupled to gas chromatography-mass spectrometry[J]. Journal of Chromatography A,2011, 1218(14): 1815-1821. DOI:10.1016/j.chroma.2011.02.010.
[8] 张伟伟, 赵春华, 付萌, 等. 水蒸气蒸馏分离-高效液相色谱-串联质谱法测定食品中N-二甲基亚硝胺的含量[J]. 理化检验(化学分册),2019(9): 1028-1031. DOI:10.11973/lhjy-hx201909008.
[9] 张力群, 刘少颖, 任韧, 等. 超高效液相色谱-串联质谱法检测生活饮用水8 种N-亚硝胺类化合物[J]. 预防医学, 2021, 33(8): 855-858.DOI:10.19485/j.cnki.issn2096-5087.2021.08.02
[10] 简龙海, 韩晶, 郑荣, 等. LC-APCI-MS/MS法检测食品中N-二甲基亚硝胺的方法[J]. 上海预防医学, 2019, 31(6): 427-431. DOI:10.19428/j.cnki.sjpm.2019.19475.
[11] HERRMANN S S, DUEDAHL-OLESEN L, GRANBY K. Occurrence of volatile and non-volatile N-nitrosamines in processed meat products and the role of heat treatment[J]. Food Control, 2015, 48: 163-169.DOI:10.1016/j.foodcont.2014.05.030.
[12] 朱萌萌, 叶群, 周婷婷, 等. 气相色谱-串联质谱法测定肉制品中10 种挥发性N-亚硝胺类化合物[J]. 色谱, 2019, 37(2): 207-215.DOI:10.3724/SP.J.1123.2018.09037.
[13] 赵庄, 许杨彪, 刘向红, 等. 改进的QuEChERS结合气相色谱-三重四极杆质谱法快速测定酸肉中10 种挥发性N-亚硝胺类化合物[J]. 色谱, 2017, 35(10): 1086-1093. DOI:10.3724/SP.J.1123.2017.06006.
[14] 赵博, 邓美林, 杨小珊, 等. 分散固相萃取-气相色谱-串联质谱法测定动物源性食品中9 种N-亚硝胺类化合物[J]. 色谱, 2016, 34(10):998-1004. DOI:10.3724/SP.J.1123.2016.07012.
[15] 高蕙文, 陆丽莎, 袁荷芳. 气相色谱-串联质谱法测定动物性食品中的9 种N-亚硝胺类化合物[J]. 理化检验(化学分册), 2019, 55(6): 655-660. DOI:10.11973/lhjy-hx201906007.
[16] 翟孟婷, 王宗义, 郑宇, 等. 氢氧化钡处理-二氯甲烷萃取/GC-MS/MS检测几种水产品和加工肉制品中的7 种N-亚硝胺[J]. 食品工业科技, 2019, 40(15): 215-219. DOI:10.13386/j.issn1002-0306.2019.15.035.
[17] LEHOTAY S J, SAPOZHNIKOVA Y, HAN L. Analysis of nitrosamines in cooked bacon by QuEChERS sample preparation and gas chromatography-tandem mass spectrometry with backflushing[J].Journal of Agricultural and Food Chemistry, 2015, 63(47): 10341-10351. DOI:10.1021/acsjafc5b04527.
[18] LI Ling, WANG Peng, XU Xinglian, et al. Influence of various cooking methods on the concentrations of volatile N-nitrosamines and biogenic amines in dry-cured sausages[J]. Journal of Food Science,2012, 77(5): 560-565. DOI:10.1111/j.1750-3841.2012.02667.x.
[19] 刘珊, 吴天俣, 侯彤瑶, 等. 盐辅助分散液-液微萃取结合气相色谱-串联质谱法快速检测啤酒中N-二甲基亚硝胺[J]. 食品安全质量检测学报, 2020, 11(16): 5713-5718. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.16.
[20] 李登昆, 张云, 赵士权, 等. 固相萃取-气相色谱-串联质谱法测定牛奶中9 种N-亚硝胺的含量[J]. 理化检验(化学分册), 2021, 57(6):487-492. DOI:10.11973/lhjy-hx202106002.
[21] RAOUL S, GREMAUD E, BIAUDET H, et al. Rapid solid-phase extraction method for the detection of volatile nitrosamines in food[J].Journal of Agricultural and Food Chemistry, 1997, 45(12): 4706-4713.DOI:10.1021/jf970232q.
[22] SANNINO A, BOLZONI L. GC/CI-MS/MS method for the identification and quantification of volatile N-nitrosamines in meat products[J]. Food Chemistry, 2013, 141(4): 3925-3930. DOI:10.1016/j.foodchem.2013.06.070.
[23] 张建斌, 马俪珍, 张甜, 等. 肉制品中9 种N-亚硝胺测定方法的建立[J]. 中国食品学报, 2020, 20(5): 276-282. DOI:10.16429/j.1009-7848.2020.05.03.
[24] 戴裕杰, 关荣发, 黄海智, 等. 改进的QuEChERS-气相色谱-质谱法测定中式腊肉中8 种挥发性N-亚硝胺[J]. 食品科学, 2021, 42(20):266-273. DOI:10.7506/spkx1002-6630-20200930-37.
[25] QIU Yuesheng, CHEN Jiehua, YU Weijun, et al. Contamination of Chinese salted fish with volatile N-nitrosamines as determined by QuEChERS and gas chromatography-tandem mass spectrometry[J]. Food Chemistry, 2017, 232: 763-769. DOI:10.1016/j.foodchem.2017.04.055.
[26] 余卫军, 邱月升, 王佩, 等. 气相色谱-三重四极杆质谱测定广东地区市售腊肠中9 种挥发性亚硝胺[J]. 肉类研究, 2016, 30(6): 29-34.DOI:10.15922/j.cnki.rlyj.2016.06.007.
[27] 陈丽香, 陈嘉敏, 陈燕敏, 等. QuEChERS-气相色谱-三重四极杆串联质谱法测定水产干制品中9 种N-亚硝胺类化合物[J]. 现代食品科技,2021, 37(8): 295-301; 257. DOI:10.1111/j.1750.3841.2012.02667.x.
[28] 孔祥一, 庄丽丽, 方恩华, 等. QuEChERS-同位素稀释-气相色谱-串联质谱法测定动物源性食品中9 种N-亚硝胺类化合物[J]. 色谱,2021, 39(1): 96-103. DOI:10.3724/SP.J.1123.2020.06010.
[29] 宿书芳, 孙立臻, 薛霞, 等. 通过式固相萃取-超高效液相色谱-串联质谱法测定水产品中地西泮[J]. 色谱, 2020, 38(7): 791-797.DOI:10.3724/SP.J.1123.2019.11028.
[30] 张再永, 马俊美, 李强, 等. 通过式固相萃取-超高效液相色谱-串联质谱法测定猪肉和牛肉中9 种类固醇激素[J]. 肉类研究, 2020,34(7): 58-63. DOI:10.7506/rlyj1001-8123-20200429-109.
[31] ZHANG Y X, XUE X, SU S F, et al. A multi-class, multi-residue method for detection of veterinary drugs in multiple meat using a passthrough cleanup SPE technique and UPLC-MS/MS analysis[J]. Food Analytical Methods, 2018, 11: 2865-2884. DOI:10.1007/s12161-018-1244-8.
[32] 国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中N-亚硝胺类化合物的测定: GB 5009.26—2016[S].北京: 中国标准出版社, 2016: 1-9.