随着生活水平的不断提高,人们对肉类的需求逐渐变高,部分商家为了较高的商业利润,使用廉价的猪肉来代替昂贵的牛羊肉[1]。这种以次充好、以假乱真的现象损害了消费者的合法权益,扰乱了市场秩序[2]。尽管许多国家建立了肉制品的相关食品安全标准,要求肉制品标签需标注物种信息类别和含量[3],但是消费者从外观上还是很难分辨出掺假肉。因此,为了确保市场秩序的稳定和食品安全,需要一种简单实用、成本低廉的快速检测方法对肉及肉制品掺假进行检测。
目前肉类掺假检测方法主要分为基于蛋白质分子和基于DNA分子的检测技术[4]。其中基于蛋白质的检测技术有电泳法[5-6]、质谱技术[7-8]、酶联免疫吸附法[9-10]和蛋白质组学[11]等。但蛋白质在加工过程中易发生变性,在对热加工处理的食品进行检测时有很大的局限性[12]。而基于D NA 分子的实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)[13-14]、数字PCR[15-16]、环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术[17-18]、滚环扩增技术[19-20]及重组酶聚合酶扩增技术[21-22]等检测方法凭借特异性强、灵敏度高等优点已成为目前肉类掺假的主要检测方法[23]。但这些技术存在引物设计困难、易产生假阳性、扩增时间长、对靶序列长度要求高等缺点,导致这些方法不能够得到更广泛的应用。因此,亟需建立一种快速、高效、操作简单、成本较低的检测新技术,以满足市场的需求。
Wang Deguo等[24]在解决LAMP技术中的假阳性问题并阐明了单链模板的产生机理后,开发了一种新型核酸等温扩增技术——梯型熔解温度等温扩增(ladder-shape melting temperature isothermal amplification,LMTIA)技术。该技术引物设计简单、反应时间迅速、灵敏度高、所需靶序列短等[25],已应用于食品掺假检测[26-27]和病毒检测[28]中。本研究以猪细胞核中的催乳素受体(prolactin receptor,PRLR)[29]基因为靶标,将一种新型荧光杂交探针,即Proofman探针(proofreading enzyme-mediated probe cleavage)[30]与LMTIA技术相结合,其检测原理如图1所示。Proofman探针是根据LMTIA的环引物所设计,在Proofman探针的3'端设计1 个错配碱基,将荧光基团标记在该错配碱基上,猝灭基团标记在探针的5'端。反应开始时,在引物F和B的作用下,形成茎环结构DNA;Proofman探针与茎环结构进行互补配对,3'端发生碱基错配,在超保真DNA聚合酶的作用下切除错配碱基,释放荧光基团,通过收集荧光信号即可对目标物质进行检测。旨在建立一种简单、快速的Proofman-LMTIA方法检测肉制品中的猪肉源基因,以期为市场上肉制品掺假提供一种快速、简便的检测方法。
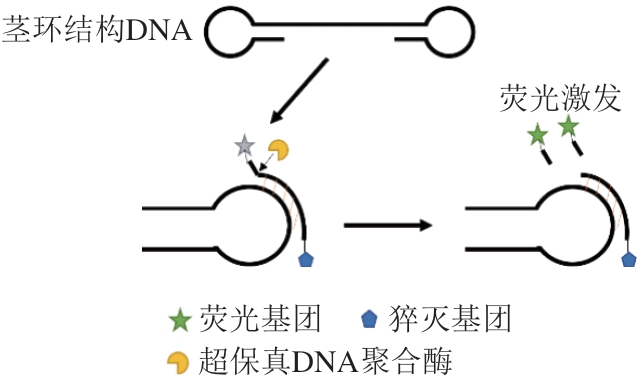
图1 Proofman探针原理
Fig. 1 Principle of Proofman probe
1 材料与方法
1.1 材料与试剂
鲜肉(鸡肉、鸭肉、猪肉、羊肉、牛肉)、淀粉制品(玉米淀粉、红薯淀粉、木薯淀粉、绿豆淀粉、小麦粉)及加工肉制品(熟牛肉、熟羊肉、牛肉卷、羊肉卷)购于许昌各大超市;猫肉、狗肉购于淘宝网。
血液/细胞/组织基因组DNA提取试剂盒 天根生化科技(北京)有限公司;Nucleo Spin®Food试剂盒德国Macherey-Nagel公司;通用型LMTIA反应预混液德歌生物技术有限公司;GPV8超保真DNA聚合酶(2 U/µL) 通用生物系统有限公司。
1.2 仪器与设备
Gentier 96E全自动医用PCR分析系统 西安天隆科技有限公司;Nano Drop One超微量核酸蛋白测定仪、SCI-VS可调式混匀仪 美国Thermo公司;1-15K高速冷冻离心机 德国Sigma公司;F6/10匀浆机 上海净信科技有限公司;Archimed时间分辨荧光定量PCR系统鲲鹏基因(北京)科技有限责任公司。
1.3 方法
1.3.1 模拟样品的制备
将所购鸡肉、鸭肉、猪肉、羊肉、牛肉、猫肉、狗肉等肉类去除表皮、脂肪和骨头后使用匀浆机打成肉糜,于-20 ℃保存。
以牛羊肉为基质,向其中加入质量分数分别为0%、0.1%、1.0%、5.0%、10.0%、20.0%、100.0%的猪肉。参考Chen Xiaoyu等[31]的方法进行模拟样品的制备:以牛肉为例,使用高速匀浆机将肉糜状的牛肉(80 g)与猪肉(20 g)间歇性混合5 min,得到猪肉质量分数为20.0%的样品(编号为A1);将50 g牛肉糜与50 g A1间歇性混合5 min,得到猪肉质量分数为10.0%的样品(编号为A2);将50 g牛肉糜与50 g A2间歇性混合5 min,得到猪肉质量分数为5.0%的样品(编号为A3);用上述方法依次制备质量分数为1.0%(A4)、0.1%(A5)的混合肉样。再以同样的方法制备以羊肉为基质的猪肉混合肉样。其中在进行肉糜混合时加入了不影响反应的有色染料,混合至颜色均匀,每组实验设置5 个平行。所有样品保存于-20 ℃备用。
1.3.2 DNA提取
称取100 mg各样品的肉糜及1.3.1节所制备的模拟肉样,使用血液/细胞/组织基因组DNA提取试剂盒提取肉样DNA。称取玉米淀粉、红薯淀粉、木薯淀粉、绿豆淀粉等样品各200 mg,使用Nucleo Spin®Food试剂盒提取各植物淀粉DNA。提取完成后使用超微量核酸蛋白测定仪测定DNA的浓度和纯度,A260 nm/A280 nm为1.6~2.0可用于LMTIA。所提取的DNA均于-20 ℃保存。
1.3.3 LMTIA引物和Proofman探针设计
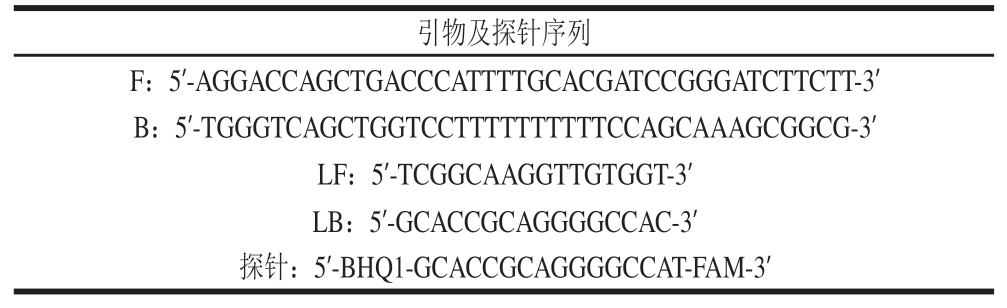
根据GenBank数据库中公布的猪源基因,本研究选取猪细胞核中的高度保守序列PRLR(GenBank ID:DQ453511.1)为靶标,将该段序列使用Oligo 7软件进行分析,选取具有梯型熔解温度的片段,再使用Primer 3 Plus在线软件(http://www.primer3plus.com)进行LMTIA引物设计。根据环引物来设计Proofman探针,荧光基团标记在3'端错配的碱基上,猝灭基团标记在5'端碱基末端。用于LMTIA的引物序列和Proofman探针序列见表1。引物及探针均由通用生物系统(安徽)有限公司合成。
表1 引物及探针序列
Table 1 Sequences of LMTIA primers and Proofman probe
?
1.3.4 反应温度优化
使用10 µL的反应体系进行LMTIA反应温度的优化,反应体系为:1.3 μmol/L引物F、B,0.6 μmol/L引物LF、0.3 μmol/L引物LB和探针、1×通用型LMTIA反应预混液1 μL(20 mmol/L Tris-HCl(pH 8.8)、10 mmol/L KCl、10 mmol/L (NH4)2SO4、6 mmol/L MgSO4、0.1% TritonTM X-100)、0.32 U/μL Bst DNA聚合酶和2 μL提取的猪肉基因组DNA。反应温度设置为57、58、59、60 ℃,反应条件为90 s采集一次荧光信号,共40 个循环。
1.3.5 灵敏度测定
将提取的猪肉基因组DNA梯度稀释至10、1 ng/μL和100、10、1 pg/μL,测定所建立的Proofman-LMTIA检测方法的灵敏度。由于样品新鲜度、人为因素和DNA降解等原因都有可能造成检测结果不一致,故每次实验进行5 次重复,以保证检测结果的准确性。
1.3.6 特异性分析
以H2O为阴性对照,猪肉基因组DNA为阳性对照,向优化好的LMTIA反应体系中加入从鸡肉、鸭肉、牛肉、羊肉、猫肉、狗肉、玉米淀粉、红薯淀粉、木薯淀粉、绿豆淀粉、小麦粉中提取的基因组DNA,观察扩增结果。
1.3.7 猪肉样品检测限测定
将所提取的猪肉质量分数分别为0%、0.1%、1.0%、5.0%、10.0%、20.0%、100.0%的混合肉样DNA分别加入到优化的Proofman-LMTIA反应体系中,每组实验重复2 次,观察扩增结果。
1.3.8 实际样品猪肉源成分检测
利用本研究建立的Proofman-LMTIA检测方法与实时荧光定量PCR检测方法(猪肉源实时荧光定量PCR检测试剂盒)对市售牛羊肉及其制品进行猪肉源成分检测,对检测结果进行分析比较。
1.4 数据处理
使用Gentier 96E全自动医用PCR分析系统(V1)对检测结果进行分析,获取扩增曲线图,再使用Excel、PowerPoint软件对结果和扩增图进行分析处理。
2 结果与分析
2.1 反应温度优化结果
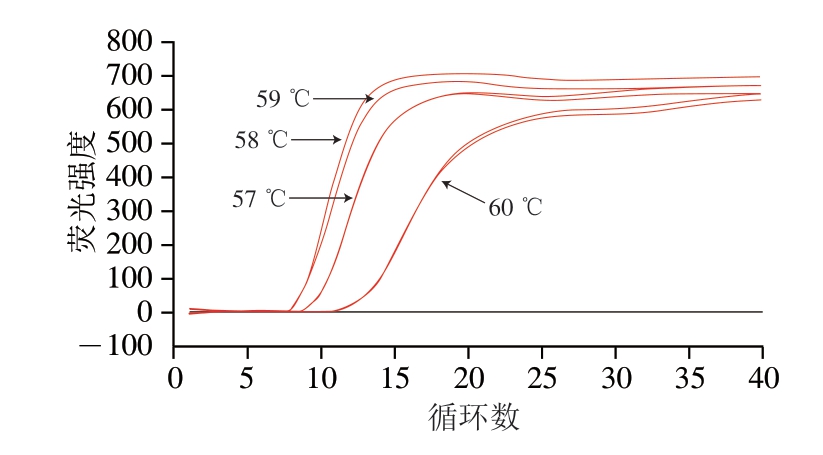
图2 Proofman-LMTIA反应温度优化结果
Fig. 2 Optimization of Proofman-LMTIA reaction temperature
由图2可知,反应温度对扩增效率的影响较大,在58 ℃和59 ℃时阴性对照不扩增,阳性对照扩增效率最好,结合后续特异性和灵敏度实验选择58 ℃作为Proofman-LMTIA反应体系的最适温度。
2.2 灵敏度测定结果
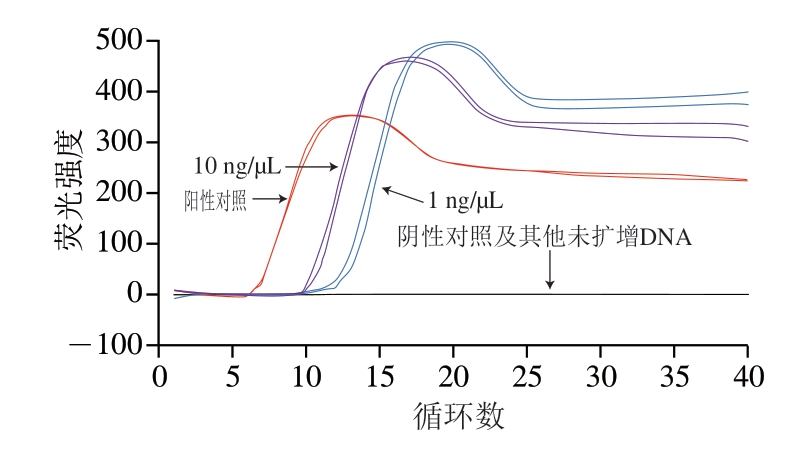
图3 Proofman-LMTIA灵敏度测定结果Fig. 3 Sensitivity of Proofman-LMTIA assay
使用优化好的反应体系和最适温度对梯度稀释至10、1 ng/μL和100、10、1 pg/μL的猪肉基因组DNA进行测定。由图3可知,10 ng/μL和1 ng/μL的DNA发生扩增,而100、10、1 pg/μL和阴性对照均未出现扩增。因此,该方法对猪基因组DNA的检测灵敏度为1 ng/μL。
2.3 特异性分析结果
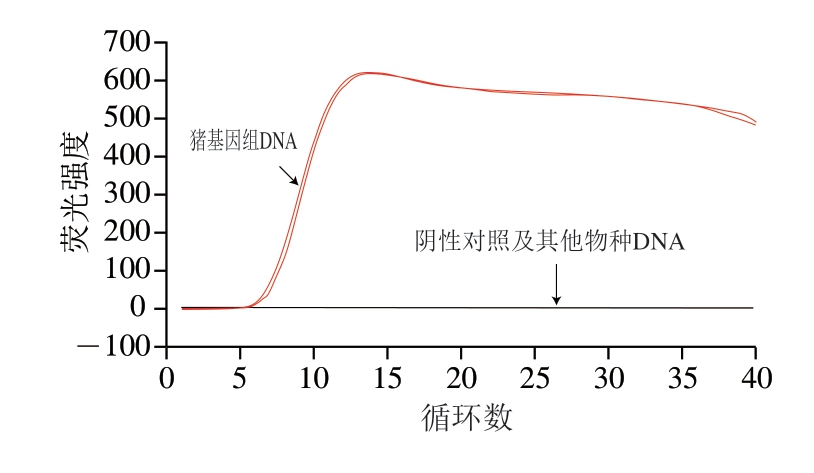
图4 Proofman-LMTIA特异性测定结果
Fig. 4 Specificity of the Proofman-LMTIA assay
由图4可知,只有猪DNA发生扩增,其余DNA及阴性对照均未扩增。说明该引物特异性较强,能够区分猪DNA和其他物种DNA,能够进行肉制品中猪源基因的检测。
2.4 猪肉样品检测限测定结果
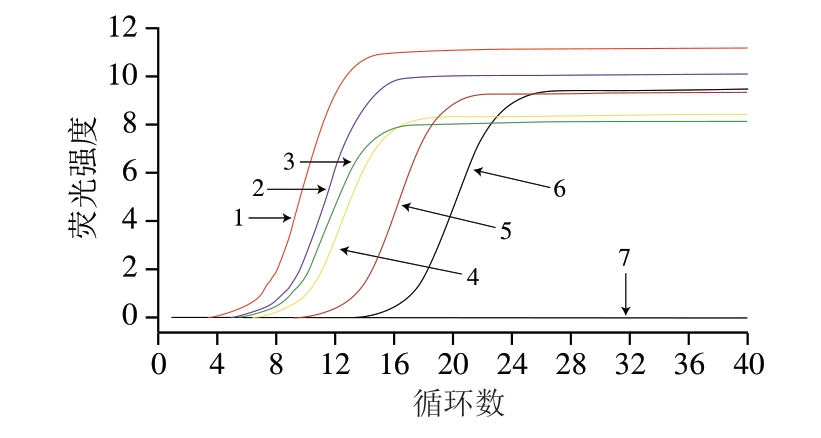
图5 模拟肉样Proofman-LMTIA测定结果
Fig. 5 Results of Proofman-LMTIA for adulterated meat samples
1~6. 猪肉质量分数分别为100.0%、20.0%、10.0%、5.0%、1.0%、0.1%的混合肉样;7. 阴性对照及猪肉质量分数为0%的混合肉样。
由图5可知,所制备的猪肉质量分数分别为0%、0.1%、1.0%、5.0%、10.0%、20.0%、100.0%的混合模拟肉样在20 个循环数以内只有质量分数为0%的模拟肉样和阴性对照未发生扩增,其余均发生扩增。说明该方法能在30 min之内检出猪肉质量分数为0.1%及以上的掺假样品,即每1 kg肉制品中掺入1 g猪肉也可被检出。
2.5 实际样品检测结果
表2 样品测定结果
Table 2 Results of Proofman-LMTIA and real-time fluorescence quantitative PCR for actual samples

?
用所建立的猪肉源基因Proofman-LMTIA检测方法对24 份市售牛羊肉及其肉制品进行检测,由表2可知,本研究建立的猪肉源Proofman-LMTIA检测方法与实时荧光定量PCR检测方法的检测结果一致,总符合率为100.0%。由于目前样品数量不多,阳性样品检出数较少,后续将增加样品数量以验证2 种方法的一致性。
3 结 论
本研究建立了一种基于Proofman探针的LMTIA方法以检测肉制品中的猪肉源基因,将Proofman探针和超保真酶加入到LMTIA反应体系中,更好地实现了反应的不开盖、可视实时检测。本方法选取猪细胞核中单拷贝的PRLR基因,对所测试的十几种非目标DNA无交叉反应,具有较强的特异性,且可检测到灵敏度为1 ng/μL的猪基因组DNA。对混合模拟肉样的检测,检测限达到0.1%。较其他分子生物学检测方法具有相同或更高的检测限,如TaqMan实时荧光PCR法的检出限为5.0%[32],可视化LAMP方法的检出限为1%[17]。但目前本研究只能够检测肉制品中的猪肉源成分,无法检测是否掺入鸡鸭肉成分,故还不能得到更好的应用,后续将致力于结合不同的荧光基团,做到高效、快速进行多物种同时检测,早日应用于肉制品掺假的市场监管中。
本研究建立的Proofman-LMTIA检测方法具有操作简单、灵敏度高、特异性强、反应时间短、适用范围广等优点,可作为肉制品掺假快速检测的有效手段,为规范肉制品市场秩序提供技术支持。
[1] ZHANG Wenjing, XUE Jianhong. Economically motivated food fraud and adulteration in China: an analysis based on 1553 media reports[J]. Food Control, 2016, 67: 192-198. DOI:10.1016/j.foodcont.2016.03.004.
[2] QIN Panzhu, LI Yulin, YAO Bangben, et al. Rational incorporating of loop-mediated isothermal amplification with fluorescence anisotropy for rapid, sensitive and on-site identification of pork adulteration[J]. Food Control, 2022, 137: 108863. DOI:10.1016/j.foodcont.2022.108863.
[3] FLOREN C, WIEDEMANN I, BRENIG B, et al. Species identification and quantification in meat and meat products using droplet digital PCR(ddPCR)[J]. Food Chemistry, 2015, 173: 1054-1058. DOI:10.1016/j.foodchem.2014.10.138.
[4] 秦盼柱, 陆剑锋, 陈伟. 基于功能化引物设计的荧光比色法检测牛肉品中鸭肉掺假成分[J]. 合肥工业大学学报(自然科学版), 2020,43(6): 844-848. DOI:10.3969/j.issn.1003-5060.2020.06.022.
[5] KIM G D, SEO J K, YUM H W, et al. Protein markers for discrimination of meat species in raw beef, pork and poultry and their mixtures[J]. Food Chemistry, 2017, 217: 163-170. DOI:10.1016/j.foodchem.2016.08.100.
[6] MONTOWSKA M, POSPIECH E. Species-specific expression of various proteins in meat tissue: proteomic analysis of raw and cooked meat and meat products made from beef, pork and selected poultry species[J]. Food Chemistry, 2013, 136(3): 1461-1469. DOI:10.1016/j.foodchem.2012.09.072.
[7] SARAH S A, FARADALILA W N, SALWANI M S, et al. LC-QTOFMS identification of porcine-specific peptide in heat treated pork identifies candidate markers for meat species determination[J]. Food Chemistry,2016, 199: 157-164. DOI:10.1016/j.foodchem.2015.11.121.
[8] 古淑青, 詹丽娜, 赵超敏, 等. 基于液相色谱-串联质谱法的肉类特征肽段鉴别及掺假测定[J]. 色谱, 2018, 36(12): 1269-1278.DOI:10.3742/SP.J.1123.2018.08005.
[9] THIENES C P, MASIRI J, BENOIT L A, et al. Quantitative detection of pork contamination in cooked meat products by ELISA[J]. Journal of AOAC International, 2018, 101(3): 810-816. DOI:10.5740/jaoacint.17-0036.
[10] BENLI H, BARUTÇU E. Sequential use of real-time polymerase chain reaction and enzyme-linked immunosorbent assay techniques verifies adulteration of fermented sausages with chicken meat[J]. Animal Bioscience, 2021, 34(12): 1995-2002. DOI:10.5713/ab.21.0139.
[11] 王忠合, 胡文梅, 卢燎源, 等. 非标记蛋白组学法鉴别牛肉丸中肉类掺假的方法研究[J]. 中国食品学报, 2022, 22(4): 295-308.DOI:10.16429/j.1009-7848.2022.04.029.
[12] 施姿鹤, VOGLMEIR J, 刘丽. 肉及其加工制品的掺假鉴别技术研究进展[J]. 食品科学, 2019, 40(23): 319-326. DOI:10.7506/spkx1002-6630-20181229-354.
[13] LI Jiapeng, WEI Yixuan, LI Jinchun, et al. A novel duplex SYBR Green real-time PCR with melting curve analysis method for beef adulteration detection[J]. Food Chemistry, 2021, 338: 127932.DOI:10.1016/j.foodchem.2020.127932.
[14] SARLAK Z, SHOJAEE-ALIABADI S, REZVANI N, et al. Development and validation of TaqMan real-time PCR assays for quantification of chicken adulteration in hamburgers[J]. Journal of Food Composition and Analysis, 2022, 106: 104302. DOI:10.1016/j.jfca.2021.104302.
[15] HE Chuan, BAI Lan, CHEN Yifan, et al. Detection and quantification of adulterated beef and mutton products by multiplex droplet digital PCR[J]. Foods, 2022, 11(19): 3034. DOI:10.3390/foods11193034.
[16] 任君安, 邓婷婷, 黄文胜, 等. 微滴式数字聚合酶链式反应精准定量检测羊肉中掺杂猪肉[J]. 食品科学, 2017, 38(2): 311-316.DOI:10.7506/spkx1002-6630-201702049.
[17] 朱凯, 康怀彬, 王德国. 可视化LAMP检测常见肉制品中猪肉成分[J].食品科学, 2019, 40(12): 296-302. DOI:10.7506/spkx1002-6630-20180526-369.
[18] ZHANG Huang, CAO Weiwei, ZHANG Yilin, et al. Identification for meat adulteration (pork, beef, sheep and duck) in foodstuff by microfluidic chip-based real-time fluorescent LAMP[J]. Journal of Food Composition and Analysis, 2023, 119: 105223.
[19] HU Xuejia, XU Hui, ZHANG Yunzhe, et al. Saltatory rolling circle amplification (SRCA) for sensitive visual detection of horsemeat adulteration in beef products[J]. European Food Research and Technology,2021, 247(11): 2667-2676. DOI:10.1007/s00217-021-03720-2.
[20] 胡学佳, 卢鑫, 张蕴哲, 等. 可视化跨越式滚环等温扩增技术在猪肉掺假检测中的应用[J]. 食品工业科技, 2020, 41(24): 75-80.DOI:10.13386/j.issn1002-0306.2020040328.
[21] FU Ming, ZHANG Quanwang, ZHOU Xiang, et al. Recombinase polymerase amplification based multiplex lateral flow dipstick for fast identification of duck ingredient in adulterated beef[J]. Animals, 2020,10(10):1765. DOI:10.3390/ani10101765.
[22] KISSENKÖTTER J, BÖHLKEN-FASCHER S, FORREST M S, et al.Recombinase polymerase amplification assays for the identification of pork and horsemeat[J]. Food Chemistry, 2020, 322: 126759.DOI:10.1016/j.foodchem.2020.126759.
[23] 胡谦, 陈颖, 倪凯, 等. 肉制品异源基因检测技术研究进展[J]. 食品科学, 2018, 39(15): 275-282. DOI:10.7506/spkx1002-6630-201815040.
[24] WANG Deguo, WANG Yongzhen, ZHANG Meng, et al. Laddershape melting temperature isothermal amplification of nucleic acids[J].BioTechniques, 2021, 71(1): 358-369. DOI:10.2144/btn-2020-0173.
[25] 王德国, 张萌, 王永真, 等. 梯型熔解温度等温扩增检测食品中植物源成分的内标方法构建[J]. 食品安全质量检测学报, 2021, 12(21):8439-8445. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.21.019.
[26] WANG Yongzhen, WANG Borui, WANG Deguo. Detection of chicken adulteration in beef via ladder-shape melting temperature isothermal amplification (LMTIA) assay[J]. Biotechnology and Biotechnological Equipment, 2022, 36(1): 339-345. DOI:10.1080/131 02818.2022.2081514.
[27] ZHANG Yongqing, WANG Yongzhen, OUYANG Xingmei, et al.Development of a ladder-shape melting temperature isothermal amplification (LMTIA) assay for the identification of cassava component in sweet potato starch noodles[J]. Molecules, 2022, 27(11):3414. DOI:10.3390/molecules27113414.
[28] WANG Yongzhen, WANG Borui, XU Dandan, et al. Development of a ladder-shape melting temperature isothermal amplification (LMTIA)assay for detection of African swine fever virus (ASFV)[J]. Journal of Veterinary Science, 2022, 23(4): e51. DOI:10.4142/jvs.22001.
[29] BIGNON C, BINART N, ORMANDY C, et al. Long and short forms of the ovine prolactin receptor: cDNA cloning and genomic analysis reveal that the two forms arise by different alternative splicing mechanisms in ruminants and in rodents[J]. Journal of Molecular Endocrinology, 1997, 19(2): 109-120. DOI:10.1677/jme.0.0190109.
[30] DING Sheng, CHEN Gangyi, WEI Yinghua, et al. Sequencespecific and multiplex detection of COVID-19 virus (SARS-CoV-2)using proofreading enzyme-mediated probe cleavage coupled with isothermal amplification[J]. Biosensors and Bioelectronics, 2021, 178:113041. DOI:10.1016/j.bios.2021.113041.
[31] CHEN Xiaoyu, LU Lixia, XIONG Xiaohui, et al. Development of a real-time PCR assay for the identification and quantification of bovine ingredient in processed meat products[J]. Scientific Reports, 2020,10(1): 2052. DOI:10.1038/s41598-020-59010-6.
[32] 杨瑶, 斯能武, 严钰澳, 等. 实时荧光PCR定量检测肉制品中猪源性成分[J]. 食品工业科技, 2022, 43(3): 268-274. DOI:10.13386/j.issn1002-0306.2021050232.