肾上腺素类药物通过与肾上腺素受体结合,激动受体产生肾上腺样作用,主要包括去甲肾上腺素、肾上腺素、多巴胺、异丙肾上腺素、间羟胺和去氧肾上腺素,其基本化学结构为β-苯乙胺(图1)。
自20世纪60年代,肾上腺素类药物一直被认为是增加恢复心跳机会的特效药。我国农业农村部于2019年颁布的GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》[1]规定在动物食品中可以使用肾上腺素和去甲肾上腺素,且不需要制定残留限量,对于其他肾上腺素类药物残留限量暂无规定。但人体摄入大剂量的儿茶酚胺类药物能够引起中枢神经兴奋,还会引起惊厥并抑制呼吸中枢,严重者引发胸痛、血压骤升和心律失常[2-3];还可导致脑溢血、急性肺水肿,甚至死亡[4-6]。因此,建立动物食品中肾上腺素类药物的检测方法非常必要。
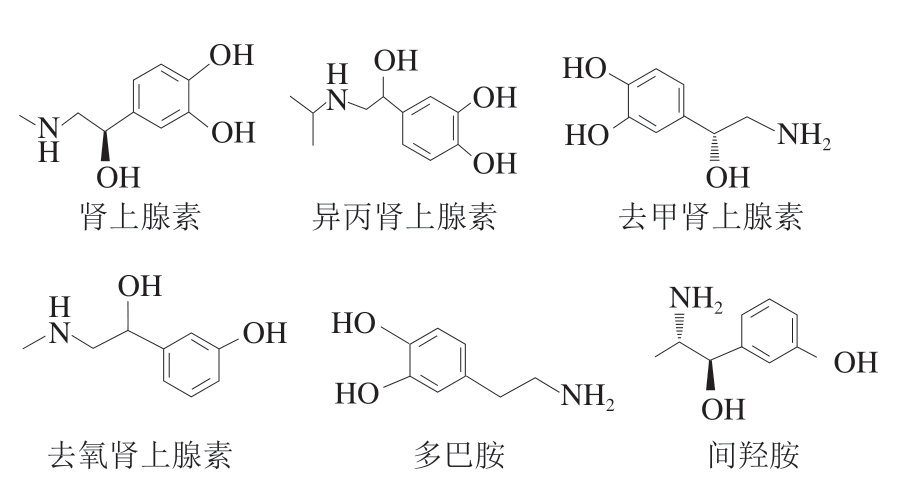
图1 肾上腺素类药物化学结构
Fig. 1 Chemical structures of adrenergic drugs
为了规范肾上腺素类药物在动物中的使用,我国陆续出台了一些标准,现行国家标准GB/T 21036—2007《饲料中盐酸多巴胺的测定 高效液相色谱法》[7]为饲料中盐酸多巴胺的高效液相色谱检测法,最低检测限为0.5 mg/kg,最低定量限为1.7 mg/kg;农业行业标准NY/T 3147—2017《饲料中肾上腺素和异丙肾上腺素的测定 液相色谱-串联质谱法》[8]中,饲料中肾上腺素和异丙肾上腺素的定量限分别为20 mg/kg和10 mg/kg,SN/T 5170—2019《出口动物源食品中肾上腺素和去甲肾上腺素的测定》[9]规定,出口动物源食品中肾上腺素和去甲肾上腺素检测限为50.0 μg/kg,定量限为100 μg/kg。目前国内外期刊文献对于肾上腺素类药物的检测方法均有所报道[10-12],常用的检测方法有分子纳米管印迹检测法[13-15]、电化学生物传感检测法[16-18]、化学发光免疫法[19]、毛细管电泳法[20]、高效液相色谱法[21-22]和高效液相色谱-串联质谱法[23-25]等,但多数文献[26-28]仅对1~2 种肾上腺素类药物或其代谢物的残留方法进行相关研究报道,相关检测方法的检出限和定量限均较高,所以急需建立一种可检测动物食品中多种肾上腺素类药物残留的标准方法。因此,本研究旨在建立一种猪肉中肾上腺素类药物的超高效液相色谱-串联质谱检测方法。
1 材料与方法
1.1 材料与试剂
肾上腺素类药物标准品及内标:肾上腺素、去甲肾上腺素、异丙肾上腺素、去氧肾上腺素、多巴胺、间羟胺、去甲肾上腺素-D6、肾上腺素-D6、异丙肾上腺素-D7、多巴胺-D4和去氧肾上腺素-D3(纯度均≥98.0%)德国Dr.Ehrenstorfer公司;纯水、甲醇、甲酸、氨水、乙腈(均为色谱纯) 美国Fisher试剂公司;三氯乙酸(化学纯)、乙酸铵(色谱纯) 北京化学试剂有限公司;滤膜(0.22 µm) 天津津腾实验设备有限公司;Bond Elut PBA固相萃取柱(100 mg/3 mL,硅胶键合苯硼酸固相萃取柱) 美国安捷伦科技有限公司。
1.2 仪器与设备
Acquity超高压液相色谱仪、Xevo TQS质谱仪、MassLynxTM色谱工作站 美国Waters公司;BS210S电子天平 北京赛多利斯天平有限公司;Milli-Q Advantage超纯水仪 美国密理博公司;3K15高速离心机 德国Sigma公司;Vortex-Genie 2旋涡混合器 美国Scientific Industries公司。
1.3 方法
1.3.1 溶液配制
1.3.1.1 基础溶液
5 g/100 mL三氯乙酸溶液:取三氯乙酸50 g,溶解至1 000 mL水中,混匀。0.1 mol/L乙酸铵缓冲溶液(pH 8.5):称取乙酸铵7.7 g,加水使其溶解,用氨水调pH值至8.5±0.1,加水定容至1 000 mL。洗脱液:取甲酸0.1 mL和甲醇50 mL,加水稀释至100 mL,混匀。氨水溶液(pH 8.5):取浓氨水约25 µL,调pH值至8.5±0.1,混匀。流动相A:称取乙酸铵0.154 g和甲酸1 mL,加水稀释至1 000 mL,混匀。
1.3.1.2 标准储备液
分别称取肾上腺素、去甲肾上腺素、异丙肾上腺素、去氧肾上腺素、多巴胺和间羟胺标准品各10 mg,精密称定。分别用甲醇溶解并稀释定容至100 mL棕色容量瓶,配制成质量浓度为100 µg/mL的标准储备液。-18 ℃保存,有效期6 个月。
1.3.1.3 内标储备液
分别称取去甲肾上腺素-D6、肾上腺素-D6、异丙肾上腺素-D7、多巴胺-D4和去氧肾上腺素-D3各10 mg,分别用甲醇溶解并稀释定容至100 mL棕色容量瓶,配制成质量浓度为100 µg/mL的标准储备液。-18 ℃保存,有效期6 个月。
1.3.1.4 混合标准工作液
精密量取肾上腺素、去甲肾上腺素、异丙肾上腺素、去氧肾上腺素、多巴胺和间羟胺标准储备液各1 mL,用甲醇稀释定容至100 mL棕色容量瓶,配制成质量浓度为1 µg/mL的混合标准工作液。2~8 ℃下避光保存,现用现配。
1.3.1.5 混合内标工作液
精密量取内标储备液各1 mL,用甲醇稀释定容至100 mL棕色容量瓶中,配制成质量浓度为1 µg/mL的混合内标工作液。2~8 ℃下避光保存,现用现配。
1.3.1.6 工作曲线溶液
取适量混合标准工作液配制0.5、1.0、2.0、10.0、50.0、100.0 µg/L的系列肾上腺素、异丙肾上腺素、去氧肾上腺素、多巴胺、间羟胺和1.0、2.0、10.0、50.0、200.0、500.0 µg/L的去甲肾上腺素系列混合标准工作液,取适量混合内标工作液配制40 µg/L内标,供超高效液相色谱-串联质谱测定,得到相应的峰面积。以肾上腺素类药物与相应同位素内标峰面积的比值为纵坐标,相应标准溶液质量浓度为横坐标,绘制标准曲线,得到回归方程和相关系数。
1.3.2 液相色谱与质谱条件
1.3.2.1 液相色谱条件
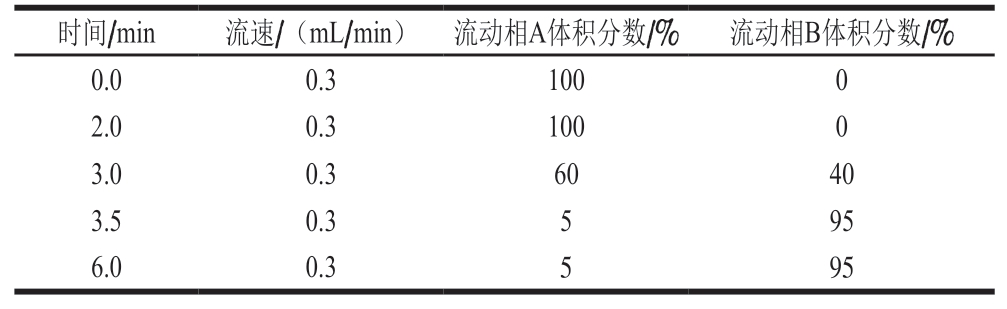
色谱柱:极性修饰Polaris Amide-C1 8色谱柱(150 mm×3.0 mm,3.0 μm);流动相:A相:含体积分数0.1%甲酸和2 mmol/L乙酸铵的水溶液,B相:乙腈;流速0.3 mL/min;柱温40 ℃;进样量5 µL,梯度洗脱条件见表1。
表1 梯度洗脱条件
Table 1 Gradient elution conditions
?
1.3.2.2 质谱条件
离子源:电喷雾离子源;扫描方式:正离子模式;检测方式:多反应监测模式;干燥气温度250 ℃,干燥气流速7 L/min;鞘气温度325 ℃,鞘气流速12 L/min;喷雾器压力40 psi;毛细管电压3 500 V;定性离子对、定量离子对、碎裂电压、碰撞能量等见表2。
表2 肾上腺素类物质测定的串联质谱参数
Table 2 MS/MS parameters for the determination of adrenergic drugs
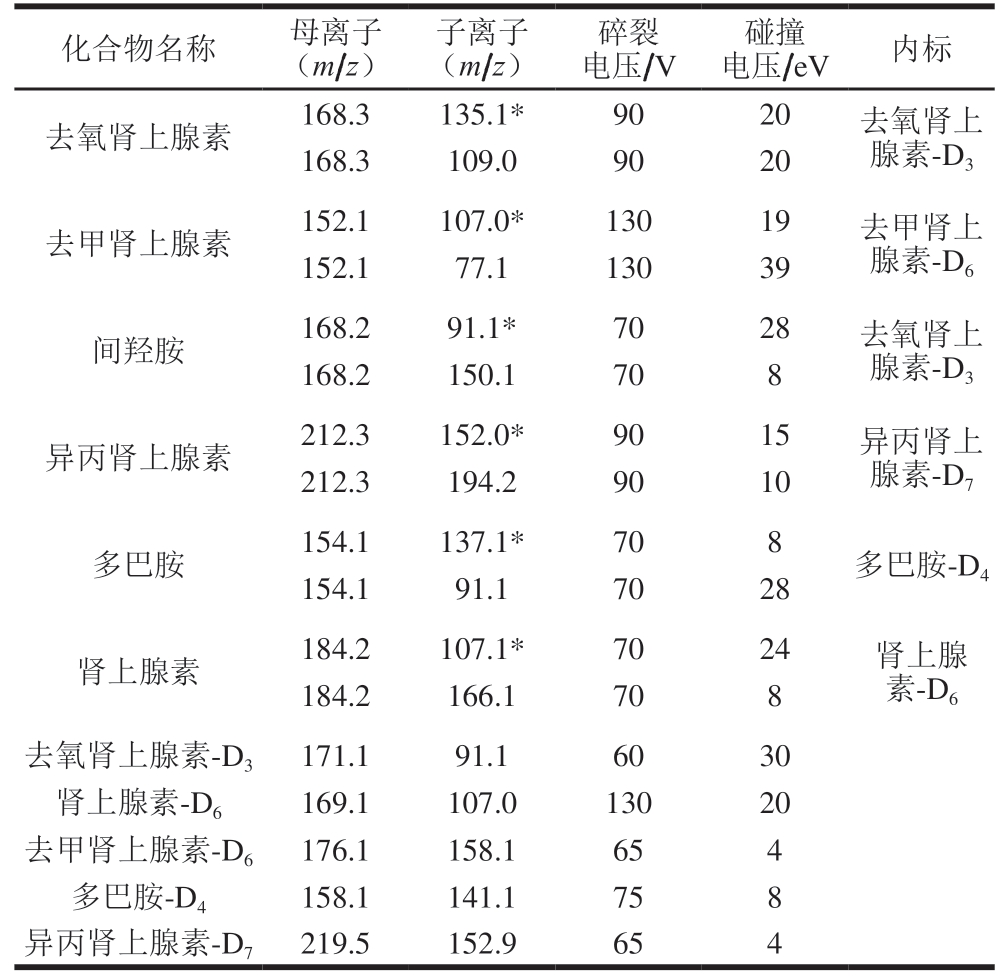
注:*. 定量离子。
?
1.3.3 样品前处理
1.3.3.1 提取
称取5 g(精确至±0.01 g)猪肉,加入200 µL同位素内标,涡旋均匀,加入10 mL 5 g/100 mL三氯乙酸溶液,涡旋1 min后,4 ℃、8 000 r/min离心5 min。吸取10 mL上清液于15 mL离心管中,加一定量浓氨水,调节pH值为8.5后,4 ℃、8 000 r/min离心5 min。取全部上清液混匀,待过柱净化。
1.3.3.2 净化
将全部上清液转移至预先用3 m L 甲醇、3 m L 0.1 mol/L、pH 8.5乙酸铵缓冲液活化的Bond Elut PBA固相萃取柱中,以1 滴/s的速率自流过柱。然后用5 mL上述乙酸铵缓冲液淋洗,抽干小柱,用5 mL 0.1%甲酸水溶液洗脱。最后挤干小柱,收集洗脱液混合均匀,过0.22 μm尼龙滤膜,待超高效液相色谱-串联质谱测定。
1.3.4 结果计算
采用与超高效液相色谱-串联质谱仪配套使用的数据采集和处理一体化软件MassLynxTM(美国Waters公司)进行实验数据的采集和实验结果的自动处理,经软件自动处理得到试样溶液中相应各肾上腺素类药物的质量浓度,按下式计算。
式中:ρi为从标准工作曲线得到的试样溶液中肾上腺素类药物的质量浓度/(μg/L);X为试样中肾上腺素类药物的残留量/(μg/kg);V为试样提取溶液总体积/mL;V1为用于净化的提取溶液体积/mL;V2为最终定容体积/mL;m为试样质量/g。
2 结果与分析
2.1 质谱条件的选择与优化
将适量浓度的标准品肾上腺素、去甲肾上腺素、异丙肾上腺素、去氧肾上腺素、多巴胺、间羟胺溶液和内标去甲肾上腺素-D6、肾上腺素-D6、异丙肾上腺素-D7、多巴胺-D4和去氧肾上腺素-D3溶液采用流动注射直接进样,通过全扫描方式确定其母离子,再对母离子进行二级质谱扫描得到碎片离子,通过优化条件,得到二级质谱图。通过多反应监测选择相对丰度较高的离子对为定性定量离子对,并对毛细管电压、碰撞电压进行优化,最终确定最佳上机参数。优化得到的质谱条件见表2。
2.2 色谱柱的选择
肾上腺素类药物具有较强的水溶性,极性较强。通过实验发现,采用一般的C18色谱柱进行检测分析,保留效果很差,同时峰形也很不理想。因此本研究尝试了极性修饰Polaris Amide-C18色谱柱和HSS T3色谱柱。极性修饰Polaris Amide-C18色谱柱和HSS T3色谱柱均对极性化合物具有保留效果良好、100%水相流动相兼容、极低的质谱检测本底等优良特征,因此,非常适合分析极性较强的肾上腺素类目标物。通过不断优化流动相比例和条件,发现使用HSS T3色谱柱时存在保留时间过短的问题,一些杂质峰会干扰目标物,而相对而言,极性修饰Polaris Amide-C18色谱柱保留时间要长一些,各目标物的峰型较好,所以,最终选择极性修饰Polaris Amide-C18色谱柱(150 mm×3.0 mm,3.0 μm)。
优化条件下各肾上腺素类药物及内标的色谱图如图2所示。
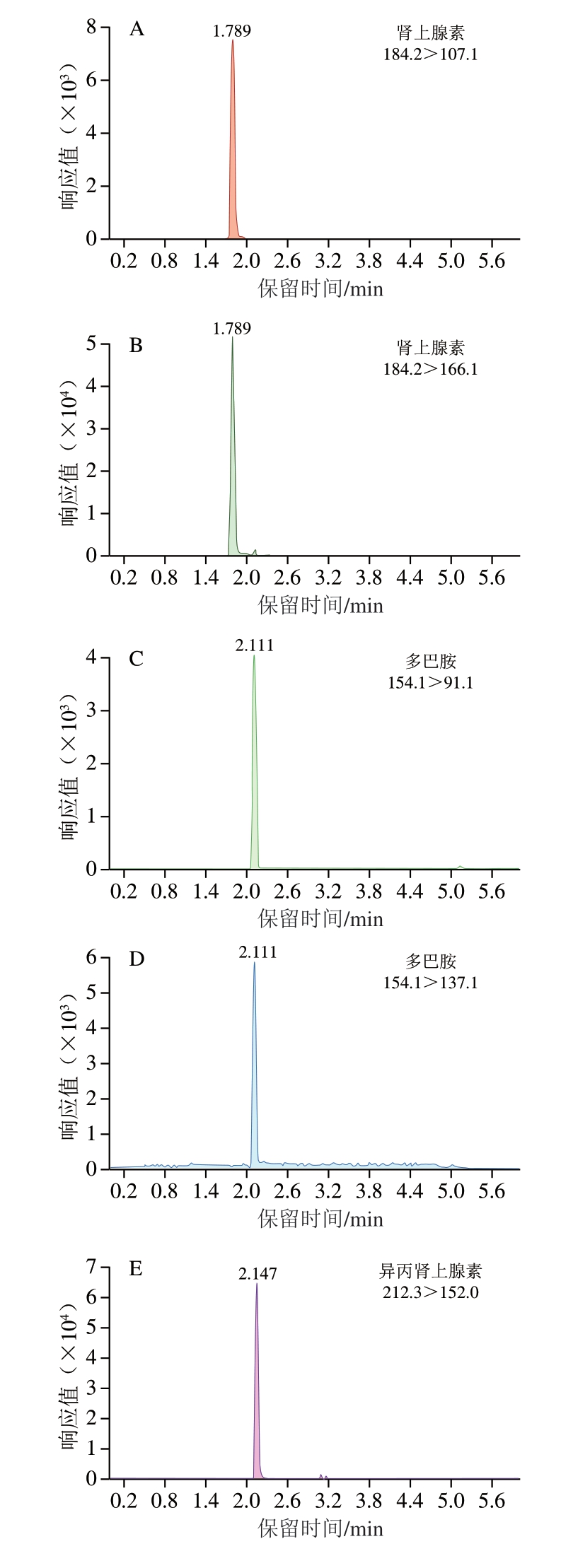
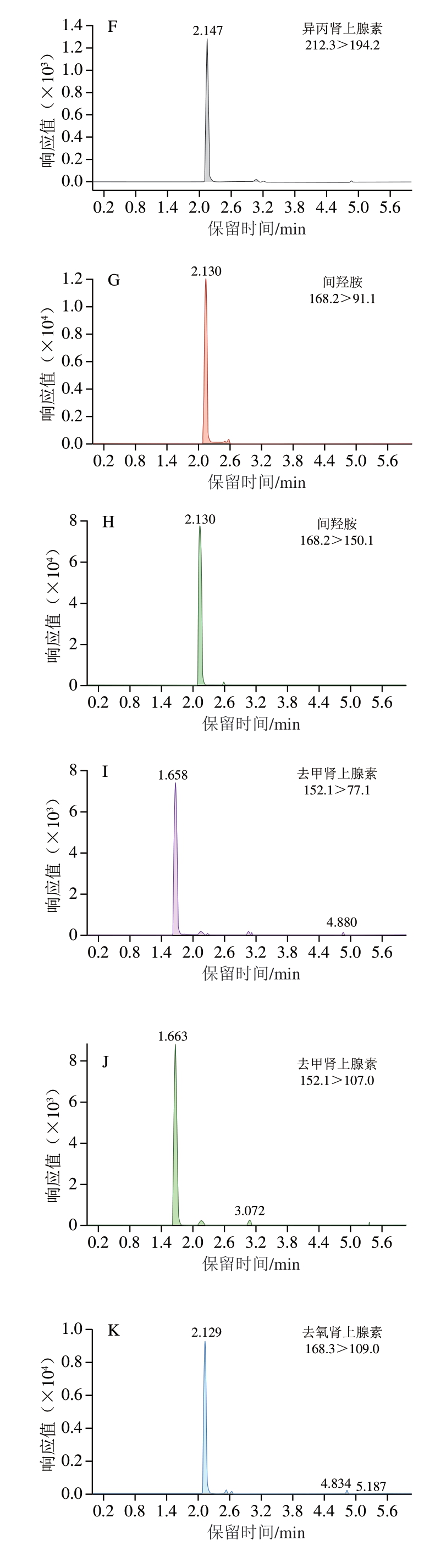
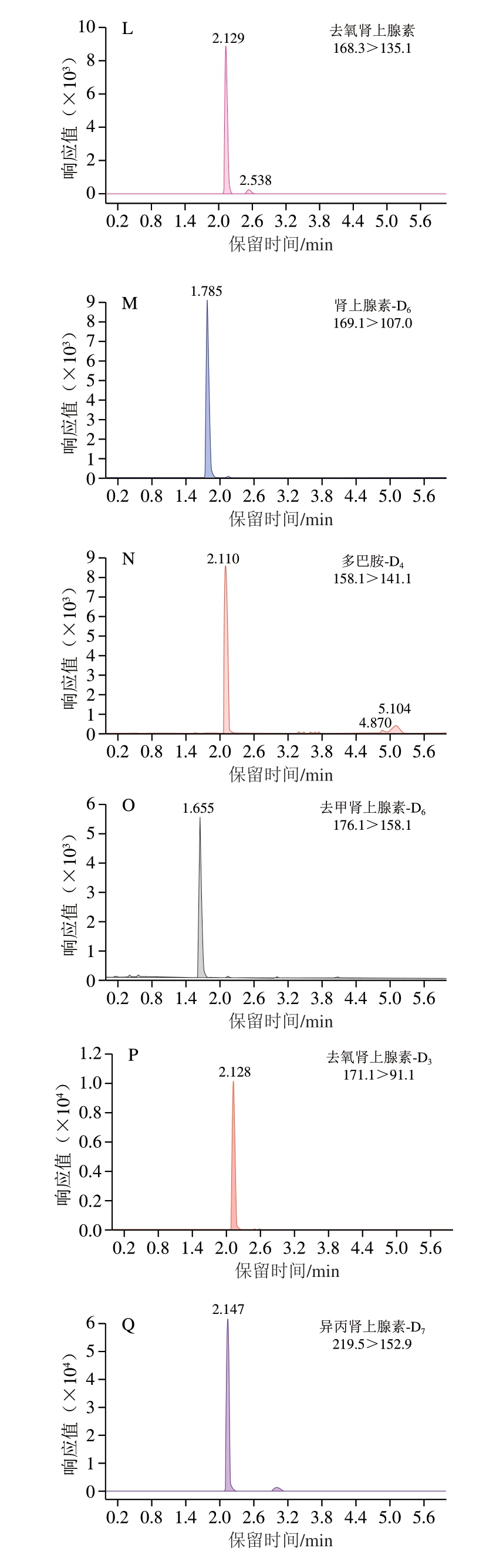
图2 优化条件下各肾上腺素类药物及内标的色谱图
Fig. 2 Chromatograms of adrenergic drugs and internal standards under optimum conditions
2.3 提取及净化方法的选择
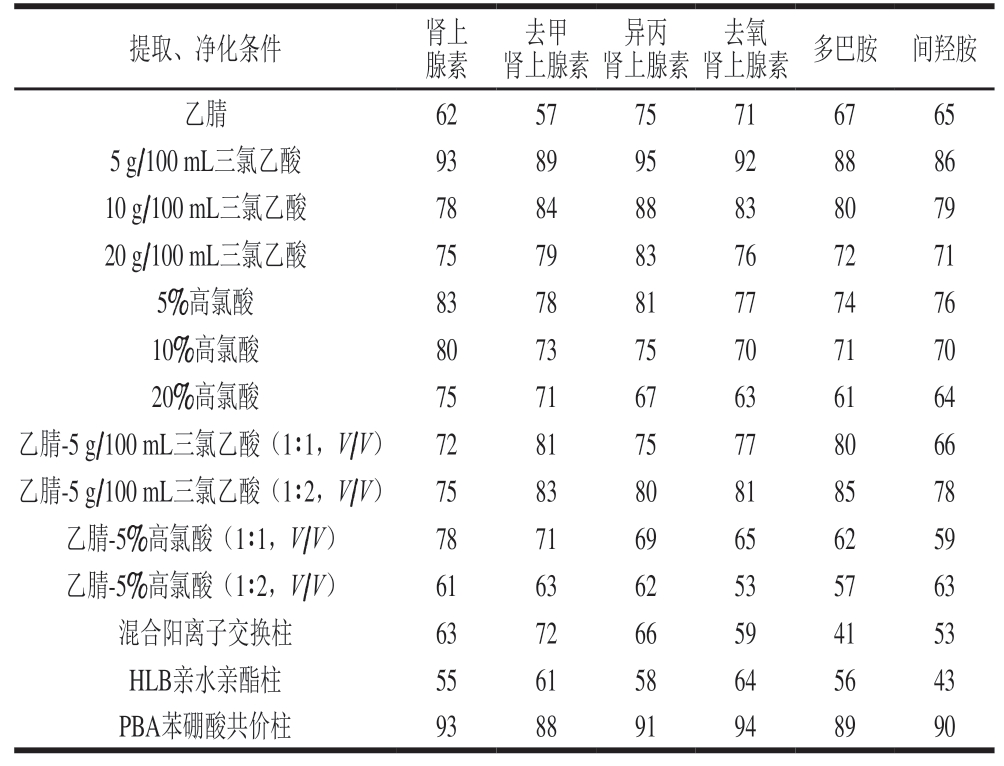
6 种肾上腺素类药物均含有羟基和氨基,极性较强,易溶于水和极性较强的有机试剂中。通过文献检索和已发布相关标准中对肾上腺素类物质提取试剂的选择来看,目前选择的常用提取溶剂为乙腈、三氯乙酸水溶液、高氯酸溶液和乙酸铵溶液等[29-31]。所以本研究通过加标回收实验,选择乙腈、三氯乙酸水溶液和高氯酸溶液以及乙腈和三氯乙酸水溶液、高氯酸溶液不同比例的混合液进行添加回收实验。
表3 6 种肾上腺素类药物在不同提取和净化条件下的加标回收率
Table 3 Recoveries of six adrenergic drugs in spiked samples under different extraction and purification conditions%
?
由表3可知,以5 g/100 mL三氯乙酸作为提取液时,能满足6 种药物的提取效果要求。
在净化实验中,综合考虑肾上腺素类物质的化学结构性质,选用3 种固相萃取柱(混合阳离子交换柱、HLB亲水亲酯柱和PBA苯硼酸共价柱)比较净化效果。PBA固相萃取小柱的回收率明显高于其他2 种固相萃取柱。因此本方法选择PBA固相萃取柱作为净化固相萃取柱。
2.4 方法学考察
2.4.1 线性范围
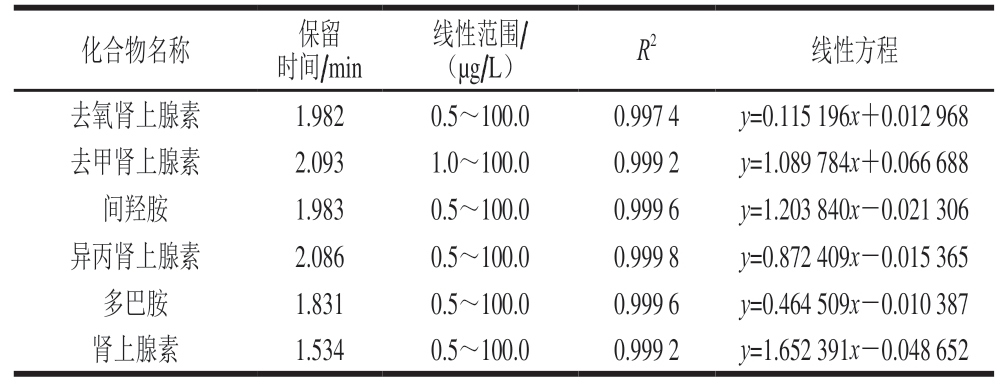
在最佳实验条件下,精密量取适量混合标准工作液及混合内标工作液,用初始流动相稀释,配制成质量浓度分别为0.50、2.0、5.0、10.0、50.0、100.0 µg/L的系列肾上腺素、异丙肾上腺素、去氧肾上腺素、多巴胺、间羟胺和1.0、2.0、5.0、10.0、50.0、100.0 µg/L的去甲肾上腺素系列混合标准工作液,内标质量浓度为20 ng/mL。采用内标标法进行分析定量。6 种肾上腺素类物质的标准曲线线性范围、线性方程和相关系数如表4所示。
表4 6 种肾上腺素类药物的线性范围、线性方程和相关系数
Table 4 Linear ranges, regression equations and correlation coefficients for six adrenergic drugs
?
2.4.2 检出限和定量限
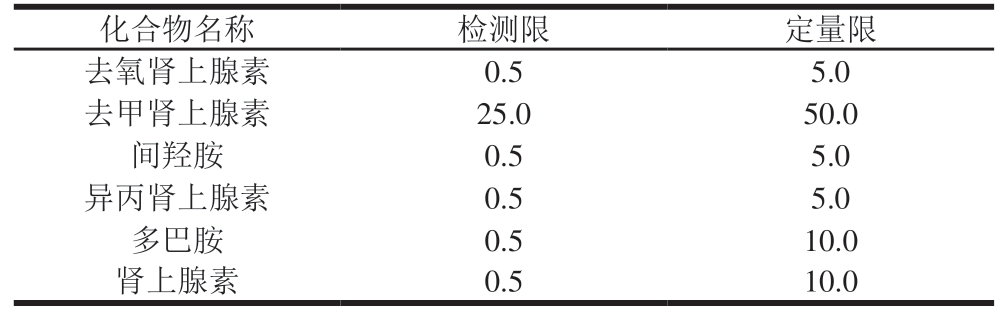
空白试样按相同的步骤处理后,在相应的保留时间下,空白试样对所测药物应无干扰。如果空白试样在相应的保留时间处出现被测药物峰,应扣除空白试样值进行结果计算。添加适量混合标准溶液于(5.00±0.01) g猪肉空白样品中,经提取后测定,检测限依据信噪比>3计算,定量限依据信噪比>10计算。6 种肾上腺素类药物在猪肉中的检测限和定量限见表5。
表5 6 种肾上腺素类药物在猪肉中的检测限和定量限
Table 5 Detection limits and quantitation limits of six adrenergic drugs in pork µg/kg
?
2.4.3 回收率和精密度
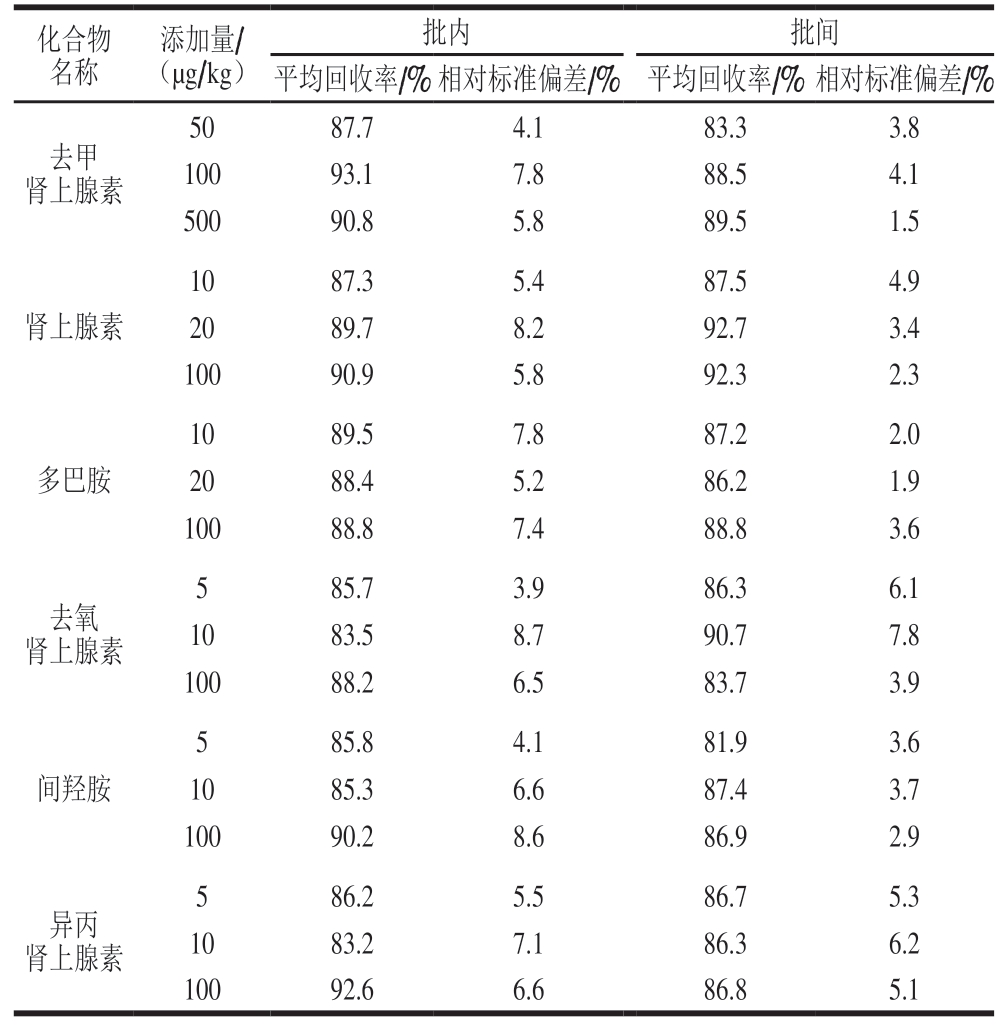
表6 猪肉中6 种肾上腺素类药物加标回收率和相对标准偏差
Table 6 Recoveries and RSDs of six adrenergic drugs in spiked pork
?
在猪肉基质中添加肾上腺素类物质标准溶液,进行准确度和精密度实验。6 种肾上腺素类物质,每种药物设置3 个添加浓度水平,每个浓度水平6 个重复样品。由表6可知,内标矫正后,加标回收率为81.9%~93.1%,相对标准偏差为1.5%~8.7%。添加回收率为60%~120%,批内相对标准偏差小于15%、批间相对标准偏差小于20%,说明建立的方法重复性和准确度较好,可以满足猪肉中肾上腺素类药物残留量的测定。
3 结 论
本研究以猪肉基质为研究对象,采用5 g/100 mL三氯乙酸溶液为提取液,PBA固相萃取柱净化,超高效液相色谱-串联质谱进行定性及定量分析,建立了猪肉中去甲肾上腺素、肾上腺素、多巴胺、异丙肾上腺素、间羟胺、去氧肾上腺素6 种肾上腺素类药物残留的检测方法。该方法样品前处理提取简单、效率高,条件易于控制,具有较高的灵敏度和选择性,能满足猪肉中肾上腺素类药物残留确证的分析要求。而且该多残留检测方法的研究和开发对已颁布的相关国家标准和已报道的相关研究起到了很好的补充和完善作用,为我国对该类药物的有效监管提供了强有力的技术支撑。
[1] 中华人民共和国农业农村部, 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准 食品中兽药最大残留限量: GB 31650—2019[S]. 北京: 中国标准出版社, 2019.
[2] 蔡辉, 郭寒, 赵智明, 等. 异丙基肾上腺素充血性心力衰竭大鼠模型心肌细胞凋亡的改变[J]. 河北医药, 2010, 32(3): 259-261.DOI:10.3969/j.issn.1002-7386.2010.03.001.
[3] 焦向英, 赵晓琴, 张燕, 等. 慢性异丙肾上腺素刺激引起心肌细胞凋亡的机制研究[J]. 中国自然医学杂志 2010, 12(1): 1-5.DOI:10.16505/j.2095-0136.2010.01.021.
[4] 孟伟, 马文涛, 张荣森, 等. 河南省濮阳市注水猪肉专项整治活动分析[J]. 中国动物检疫, 2018, 35(8): 49-51. DOI:10.3969/j.issn.1005-944X.2018.08.013.
[5] 陈光胜. 病死猪及注水猪的危害与鉴定标准[J]. 中国动物保健,2018, 20(11): 4-5. DOI:10.3969/j.issn.1008-4754.2018.11.002.
[6] 李志刚, 任南, 马燕红, 等. 高效液相色谱-串联质谱法检测鲜冻肉中违禁注水药物[J]. 食品科学, 2018, 39(12): 308-312. DOI:10.7506/spkx1002-6630-201812047.
[7] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 饲料中盐酸多巴胺的测定 高效液相色谱法:GB/T 21036—2007[S]. 北京: 中国标准出版社, 2007.
[8] 中华人民共和国农业部. 饲料中肾上腺素和异丙肾上腺素的测定液相色谱-串联质谱法: NY/T 3147—2017[S]. 北京: 中国农业出版社, 2017.
[9] 中华人民共和国国家质量监督检验检疫总局. 出口动物源食品中肾上腺素和去甲肾上腺素的测定: SN/T 5170—2019[S]. 北京: 中国标准出版社, 2019.
[10] 何志霞. 超高效液相色谱-串联质谱法测定猪肉中儿茶酚胺类的残留[J]. 食品安全质量检测学报, 2020, 11(16): 5608-5613.DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.16.047.
[11] BRITTO J J, ANTUNES N J, CAMPOS R, et al. Determination of dopamine, noradrenaline and adrenaline in Krebs-Henseleit’s solution by liquid chromatography coupled tandem mass spectrometry.Measurement of basal release from chelonoidis carbonaria aortae in vitro[J]. Biomedical Chromatography, 2020, 35(2): 4978.DOI:10.1002/bmc.4978.
[12] CHEN Di, ZHANG Jingxian, CUI Weiqi. A simultaneous extraction/derivatization strategy coupled with liquid chromatography-tandem mass spectrometry for the determination of free catecholamines in biological fluids[J]. Journal of Chromatography A, 2021, 1654:462474. DOI:10.1016/j.chroma.2021.462474.
[13] 丘秀珍, 华永标, 郭会时, 等. 分子印迹纳米管膜的制备及对人体尿液中儿茶酚胺类药物的检测[J]. 高等学校化学学报, 2018, 39(4):653-659. DOI:10.7503 /cjcu20170568.
[14] 董捷, 房刚, 叶新强. 儿茶酚胺类物质的分析进展[J]. 化学分析计量,2001, 10(6): 34-37. DOI:10.3969/j.issn.1008-6145.2001.06.016.
[15] 周慧, 董佳, 贺茂芳, 等. 生物样品中儿茶酚胺的分析方法研究进展[J]. 化工科技, 2020, 28(5): 75-80. DOI:10.16664/j.cnki.issn1008-0511.2020.05.015.
[16] 王玲, 阳愿望. 液相色谱串联电化学检测器测定人体血浆和尿液儿茶酚胺浓度[J]. 现代养生, 2015(24): 20-22. DOI:10.3969/j.issn.1671-0223(b).2015.12.017.
[17] TAIRA K, WEI L, TSUYOSHI M, et al. Well-designed dopamine imprinted polymer interface for selective and quantitative dopamine detection among catecholamines using a potentiometric biosensor[J].Biosensors and Bioelectronics, 2018, 117: 810-817. DOI:10.1016/j.bios.2018.07.014.
[18] 丁忙, 王敏, 吴靓, 等. 基于电化学生物传感方法检测肾上腺素等生物小分子研究进展[J]. 江西化工, 2015(5): 66-70. DOI:10.14127/j.cnki.jiangxihuagong.2015.05.021.
[19] 庄路阳, 许君艳, 刘念, 等. 磁微粒化学发光法测定人尿液/血浆中儿茶酚胺类物质[J]. 检验医学与临床, 2022, 19(12):1675-1678.DOI:10.3969/j.issn.1672-9455.2022.12.024.
[20] 余丽双, 褚克丹, 许惠凤. 毛细管电泳法分离检测三种肾上腺素类化合物[J]. 聊城大学学报(自然科学版), 2011, 24(3): 15-17.DOI:10.3969/j.issn.1672-6634.2011.03.005.
[21] ROZET E, MORELLO R, LECOMTE F, et al. Performances of a multidimensional on-line SPE-LC-ECD method for the determination of three major catecholamines in native human urine: validation, risk and uncertainty assessments[J]. Journal of Chromatography B, 2006,844(2): 251-260. DOI:10.1016/j.jchromb.2006.07.060.
[22] 毕月玲, 许桐, 陈利琴. 纳米纤维在线固相萃取检测尿液中3 种儿茶酚胺和5-羟色胺[J]. 色谱, 2021, 39(12): 1306-1313. DOI:10.3724/SP.J.1123.2021.07001.
[23] 李双, 刘忠义, 李露青, 等. 液相色谱-串联质谱法检测猪肉中肾上腺素及其代谢物残留[J]. 环境化学, 2019, 38(3): 701-703.
[24] 李泰锋, 刘雪梅, 胡蕾罗, 等. HPLC-MS/MS法测定人血浆中儿茶酚胺浓度的方法学建立[J]. 中国新药杂志, 2019, 28(17): 2120-2125.DOI:10.3969/j.issn.1003-3734.2019.17.013.
[25] 李艳, 许舒欣, 刘海培, 等. 液相色谱-串联质谱法测定血浆中甲氧基肾上腺素和甲氧基去甲肾上腺素[J]. 分析科学学报, 2020, 36(3):374-378. DOI:10.13526/j.issn.1006-6144.2020.03.010.
[26] 牛晋阳, 郭文萍, 孙焕, 等. 液质法测定动物源性食品中肾上腺素、多巴胺[J]. 食品科学, 2009, 30(20): 322-324.
[27] 张海超, 魏欣欣, 王敬, 等. 超高效液相色谱-串联质谱法测定动物源食品中肾上腺素和去甲肾上腺素的残留[J]. 食品安全质量检测学报, 2022, 13(12): 3811-3817. DOI:10.19812 /j.cnki.jfsq11-5956/ts.2022.12.023.
[28] 何亮娜, 马俊美, 范力欣, 等. 固相萃取结合超高效液相色谱-质谱法测定畜禽肉及肉制品中肾上腺素和多巴胺的残留量[J]. 肉类研究,2019, 33(9): 32-37. DOI:10.7506/rlyj1001-8123-20210422-107.
[29] 位佳静, 曹艳云, 王祎娟, 等. 超高效液相色谱-串联质谱法测定猪肉中肾上腺素残留量[J]. 肉类工业, 2019(8): 51-53. DOI:10.3969/j.issn.1008-5467.2019.08.011.
[30] 任南, 赵文涛, 陈超, 等. 固相萃取联合超高效液相色谱-串联质谱法测定畜肉中3 种儿茶酚胺类物质[J]. 食品科学, 2019, 40(24):300-305. DOI:10.7506/spkx 1002-6630-20190107-085.
[31] 王聪, 赵晓宇, 孙磊, 等. 高效液相色谱-三重四极杆质谱法测定猪肉及肝脏中肾上腺素代谢物[J]. 食品安全质量检测学报, 2020,11(21): 269-274. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.21.041.