我国是世界最大的水产品生产和消费国之一,2020年我国斑点叉尾鮰(Ietalurus punetaus)养殖产量为23 万t。斑点叉尾鮰又称美洲鲶、沟鲶,原产于北美洲,是一种淡水经济鱼类,其水分含量高、蛋白质含量丰富[1-2]。鮰鱼主要以鲜销、加工鱼片为主[3-4],在贮藏过程中极易受微生物侵染而导致腐坏[5],造成经济损失甚至威胁人类健康。
引起水产品变质的主要原因是微生物繁殖[6]、脂质氧化[7]以及食品中固有酶的活动[8]。鱼死亡后,鱼肉中的微生物进入滞后阶段,并在贮藏阶段呈指数增长,微生物在繁殖的过程中通过分泌胞外酶导致鱼肉腐败[9]。鱼体在开始阶段会受到多种微生物的污染,但在腐败过程中,只有部分菌参与腐败进程,这些菌被称为优势腐败菌(specific spoilage organisms,SSOs)[10]。鱼类的高水活性及富含低分子质量含氮分子为SSOs的生长创造了良好的基质,SSOs迅速繁殖并通过降解鱼体的营养物质,产生氨、胺类及醛类物质,这些物质会产生强烈的腐臭味,具有很强的致腐能力[11]。水产品贮藏期间,SSOs生长速率快,致腐能力明显强于其他细菌,是控制鱼肉品质的关键点。Wang Hang等[12]研究表明,将假单胞菌、气单胞菌、腐败希瓦氏菌接种到草鱼中能显著增加草鱼的总挥发性盐基氮(total volatile basic nitrogen,TVB-N)及生物胺的分泌。
目前对S S O s 的研究多集中在草鱼、金枪鱼、鲢鱼等[13-15],但针对斑点叉尾鮰贮藏期的SSOs研究甚少,从现有报告已知鮰鱼中的腐败菌有假单胞菌(Pseudomonas)、希瓦氏菌(Shewanella)及气单胞菌(Aeromonas)[16-17]。但鮰鱼中的SSOs及其致腐能力并没有具体的研究。本研究从4 ℃贮藏末期的鮰鱼中分离出多株腐败菌,挑选其中腐败性较强的菌株反接种到鮰鱼中,测定接菌后鱼肉的菌落总数及TVB-N含量,定量计算优势腐败菌的TVB-N产量因子,从而判断菌株的致腐能力,为探究冷藏过程中鮰鱼的SSOs以及进一步开发鮰鱼保鲜剂提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活斑点叉尾鮰,体质量2 500~3 000 g/条 湖北省武汉市白沙洲水产品批发市场。
无水乙醇、体积分数75%乙醇、氯化钠、氧化镁、甲基红、次甲基蓝、溴甲酚绿、硼酸、无水碳酸钠、盐酸、甘油、LB肉汤培养基、LB营养琼脂培养基、胰酪大豆胨蛋白琼脂(tryptose soya agar,TSA)培养基、胰酪大豆肉汤(trypticase (tryptic) soy broth,TSB)培养基、假单胞菌CFC选择性培养基、平板计数琼脂(plate count agar,PCA)培养基 国药集团化学试剂有限公司;微生物微量生化鉴定管 青岛海博生物技术有限公司;磁珠法基因组DNA提取试剂盒 武汉纳磁生物科技有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix 基因科技(上海)股份有限公司;96 孔板 美国康宁公司;通用引物 上海生工生物工程有限公司;POP-7™聚合物、3730运行缓冲液(10×) 美国应用生物系统公司(上海);以上试剂均为分析纯。
1.2 仪器与设备
DL-CJ-2NDⅡ洁净工作台 北京科誉兴业科技发展有限公司;LRH-250生化培养箱 上海博迅医疗生物仪器股份有限公司;DH-9070电热恒温鼓风干燥箱 上海精宏实验设备有限公司;K9860全自动凯氏定氮仪 山东海能科学仪器有限公司;HZ150L多功能培养摇床 武汉瑞华仪器设备有限责任公司;D1008E小型离心机 大龙兴创实验仪器(北京)有限公司;S-96 Nucleic Acid Extraction System 96 孔核酸提取仪武汉纳磁生物科技有限公司;NanoDrop 8000超微量分光光度计 赛默飞世尔科技公司;Veriti 96-Well Thermal Cycler PCR仪、3730xl DNA Analyzer测序仪 美国应用生物系统公司(上海);DYY-6C电泳仪 北京六一生物科技有限公司;GelDocTMXR+紫外分析仪 伯乐生命医学产品(上海)有限公司。
1.3 方法
1.3.1 腐败菌株的分离纯化
鲜活斑点叉尾鮰宰杀后,将鱼肉切块,真空包装后放置于4 ℃冰箱中到达腐败末期(9 d)[18]。取适量鱼肉于洁净工作台中剪碎,称取10 g,加入提前灭菌的90 mL生理盐水稀释并摇匀,取1 mL进行10 倍梯度稀释,选择3 个合适的稀释梯度,每个梯度取100 μL菌液,均匀涂布于LB营养琼脂、TSA培养基、假单胞菌CFC培养基及PCA上,其中LB营养琼脂和PCA培养基25 ℃培养72 h。TSA固体培养基、假单胞菌CFC选择性培养基30 ℃培养48 h。之后根据菌落特征的不同,挑取各平板上长势较好的典型菌落在LB营养琼脂上进行3 代纯化培养后,接种于LB肉汤中30 ℃恒温摇床培养18 h,菌悬液加体积分数20%甘油,于-80 ℃保存备用。
1.3.2 SSOs的筛选
1.3.2.1 菌悬液制备
将菌落分别挑取于LB肉汤培养基中划线活化,培养箱中30 ℃培养至对数期。再取单菌落2 代纯化培养,得到纯菌落。挑取一环菌苔接种于20 mL LB肉汤培养基(50 mL锥形瓶)中,在30 ℃、150 r/min的摇床中培养24 h,使菌液浓度达到108 CFU/mL,将菌液8 000 r/min离心10 min后,收集菌体,用生理盐水将其重悬,调整菌液浓度为106 CFU/mL。
1.3.2.2 无菌鱼片制备
将鲜活斑点叉尾鮰碎冰致死,去皮去内脏,鱼肉切成2 cm×3 cm×3 cm大小、质量20 g的鱼片,放入无菌封口袋中,送至湖北辐照实验中心以60Co γ为放射源、4 kGy剂量辐照灭菌[19]。
1.3.2.3 接种与贮藏
将处理好的无菌鱼片放入制备好的菌悬液浸泡5 min,取出于无菌滤纸上晾干,使初始接菌量为4(lg(CFU/g)),密封包装后贮藏于4 ℃冰箱中,每隔2 d分别取出样品分析菌落总数和TVB-N含量。以无菌生理盐水浸泡的鱼片作为对照组。
1.3.2.4 感官评定
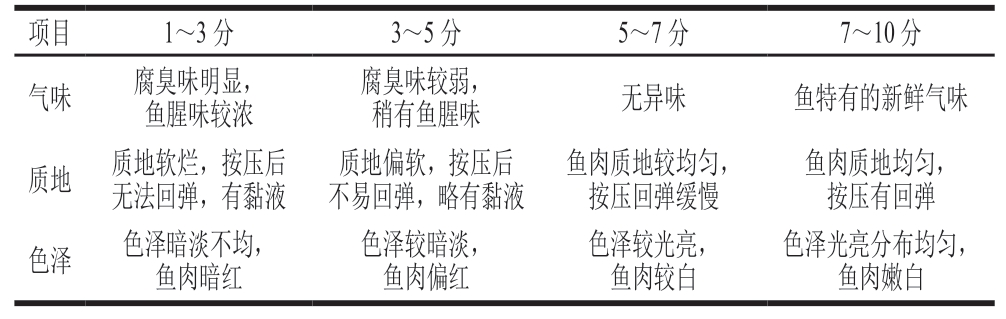
参考曹琳等[20]方法并稍作改动。由10 名经过训练的感官评测员采用10 分制评分法分别对鮰鱼片的气味、质地与色泽指标进行感官评定,计算平均分,确定SSOs。感官评分标准如表1所示。
表1 鮰鱼片感官评分标准
Table 1 Criteria for sensory evaluation of channel catfish fillets
?
1.3.3 菌落特征及菌体形态观察
将纯化后的菌株在LB琼脂培养基上划线培养,挑取长势较好的单菌落进行革兰氏染色镜检,并参考《伯杰氏细菌学鉴定手册》(第9版)的标准[21]用细菌微量生化鉴定管进行生化鉴定。
1.3.4 16S rDNA分子鉴定及系统发育树构建
挑取单菌落于LB肉汤培养基中,30 ℃、150 r/min培养24 h至生长对数期。4 ℃、8 000 r/min离心10 min后收集菌体。将菌体送至武汉天一华煜基因科技有限公司进行16S rDNA扩增及测序。将所得目的序列使用NCBI的BLAST程序对获得的16S rDNA序列进行同源序列比对,合理选取相似性高的序列,最后使用MEGA7.0.26软件(美国MEGA公司)的邻接法构建系统发育树[22]。
1.3.5 SSOs致腐能力评估
1.3.5.1 菌落总数测定
参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》[23]方法测定。
1.3.5.2 TVB-N含量测定
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》[24]半微量定氮法测定。
1.3.5.3 致腐能力定量分析
参考郑瑞生等[25]的方法对不同菌的腐败能力进行定量分析,YTVB-N作为评估SSOs致腐能力的指标,按下式计算。
式中:C0为贮藏期开始的TVB-N含量/(mg/g);Cs为贮藏期结束时的TVB-N含量/(mg/g);N0为贮藏期开始的菌落总数/(CFU/g);Ns为贮藏期结束时的菌落总数/(CFU/g)。
1.4 数据处理
所有实验均重复3 次,所得数据均采用Microsoft Excel 2019、Origin 2017及Graph Pad Prism 5软件进行处理及绘图,使用SPSS 23.0软件中的One-Way ANOVA对所有数据进行方差分析。
2 结果与分析
2.1 腐败菌的分离纯化
通过不同培养基进行涂布筛选,并在平板上至少进行3 次划线分离,根据菌落生长情况选取8 株典型腐败细菌菌落,其中LB琼脂培养基2 株(L1、L2)、TSA琼脂培养基3 株(T1、T2、T3)、假单胞菌CFC培养基2 株(C1、C2)、PCA平板计数琼脂1 株(P1)。
2.2 SSOs的筛选
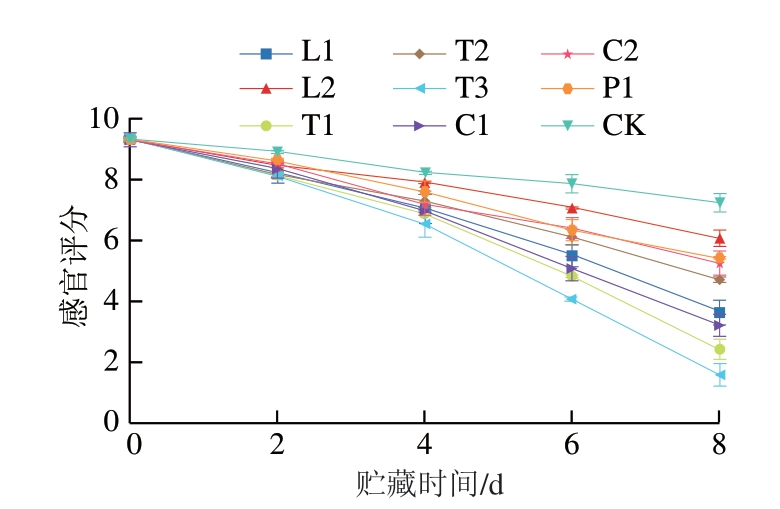
图1 接种腐败菌鮰鱼的感官评分
Fig. 1 Sensory score of channel catfish inoculated with spoilage bacteria
将从鮰鱼中分离出的8 株腐败菌菌株接种于无菌鱼片中,4 ℃贮藏,通过感官评定筛选SSOs。由图1可知,随贮藏期的延长,接种腐败菌的鱼肉感官评分明显低于对照组,其中接种菌株L1、T1、T3、C1的鱼肉贮藏6 d时出现异味,并且鱼肉表面失去光泽、产生少量黏液,弹性下降,贮藏8 d时有强烈的腐烂味道,鱼肉肉质软烂、呈暗红色。接种菌株L2、T2、C2、P1的鱼肉感官评分下降较为缓慢,在贮藏前6 d鱼肉并未出现明显的腐败现象,贮藏8 d时肉质变软、失去光泽,鱼腥味很重并且带有腐臭味。鱼肉在腐败过程中,由于微生物的作用导致鱼体中的蛋白质分解,脂肪氧化,色素降解沉淀,从而使鱼肉变软、弹性下降,鱼肉表面失去光泽并出现颜色变化[26-27]。从感官评定的结果可以筛选出L1、T1、T3、C1 4 株菌为斑点叉尾鮰中的SSOs。
2.3 SSOs的菌体形态观察及生理生化鉴定
2.3.1 形态观察
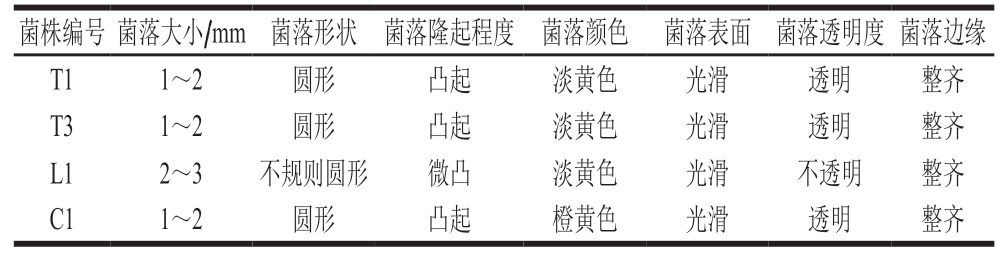
将筛选出的4 株SSOs进行菌落形态观察,革兰氏染色结果如图2所示,形态特征见表2。4 株SSOs菌落的形状均为圆形、光滑、边缘整齐,其中L1的菌落为不规则圆形、不透明。C1菌落颜色为橙黄色。同时,革兰氏染色结果表明,4 株腐败菌均为革兰氏阴性菌。
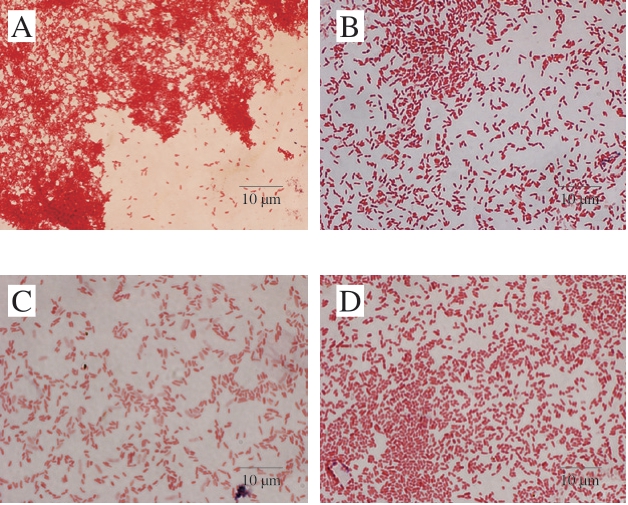
图2 4 株SSOs的革兰氏染色图
Fig. 2 Gram’s staining of four SSOs
A. T1;B. T3;C. C1;D. L1。
表2 4 株SSOs的菌落形态特征
Table 2 Colony characteristics of four SSOs
?
2.3.2 生理生化鉴定
由表3可知,T1、T3表现出一致的特性,不发酵麦芽糖、山梨醇、果糖、阿拉伯糖、乳糖和侧金盏花醇,但能发酵蔗糖。L1能发酵麦芽糖和侧金盏花醇,C1能发酵麦芽糖、蔗糖及阿拉伯糖。过氧化氢实验4 株菌均为阳性;硫化氢实验除C1阴性外其他3 株菌为阳性;V-P实验和吲哚实验4 株菌均为阴性;明胶液化实验、触酶实验及氧化酶实验4 株菌均为阳性;除C1外,T1、T3、L1产鸟氨酸脱羧酶,但4 株菌均不产赖氨酸脱羧酶;L1、C1产精氨酸双水解酶,T1、T3精氨酸双水解酶实验为阴性。参考《伯杰氏细菌学鉴定手册》(第9版)的标准[21],通过生理生化鉴定结果能初步判断L1、T1、T3为希瓦氏菌属,而C1不产硫化氢则更接近假单胞菌属。
表3 4 株SSOs的生理生化鉴定结果
Table 3 Results of physiological and biochemical identification of four SSOs
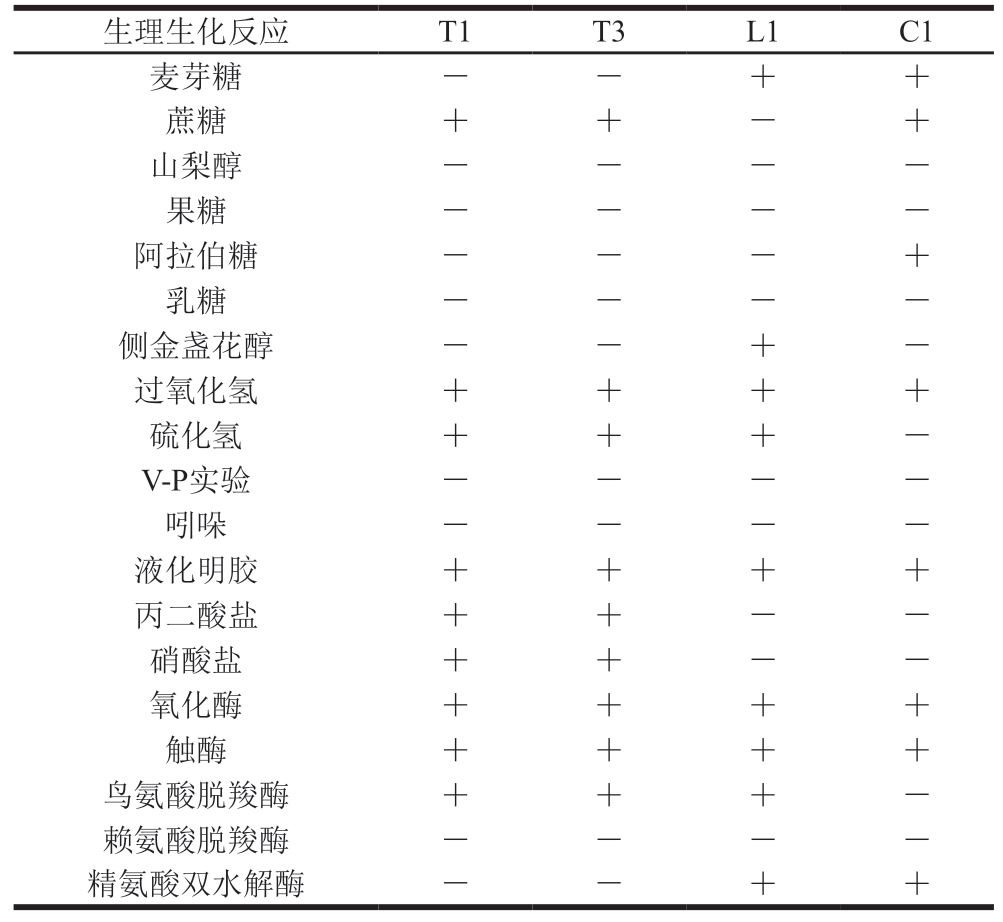
注:+. 阳性;-. 阴性。
?
2.4 16S rDNA分子鉴定及系统发育树构建
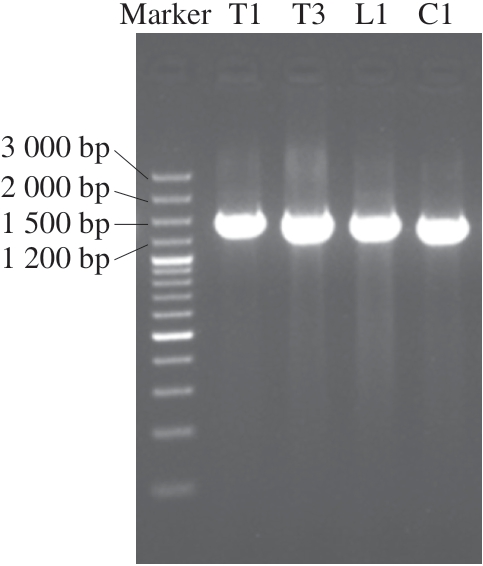
图3 16S rDNA PCR扩增产物电泳图
Fig. 3 Electrophoretograms of 16S rDNA PCR amplification products
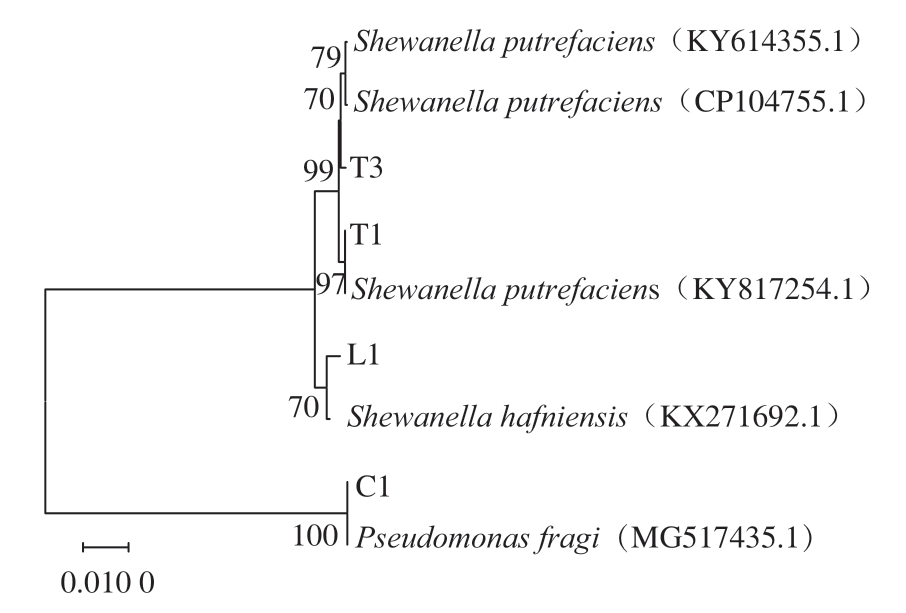
图4 基于16S rDNA序列同源性的4 株SSOs系统发育树
Fig. 4 Phylogenetic tree of four SSOs based on 16S rDNA sequences
以4 株菌株的总DNA为模板,通过PCR扩增细菌16S rDNA片段。由图3可知,4 株菌株均在约1 500 bp处有明显目的条带。将各菌株的16S rDNA片段通过BLAST检索系统进行序列比对分析以及构建系统进化树,由图4可知,T1、T3与腐败希瓦氏菌亲缘关系最近,L1与哈夫尼希瓦氏菌亲缘关系最近,C1与莓实假单胞菌亲缘关系最近。
2.5 SSOs致腐能力
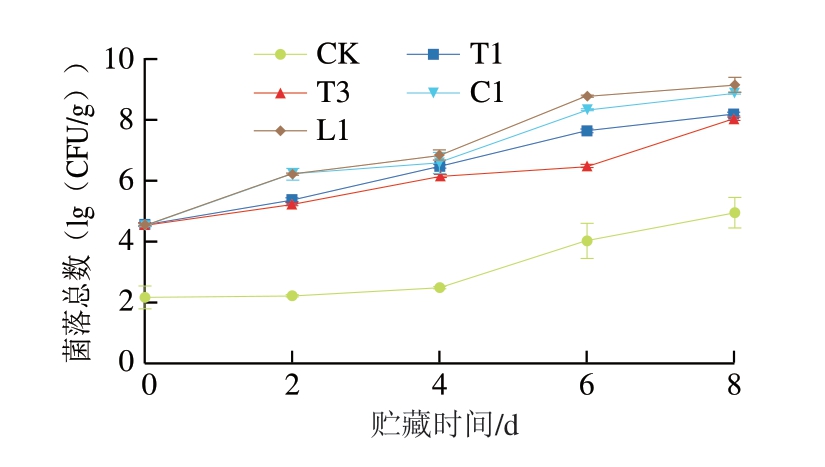
图5 接种4 株SSOs鱼片菌落总数随贮藏时间的变化
Fig. 5 Changes in total viable count of fish fillets inoculated with each of four SSOs
2.5.1 不同腐败菌对鮰鱼冷藏过程中菌落总数的影响
菌落总数能够反映淡水鱼产品中的蛋白质和氨基酸的代谢情况,由图5可知,冷藏期间各组肉样的菌落总数均呈持续增长趋势。贮藏2 d,L1和C1生长速度最快,T1、T3次之。贮藏6 d时,L1及C1菌落总数分别为8.31、8.74(lg(CFU/g)),已超过国际微生物规格委员会规定的食品微生物最高安全限值(7(lg(CFU/g))),表明鱼肉已超过供人们消费的最高菌落总数水平[28]。贮藏末期,接菌组鱼肉菌落总数都接近于8(lg(CFU/g))左右,显著大于对照组(P<0.05),而不同菌株的生长情况随贮藏时间呈现出差异性,这可能是因为不同菌株的致腐机制不同。6 d之后,接种腐败菌样品的菌落总数生长趋于稳定,这可能由于鮰鱼鱼肉中氧气、营养物质的消耗及生物胺和有机物质的积累抑制了微生物的生长,从而维持在相对稳定的数量级[29]。结果表明,希瓦氏菌及假单胞菌在鮰鱼中生长能力强,是鮰鱼中的SSOs[30]。
2.5.2 不同腐败菌对鮰鱼冷藏过程中TVB-N含量的影响
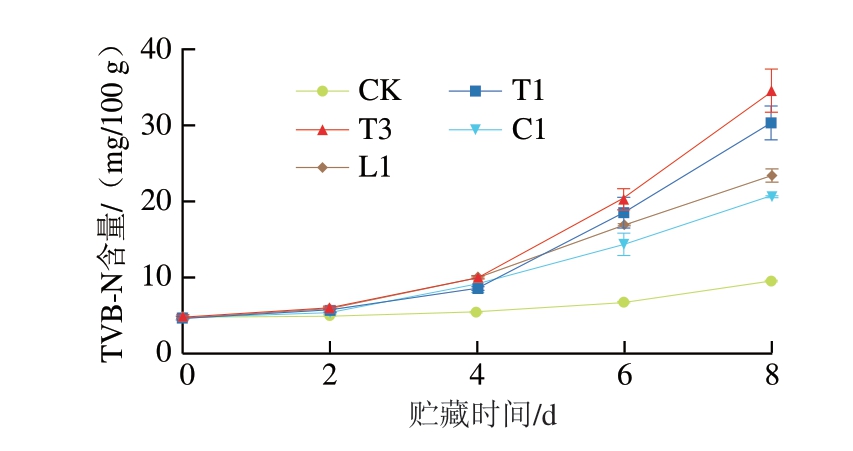
图6 接种4 株SSOs鱼片TVB-N含量随贮藏时间的变化
Fig. 6 Changes in TVB-N content of fish fillets inoculated with each of four SSOs
TVB-N含量可用于评价鱼肉新鲜度。由图6可知,随贮藏时间的延长,各组鱼肉TVB-N含量均呈上升趋势,并且接菌组的鱼肉TVB-N含量均高于对照组。因为淡水鱼在贮藏过程中TVB-N含量的产生主要是由于酶和微生物的作用导致蛋白质分解为具有挥发性的碱性物质,如氨、胺类等[31]。贮藏前4 d各组鱼肉TVB-N含量增长缓慢,贮藏6 d时各组上升趋势加快,T3组TVB-N含量为20.52 mg/100 g,而T1、L1、C1组均已超过一级鲜度(≤15 mg/100 g)[32],其中T1组贮藏6 d时增长速率最大。贮藏8 d时,T3组TVB-N含量已达到34.58 mg/100 g,T1组达到30.31 mg/100 g,均远超过二级鲜度(≤25 mg/100 g),L1、C1组分别为23.42、20.67 mg/100 g,相对于T1、T3组含量较低。Stohr等[33]研究表明,假单胞菌属对冷熏鲑鱼的产TVB-N能力有显著影响。Yi Zhengkai等[34]研究表明,从大眼金枪鱼中分离出的腐败希瓦氏菌具有很高的腐败潜力,与本研究结果一致。结合图5可以看出,随着菌落总数的提高,接种SSOs的鱼肉中的TVB-N含量也随之增加,说明SSOs的生长繁殖是鱼肉中TVB-N含量增加的主要原因。
2.5.3 SSOs腐败能力定量测定
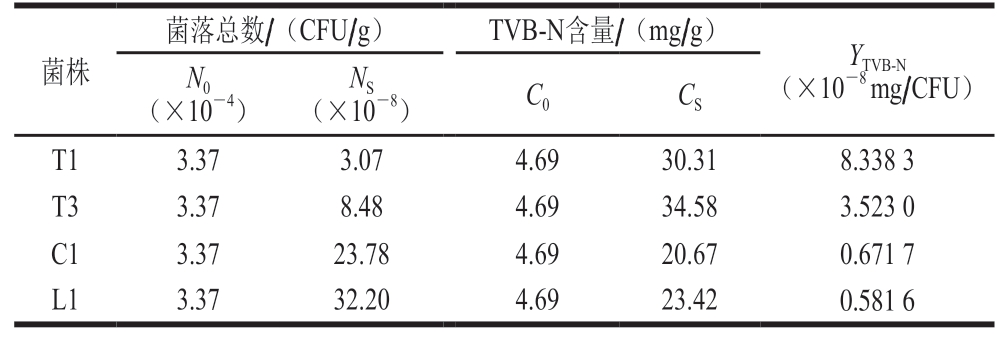
表4 4 株SSOs的YTVB-N
Table 4 YTVB-N of four SSOs
?
腐败代谢产物产量因子YTVB-N表示腐败菌致腐能力,通过测定腐败因子能确定货架期终点时单位数量污染菌产生腐败代谢产物的量。由表4可知,4 株SSOs致腐能力大小为:T1>T3>C1>L1,其中T1致腐能力最强,YTVB-N为8.33×10-8 mg/CFU,L1、C1两组的YTVB-N接近,致腐能力较弱,分别为0.58×10-8、0.67×10-8 mg/CFU。4 株SSOs的YTVB-N不同,能体现出不同SSOs导致鮰鱼腐败能力的差异[35-36]。
3 结 论
本研究从斑点叉尾鮰中分离出8 株腐败菌,接种于无菌鮰鱼片中,通过感官评定筛选出4 株SSOs T1、T3、L1、C1。对4 株SSOs进行菌落形态观察,结合生理生化指标及16S rDNA分子鉴定,得出T1、T3为腐败希瓦氏菌,L1为哈夫尼希瓦氏菌、C1为莓实假单胞菌。对4 株SSOs进行致腐能力测定,T1的腐败代谢产物产量因子YTVB-N最高,致腐能力最强,L1、C1YTVB-N相对较低,致腐能力较弱。可以通过对鮰鱼中的SSOs进行靶向抑制,从而延长鮰鱼的货架期。但水产品的腐败主要是由细菌群体感应调控的,下一步将对多种SSOs之间的相互作用及致腐能力进行更深入的研究,以期为冷藏鮰鱼的保鲜提供理论基础。
[1] MOHAMED M R, LI Dapeng, TIAN Xing, et al. Physiological responses of channel catfish (Ictalurus punctatus) reared at different stocking densities in a recirculating aquaculture system[J]. Aquaculture, 2022, 557: 738329. DOI:10.1016/j.aquaculture.2022.738329.
[2] 张艳凌, 许瑞红, 杨立, 等. 利用鮰鱼排开发高钙风味酱的配方研究[J]. 华中农业大学学报, 2020, 39(6): 88-95. DOI:10.13300/j.cnki.hnlkxb.2020.06.013.
[3] 姜启兴, 聂程芳, 高沛, 等. 斑点叉尾鮰鱼软罐头杀菌工艺研究[J].食品与生物技术学报, 2021, 40(3): 97-102. DOI:10.3969/j.issn.1673-1689.2021.03.012.
[4] MOUSA A A, RESHMA R, OZAN O, et al. Dietary transcinnamaldehyde improves oxidative stress response of channel catfish (Ictalurus punctatus) following Edwardsiella ictaluri infection[J]. Aquaculture, 2021, 532: 735985. DOI:10.1016/j.aquaculture.2020.735985.
[5] 陶晓雅, 杨振泉, 张辉, 等. 不同贮藏温度下斑点叉尾鮰鲜度及优势腐败菌群变化规律研究[J]. 食品科技, 2016, 41(12): 97-102.DOI:10.13684/j.cnki.spkj.2016.12.021.
[6] 姜晓娜, 孟璐, 冯俊丽, 等. 鲐鱼贮藏过程中的品质变化及腐败微生物多样性分析[J]. 中国食品学报, 2019, 19(10): 197-205.DOI:10.16429/j.1009-7848.2019.10.024.
[7] 励建荣. 海水鱼类腐败机制及其保鲜技术研究进展[J]. 中国食品学报, 2018, 18(5): 1-12. DOI:10.16429/j.1009-7848.2018.05.001.
[8] 郑振霄, 周聃, 冯俊丽, 等. 3 种保鲜方法对鲐鱼贮藏期间鲜度的影响[J]. 中国食品学报, 2016, 16(1): 181-187. DOI:10.16429/j.1009-7848.2016.01.025.
[9] HANSEN L T, GILL T, SUSANNE D R, et al. Importance of autolysis and microbiological activity on quality of cold-smoked salmon[J]. Food Research International, 1996, 29(2): 181-188.DOI:10.1016/0963-9969(96)00003-8.
[10] PAW D. Qualitative and quantitative characterization of spoilage bacteria from packed fish[J]. International Journal of Food Microbiology, 1995, 26(3): 319-333. DOI:10.1016/0168-1605(94)00137-u.
[11] SAELENS G, HOUF K. Systematic review and critical reflection on the isolation and identification methods for spoilage associated bacteria in fresh marine fish[J]. Journal of Microbiological Methods, 2022,203: 106599. DOI:10.1016/j.mimet.2022.106599.
[12] WANG Hang, LIU Xiaochang, ZHANG Yuemei, et al. Spoilage potential of three different bacteria isolated from spoiled grass carp(Ctenopharyngodon idellus) fillets during storage at 4 ℃[J]. LWTFood Science and Technology, 2016, 81: 10-17. DOI:10.1016/j.lwt.2016.11.010.
[13] TIAN Li, LUO Tao, ZHUANG Shuai, et al. The changes in physicochemical properties and microbiota composition of grass carp(Ctenopharyngodon idellus) under different aquaculture modes during 4 ℃ storage[J]. Journal of Food Processing and Preservation, 2021,46(1): 1-12. DOI:10.1111/jfpp.16188.
[14] 刘爱芳, 谢晶, 钱韻芳. 冷藏金枪鱼优势腐败菌致腐败能力[J]. 食品科学, 2018, 39(3): 7-14. DOI:10.7506/spkx1002-6630-201803002.
[15] 李婷婷, 陈思, 李欢, 等. 冷藏鲢鱼优势腐败菌致腐能力的初步分析[J]. 食品与发酵工业, 2017, 43(6): 140-145. DOI:10.13995/j.cnki.11-1802/ts.201706023.
[16] 赵欣宇, 孙卫青, 熊光权, 等. 冷藏鮰鱼片中优势腐败菌的分离鉴定[J]. 食品工业科技, 2020, 41(17): 104-108. DOI:10.13386/j.issn1002-0306.2020.17.017.
[17] ZHUANG Shuai, TAN Yuqing, HONG Hui, et al. Exploration of the roles of spoilage bacteria in degrading grass carp proteins during chilled storage: a combined metagenomic and metabolomic approach[J]. Food Research International, 2022, 152: 110926.DOI:10.1016/j.foodres.2021.110926.
[18] TAN Chunming, LI Pinglan, SHANG Nan. Novel perspective on the spoilage metabolism of refrigerated sturgeon fillets: nonspecific spoilage dominant organisms play an important role[J]. LWTFood Science and Technology, 2023, 173: 114292. DOI:10.1016/j.lwt.2022.114292.
[19] 鉏晓艳, 王玮琼, 陈玉霞, 等. 60Co-γ辐照剂量对鲈鱼感官和质构的影响[J]. 现代食品科技, 2017, 33(5): 202-206; 167. DOI:10.13982/j.mfst.1673-9078.2017.5.032.
[20] 曹琳, 曹东, 黄家秀, 等. 模糊感官评定与响应面法结合优化黄秋葵复合饮料配方[J]. 粮食与油脂, 2018, 31(8): 37-41.
[21] 希坎南R E. 伯杰氏细菌鉴定手册[M]. 北京: 科学出版社, 1989: 323-378.
[22] 赵宏强, 蓝蔚青, 孙晓红, 等. 冷藏鲈鱼片优势腐败菌的分离鉴定及致腐能力分析[J]. 中国食品学报, 2019, 19(8): 208-215.DOI:10.16429/j.1009-7848.2019.08.024.
[23] 国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准食品微生物学检验 菌落总数测定: GB 4789.2—2022[S]. 北京: 中国标准出版社, 2022: 12.
[24] 国家卫生和计划生育委员会. 食品安全国家标准 食品中挥发性盐基氮的测定: GB 5009.228—2016[S]. 北京: 国标准出版社, 2016: 3-5.
[25] 郑瑞生, 邹菊琴, 金兴珏, 等. 即食鲍鱼特定腐败菌的鉴定及其致腐能力研究[J]. 中国食品学报, 2021, 21(7): 307-312. DOI:10.16429/j.1009-7848.2021.07.037.
[26] 赵文宇, 徐璐, 祁立波, 等. 鲟鱼肌肉脱脂工艺研究[J]. 食品研究与开发, 2021, 42(12): 102-107. DOI:10.12161/j.issn.1005-6521.2021.12.017.
[27] DONG H P, LEE S Y, BYEON Y M, et al. Effect of supercooling storage applied with stepwise algorithm for fishes (Salmon and Olive flounder) and its freshness during extended storage[J]. Food Bioscience, 2022, 49: 101950. DOI:10.1016/j.fbio.2022.101950.
[28] MAVIS B C, ALBERT S P. Microorganisms in foods 2: sampling for microbiological analysis: principles and specific applications[J].Technometrics, 1974, 19(2): 221. DOI:10.1080/00401706.1977.10489539.
[29] GRAM L, HUSS H H. Microbiological spoilage of fish and fish products[J]. International Journal of Food Microbiology, 1996, 33(1):121-137. DOI:10.1016/0168-1605(96)01134-8.
[30] PARLAPAN F F, IOANNIS S. B. Monitoring of spoilage and determination of microbial communities based on 16S rRNA gene sequence analysis of whole sea bream stored at various temperatures[J]. LWT-Food Science and Technology, 2016, 66:553-559. DOI:10.1016/j.lwt.2015.11.007.
[31] KUNG H F, LIN C S, LIU S S, et al. High pressure processing extend the shelf life of milkfish flesh during refrigerated storage[J]. Food Control, 2022, 134: 108768. DOI:10.1016/j.foodcont.2021.108768.
[32] 吴成业, 叶玫, 王勤, 等. 几种淡水鱼在冻藏过程中鲜度变化研究[J].淡水渔业, 1994(1): 16-18.
[33] STOHR V, JOFFRAUD J J, CARDINAL M, et al. Spoilage potential and sensory profile associated with bacteria isolated from coldsmoked salmon[J]. Food Research International, 2001, 34(9): 797-806.DOI:10.1016/S0963-9969(01)00101-6.
[34] YI Zhengkai, XIE Jing. Assessment of spoilage potential and amino acids deamination and decarboxylation activities of Shewanella putrefaciens in bigeye tuna (Thunnus obesus)[J]. LWT-Food Science and Technology, 2022, 156: 113016. DOI:10.1016/j.lwt.2021.113016.
[35] 冯豪杰, 蓝蔚青, 臧一宇, 等. 优势腐败菌对暗纹东方鲀冷藏期间品质变化影响及致腐能力分析[J]. 食品科学, 2022, 43(1): 191-197.DOI:10.7506/spkx1002-6630-20210131-363.
[36] 王筱梦, 孙芝兰, 诸永志, 等. 羊肉屠宰加工场主要污染菌的分布及其对熟制羊肉的致腐能力[J]. 食品科学, 2017, 38(16): 261-267.DOI:10.7506/spkx1002-6630-201716042.