海参隶属于棘皮动物门(Echinodermata)、海参纲(Holothuroidea),是一种重要的无脊椎动物[1]。2021年我国海参养殖产量达22.2 万t,对比2020年增长13.3%,在众多经济水产品中占据重要地位[2]。海参具有丰富的营养价值和食疗养生功能,是典型的低胆固醇、低脂肪、低糖食品,富含多种维生素和氨基酸[3]。海参中还含有多种生物活性物质,如海参多糖[4]、海参皂苷[5]和脑 苷脂[6]等,其生物活性主要表现在抗凝血[7]、抗肿瘤[8]、抗血栓[9]和抗氧化[10]等方面。随着人们生活水平的提高及对营养、健康食品的需求日益增加,海参逐渐得到消费者青睐,消费需求不断增大,促进了我国海参产业链的良好发展。
海参具有高水分、高蛋白的原料特性,其体内含有丰富的内源性蛋白酶,极易发生自溶化皮现象,使得海参在加工、贮藏和运输过程中不可避免地发生蛋白质变性、质构劣变和营养物质损失等一系列品质变化,导致新鲜海参难以长时间贮藏和流通[11-12]。因此,市售海参多以加工制品和冷冻品为主。即食海参因其处理便捷、食用方便、营养损失少等优点而广受消费者喜爱,已成为主流的海参加工产品。目前即食海参多采用常压蒸煮、常压煮沸和高压蒸煮等加工方式,虽然处理过程会使海参内源酶钝化及微生物失活,但其剧烈的加工方式会导致即食海参在贮藏过程中发生非酶凝胶劣化,出现变黏、软化等现象,缩短了产品贮藏期,制约了海参制品的发展[13-14]。因此,采取高效、安全的保鲜措施,延缓或抑制新鲜海参和即食海参品质劣化速率,提高海参及其制品的贮藏稳定性,延长保质期,是迫切需要解决的问题。
因此,本文以新鲜海参和即食海参为主要对象,系统阐述海参贮藏保鲜过程中内源酶和微生物的作用机理,并对现有海参的贮藏保鲜技术研究进展进行系统综述,对未来发展趋势予以展望,以期推进相关研究,旨在为海参新型贮藏保鲜技术开发和进一步商业化应用提供理论参考。
1 海参贮藏保鲜机理
1.1 内源酶对海参贮藏品质的影响
海参体壁和内脏中含有大量内源性蛋白酶,蛋白酶体可以破坏胶原蛋白组织结构,使肌原纤维束中的肌动蛋白和肌球蛋白被降解,因此内源性蛋白酶在海参自溶水解过程中发挥重要作用[15-16]。海参内源性蛋白酶中,组织蛋白酶、基质金属蛋白酶等是使海参体壁胶原蛋白降解的主要内源酶之一。其中组织蛋白酶K可与海参硫酸软骨素偶联,形成致密结构胶原蛋白复合分子的同时进行多位点降解,并且还能对弹性蛋白和弹性纤维进行降解,使海参体壁弹性下降[17]。组织蛋白K对胶原蛋白的降解可在酸性和中性环境中进行,新鲜海参呈弱碱性,随着海参发生自溶降解,组织蛋白酶释放,导致pH值上升到适宜组织蛋白酶K进行降解的环境[18]。有研究表明,海参的组织蛋白酶K参与海参自溶降解过程,并且具有金属依赖性,金属离子Fe2+、Fe3+、Cu2+、Zn2+可抑制其活性[19]。基质金属蛋白酶包括降解胶原蛋白的胶原酶、降解明胶和基底膜蛋白的明胶酶和表现出底物特异性的基质溶素[20]。基质金属蛋白酶已被证实对海参有明显降解作用,可溶性糖胺聚糖的释放会引起胶原纤维间蛋白多糖桥断裂,此外,可溶性羟脯氨酸和吡啶交联物的释放会引起胶原纤维完全解聚成单个胶原纤维或胶原纤维 束[21-23]。因此在新鲜海参贮藏保鲜过程中,可以通过添加相关酶抑制剂来降低海参内源酶的活性。基质金属蛋白酶在酶抑制剂乙二胺四乙酸二钠和1,10-菲罗啉的共同作用下几乎可以完全抑制其酶活力[23]。乳清蛋白和碘乙酸可以抑制90%以上的组织蛋白酶K活性,从而延缓海参中肌动蛋白和肌球蛋白的降解[24]。此外,海参中组织蛋白酶B[25]、组织蛋白酶L[26]、碱性磷酸酶[27]和酸性磷酸酶[28] 等也都被证实参与海参自溶过程。目前对不同种类蛋白酶抑制剂方面仍需要进一步的研究,应致力于找到安全、高效的蛋白酶抑制剂,来延缓海参体壁自溶。
现有即食海参加工工艺主要包括:其一,利用干制海参经过复水工艺制成即食海参,如盐干、冻干和淡干海参等,其加工过程都需要经过高温水煮,水煮过程可使海参内源酶失活;其二,利用新鲜海参经过高温、高压蒸煮、调味、杀菌等工艺流程直接制成即食海参制品,其内源酶在蒸煮过程中失活,从而可避免自溶对即食海参贮藏保鲜的影响[29]。前期研究结果表明,20~40 ℃内源酶活力随温度升高逐渐增加,45 ℃时内源酶活性最高,后续随着温度持续升高酶活力降低,80 ℃时海参中内源酶被完全灭活[30]。因此,在即食海参的加工过程中高温使内源酶钝化,通常不会因为内源酶的作用而影响即食海参品质。新鲜海参中不同内源酶最适温度及pH值如表1所示。
表1 新鲜海参中不同内源酶最适温度及p 值
值
Table 1 Optimal temperature and pH for different endogenous enzymes in fresh sea cucumber
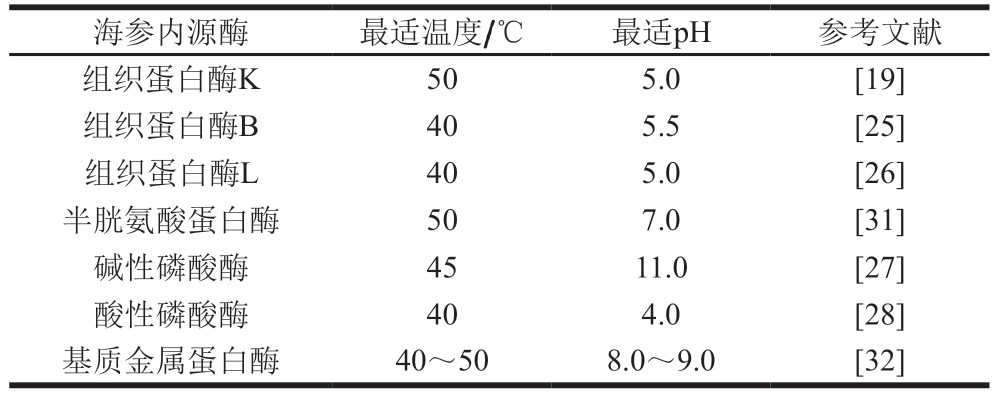
海参内源酶 最适温度/℃ 最适pH 参考文献组织蛋白酶K 50 5.0 [19]组织蛋白酶B 40 5.5 [25]组织蛋白酶L 40 5.0 [26]半胱氨酸蛋白酶 50 7.0 [31]碱性磷酸酶 45 11.0 [27]酸性磷酸酶 40 4.0 [28]基质金属蛋白酶 40~50 8.0~9.0 [32]
1.2 微生物对海参贮藏品质的影响
微生物在生长繁殖过程中会产生蛋白酶、酯酶等代谢产物,不断分解利用海参体内的蛋白质、糖类和脂质等营养元素,产生不良风味物质,如胺类、醛类、硫化物和有机酸等,破坏海参营养价值,致使海参腐败变质[33]。 目前海洋污染严重,不同的水域、水质情况对海参微生物均有不同程度的影响,微生物种类不同,致腐能力也有所差异[34-35]。新鲜海参中存在的优势腐败菌极易使海参品质劣化,从大连产海参的体表和肠道中检测出2 株优势腐败菌和1 株致病菌,其中1 株腐败菌为革兰氏阴性菌玫瑰色考克氏菌(Kocuria rosea),被发现大量存在于海参中,可以分解海参体壁中的酪蛋白,使海参腐败变质;从海参呼吸树中检测出腐败菌为棒状杆菌,具有分解海参体壁胶原蛋白的能力,造成营养物质损失和品质劣化;海参消化道中检出少量致病菌有毒威克斯菌,能使海参在贮藏流通过程中逐渐发生腐败分解[36]。
虽然即食海参在加工过程中微生物被灭活,但随着贮藏时间的延长也会发生腐败现象。在腐败的即食海参中发现了蜂房哈夫尼菌(Hafnia alvei),为革兰氏阴性菌,具有耐低温特性,是造成即食海参腐败分解的主要优势腐败菌之一[37-38]。前期研究表明,蜂房哈夫尼菌可能附着在加工器械的表面进入食品中,导致其腐败变质,在即食海参中可能来源于真空包装、气调包装及相关生产设备,具有较强的群体感应活性,会产生N-酰基高丝氨酸内酯(N-acylhomoserine lactone,AHLs)类信号分子,AHLs能够启动微生物中相关基因表达,进而对其腐败特性起到调控作用[39-41]。从已腐败的即食海参中提取的蜂房哈夫尼菌H4菌株可以分泌AHLs,其活性随着菌株的密度发生变化,而群体感应系统受环境因素影响,不同pH值、含盐量、碳源和氮源都可能引起AHLs变化,不利于菌株生长[42]。因此在即食海参贮藏稳定性相关方面研究,可以通过控制外界环境因素抑制AHLs信号分子分泌量,激活其微生物群体感应系统,从而控制即食海参贮藏腐败。此外,在即食海参相关研究中发现,蜂房哈夫尼菌H4群体感应LuxR/I系统对其生物被膜的形成和泳动性起到调控作用,可通过基因敲除法去除luxI基因,使其无法合成AHLs[43]。因此可以通过作用于海参群体感应系统,控制微生物生物被膜的形成和泳动性,以减少即食海参贮藏时腐败菌的生长。当前即食海参微生物种类的研究较少,微生物是食品腐败的主要因素之一,因此,研究群体感应系统与即食海参腐败之间的关系并揭示其作用机制对开发即食海参贮藏保鲜新方法具有重要意义。环境因素对即食海参中AHLs的影响如表2所示。
表2 环境因素对即食海参中A Ls的影响[42]
Ls的影响[42]
Table 2 Effects of environmental factors on AHLs in ready-to-eat sea cucumber[42]

环境因素 蜂房哈夫尼菌H4分泌AHLs活性NaCl 高盐分抑制AHLs活性pH 弱酸、弱碱抑制AHLs活性温度 低温抑制AHLs分泌碳源 葡萄糖和麦芽糖可抑制AHLs分泌氮源 酪蛋白胨可抑制AHLs活性
2 海参贮藏保鲜技术的应用
2.1 低温保鲜
在新鲜海参低温保鲜中,冷藏(0~4 ℃)和冰温(0~-2 ℃)保鲜较为常见。低温保鲜原理是通过降低温度来抑制酶活性和微生物生长,冷藏保鲜技术可以使海参温度降低至冰点附近,且不形成冰晶[44]。这种保鲜技术可以在一定程度上抑制腐败菌生长繁殖,因其技术简单、易被实现,冷藏保鲜被大量研究并应用于实际工厂海参生产加工过程中[45]。由于新鲜海参体壁水分含量较高,在冷藏条件下难以长时间抑制内源酶活性和腐败菌生长,从而难以维持较高品质口感和感官特性。随着贮藏时间的延长,海参逐渐自溶分解,出现软烂化皮现象。在4 ℃冷藏条件下,贮藏5 d时海参尚能保持完整形态,随着贮藏时间的延长,海参体壁逐渐分解,30 d之后海参已经失去完整形态;此外,冷藏过程中海参质构特性会随着时间的延长发生显著变化,在自身酶解和腐败菌生长作用下,海参体壁发生软化,弹性、咀嚼性、硬度和凝聚性等感官特性变化均与时间呈负相关[46]。此外,海参的持水能力也随贮藏时间延长呈现下降趋势,与海参新鲜度有关的指标K值和腐败指标总挥发性盐基氮含量呈线性增加[47];同时与胶原蛋白降解有关的组织蛋白酶被激活,其酶活力变化呈现先上升后降低的趋势[48]。 有研究将海参分别贮藏在0、5、15、20 ℃条件下,通过研究其营养指标和新鲜度指标,得出海参在0 ℃下进行冰温贮藏效果最佳的结论,冰温贮藏条件能有效减少海参中营养物质损失,并且能使海参保持较好的新鲜度[49]。生产过程中,低温贮藏常与其他保鲜工艺结合,如超高压保鲜、生物保鲜剂、臭氧保鲜、气调保鲜等,以达到更好的保鲜效果[44]。低温保鲜不仅能很好地保存海参营养价值、原有风味和外观质量,同时具有操作简单的特点,适用于处理和贮藏大批量新鲜海参。
在即食海参的研究中,常规采用冷藏和冷冻贮藏,为了方便贮运及延长产品货架期,研究不同贮藏温度(20~60 ℃)对即食海参保质期的影响。经过加工处理制成的即食海参,排除了微生物和内源酶活性对海参后续贮藏过程中组织结构变化的影响,但在贮藏过程中仍会发生品质劣化现象[50]。其原因是即食海参在后续贮藏期间体壁胶原蛋白的三股螺旋结构解开,断裂成无规则卷曲形状的分子链,同时伴随能量的释放,胶原蛋白裂解导致即食海参品质变化[51]。通过对比4、20、37 ℃贮藏条件下即食海参的质构特性变化,发现其硬度和咀嚼性随贮藏时间延长而呈现逐渐下降的趋势,且下降趋势与贮藏温度显著正相关,说明4 ℃冷藏条件下能够有效缓解即食海参品质劣化[52]。通过对比4、20、37、50、60 ℃贮藏条件下即食海参弹性变化,发现4 ℃冷藏条件下弹性无明显变化,随着贮藏温度的升高弹性逐渐减小,说明在4 ℃冷藏条件下能有效维持即食海参体壁弹性[53]。此外,即食海参体壁组织结构会随着温度的升高出现逐渐降解的现象,因此采用低温贮藏即食海参能有效减缓海参体壁的降解程度,从而延长即食海参货架期[13]。采用低温贮藏时还需注意即食海参贮藏过程中需要避免温度波动,因为即食海参经过反复冻融后会形成冰晶,破坏即食海参组织结构,这会导致自由水和可溶性蛋白质流失,使即食海参营养价值和感官特性有所降低[54]。不同贮藏温度下即食海参微观结构及质构特性变化如表3所示。
表3 不同贮藏温度下即食海参微观结构及质构特性变化
Table 3 Changes in microstructure and texture of instant sea cucumber under different storage temperatures

贮藏温度/℃ 微观结构 质构特性 参考文献4 体壁组织结构完整,无明显断裂情况 硬度、咀嚼性下降,弹性无明显变化 [53]20 体壁组织结构较为完整 硬度、咀嚼性下降,弹性减小 [52]25 胶原纤维束逐渐混乱 硬度、咀嚼性下降,弹性减小 [50,55]37 体壁组织呈片层状结构 弹性减小,黏聚性和回复性无明显相关性 [56]60 体壁组织呈泡沫状结构 弹性减小,黏聚性和回复性无明显相关性 [13]
2.2 保鲜剂保鲜
在海参贮藏过程中,由于微生物生长、自身内源酶和环境因素等作用发生自溶,导致海参质构发生改变,蛋白质腐败变质生成组胺、三甲胺和一些醛类、 酮类等[57]。保鲜剂技术是通过添加各种化学或生物成分,达到杀菌、抑菌的作用,阻止醛类、酮类等的生成,从而起到对海参的保鲜效果,延长产品货架期[58]。现阶段,已报道利用乳酸链球菌、链霉菌和木醋液保鲜剂进行新鲜海参保鲜方面的研究。乳酸链球菌在生长代谢过程中合成分泌具有极强杀菌作用的乳酸链球菌素,通过阻碍细菌基因转录和细胞壁合成,从而抑制芽孢杆菌、大多数革兰氏阳性菌和少数革兰氏阴性菌的生长,并且在人体内会被α-胰凝乳蛋白酶降解成氨基酸,食用后对人体无负面影响[59];链霉菌在发酵过程中生成具有抗菌作用的天然防腐剂纳他霉素,低浓度下亦能有效抑制真菌、霉菌和酵母菌的生长,并且对人体不产生毒害作用[60]。在0 ℃冰温条件下,单独或复合利用乳酸链球菌素和纳他霉素2 种保鲜剂对鲜活海参进行保鲜,能够减少海参营养成分损失,在不影响鲜活海参生理生化指标的条件下,还能够有效维持其生命活力[61]。相关研究对比乳酸链球菌素保鲜剂、纳他霉素保鲜剂和臭氧化盐保鲜剂作用下,于0 ℃冰温条件下贮藏的海参,发现三者均能有效延缓海参硬度下降速率,通过对海参挥发性物质进行分析,发现醇类化合物种类及相对含量最高,其中 5-癸烯-1-醇可能是一种海参腐败特征性风味化合物,经乳酸链球菌素处理后,5-癸烯-1-醇含量显著低于纳他霉素处理组,说明乳酸链球菌素保鲜效果优于纳他霉素,可能是因为细菌是导致海参腐败的主要因素,乳酸链球菌素对细菌的作用较强,而纳他霉素主要作用于霉菌,此外,臭氧化盐抑菌作用较强,但半衰期短,随着贮藏时间的延长,抑菌效果逐渐减弱[62]。木醋液中含有酚类、酮类和有机酸类等物质,在多种成分相互作用下具有抑菌保鲜效果[63]。利用不同浓度木醋液对0 ℃冰温贮藏的新鲜海参进行处理,通过对比0.1%、0.3%、0.5%、1.5%、2.5%和3.5%几种不同体积分数的木醋液,得到0.5%木醋液保鲜效果更佳,能使海参保持较好形态、硬度、回复性、弹性及营养成分,还能够延缓海参腐败及挥发性气味的变化,而体积分数1.5%以上的木醋液不适宜用于新鲜海参。利用0.5%木醋液、ε-聚赖氨酸和乳酸链球菌素进行复配,发现该复合保鲜剂同0.5%木醋液相比,对新鲜海参保鲜效果无明显差异,但复合保鲜剂能更好地延缓新鲜海参硬度下降[64-65]。以上研究证明在海参保鲜剂的研究方面,可以通过挖掘不同保鲜剂的作用优势,再通过不同保鲜剂复配或与其他保鲜技术相结合的方式,使海参具有更好的保鲜效果。
2.3 超高压保鲜
超高压保鲜是指在常温或较低温度下,对包装食品施加100~1 000 MPa的压力,达到抑制酶活性、微生物灭活和保鲜的效果[66]。超高压处理过程中,新鲜海参内源酶活力会随着压力的增加逐渐下降,主要原因是超高压技术使内源酶钝化,失去活性[67]。超高压处理过程中海参中淀粉酶活力会呈现先上升的趋势是因为在100 MPa的压力下,被包埋的淀粉酶被释放,当压力达到200 MPa及以上时,淀粉酶活性被抑制,淀粉酶活力开始呈现逐渐下降的趋势[68]。新鲜海参经高压处理后其pH值较未处理组略增,但随着贮藏时间的延长整体呈缓慢下降趋势,在贮藏末期有所增加,可能是因为高压处理使其蛋白质变性,引起新鲜海参pH值增加,而贮藏前期在糖原酵解作用下产生乳酸、磷酸肌酸等物质而导致pH值降低,在贮藏后期,由于超高压作用使蛋白质伸展开,促进氨基酸等含氮物质分解,产生碱性含氮物,使其pH值升高[69-70]。新鲜海参可以通过延长保压时间和增大处理压力来提高超高压技术的杀菌保鲜效果,通过正交试验得到最佳保鲜效果的参数为处理压力500 MPa、pH 6.5、超高压处理时间30 min[71]。以新鲜海参、超高压海参、超高压烫漂后的即食海参和盐渍复水即食海参为研究对象,发现超高压海参和超高压烫漂后的即食海参在4 ℃冷藏条件下贮藏保质期为28 d,并且其质构特性明显优于新鲜海参和盐渍复水的即食海参[72]。研究超高压处理海参软罐头在室温(25 ℃)和冷藏(4 ℃)条件下的品质变化,得到钝化酶的最佳工艺为在15 ℃条件下600 MPa超高压处理30 min,海参软罐头在室温(25 ℃)和冷藏(4 ℃)条件下保质期分别为60、90 d,其中冷藏条件下的海参软罐头品质更佳[68]。
在海参贮藏过程中,超高压保鲜技术具有操作简单、安全性高、应用范围广、环保、高效的特点,在维持品质和营养价值方面具有一定的优势,在海参保鲜方面具有广阔的发展前景[73]。但经过超高压处理的海参在后续贮藏过程中会发生胶原纤维断裂、水分迁移和蛋白质降解等非酶凝胶劣化现象,使海参体壁劣化,影响即食海参品质口感[74]。因此,在充分利用超高压保鲜优势的同时,深入研究和避免非酶凝胶劣化现象是关键,也是该技术在海参保鲜应用中的研究热点和主要方向。
2.4 臭氧保鲜
利用臭氧技术对食品进行保鲜在国外已较普遍,臭氧作为强氧化剂具有杀菌能力强、可自行分解、绿色环保等优点,其缺点是分解后其杀菌效率降低,稳定性较差,在海参臭氧保鲜的操作过程中还应注意控制臭氧浓度,浓度较高时对人体有害[75]。臭氧保鲜原理是通过破坏微生物细胞结构使细胞凋亡,或者直接破坏微生物遗传物质使细胞死亡[76]。新鲜海参可以利用臭氧结合果蔬清洗剂和R-多糖(克霉王)进行协同保鲜,果蔬清洗剂具有较好的杀菌、抑菌作用;R-多糖的主要成分是溶菌酶和壳聚糖等,无毒无害,具有抑制细菌、酵母菌和霉菌的特点[77-79]。臭氧结合果蔬清洗剂和R-多糖能使海参维持较好的感官特性和新鲜度,新鲜海参的保质期可延长至7 d,其最佳工艺为臭氧处理时间20 min、果蔬清洗剂稀释2 倍、控制pH 6.5~7.0、R-多糖体积分数0.5%[79]。臭氧还能与微波技术和食品防腐剂肉桂醛结合对新鲜海参进行保鲜,其最佳工艺为体积分数0.15%肉桂醛溶液,协同臭氧处理20 min,微波处理18 min,能够有效抑制微生物生长,延长保质期[80]。
2.5 交联剂保鲜
目前,海参交联剂保鲜的相关研究主要针对即食海参产品,交联剂可以提高即食海参贮藏稳定性,防止海参体壁非酶凝胶化。通过植物提取物稳定海参体壁胶原蛋白结构,进而提高即食海参品质的研究方向成为热点。植物多酚作为植物提取物的主要成分属于天然交联剂,多酚中富含大量酚羟基,可以与胶原蛋白、多糖等大分子化合物产生的氢键发生化学反应,可以通过稳定胶原蛋白的三螺旋结构,进一步促进分子间的交联,从而改善即食海参贮藏稳定性[81]。酚类物质和胶原蛋白交联会使海参体壁中游离羟基和游离醛基含量减少,降低海参的亲水性,导致即食海参体壁水分含量下降,硬度和弹性有所增加[82]。随着贮藏时间的延长,海参形态、气味和质地等均发生一定程度劣化,植物提取物在贮藏前2 周能使海参维持良好形态和外观,除具有植物提取物本身气味外无其他不良风味产生,使海参具有较好的感官特性[56]。此外,交联剂中酚类化合物的羟基能够与胶原蛋白的羟基、氨基结合形成氢键,将即食海参体壁中自由水逐渐转化为结合水,发生水分迁移[51]。即食海参贮藏稳定性与水分状况关系密切,高水分含量使海参在贮藏期间结构更易受损,适量降低水分含量可减少胶原纤维断裂情况,缓解凝胶劣化现象[83]。因此,在交联剂作用下,即食海参水分含量变化和水分迁移更有益于提高贮藏稳定性。
目前已证实,利用五倍子和诃子植物提取物中富含的酚羟基结构与海参胶原蛋白之间发生共价结合,可以达到稳定海参体壁胶原纤维的作用,同时可以降低即食海参体壁水分含量和水分活度,实现延长保质期的目的[56]; 利用富含多酚的绿茶提取物和没食子酸与即食海参进行交联,可改善海参体壁胶原蛋白降解情况,使其硬度与弹性有所提高,从而改善即食海参的质构特性,延长货架期[84];芹菜提取物和绿原酸中的酚类成分也可以与即食海参发生分子交联,改善海参体壁水分迁移和胶原蛋白降解情况,进而有效提高即食海参贮藏稳定性[85]; 芹菜、黄瓜提取物、有机酸和多酚提取物协同作用均可有效提高即食海参贮藏稳定性[86-87]。此外,转谷氨酰胺酶也可交联海参,可将即食海参在冷藏状态下的保质期延长到1 年,室温条件下的保质期高达3 个月[88]。
3 结 语
目前国内外学者对海参贮藏保鲜机理和保鲜技术进行了多方面的研究,取得了很大进展。本文以新鲜海参和即食海参为主要研究对象,对贮藏保鲜过程中内源酶和微生物的作用机理进行了系统阐述,梳理归纳了相关保鲜技术,如低温保鲜、保鲜剂保鲜、超高压保鲜、臭氧保鲜和交联剂保鲜的研究进展。在此基础上,对海参保鲜机理及保鲜技术发展趋势进行展望:1)海参保鲜相关研究目前尚在起步阶段,海参微生物致腐机制方面还有待进一步研究,海参自溶方面,应致力于寻找安全、高效的蛋白酶抑制剂,以期延缓海参体壁自溶;2)部分保鲜技术成本较高,缺乏实际生产加工过程验证,如交联剂保鲜虽然能达到较好的保鲜效果,但其有效成分含量较低,提取较为复杂。因此,仍需以开发经济适用型保鲜技术为研究重点,关注不同保鲜技术的协同效用,在能够达到良好保鲜效果的同时减少单一保鲜技术的成本。
[1] SONG Zhuoyue, LI Hailun, WEN Jing, et al. Consumers’ attention on identification, nutritional compounds, and safety in heavy metals of Canadian sea cucumber in Chinese food market[J]. Food Science and Nutrition, 2020, 8(11): 5962-5975. DOI:10.1002/fsn3.1882.
[2] 农业部渔业管理局. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2022: 21-29.
[3] 杨林彤, 黄栋, 周建华, 等. 海参营养价值与主要功效成分的研究进展[J]. 食品科技, 2022, 47(2): 168-172. DOI:10.13684/j.cnki.spkj.2022.02.019.
[4] 安子哲, 张朝辉, 刘梦阳, 等. 海参硫酸多糖化学组成与结构的研究进展[J]. 食品科学, 2022, 43(7): 289-297. DOI:10.7506/spkx1002-6630-20210315-189.
[5] ZHAO Yingcai, XUE Changhu, ZHANG Tiantian, et al. Saponins from sea cucumber and their biological activities[J]. Journal of Agricultural and Food Chemistry, 2018, 66(28): 7222-7237. DOI:10.1021/acs.jafc.8b01770.
[6] 韦豪华, 张红玲, 李兴太. 海参化学成分及生物活性研究进展[J]. 食品安全质量检测学报, 2017, 8(6): 2054-2061. DOI:10.3969/j.issn.2095-0381.2017.06.019.
[7] LUO Lan, WU Mingyi, XU Li, et al. Comparison of physicochemical characteristics and anticoagulant activities of polysaccharides from three sea cucumbers[J]. Marine Drugs, 2013, 11(2): 399-417. DOI:10.3390/md11020399.
[8] 金情, 滕瑶, 胡晓群, 等. 海参多糖抗肿瘤作用机制的研究进展[J]. 浙江医学, 2019, 41(3): 4300-4303. DOI:10.12056/j.is sn.1006-2785.2019.41.3.2018-2412.
[9] PAULO A S, MOURO, MARCO A M, et al. Antithrombotic activity of a fucosylated chondroitin sulphate from echinoderm: sulphated fucose branches on the polysaccharide account for its antithrombotic action[J]. British Journal of Haematology, 1998, 101(4): 647-652. DOI:10.1046/j.1365-2141.1998.00769.x.
[10] ZHOU Tianyi, XIANG Xingwei, DU Ming, et al. Protective effect of polysaccharides of sea cucumber Acaudina leucoprocta on hydrogen peroxide-induced oxidative injury in RAW264.7 cells[J]. International Journal of Biological Macromolecules, 2019, 139(15): 1133-1140. DOI:10.1016/j.ijbiomac.2019.08.092.
[11] 吕兴霜, 张永勤, 王鹏博, 等. 海参体壁自溶机制及其控制技术的研究进展[J]. 食品工业科技, 2020, 41(3): 327-331. DOI:10.13386/j.issn1002-0306.2020.03.054.
[12] 颜龙杰. 刺参(Stichopus japonicas)胶原蛋白及自溶相关蛋白酶的 研究[D]. 厦门: 集美大学, 2019: 2-14.
[13] 林琳, 孙霄, 侯虎. 贮藏温度对高温高压海参体壁组织结构变化的作用[J]. 食品与发酵工业, 2019, 45(19): 194-199. DOI:10.13995/j.cnki.11-1802/ts.021189.
[14] GU Pan, QI Shizhe, ZHAI Ziyang, et al. Comprehensive proteomic analysis of sea cucumbers (Stichopus japonicus) in thermal processing by HPLC-MS/MS[J]. Food Chemistry, 2022, 373: 131368. DOI:10.1016/j.foodchem.2021.131368.
[15] ROBERT N, BRIAND M, TAYLOR R, et al. The effect of proteasome on myofibrillar structures in bovine skeletal muscle[J]. Meat Science, 1999, 51(2): 149-153. DOI:10.1016/S0309-1740(98)00113-2.
[16] DUTAUD D, AUBRY L, GUIGNOT F, et al. Bovine muscle 20S proteasome. II: contribution of the 20S proteasome to meat tenderization as revealed by an ultrastructural approach[J]. Meat Science, 2006, 74(2): 337-344. DOI:10.1016/j.meatsci.2006.03.026.
[17] HELSKE S, SYVÄRANTA S, LINDSTEDT K A, et al. Increased expression of elastolytic cathepsins S, K, and V and their inhibitor cystatin C in stenotic aortic valves[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2006, 26(8): 1791-1798. DOI:10.1161/01.ATV.0000228824.01604.63.
[18] LI Zhenqiang, HOU Wushiun, ESCALANTE-TORRES C R, et al. Collagenase activity of cathepsin K depends on complex formation with chondroitin sulfate[J]. Journal of Biological Chemistry, 2002, 277(32): 28669-28676. DOI:10.1074/jbc.M204004200.
[19] 季晓彤, 王玲, 薛鹏, 等. 海参组织蛋白酶K的部分酶学性质及其对海参自溶的影响[J]. 中国农业大学学报, 2017, 22(9): 72-77. DOI:10.11841/j.issn.1007-4333.2017.09.09.
[20] SINGH A, NELSON-MOON Z L, THOMAS G J, et al. Identification of matrix metalloproteinases and their tissue inhibitors type 1 and 2 in human masseter muscle[J]. Archives of Oral Biology, 2000, 45(6): 431-440. DOI:10.1016/S0003-9969(00)00020-0.
[21] GARNERO P, BOREL O, BYRJALSEN I, et al. The collagenolytic activity of cathepsin K is unique among mammalian proteinases[J]. The Journal of Biological Chemistry, 1998, 273(48): 32347-32352. DOI:10.1074/jbc.273.48.32347.
[22] SUN Liming, WANG Tingting, ZHU Beiwei, et al. Effect of matrix metalloproteinase on autolysis of sea cucumber Stichopus japonicus[J]. Food Science Biotechnology, 2013, 22(5): 1-3. DOI:10.1007/s10068-013-0210-x.
[23] LIU Ziqiang, LIU Yuxin, ZHOU Dayong, et al. The role of matrix metalloprotease (MMP) to the autolysis of sea cucumber (Stichopus japonicus)[J]. Journal of the Science of Food Agriculture, 2019, 99(13): 5752-5759. DOI:10.1002/jsfa.9843.
[24] WU Haitao, LI Dongmei, ZHU Beiwei, et al. Proteolysis of noncollagenous proteins in sea cucumber, Stichopus japonicus, body wall: characterisation and the effects of cysteine protease inhibitors[J]. Food Chemistry, 2013, 141(2): 1287-1294. DOI:10.1016/j.foodchem.2013.03.088.
[25] ZHENG Jie, WU Haitao, ZHU Beiwei, et al. Identification of antioxidative oligopeptides derived from autolysis hydrolysates of sea cucumber (Stichopus japonicus) guts[J]. European Food Research Technology, 2012, 234(5): 895-904. DOI:10.1007/s00217-012-1708-9.
[26] ZHU Beiwei, ZHAO Lulu, SUN Liming, et al. Purification and characterization of a cathepsin L-like enzyme from the body wall of the sea cucumber Stichopus japonicus[J]. Bioscience, Biotechnology, and Biochemistry, 2008, 72(6): 1430-1437. DOI:10.1271/bbb.70741.
[27] WU Haitao, LI Dongmei, ZHU Beiwei, et al. Purification and characterization of alkaline phosphatase from the gut of sea cucumber Stichopus japonicus[J]. Fisheries Science, 2013, 79(3): 477-485. DOI:10.1007/s12562-013-0613-x.
[28] ZHU Beiwei, YU Jianwei, ZHANG Zongshen, et al. Purification and partial characterization of an acid phosphatase from the body wall of sea cucumber Stichopus japonicus[J]. Process Biochemistry, 2009, 44(8): 875-879. DOI:10.1016/j.procbio.2009.04.010.
[29] 常耀光, 刘艳艳, 石菲菲, 等. 海参在加工过程中的组分与食品结构变化[J]. 水产学报, 2022, 46(7): 1129-1142. DOI:10.11964/jfc.20220513486.
[30] 李秀芬, 牛海玲, 张蕊, 等. 海参蛋白酶体的提取及其酶学性质研究[J]. 中国食品学报, 2013, 13(12): 65-70. DOI:10.16429/j.1009-7848.2013.12.027.
[31] QI H, DONG X P, CONG L N, et al. Purification and characterization of a cysteine-like protease from the body wall of the sea cucumber (Stichopus japonicus)[J]. Fish Physiology Biochemistry, 2007, 33(2): 181-188. DOI:10.1007/s10695-007-9129-6.
[32] WU Hailong, HU Yaqin, SHEN Jiandong, et al. Identification of a novel gelatinolytic metalloproteinase (GMP) in the body wall of sea cucumber (Stichopus japonicus) and its involvement in collagen degradation[J]. Process Biochemistry, 2013, 48(5/6): 871-877. DOI:10.1016/j.procbio.2013.04.011.
[33] HOLDEN M T, RAM CHHABRA S, DE NYS R, et al. Quorumsensing cross talk: isolation and chemical characterization of cyclic dipeptides from Pseudomonas aeruginosa and other Gram-negative bacteria[J]. Molecular Microbiology, 1999, 33(6): 1254-1266. DOI:10.1046/j.1365-2958.1999.01577.x.
[34] 柴英辉, 范鑫昊, 刘胜男, 等. 海参肠道微生物的形成与影响因素研究进展[J]. 天津农学院学报, 2019, 26(2): 84-88. DOI:10.19640/j.cnki.jtau.2019.02.019.
[35] DALGAARD P, MADSEN H, SAMIEIAN N, et al. Biogenic amine formation and microbial spoilage in chilled garfish (Belone belone belone): effect of modified atmosphere packaging and previous frozen storage[J]. Journal of Applied Microbiology, 2006, 101(1): 80-95. DOI:10.1111/j.1365-2672.2006.02905.x.
[36] 向怡卉, 苏秀榕, 董明敏, 等. 海参细菌的分离鉴定和生长特性研究[J]. 中国食品学报, 2006, 6(1): 25-29. DOI:10.16429/j.1009-7848.2006.01.006.
[37] 葛静慧, 崔玉娜, 王晶, 等. 即食海参优势腐败菌群体感应信号分子识别[J]. 中国食品学报, 2015, 15(11): 186-191. DOI:10.16429/j.1009-7848.2015.11.028.
[38] PADILLA D, REMUZGO-MARTÍNEZ S, ACOSTA F, et al. Hafnia alvei and Hafnia paralvei taxonomy defined but still far from virulence and pathogenicity[J]. Veterinary Microbiology, 2013, 163(1/2): 200-201. DOI:10.1016/j.vetmic.2012.11.041.
[39] 朱耀磊, 曲继发, 桑雪, 等. 海产品中蜂房哈夫尼菌的鉴定及相关特性研究[J]. 中国食品学报, 2021, 21(4): 295-302. DOI:10.16429/j.1009-7848.2021.04.035.
[40] CONWAY B-A D, VENU V, SPEERT D P. Biofilm formation and acyl homoserine lactone production in the Burkholderia cepaciacomplex[J]. Journal of Bacteriology, 2002, 184(20): 5678-5685. DOI:10.4067/S0716-97602009000400004.
[41] TAN Jiayi, YIN Waifong, CHAN Kokgan. Quorum sensing activity of Hafnia alvei isolated from packed food[J]. Sensors, 2014, 14(4): 6788-6796. DOI:10.3390/s140406788.
[42] 孔西曼, 张公亮, 王佳莹, 等. 环境因素对即食海参蜂房哈夫尼菌群体感应的影响[J]. 现代食品科技, 2017, 33(1): 87-92. DOI:10.13982/j.mfst.1673-9078.2017.1.014.
[43] 朱耀磊, 侯红漫, 张公亮, 等. 蜂房哈夫尼菌群体感应对其生物膜及泳动性的调控作用[J]. 食品科学, 2020, 41(14): 169-174. DOI:10.7506/spkx1002-6630-20190624-288.
[44] 吴明, 黄晓红, 杨勇, 等. 肉类低温保鲜技术研究进展[J]. 肉类研究, 2021, 35(5): 60-69. DOI:10.7506/rlyj1001-8123-20210203-029.
[45] LEITÃO M F F, RIOS D P A. Microbiological and chemical changes in freshwater prawn (Macrobrachium rosembergii) stored under refrigeration[J]. Brazilian Journal of Microbiology, 2000, 31(3): 177-182. DOI:10.1590/S1517-83822000000300006.
[46] 白颖, 冯丁丁, 浦源, 等. 海参低温贮藏过程中品质与理化性质的变化[J]. 中国食品学报, 2021, 21(1): 208-214. DOI:10.16429/j.1009-7848.2021.01.026.
[47] XIONG Xin, HE Baoyu, JIANG Di, et al. Postmortem biochemical and textural changes in the sea cucumber Stichopus japonicus body wall (SJBW) during iced storage[J]. LWT-Food Science and Technology, 2019, 118: 108705. DOI:10.1016/j.lwt.2019.108705.
[48] 冯丁丁. 不同温度处理条件下海参质构与理化性质的研究[D]. 大连: 大连工业大学, 2018: 10-42.
[49] 李江阔, 郭兴月, 张鹏, 等. 不同温度处理对海参自溶酶及品质的影响[J]. 食品科技, 2014, 39(10): 159-163. DOI:10.13684/j.cnki.spkj.2014.10.034.
[50] 赵园园, 薛勇, 李兆杰, 等. 即食仿刺参的制备与常温贮藏期间品质变化研究[J]. 食品工业科技, 2015, 36(11): 305-308. DOI:10.13386/j.issn1002-0306.2015.11.053.
[51] SUN Xiao, ZHU Lulu, QI Xin, et al. Cleavage sites and nonenzymatic self-degradation mechanism of ready-to-eat sea cucumber during storage[J]. Food Chemistry, 2022, 375: 131722. DOI:10.1016/j.foodchem.2021.131722.
[52] 马桂兰. 海参果冻的加工工艺及熟制海参劣化机理的初步探讨[D]. 青岛: 中国海洋大学, 2012: 35-48.
[53] CHEN Tiejun, PENG Zhe, LU Jiaohan, et al. Self-degradation of sea cucumber body wall under 4 ℃ storage condition[J]. Journal of Food Processing Preservation, 2016, 40(4): 715-723. DOI:10.1111/jfpp.12652.
[54] 祖崟雪. 反复冻融对即食海参水分动力学的影响研究[D]. 大连: 大连工业大学, 2017: 11-54.
[55] 夏培浩. 明胶-结冷胶复配体系的研究及其在即食海参产品中的应用研究[D]. 青岛: 中国海洋大学, 2012: 21-30.
[56] 赵园园. 即食海参贮藏稳定性研究[D]. 青岛: 中国海洋大学, 2015: 20-59.
[57] 励建荣. 海水鱼类腐败机制及其保鲜技术研究进展[J]. 中国食品学报, 2018, 18(5): 1-12. DOI:10.16429/j.1009-7848.2018.05.001.
[58] 裴诺, 施文正, 汪之和. 壳聚糖与生物保鲜剂复合使用在水产品保鲜中的研究进展[J]. 食品工业科技, 2022, 43(5): 448-454. DOI:10.13386/j.issn1002-0306.2021030204.
[59] 黄可榆, 谢彩锋, 杭方学, 等. 乳酸链球菌素抗菌活性的改善及在食品保鲜中的研究进展[J]. 中国食品添加剂, 2021, 32(12): 208-213. DOI:10.19804/j.issn1006-2513.2021.12.028.
[60] 陈方圆, 戴久竣, 徐家延, 等. 纳他霉素抑菌机制及在食品保鲜中的应用研究进展[J]. 食品科技, 2021, 46(9): 47-51. DOI:10.13684/j.cnki.spkj.2021.09.010.
[61] 朱璐璐, 农绍庄, 李江阔, 等. 两种生物保鲜液对鲜活海参贮藏品质的影响[J]. 食品工业, 2015, 36(6): 128-132.
[62] 朱璐璐. 鲜活海参营养保鲜剂研制及应用技术研究[D]. 大连: 大连工业大学, 2015: 17-38.
[63] 刘星宇. 木醋液抑菌功能性及应用研究[D]. 长春: 吉林大学, 2022: 9-10.
[64] 肖水水, 张鹏, 李江阔, 等. 不同浓度食用级木醋液对鲜活海参保鲜效果的研究[J]. 食品科技, 2016, 41(5): 35-40. DOI:10.13684/j.cnki.spkj.2016.05.007.
[65] 肖水水. 食用级木醋液在海参保鲜中的应用研究[D]. 大连: 大连工业大学, 2016: 18-66.
[66] LUO Huahin, SHENG Zhenzhen, GUO Chenxu, et al. Quality attributes enhancement of ready-to-eat hairtail fish balls by highpressure processing[J]. LWT-Food Science and Technology, 2021, 147: 111658. DOI:10.1016/j.lwt.2021.111658.
[67] LIU Peiling, ZHANG Qing, SHEN Qun, et al. Effect of high hydrostatic pressure on modified noncrystalline granular starch of starches with different granular type and amylase content[J]. LWTFood Science and Technology, 2012, 47(2): 450-458. DOI:10.1016/j.lwt.2012.02.005.
[68] 曾绍校, 郑明静, 陈玲, 等. 超高压处理海参自溶酶失活动力学及其软罐头贮藏品质[J]. 中国食品学报, 2017, 17(11): 173-180. DOI:10.16429/j.1009-7848.2017.11.023.
[69] 邓记松. 超高压处理海珍品保鲜实验研究[D]. 大连: 大连理工大学, 2009: 28-52.
[70] 闫春子. 超高压处理对淡水鱼冷藏保鲜效果的影响[D]. 无锡: 江南大学, 2016: 21-22.
[71] 李庆领, 宋吉昌, 吴俊飞, 等. 海参超高压保鲜的工艺研究[J]. 食品科学, 2009, 30(12): 117-119. DOI:10.3321/j.issn:1002-6630.2009.12.021.
[72] 郝梦甄, 胡志和. 超高压和盐渍泡发处理海参的质构和功能成分比较研究[J]. 食品科学, 2013, 34(5): 115-119. DOI:10.7506/spkx1002-6630-201305024.
[73] SEQUEIRA-MUNOZ A, CHEVALIER D, LEBAIL A, et al. Physicochemical changes induced in carp (Cyprinus carpio) fillets by high pressure processing at low temperature[J]. Innovative Food Science Emerging Technologies, 2006, 7(1/2): 13-18. DOI:10.1016/j.ifset.2005.06.006.
[74] 侯虎, 陈铁军, 彭喆, 等. 超高压处理对海参体壁凝胶稳定性及其劣化的影响[J]. 农业工程学报, 2014, 30(22): 316-322. DOI:10.3969/j.issn.1002-6819.2014.22.039.
[75] 蓝蔚青, 赵亚楠, 刘琳, 等. 臭氧水处理在水产品杀菌保鲜中的应用研究进展[J]. 渔业科学进展, 2020, 41(4): 190-197. DOI:10.19663/j.issn2095-9869.20191218001.
[76] PANDISELVAM R, SUBHASHINI S, BANUU PRIYA E P, et al. Ozone based food preservation: a promising green technology for enhanced food safety[J]. Ozone: Science Engineering, 2019, 41(1): 17-34. DOI:10.1080/01919512.2018.1490636.
[77] 杨振. 果蔬洗涤剂的研究与发展综述[J]. 盐科学与化工, 2020, 49(5): 1-4. DOI:10.16570/j.cnki.issn1673-6850.2020.05.001.
[78] 裴炜, 尹京苑, 李标, 等. 生物保鲜剂R-多糖低温保鲜荔枝的研究[J]. 中国食品学报, 2012, 12(5): 121-129. DOI:10.16429/j.1009-7848.2012.05.025.
[79] 崔花善, 侯英雪, 李志文, 等. 新鲜海参的保鲜剂配制工艺研究[J]. 食品研究与开发, 2012, 33(9): 189-193.
[80] 朱璐璐, 农绍庄, 刘畅, 等. 鲜活海参防腐保鲜工艺研究[J]. 食品工业, 2014, 35(2): 39-42.
[81] OZDAL T, CAPANOGLU E, ALTAY F. A review on protein-phenolic interactions and associated changes[J]. Food Research International, 2013, 51(2): 954-970. DOI:10.1016/j.foodres.2013.02.009.
[82] MANJARI M S, AARON K P, MURALIDHARAN C, et al. Highly biocompatible novel polyphenol cross-linked collagen scaffold for potential tissue engineering applications[J]. Reactive and Functional Polymers, 2020, 153: 104630. DOI:10.1016/j.reactfunctpolym.2020.104630.
[83] ZHANG Yan, HOU Hu, FAN Yan, et al. Effect of moisture status on the stability of thermal gels from the body wall of sea cucumbers (Apostichopus japonicus)[J]. LWT-Food Science and Technology, 2016, 74: 294-302. DOI:10.1016/j.lwt.2016.07.058.
[84] QI Xin, SUN Xiao, ZHU Lulu, et al. Intervention mechanism of selfdegradation of ready-to-eat sea cucumber by adding green tea extract and gallic acid[J]. Food Research International, 2022, 156: 111282. DOI:10.1016/j.foodres.2022.111282.
[85] ZHU Lulu, QI Xin, BAI Jing, et al. The mechanism of molecular cross-linking against nonenzymatic degradation in the body wall of ready-to-eat sea cucumber[J]. Food Chemistry, 2022, 373: 131359. DOI:10.1016/j.foodchem.2021.131359.
[86] 侯虎, 朱露露, 樊燕, 等. 一种具有良好贮藏稳定性的即食海参: 202210135930.2[P]. 2022-05-27.
[87] 周大勇, 刘自强, 朱蓓薇, 等. 一种贮藏稳定的即食海参的制作方法: 201910733777.1[P]. 2019-10-18.
[88] 张永勤, 薛长湖, 薛勇, 等. 一种胶原蛋白稳定的即食海参的制作 方法: 201010144056.6[P]. 2010-09-08.