动物肌肉品质受多种因素影响[1-4],其中品种和养殖环境是引起差异的主要因素[5-6]。近年来,研究者关注到养殖环境条件控制与优质肉生产之间有着密不可分的关系[7],其中,热应激对畜禽肌肉品质影响成为研究热点。
当环境长时间保持高温、高湿,畜禽依靠行为反应无法有效达到降温效果时,便会陷入热应激带来的不利影响中,其体内会通过调节激素的分泌来降低代谢水平,以起到促进散热和减少产热的效果[8]。但与此同时,这种代谢水平变化不仅影响畜禽免疫水平,还会导致畜禽生长速度减缓和生产率降低,也会造成肉品质下降[9-10]。
甄少波等[11]研究显示,高温天气下猪肉的保水性显著降低,滴水损失和蒸煮损失远高于秋冬季节时的猪肉;冯京海[12]的研究结果显示,循环高温会导致鸡肉品质下降,包括pH值降低引起的酸味、滴水损失和剪切力增加引起的嫩度下降等;Imik等[13]研究发现,暴露于热应激(34~41 ℃)的肉鸡,鸡肉的氧化应激、蛋白质和脂肪氧化增加,产品货架期缩短;Kadim等[14]的研究也显示高温天气下牛肉的肉色更为黯淡,pH值和剪切力均有所下降。但目前的研究主要集中于猪、牛等家禽动物上,对绵羊的研究较少。
随着人民群众生活水平的提高,我国羊肉生产量和消费量呈现出快速增长的发展趋势[15],同时消费者也开始注重肉的品质和风味。我国大宗羊肉的生产及流通以绵羊为主,其中主要肉羊品种有:湖羊、小尾寒羊、杜泊羊等品种及杂交羊[16-17],鲁中肉羊是以湖羊和南非白头杜泊羊为亲本培养的新品种肉用绵羊,具有生长速度快、繁殖率高、屠宰率高、肉质好、耐粗饲、性情温和等一系列优点[18]。本研究以鲁中肉羊为研究对象,通过人工控温创造适宜环境与应激环境,研究热应激对绵羊肉品质的影响,为绵羊在北方高温地区的养殖和屠宰加工提供一定理论依据。
1 材料与方法
1.1 材料与试剂
自山东省莱芜嬴泰农牧科技有限公司(鲁中肉羊育成单位)选取8 月龄、健康无病、体质量均匀的公羊12 只。
促甲状腺激素释放激素(thyrotropinreleasing hormone,TRH)、三碘甲状腺原氨酸(triiodothyronine,T3)、甲状腺素(thyroxine,T4)、免疫球蛋白A(immunoglobulin A,IgA)、IgM、IgG、白细胞介素4(interleukin 4,IL-4)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、肾上腺素(epinephrine,EPI)、皮质醇(cortisol,Cor)、胰岛素(insulin,Ins)酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)试剂盒 上海酶联生物科技有限公司;尿素氮(urea nitrogen,BUN)、肌酐(creatinine,CR)、肌酸激酶(creatine kinase,CK)、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒浙江美康生物科技有限公司。
1.2 仪器与设备
DW-86L416G超低温冰箱(-80 ℃) 中国海尔公司;DK-88恒温水浴锅 上海精宏实验设备有限公司;MC-15k微型高速离心机 浙江佑宁仪器有限公司;BSA124S-CW分析天平 德国赛斯多利斯公司;7180生化分析仪 日本日立公司;Milli-Q IQ7000超纯水净化装置 美国默克密理博公司;CR-400色彩色差计日本柯尼卡美能达公司;TA.XT-Plus质构仪 英国Stable Micro Systems公司、FE-plus pH计 瑞士梅特勒-托利多公司;FSH-2A可调高速匀浆机 山东函优生物科技有限公司。
1.3 方法
1.3.1 实验羊只处理
将实验羊只分为应激组与对照组,每组6 只,适应性饲养期间保持通风,使用风扇和喷淋保持羊舍温度处于正常范围内,为期14 d。实验期间饲喂使用的饲粮根据NY/T 816ü2021《肉羊营养需要量》[19]进行配制,饲粮营养水平和配方组成如表1所示。
表1 饲粮配方
Table 1 Ingredients and nutrient composition of experimental diet
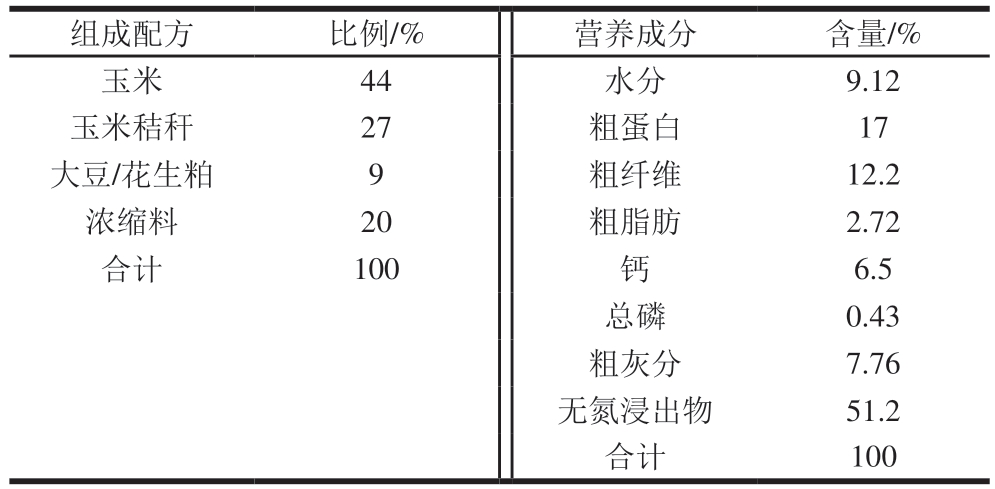
注:浓缩料中含有尿素、麦芽根、小苏打、预混料2.5%(m/m)、食盐2.5%(m/m)。预混料中矿物元素添加量为:S 200 mg/kg、Zn 40 mg/kg、Cu 8 mg/kg、Mn 40 mg/kg、I 0.3 mg/kg、Se 0.2 mg/kg、Fe 25 mg/kg、Co 0.1 mg/kg。粗蛋白、粗纤维、粗脂肪、粗灰分、无氮浸出物含量为实测值,其他为计算值。
组成配方比例/%营养成分含量/%玉米44水分9.12玉米秸秆 27粗蛋白17大豆/花生粕 9粗纤维12.2浓缩料20粗脂肪2.72合计100钙6.5总磷0.43粗灰分7.76无氮浸出物51.2合计100
适应期结束后调整应激组羊舍温湿度,使其达到热应激水平,进行为期3 d的热应激刺激,对照组保持正常饲养管理。实验期间2 组实验羊只均保持自由采食与饮水。热应激刺激完成后,于第4天晨间进行屠宰,宰前禁食12 h、禁水3 h。
热应激第3天分别于8:00、14:00、22:00时采集实验羊只颈静脉血,使用移液器将采集血液转移到离心管中,于常温4 000 r/min条件下离心15 min,收集上清血浆部分,防止下层血细胞混入,将收集到的血浆置于-80 ℃低温冰箱备用。
实验动物屠宰后,取一侧背最长肌于现场进行肉品质各项数据检测;其余样品带回实验室于4 ℃冷库贮藏,用于后续检测。
1.3.2 环境温湿度检测及热应激状态判断
将温湿度检测仪悬挂于羊舍中心位置,离地约1.5 m以保障数据采集准确性及防止羊群损坏仪器。在14 d适应期和3 d刺激期内于每天8:00、14:00、22:00进行记录。使用温湿度指数(temperature humidity index,THI)判断羊只是否处于热应激状态。THI按式(1)计算:
式中:T为干球温度/℃;RH为畜禽所处环境的相对湿度/%。
1.3.3 绵羊肉品质测定
根据NY/T 2793—2015《肉的食用品质客观评价方法》[20],对实验羊只的滴水损失、蒸煮损失、pH值、肉色和剪切力进行检测,每个检测项目设置3 个平行以保证实验结果的可靠性。其中pH值、肉色和剪切力结果为仪器显示的直接检测值。滴水损失率和蒸煮损失率均按式(2)计算。
式中:m1为处理前肉块质量/g;m2为处理后肉块质量/g。
1.3.4 感官评价
根据GB/T 22210ü2008《肉与肉制品感官评定规范》[21],挑选12 名(其中6 名女性、6 名男性)具有食品专业基础人员对样品进行感官评价。实验选择脖颈部位进行烹饪,烹饪方法为清水煮制,不添加任何调味料。采用盲评方式进行评价,评价结果取平均值。感官评价标准如表2所示。
表2 感官评价标准
Table 2 Criteria for sensory evaluation of cooked sheep meat

整体形状出现塌陷、破损,色泽暗淡口感(5 分)入口软嫩,但耐咀嚼入口口感较差,难以咀嚼入口口感差,长时间咀嚼后仍难以下咽多汁性(5 分)入口咀嚼后汁液丰富,多次咀嚼后仍保持较好口感指标优(4~5 分)良(2~3 分)差(1 分)外观(5 分)整体形状保持完好,色泽鲜亮,令人有食欲整体形状保持完好,色泽暗淡入口咀嚼后汁液匮乏,难以咀嚼气味(5 分)有明显的肉香味及羊肉特色风味,无异味入口咀嚼后汁液丰富,多次咀嚼后口感损失严重肉香味及风味不明显,有明显的异味风味(5 分)羊肉特有风味明显有一定的羊肉特有风味基本没有特色风味异味(5 分)无异味(膻味、酸味等)有细微异味(膻味、酸味等),但在可接受范围内肉香及风味不明显,无异味异味(膻味、酸味等)明显
1.3.5 肌肉纤维结构测定
将烹饪后的肌肉样品切成5 mmh5 mmh15 mm立方体,使用体积分数3%戊二醛溶液固定,固定完成后置于干冰中贮藏,委托北京中科百测有限公司进行扫描电镜检测。
1.3.6 酶联免疫分析
根据试剂盒说明书对TRH、T4、Cor、EPI、Ins、T3、ACTH、IgA、IgG、IgM和IL-4进行ELISA,使用酶标仪对其含量进行检测。
1.3.7 血液生化分析
使用全自动生化分析仪对BUN、CR、CK和LDH含量进行测定。
1.4 数据处理
使用WPS表格软件对实验中获得的各项数据进行整理并制表,结果表示为平均值±标准差。使用SPSS 22.0软件对数据进行单因素方差分析和多重比较,其中多重分析使用Duncan’s法进行,将显著性水平设置为0.05,分析2 组之间各项数据的差异显著性。
2 结果与分析
2.1 环境温湿度检测结果
施加应激期间于羊舍测定早、中、晚不同时间点环境THI,用于判断环境条件是否达到热应激标准,结果如表3所示。绵羊热应激判断标准为:THI<72为无热应激;72<THI<78为轻度热应激;78<THI<88为中度热应激;THI≥88为重度热应激[22]。
表3 环境THI
Table 3 Environmental temperature and humidity index
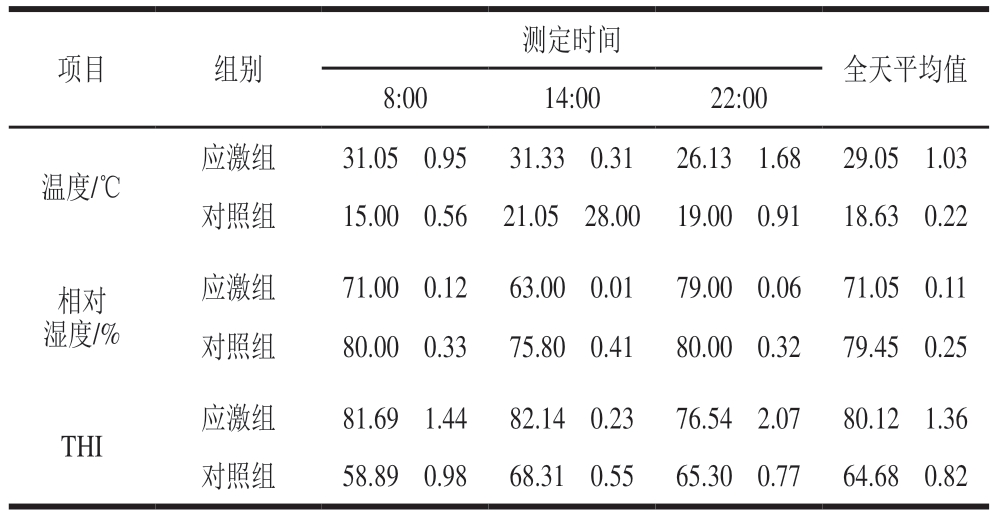
测定时间项目组别全天平均值8:0014:0022:00温度/℃应激组31.05f0.9531.33f0.3126.13f1.6829.05f1.03对照组15.00f0.5621.05f28.0019.00f0.9118.63f0.22相对湿度/%应激组71.00f0.1263.00f0.0179.00f0.0671.05f0.11对照组80.00f0.3375.80f0.4180.00f0.3279.45f0.25 THI应激组81.69f1.4482.14f0.2376.54f2.0780.12f1.36对照组58.89f0.9868.31f0.5565.30f0.7764.68f0.82
本研究中,适应期8:00、14:00、22:00的平均THI分别为58.89、68.31、65.30,全天平均THI为64.68,属于无热应激范围。说明在适应期间,对照组与应激组均未受到热应激影响。刺激期间,对照组养殖环境保持不变,应激组养殖环境经过调控后每天8:00、14:00、22:00的平均THI分别为81.69、82.14、76.54,说明应激组在刺激期间白天受到中度热应激影响,夜间有所恢复,受到轻度热应激影响;全天平均THI为80.12,总体处于中度热应激状态。
2.2 热应激对绵羊肉品质的影响
由表4可知,热应激对实验羊只在45 min和24 h时的pH值以及蒸煮损失均无显著影响;而滴水损失、剪切力以及在45 min和24 h时的肉色指标(L*、a*和b*)在2 组间均存在显著差异(P<0.05),其中应激组滴水损失显著高于对照组(P<0.05),剪切力显著低于对照组(P<0.05)。
表4 热应激对绵羊肉品质的影响
Table 4 Effect of heat stress on the meat quality of sheep
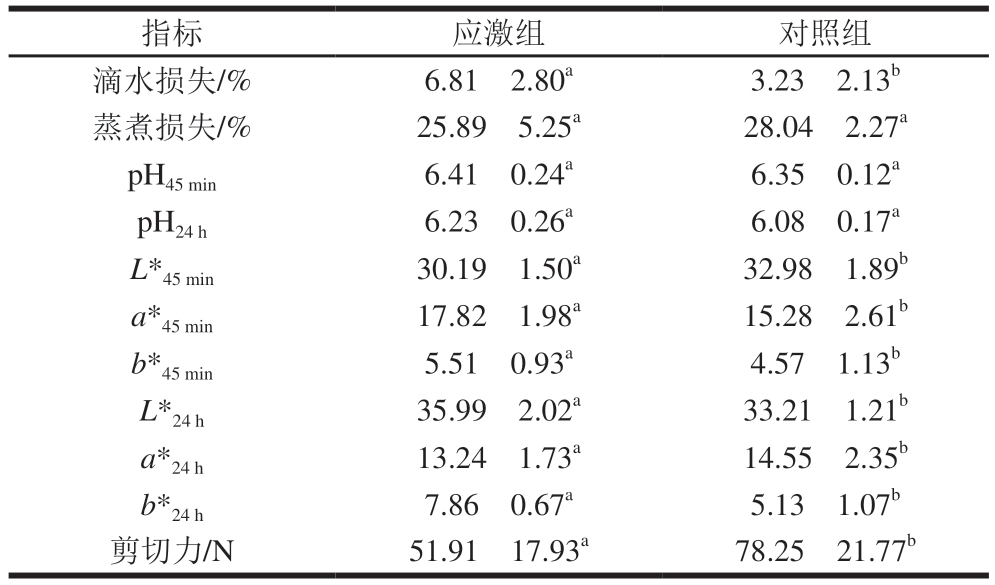
注:同行小写字母不同,表示组间差异显著(P<0.05)。
指标应激组对照组滴水损失/%6.81f2.80a3.23f2.13b蒸煮损失/%25.89f5.25a28.04f2.27a pH45 min6.41f0.24a6.35f0.12a pH24 h6.23f0.26a6.08f0.17a L*45 min30.19f1.50a32.98f1.89b a*45 min17.82f1.98a15.28f2.61b b*45 min5.51f0.93a4.57f1.13b L*24 h35.99f2.02a33.21f1.21b a*24 h13.24f1.73a14.55f2.35b b*24 h7.86f0.67a5.13f1.07b剪切力/N51.91f17.93a78.25f21.77b
本研究中,滴水损失结果显示对照组较好,应激组剪切力显著低于对照组(P<0.05)。此外,新鲜屠宰的2 组实验羊只肉色指标均差异显著,表明热应激羊肉具有更好的新鲜度,但保水性较差。有研究[23]表明L*与肌肉的保水性呈负相关,肌肉保水性会伴随着L*增加而下降;a*与肉制品新鲜度呈正相关性;b*则与a*相反,与肉制品新鲜度呈负相关,这与本研究结果不符。
为验证初步实验结果的准确性,进行肌肉纤维扫描电镜分析、感官评价以及在4 ℃条件下贮藏24 h后的肉色检测。贮藏45 min~24 h期间,应激组L*由30.19上升至35.99,变化明显;a*由17.82下降至13.24,变化明显;b*由5.51上升至7.86,变化明显。对照组L*、a*、b*的变化趋势均与应激组相同,但L*和a*变化均不明显,仅b*变化明显,但其变化幅度远小于应激组。
以上结果表明,24 h贮藏后,应激组羊肉保水性大幅下降,水分流失情况严重。
2.3 热应激对绵羊肌肉纤维结构的影响
由图1可知,横向截面结果显示,对照组肌肉纤维平均直径约60 μm,纤维排列紧密;应激组肌肉纤维平均直径约60 μm,纤维排列较为松散,可以观察到明显的纤维间隙,宽度约10 μm。纵向截面结果显示,对照组肌肉纤维完整且排列紧密,无纤维断裂情况;应激组肌肉纤维排列较为松散、肌肉纤维较为完整、无断裂情况。
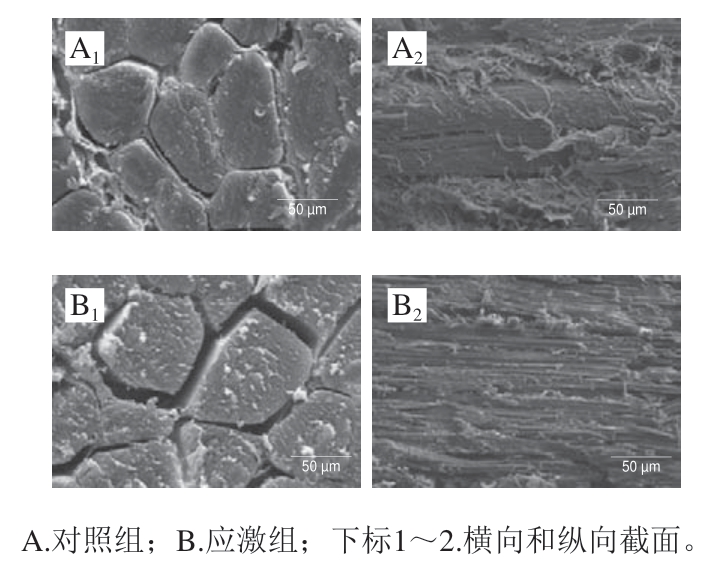
图1 绵羊肌肉纤维扫描电镜结果
Fig. 1 Scanning electron microscopy micrographs of muscle fibers in sheep meat
扫描电镜结果显示,应激组羊肉的肌肉纤维排列松散,可以观察到明显的间隙;对照组肌肉纤维则排列较为紧密,排列松散的肌肉纤维更容易被切断,因此应激组得到了更低的剪切力数据。生物体内的水分分为结合水、不易流动水和自由水3 部分,在肉类贮藏期间,最先发生流失的水是存在于细胞组织间隙中的自由水[24],应激组肌肉组织间隙的存在会导致自由水的流失速度大幅增加,降低保水性,此结论与贮藏24 h后的羊肉肉色检测结果一致。
2.4 热应激对绵羊肉感官评价结果的影响
由图2可知,应激组与对照组之间外观和气味并无显著差异,且评分均在4 分以上;口感和多汁性组间存在极显著差异(P<0.01),对照组分别为3.75和4.06,高于应激组的2.63、2.81;风味组间存在显著差异(P<0.05),对照组风味得分略高于应激组;异味方面应激组与对照组差异极显著(P<0.01),大部分参与测试者均表示在应激组样品中可以感受到明显酸味,而对照组没有。
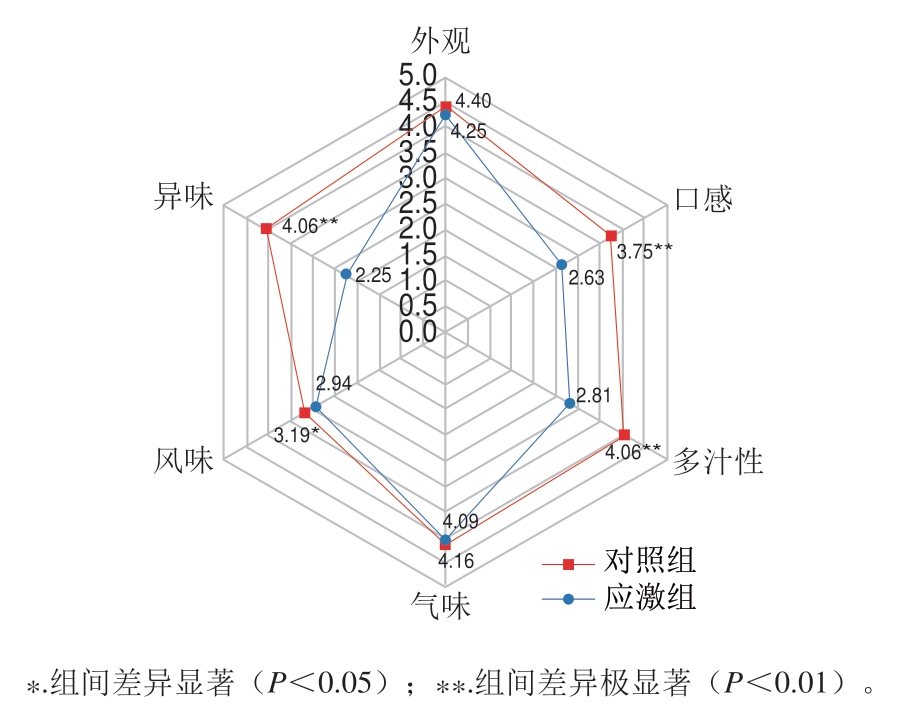
图2 羊肉感官评价结果雷达图
Fig. 2 Sensory evaluation radar plots of cooked sheep meat
感官评价结果同样验证了应激组与对照组之间的差异,口感与多汁性评分显著下降说明应激组羊肉中水分流失严重,明显的异味说明应激组羊肉的新鲜度远低于对照组。在口感方面参评人员普遍认为应激组更好,由此判断这是因为虽然肌肉纤维的松散会带来更低的剪切力,但其导致的水分流失会产生更为严重的口感差距,对于消费者来说反而无法获得更良好的食用体验。
2.5 热应激对绵羊血液激素水平的影响
由表5可知,在热应激状态下,应激组实验羊只血液中TRH、T4、Cor含量相较于对照组在全天各时间点均显著降低(P<0.05、P<0.01);应激组EPI、Ins含量相较于对照组在全天各时间点均极显著上升(P<0.01);应激组T3含量相较于对照组在全天各时间点均无显著差异;应激组ACTH含量在夜间较对照组显著下降(P<0.05),但全天平均水平无显著差异。
表5 绵羊血液激素水平
Table 5 Blood hormone levels in sheep
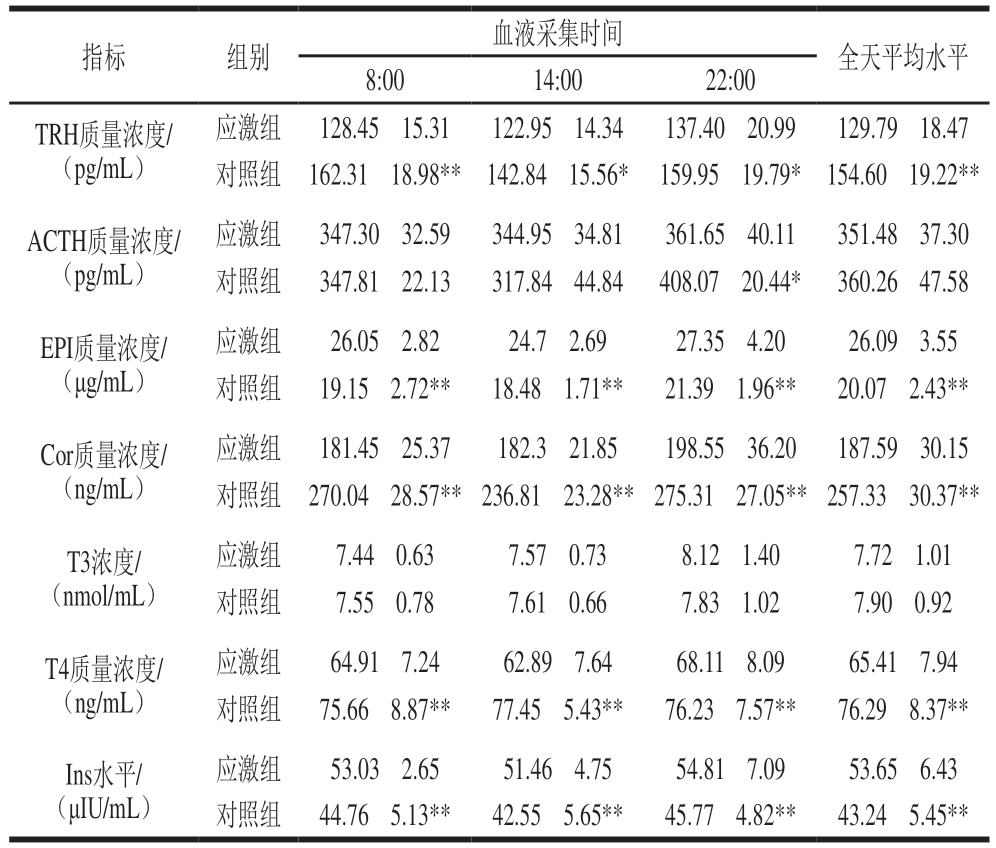
注:*.同一物质组间差异显著(P<0.05);**.同一物质组间差异极显著(P<0.01)。下同。
应激组128.45f15.31122.95f14.34137.40f20.99129.79f18.47对照组162.31f18.98**142.84f15.56*159.95f19.79*154.60f19.22**ACTH质量浓度/(pg/mL)指标组别血液采集时间全天平均水平8:0014:0022:00 TRH质量浓度/(pg/mL)应激组347.30f32.59344.95f34.81361.65f40.11351.48f37.30对照组347.81f22.13317.84f44.84408.07f20.44*360.26f47.58 EPI质量浓度/(μg/mL)应激组26.05f2.8224.7f2.6927.35f4.2026.09f3.55对照组19.15f2.72**18.48f1.71**21.39f1.96**20.07f2.43**Cor质量浓度/(ng/mL)应激组181.45f25.37182.3f21.85198.55f36.20187.59f30.15对照组270.04f28.57**236.81f23.28**275.31f27.05**257.33f30.37**T3浓度/(nmol/mL)应激组7.44f0.637.57f0.738.12f1.407.72f1.01对照组7.55f0.787.61f0.667.83f1.027.90f0.92 T4质量浓度/(ng/mL)应激组64.91f7.2462.89f7.6468.11f8.0965.41f7.94对照组75.66f8.87**77.45f5.43**76.23f7.57**76.29f8.37**Ins水平/(μIU/mL)应激组53.03f2.6551.46f4.7554.81f7.0953.65f6.43对照组44.76f5.13**42.55f5.65**45.77f4.82**43.24f5.45**
2.6 热应激对绵羊免疫水平的影响
由表6可知,热应激状态下,应激组IgA含量相较于对照组在全天各时间点均极显著降低(P<0.01);应激组IgG、IgM、IL-4含量相较于对照组在全天各时间点均无显著差异。免疫球蛋白具有抗病毒和免疫调节功能[25],不同的免疫球蛋白具有相似的结构,但各自具有不同的免疫学功能,其中IgA可以中和血液中的抗原,防止炎症发生[26]。IgA含量降低说明热应激状态下实验绵羊免疫力显著下降,将更容易受到疾病影响。
表6 绵羊血液免疫因子水平
Table 6 Blood immune cytokines levels in sheep
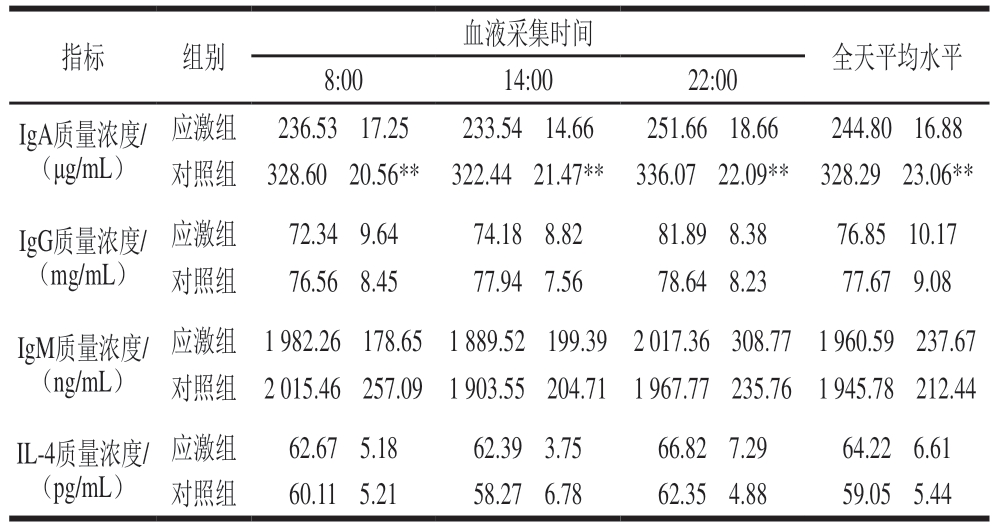
指标组别血液采集时间全天平均水平8:0014:0022:00 IgA质量浓度/(μg/mL)应激组72.34f9.6474.18f8.8281.89f8.3876.85f10.17对照组76.56f8.4577.94f7.5678.64f8.2377.67f9.08 IgM质量浓度/(ng/mL)应激组236.53f17.25233.54f14.66251.66f18.66244.80f16.88对照组328.60f20.56**322.44f21.47**336.07f22.09**328.29f23.06**IgG质量浓度/(mg/mL)应激组1 982.26f178.651 889.52f199.392 017.36f308.771 960.59f237.67对照组2 015.46f257.091 903.55f204.711 967.77f235.761 945.78f212.44 IL-4质量浓度/(pg/mL)应激组62.67f5.1862.39f3.7566.82f7.2964.22f6.61对照组60.11f5.2158.27f6.7862.35f4.8859.05f5.44
2.7 热应激对绵羊血液生化水平的影响
由表7可知,热应激状态下实验绵羊BUN含量应激组相较于对照组在14:00显著升高(P<0.05),其他时间极显著升高(P<0.01);CR含量应激组相较于对照组在全天各时间点均极显著升高(P<0.01)。这2 种物质在动物体内主要通过肾小球进行过滤然后经由尿液排出,其含量升高意味着肾功能在热应激影响下受到了一定程度的损伤。LDH活力应激组相较于对照组在晨间显著降低(P<0.05),在午间和夜间无显著差异,但全天平均水平极显著降低(P<0.01);CK水平应激组相较于对照组在全天各时间点均无显著差异。
表7 绵羊血液生化指标
Table 7 Blood biochemical indicators in sheep
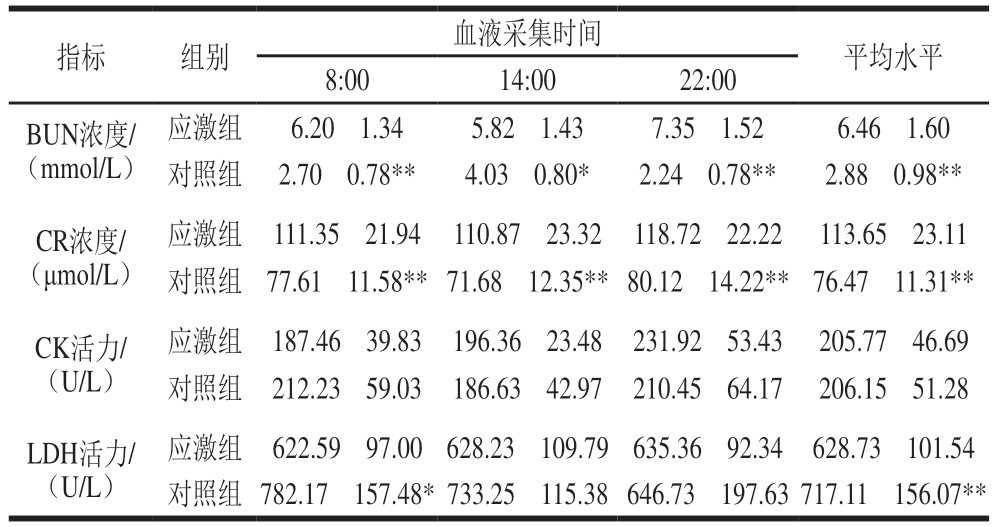
指标组别血液采集时间平均水平8:0014:0022:00 BUN浓度/(mmol/L)应激组6.20f1.345.82f1.437.35f1.526.46f1.60对照组2.70f0.78**4.03f0.80*2.24f0.78**2.88f0.98**CR浓度/(μmol/L)应激组187.46f39.83196.36f23.48231.92f53.43205.77f46.69对照组212.23f59.03186.63f42.97210.45f64.17206.15f51.28 LDH活力/(U/L)应激组111.35f21.94110.87f23.32118.72f22.22113.65f23.11对照组77.61f11.58**71.68f12.35**80.12f14.22**76.47f11.31**CK活力/(U/L)应激组622.59f97.00628.23f109.79635.36f92.34628.73f101.54对照组782.17f157.48*733.25f115.38646.73f197.63717.11f156.07**
3 讨 论
肉品质的评定指标包括肉色、pH值、滴水损失、蒸煮损失、剪切力等,其中肉色是评定肉品质时最直观的指标,其优劣会直接影响消费者的选择[27-28]。本研究中,刚完成宰杀时应激组羊肉与对照组羊肉在肉色方面并无显著差异,但在经过24 h贮藏后,应激组羊肉的亮度显著提高,其直观表现是颜色更白,这种变化与PSE(pale, soft, exudative)肉的特征相似,PSE肉的特点为色泽苍白、质地更加柔软、保水性差,严重时会有液体从表面渗出[29]。扫描电镜结果显示,应激组羊肉的肌肉纤维排列松散,可以观察到明显的间隙,更容易被切断,应激组肌肉纤维间隙的存在会导致自由水的流失速度大幅增加[24],降低了保水性,这些表现与PSE肉的性状一致,感官评价结果也得到一致的结果。本研究中从各项指标和外观表现来看,应激组羊肉尚未达到PSE肉的程度,但从2 组羊肉之间肉色、保水性和剪切力等指标的差异来判断,应激组羊肉有向PSE肉发展的趋势,
热应激不仅影响了绵羊的肉品质,还对其生理状态造成了极大的负面影响。本研究发现,热应激状态下绵羊的IgA含量显著降低,与施力光等[30]的研究一致,表明热应激使绵羊免疫能力出现了显著下降;BUN和CR含量显著升高,与刘若楠[31]、王桂超[32]等的研究结果相似。董书清[33]的研究显示,血液BUN浓度受到生理和病理多种因素影响,生理因素主要为高蛋白饮食,但本研究中2 组实验动物所用饲料一致,因此应为病理性升高,最可能的原因是高热环境下实验动物失水导致血液浓度升高引起的尿素潴留;CR则是肌酸代谢的最终产物,经肾小球滤过后不被肾小管重吸收,通过肾小管排泄出体外,在肾脏病变初期其水平通常不变化,直至肾脏受到实质性损伤时才会开始升高。因此在高温环境下,BUN和CR含量升高表示实验动物的肾脏功能可能受到一定损伤,如果不进行及时的应对,不仅会影响肉品质、损害消费者利益,还有可能引发家畜疾病甚至死亡,对养殖者造成巨大的经济损失。
快速准确地判断热应激的发生对于应对热应激带来的影响至关重要,目前研究者们普遍依靠畜禽养殖环境的THI进行热应激水平判断[34],本研究也采用此方法,但研究者们仍进一步研究和探索可以准确反映畜禽热应激状态的生物标志物。热休克蛋白(heat shock proteins,HSP)被认为是可以最有效反映热应激程度和持续时间的标志物[35-36],其作为热应激标志物的研究已经非常深入[37],但HSP的检测需要的经济和技术成本都较高,因此对其他便于检测标志物的研究迫在眉睫。本研究通过ELISA和血液生化分析仪对2 组实验羊只血液中7 种激素进行定量检测,其中Ins、TRH和Cor 3 种激素的含量在热应激状态下出现显著变化,可以有效反映出畜禽热应激状态的变化,这与童雄[38]、Petersen[39]等的研究基本一致;除此之外,相较于HSP这些激素的检测成本更为低廉,有利于热应激检测的开展和推广。因此本研究判断Ins、TRH和Cor 3 种激素可作为生物标志物用于绵羊热应激状态的判断。
4 结 论
本研究结果显示,实验绵羊在经过3 d的中度热应激刺激后,肉品质受到了严重的负面影响,有向PSE肉发展的趋势;免疫功能显著降低,肾功能受到一定影响。通过对血液生化指标差异进行分析,发现Ins、TRH、Cor 3 种激素在热应激状态下变化显著,可作为生物标志物用于绵羊热应激状态的判断。本实验结果可为绵羊在高温地区的养殖及高温条件下屠宰加工的动物福利管理提供一定的理论支持,为改善热应激的影响提供研究基础。
[1]柴佳丽, 王振宇, 侯成立, 等. 不同品种羊肉熏制加工适宜性评价模型研究[J]. 食品科学, 2017, 38(19): 75-80. DOI:10.7506/spkx1002-6630-201719013.
[2]宋洁, 侯成立, 王振宇, 等. 不同月龄羊肉原料肉品质与涮食羊肉品质的关系[J]. 食品科学, 2017, 38(5): 154-159. DOI:10.7506/spkx1002-6630-201705025.
[3]黄欢. 不同饲养方式对苏尼特羊脂肪代谢及肉品质的影响[D].呼和浩特: 内蒙古农业大学, 2021: 19-34. DOI:10.27229/d.cnki.gnmnu.2021.000493.
[4]黄欢, 郭月英, 张敏, 等. 运动对苏尼特羊脂肪代谢和肉品质的影响[J]. 食品科学, 2021, 42(21): 17-23. DOI:10.7506/spkx1002-6630-20201124-246.
[5]CLOETE J J, HOFFMAN L C, CLOETES W. A comparison between slaughter traits and meat quality of various sheep breeds: wool,dual-purpose and mutton[J]. Meat Science, 2012, 91(3): 318-324.DOI:10.1016/j.meatsci.2012.02.010.
[6]YOUSEFI A R, KOHRAMH, ZARE S A, et al. Comparison of the meat quality and fatty acid composition of traditional fat-tailed (Chall)and tailed (Zel) Iranian sheep breeds[J]. Meat Science, 2012, 92(4):417-422. DOI:10.1016/j.meatsci.2012.05.004.
[7]皇甫晓鹏. 提高畜禽养殖效益的要点[J]. 养殖与饲料, 2023, 22(3):64-67.
[8]PRAGNA P, SEJIAN V, SOREN N M, et al. Summer season induced rhythmic alterations in metabolic activities to adapt to heat stress in three indigenous (Osmanabadi, Malabari and Salem Black) goat breeds[J]. Biological Rhythm Research, 2018, 49(4): 551-565. DOI:10.1080/09291016.2017.1386891.
[9]刘爱瑜, 王超, 吴占军, 等. 热应激对断奶绵羔羊生长性能、抗氧化性能和瘤胃菌群的影响[J]. 草业学报, 2023, 32(4): 173-182.DOI:10.11686/cyxb2022249.
[10]吴正可, 赵小刚, 李全丰, 等.热应激对猪生长和繁殖性能的影响及其营养调控研究进展[J]. 饲料工业, 2023, 44(3): 66-73.
[11]甄少波, 刘奕忍, 郭慧媛, 等. 运输季节对生猪应激及猪肉品质的影响[J]. 农业工程学报, 2015, 31(1): 333-338. DOI:10.3969/j.issn.1002-6819.2015.01.044.
[12]冯京海. 环境高温对肉鸡线粒体功能及胸肌品质的影响[D]. 北京:中国农业科学院, 2006.
[13]IMIK H, ATASEVER M A, URCAR S, et al. Meat quality of heat stress exposed broilers and effect of protein and vitamin E[J]. British Poultry Science, 2012, 53(5): 689-698. DOI:10.1080/00071668.2012.7 36609.
[14]KADIM I T, MAHGOUB O, AL-AJMI D S, et al. The influence of season on quality characteristics of hot-boned beef M. longissimus thoracis[J]. Meat Science, 2004, 66(4): 831-836. DOI:10.1016/j.meatsci.2003.08.001.
[15]中华人民共和国国家统计局. 国际统计年鉴(2022)[M]. 北京: 中国统计出版社, 2022. DOI:10.40049/y.cnki.yinfn.2022.000001.
[16]冉亮东, 吴建平, 郎侠, 等. 引入肉羊品种与湖羊杂交的屠宰性能、肉品质及血液生化指标比较研究[J]. 畜牧与兽医, 2021, 53(4): 28-31.
[17]王慧华, 赵福平, 张莉, 等. 中国地方绵羊品种的地域分布及肉用相关性状的多元分析[J]. 中国农业科学, 2015, 48(20): 4170-4177.DOI:10.3864/j.issn.0578-1752.2015.20.016.
[18]李强, 潘林香. 鲁中肉羊新品种培育经历及应用[J]. 中国畜禽种业,2020, 16(12): 100-101.
[19]农业农村部. 肉羊营养需要量: NY/T 816ü2021[S]. 北京: 中国标准出版社, 2021.
[20]农业部. 肉的食用品质客观评价方法: NY/T 2793ü2015[S]. 北京:中国标准出版社, 2015.
[21]国家质量监督检验检疫总局. 肉与肉制品感官评定规范: GB/T 22210ü2008[S]. 北京: 中国标准出版社, 2008.
[22]严啊妮, 沈奔, 王洪荣, 等. 过瘤胃葡萄糖和缓释尿素对热应激绵羊生产性能及瘤胃发酵功能的影响[J]. 中国畜牧兽医, 2022, 49(6):2105-2115. DOI:10.16431/j.cnki.1671-7236.2022.06.011.
[23]WULF D M, O’CONNOR S F, TATUM J D, et al. Using objective measures of muscle color to predict beef Longissimus tenderness[J]. Journal of Animal Science, 1997, 75(3): 684-692.DOI:10.2527/1997.753684x.
[24]CHENG S, WANG X, LI R, et al. Influence of multiple freeze-thaw cycles on quality characteristics of beef Semimembranous muscle: with emphasis on water status and distribution by LF-NMR and MRI[J].Meat Science, 2019, 147: 44-52. DOI:10.1016/j.meatsci.2018.08.020.
[25]郝光恩. 枯草芽孢杆菌对樱桃谷肉鸭增重、先天性免疫应答及抗病力的影响[D]. 泰安: 山东农业大学, 2018.
[26]李晶晶. 浅谈免疫球蛋白在免疫中的作用[J].中国畜禽种业, 2018,14(2): 85. DOI:CNKI:SUN:XMZY.0.2018-02-070.
[27]佟辉. 肌红蛋白的基因表达对肉色的影响及肉色相关分子遗传标记研究[D]. 南京: 南京农业大学, 2004. DOI:10.7666/d.Y679755.
[28]TROY D J, KERRY J P. Consumer perception and the role of science in the meat industry[J]. Meat Science, 2010, 86(1): 214-226.DOI:10.1016/j.meatsci.2010.05.009.
[29]胡鹏, 蔡荣宝, 赵增祥, 等. PSE肉的形成机制及预防措施[J].中国食物与营养, 2009(10): 31-33. DOI:10.3969/j.issn.1006-9577.2009.10.010.
[30]施力光, 彭维祺, 胡海超, 等. 持续性环境热应激对公羊血液生化指标、生殖激素及精液品质的影响[J]. 家畜生态学报, 2018, 39(3):53-57. DOI:10.3969/j.issn.1673-1182.2018.03.011.
[31]刘若楠. 保定地区羊尿结石的流行病学调查与防治[D]. 保定: 河北农业大学, 2022.
[32]王桂超, 杨金丽, 曹平, 等. 不同日粮对蒙古羔羊瘤胃内环境及血液中尿素氮和肌酐的影响[J]. 黑龙江畜牧兽医, 2016(12): 67-69.DOI:10.13881/j.cnki.hljxmsy.2016.1057.
[33]董书清. 血清肌酐、尿素氮的检测值及其比值与肾脏损害的探讨[J]. 中国医药指南, 2011, 9(36): 136-137. DOI:10.15912/j.cnki.gocm.2011.36.298.
[34]National Oceanic and Atmospheric Administration (NOAA). Livestock hot weather stress[M]. Kansas City, Missouri: US Department Commerce, National, 1976: C31-C76.
[35]PIRKKALA L, NYKÄNEN P, SISTONEN L E A. Roles of the heat shock transcription factors in regulation of the heat shock response and beyond[J]. The FASEB Journal, 2001, 15(7): 1118-1131.DOI:10.1096/fj00-0294rev.
[36]MIZZEN L A, WELCH W J. Characterization of the thermotolerant cell. I. Effects on protein synthesis activity and the regulation of heatshock protein 70 expression[J]. The Journal of Cell Biology, 1988,106(4): 1105-1116. DOI:10.1083/jcb.106.4.1105.
[37]RHOADS R P, BAUMGARD L H, SUAGEE J K, et al. Nutritional interventions to alleviate the negative consequences of heat stress[J]. Advances in Nutrition, 2013, 4(3): 267-276. DOI:10.3945/an.112.003376.
[38]童雄, 闵力, 孙浩, 等. 雷州山羊、努比亚羊及其杂交F1代在热应激环境下生理和血液生化指标的对比研究[J]. 中国畜牧兽医, 2021,48(10): 3625-3634. DOI:10.16431/j.cnki.1671-7236.2021.10.013.
[39]PETERSEN K F, SHULMAN G I. Etiology of insulin resistance[J].The American Journal of Medicine, 2006, 119(5): S10-S16.DOI:10.1016/j.amjmed.2006.01.009.