生物活性肽通过蛋白质体外水解、体内胃肠道消化或微生物发酵释放生物活性[1],根据氨基酸的组成、序列及结构的不同,其可发挥降血压、抗氧化、抗菌、抗糖尿病、抗炎、抗癌和免疫调节等多种生理功能[2-3]。免疫活性肽作为具有免疫调节功能的生物活性肽,可以增强巨噬细胞吞噬能力、促进脾淋巴细胞增殖和调节细胞因子的分泌和活性等[4],对先天免疫和适应性免疫均可起到调节作用,还具备治疗各种自身免疫疾病的潜力。由于其在食品工业、医学、化妆品、药物研发等领域的适用性,免疫活性肽成为目前研究的焦点[5]。
免疫系统通过识别自身的组织和细胞建立免疫耐受,当免疫耐受被破坏时,免疫系统便会对自身组织和细胞产生持续且强烈的免疫应答,破坏机体细胞,形成组织损伤,继而导致自身免疫性疾病(autoimmune diseases,AIDs)的发生[6]。目前针对AIDs的常规治疗主要包括广谱抗炎药物或者皮质类固醇、环孢素等非特异性的免疫抑制药物缓解临床症状,或者器官切除、血浆置换等[7]。然而,长期且广泛的使用免疫抑制剂和细胞毒性药物会损害自身正常的免疫反应,副作用明显,甚至有潜在风险(比如造成机体感染、罹患癌症等)[8]。因此,研发具有特异性治疗免疫系统疾病且副作用小的免疫抑制剂意义重大。目前有诸多研究表明生物活性肽可用于预防和治疗肥胖、高血压、II型糖尿病、高胆固醇血症和相关疾病[9],也有以提高免疫力为目的的免疫活性肽产品上市[10],因此免疫活性肽在免疫疾病的预防和治疗以及免疫药物的研发领域中具有广阔的应用前景。
免疫活性肽来源丰富,包括动物源、植物源以及微生物源。首次被发现可以提高小鼠免疫力的活性肽是人酪蛋白经胰蛋白酶消化后产生的[11]。动物源免疫活性肽具备食用安全性高、营养特性好以及发展前景广阔等优势而占据重要地位。目前研究者已鉴定出大量动物蛋白源免疫活性肽,比如蚕蛹蛋白酶解片段PNPNTN[12]、蟹肉酶解肽段LGLGAAVL[13]等,然而免疫活性肽发挥调节作用的机制尚未明确。本文拟对动物源免疫活性肽的制备和功能评价的研究进展进行综述,以期为免疫活性肽的深入研究和相关产品开发提供参考,并对未来研究趋势进行展望。
1 动物源免疫活性肽的制备技术
免疫活性肽的制备技术通常包括多肽的提取和分离纯化。多肽的常用提取方法有微生物发酵法、酶解法,此外还有直接提取法和人工合成法。多肽的分离纯化主要包括膜分离技术、色谱分离技术以及质谱鉴定等(图1)。
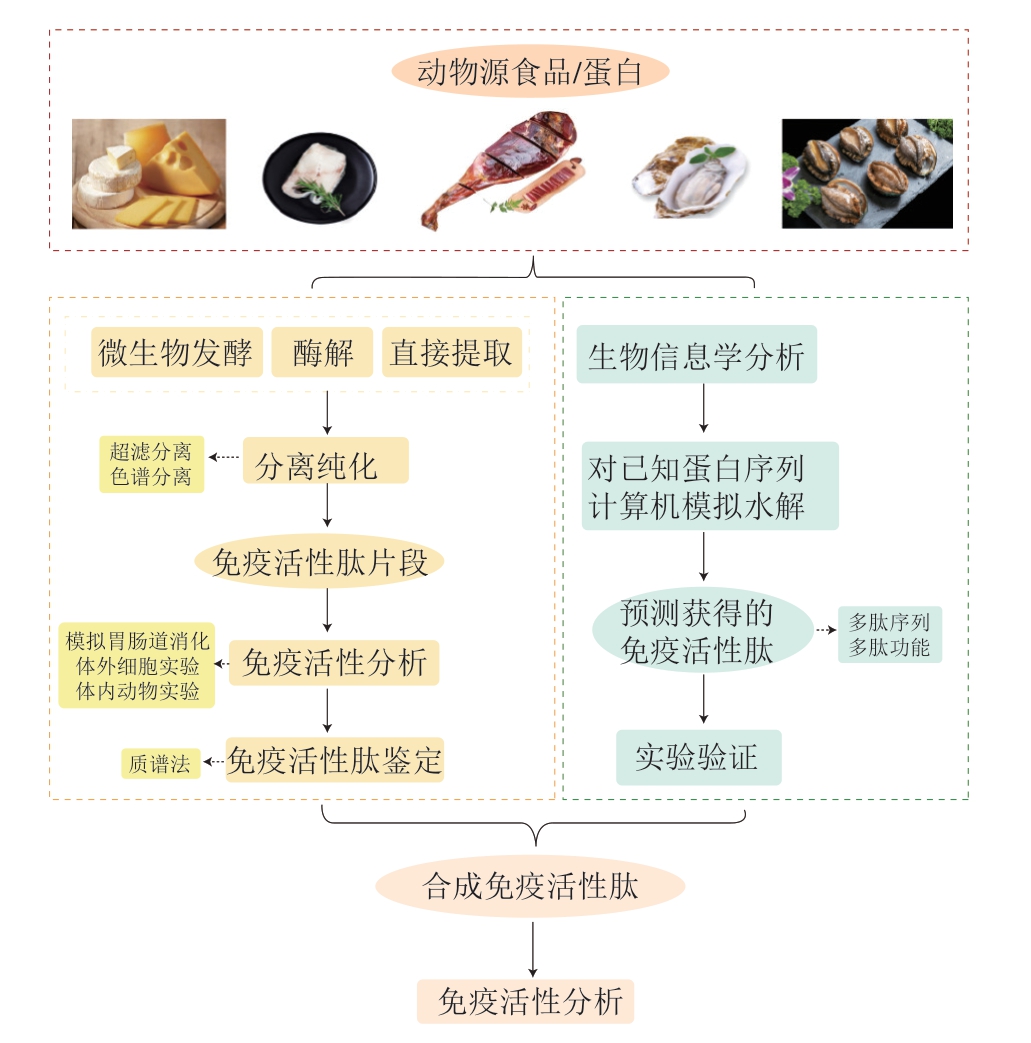
图1 动物源免疫活性肽的制备
Fig. 1 Preparation of animal-derived immunoactive peptides
1.1 免疫活性肽的提取
1.1.1 微生物发酵法
提取免疫活性肽的微生物发酵法是利用微生物代谢活动中的蛋白酶在发酵过程中将蛋白质降解为活性肽的过程[14]。根据发酵类型,可将微生物发酵分为固态发酵和液态发酵[15]。张奕[16]通过乳酸菌和酵母菌混合发酵新疆驼乳,在其上清液中提取的多肽对小鼠脾淋巴细胞增殖具有明显的刺激作用,显著增加干扰素γ(interferon γ,IFN-γ)、白细胞介素12(interleukin 12,IL-12)、IL-23等细胞因子的表达,同时明显降低核转录因子κB(nuclear factor κB,NF-κB)和IL-6的表达。在此研究中,研究者直接将发酵的驼乳上清液进行超滤制备多肽,避免了外部化学试剂的添加,在保证多肽纯度的同时且节省制备时间,突显了微生物发酵法制备多肽的优势。邢瀚文等[17]利用枯草芽孢杆菌固态发酵罗非鱼鱼皮制备胶原蛋白肽,并超滤分离得到了具有最高抗氧化活性的多肽组分TSCP-c,为罗非鱼皮的开发利用和胶原蛋白肽的技术生产途径提供了理论指导。
此外,微生物发酵法制备免疫活性肽为提高副产物或下脚料的高值化提供了思路,侯银臣等[18]利用枯草芽孢杆菌发酵羊胎盘的下脚料制备活性肽,当料液pH 5.42、发酵43.45 h、碳源含量1.73%时,发酵产物对小鼠脾细胞增殖具有明显的促进作用。微生物发酵法制备免疫活性肽工艺简单、成本低,效率高,但是产物也受原料、菌种和工艺的影响[19],发酵过程不易控制,产物不稳定,因此如何利用微生物发酵制备出标准化、产品化的免疫活性肽亟待探究。
1.1.2 酶解法
提取免疫活性肽的酶解法是指通过蛋白酶水解使蛋白质中的肽键断裂,释放出具有生物活性的肽段,酶解条件温和,安全可控,已成为制备活性肽最常用的方法[20]。蛋白酶的筛选、酶添加量、酶解时间、酶解温度等都会影响产物活性。董晓泽等[21]比较了胃蛋白酶、木瓜蛋白酶、中性蛋白酶、胰蛋白酶和碱性蛋白酶酶解日本黄姑鱼鱼皮的产物对RAW264.7细胞相对增殖率的影响。结果选定中性蛋白酶为最优酶,最佳酶解条件为pH值为7、温度45.5 ℃、时间5.5 h、酶添加量1 500 U/g,液料比10∶1(V/m),在此工艺条件下所得鱼皮酶解产物刺激小鼠巨噬细胞RAW264.7的相对增殖率为57.47%。Qian Bingjun等[22]用胰蛋白酶、胃蛋白酶和脯氨酰内肽酶酶解干牡蛎软组织得到的4 种肽组分(PEP-1,PEP-2、TRYP-2和MIX-2)对RAW264.7细胞无细胞毒性,并且可以选择性地抑制促炎介质肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、IL-1β、IL-6和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的产生。综上所述,酶解法制备多肽需要对酶种进行筛选,对酶解条件进行探索和优化才能得到具有理想免疫功能的多肽。
然而,由于蛋白酶酶切位点具有随机性和不确定性,导致筛选蛋白酶的工作量繁重且有一定盲目性,生物信息学的发展和蛋白质数据库的完善为酶解法提供了有效模拟手段。赵贵琴等[23]在蛋白数据库中检索鲈鱼心肌的肌球蛋白得到可靠氨基酸序列,并通过PeptideCutter网站,选择低特异性的胰凝乳蛋白酶、胃蛋白酶、胰蛋白酶3 种酶组合作用于鲈鱼肌球蛋白进行虚拟酶解,最后根据需要筛选出了所需的肽链。计算机模拟的利用为多肽的酶解制备节省时间、降低实验成本、提高效率,但是目前该方法只能对已知氨基酸序列的蛋白质进行模拟酶切,对于未知序列的蛋白酶解依然需要靠传统方法探索条件,所以蛋白质数据库亟需扩充和完善。
1.1.3 其他制备方法
除常用的微生物发酵法和酶解法外,免疫活性肽的制备方法还有直接提取法和人工合成法。直接提取免疫调节肽多应用于发酵食品,如干腌火腿作为一种长周期发酵肉制品,经过内源酶和微生物酶的共同作用使蛋白质降解形成大量的肽段和游离氨基酸[24],经研究表明具有较好的生物活性。Fu Lijuan等[25]用0.2 mmol/L盐酸提取宣威火腿的生物活性肽,测得肽含量为8.49%,并且证明了该多肽可以抑制脂多糖诱导的RAW264.7细胞的炎症反应。直接提取法可以最大程度保留原材料中的多肽种类,体现原材料本身的多肽组成和营养价值。人工合成法通常是基于已知肽的氨基酸序列,从氨基酸C末端到N末端进行缩合反应,大多数用于获得肽序列后进行合成,从而对相应的肽性质进行验证,比如Fu Lijuan等[25]用质谱获得肽序列后,人工合成了4 条多肽(GPPGL、GPAGPL、GPPGAP和FSGL),并测定其对脂多糖诱导下RAW264.7细胞分泌NO和IL-6的影响,结果显示GPAGPL和GPPGAP通过减少NO和IL-6的分泌而具有更高的抗炎能力。
1.2 免疫活性肽的分离纯化和鉴定
免疫活性肽的分离纯化和鉴定对于探究其生物活性及作用机理十分必要,常用的分离纯化鉴定技术包括膜分离技术、色谱分离技术以及质谱鉴定等。膜分离主要是利用分子质量的不同进行多肽分离,在分离多肽中最常用的方法是超滤。色谱分离技术主要有离子交换色谱、凝胶过滤色谱和反相高效液相色谱(reverse phase high-performance liquid chromatography,RP-HPLC)。多肽的鉴定多采用质谱法,质谱仪将多肽轰击成碎片离子,然后根据质荷比对不同的成分和结构进行分析[26],液相色谱串联质谱法(liquid chromatography tandem mass spectrometry,LC-MS/MS)经常被用于识别多肽序列,基质辅助激光解吸电离飞行时间质谱(matrix assisted laser desorption ionization time of flight mass spectrometry,MALDI-TOF-MS)可用于分析生成蛋白质水解物的肽谱,此外还有红外基质辅助激光脱附电喷雾电离质谱(infrared matrix assisted laser desorption electrospray ionization mass spectrometry,IR-MALDESI-MS)法以及液相色谱-三重四极杆串联质谱(liquid chromatographytriple quadrupole tandem mass spectrometry,LC-QQQMS)法等。
多肽的分离纯化和鉴定中通常会采用多种方法联用。Li Zhiyong等[27]将超声波预处理的蚕蛹蛋白溶液进行酶解,经过Sephadex G-100凝胶色谱柱分离,筛选出脾淋巴细胞增殖活性最高的组分,继续用G-15凝胶色谱柱分离,并用RP-HPLC进行纯化,多肽的分子质量和氨基酸序列通过离子阱质谱法测定,最终得到氨基酸序列为Asp-His-Ala-Val的四肽(DHAV)。曾瑜等[28]将厚壳贻贝粗肽依次经过Sephadex G-25、RP-HPLC分离纯化,再经过LC-MS/MS检测并筛选得到免疫活性肽LVVLGH。分离纯化的方法各有优缺点,比如超滤法虽然操作简单成本低,但是分子质量相近的混合物不适用该方法,所以在分离纯化前对粗肽的分子质量进行测定有助于对后续分离纯化方法的选择,不同的粗肽需要综合考虑采用合适的方法进行分离纯化。
1.3 基于生物信息学的免疫活性肽的鉴定和分析
随着生物信息学的快速发展,计算机分析在生物活性肽的筛选和预测、生物功能预测以及结构功能分析中的应用越来越广泛,其高通量分析能力和预测精度极大地提高了分析效率[29]。基于生物信息学的生物活性肽识别和分析主要包括酶和底物蛋白的选择、模拟酶水解、生物活性肽的鉴定和预测、生物活性的体内和/或体外验证以及作用机制的探究、多肽生物活性的预测和修饰等[30]。目前线上分析生物活性肽的数据库有BIOPEP(https://www.uwm.edu.pl/biochemia/)、PepBank(https://pepbank.mgh.harvard.edu/)、AHTpin(https://crdd.osdd.net/raghava/ahtpin/)、NCBI(https://www.ncbi.nl m.nih.gov/protein/)等[31],此外还有用PeptideCutter和BIOPEP-UWM等分析平台对已知蛋白序列进行模拟酶切等研究[32]。Chen Junbo等[33]使用ProtParam工具计算10 种兔肉蛋白质中的氨基酸残基数量,利用BIOPEP-UWM数据库评估作为血管紧张素转换酶(angiotensin I-converting enzyme,ACE)抑制肽前体的所有蛋白质的图谱,将选定的蛋白质序列采用胃蛋白酶、胰蛋白酶和糜蛋白酶同时进行模拟水解后,利用BIOPEP-UWM数据库中的“Enzyme action”工具评估蛋白质对酶促消化的敏感性,使用PeptidRanker计算释放二肽、三肽和四肽的活性得分,活性评分>0.5的肽被认为是潜在生物活性肽,然后通过BIOPEP数据库筛选出具有潜在ACE抑制活性的肽EACF和CDF。此外也有研究利用计算机模拟对蛋白酶酶种进行高效筛选。Bleakley等[34]采用PeptideCutter对燕麦蛋白进行模拟酶切,以生成的寡肽数量为指标建立肽库,从89 种蛋白酶中筛选出4 种优势酶,制备出了高二肽基肽酶抑制活性的酶解产物,同时显著降低了实验成本。计算机模拟水解和多肽生物活性预测网站的利用极大地提高了免疫活性肽的筛选效率,生物信息技术的快速发展与数据库的不断完善,为动物源免疫活性肽的鉴定和分析提供了新的思路和方法,可以加快推进免疫活性肽的发掘与活性研究。
2 动物源免疫活性肽的作用机制
动物源免疫活性肽本身不具有抗原性,其通过与抗原递呈细胞中的MHC II类分子结合并被T细胞识别后参与免疫应答,对非特异性免疫和特异性免疫均有调节作用[10]。
2.1 动物源免疫活性肽对非特异性免疫的影响
非特异性免疫又称先天性免疫或固有免疫,是机体抵御不同病原微生物入侵的第一道防线,通过生理组织屏障、免疫细胞或固有免疫分子进行免疫应答[35]。巨噬细胞、树突状细胞(dendritic cells,DCs)和自然杀伤(natural killer,NK)细胞作为主要细胞群在非特异性免疫中发挥重要作用[36]。巨噬细胞表面覆盖的多种受体可以识别外源物质,促进巨噬细胞的极化,通过分泌细胞因子参与免疫调节[10]。有研究表明紫贻贝免疫活性肽对小鼠RAW264.7巨噬细胞无毒性作用,并且能显著促进细胞的增殖能力,还可以有效激活细胞分化,提高细胞对中性红的吞噬能力[37]。珍珠贝水解肽可以降低脂多糖诱导的小鼠RAW264.7巨噬细胞NO和IL-1β、IL-6和TNF-α等炎性细胞因子的分泌量[38]。DCs作为抗原呈递细胞发挥作用,是连接非特异性免疫和特异性免疫的桥梁,同时还可以分泌细胞因子参与T细胞和B细胞的活化[39],比如蜘蛛毒分离肽分子质量小于3 kDa的部分可以激活DCs,增加激活依赖性表面标志物和细胞因子的释放(IL-1和TNF-α)[40]。NK细胞可以发挥抗肿瘤、抗病毒和免疫调节作用,从健康小牛脾脏中提取的肽LP通过NF-κB信号通路显著降低脂多糖诱导的促炎细胞因子的过表达水平,经LP处理后的NK细胞和腹腔巨噬细胞的活化细胞百分比显著增加,LP可作为治疗免疫系统疾病患者的潜在候选药物[41]。由此可见,动物源免疫活性肽主要通过激活免疫细胞、促进免疫细胞的增殖以及吞噬能力、调控细胞分泌细胞因子等途径发挥非特异性免疫作用。
2.2 动物源免疫活性肽对特异性免疫的影响
特异性免疫也被称为适应性免疫或获得性免疫,是机体被特定的抗原刺激后产生专一抗体所形成的免疫,可分为细胞免疫和体液免疫,发挥主要作用的细胞为T淋巴细胞和B淋巴细胞[42]。T淋巴细胞通过释放免疫调节因子和介导与抗原递呈细胞相互作用的细胞免疫发挥免疫功能,B淋巴细胞通过被抗原刺激后分化为浆细胞,浆细胞产生特异性抗体即免疫球蛋白来发挥免疫保护机制[43]。Yu Fangmiao等[44]分离出的青蛤多肽SCSP以剂量依赖性的方式上调了环磷酰胺诱导的免疫抑制小鼠血清中TNF-α的含量,并且使CD4+T细胞计数增加,血清中的IgA、IgG、IgM和溶血素水平显著升高,表明SCSP增强免疫抑制小鼠的细胞和体液免疫。也有研究表明卵转铁蛋白衍生肽具有免疫调节活性,其通过减少MHC II、CD83和CD86的表达以及TNF-α、IL-12 p70和趋化因子的产生抑制脂多糖诱导的小鼠骨髓源性DCs的成熟,还可以影响脂多糖刺激的骨髓基质干细胞诱导同种异体T淋巴细胞增殖的能力,并通过激活T细胞降低IFN-γ的产生[45]。Cao Hui等[46]从鸡胸骨软骨II型胶原中分离免疫调节肽,发现P3-2-4组分具有最高的脾淋巴细胞增殖活性和与人类白细胞抗原-DRB1分子的结合能力,表明其具有一定的免疫调节活性。综上所述,动物源免疫活性肽可通过调节淋巴细胞的增殖活性、T细胞亚群的数量变化、免疫细胞因子和免疫球蛋白的分泌水平等途径发挥特异性免疫调节作用。
3 动物源免疫活性肽功能评价
动物源免疫活性肽的功能评价主要包括体外细胞模型评价和体内动物模型评价,免疫细胞的增殖活性检测、巨噬细胞吞噬能力检测、细胞因子的分泌检测等是体内外免疫学检测常用的功能评价方法,同时还可以通过测定细胞通路中的蛋白分子表达情况探究免疫调控信号通路(表1)。
表1 动物源免疫活性肽的来源、制备和评价方法实例
Table 1 Sources, preparation, and evaluation methods of animal-derived immunoactive peptides
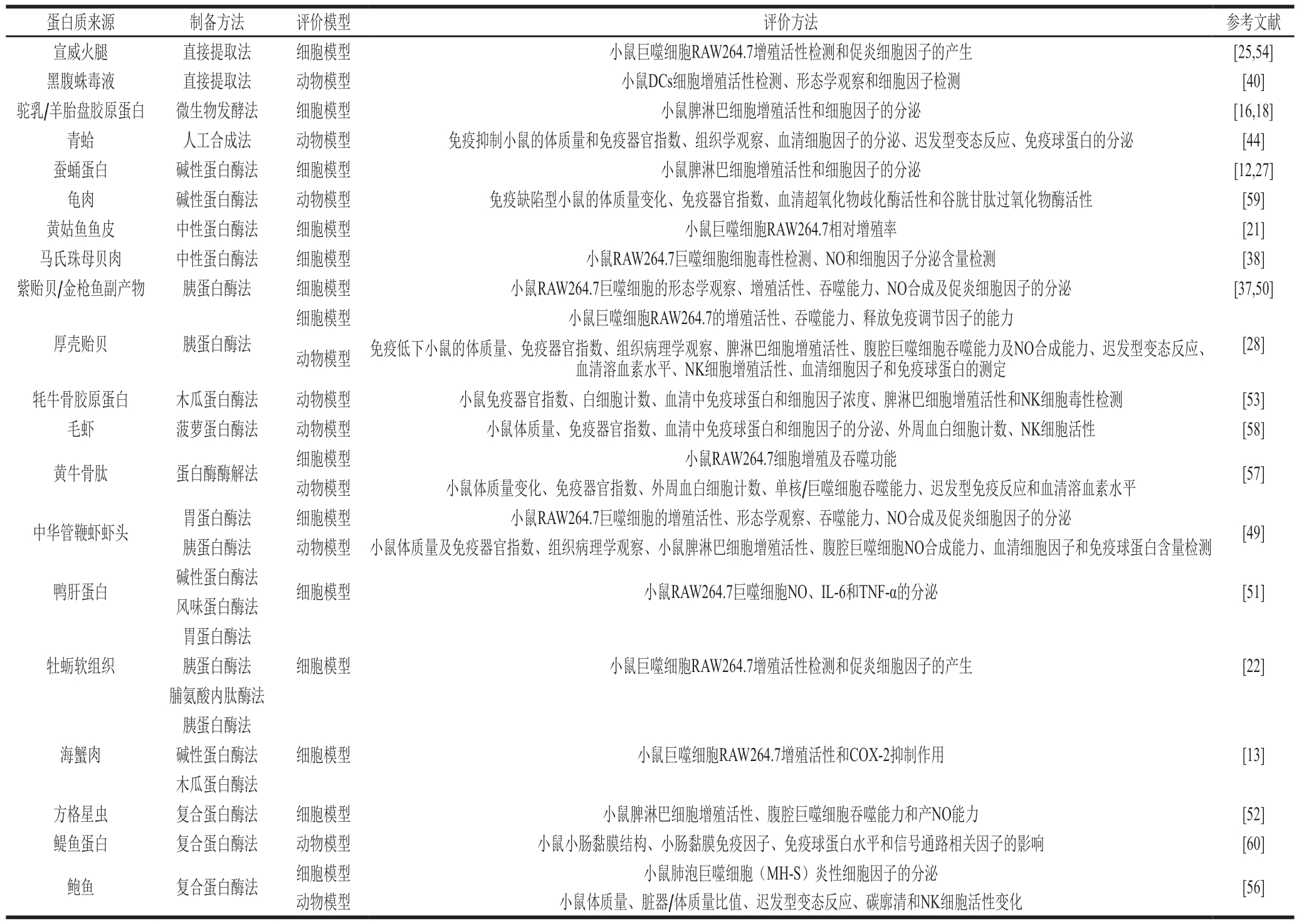
蛋白质来源制备方法评价模型评价方法参考文献宣威火腿直接提取法细胞模型小鼠巨噬细胞RAW264.7增殖活性检测和促炎细胞因子的产生[25,54]黑腹蛛毒液直接提取法动物模型小鼠DCs细胞增殖活性检测、形态学观察和细胞因子检测[40]驼乳/羊胎盘胶原蛋白微生物发酵法细胞模型小鼠脾淋巴细胞增殖活性和细胞因子的分泌[16,18]青蛤人工合成法动物模型免疫抑制小鼠的体质量和免疫器官指数、组织学观察、血清细胞因子的分泌、迟发型变态反应、免疫球蛋白的分泌[44]蚕蛹蛋白碱性蛋白酶法细胞模型小鼠脾淋巴细胞增殖活性和细胞因子的分泌[12,27]龟肉碱性蛋白酶法动物模型免疫缺陷型小鼠的体质量变化、免疫器官指数、血清超氧化物歧化酶活性和谷胱甘肽过氧化物酶活性[59]黄姑鱼鱼皮中性蛋白酶法细胞模型小鼠巨噬细胞RAW264.7相对增殖率[21]马氏珠母贝肉中性蛋白酶法细胞模型小鼠RAW264.7巨噬细胞细胞毒性检测、NO和细胞因子分泌含量检测[38]紫贻贝/金枪鱼副产物胰蛋白酶法细胞模型小鼠RAW264.7巨噬细胞的形态学观察、增殖活性、吞噬能力、NO合成及促炎细胞因子的分泌[37,50]厚壳贻贝胰蛋白酶法细胞模型小鼠巨噬细胞RAW264.7的增殖活性、吞噬能力、释放免疫调节因子的能力[28]动物模型 免疫低下小鼠的体质量、免疫器官指数、组织病理学观察、脾淋巴细胞增殖活性、腹腔巨噬细胞吞噬能力及NO合成能力、迟发型变态反应、血清溶血素水平、NK细胞增殖活性、血清细胞因子和免疫球蛋白的测定牦牛骨胶原蛋白木瓜蛋白酶法动物模型小鼠免疫器官指数、白细胞计数、血清中免疫球蛋白和细胞因子浓度、脾淋巴细胞增殖活性和NK细胞毒性检测[53]毛虾菠萝蛋白酶法动物模型小鼠体质量、免疫器官指数、血清中免疫球蛋白和细胞因子的分泌、外周血白细胞计数、NK细胞活性[58]黄牛骨肽蛋白酶酶解法细胞模型小鼠RAW264.7细胞增殖及吞噬功能[57]动物模型小鼠体质量变化、免疫器官指数、外周血白细胞计数、单核/巨噬细胞吞噬能力、迟发型免疫反应和血清溶血素水平中华管鞭虾虾头胃蛋白酶法细胞模型小鼠RAW264.7巨噬细胞的增殖活性、形态学观察、吞噬能力、NO合成及促炎细胞因子的分泌[49]胰蛋白酶法动物模型 小鼠体质量及免疫器官指数、组织病理学观察、小鼠脾淋巴细胞增殖活性、腹腔巨噬细胞NO合成能力、血清细胞因子和免疫球蛋白含量检测鸭肝蛋白碱性蛋白酶法细胞模型小鼠RAW264.7巨噬细胞NO、IL-6和TNF-α的分泌[51]风味蛋白酶法牡蛎软组织胃蛋白酶法细胞模型小鼠巨噬细胞RAW264.7增殖活性检测和促炎细胞因子的产生[22]胰蛋白酶法脯氨酸内肽酶法海蟹肉胰蛋白酶法细胞模型小鼠巨噬细胞RAW264.7增殖活性和COX-2抑制作用[13]碱性蛋白酶法木瓜蛋白酶法方格星虫复合蛋白酶法细胞模型小鼠脾淋巴细胞增殖活性、腹腔巨噬细胞吞噬能力和产NO能力[52]鳀鱼蛋白复合蛋白酶法动物模型小鼠小肠黏膜结构、小肠黏膜免疫因子、免疫球蛋白水平和信号通路相关因子的影响[60]鲍鱼复合蛋白酶法细胞模型小鼠肺泡巨噬细胞(MH-S)炎性细胞因子的分泌[56]动物模型小鼠体质量、脏器/体质量比值、迟发型变态反应、碳廓清和NK细胞活性变化
3.1 体外模型免疫活性评价
免疫活性肽的体外功能评价通常采用细胞模型来检测。巨噬细胞通过吞噬作用直接杀死病原体,或通过释放NO及细胞因子(如TNF-α和IL-6)间接杀死病原体,被认为是评估生物活性化合物免疫调节活性的理想细胞模型[47],小鼠巨噬细胞RAW264.7是最常用的细胞模型之一。此外,DCs、人单核细胞U937巨噬细胞、结肠癌细胞(Caco-2细胞)、结直肠癌细胞(HT-29细胞)等亦用于免疫活性评价[48]。
动物源免疫活性肽可以通过促进巨噬细胞的增殖活化及细胞因子的分泌进行免疫调节。姜烁琦等[49]以中华管鞭虾的虾头为原料制备了低分子质量活性肽SCHPs-F1,发现其在一定浓度范围内可以剂量依赖性的促进RAW264.7细胞增殖,并且使巨噬细胞活化,增强其吞噬和趋化能力。当质量浓度为200 μg/mL时,SCHPs-F1显著促进NO、TNF-α和IL-1β的分泌。进一步联合采用免疫荧光、免疫印迹技术分析SCHPs-F1对RAW264.7细胞中NF-κB通路和丝裂原激活蛋白激酶(mitogenactivated protein kinase,MAPK)相关通路蛋白的表达情况,推测其可能通过这两条信号通路激活巨噬细胞以及相关细胞因子的释放,从而呈现一定的体外免疫调节活性。金枪鱼辅料的胰蛋白酶水解物分离得到的肽段可以增强RAW264.7细胞的吞噬能力,并促进NO、IL-1β、IL-6和TNF-α的分泌,此外还显著增加了Toll样受体2(Toll-like receptor 2,TLR2)和TLR4的表达,并进一步激活NF-κB信号通路以促进RAW264.7细胞的免疫反应[50]。动物源免疫活性肽也可以通过抑制免疫细胞中促炎细胞因子的释放发挥抗炎功效,比如鸭肝蛋白酶解后的活性肽[51]对脂多糖诱导的RAW264.7细胞中NO、TNF-α和IL-6等炎症细胞因子的释放具有不同的抑制活性,表现出一定的抗炎作用。
除上述传代细胞外,原代细胞也可以用作免疫活性评价。一般在无菌条件下提取小鼠腹腔巨噬细胞或者脾淋巴细胞培养后用多肽进行孵育预处理,通过检测对比细胞活性、形态变化或者细胞因子分泌水平,从而对多肽的免疫活性进行评估。孙瑞坤[52]通过提取小鼠脾淋巴细胞来体外评估方格星虫酶解产物的免疫活性,结果显示,在0.1~0.6 mg/mL范围内可以促进小鼠脾淋巴细胞的增殖活性。Gao Song等[53]制备的牦牛骨胶原蛋白的木瓜蛋白酶水解物可以促进脾淋巴细胞的增殖和抑制巨噬细胞NO产生。
此外,研究表明食源性免疫活性肽的生物功效可能会受到胃肠消化吸收和代谢等的影响。邢路娟等[54]实验证明经体外胃肠道模拟消化后,干腌火腿肽段数量显著增加,小肽数量占比增高,多肽对巨噬细胞炎症因子分泌的抑制作用增强,表明胃肠道模拟消化使火腿多肽降解产生了大量小分子肽,且增强了其抗炎作用。然而也有多肽的生物功效不受胃肠道消化的影响,但经细胞转运后生物功效明显提高。Liang Qiufang等[55]研究发现玉米醇溶蛋白水解产物及其胃肠道模拟消化物均显著降低了TNF-α诱导的内皮细胞中促炎血管细胞黏附分子-1的表达,但是模拟消化前后的抗炎活性并无显著性差异。然而经过Caco-2细胞上皮转运后获得的多肽抗炎活性显著提升,可能是由于转运后抗炎肽的选择性积累或在Caco-2细胞中肽酶的作用下形成具有高生物活性的新肽。
3.2 动物模型免疫活性评价
免疫活性肽的体内功能评价通常利用动物模型来评估,通常用多肽喂养正常小鼠或者免疫抑制的小鼠模型,分析小鼠体质量、免疫器官指数、脾淋巴细胞增殖活性、细胞因子分泌和免疫球蛋白表达情况等来评估多肽的免疫活性。王敏等[56]用不同剂量的鲍鱼水解肽喂养正常小鼠,体质量无明显变化,免疫器官胸腺和脾脏与体质量的比值差异不显著,表明水解肽对小鼠机体无明显毒性作用,同时高剂量的水解肽显著提高了小鼠的单核-巨噬细胞吞噬能力,对NK细胞的活性具有极显著的促进作用,表明鲍鱼水解肽具有一定的免疫调节作用。也有研究以免疫抑制小鼠为模型评估多肽的免疫活性。段毅超等[57]研究结果显示黄牛骨肽可以缓解免疫抑制小鼠的体质量下降,增加小鼠的相对脾脏指数和胸腺指数,并且多肽的中高剂量组小鼠比免疫抑制组小鼠的血清溶血素抗体水平显著增加,表明黄牛骨肽具有较好的免疫调节活性。杨志艳等[58]通过环磷酰胺诱导建立免疫抑制小鼠模型,探究毛虾活性肽的免疫调节功能,结果显示小鼠经不同剂量组的活性肽灌胃后,免疫抑制小鼠的体质量显著增加,脾脏指数和胸腺指数显著提高,血清中免疫球蛋白(IgA、IgG和IgM)以及细胞因子(IL-2、IL-6和TNF-α)水平也明显提升,外周血白细胞总数基本恢复正常水平,NK细胞活性显著增强,表明毛虾活性肽可以改善免疫抑制剂导致的免疫功能损伤,具有增强免疫抑制小鼠免疫调节的作用。此外,也有研究表明黄塘龟和三纹箱龟的蛋白酶解物可改变环磷酰胺诱导的免疫缺陷型小鼠体质量增长曲线、胸腺和脾脏指数、血清超氧化物歧化酶活性和谷胱甘肽过氧化物酶活性,具有良好的免疫增强效果[59]。除了上述常用的测定指标外,也有学者通过探究活性肽对免疫抑制小鼠的肠道黏膜免疫功能的影响,揭示其免疫调节作用。刘银媛等[60]研究表明鳀鱼蛋白肽可以减轻环磷酰胺造成的小鼠肠黏膜结构损伤,提高小肠绒毛长度,降低隐窝深度,同时还能够改善环磷酰胺对小肠黏膜中免疫因子的抑制,上调免疫球蛋白的分泌和小肠中TLR-4、TLR-6、TLR-9和NF-κB基因表达,具有改善环磷酰胺对肠黏膜结构造成的损伤和肠黏膜免疫功能的作用。
4 结语
目前有大量研究者对动物源免疫活性肽的制备、作用机制以及功能评价进行了探讨,免疫活性肽可以促进免疫调节,减轻炎症反应,在功能性食品和医药领域具有广阔的应用前景,但是仍有诸多方向亟待加强研究。一是创新免疫活性肽的制备方法,目前常用的是酶解法且研究多集中在探讨酶解条件上,可以扩充活性肽的制备研究思路,比如通过物理技术(超高压、超声波等)辅助酶解,微生物-酶协同法等高效制备活性肽,开发新的活性肽制备工艺;二是提高免疫活性肽的筛选效率,目前常用的免疫活性肽分离纯化方法耗时长且纯度不高,可以充分利用计算机模拟、数据库筛选并结合组学技术提高活性肽的筛选效率;三是动物源性免疫活性肽的作用机制有待深入研究,免疫调节与多种免疫疾病,如炎症、高血压和其他过敏性疾病密切相关,对作用机制的深入探讨可以为活性肽预防和治疗相应疾病提供理论基础;四是活性肽的功能评价目前多为细胞模型和动物模型,缺少临床试验或者人体试验来验证免疫调节作用。此外免疫活性肽功效评价相关的国家标准亟待完善,以促进评价指标的规范性和科学性。
[1] JAKUBCZYK A, KARAŚ M, RYBCZYŃSKA-TKACZYK K, et al.Current trends of bioactive peptides: new sources and therapeutic effect[J]. Foods, 2020, 9(7): 846. DOI:10.3390/foods 9070846.
[2] MANZOOR M, SINGH J, GANI A. Exploration of bioactive peptides from various origin as promising nutraceutical treasures: in vitro, in silico and in vivo studies[J]. Food Chemistry, 2022, 373: 131395.DOI:10.1016/j.foodchem.2021.131395.
[3] SAMTIYA M, ACHARYA S, PANDEY K K, et al. Production,purification, and potential health applications of edible seeds’bioactive peptides: a concise review[J]. Foods, 2021, 10(11): 2696.DOI:10.3390/foods10112696.
[4] XU Z, MAO T M, HUANG L, et al. Purification and identification immunomodulatory peptide from rice protein hydrolysates[J]. Food and Agricultural Immunology, 2019, 30(1): 150-162. DOI:10.1080/09 540105.2018.1553938.
[5] PAVLICEVIC M, MARMIROLI N, MAESTRI E. Immunomodulatory peptides: a promising source for novel functional food production and drug discovery[J]. Peptides, 2022, 148: 170696. DOI:10.1016/j.peptides.2021.170696.
[6] 方心宇, 冷瑞雪, 范引光, 等. 自身免疫性疾病流行病学研究进展[J].中华疾病控制杂志, 2021, 25(8): 869-873. DOI:10.16462/j.cnki.zhjbkz.2021.08.001.
[7] 姬芳玲, 吴健, 贾凌云. 免疫吸附治疗自身免疫疾病的研究进展[J].生物化学与生物物理进展, 2022, 49(1): 139-148. DOI:10.16476/j.pibb.2021.0384.
[8] 罗仁幸, 王妍妍, 黄功华. 纳米载药技术在几种常见自身免疫性疾病模型中的应用研究进展[J]. 中南药学, 2023(7): 1890-1896.DOI:10.7539/j.issn.1672-2981.2023.07.032.
[9] SINGH B P, ALUKO R E, HATI S, et al. Bioactive peptides in the management of lifestyle-related diseases: current trends and future perspectives[J]. Critical Reviews in Food Science and Nutrition, 2022,62(17): 4593-4606. DOI:10.1080/10408398.2021.1877109.
[10] 马可儿, 李卫静, 何荣. 免疫调节肽的研究进展及开发现状[J].粮食科技与经济, 2022, 47(5): 114-120. DOI:10.16465/j.gste.cn431252ts.20220527.
[11] JOLLES P, PARKER F, FLOC’H F, et al. Immunostimulating substances from human casein[J]. Journal of Immunopharmacology,1981, 3(3/4): 363-370. DOI:10.3109/08923978109031067.
[12] LI Z Y, ZHAO S, XIN X D, et al. Purification and characterization of a novel immunomodulatory hexapeptide from alcalase hydrolysate of ultramicro-pretreated silkworm (Bombyx mori) pupa protein[J]. Journal of Asia-Pacific Entomology, 2019, 22(3): 633-637. DOI:10.1016/j.aspen.2019.04.005.
[13] NARAYANASAMY A, BALDE A, RAGHAVENDER P, et al.Isolation of marine crab (Charybdis natator) leg muscle peptide and its anti-inflammatory effects on macrophage cells[J]. Biocatalysis and Agricultural Biotechnology, 2020, 25: 101577. DOI:10.1016/j.bcab.2020.101577.
[14] RAVESCHOT C, CUDENNEC B, COUTTE F, et al. Production of bioactive peptides by Lactobacillus species: from gene to application[J]. Frontiers in Microbiology, 2018, 9: 2354. DOI:10.3389/fmicb.2018.02354.
[15] CHAI K F, VOO A Y H, CHEN W N. Bioactive peptides from food fermentation: a comprehensive review of their sources, bioactivities,applications, and future development[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(6): 3825-3885.DOI:10.1111/1541-4337.12651.
[16] 张奕. 新疆发酵驼乳免疫活性肽的分离鉴定及免疫调节机制研究[D].乌鲁木齐: 新疆医科大学, 2016.
[17] 邢瀚文, 韩玮, 施文正, 等. 固态发酵法制备罗非鱼皮胶原蛋白肽及其抗氧化活性研究[J]. 食品与发酵工业, 2020, 46(19): 104-110.DOI:10.13995/j.cnki.11-1802/ts.024123.
[18] 侯银臣, 吴丽, 刘旺旺, 等. 羊胎盘免疫活性肽的制备及其活性[J].中国食品学报, 2016, 16(1): 123-129. DOI:10.16429/j.1009-7848.2016.01.017.
[19] 高博雅, 李平兰. 微生物发酵技术生产水产胶原蛋白肽的研究进展[J]. 中国酿造, 2023, 42(3): 1-7. DOI:10.11882/j.issn.0254-5071.2023.03.001.
[20] 傅丽娟, 邢路娟, 张万刚. 食源性抗炎活性肽的研究进展[J].中国食品学报, 2022, 22(8): 343-352. DOI:10.16429/j.1009-7848.2022.08.037.
[21] 董晓泽, 徐书敏, 王丽君, 等. 日本黄姑鱼鱼皮免疫活性肽的酶解制备工艺研究[J]. 浙江海洋大学学报(自然科学版), 2020, 39(2): 110-116.
[22] QIAN B J, ZHAO X, YANG Y, et al. Antioxidant and antiinflammatory peptide fraction from oyster soft tissue by enzymatic hydrolysis[J]. Food Science & Nutrition, 2020, 8(7): 3947-3956.DOI:10.1002/fsn3.1710.
[23] 赵贵琴, 李婷婷, 宋敏杰, 等. 分子对接技术筛选鲈鱼肌球蛋白中黄嘌呤氧化酶抑制肽[J]. 中国食品学报, 2021, 21(6): 81-91.DOI:10.16429/j.1009-7848.2021.06.010.
[24] 李平, 杨婷, 周辉, 等. 干腌火腿中生物活性肽功能特性研究进展[J].食品科学, 2021, 42(11): 278-283. DOI:10.7506/spkx1002-6630-20200418-238.
[25] FU L J, XING L J, HAO Y J, et al. The anti-inflammatory effects of dry-cured ham derived peptides in RAW264.7 macrophage cells[J].Journal of Functional Foods, 2021, 87: 104827. DOI:10.1016/j.jff.2021.104827.
[26] 谢博, 傅红, 杨方. 生物活性肽的制备、分离纯化、鉴定以及构效关系研究进展[J]. 食品工业科技, 2021, 42(5): 383-391.DOI:10.13386/j.issn1002-0306.2020050012.
[27] LI Z Y, ZHAO S, XIN X D, et al. Purification, identification and functional analysis of a novel immunomodulatory peptide from silkworm pupa protein[J]. International Journal of Peptide Research and Therapeutics, 2020, 26: 243-249. DOI:10.1007/s10989-019-09832-4.
[28] 曾瑜. 厚壳贻贝活性肽的分离纯化、表征及其免疫调节作用的研究[D]. 舟山: 浙江海洋大学, 2022.
[29] FITZGERALD R J, CERMEÑO M, KHALESI M, et al. Application of in silico approaches for the generation of milk protein-derived bioactive peptides[J]. Journal of Functional Foods, 2020, 64: 103636.DOI:10.1016/j.jff.2019.103636.
[30] TU M L, CHENG S Z, LU W H, et al. Advancement and prospects of bioinformatics analysis for studying bioactive peptides from food-derived protein: sequence, structure, and functions[J]. TrAC Trends in Analytical Chemistry, 2018, 105: 7-17. DOI:10.1016/j.trac.2018.04.005.
[31] GUO Q Y, CHEN P F, CHEN X G. Bioactive peptides derived from fermented foods: preparation and biological activities[J]. Journal of Functional Foods, 2023, 101: 105422. DOI:10.1016/j.jff.2023.105422
[32] 李富强, 张廷新, 朱丽萍, 等. 食物蛋白源免疫调节肽研究进展[J]. 食品与发酵工业, 2022, 48(1): 308-314. DOI:10. 13995/j.cnki.11-1802/ts. 028607.
[33] CHEN J B, YU X D, CHEN Q Z, et al. Screening and mechanisms of novel angiotensin-I-converting enzyme inhibitory peptides from rabbit meat proteins: a combined in silico and in vitro study[J]. Food Chemistry, 2022, 370: 131070. DOI:10.1016/j.foodchem. 2021.131070
[34] BLEAKLEY S, HAYES M, O’SHEA N, et al. Predicted release and analysis of novel ACE-I, renin, and DPP-IV inhibitory peptides from common oat (Avena sativa) protein hydrolysates using in silico analysis[J]. Foods, 2017, 6(12): 108. DOI:10.3390/foods6120108.
[35] 尚丽君, 谯仕彦. 天然免疫调节肽的研究进展[J]. 饲料工业, 2022,43(5): 55-60. DOI:10.13302/j.cnki.fi.2022.05.010.
[36] TAK Y, KAUR M, AMAROWICZ R, et al. Pulse derived bioactive peptides as novel nutraceuticals: a review[J]. International Journal of Peptide Research and Therapeutics, 2021, 27(3): 2057-2068.DOI:10.1007/s10989-021-10234-8.
[37] 于莹, 宿小杰, 周德庆, 等. 响应面法优化紫贻贝免疫活性肽的制备工艺[J]. 中国海洋药物, 2021, 40(6): 21-29. DOI:10.13400/j.cnki.cjmd.2021.06.001.
[38] 沈金鹏, 王珂雯, 黄潘钿, 等. 珍珠贝水解肽的制备、氨基酸组成及抗炎活性[J]. 食品与机械, 2023, 39(2): 132-139; 206. DOI:10.13652/j.spjx.1003.5788.2022.80425.
[39] 李琳琳, 朱珊, 陈京涛. 外泌体调控树突状细胞免疫功能的研究进展[J]. 中国免疫学杂志, 2023, 39(2): 404. DOI:10.3969/j.issn.1000-484X.2023.02.034.
[40] DE MATO F C, BARRETO N, CORDEIRO G, et al. Isolated peptide from spider venom modulates dendritic cells in vitro: a possible application in oncoimmunotherapy for glioblastoma[J]. Cells, 2023,12(7): 1023. DOI:10.3390/cells12071023.
[41] WANG J, ZHENG M Z, MIN Q X, et al. The dual regulatory function of lienal peptide on immune system[J]. International Immunopharmacology, 2018, 55: 245-253. DOI:10.1016/j.intimp.2017.12.005.
[42] 李欣茹, 赵永强, 薛长湖, 等. 海洋源活性多糖的免疫调节作用研究进展[J]. 食品安全质量检测学报, 2023, 14(2): 138-145.DOI:10.19812/j.cnki.jfsq11-5956/ts.2023.02.017.
[43] 文李, 刘步青, 许宙, 等. 食源性免疫活性肽的筛选策略及作用机制研究进展[J]. 食品与机械, 2020, 36(2): 7-11; 37. DOI:CNKI:SUN:SP JX.0.2020-02-002.
[44] YU F M, ZHANG Z W, YE Shengwang, et al. Immunoenhancement effects of pentadecapeptide derived from Cyclina sinensis on immunedeficient mice induced by cyclophosphamide[J]. Journal of Functional Foods, 2019, 60: 103408. DOI:10.1016/j.jff.2019.06.010.
[45] RATHNAPALA E C N, AHN D U, ABEYRATHNE S. Functional properties of ovotransferrin from chicken egg white and its derived peptides: a review[J]. Food Science and Biotechnology, 2021, 30(5):619-630. DOI:10.1007/s10068-021-00901-3.
[46] CAO H, CAO J F, ZHANG Y J, et al. Continuous preparation and characterization of immunomodulatory peptides from type II collagen by a novel immobilized enzyme membrane reactor with improved performance[J]. Journal of Food Biochemistry, 2019, 43(7): e12862.DOI:10.1111/jfbc.12862.
[47] ZHANG M M, WANG G, LAI F R, et al. Structural characterization and immunomodulatory activity of a novel polysaccharide from Lepidium meyenii[J]. Journal of Agricultural and Food Chemistry,2016, 64(9): 1921-1931. DOI:10.1021/acs.jafc.5b05610.
[48] 张芷萌, 倪策, 欧晓晖, 等. 食源性生物活性肽的免疫功能研究进展[J].食品与机械, 2023, 39(5): 193-202. DOI:10.13652/j.spjx.1003.5788.2022.60156.
[49] 姜烁琦. 中华管鞭虾虾头活性肽的免疫调节作用研究[D]. 舟山:浙江海洋大学, 2021. DOI:10.27747/d.cnki.gzjhy.2021.000270.
[50] CAI B N, CHEN H, WAN P, et al. Isolation and identification of immunomodulatory peptides from the protein hydrolysate of tuna trimmings (Thunnas albacares)[J]. LWT-Food Science and Technology, 2022, 164: 113614. DOI:10.1016/j.lwt.2022.113614.
[51] 张来弟, 孙杨赢, 周昌瑜, 等. 鸭肝蛋白酶解产物中抗炎肽的分离鉴定及活性分析[J]. 食品科学, 2023, 44(12): 150-156. DOI:10.7506/spkx1002-6630-20211216-196.
[52] 孙瑞坤. 裸体方格星虫活性肽的酶法制备及其免疫活性的研究[D].广州: 广东海洋大学, 2019.
[53] GAO S, HONG H, ZHANG C Y, et al. Immunomodulatory effects of collagen hydrolysates from yak (Bos grunniens) bone on cyclophosphamide-induced immunosuppression in BALB/c mice[J].Journal of Functional Foods, 2019, 60: 103420. DOI:10.1016/j.jff.2019.103420.
[54] 邢路娟, 任晓镤, 王紫旭, 等. 体外胃肠道消化及跨膜转运对干腌火腿肽抗炎活性的影响[J]. 肉类研究, 2022, 36(10): 1-7. DOI:10.7506/rlyj1001-8123-20220919-120.
[55] LIANG Q F, CHALAMAIAH M, REN X F, et al. Identification of new anti-inflammatory peptides from zein hydrolysate after simulated gastrointestinal digestion and transport in Caco-2 cells[J].Journal of Agricultural and Food Chemistry, 2018, 66(5): 1114-1120.DOI:10.1021/acs.jafc.7b04562.
[56] 王敏, 卢赛, 张曾亮. 鲍鱼水解肽的抗氧化、抗炎及免疫调节作用[J]. 食品工业科技, 2021, 42(5): 282-288. DOI:10.13386/j.issn1002-0306.2020050062.
[57] 段毅超, 郭汝悦, 刘怀高, 等. 黄牛骨肽对巨噬细胞及免疫低下小鼠的免疫调节作用[J]. 食品研究与开发, 2022, 43(24): 58-65.DOI:10.12161/j.issn.1005-6521.2022.24.009.
[58] 杨志艳, 惠婷婷, 祝宝华, 等. 中国毛虾活性肽对免疫抑制小鼠免疫调节作用的影响[J]. 食品工业科技, 2023, 44(9): 380-386.DOI:10.13386/j.issn1002-0306.2022080148.
[59] LV Y B, ZHOU Q, FAN Y, et al. Preparation, structural identification and intervention on immunodeficiency mice of enzymatic peptides from Mauremys mutica and Cuora trifasciata[J]. Journal of Ethnopharmacology, 2019, 241: 111920. DOI:10.1016/j.jep.2019.111920.
[60] 刘银媛, 王寒梅, 逯良忠, 等. 鳀鱼蛋白肽和大豆蛋白肽的多肽组成和小肠黏膜免疫调节活性的比较[J]. 食品科学, 2023, 44(19): 107-117. DOI:10.7506/spkx1002-6630-20230103-015.