牛肉由于其丰富的蛋白质等营养物质与绝佳的风味,是消费量排行第三的肉类,仅次于猪肉和禽肉。根据美国农业部统计,2022年牛肉及牛肉制品的总出口量为117.1 亿美元,而中国市场高达21.4 亿美元,成为仅次于韩国和日本的世界第三大出口国。随着生活品质的提高和市场的全球化,新鲜牛肉的需求量越来越大,故延长新鲜牛肉的保质期变得越来越重要。此外,牛肉中含有丰富的营养成分,因此,在运输、加工和贮藏过程中,易发生因其代谢和微生物污染引起的氧化反应[1]。酸类、醛类及高铁肌红蛋白含量升高,导致色泽和风味变差、汁液流失率高、货架期缩短、营养价值降低,严重影响牛肉的消费者可接受性,给肉类行业带来巨大经济损失。在全球范围内,每年有263.50亿 t肉类被浪费,其中约50%的肉类浪费发生在贮藏阶段[2]。因此,预防生鲜牛肉变质一直是肉类行业的研究难点与热点。
肌原纤维蛋白是肌肉中含量最高的蛋白质,约占肉类蛋白含量的55%~60%,蛋白质的功能特性影响肉和肉制品品质[3]。蛋白质氧化往往会引起蛋白理化性质的改变,从而导致牛肉肉色劣变、持水力降低以及营养价值的降低[4]。自由基是蛋白氧化的首要作用产物,并且还可以诱导脂质氧化和非酶糖基化,并通过活性中间产物间接诱导蛋白质氧化。
牛肉在运输、贮藏以及销售过程中不可避免的光照及与氧气接触引发了自动氧化与光氧化。目前,氧气对牛肉以及蛋白的氧化已有大量研究,而关于光照对牛肉以及蛋白氧化影响的研究还鲜有报道。因此,本实验对冷鲜牛肉在不同氧化处理下,即光照与氧气对牛肉以及肌原纤维蛋白氧化的影响进行研究,通过测定牛肉的理化性质和氧化程度,肌原纤维蛋白的结构与功能性质的变化,研究肌原纤维蛋白氧化与牛肉氧化间的构效关系,以及光氧化对蛋白的作用机制,旨在为牛肉贮藏运输过程中品质控制提供理论依据和方法指导。
1 材料与方法
1.1 材料与试剂
鲜牛里脊肉 湖北省武汉市洪山区南湖大道悦活里超市。
1.2 仪器与设备
CR-400色度仪 日本柯尼卡-美能达控股株式会社;FE20 pH计 梅特勒-托利多仪器(上海)有限公司;UV2100紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;K9840自动凯氏定氮仪 山东海能科学仪器有限公司;AJ高速冷冻离心机 美国贝克曼公司;PMK124ZH/E分析天平 奥豪斯仪器(常州)有限公司;FSH-2A可调速均质机 常州越新仪器制造有限公司;F-4600荧光分光光度计 丹麦福斯集团公司;AUX-PB953破壁机 佛山市海迅电器有限公司。
1.3 方法
1.3.1 牛肉的氧化处理
牛肉糜预处理:将牛里脊肉冰温运输至实验室,及时用破壁机以3档破碎30 s,重复3 次得到肉糜。取10 g肉糜分别置于无光无氧(A组:样品用真空袋包装后抽真空,并且通过套上黑色包装袋避光)、避光(B组:不密封,装于不密封的真空袋后用黑色包装袋避光)、无氧(C组:自然光,装于真空袋后抽真空密封)以及自然冷藏条件(D组:自然光、不密封,装于真空袋),4 种条件(均置于4 ℃)下贮藏,在第0、1、2、3、4、5天测量指标。
牛肉块预处理:将牛肉切成5 mm×5 mm×3 mm的规格,与牛肉糜的处理与保存方法相同,用于扫描电镜观察。
1.3.2 肌原纤维蛋白的提取取10 g肉糜,加入40 mL缓冲液(0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L乙二醇四乙酸、6.1 mmol/L磷酸氢二钠和3.9 mmol/L磷酸二氢钠,pH 7.0)。均质30 s后以2 000×g离心15 min取沉淀,后以相同的混合和离心条件,洗涤沉淀(粗肌原纤维蛋白)2 次。然后在上述相同条件下用40 mL 0.1 mol/L NaCl溶液再洗涤沉淀2 次。第3次时,取沉淀通过4 层粗棉布过滤以除去结缔组织,并在离心前用0.1 mol/L HCl溶液将其pH值调节至6.0(以模拟加工肉类中的pH值条件)[5]。
1.3.3 牛肉糜贮藏过程中的理化性质以及品质指标测定
1.3.3.1 色值
参考Fu Li等[6]的方法,并略作修改。测定牛肉糜不同位置6 个点的色差,取平均值。色差仪使用前先在白色和黑色标准板上校准,再对牛肉糜进行测定,分别记录亮度值(L*)、红度值(a*)、黄度值(b*)。
1.3.3.2 pH值
参考GB 5009.237—2016《食品安全国家标准 食品pH值的测定》,称取2 g肉糜,加入20 g氯化钾溶液(0.1 mol/L),用均质机均质1 min,用pH计进行测定,待读数显示稳定以后,直接读数,精确至0.01。同一制备试样至少进行2 次测定。
1.3.3.3 硫代巴比妥酸反应物(thiobarbituric reactive substances,TBARs)值
参考GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》中的分光光度法,测定牛肉糜的TBARs值。
1.3.3.4 挥发性盐基氮(total volatile base nitrogen,TVB-N)含量
参考GB/T 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中的自动凯氏定氮仪法,测定牛肉糜的TVB-N含量。取10 g肉糜,精确至0.001 g,置于蒸馏管内,加入75 mL水,振摇,使试样在样液中分散均匀,浸渍30 min后进行测定。TVB-N含量按式(1)计算。
式中:X为牛肉中TVB-N含量/(mg/100 g);V1为试样消耗盐酸或硫酸标准滴定溶液的体积/mL;V2为试样空白消耗盐酸或硫酸标准滴定溶液的体积/mL;c为盐酸或硫酸标准滴定溶液的浓度/(mol/L)。
1.3.3.5 微观结构观察
将不同处理组的牛肉切成5 mm×5 mm×3 mm的规格,在2.5%戊二醇溶液中固定12 h后用不同体积分数乙醇溶液中脱水10 min。将脱水后的牛肉样品冷冻干燥后,在扫描电子显微镜下观察微观结构。
1.3.3.6 高铁肌红蛋白含量
参照Krzywicki[7]的方法,取肉样5 g,加入25 mL 0.04 mol/L磷酸钠缓冲液(pH 6.8),用超细匀浆器在室温下以转速10 000 r/min均质25 s。置均质液于4 ℃冰箱中放置1 h,然后于4 500×g、2~4 ℃条件下离心20 min。将上清液通过滤纸过滤,滤液用分光光度计分别在525、545、565 nm和572 nm处测其吸光度。高铁肌红蛋白相对含量按式(2)计算。
式中:P1为高铁肌红蛋白相对含量/%;R1、R2、R3分别为A572 nm/A525 nm、A565 nm/A525 nm、A545 nm/A525 nm。
1.3.4 蛋白结构以及功能性质测定
1.3.4.1 羰基含量
参照符婉丽等[8]的方法,并稍作修改。将肌原纤维蛋白原液稀释至2 mg/mL,在2 mL离心管内加入0.5 mL肌原纤维蛋白稀释液和0.5 mL 10 mmol/L 2,4-二硝基苯肼(含2 mol/L盐酸),对照组加入0.5 mL肌原纤维蛋白稀释液和0.5 mL 2 mol/L盐酸溶液,室温下反应1 h。再加入0.5 mL质量分数20%三氯乙酸溶液,在12 000 r/min条件下离心10 min(4 ℃),倒掉上清液,加入1 mL无水乙醇-乙酸乙酯(体积比1∶1),同样条件下重复离心操作4 次,至沉淀无颜色。将沉淀物溶于1.5 mL 6 mol/L盐酸胍溶液中,在37 ℃下准确水浴15 min,在12 000 r/min条件下离心15 min,取上清液,盐酸胍溶液进行调零。在370 nm处测吸光度。羰基含量按式(3)计算。
式中: n 为稀释倍数; ε 为摩尔吸光系数22 000 L/(mol·cm);ρ为蛋白质量浓度/(mg/mL)。
1.3.4.2 总巯基含量
按照符婉丽等[8]方法进行测定。将肌原纤维蛋白溶液稀释至2 mg/mL,取0.5 mL,加入2 mL尿素-十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液(8.0 mol/L尿素、30.0 g/L SDS、0.1 mol/L磷酸钠缓冲液,pH 7.4)和0.5 mL 10 mmol/L 2-二硝基苯甲酸试剂(0.1 mol/L)磷酸钠缓冲液(pH 7.4)。用磷酸盐缓冲溶液代替肌原纤维蛋白溶液作对照组。室温下反应15 min,取上清液在412 nm下测定吸光度。总巯基含量按式(4)计算。
式中: n 为稀释倍数; ε 为摩尔吸光系数11 400 L/(mol·cm);ρ为蛋白质量浓度/(mg/mL)。
1.3.4.3 二聚酪氨酸含量
参照Davies等[9]的方法,用20 mmol/L磷酸盐溶液(含0.6 mol/L KCl,pH 6.0)将氧化后的蛋白溶液稀释到1 mg/mL。蛋白溶液经离心(10 000 r/min,10 min)除去不溶性物质。用荧光分光光度计测定荧光强度,激发波长为325 nm,发射波长为420 nm,狭缝宽度为10 nm。二聚酪氨酸含量用所测荧光强度除以蛋白质量浓度获得,以相对荧光值表示。
1.3.4.4 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)
取第0、3、5天的样品,稀释至4 mg/mL后与5×上样缓冲液以1∶1混合,沸水浴5 min,冷却后离心(8 000 r/min、10 min),取上清液进行SDS-PAGE分析。
1.4 数据处理
实验均重复3 次,采用SPSS 25.0软件对数据进行统计分析,不同处理组间P<0.05,有显著性差异;使用Origin 2023软件绘图。
2 结果与分析
2.1 不同氧化处理对贮藏过程中牛肉糜理化性质的影响
2.1.1 pH值
牛肉宰时pH值高达7.0左右。宰后初期,短时间内糖原酵解,乳酸蓄积导致肉类pH值下降到5.4~5.6。宰后ATP水解产生磷酸,酸性物质长期累积并无法分解与转运,也会使得pH值迅速下降。僵直达到最大程度时,pH值不再降低,因为肌糖原无氧酵解中产生的酸抑制了无糖酵解酶的活性,不再生成乳酸。在肉制品的贮藏过程中,随着僵直解除,糖类物质消耗殆尽,乳酸从生成转变成分解,pH值开始升高[10]。此外,蛋白质的降解产生的氨基酸被细菌利用,分解产生的氨类物质累积导致pH值升高;肉糜贮藏过程中由于假单胞菌(Pseudomonas)、莫拉氏菌(Moraxella)、不动杆菌(Acinetobacter)等革兰氏阴性菌的生长过程中分泌各种酶,包括蛋白酶、脱羧酶和脱氢酶[11]。这些酶分解牛肉中的蛋白质并产生碱性物质,如生物胺和氨[12],pH值会出现缓慢上升的趋势。
由图1可知,包装方法、贮藏时间对牛肉pH值有显著影响(P<0.05)。贮藏0~3 d时,肉糜的pH值升高不明显;贮藏3~5 d,光、氧共同作用下,pH值开始明显上升,贮藏5 d时D组pH值达到最大值6.94,可能是由于贮藏期间葡萄糖被消耗完,细菌分解蛋白质释放氨基酸,氨基酸进一步降解导致氨累积并引起pH值升高[13]。自然条件下(D组)pH值增长速率比其他处理组增长快,可能是由于光、氧同时存在更加有利于细菌利用蛋白质降解产生氨基酸。避光贮藏以及真空避光贮藏条件下,pH值显著低于自然冷藏条件,说明光照不利于牛肉糜pH值的维持,可能是由于光照促进了蛋白质降解以及微生物的发酵代谢。综上所述,避光和真空2 种处理方法能有效抑制pH值的上升。根据肉制品新鲜度等级评价,一级鲜肉的pH 5.8~6.2,二级鲜肉pH 6.3~6.6,腐败肉pH>6.7[14]。由此可知,4 ℃自然贮藏条件下牛肉糜能贮藏4 d。
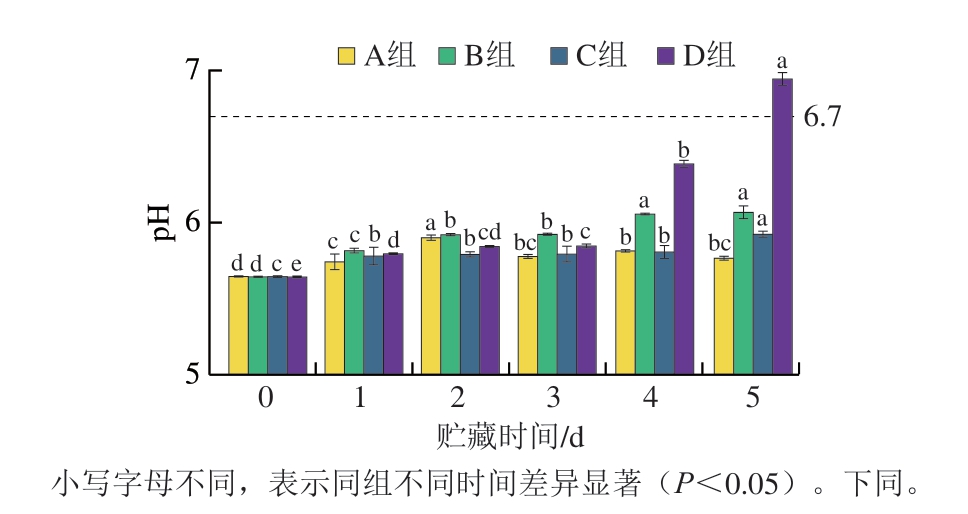
图1 牛肉糜贮藏过程中pH值变化
Fig. 1 pH changes during beef storage
2.1.2 TBARs值
脂质氧化导致肉类和肉制品的质量下降和保质期缩短。TBARs值主要用于评价脂质过氧化程度,反映了脂质过氧化的降解产物丙二醛的含量[15]。鲜肉TBARs值为0.20~0.66 mg/kg[16-17]。当TBARs值大于1 mg/kg时,肉中的脂质严重氧化,肉的风味劣变[18]。
由图2可知,各组TBARs值在0.21~0.67 mg/kg,TBARs值随贮藏时间延长而增大。贮藏1 d时,不同处理组之间差异不明显。贮藏2~5 d,自然冷藏条件下TBARs值显著高于其他处理组。贮藏5 d时,自然冷藏、避光、真空、避光真空条件下牛肉中的TBARs值分别为0.67、0.55、0.57、0.45 mg/kg,其中自然冷藏条件下TBARs值高于0.66 mg/kg,超过新鲜肉标准限值。避光(B组)与真空条件(C组)下,贮藏0~5 d无明显差异,说明光照与氧气对肉糜的脂质氧化结果影响相似,第5天TBARs含量是自然冷藏条件下的84.72%和82.50%。而避光真空条件下,第5天TBARs含量是自然冷藏条件下的67.19%。结果表明,自然冷藏条件下,牛肉糜放置第4天不再新鲜,不可食用。光、氧对于脂质氧化速率的影响无明显差异,而避光避氧能有效抑制脂质氧化。
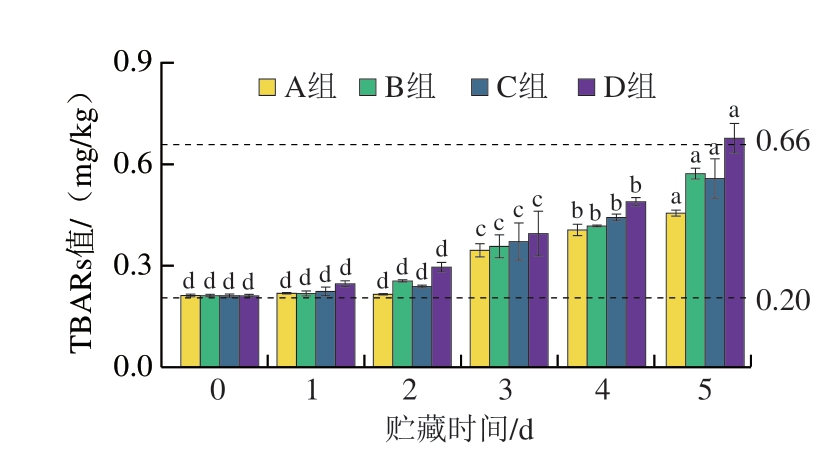
图2 牛肉糜贮藏过程中TBARs值变化
Fig. 2 Changes in TBARs during beef storage
2.1.3 TVB-N含量
TVB-N含量通常被认为是评估肉类新鲜度和保质期的主要指标,TVB-N含量越高,肉类的腐败程度越高。GB 2707—2016《食品安全国家标准 鲜(冻)畜禽产品》规定新鲜禽肉TVB-N含量不高于15 mg/100 g。TVB-N含量超过15 mg/100 g则表示肉及肉制品不新鲜。韩国农林部规定TVB-N含量小于20 mg/100 g,也有学者认为TVB-N含量小于40.3 mg/100 g[19]。
由图3可知,不同条件下牛肉糜的TVB-N含量在贮藏过程中逐渐升高。TVB-N含量在4.55~20.08 mg/100 g,自然冷藏条件下TVB-N含量增长速率明显高于其他处理组。相比于有氧条件,无氧组增长速率较慢,说明光照对TVB-N含量的影响低于氧气。贮藏0~1 d,TVB-N含量增长速率为3.08%~19.23%,而第2天增长速率为46.15%~102.33%,牛肉糜从第3天开始变质加快。自然冷藏条件下第5天时TVB-N含量为20.08 mg/100 g,超过国家标准规定,表示牛肉糜已变质,不宜食用。
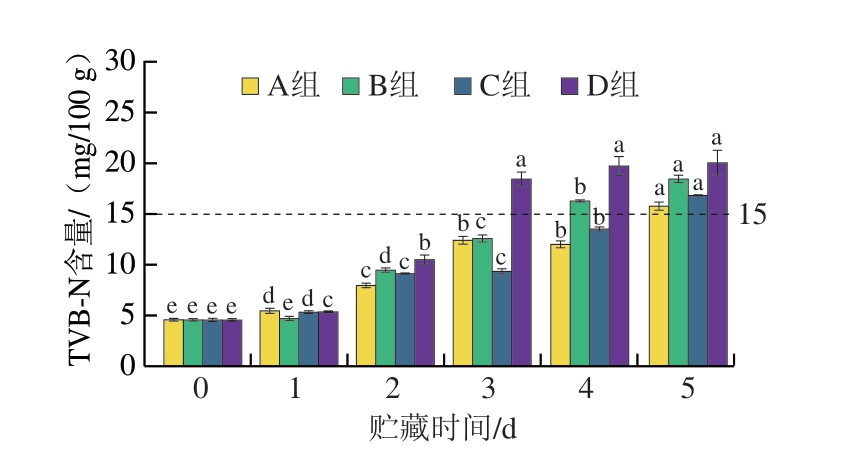
图3 牛肉糜贮藏过程中TVB-N含量变化
Fig. 3 Changes of TVB-N content during beef storage
2.1.4 色泽
色泽是影响牛肉品质的重要因素之一,消费者通常会通过颜色来判断牛肉糜新鲜度和安全性[20]。同时,肉变色的主要原因是表面形成并积累了高铁肌红蛋白[21]。贮藏期间影响肉色的环境因素包括光、氧含量以及温度等[22]。L*、a*、b*分别对应于牛肉表面颜色的亮度、红度、黄度。
由表1可知,随着贮藏时间的延长,牛肉糜的L*逐渐减小,但是自然冷藏条件下L*下降得更快。牛肉糜的a*在贮藏0~4 d显著提高,自然条件下升高速率更快,有光有氧条件下肌内肌原蛋白氧化速率快速增加,导致肉色褐变加快[23]。贮藏期肉色褐变还可能受到肌内脂肪氧化的诱导,脂肪氧化产生的自由基可能会攻击肌红蛋白中卟啉环上铁离子外层电子的跃变,从而破坏高铁肌红蛋白还原酶。由于贮藏期高铁肌红蛋白还原酶损失或消耗,导致肉色变暗或呈现不受消费者欢迎的灰褐色[24]。而贮藏5 d时下降,可能是由于在第5天牛肉发生变质,腐败微生物的增多导致牛肉糜红度的突变。b*在贮藏过程中波动变化。
表1 牛肉糜贮藏过程中色泽的变化
Table 1 Color changes during beef storage
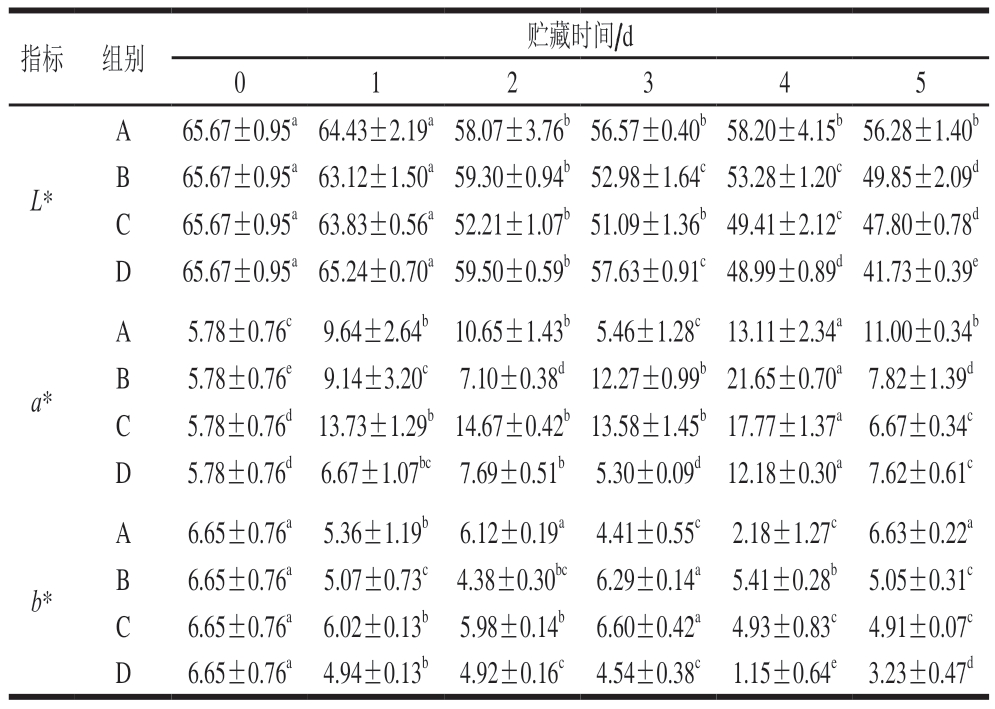
注:同行小写字母不同,表示差异显著(P<0.05)。
指标 组别贮藏时间/d 0 1 2 3 4 5 L*A65.67±0.95a 64.43±2.19a 58.07±3.76b 56.57±0.40b 58.20±4.15b 56.28±1.40b B65.67±0.95a 63.12±1.50a 59.30±0.94b 52.98±1.64c 53.28±1.20c 49.85±2.09d C65.67±0.95a 63.83±0.56a 52.21±1.07b 51.09±1.36b 49.41±2.12c 47.80±0.78d D65.67±0.95a 65.24±0.70a 59.50±0.59b 57.63±0.91c 48.99±0.89d 41.73±0.39e a*A5.78±0.76c 9.64±2.64b 10.65±1.43b 5.46±1.28c 13.11±2.34a 11.00±0.34b B5.78±0.76e 9.14±3.20c 7.10±0.38d 12.27±0.99b 21.65±0.70a 7.82±1.39d C5.78±0.76d 13.73±1.29b 14.67±0.42b 13.58±1.45b 17.77±1.37a 6.67±0.34c D5.78±0.76d 6.67±1.07bc 7.69±0.51b 5.30±0.09d 12.18±0.30a 7.62±0.61c b*A6.65±0.76a 5.36±1.19b 6.12±0.19a 4.41±0.55c 2.18±1.27c 6.63±0.22a B6.65±0.76a 5.07±0.73c 4.38±0.30bc 6.29±0.14a 5.41±0.28b 5.05±0.31c C6.65±0.76a 6.02±0.13b 5.98±0.14b 6.60±0.42a 4.93±0.83c 4.91±0.07c D6.65±0.76a 4.94±0.13b 4.92±0.16c 4.54±0.38c 1.15±0.64e 3.23±0.47d
2.1.5 高铁肌红蛋白含量
高铁肌红蛋白是影响新鲜牛肉品质的重要原因之一,其在肉中含量越高,蛋白质结构越不稳定,肉制品的品质就随之降低。同时,高铁肌红蛋白的生成会导致新鲜牛肉的颜色稳定性变差,从而显示出不新鲜的棕色。由图4可知,高铁肌红蛋白相对含量的初始值约为16%。在贮藏5 d时,不同处理组高铁肌红蛋白含量分别增至第0天的1.52、1.52、1.78 倍和1.97 倍。光照作用下,高铁肌红蛋白含量增长速率显著低于氧气作用,光照对高铁肌红蛋白的影响无明显差异,并且高铁肌红蛋白含量在贮藏1~2 d增长速率显著增大,牛肉糜在氧气充足的条件下,肌红蛋白和氧合肌红蛋白不断转变为高铁肌红蛋白,导致高铁肌红蛋白相对含量不断增加[1]。
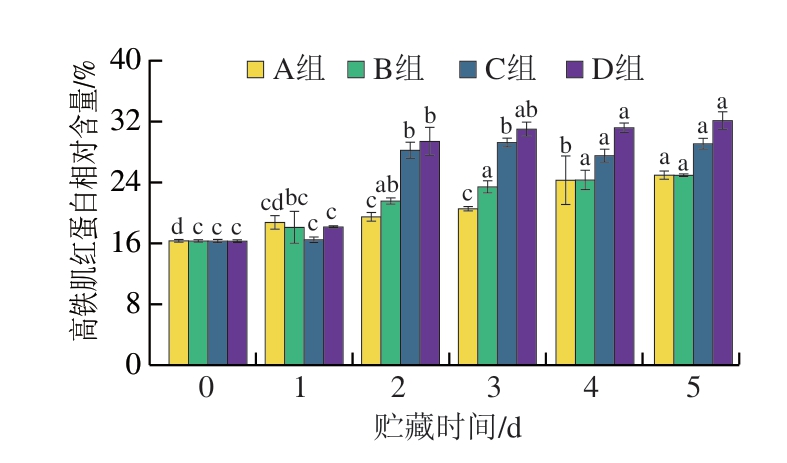
图4 牛肉糜贮藏过程中高铁肌红蛋白相对含量变化
Fig. 4 Changes in MetMb content during beef storage
2.1.6 微观结构
通过扫描电镜可观察样品的微观结构,肌肉纤维的结构排列和完整性可以直接反映肉制品的质地,从而决定其嫩度。由图5可知,未经处理(D组)的牛肉样品肌纤维被破坏,肌纤维间隙明显变大,牛肉结构被破坏。可能由于纤维层之间形成了更多的裂缝,表面积扩大,导致暴露更多的极性基团,如羟基和羧基[26],并且增大了与氧气的接触面积,形成恶性循环,加快牛肉的氧化速率。而无氧或者无光条件下,A、B、C组样品表现出更完整的微观结构和光滑表面,肌肉束紧密平行排列。相比于有氧无光(B组)、有光(C组)条件下牛肉表面结构更加光滑紧致,且表面无其他物质覆盖。这可能是由于氧气存在的情况下,部分微生物代谢形成的产物覆盖于牛肉表面[27]。

图5 不同处理条件下第5天时牛肉的微观结构变化
Fig. 5 Microstructure of beef on day 5 under different treatment conditions
2.2 不同氧化处理对贮藏过程中牛肉糜蛋白氧化性质的影响
2.2.1 羰基与巯基含量
羰基及巯基含量的变化被广泛应用于评价蛋白质氧化的程度。在蛋白氧化条件下,氨基酸(如脯氨酸、精氨酸、赖氨酸和苏氨酸)侧链会生成羰基基团(醛和酮)[28]。如图6A所示,牛肉糜初始羰基含量为1.08 nmol/mg,与白雪原[29]测量结果相似。随着贮藏时间延长,牛肉糜羰基化水品显著上升(P<0.05)。B、C组在第5天时相较于第0天分别增加5.69 倍和7.69 倍,表明与自然光相比,氧气更易加速牛肉蛋白中羰基的生成。
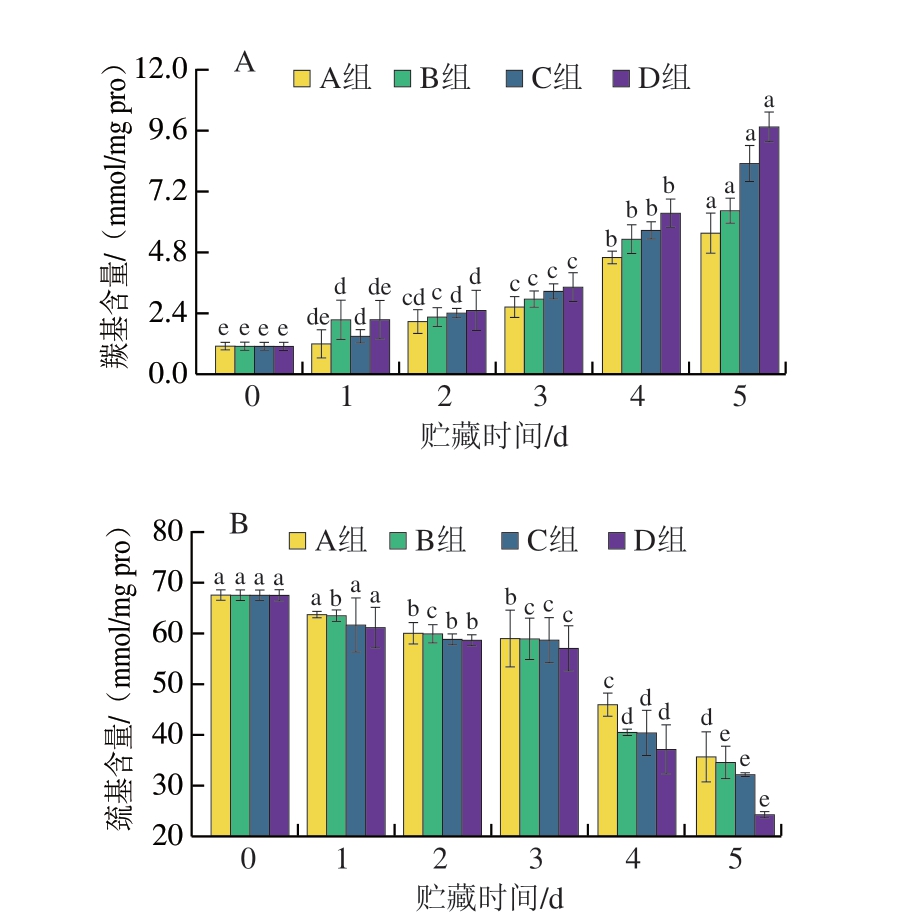
图6 牛肉糜贮藏过程中羰基(A)和巯基(B)含量变化
Fig. 6 Changes in carbonyl (A) and sulfhydryl contents (B) during beef storage
巯基可以通过氧化相邻蛋白链上的2 个半胱氨酸残基形成二硫键,是维持蛋白三、四级结构的关键因素[34]。天然蛋白质中,大多数巯基被包裹在紧凑的蛋白分子内部[30]。如图6B所示,随着贮藏时间的延长,0~3 d巯基含量下降趋势不明显,从第4天开始,牛肉糜中巯基含量显著下降。B、C组在第5天时巯基含量分别下降至第0天的51.23%和47.76%,与氧气相比,光照能加速巯基的减少。
2.2.2 二聚酪氨酸含量
酪氨酸残基易被活性氧自由攻击发生氧化聚合反应,生成二聚酪氨酸[31],因此可以通过测定二聚酪氨酸的含量反映蛋白质氧化程度。二聚酪氨酸可以由2 条不同氨基酸多肽链或由同一氨基酸多肽链上的2 个不同位置的酪氨酸自由基反应产生,导致蛋白质分子内或分子间的交联,蛋白质氨基酸残基的共价或非共价修饰可导致蛋白构象和功能性质发生显著改变。二聚酪氨酸由酪氨酸受到自由基攻击后产生的酪氨酸自由基和酪氨酸残基通过共价键和非共价键相互作用形成,其可在一定程度上反映蛋白质结构的变化,二聚酪氨酸含量越高,蛋白质结构变化越严重,氧化程度越大[32]。
由图7可知,随着贮藏时间的延长,二聚酪氨酸含量显著增大,有光有氧条件下,二聚酪氨酸含量上升最明显,蛋白氧化程度最高。
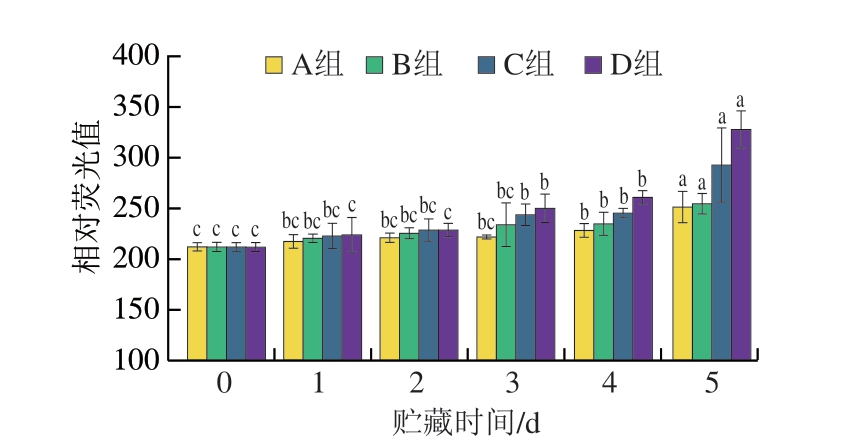
图7 牛肉糜贮藏过程中二聚酪氨酸含量变化
Fig. 7 Changes in dimeric tyrosine content during beef storage
2.2.3 SDS-PAGE
对牛肉中的肌原纤维蛋白溶液进行SDS-PAGE分析,了解不同处理条件下肌原纤维蛋白亚基片段分布。蛋白质氧化主要是通过共价键和非共价键的方式形成蛋白质聚合物,导致一些蛋白分子堆积在分离胶顶部,甚至可能存在于浓缩胶中[33]。
由图8可知,不同氧化条件下牛肉提取的肌原纤维蛋白泳道上存在多条共同条带,主要包括肌球蛋白重链(约200 kDa)、副肌球蛋白(100~135 kDa)、肌动蛋白(35~48 kDa)以及肌球蛋白轻链(11~17 kDa)。肌球蛋白重链和肌动蛋白含量最高,说明肌原纤维蛋白是由肌球蛋白和肌动蛋白组成。与第3天相比,第5天各组样品条带更加模糊、弱化以及宽度扩展,且在低分子质量区域(10 kDa左右)出现新条带,这可能是由于蛋白质分子发生降解[34]。样品在低分子质量区域条带在第5天时出现了新的条带并且颜色较深,同样可能也是因为蛋白质分子发生降解[35]。与有氧条件下样品(C组)相比,光照处理下(B组)样品条带加深,说明光照一定程度加速了牛肉肌原纤维蛋白的降解,可能是由于肌细胞中的内源性蛋白酶在光照催化情况下释放[4],从而使肌原纤维蛋白中的肌球蛋白发生降解。

图8 牛肉糜贮藏过程中肌原纤维蛋白SDS-PAGE图
Fig. 8 Changes in SDS-PAGE pattern of myofibrillar protein during beef storage
3 结 论
光氧化与氧气对牛肉品质以及蛋白氧化有显著促进作用,在二者共同作用下,牛肉在4 ℃下贮藏期不能超过4 d。而无光、无氧条件可有效降低牛肉氧化速率,延长货架期。贮藏过程中不同处理组牛肉pH值都呈上升趋势,各组TVB-N含量和TBARs值均随时间延长而增加,而无光无氧能减缓牛肉蛋白和脂肪氧化。光、氧共同作用下,牛肉的微观结构明显被破坏,肌肉纤维间隙变大,并且光照相比于氧气更能加速肌原纤维蛋白的降解或交联。结果表明,光氧化与氧气氧化对牛肉品质均产生了负面作用,即便是冷鲜保藏,冷鲜牛肉贮藏时间不宜超过4 d。
[1] 扶庆权, 王海鸥, 李坤, 等 高氧气调包装对宰后牛半膜肌成熟过程中品质的影响[J]. 食品科学, 2020, 41(23): 236-242. DOI:10.7506/spkx1002-6630-20200512-126.
[2] LIN H X, ZHAO S S, HAN X Y, et al. Effect of static magnetic field extended supercooling preservation on beef quality[J]. Food Chemistry,2022, 370: 131264. DOI:10.1016/j.foodchem.2021.131264.
[3] CHEN X, XU X L, LIU D M, et al. Rheological behavior,conformational changes and interactions of water-soluble myofibrillar protein during heating[J]. Food Hydrocolloids, 2018, 77: 524-533.DOI:10.1016/j.foodhyd.2017.10.030.
[4] YANG H H, ZHONG C, SUN L C, et al. Effects of partial substitution of NaCl on myofibrillar protein properties from pearl mussel Hyriopsis cumingii muscle: Structural characteristics and aggregation behaviors[J]. Food Chemistry, 2021, 356(15): 129734. DOI:10.1016/j.foodchem.2021.129734.
[5] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J]. Food Chemistry, 2007, 101(3):1239-1246. DOI:10.1016/j.foodchem.2006.03.028.
[6] FU L, DU L H, SUN Y Y, et al. Effect of lentinan on lipid oxidation and quality change in goose meatballs during cold storage[J]. Foods,2022. 11(7): 1055. DOI:10.3390/foods11071055.
[7] KRZYWICKI K. The determination of haem pigments in meat[J]. Meat Science, 1982, 7(1): 29-36. DOI:10.1016/0309-1740(82)90095-x.
[8] 符婉丽, 桑晓涵, 陈姑, 等. 低温等离子体对金鲳鱼蛋白质和脂质氧化的影响[J]. 食品研究与开发, 2022, 43(22): 15-22. DOI:10.12161/j.issn.1005-6521.2022.22.003.
[9] DAVIES K J, DELSIGNORE M E, LIN S W. Protein damage and degradation by oxygen radicals. II. Modification of amino acids[J].Journal of Biological Chemistry, 1987, 262(20): 9902-9907.DOI:10.1016/S0021-9258(18)48019-2.
[10] 崔海燕, 牛选民. 大蒜提取物对冷鲜牛肉保鲜效果的研究[J]. 食品科技, 2022. 47(5): 159-164.DOI:10.13684/j.cnki.spkj.2022.05.034.
[11] SINGH P, SAHOO J, CHATLI M K, et al. Shelf life evaluation of raw chicken meat emulsion incorporated with clove powder, ginger and garlic paste as natural preservatives at refrigerated storage (4 ± 1 ℃)[J].International Food Research Journal, 2014, 21(4): 1363-1373.
[12] ARANCIBIA M Y, LÓPEZ-CABALLERO M E, GÓMEZGUILLÉN M C, et al. Chitosan coatings enriched with active shrimp waste for shrimp preservation[J]. Food Control, 2015, 54: 259-266.DOI:10.1016/j.foodcont.2015.02.004.
[13] SHAH M A, BOSCO S J D, MIR S A. Effect of Moringa oleifera leaf extract on the physicochemical properties of modified atmosphere packaged raw beef[J]. Food Packaging & Shelf Life, 2015, 3: 31-38.DOI:10.1016/j.fpsl.2014.10.001.
[14] 董文丽, 巩雪, 常江. 复合生物保鲜剂对冷鲜牛肉的保鲜效果研究[J]. 包装工程, 2020, 41(3): 13-20. DOI:10.19554/j.cnki.1001-3563.2020.03.003.
[15] MORRISSEY P A, SHEEHY P J A, GALVIN K, et al. Lipid stability in meat and meat products[J]. Meat Science, 1998, 49(1): S73-S86.DOI:10.1016/S0309-1740(98)90039-0.
[16] LI F H, WU S J, XU B. Preservation of stewed beef chunks by using ε-polylysine and tea polyphenols[J]. LWT-Food Science and Technology, 2021, 147: 111595. DOI:10.1016/j.lwt.2021.111595.
[17] ZHANG Y M, HOLMAN B W B, PONNAMPALAM E N, et al.Understanding beef flavour and overall liking traits using two different methods for determination of thiobarbituric acid reactive substance(TBARs)[J]. Meat Science, 2019, 149: 114-119. DOI:10.1016/j.meatsci.2018.11.018.
[18] KRICHEN F, HAMED M, KAROUD W, et al. Essential oil from pistachio by-product: potential biological properties and natural preservative effect in ground beef meat storage[J]. Journal of Food Measurement and Characterization, 2020, 14(6): 3020-3030.DOI:10.1007/s11694-020-00546-6.
[19] UNTERMANN R S S. Chemical attributes characterizing sticky postmortem ageing in beef[J]. Meat Science, 1997, 47(3/4): 331-335.DOI:10.1016/S0309-1740(97)00073-9.
[20] MANCINI R A, HUNT M C. Current research in meat color[J]. Meat Science, 2005, 71(1): 100-121. DOI:10.1016/j.meatsci.2005.03.003.
[21] NGUYEN T, PHAN K N, LEE J B, et al. Met-myoglobin formation,accumulation, degradation, and myoglobin oxygenation monitoring based on multiwavelength attenuance measurement in porcine meat[J].Journal of Biomedical Optics, 2016, 21(5): 57002. DOI:10.1117/1.JBO.21.5.057002.
[22] O’KEEFFE M, HOOD D E. Biochemical factors influencing metmyoglobin formation on beef from muscles of differing colour stability[J]. Meat Science, 1982, 7(3): 209-228. DOI:10.1016/0309-1740(82)90087-0.
[23] GREENE B E. Lipid oxidation and pigment changes in raw beef[J].Journal of Food Science, 2010, 34(2): 110-113. DOI:10.1111/j.1365-2621.1969.tb00898.x.
[24] DECKER E A, WKM C, LIVISAY S A, et al. Interactions between carnosine and the different redox states of myoglobin[J]. Journal of Food Science, 1995, 60(6): 1201-1204. DOI:10.1111/j.1365-2621.1995.tb04555.x.
[25] HU Y Y, DONG Z M, WEN R X, et al. Combination of ultrasound treatment and starter culture for improving the quality of beef jerky[J]. Meat Science, 2023, 204: 109240. DOI:10.1016/j.meatsci.2023.109240.
[26] ZHANG M C, WANG Z, WU J C, et al. Effects of adding citrus fiber with different chemical compositions and physicochemical properties on the cooking yield of spiced beef[J]. LWT-Food Science and Technology, 2023, 176(15): 114486. DOI:10.1016/j.lwt.2023.114486.
[27] XU H B, ZHU Y P, YU B, et al. Comparative analysis of helium and air surface micro-discharge plasma treatment on the microbial reduction and quality attributes of beef slices[J]. Meat Science, 2023,204(1): 109259. DOI:10.1016/j.meatsci.2023.109259.
[28] DALLE-DONNE I, ROSSI R, GIUSTARINI D, et al. Protein carbonyl groups as biomarkers of oxidative stress[J]. Clinica Chimica Acta,2003, 329(1/2): 23-38. DOI:10.1016/S0009-8981(03)00003-2.
[29] 白雪原. 屠宰年龄对牦牛肉品质特性的影响机制研究[D]. 郑州:河南农业大学, 2023. DOI:10.27117/d.cnki.ghenu.2022.000668.
[30] CHEN X, XU X L, LIU D M, et al. Rheological behavior,conformational changes and interactions of water-soluble myofibrillar protein during heating[J]. Food Hydrocolloids, 2018, 77: 524-533.DOI:10.1016/J.FOODHYD.2017.10.030.
[31] 李玲, 蔡爽, 陈娇娇, 等. EGCG浓度对肌原纤维蛋白侧链结构和凝胶水分分布的影响[J]. 食品研究与开发, 2022, 43(18): 19-33.DOI:10.12161/j.issn.1005-6521.2022.18.003.
[32] 贾琴, 黄予豫, 唐善虎, 等. 刺梨水提物对牦牛肉糜贮藏过程蛋白质和脂质氧化影响的研究[J]. 食品工业科技, 2023, 44(5): 347-355.DOI:10.13386/j.issn1002-0306.2022050210.
[33] 刘鑫鑫, 陈彧, 陈徐欢, 等. 生姜提取物对鱿鱼肌原纤维蛋白氧化的影响[J]. 中国食品学报, 2021, 21(9): 225-232. DOI:10.16429/j.1009-7848.2021.09.024.
[34] 汤晓艳, 周光宏, 徐幸莲, 等. 高浓度CaCl2溶液对某些肌原纤维蛋白的作用研究[J]. 食品科学, 2007, 28(12): 117-121. DOI:10.3321/j.issn:1002-6630.2007.12.023.
[35] CAI L Y, NIAN L Y, CAO A L, et al. Effect of carboxymethyl chitosan magnetic nanoparticles plus herring antifreeze protein on conformation and oxidation of myofibrillar protein from red sea bream (Pagrosomus major) after freeze-thaw treatment[J]. Food and Bioprocess Technology, 2020, 13(2): 355-366. DOI:10.1007/s11947-019-02384-x.