海马属于脊索动物门硬骨鱼纲的小型海洋生物,是我国传统的名贵中药材,已有几千年的药用历史,最早被《本草经集注》所收载。海马中具有氨基酸、脂肪酸、多肽、甾体类等多种活性成分[1-2],具有增强学习记忆能力、保护脑缺血再灌注损伤、激素样、抗疲劳、抗抑郁等药理作用[3-6]。膨腹海马(Hippocampus abdominalis)是所有海马中体型最大的一种,体长超过30 cm,体质量高达30 g,主要分布于澳大利亚和新西兰海域[7-8]。海洋中具有丰富的多肽生物资源,多肽作为具有生物活性的天然产物有广阔的应用前景。近年来,在各种海洋生物及其副产物的生物活性肽这一领域进行了大量的研究,发现海洋生物肽具有广泛的生物活性如抗肿瘤、降血压、免疫调节等作用[9-11]。Kim等[12]从膨腹海马中提取分离出抗氧化肽和血管紧张素转换酶(angiotensin I-converting enzyme,ACE)抑制肽;Lee等[13]发现膨腹海马酶解物具有抗氧化的潜力;Lee等[14]还发现从膨腹海马中分离纯化的多肽具有潜在降血压活性。因此对膨腹海马酶解物的研究具有良好的前景。海洋生物来源的多肽具有安全性高、结构新颖、更有益于人体健康等优点;此外,多肽抗氧化活性越好,氨基酸含量越高[15-16]。氨基酸是海马的主要化学成分之一,因此将海马用于制备抗氧化活性肽具有极好的发展前景。
响应面与正交试验设计和均匀设计相比,具有精确性高、实验次数少的优点,是一种广泛用于生物、医学、食品等领域的优化方法[17-18]。自由基会导致氧化应激损伤从而导致多种慢性疾病的发生发展,因此对具有抗氧化活性的物质的研究十分重要[19]。超微粉碎技术又称细胞破壁技术,在细胞层面对药物进行破碎,有助于增加药物的溶解度,提高有效成分的溶出度,增强中药药效[20-21]。本研究采用酶解法制备膨腹海马超微粉酶解物,并通过单因素试验和响应面试验设计优化酶解工艺,对酶解物进行抗氧化活性的研究,进一步拓宽膨腹海马的应用市场。
1 材料与方法
1.1 材料与试剂
膨腹海马 厦门小嶝水产科技有限公司。
胰酶(4 000 U/g)、木瓜蛋白酶(80万 U/g)、胃蛋白酶(3 000 NFU/mg) 南宁庞博生物工程有限公司;胰蛋白酶(250 NFU/mg)、碱性蛋白酶(200 000 U/g)、风味蛋白酶(30 000 U/g)、牛血清白蛋白 北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、VC、硫酸亚铁 上海麦克林生化科技股份有限公司;过氧化氢、过硫酸钾 国药集团化学试剂有限公司;水杨酸 上海阿拉丁生化科技股份有限公司;2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS) 美国 Sigma公司。
1.2 仪器与设备
CW3-40QA破壁超微粉碎机 烟台慧宝设备制造有限公司;Centrifuge 5810R台式离心机 美国Eppendorf公司;Spectra Max M3酶标仪 美国Molecular Devices公司;Beta 2-8 LSCplus冷冻干燥机 德国Martin Christ公司;DELTA 320 pH计 美国Mettler Toledo公司。
1.3 方法
1.3.1 膨腹海马粉制备
将膨腹海马洗净晒干,放入热循环烘箱干燥。当干海马水分含量小于6%后,使用粗粉碎机将海马粉碎成粒径10 mm的小块,后经细粉碎机将其粉碎至可全部通过80 目筛。最后使用破壁超微粉碎机在-10 ℃条件下粉碎50 min。将得到的粉末置于-20 ℃冰箱中保存备用。
1.3.2 膨腹海马酶解物制备
参考刘云姣等[22]方法稍作修改,具体工艺流程如下:将1.3.1节中制得的膨腹海马粉→加水混匀调节pH值与水浴锅温度至各酶适宜值→预热10 min后→加入一定量酶水解4 h,再经15 min、95 ℃高温使酶失活→调节pH值至中性→5 000 r/min离心10 min→定性滤纸过滤离心液,取上清液保留→冷冻干燥。
1.3.3 最佳蛋白酶筛选
分别采用碱性蛋白酶、风味蛋白酶、胰蛋白酶、木瓜蛋白酶、胃蛋白酶、胰酶6 种酶进行酶解。固定料液比1∶20、酶与底物比例(enzyme/substrate,E/S)为4%,在各酶最适条件下酶解4 h。以DPPH自由基清除率为指标筛选出最佳酶。各酶最适宜条件如表1所示。
表1 各蛋白酶酶解条件
Table 1 Enzymatic conditions for different proteases

酶种类最适温度/℃最适pH碱性蛋白酶5010风味蛋白酶508胰蛋白酶378木瓜蛋白酶557胃蛋白酶452胰酶508
1.3.4 DPPH自由基清除率测定
参考文献[23-24]并在此基础上适当改进。取膨腹海马酶解物冻干粉,用超纯水配制成质量浓度为10、5、2.5、1.25、0.625 mg/mL的溶液。取50 μL溶液加到96 孔板中,再加入含量为0.06 mg/mL的DPPH溶液150 μL。混匀后置于暗处反应30 min,于517 nm波长处测定吸光度,并设置对照组,每个样品设3 个复孔,按式(1)计算DPPH自由基清除率。
式中:As为样品溶液+DPPH溶液吸光度;Ac为样品溶液+无水乙醇溶液吸光度;Ab为DPPH溶液+样品溶剂吸光度。
1.3.5 ABTS阳离子自由基清除率测定
参考文献[25]方法,略有改动。将7 mmol/L ABTS溶液与2.45 mmol/L的过硫酸钾按体积比1∶1混合,于室温下暗处反应16 h,形成ABTS阳离子溶液。使用磷酸盐缓冲液(phosphate buffered saline,PBS)将其稀释至在734 nm波长处的吸光度为0.70±0.02后使用。称量10 mg海马酶解物冻干粉溶解于1 mL超纯水中,制成10 mg/mL的样品溶液。将100 μL样品溶液与100 μL ABTS阳离子溶液混匀,在室温下反应10 min,于734 nm波长处测定吸光度。以同等质量浓度的VC为阳性对照,水为空白对照。ABTS阳离子自由基清除率按式(2)计算。

式中:Ao为空白对照吸光度;Ai为样品溶液吸光度。
1.3.6 羟自由基清除率测定
参考文献[26]测定方法,略有改动。称量10 mg海马酶解物冻干粉溶解于1 mL超纯水中,制成10 mg/mL的样品溶液。在96 孔板中加入15 μL 0.15 mol/L硫酸亚铁溶液、60 μL 2 mmol/L水杨酸乙醇溶液,再加入75 μL超纯水和30 μL样品溶液,最后加入6 mmol/L过氧化氢溶液30 μL,在37 ℃条件下反应1 h,于510 nm波长处测定吸光度。以VC为阳性对照,水为空白对照。羟自由基清除率按式(3)计算。
式中:Ai为对照加样液吸光度;Aj为样品溶液吸光度;A0为空白对照吸光度。
1.3.7 单因素试验
酶解时间:在固定料液比为1∶20(m/V)、E/S为4%、pH 10、酶解温度50 ℃条件下,考察不同酶解时间(2、3、4、5、6 h)对膨腹海马酶解物DPPH自由基清除率的影响。
酶解pH值:在固定料液比为1∶20、E/S为4%、温度50 ℃条件下酶解4 h,考察不同酶解pH值(pH 8、9、10、11、12)对膨腹海马酶解物DPPH自由基清除率的影响。
酶解温度:在固定料液比为1∶20、E/S为4%、pH 10条件下酶解4 h考察不同酶解温度(40、45、50、55、60 ℃)对膨腹海马酶解物DPPH自由基清除率的影响。
1.3.8 响应面试验优化酶解工艺
在单因素实验的基础上,根据Box-Behnken设计原理,对酶解时间、pH值、酶添加量进行3因素3水平优化,如表4所示。
表4 响应面法优化酶解工艺因素与水平设计
Table 4 Code and level of variables used in Box-Behnken design
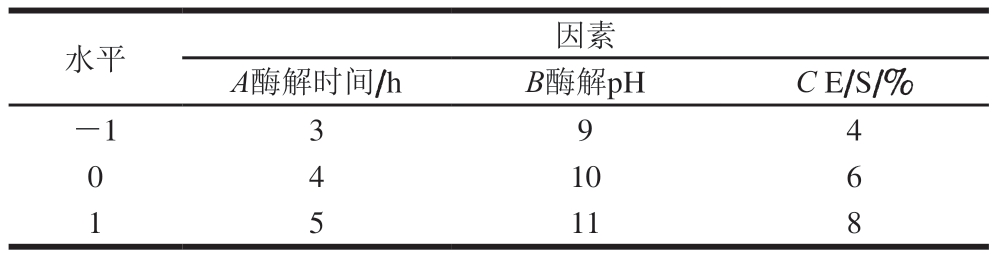
水平因素A酶解时间/hB酶解pHC E/S/%-1394 0 4 106 1 5 118
1.4 数据处理
使用Design Expert 8.0.6软件进行响应面实验设计与数据分析,采用GraphPad Prism 8.0.2和Origin 2022软件绘图。所有的数据均以均值±标准差( ±s)表示,P<0.05表示差异显著,P<0.01表示差异极显著。
±s)表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 蛋白酶筛选结果
不同蛋白酶的酶切位点不同,可以剪切出具有不同生物活性的肽段,从而产生不同生物活性。本研究选用碱性蛋白酶、风味蛋白酶、胰蛋白酶、木瓜蛋白酶、胃蛋白酶和胰酶分别对膨腹海马粉进行酶解,以DPPH自由基清除率为指标,筛选出最优酶。6 种酶解物对DPPH自由基的清除能力如图1可知。不同蛋白酶对DPPH自由基的清除率不同,其中,碱性蛋白酶、风味蛋白酶、胰蛋白酶在固定酶解时间下对DPPH自由基的清除率较高。碱性蛋白酶是一种内肽酶,具有多个酶切位点,主要切割疏水氨基酸的羧基端[27];风味蛋白酶主要切割亮氨酸和脯氨酸之间的肽键,使得酶解产物具有广泛的特异功能[28];胰蛋白酶也属于内肽酶,主要作用位点在赖氨酸和精氨酸形成的肽键的羧基端[27]。但胰蛋白酶从动物胰脏中提纯,价格昂贵;碱性蛋白酶和风味蛋白酶分别提取自枯草芽孢杆菌和米曲霉等微生物代谢产物,具有酶活力强、产量高、价格低廉等优势[29]。因此,综合对DPPH自由基的清除能力和成本考虑,选用碱性蛋白酶进行后续实验。
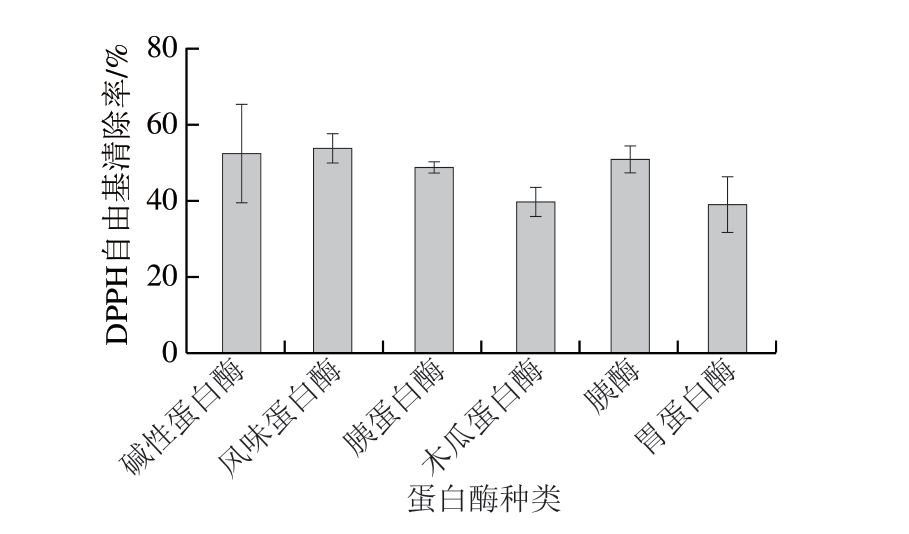
图1 不同酶解物对DPPH自由基的清除能力
Fig. 1 DPPH radical scavenging capacity of hydrolysates obtained with different proteases
2.2 单因素试验结果
2.2.1 酶解时间对酶解多肽DPPH自由基清除率的影响
酶解时间过短不能完全酶解底物,过长则会使酶解反应过度[30]。由图2可知,在其他酶解条件相同、酶解时间2~6 h内,随着酶解时间延长,多肽粉对DPPH自由基清除率升高,并于5 h达到峰值后减少。综合考虑,选择3、4、5 h进行优化实验。
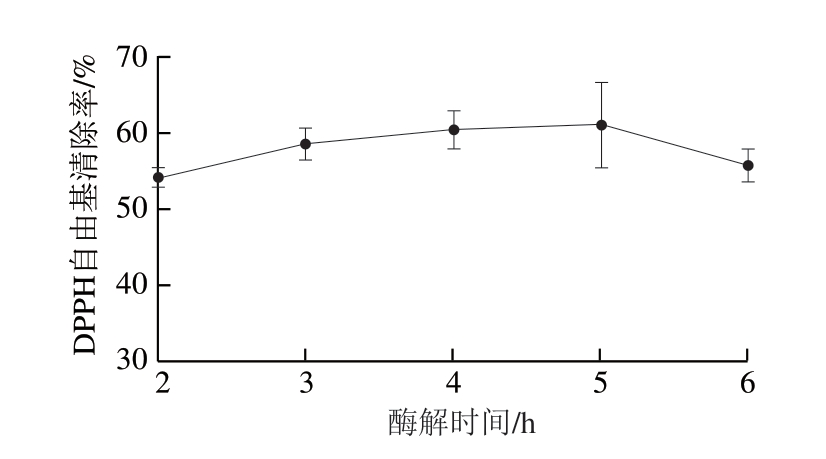
图2 酶解时间对DPPH自由基清除率的影响
Fig. 2 Effect of hydrolysis time on DPPH radical scavenging capacity
2.2.2 pH值对酶解多肽DPPH自由基清除率的影响
pH值通过改变极性基团的解离来改变酶分子带电状态,使得酶中心结构发生变化,进而影响酶解效率以及酶解产物活性,pH值过低或者过高都会导致酶失活[30]。由图3所知,维持其他条件不变,考察pH值在8 ~1 2 范围内酶解多肽影响的D P P H 自由基清除率。结果显示,在pH值到达11之前,随着pH值的增大,DPPH自由基清除率逐渐增大;当pH值为11时,DPPH清除率达到最大值(44.77±1.95)%。然而,当pH值继续增加至12时,DPPH自由基清除率降低至(3.73±1.00)%,原因可能是由于酶解过程中需要消耗较大量NaOH以维持pH值稳定,酶解结束后也需用HCl将pH值调至中性,在此过程中产生的盐对DPPH自由基清除率的影响较大。因此选择pH 9、10、11进行优化试验考察。
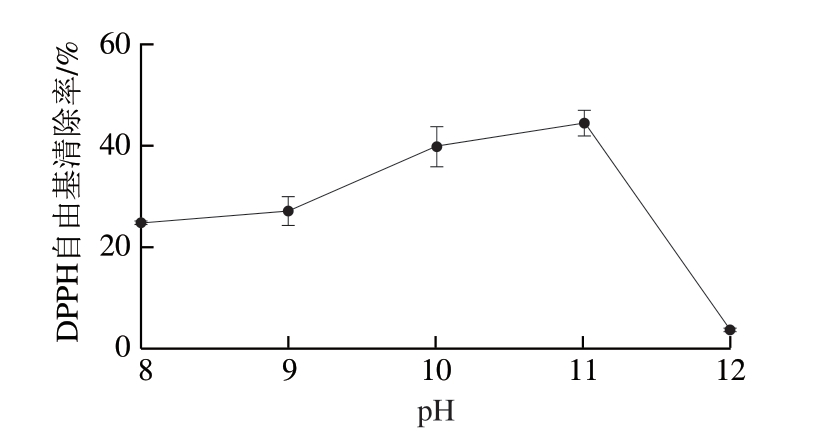
图3 pH值对DPPH自由基清除率的影响
Fig. 3 Effect of pH on DPPH radical scavenging capacity
2.2.3 酶解温度对酶解多肽DPPH自由基清除率的影响
酶解温度影响蛋白酶作用的活力,温度过高或过低都会改变酶分子的中心活性结构使酶失活,导致酶解效率下降,多肽得率降低,生物活性也下降[31]。由图4可知,改变酶解温度,控制其他条件不变的情况下,考察40~60 ℃范围内酶解多肽对DPPH自由基清除率的影响。随着温度升高,DPPH自由基清除率也逐步上升。
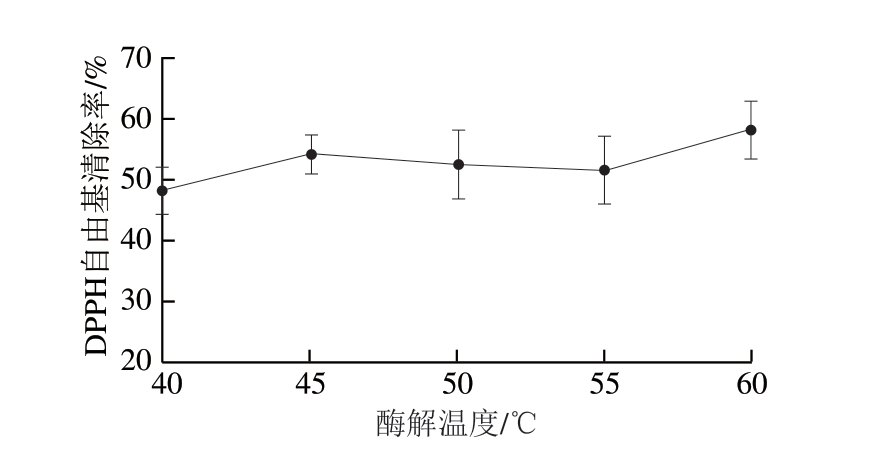
图4 酶解温度对DPPH自由基清除率的影响
Fig. 4 Effect of hydrolysis temperature on DPPH radical scavenging capacity
2.2.4 碱性蛋白酶E/S对酶解多肽的影响
在保持其他条件不变的情况下,观察碱性蛋白酶E/S为2%~8%时对DPPH自由基清除率的影响。由图5可知,当E/S为4%时DPPH自由基清除率最高。当E/S超过6%时,酶解产物对DPPH自由基的清除率趋于平缓,这可能是由于当加酶量增大时,溶液中的酶能够充分与底物反应,酶解物的生物活性提高;但当加酶量过高时,在一定反应条件下,底物中的蛋白几乎酶解完全,酶解到达饱和。
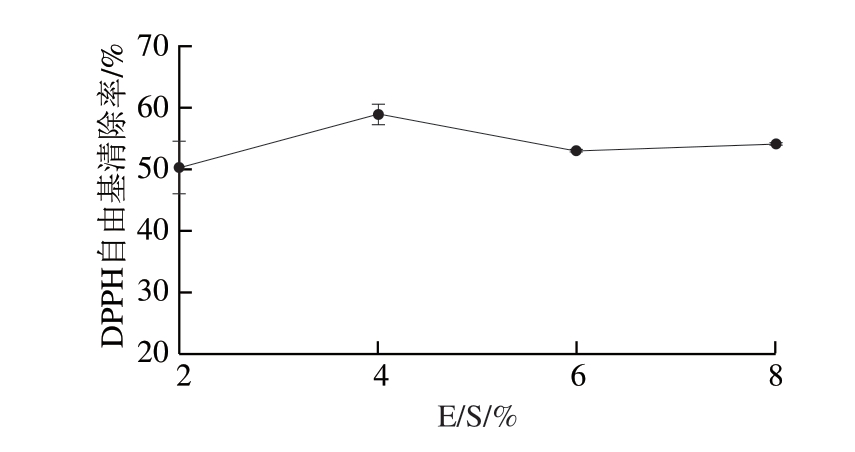
图5 碱性蛋白酶E/S对DPPH自由基清除率的影响
Fig. 5 Effect of alkaline protease substrate ratio on DPPH radical scavenging capacity
2.3 响应面试验结果
2.3.1 试验设计与结果分析
响应面试验能够通过少量试验获得独立因子和预测因子之间的相互作用效应,并构建回归模型,是一项成本低、效益高的实验技术;Box-Behnken设计能够考察独立参数对响应值的独立效应、二次效应以及交互效应,采用二阶多项式方程拟合,预测值更贴近正常值,并能够做出3D变量曲面图,对变量直接的关系进行更直观的量化分析[32-33]。本研究根据Box-Behnken设计条件进行实验,测定不同酶解时间、pH值、E/S对DPPH自由基清除率的影响,实验设计和结果见表5。
表5 响应曲面实验及结果
Table 5 Box-Behnken design matrix used for RSM and experimental results
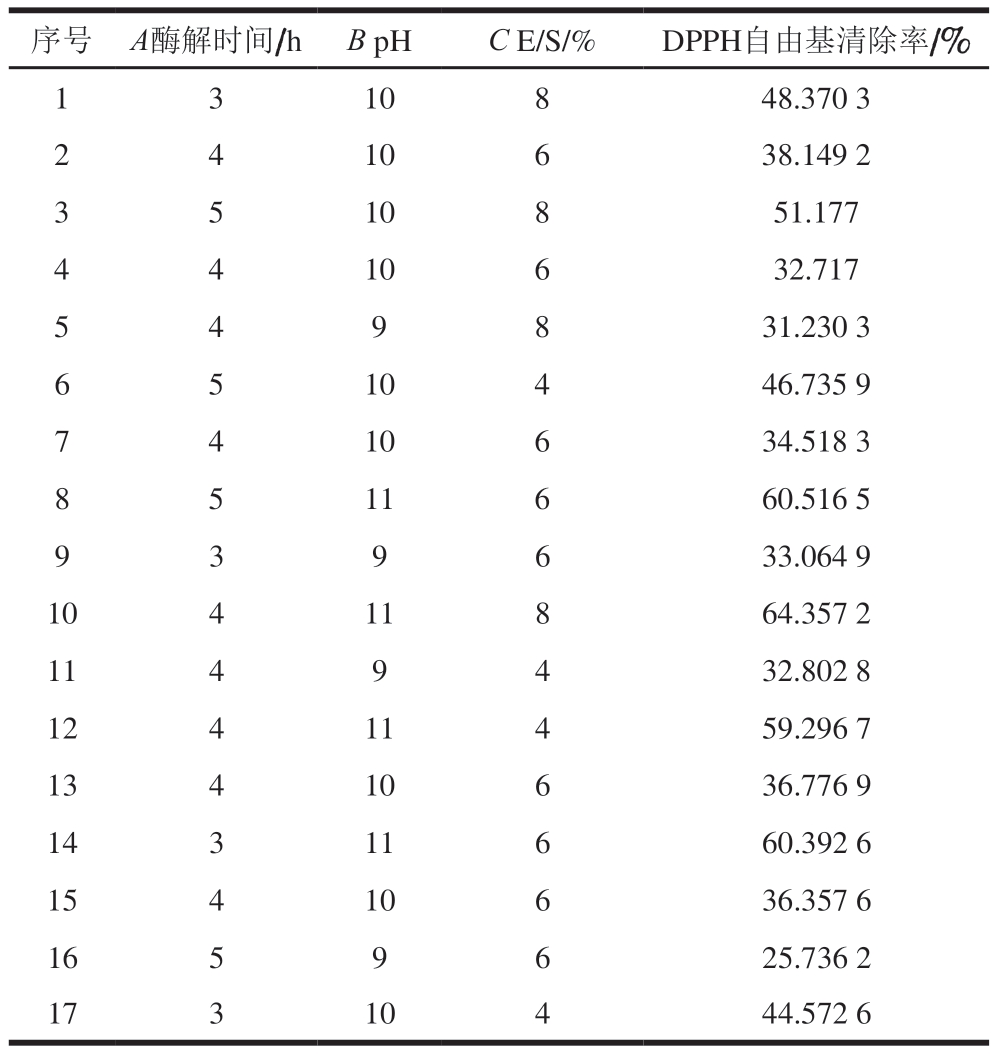
序号 A酶解时间/h B pHC E/S/%DPPH自由基清除率/%1310848.370 3 2410638.149 2 3510851.177 4410632.717 549831.230 3 6510446.735 9 7410634.518 3 8511660.516 5 939633.064 9 10411864.357 2 1149432.802 8 12411459.296 7 13410636.776 9 14311660.392 6 15410636.357 6 1659625.736 2 17310444.572 6
通过Design Expert 8.0.6软件对实验结果进行分析,获得响应值与自变量之间的关系,以二阶多项式方程表示。海马多肽DPPH自由基清除率的回归方程为:Y=35.7-0.28A+15.22B+1.47C+1.86AB+0.16AC+1.66BC+5.01A2+4.22B2+7C2。对回归方程进行方差分析,结果见表6。一次项B和二次项A2、B2、C2对提取得到的海马多肽DPPH自由基清除率影响极显著,其他因素不显著。通过F值得到影响海马多肽粉DPPH清除率的因素顺序为:B>C>A,即pH值>E/S>酶解时间。
表6 响应曲面回归模型方差分析
Table 6 Analysis of variance of response surface regression model
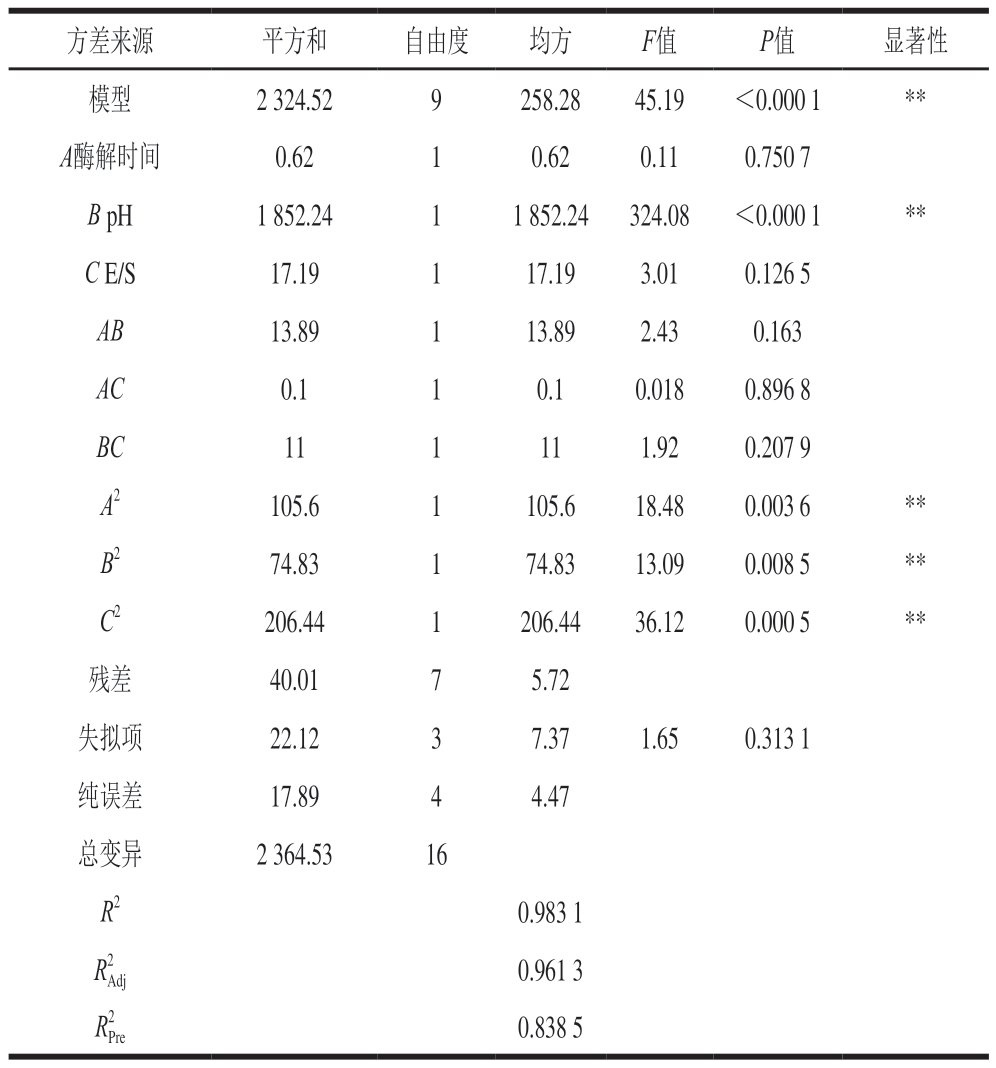
注:**.极显著(P<0.01)。
方差来源平方和自由度均方F值P值显著性模型2 324.529258.2845.19<0.000 1**A酶解时间0.6210.620.110.750 7 B pH1 852.2411 852.24324.08<0.000 1**C E/S17.19117.193.010.126 5 AB13.89113.892.430.163 AC0.110.10.0180.896 8 BC111111.920.207 9 A2105.61105.618.480.003 6**B274.83174.8313.090.008 5**C2206.441206.4436.120.000 5**残差40.0175.72失拟项22.1237.371.650.313 1纯误差17.8944.47总变异2 364.5316 R20.983 1 R2 Adj0.961 3 R2 Pre0.838 5
此模型的F=45.19,P<0.000 1,响应面回归模型极为显著;失拟项F=1.65,P=0.313 1(>0.05),失拟项不显著,说明失拟相对于纯误差不显著,模型合适[34]。变异系数5.52%(<10%),说明非实验因素对结果影响不大,模型的实验稳定性好;模型相关系数R2=0.983 1,说明该实验模型和实际拟合较好,实验中约有98.31%的结果可以通过拟合模型进行解释[35]。校正后的![]() =0.961 3,与R2接近,说明模型具有准确性和通用性[36],因此可用该模型来分析和预测海马多肽提取实验中各因素对DPPH自由基清除率的影响。
=0.961 3,与R2接近,说明模型具有准确性和通用性[36],因此可用该模型来分析和预测海马多肽提取实验中各因素对DPPH自由基清除率的影响。
2.3.2 各因素交互作用对酶解物DPPH自由基清除率的影响
在回归模型方差分析结果的基础上,采用Design-Expert 8.0.6根据回归方程式绘制响应面图和等高线图,分析酶解时间、pH值和E/S对DPPH自由基清除率的影响。2 个因素的交互作用对响应值的影响可以用等高线图和响应曲面表示,结果见图6。响应曲面越陡,交互作用对响应值的影响越显著;等高线越接近椭圆,因素之间的交互作用越强[37]。
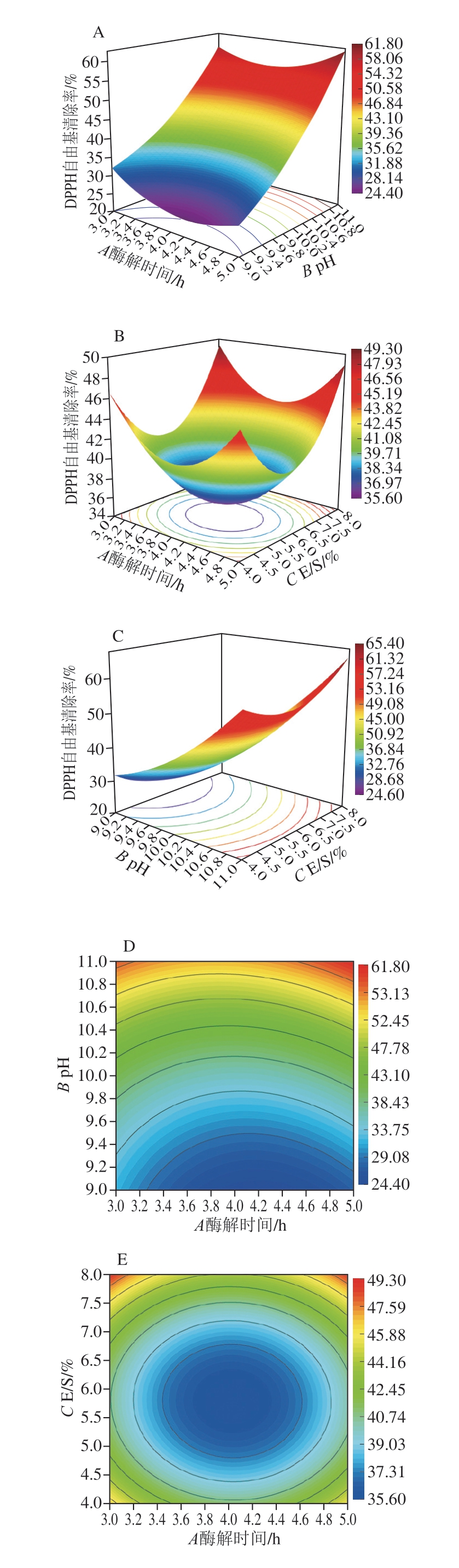
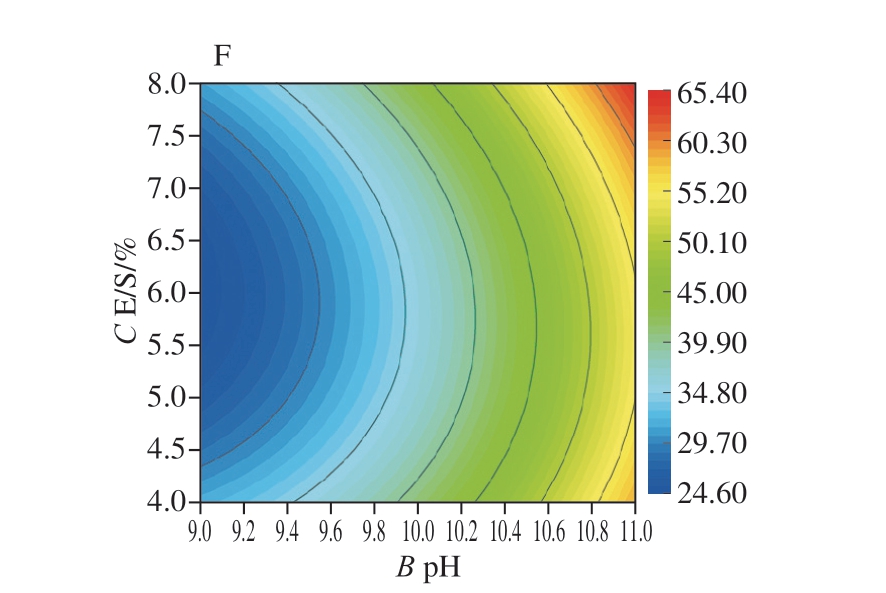
图6 Box-Behnken响应面三维图和等高线图
Fig. 6 Response surface and contour plots
酶解时间和pH值、pH值和E/S的响应曲面与酶解时间和E/S的响应曲面相比更加陡峭,因此前两者对响应值的影响更显著。pH值和E/S的交互作用等高线接近椭圆,表明其对DPPH自由基清除率的影响最大,酶解时间和pH值的交互作用对DPPH自由基清除率的影响次之。
2.3.3 工艺优化验证
采用Design Expert 8.0.6软件求解方程,得到理想的提取条件为:酶解时间3 h、pH 11、E/S 7.518%,此时得到的海马多肽对DPPH自由基清除率为64.745%。进行3 次重复实验,平均值为63.6170%,与预测值相符,提取工艺稳定。
2.4 体外抗氧化能力测定
2.4.1 不同质量浓度海马多肽的DPPH自由基清除率
由图7可知,海马多肽对DPPH自由基的清除能力弱于VC,但随着多肽质量浓度增加,对DPPH自由基的清除力也不断增强。其半清除质量浓度(half maximal inhibitory concentration,IC50)为4.549 mg/mL。
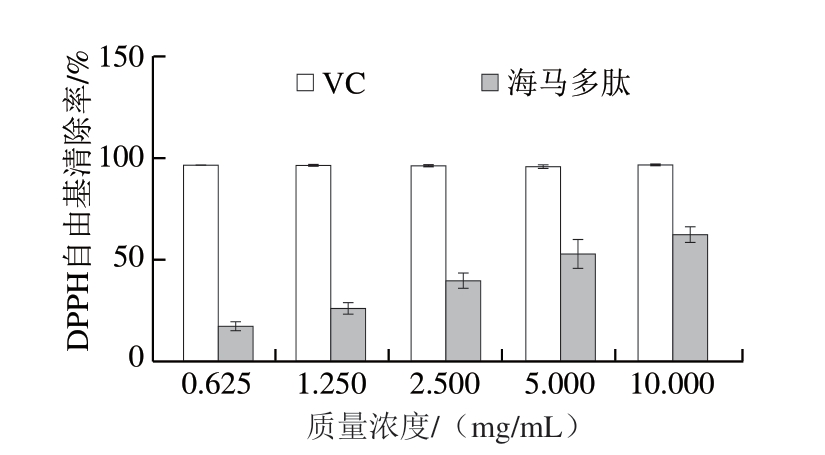
图7 不同质量浓度海马多肽的DPPH自由基清除作用
Fig. 7 DPPH radical scavenging capacity of peptides from Hippocampus abdominals
2.4.2 不同质量浓度海马多肽的ABTS阳离子自由基清除率
由图8 可知,海马多肽对A B T S 阳离子自由基的清除作用与V C 相当,当多肽质量浓度为1.2 5 m g/m L 时,对A B T S 阳离子自由基清除率为(94.42±0.15)%,而VC的ABTS阳离子自由基清除率为(94.76±0.01)%。
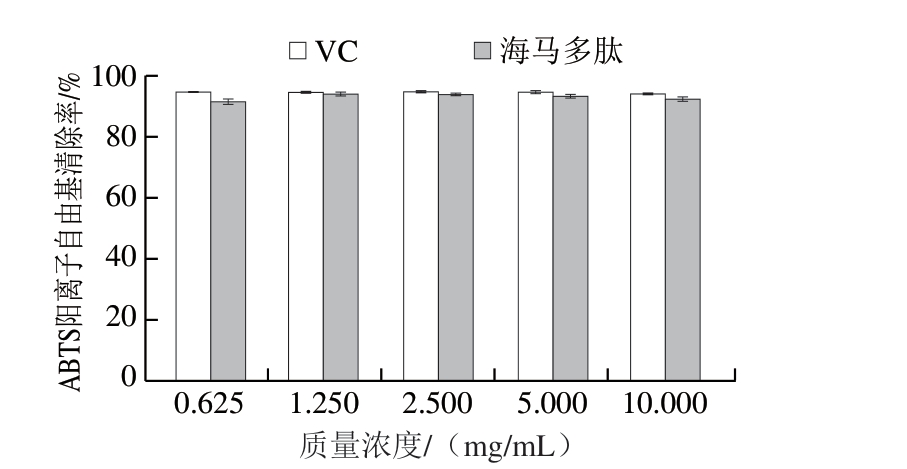
图8 不同质量浓度海马多肽的ABTS阳离子自由基清除作用
Fig. 8 ABTS cation radical scavenging effect of peptides from Hippocampus abdominals
2.4.3 不同质量浓度海马多肽的羟自由基清除率
由图9可知,海马多肽对羟自由基的清除能力弱于VC,但随海马多肽含量的增加,清除能力也不断增强,其IC50为6.815 mg/mL。
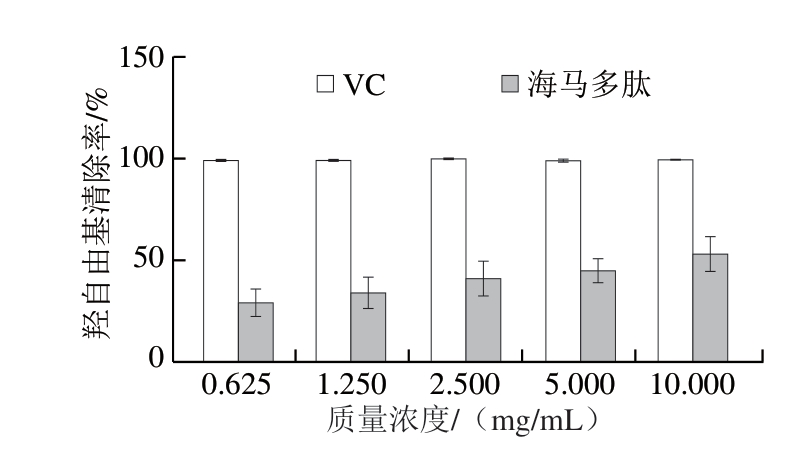
图9 不同质量浓度海马多肽的羟自由基清除作用
Fig. 9 Hydroxyl radical scavenging effect of peptides from Hippocampus abdominals
3 结 论
本研究通过酶解法对膨腹海马酶解多肽进行提取,以DPPH自由基清除率为指标筛选出碱性蛋白酶为最优酶。进一步通过单因素和响应曲面试验确定膨腹海马酶解物的最佳提取工艺。最终确定最佳提取工艺:在料液比1∶20、pH 11、温度50 ℃、E/S 7.581%条件下酶解3 h,此时含量为10 mg/mL的酶解物溶液对DPPH自由基清除率能够达到64.62%,与模型预测值相近。通过DPPH自由基、ABTS阳离子自由基以及羟自由基清除实验对最佳提取工艺提取出的膨腹海马酶解物的抗氧化活性进行验证,实验结果表明该方法提取的酶解物具有良好的抗氧化活性,可用于食品、化妆品、药品等研发原料,具有较广阔的研究应用前景。
海马作为一种名贵中药材,在药用领域有着十分悠久的研究历史。为进一步拓宽海马在食品领域的开发,海马酒是一种常见的应用形式,但海马酒生产过程中易造成大量残渣蛋白质流失,导致资源未能得到有效的利用。本研究可为后续对海马酒残渣酶解多肽的研究提供一定的基础。之后还可通过对酶解物中氨基酸、分子质量的测定以及分离纯化多肽,对其活性进一步研究。
[1] 朱苗, 谢勇, 卢忠英, 等. 海马活性成分提取技术研究进展[J].广州化工, 2015, 43(10): 19-20; 32. DOI:CNKI:SUN:GZ HA.0.2015-10-008.
[2] 司夏丹, 葛晓鸣, 徐永健, 等. 基于气味客观化的海马化学成分分析[J]. 核农学报, 2018, 32(5): 941-951. DOI:10.11869/j.issn.100-8551.2018.05.0941.
[3] 陈梦, 陈建真, 葛宇清, 等. 海马化学成分及药理活性研究进展[J]. 中草药, 2017, 48(19): 4089-4099. DOI:10.7501/j.issn.0253-2670.2017.19.029.
[4] 唐海婷, 张才, 张永平, 等. 雌、雄海马抗疲劳和改善记忆障碍比较[J]. 广东海洋大学学报, 2019, 39(3): 103-108. DOI:10.3969/j.issn.1673-9159.2019.03.014.
[5] 李康伟, 颜玲, 张才, 等. 海马对慢性应激模型小鼠抑郁行为及神经递质含量的影响[J]. 广东海洋大学学报, 2018, 38(6): 76-82.DOI:10.3969/j.issn.1673-9159.2018.06.012.
[6] 冯星, 巫志峰, 杨柳, 等. 中药海马提取物对实验性脑缺血再灌注损伤的药理作用[J]. 湖南师范大学学报(医学版), 2005, 2(1): 1-4.DOI:10.3969/j.issn.1673-016X.2005.01.001.
[7] 罗辉玉, 祁剑飞, 郑乐云, 等. 膨腹海马温度耐受性及不同温度对其生长的影响[J]. 渔业研究, 2021, 43(5): 480-486. DOI:10.14012/j.cnki.fjsc.2021.05.005.
[8] WILSON A B, MARTIN-SMITH K M. Genetic monogamy despite social promiscuity in the pot-bellied seahorse (Hippocampus abdominalis)[J]. Molecular Ecology, 2007, 16(11): 2345-2352.DOI:10.1111/j.1365-294X.2007.03243.x.
[9] SUAREZ-JIMENEZ G M, BURGOS-HERNANDEA A,EZQUERRA-BRAUER J M. Bioactive peptides and depsipeptides with anticancer potential: sources from marine animals[J]. Marine Drugs, 2012, 10(5): 963-986. DOI:10.3390/md10050963.
[10] LEE S Y, HUR S J. Antihypertensive peptides from animal products,marine organisms, and plants[J]. Food Chemistry, 2017, 228: 506-517.DOI:10.1016/j.foodchem.2017.02.039.
[11] KANG H K, LEE H H, SEO C H, et al. Antimicrobial and immunomodulatory properties and applications of marinederived proteins and peptides[J]. Marine Drugs, 2019, 17(6): 350.DOI:10.3390/md17060350.
[12] KIM H S, JE J G, RYU B, et al. Antioxidant and angiotensin-I converting enzyme inhibitory peptides from Hippocampus abdominalis[J]. European Food Research and Technoiogy, 2019,245(2): 479-487. DOI:10.1007/s00217-018-3179-0.
[13] LEE H G, NAGAHAWATTA D P, YANG F, et al. Antioxidant potential of hydrolysate-derived seahorse (Hippocampus abdominalis)peptide: protective effects against AAPH-induced oxidative damage in vitro and in vivo[J]. Food Chemistry, 2023, 407: 135130. DOI:10.1016/j.foodchem.2022.135130.
[14] LEE H G, KIM H S, AN H, et al. Antihypertensive effects of IGTGIPGIW peptide purified from Hippocampus abdominalis:p-eNOS and p-AKT stimulation in EA.hy926 cells and lowering of blood pressure in SHR model[J]. Marine Drugs, 2022, 20(6): 354.DOI:10.3390/md20060354
[15] 林端权, 郭泽镔, 张怡, 等. 海洋生物活性肽的研究进展[J].食品工业科技, 2016, 37(18): 367-373. DOI:10.13386/j.issn1002-0306.2016.18.062.
[16] 周德庆, 李娜, 王珊珊, 等. 水产加工副产物源抗氧化肽的研究现状与展望[J]. 水产学报, 2019, 43(1): 188-196. DOI:10.11964/jfc.20180811427.
[17] ZHU Y, YU J, JIAO C, et al. Optimization of quercetin extraction method in Dendrobium officinale by response surface methodology[J].Heliyon, 2019, 5(9): e02374. DOI:10.1016/j.heliyon.2019.e02374.
[18] 王慧森, 刘明, 李更生, 等. HPLC-PDA联合Box-Behnken响应面法优选五苓散低极性部位提取工艺[J]. 中草药, 2022, 53(21): 6741-6749.DOI:10.7501/j.issn.0253-2670.2022.21.011.
[19] PISOSCHI A M, POP A. The role of antioxidants in the chemistry of oxidative stress: a review[J]. European Journal of Medicinal Chemistry, 2015, 97: 55-74. DOI:10.1016/j.ejmech.2015.04.040.
[20] 凌霞, 范可青. 超微粉碎技术对栀子的影响[J]. 中国标准化,2022(15): 228-231. DOI:10.3969/j.issn.1002-5944.2022.15.038.
[21] 李艺博, 李娟, 刘碧原, 等. 中药超微粉碎技术应用概况[J]. 中华中医药杂志, 2020, 35(9): 4568-4570.
[22] 刘云姣, 张海燕, 刘淑晗, 等. 响应面优化南极磷虾蛋白酶解工艺及蛋白肽组分分析[J]. 现代食品科技, 2019, 35(1): 144-151.DOI:10.13982/j.mfst.1673-9078.2019.1.021.
[23] 石雪萍, 郑萍. 紫包菜花色苷提取工艺及其对DPPH清除活性研究[J]. 食品研究与开发, 2018, 39(1): 37-40. DOI:10.3969/j.issn.1005-6521.2018.01.008.
[24] 冯艳霞, 贾一凡, 顾海华, 等. 响应面法优化板栗多肽制备及其清除DPPH能力的研究[J]. 食品工业科技, 2016, 37(22): 315-319; 335.DOI:10.13386/j.issn1002-0306.2016.22.053.
[25] 颜阿娜, 洪燕婷, 王琳, 等. 鲭鱼酶解工艺双响应面法优化及抗氧化活性研究[J]. 通化师范学院学报, 2023, 44(4): 59-67.
[26] 李巧凤. 甜柿果醋酿造工艺、抗氧化活性及催陈研究[D]. 武汉: 华中农业大学, 2020.
[27] 李志成, 蒋爱民, 岳田利, 等. 山羊乳酪蛋白酶解工艺及抗氧化性研究[J]. 食品科学, 2009, 30(21): 252-257. DOI:10.3321/j.issn:1002-6630.2009.21.059.
[28] 杨雅兰, 阳志军, 阳格. 不同蛋白酶对燕麦蛋白水解物乳化性和抗氧化性的影响[J]. 粮食与油脂, 2021, 34(7): 28-31. DOI:10.3969/j.issn.1008-9578.2021.07.008.
[29] 段志强. 大豆肽的制备及其在食品中的应用[D]. 上海: 华东师范大学, 2015.
[30] 付雪媛, 杜芬, 孙呈浩, 等. 蛤蜊肽的制备工艺优化及其增强免疫活性[J]. 食品工业科技, 2023, 44(9): 244-253. DOI:10.13386/j.issn1002-0306.2022080126.
[31] 陈弘培, 刘艺琳, 龚世禹,等. 响应面法优化牡蛎多肽酶解工艺的研究[J]. 农产品加工(上半月), 2019(9): 19-23. DOI:10.16693/j.cnki.1671-9646(X).2019.05.006.
[32] EIKADY E F, FOUAD M A, MOZAYAD A N. Application of Box-Behnken experimental design and response surface methodology for selecting the optimum RP-HPLC conditions for the simultaneous determination of methocarbamol, indomethacin and betamethasone in their pharmaceutical dosage form[J]. BMC Chemistry, 2022, 16(1):114. DOI:10.1186/s13065-022-00908-9.
[33] 李婷, 刘婵, 凌佳琦, 等. Box-Behnken设计-响应面法优选复方三七降脂滴丸成型工艺[J]. 中国药师, 2022, 25(7): 1259-1301.DOI:10.19962/j.cnki.issn1008-049X.2022.07.029.
[34] LI Y L, FANG Z X, YOU J. Application of Box-Behnken experimental design to optimize the extraction of insecticidal Cry1Ac from soil[J]. Journal of Agricultural and Food Chemistry, 2013, 61(7):1464-1470. DOI:10.1021/jf304970g.
[35] KOVÁCS Z, MOLNÁR C, ŠTANGAR U L, et al. Optimization method of the solvothermal parameters using Box-Behnken experimental design-the case study of ZnO structural and catalytic tailoring[J]. Nanomaterials, 2021, 11(5): 1334. DOI:10.3390/nano11051334.
[36] 娄悦, 苏雪蓉, 毛春芹, 等. Box-Behnken响应面实验优化鳖血冻干粉的制备工艺[J]. 中国药房, 2023, 34(13): 1573-1576. DOI:10.6039/j.issn.1001-0408.2023.13.06.
[37] 李琪, 张慧, 安超, 等. 响应面法优化苦瓜甙的提取工艺及其HPLC测定[J]. 安徽农业大学学报, 2022, 49(1): 175-180. DOI:10.13610/j.cnki.1672-352x.20220325.011.