罗非鱼片含水量高,容易受到微生物污染,失去食用价值和经济价值。假单胞菌(Pseudomonas)是一类好氧或兼性厌氧的革兰氏阴性细菌,广泛分布在土壤[1]、水[2]及水产品[3-4]中,是罗非鱼片的特定腐败菌[5],抑制Pseudomonas等微生物的生长是鱼片保鲜的目标和方向。目前关于鱼片保鲜的物理和化学方法有很多,真空保鲜[6]、气调保鲜[7]、辐照保鲜[8]和防腐剂保鲜[9],往往出现不易被接受、口感差、保鲜效果不佳、成本高[10]等问题,难以满足实际需要。近年来,金属离子的抑菌作用研究及其在食品保鲜中的应用逐渐兴起。李瑜珍等[11]研究不同浓度葡萄糖、氯化钠及氯化铁对铜绿假单胞菌生物膜形成的影响。鲁重等[12]阐述了致腐Pseudomonas生物被膜形成的调控机制,揭示生鲜食品来源的Pseudomonas致腐机制。杨静[13]以乳酸亚铁为保鲜剂处理罗非鱼,并加入0.5%的柠檬酸,置于8 ℃下冷藏,结果显示,经喷淋乳酸亚铁的罗非鱼其感官评分、菌落总数、挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、硫代巴比妥酸反应物(thiobarbituric acid reaction substances,TBARs)值及pH值均低于对照,证实亚铁离子对罗非鱼具有保鲜效果。
铁离子作为微生物生长所必需的微量元素之一,是细胞色素、细胞呼吸酶、过氧化氢酶、氮酸还原酶等物质的重要组成部分[14-15],通常会与酶蛋白质共价结合,促进细胞呼吸和生物遗传因子的合成等[16]。为抑制细菌侵染,宿主会进入“铁限制”状态[17-18],大部分细菌会因缺铁而生长受到抑制。但某些竞争力强的细菌,如Pseudomonas能够在低铁的环境下产生铁螯合蛋白——嗜铁素,从宿主细胞内将铁“争夺”出来[19],适应环境中铁离子含量变化,从而在整个微生物菌相中处于优势地位。但当宿主环境中含有足够的铁离子时,菌群间对铁离子竞争的拮抗作用即会削弱,原来竞争性弱的细菌也会得到生长繁殖,呈现多菌相状态。在固定营养基质的前提下,优势腐败菌的生长是否会受到其他细菌生长的影响而失去优势地位,从而减少腐败产物的产生,延缓产品货架期,是值得探讨的问题。除此之外,亚铁离子还可以与过氧化氢、超氧阴离子等反应生成强氧化剂羟自由基,破坏包括糖、脂质、脱氧核糖核酸链等几乎所有的生物分子,对微生物具有极大的损害效应[20]。目前关于应用氯化亚铁保鲜罗非鱼片鲜见研究报道。
因此,本实验通过氯化亚铁溶液浸泡罗非鱼鱼片的方式,研究其对鱼片特定腐败菌Pseudomonas生长代谢特性的影响,旨在为鱼片冷藏保鲜提供思路。
1 材料与方法
1.1 材料与试剂
罗非鱼片 茂名市海名威水产科技有限公司提供;细菌基因组DNA快速提取试剂盒 广州东盛生物科技公司;Goldview染料(含量≥95%) 上海俊晟生物科技有限公司;DNA Marker DL2000 南京生兴生物技术有限公司;溴化乙锭溶液、6×上样缓冲液 北京百奥莱博科技有限公司;2×GoTaq Green Master Mix 普洛麦格(北京)生物技术有限公司;氯化亚铁 青岛海博生物技术有限公司;氯化钠 北京奥博星生物技术有限责任公司。
1.2 仪器与设备
2001-220DGGE电泳仪 美国CBS Scientific公司;T196 DNA扩增仪 德国Biometra公司;DYCP-31CN水平电泳仪 北京六一仪器厂;DSHZ-300A型旋转式恒温振荡器 太仓实验设备厂;TPX-20MC紫外观察仪 法国Vilber Lourmat公司;TGL-16G型台式高速离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 罗非鱼片处理
根据孙红启[20]、杨静[13]的研究,以满足微生物生长所需及微生物细胞对金属离子的耐受性为参考,选择一定的盐含量进行实验。分别配制质量浓度2 g/100 mL的氯化亚铁溶液、1.84 g/100 mL的氯化钠溶液,高压灭菌后冷却。无菌操作下将新鲜罗非鱼片浸泡在氯化亚铁溶液和氯化钠溶液中30 min左右(浸泡后鱼片中亚铁离子质量浓度为8.84 mg/mL),以浸泡无菌蒸馏水的鱼片作对照,鱼片捞出沥干,覆保鲜膜后于4 ℃冰箱中保藏,每隔3 d取样进行分析。
1.3.2 感官评定
选择6 位有鉴定能力的感官评价员,按照感官评定标准(表1)对样品的色泽、气味、质地、黏液外观四方面进行评定打分,对评价结果进行统计分析。
表1 感官评定标准
Table 1 Criteria for sensory evaluation of fish fillets

项目(权重) 极新鲜(9~10 分) 新鲜(6~8 分) 轻度腐败(4~5 分) 严重腐败(1~3 分)色泽(20%)肉色非常明亮肉色明亮肉色暗淡肉色发暗气味(30%) 鱼特有的新鲜气味无明显气味淡淡腥臭味或酸臭味 浓重腥臭味或酸臭味质地(30%)质地紧密,弹性很好,指压表面肌肉立即复原鱼肉坚实,指压表面肌肉缓慢复原鱼肉中度柔软,弹性差鱼肉十分柔软黏液外观(20%) 微量澄清,光亮少量,澄清黏液较多,较浑浊大量黏液,浑浊
1.3.3 菌落总数的测定
按照GB 4789.2—2016《食品微生物学检验 菌落总数测定》的方法,无菌条件下取鱼肉10 g至无菌锥形瓶中,加入灭菌生理盐水90 mL,120 r/min振荡器振摇30 min。取1 mL上清液进行梯度稀释,用计数培养基于30 ℃培养48 h,计算菌落总数。
1.3.4 TVB-N含量的测定
按照GB/T 5009.44—2003《肉与肉制品卫生标准的分析方法》中的微量扩散法,以每100 g鱼片中所含氮含量(mg)表示。
1.3.5 三甲胺(trimethylamine,TMA)含量的测定
采用微量扩散法,取适量鱼浆液(鱼肉∶水=1∶3,m/V)和0.5 mL甲醛溶液于康卫皿外室,取2.0 mL质量分数2%硼酸吸收液于皿内室,皿口涂凡士林,外室加1 mL质量分数40%碳酸钾溶液,迅速盖好皿盖,微倾斜,使碳酸钾溶液和样品混匀,于37 ℃恒温箱中反应3 h,取出样品冷却,用0.01 mol/L的盐酸标准溶液滴定内室硼酸吸收液至蓝紫色为终点。TMA含量按下式计算。
式中:V为滴定样品消耗盐酸标准溶液体积/mL;V0为滴定空白消耗盐酸标准溶液体积/mL;m为样品液所含样品质量/g;14为每克当量氮质量/g;0.01为盐酸标准溶液浓度/(mol/L)。
1.3.6 细菌总DNA的提取
无菌取10 g鱼肉样品于盛有90 mL生理盐水的无菌锥形瓶中,加入10 g玻璃珠,置于振荡器上120 r/min振荡30 min,静置5 min,移取20 mL上清液于无菌离心管中。然后以10 000 r/min离心20 min,弃上清液得菌体沉淀[21]。按试剂盒操作步骤将所得沉淀加入DS缓冲液200 μL,剧烈涡漩振荡后加入蛋白酶K溶液20 μL,55 ℃条件下水浴30 min。加入裂解液220 μL,漩涡混匀,65 ℃水浴10 min,再加入无水乙醇220 μL,上下混匀后将溶液及絮状沉淀全部转移到纯化柱中,12 000 r/min离心1 min,弃滤液,继续按试剂盒说明进行。将提取的细菌总DNA溶于60 μL Tris-EDTA洗脱液中,用质量分数1%琼脂糖凝胶电泳检测其浓度及纯度后于-20 ℃冻存备用。
1.3.7 细菌总DNA的16S rDNA的V3可变区的聚合酶链式反应(polymerase chain reaction,PCR)扩增
本实验所用引物序列见表2,由上海捷瑞生物工程有限公司合成。采用巢氏PCR法,先用引物8F/798R进行第1轮PCR,扩增约800 bp的细菌16S rDNA序列[22]。25 μL PCR体系:GoTaq Green Master Mix(2×)12.5 μL,细菌DNA模板2 μL,引物(10 μmol/L)各1 μL,ddH2O 8.5 μL。PCR程序[23]:94 ℃预变性2 min;94 ℃变性1 min,58 ℃退火1 min,72 ℃延伸2 min,25 个循环;最后72 ℃再延伸2 min。用含Goldview染料的质量分数1%琼脂糖电泳检测PCR产物产量及特异性后进行第2轮PCR。
表2 实验所用引物序列
Table 2 Primer sequences used in this experiment
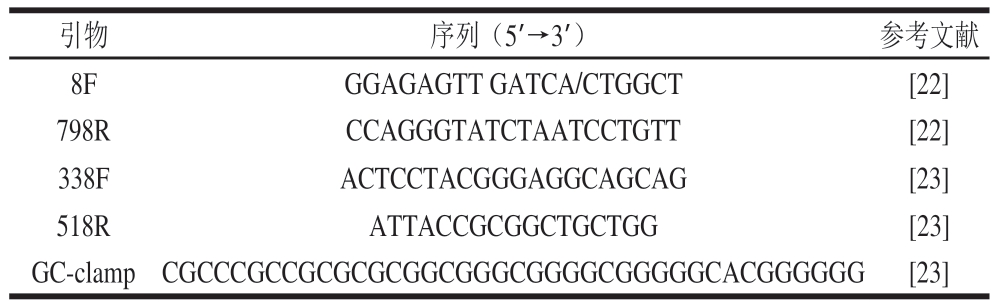
注:GC-clamp(夹板)加在该引物5’端。
引物序列(5’→3’)参考文献8FGGAGAGTT GATCA/CTGGCT[22]798RCCAGGGTATCTAATCCTGTT[22]338FACTCCTACGGGAGGCAGCAG[23]518RATTACCGCGGCTGCTGG[23]GC-clamp CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGG[23]
以第1轮PCR产物为模板进行第2轮PCR,采用引物GC338F/518R,对细菌16S rDNA的V3区片段进行降落PCR扩增。50 μL PCR体系:GoTaq Green Master Mix(2×)25 μL,DNA模板1 μL,引物(10 μmol/L)各1 μL,ddH2O 22 μL。PCR程序:94 ℃预变性5 min,然后进行降落PCR程序,20 个循环(94 ℃变性1 min;退火温度从65 ℃到55 ℃,退火30 s;72 ℃延伸3 min),再于恒定退火温度下进行10 个循环(94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸3 min),最后72 ℃延伸10 min。PCR产物经质量分数1.2%琼脂糖凝胶电泳检测后,于-20 ℃冰箱中冻存。
1.3.8 PCR产物的变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)分析
参照Muyzer等[24]方法,进行细菌16S rDNA的V3区扩增产物的DGGE分析。质量浓度80 g/L聚丙烯酰胺凝胶(丙烯酰胺与甲基双丙烯酰胺的质量比为37.5∶1),40%~60%变性剂梯度(100%变性剂含有7 mol/L尿素和40%甲酰胺),在1×TAE缓冲溶液中,60 ℃恒温,150 V电压电泳5 h。电泳结束后,用1×TAE(含0.5 mg/L E B)将D G G E 胶片染色3 0 m i n。弃去染色液,用ddH2O漂洗10 min。染色后的DGGE胶片用凝胶成像系统拍照。
1.3.9 DGGE条带的切割、重扩增及PCR产物纯化
将DGGE胶片放在紫外观测台上,参照Toffin等[25]方法,切下各泳道中的主要条带,溶于30 μL ddH2O中,4 ℃下过夜。以10 μL回收的DNA溶液为模板,338F(无GC夹)/518R为引物,采用1.3.7节的PCR体系和程序进行扩增。取4 μL PCR产物进行琼脂糖电泳,检查其产量及特异性。采用割胶纯化法进行PCR产物纯化。
1.3.10 DGGE条带的克隆、测序
DNA测序由上海生物工程技术服务公司完成,将纯化后的PCR产物连接到pMD18-T载体上,转化DH5α细胞,对阳性克隆株进行测序,测序得到细菌16S rDNA片段序列,用NCBI中的BLAST命令与GenBank数据库进行比对,找出相似度最高的序列。
1.4 数据处理
采用Microsoft Excel 2007软件处理数据和绘制图表,用SPSS 18.0软件分析方差。所有实验均平行测定3 次,结果取平均值。
2 结果与分析
2.1 亚铁离子对冷藏罗非鱼片感官评分的影响
由图1可知,4 ℃冷藏条件下,随冷藏时间延长,氯化亚铁溶液、氯化钠溶液、无菌蒸馏水3 种处理方式的鱼片的感官评分逐渐下降。冷藏到第9天时,无菌蒸馏水、氯化钠溶液、氯化亚铁溶液浸泡的鱼片的感官评分分别为4.38、4.69、6.42 分。方差分析可知,不同溶液浸泡处理对罗非鱼片的感官评分影响显著(P<0.05)。
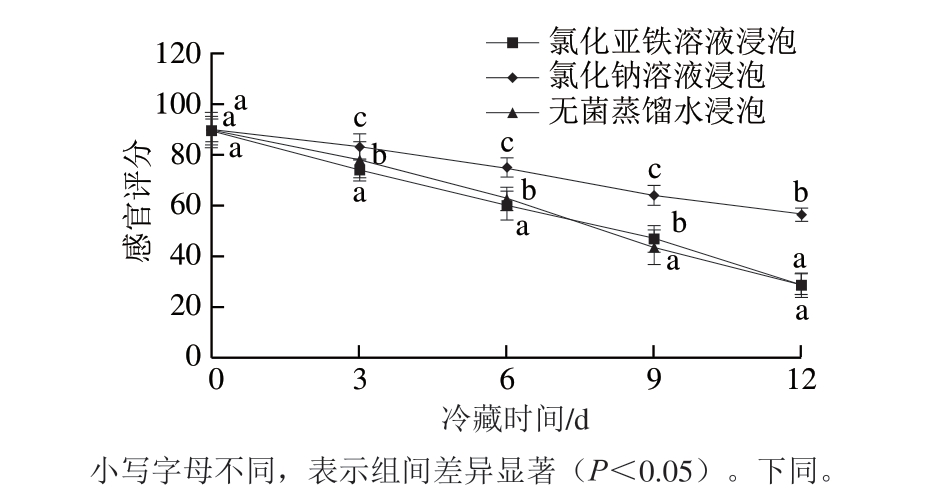
图1 亚铁离子处理的罗非鱼片在冷藏过程中感官评分的变化
Fig. 1 Changes in sensory score of tilapia fillets treated with ferrous ions during refrigeration
2.2 亚铁离子对冷藏罗非鱼片菌落总数的影响
由图2 可知,4 ℃冷藏条件下,随冷藏时间延长,氯化亚铁溶液、氯化钠溶液、无菌蒸馏水3 种处理溶液浸泡的鱼片的菌落总数均呈递增趋势。参照SC/T 3116—2006《冻淡水鱼片》规定[26],菌落总数须不超过1.0×107 CFU/g。冷藏到第9天,无菌蒸馏水和氯化钠溶液浸泡的鱼片菌落总数分别达到2.5×109、2.1×108 CFU/g,均超过标准规定;而氯化亚铁溶液浸泡的鱼片的菌落总数仅为2.6×105 CFU/g,没有超标。这可能是由于亚铁离子虽然能够提升Psychrobacter等细菌的生长,但其生长增量却低于Pseudomonas的生长减量。这与樊洁敏等[27]的研究结果一致,金属离子对食品致腐荧光Pseudomonas生物被膜形成会产生影响。方差分析发现,不同溶液浸泡处理对罗非鱼片的菌落总数影响显著,由多重比较得,氯化亚铁溶液最能有效抑制罗非鱼片上菌落总数的增加。
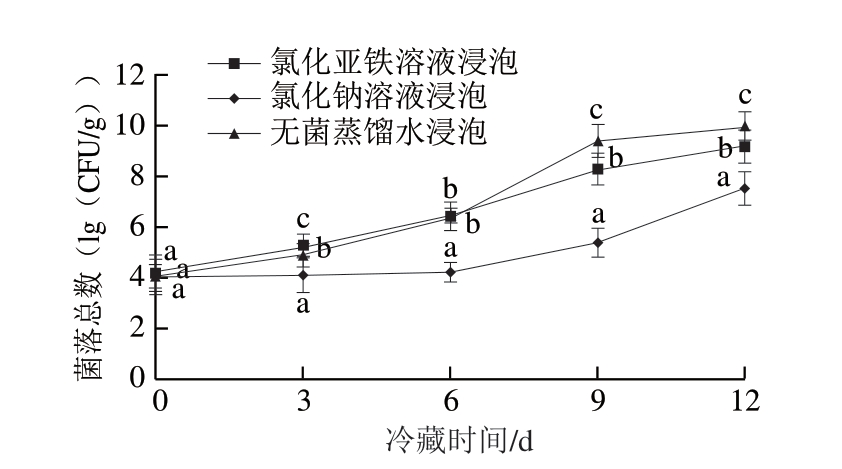
图2 亚铁离子处理的罗非鱼片在冷藏过程中菌落总数的变化
Fig. 2 Changes in total bacterial count on tilapia fillets treated with ferrous ions during refrigeration
2.3 亚铁离子对冷藏罗非鱼片TVB-N含量的影响
由图3可知,4 ℃冷藏条件下,随冷藏时间延长,氯化亚铁溶液、氯化钠溶液、无菌蒸馏水3 种处理方式的鱼片的TVB-N含量均增加。参照SC/T 3116—2006规定TVB-N含量≤20 mg/100 g。冷藏到第9天时,无菌蒸馏水浸泡鱼片的TVB-N含量为20.58 mg/100 g,氯化钠溶液浸泡鱼片的TVB-N含量为20.69 mg/100 g,2 种处理方式均超过标准规定;而氯化亚铁溶液浸泡的鱼片的TVB-N含量为17.42 mg/100 g,没有超标。方差分析可知,不同溶液浸泡处理对罗非鱼片的TVB-N含量影响显著(P<0.05),经多重比较,氯化亚铁溶液最能有效抑制罗非鱼片上TVB-N含量增加。
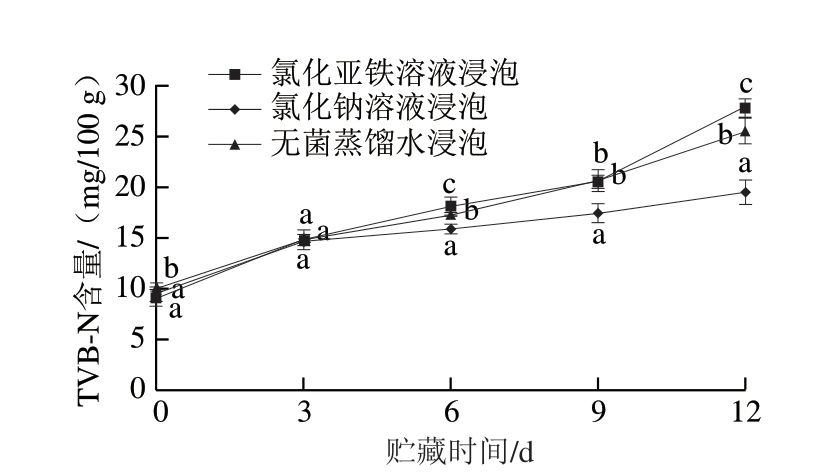
图3 亚铁离子处理的罗非鱼片在冷藏过程中TVB-N含量的变化
Fig. 3 Changes in TVB-N value of tilapia fillets treated with ferrous ions during refrigeration
2.4 亚铁离子对冷藏罗非鱼片TMA含量的影响
由图4可知,4 ℃冷藏条件下,随冷藏时间延长,氯化亚铁溶液、氯化钠溶液、无菌蒸馏水3 种溶液浸泡的鱼片的TMA含量均呈上升趋势,冷藏到第12天时,无菌蒸馏水、氯化钠溶液、氯化亚铁溶液浸泡鱼片的TMA含量分别达到5.08、4.92、2.54 mg/100 g。方差分析可知,不同溶液浸泡处理对罗非鱼片的TMA含量影响显著(P<0.05),多重比较结果表明,氯化亚铁溶液最能有效抑制罗非鱼片上TMA含量的增加。
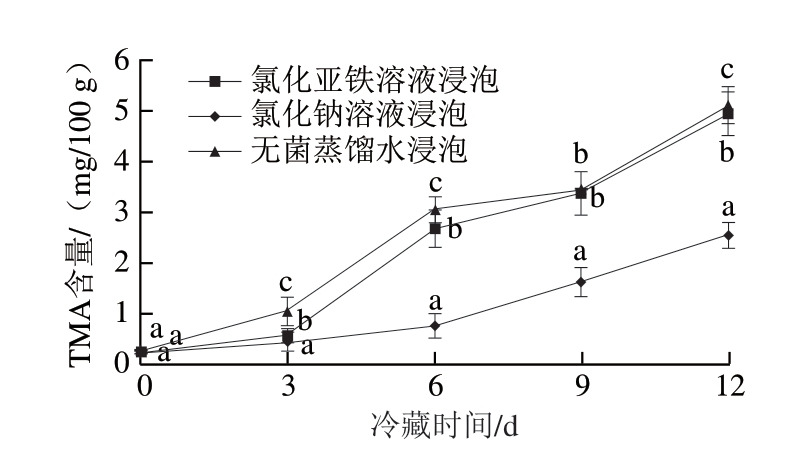
图4 亚铁离子处理的罗非鱼片在冷藏过程中TMA含量的变化
Fig. 4 Changes in TMA content of tilapia fillets treated with ferrous ions during refrigeration
2.5 亚铁离子对冷藏罗非鱼片上细菌生长的影响
细菌总DNA提取及PCR扩增结果分别如图5所示,3 种不同溶液浸泡处理的鱼片的细菌总DNA均扩增出目的片段。
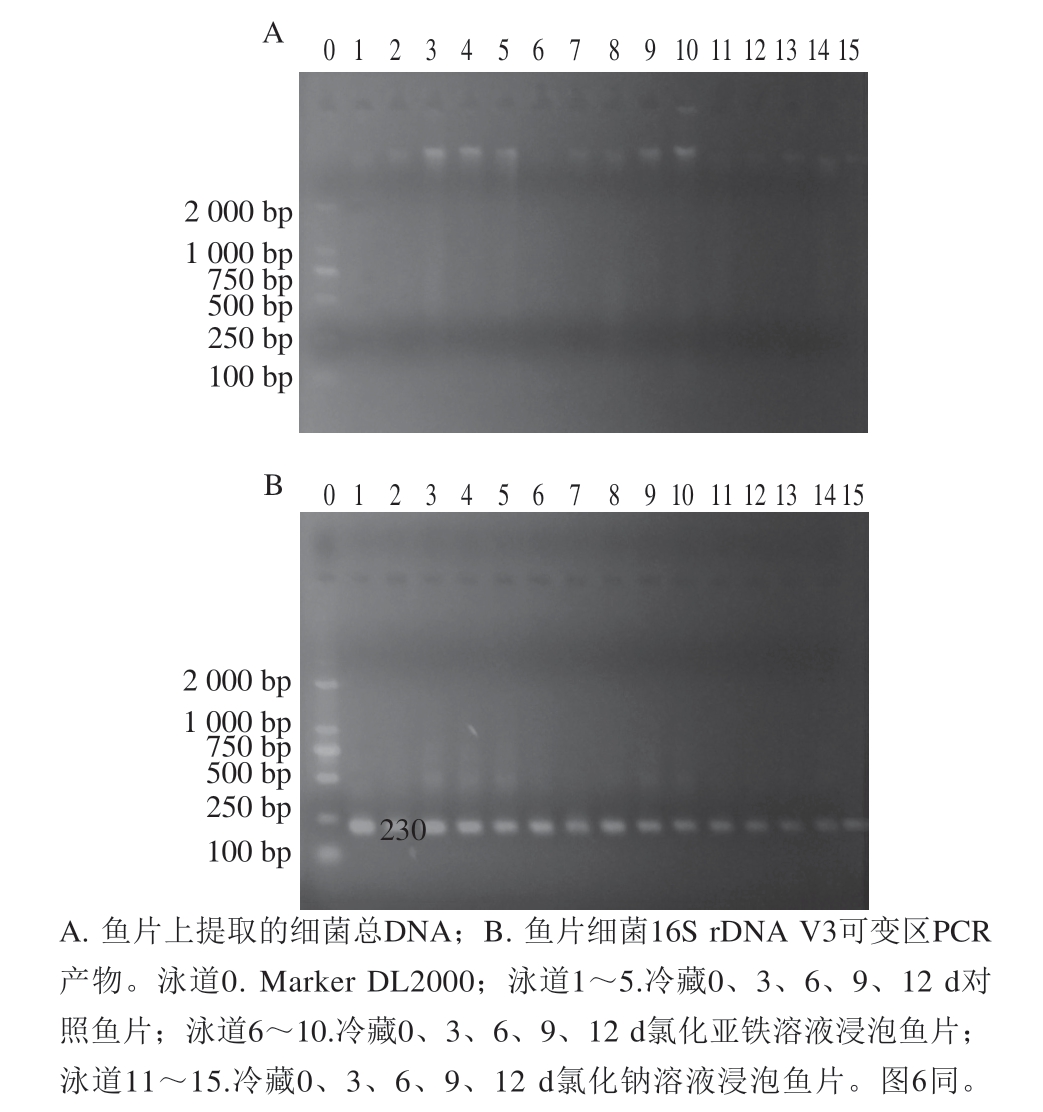
图5 罗非鱼片上细菌总DNA及PCR扩增产物电泳图
Fig. 5 Electropherograms of total bacterial DNA and PCR amplification products from tilapia fillets
由图6和表3可知,从1~5号泳道、6~10号泳道、11~15号泳道,f条带的亮度逐渐增大,说明随冷藏时间延长,对照、氯化亚铁溶液、氯化钠溶液浸泡处理鱼片上的Pseudomonas数量均逐渐增加;6号和11号泳道类似,其c、d、e、h、i条带强度均比1号泳道大,说明氯化亚铁溶液和氯化钠溶液浸泡处理鱼片在冷藏初期的菌相较为复杂,Shewanella putrefaciens、Psychrobacter sp.、Acinetobacter sp.、Brevibacterium sp.等微生物的数量较对照鱼片多,这与初期鱼片状态有关;8号、9号泳道的d、e条带均比3号和4号、13号和14号的亮度大,说明氯化亚铁溶液浸泡处理鱼片上的Shewanella putrefaciens和Psychrobacter数量比对照和氯化钠溶液浸泡处理鱼片多,即亚铁离子的存在提高了Shewanella putrefaciens、Psychrobacter等细菌在此特定生态系统中的竞争力,这种情况可能是因为外加的亚铁离子改善了其他细菌对铁的摄取情况,使其不至于因Pseudomonas分泌嗜铁素导致铁离子缺乏而死亡[28-29]。但外加的亚铁离子并未根本改变Pseudomonas的优势地位。其原因可能是亚铁离子含量不适当,不足以维持Psychrobacter等细菌在冷藏后期的生长所需。11~15号泳道中c、d、e、h条带从有到无,表明随冷藏时间延长,氯化钠溶液浸泡处理鱼片的菌相趋向单一,Pseudomonas优势菌地位越来越突出。
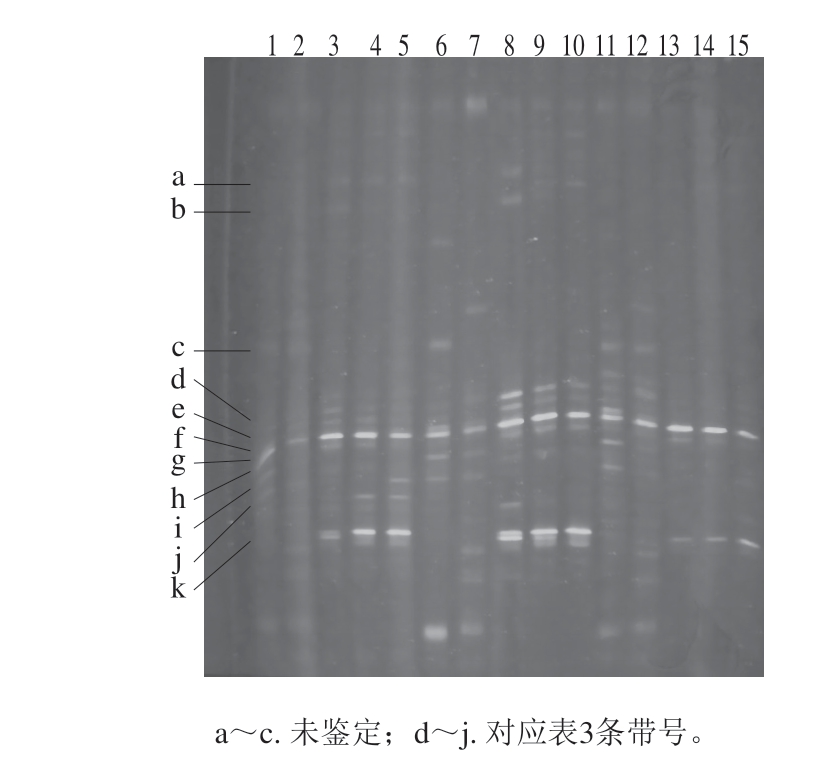
图6 罗非鱼片上细菌16S rDNA的DGGE电泳图
Fig. 6 DGGE electropherograms of bacterial 16S rDNA from tilapia fillets
表3 DGGE条带分离的细菌16S rDNA序列鉴定
Table 3 Identification of 16S rDNA sequences of bacteria isolated in DGGE bands

条带号最相似已知菌d 腐败希瓦氏菌(Shewanella putrefaciens)e嗜冷杆菌属(Psychrobacter sp.)f假单胞菌属(Pseudomonas sp.)g黄杆菌属(Flavobacterium sp.)h不动杆菌属(Acinetobacter sp.)i短杆菌属(Brevibacterium sp.)j迪茨氏菌属(Dietzia timorensis)k紫色杆菌属(Janthinobacterium sp.)
有研究[30-31]表明,Pseudomonas为冷藏鱼类的特定腐败菌,抑制其生长能有效延缓鱼类的腐败速度。本研究中亚铁离子的添加提升了Shewanella putrefaciens、Psychrobacter等细菌在此特定生态系统中的竞争力,虽未根本改变Pseudomonas的优势地位,但从菌落总数、TVB-N、TMA含量的结果来看,氯化亚铁处理罗非鱼片后却能够有效抑制罗非鱼片上菌落总数、TVB-N和TMA含量的增加,这也为后续研究提供了方向。
3 结 论
本研究结果显示,以质量浓度2 g/100 mL的氯化亚铁溶液处理罗非鱼片,能够提升Psychrobacter等细菌的竞争力,有效降低鱼片菌落总数、TVB-N和TMA含量。通过改变亚铁离子含量或动态添加并监控亚铁离子含量是否能够改变鱼片冷藏过程中(特别是冷藏后期)Pseudomonas的优势地位,有待进一步研究。
[1] 王红丽. 冷冻罗非鱼片品质综合评价及货架期预测模型的研究[D].上海: 上海海洋大学, 2022. DOI:10.27314/d.cnki.gsscu.2022.000898.
[2] 韩春阳, 黎芊芊, 张丽芳, 等. 壳聚糖/肉桂精油复合涂膜对罗非鱼肉的保鲜效果研究[J]. 包装工程, 2023, 44(11): 20-26. DOI:10.19554/j.cnki.1001-3563.2023.11.003.
[3] QIU L Q, ZHANG M, BHANDARI B, et al. Shelf life extension of aquatic products by applying nanotechnology: a review[J]. Critical Reviews in Food Science and Nutrition, 2022, 62(6): 1521-1535. DOI:10.1080/10408398.2020.1844139.
[4] 陶雯雯, 陈桑宁, 熊思琦, 等. 罗非鱼保鲜技术的研究进展[C]//中国食品科学技术学会. 中国食品科学技术学会第十九届年会论文摘要集. 中国食品科学技术学会, 2022: 2. DOI:10.26914/c.cnkihy.2022.051200.
[5] TEREFE G. Preservation techniques and their effect on nutritional values and microbial population of brewer’s spent grain: a review[J].CABI Agriculture and Bioscience, 2022, 3(1): 1-8. DOI:10.1186/s43170-022-00120-8.
[6] HE Y D, SANG S Y, TANG H ,et al. In vitro mechanism of antibacterial activity of eucalyptus essential oil against specific spoilage organisms in aquatic products[J]. Journal of Food Processing and Preservation, 2022, 46: e16349. DOI:10.1111/jfpp.16349.
[7] 王津. 极低频脉冲电场对冷藏罗非鱼保鲜及其作用机理的研究[D].广州: 华南理工大学, 2022. DOI:10.27151/d.cnki.ghnlu.2022.001038.
[8] 符腾飞. 低温等离子体对肠炎沙门氏菌和单增李斯特菌杀菌机理及在罗非鱼中应用研究[D]. 海口: 海南大学, 2021. DOI:10.27073/d.cnki.ghadu.2021.000618.
[9] 付仁豪. 基于肌肉微结构分形维数表征的罗非鱼片贮藏中品质变化的研究[D]. 海口: 海南大学, 2021. DOI:10.27073/d.cnki.ghadu.2021.000534.
[10] 王艺静. 气调等离子体处理对罗非鱼片保鲜的研究[J]. 包装与食品机械, 2021, 39(2): 22-27. DOI:10.3969/j.issn.1005-1295.2021.02.005.
[11] 李瑜珍, 郑琳, 张惠媚, 等. 不同浓度葡萄糖、氯化钠及氯化铁对铜绿假单胞菌生物膜形成的影响研究[J]. 现代检验医学杂志, 2018,33(4): 131-133. DOI:10.3969/j.issn.1671-7414.2018.04.036.
[12] 鲁重, 刘静聪, 吴诗媛, 等. 生鲜食品致腐假单胞菌生物被膜形成及其调控机制研究进展[J]. 食品科学, 2023, 44(17): 278-293.DOI:10.7506/spkx1002-6630-20220920-199.
[13] 杨静. 亚铁盐抑菌作用的研究及其在罗非鱼保鲜中的应用[D].广州: 仲恺农业工程学院, 2013. DOI:10.7506/spkx1002-6630-201315027.
[14] SAINZ-MEJÍAS M, JURADO-MARTÍN I, MCCLEAN S.Understanding Pseudomonas aeruginosa-host interactions: the ongoing quest for an efficacious vaccine[J]. Cells, 2020, 9(12): 2617.DOI:10.3390/CELLS9122617.
[15] AZAM M W, KHAN A U. Updates on the pathogenicity status of Pseudomonas aeruginosa[J]. Drug Discovery Today, 2019, 24(1):350-359. DOI:10.1016/j.drudis.2018.07.003.
[16] 范颖. 铁离子对铜绿假单胞菌群体感应系统的抑制作用及其机制研究[D]. 兰州: 兰州大学, 2023. DOI:10.27204/d.cnki.glzhu.2023.001773.
[17] VIDAILLAC C, CHOTIRMALL S H. Pseudomonas aeruginosa in bronchiectasis: infection, inflammation, and therapies[J]. Expert Review of Respiratory Medicine, 2021, 15(5): 649-662. DOI:10.1080/17476348.2021.1906225.
[18] LI Z Y, HE L M, WU J, et al. Bacterial community diversity associated with four marine sponges from the South China Sea based on 16S rDNA DGGE fingerprinting[J]. Journal Experimental Marine Biological Ecology, 2006, 329(1): 75-85. DOI:10.1016/j.jembe.2005.08.014.
[19] PARK W S, LEE J, NA G, et al. Benzyl isothiocyanate attenuates inflammasome activation in Pseudomonas aeruginosa LPS-stimulated THP-1 cells and exerts regulation through the MAPKs/NF-κB pathway[J]. International Journal of Molecular Sciences, 2022, 23(3):1228. DOI:10.3390/IJMS23031228.
[20] 孙红启. 铁载体和铁离子对细菌生长过程的影响[D]. 济南: 山东大学, 2008. DOI:10.7666/d.y1939374.
[21] 孟晓华, 段杉. 生鲜罗非鱼片在冷藏过程中细菌群落演替的PCR-DGGE分析[J]. 食品工业科技, 2012, 33(11): 343-347; 351.DOI:CNKI:11-1759/TS.20111129.1335.013.
[22] ALATRAKTCHI F A, SVENDSEN W E, MOLIN S. Electrochemical detection of pyocyanin as a biomarker for Pseudomonas aeruginosa:a focused review[J]. Sensors, 2020, 20(18): 5281. DOI:10.3390/s20185218.
[23] AMPE F, OMAR N B, MOIZAN C, et al. Polyphasic study of the spatial distribution of microorganisms in Mexican pozol, a fermented maize dough, demonstrates the need for cultivation-independent methods to investigate traditional fermentations[J]. Applied and Environmental Microbiology, 1999, 65(12): 5464-5473. DOI:10.1089/oli.1.1999.9.549.
[24] MUYZER G, DE WAAL E C, UITTERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoreses analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology,1993, 59(3): 695-700. DOI:10.1128/AEM.59.3.695-700.1993.
[25] TOFFIN L, WEBSTER G, WEIGHTMAN A J,et al. Molecular monitoring of culturable bacteria from deep-sea sediment of the Nankai Trough, Leg 190 Ocean Drilling Program[J]. FEMS Microbiology Ecology, 2010, 48(3): 357-367. DOI:10.1016/j.femsec.2004.02.009.
[26] 杨贤庆, 李来好, 刁石强, 等. SC/T 3116—2006冻淡水鱼片[S]. 北京:中国标准出版社, 2006.
[27] 樊洁敏, 唐蓉, 王雅莹, 等. 氯化钙对食品致腐荧光假单胞菌生物被膜形成的影响[J]. 食品科学, 2019, 40(14): 160-165. DOI:10.7506/spkx1002-6630-20180821-217.
[28] ROSSI E, LA ROSA R, BARTELL J A, et al. Pseudomonas aeruginosa adaptation and evolution in patients with cystic fibrosis[J].Nature Reviews Microbiology, 2021, 19(5): 331-342. DOI:10.1038/s41579-020-00477-5.
[29] GRAM L, HUSS H H. Microbiological spoilage of fish and fish products[J]. International Journal of Food Microbiology, 1996, 33:121-137. DOI:10.1016/0168-1605(96)01134-8.
[30] GRAM L, DALGAARD P. Fish spoilage bacteria-problems and solutions[J]. Current Opinion in Biotechnology, 2002, 13(3): 262-266.DOI:10.1016/S0958-1669(02)00309-9.
[31] 周幸芝, 段杉, 孟晓华, 等. 乳酸菌及葡萄糖对鱼片中细菌群落及TVBN值的影响[J].食品与发酵工业, 2015, 41(5): 66-71.DOI:10.13995/j.cnki.11-1802/ts.201505012.